ABSTRAK
PUTRI WULANDARI
Formula Campuran Ekstrak Temulawak (
Curcuma
xanthorriza
) dan Meniran (
Phyllanthus niruri
) sebagai Antijerawat. Dibimbing
oleh LATIFAH KOSIM DARUSMAN dan IRMANIDA BATUBARA.
Penelitian ini bertujuan menguji efektivitas campuran ekstrak temulawak
(
Curcuma xantorrizha
) dan meniran (
Phyllanthus niruri
) sebagai antijerawat
dibandingkan masing-masing ekstrak, terutama dilihat dari aktivitasnya sebagai
antibakteri terhadap
Staphyllococcus epidermidis
dan antioksidan. Rimpang
temulawak dan meniran diekstraksi dengan etanol 96%. Selanjutnya ekstrak
tersebut dibuat formula campurannya berdasarkan rancangan
simplex centroid
.
Kesepuluh formula yang diperoleh diuji aktivitasnya sebagai antioksidan dan
antibakteri. Formula 5 (½ temulawak dan ½ meniran) merupakan formula teraktif
sebagai antijerawat dengan nilai IC
50untuk antioksidan sebesar 9.47 ppm,
konsentrasi hambat minimum (KHM) untuk
S.epidermidis
sebesar 0.25 mg/mL,
dan konsentrasi bunuh minimum (KBM) sebesar 1.00 mg/mL. Setelah dianalisis
penciri dengan kromatografi lapis tipis (KLT) dan kromatografi cair kinerja tinggi
(KCKT), diketahui bahwa dalam formula 5 terdapat senyawa xantorizol, filantin,
dan hipofilantin.
ABSTRACT
PUTRI WULANDARI
Mixture Formula Temulawak (
Curcuma xanthorriza
)
and Meniran (
Phyllanthus niruri
) Extract as Antiacne. Supervised by LATIFAH
KOSIM DARUSMAN dan IRMANIDA BATUBARA.
This study aimed to examine the effectiveness of temulawak (
Curcuma
xantorrizha
) and meniran (
Phyllanthus niruri
) extract as an antiacne compared to
each extract, especially based on its activity as an antibacterial against
Staphyllococcus epidermidis
and antioxidants. Temulawak rhizome and meniran
were extracted with 96% ethanol. Furthermore, simplex centroid design was used
to prepared formula from extract. Tenth formula obtained and tested for their
antioxidant and antibacterial activities. Formula 5 (½ temulawak and ½ meniran)
as the most active antiacne formula with IC
50of antioxidant values of 9.47 ppm,
1
PENDAHULUAN
Jerawat (Acne vulgaris) merupakan penyakit kulit peradangan kronik folikel polisebasea yang umumnya terjadi pada masa remaja dengan gambaran klinis berupa komedo, papul, dan nodus pada daerah muka, bahu, leher, dada, punggung bagian atas dan lengan bagian atas. Jerawat terjadi karena pori-pori kulit terbuka dan tersumbat dengan minyak, sel-sel kulit mati, infeksi bakteri, faktor makanan, kosmetik, dan bahan kimia lain (Wasistaatmadja 2002). Penyakit ini tidak fatal, namun cukup merisaukan karena berhubungan dengan menurunnya kepercayaan diri akibat berkurangnya keindahan wajah para penderita.
Bakteri yang berperan dalam jerawat adalah Propionibacterium acnes dan
Staphylococcus epidermidis (Wasistaatmadja 2002). Bakteri ini tentunya harus dihambat pertumbuhannya untuk mengurangi terjadinya peradangan (inflamasi). Selain itu, lipase dari
P. acnes juga merupakan faktor penting dalam patogenesis jerawat karena lipase memecah asam lemak bebas dari lipid kulit yang mengakibatkan inflamasi jaringan dan mendukung terbentuknya jerawat (Brook et al. 2005). Menurut Katzman & Logan (2007) kondisi paling kronis ditandai dengan stres oksidatif dan inflamasi, serta ada kemungkinan bahwa tingkat antioksidan dalam darah dipakai untuk mengurangi radikal bebas pada jerawat.
Sekarang ini, penelitian tanaman obat sedang dikembangkan untuk menangani masalah jerawat dengan melihat potensinya sebagai antijerawat. Potensi antijerawat dapat dilihat dari aktivitas tanaman obat sebagai antibakteri, penghambat aktivitas lipase, dan antioksidan (Batubara et al. 2009), karena menurut Katzman & Logan (2007) masalah jerawat dapat diatasi dengan menghambat pertumbuhan P. acnes, menghambat aktivitas lipase P. acnes, dan menghambat stres oksidatif (Katzman & Logan 2007). Selain itu, tanaman tersebut juga harus aman bagi kulit (tidak menyebabkan iritasi) (Tilaar et al.
2008).
Temulawak (Curcuma xanthorriza Roxb.) merupakan salah satu tanaman obat yang memiliki banyak kegunaan, antara lain sebagai antibakteri Streptococcus mutans,
Staphylococcus aureus, dan P. acnes (Hwang 2000; Husein et al. 2009; Batubara et al.
2008), penghambat aktivitas lipase P. acnes
(Batubara et al. 2008), dan sebagai antioksidan (Batubara 2008; Tilaar et al.
2008; Jitoe et al. 1992; Masuda et al. 1992). Senyawa aktif yang berperan sebagai antibakteri adalah xantorizol (Hwang 2000). Selain xantorizol, temulawak mengandung kurkumin yang memiliki aktivitas antioksidan tinggi tetapi aktivitas antibakterinya rendah dan tidak ada daya inhibisi terhadap aktivitas lipase P. acnes dan gama elemenon yang memiliki aktivitas tinggi dalam menghambat aktivitas lipase P. acnes (Batubara et al.
2008). Keberadaan komponen sebagai antibakteri P. acnes, penghambat aktivitas lipase P. acnes, dan antioksidan menunjukkan bahwa temulawak memiliki potensi sebagai antijerawat (Batubara 2008; Batubara 2009). Selain itu, menurut Tilaar et al. (2008) temulawak juga aman bagi kulit karena tidak menyebabkan iritasi.
Meniran (Phyllanthus niruri L.) juga salah satu tanaman obat yang berfungsi sebagai antibakteri E. coli (Balistika 2000; Gunawan 2008), S. typhi, dan S. aureus dengan nilai konsentrasi hambat minimum (KHM) sebesar 50 µg/ml (Sumathi & Paravathi 2010) dan sebagai antioksidan (Harish & Shivanandappa 2006). Senyawa aktif yang berperan dalam antibakteri adalah senyawa filantin (Murugaiyah & Chan 2007) dan senyawa terpenoid (campuran senyawa phytadiena dan 1,2-seco cladiellan) (Gunawan 2008).
Berdasarkan latar belakang di atas maka perlu dilakukan penelitian untuk mengetahui efektivitas campuran ekstrak temulawak (C. xantorrizha Roxb.) dan meniran (P. niruri L.) sebagai antijerawat dibandingkan masing-masing ekstrak, terutama dilihat dari aktivitasnya sebagai antibakteri terhadap S. epidermidis yang merupakan salah satu bakteri penyebab jerawat dan sebagai antioksidan.
TINJAUAN PUSTAKA
Temulawak (Curcuma xanthorriza Roxb.)
1
PENDAHULUAN
Jerawat (Acne vulgaris) merupakan penyakit kulit peradangan kronik folikel polisebasea yang umumnya terjadi pada masa remaja dengan gambaran klinis berupa komedo, papul, dan nodus pada daerah muka, bahu, leher, dada, punggung bagian atas dan lengan bagian atas. Jerawat terjadi karena pori-pori kulit terbuka dan tersumbat dengan minyak, sel-sel kulit mati, infeksi bakteri, faktor makanan, kosmetik, dan bahan kimia lain (Wasistaatmadja 2002). Penyakit ini tidak fatal, namun cukup merisaukan karena berhubungan dengan menurunnya kepercayaan diri akibat berkurangnya keindahan wajah para penderita.
Bakteri yang berperan dalam jerawat adalah Propionibacterium acnes dan
Staphylococcus epidermidis (Wasistaatmadja 2002). Bakteri ini tentunya harus dihambat pertumbuhannya untuk mengurangi terjadinya peradangan (inflamasi). Selain itu, lipase dari
P. acnes juga merupakan faktor penting dalam patogenesis jerawat karena lipase memecah asam lemak bebas dari lipid kulit yang mengakibatkan inflamasi jaringan dan mendukung terbentuknya jerawat (Brook et al. 2005). Menurut Katzman & Logan (2007) kondisi paling kronis ditandai dengan stres oksidatif dan inflamasi, serta ada kemungkinan bahwa tingkat antioksidan dalam darah dipakai untuk mengurangi radikal bebas pada jerawat.
Sekarang ini, penelitian tanaman obat sedang dikembangkan untuk menangani masalah jerawat dengan melihat potensinya sebagai antijerawat. Potensi antijerawat dapat dilihat dari aktivitas tanaman obat sebagai antibakteri, penghambat aktivitas lipase, dan antioksidan (Batubara et al. 2009), karena menurut Katzman & Logan (2007) masalah jerawat dapat diatasi dengan menghambat pertumbuhan P. acnes, menghambat aktivitas lipase P. acnes, dan menghambat stres oksidatif (Katzman & Logan 2007). Selain itu, tanaman tersebut juga harus aman bagi kulit (tidak menyebabkan iritasi) (Tilaar et al.
2008).
Temulawak (Curcuma xanthorriza Roxb.) merupakan salah satu tanaman obat yang memiliki banyak kegunaan, antara lain sebagai antibakteri Streptococcus mutans,
Staphylococcus aureus, dan P. acnes (Hwang 2000; Husein et al. 2009; Batubara et al.
2008), penghambat aktivitas lipase P. acnes
(Batubara et al. 2008), dan sebagai antioksidan (Batubara 2008; Tilaar et al.
2008; Jitoe et al. 1992; Masuda et al. 1992). Senyawa aktif yang berperan sebagai antibakteri adalah xantorizol (Hwang 2000). Selain xantorizol, temulawak mengandung kurkumin yang memiliki aktivitas antioksidan tinggi tetapi aktivitas antibakterinya rendah dan tidak ada daya inhibisi terhadap aktivitas lipase P. acnes dan gama elemenon yang memiliki aktivitas tinggi dalam menghambat aktivitas lipase P. acnes (Batubara et al.
2008). Keberadaan komponen sebagai antibakteri P. acnes, penghambat aktivitas lipase P. acnes, dan antioksidan menunjukkan bahwa temulawak memiliki potensi sebagai antijerawat (Batubara 2008; Batubara 2009). Selain itu, menurut Tilaar et al. (2008) temulawak juga aman bagi kulit karena tidak menyebabkan iritasi.
Meniran (Phyllanthus niruri L.) juga salah satu tanaman obat yang berfungsi sebagai antibakteri E. coli (Balistika 2000; Gunawan 2008), S. typhi, dan S. aureus dengan nilai konsentrasi hambat minimum (KHM) sebesar 50 µg/ml (Sumathi & Paravathi 2010) dan sebagai antioksidan (Harish & Shivanandappa 2006). Senyawa aktif yang berperan dalam antibakteri adalah senyawa filantin (Murugaiyah & Chan 2007) dan senyawa terpenoid (campuran senyawa phytadiena dan 1,2-seco cladiellan) (Gunawan 2008).
Berdasarkan latar belakang di atas maka perlu dilakukan penelitian untuk mengetahui efektivitas campuran ekstrak temulawak (C. xantorrizha Roxb.) dan meniran (P. niruri L.) sebagai antijerawat dibandingkan masing-masing ekstrak, terutama dilihat dari aktivitasnya sebagai antibakteri terhadap S. epidermidis yang merupakan salah satu bakteri penyebab jerawat dan sebagai antioksidan.
TINJAUAN PUSTAKA
Temulawak (Curcuma xanthorriza Roxb.)
Zingiberales, marga Curcuma, dan jenis
xantorrizha.
Gambar 1 Tanaman temulawak (C. xanthorrizol Roxb.) (Koleksi pribadi 2011)
Temulawak (C. xanthorriza Roxb.) telah diketahui berpotensi sebagai antioksidan (Jitoe et al. 1992) dan antibakteri dengan xantorizol yang berperan sebagai senyawa aktifnya (Hwang 2000). Kandungan senyawa xantorizol dalam temulawak sebesar 21% (Darusman et al. 2006). Xantorizol merupakan antibakteri potensial yang memiliki spektrum luas terhadap aktivitas antibakteri, stabil terhadap panas, dan aman terhadap kulit (Hwang 2000). Menurut Batubara et al. (2009), ekstrak temulawak dalam etanol 50% memiliki potensi sebagai antijerawat dengan nilai konsentrasi hambat minimum (KHM) untuk P. acnes sebesar 0,5 mg/ml, nilai konsentrasi bunuh minimum (KBM) sebesar 2,0 mg/ml, dan nilai IC50
untuk antioksidan sebesar 80,72 µg/ml.
Meniran (Phyllanthus niruri L.)
Meniran (P. niruri) merupakan tanaman yang batangnya berbentuk bulat dengan tinggi kurang dari 50 cm. Meniran memiliki daun yang bersirip genap dan setiap satu tangkai daun terdiri dari daun majemuk yang memiliki ukuran kecil dan berbentuk lonjong. Bunga meniran terdapat pada ketiak daun menghadap ke arah bawah (Gambar 1). Tumbuhan ini berasal dari daerah tropis yang tumbuh liar di hutan-hutan, ladang-ladang, kebun-kebun, maupun pekarangan rumah. Meniran tumbuh subur di tempat yang lembab pada dataran rendah sampai ketinggian 1000 meter di atas permukaan laut.
Gambar 2 Tanaman meniran (P. niruri L.) (Koleksi pribadi 2011).
Secara taksonomi, meniran diklasifikasikan dalam divisi Sphermatophyta, sub divisi Angiospermae, kelas Dicotyledone, bangsa Geraniales, suku Euphobiaceae, marga
Phyllantus, dan jenis niruri. Senyawa aktif yang dikandung meniran antara lain filantin, hipofilantin, filtetralin, dan niranrin (Murugaiyah & Chan 2007), alkaloid (Petchnaree 1986), terpenoid (Gunawan 2008), tannin (Markom et al. 2007), dan glikosida flavanon (Gupta & Bahar 1984).
Meniran memiliki aktivitas sebagai antibakteri, terutama S. aureus, S. thypi, dan
E. coli (Balistika 2000; Gunawan 2008; Sumathi & Paravathi 2010) dan sebagai antioksidan (Harish & Shivanandappa 2006). Aktivitas antibakteri yang dimiliki meniran dapat diteliti lebih lanjut sebagai antijerawat sebab jerawat umumnya disebabkan oleh infeksi bakteri P. acnes dan S. epidermidis, bakteri S. epidermidis merupakan bakteri yang tergolong dalam satu genus dengan S. aureus. Aktivitasnya sebagai antioksidan juga berfungsi mengurangi oksidasi pada jerawat (Katzman & Logan 2007).
Jerawat
Jerawat (Acne vulgaris) adalah penyakit kulit akibat peradangan menahun dari folikel polisebasea (Wasitaatmadja 2002). Penyakit ini biasanya terjadi pada remaja. Jerawat terutama timbul pada kulit yang berminyak berlebihan (Yuindarmanto 2009). Selain itu, jerawat juga disebabkan oleh infeksi dari jasad renik, antara lain Propionibacterium acne, Staphylococcus epidermidis atau
Pityrosporum ovale dan P. orbiculare. Kadang-kadang jerawat menyebabkan rasa gatal yang mengganggu atau rasa sakit kecuali bila terjadi pustula atau nodus yang besar (Wasitaatmadja 2002).
mengandung bakteri. Kondisi ini dapat menyebabkan inflamasi. Asam lemak dan minyak kulit tersumbat dan mengeras. Jika jerawat disentuh maka inflamasi akan meluas sehingga padatan asam lemak dan minyak kulit yang mengeras akan membesar (Brook et al. 2005).
Antijerawat merupakan salah satu komponen yang dapat mengatasi timbulnya jerwat. Jerawat dapat diatasi dengan menghambat pertumbuhan P. acnes, menghambat aktivitas lipase P. acnes, dan menghambat stres oksidatif (Katzman & Logan 2007). Artinya, suatu komponen yang bersifat antijerawat harus mampu mnghambat pertumbuhan P. acnes, menghambat aktivitas lipase P. acnes, dan menghambat stres oksidatif (Batubara et al. 2008; Batubara et al.
2009).
Staphylococcus epidermidis
Staphylococcus epidermidis merupakan salah satu dari 30 jenis bakteri yang termasuk dalam genus Staphylococcus. Bakteri ini terdapat pada kulit dan dapat ditemukan dalam selaput lendir pada hewan. S. epidermidis tergolong bakteri gram positif, bersifat aerob fakultatif, tidak menghasilkan spora dan tidak motil, umumnya tumbuh membentuk kluster seperti anggur (Gambar 4), dengan diameter sekitar 1-2 mm, dan tumbuh dengan optimum pada suhu 37 oC (Otto 2009). Bakteri tersebut tumbuh cepat pada agar darah dan tidak menghasilkan enzim koagulase yang dapat menggumpalkan darah, sehingga sering disebut Staphylococcus
koagulase negatif (Kirchhoff & Sheagren 1985).
Gambar 3 Bakteri S. epidermidis (Otto 2009).
Infeksi yang disebabkan oleh S. epidermidis biasanya dikaitkan dengan perangkat medis, seperti kateter, dan sering terjadi pada orang dengan sistem kekebalan yang lemah (Goldmann 1993). Sedikit yang diketahui tentang bagaimana S. epidermidis
menyebabkan penyakit pada manusia. Karakteristik dari banyak strain mikroba ini adalah produksi dari kapsul atau lendir yang
dihasilkan dalam pembentukan biofilm (Fitzpatrick et al. 2005).
Dalam sebuah biofilm, S. epidermidis
dilindungi terhadap serangan dari sistem kekebalan tubuh dan melawan perlakuan antibiotik yang membuat infeksi S. epidermidis sulit dihentikan (Fitzpatrick et al.
2005). Kekebalannya terhadap beberapa antibiotik menyebabkan bakteri tersebut memerlukan pengobatan lain, seperti vankomisin, rifampisin, dan kuinolon (Kirchhoff & Sheagren 1985). Namun baru-baru ini S.epidermis menunjukkan keresistenannya terhadap vankomisin, sehingga muncul antibiotik lain seperti linezolid dan quinupristin (John et al. 2002).
Antibakteri
Antibakteri adalah zat yang dapat mengganggu pertumbuhan atau bahkan mematikan bakteri dengan cara mengganggu metabolisme mikroba yang merugikan. (Madigan et al. 2008). Antibakteri termasuk ke dalam antimikroba yang digunakan untuk menghambat pertumbuhan bakteri. Mekanisme kerja dari senyawa antibakteri diantaranya yaitu menghambat sintesis dinding sel, menghambat keutuhan permeabilitas dinding sel bakteri, menghambat kerja enzim, dan menghambat sintesis asam nukleat dan protein (Jawetz et al. 1996). Faktor-faktor yang mempengaruhi aktivitas senyawa antibakteri antara lain pH, suhu stabilitas bakteri tersebut, lamanya inkubasi, dan aktivitas metabolisme bakteri (Madigan et al. 2008).
Antioksidan
dalam makromolekul biologi (Masuda et al.
1992).
Salah satu metode yang digunakan untuk pengujian aktivitas antioksidan adalah metode DPPH. Metode DPPH didasarkan pada kemampuan antioksidan untuk menghambat radikal bebas dengan mendonorkan atom hidrogen. Uji aktivitas antioksidan dengan metode DPPH menggunakan 1,1-difenil-2-pikrilhidrazil (DPPH) sebagai radikal bebas. Prinsipnya adalah reaksi penangkapan hidrogen oleh DPPH dari senyawa antioksidan yang mengubahnya menjadi 1,1-difenil-2-pikrilhidrazin. Metode ini menggunakan kontrol positif sebagai pembanding untuk mengetahui aktivitas antioksidan sampel. Kontrol positif ini dapat berupa tokoferol, BHT, dan vitamin C (Rahman et al. 2008).
Gambar 4 Mekanisme penangkapan radikal DPPH (Rahman et al. 2008).
Ekstraksi
Ekstraksi merupakan suatu metode yang melibatkan perpindahan suatu konstituen padat atau cair ke dalam cairan lain, yaitu pelarutnya. Prinsip dasar ekstraksi adalah kelarutan, pemisahan zat terlarut yang diinginkan atau menghilangkan komponen zat terlarut yang tidak diinginkan dari fase padat maka fase padat dikontakkan dengan fase cair. Terdapat berbagai cara ekstraksi, salah satunya adalah maserasi (Harborne 1987).
Maserasi adalah proses perendaman sampel menggunakan pelarut pada suhu ruang. Teknik maserasi sangat menguntungkan dalam isolasi senyawa bahan alam karena dengan perendaman terjadi pemecahan dinding dan membran sel akibat perbedaan tekanan di dalam dan di luar sel sehingga metabolit sekunder yang ada di dalam sitoplasma akan terlarut dalam pelarut (Harborne 1987). Selain itu ekstraksi senyawa akan sempurna karena dapat diatur lama perendamannya. Pemilihan pelarut untuk proses maserasi akan memberikan efektivitas yang tinggi dengan memperhatikan kelarutan senyawa bahan alam pada pelarut tersebut (Rohman et al.2006).
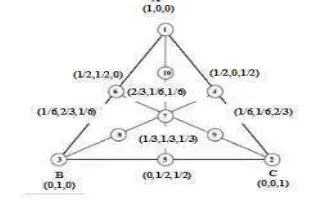
Desain Campuran dengan Simplex Centroid
Desain campuran merupakan rancangan yang digunakan pada percobaan dengan campuran bahan. Faktor dari rancangan ini adalah komponen dari campuran sehingga taraf masing-masing faktor tidak saling bebas (Delaroza 2008). Salah satu contoh desain rancangan adalah simplex centroid. Simplex centroid memberikan ulasan percobaan dari respon permukaan di bagian tengah bidang. Salah satu cara untuk menggambarkan model adalah mempertimbangkan struktur dari percobaan tiga faktor. Desain tiga komponen dapat digambarkan dengan segitiga sama sisi dalam dua dimensi (Gambar 5) (Borges et al.
2007).
Gambar 5 Desain campuran dengan simplex centroid.
Analisis Penciri dengan Kromatografi
Analisis penciri adalah suatu analisis yang digunakan untuk mengidentifikasi dan membandingkan suatu komponen dengan komponen lain berdasarkan informasi kimia yang dihasilkan (Liang et al. 2007). Analisis penciri kromatografi dapat dilakukan dengan menggunakan kromatografi lapis tipis dan kromatografi cair kinerja tinggi.
Kromatografi Lapis Tipis (KLT)
Kromatografi lapis tipis (KLT) merupakan jenis kromatografi partisi menggunakan sebuah lapis tipis silika atau alumina yang seragam pada sebuah lempeng gelas atau logam yang keras. Fase diam untuk KLT seringkali juga mengandung substansi yang dapat berpendar dalam sinar ultra violet. Fase gerak merupakan pelarut atau campuran pelarut yang sesuai (Harvey 2000). Pergerakan zat relatif terhadap garis depan pelarut dalam sistem kromatografi lapis tipis dapat didefinisikan sebagai nilai Rf, yaitu
5
untuk menganalisis berbagai macam sampel. Hampir lebih dari 30 noda dapat diamati secara simultan pada satu waktu di dalam satu pelat (Funk & Droeschel 1991).
Kromatografi Cair Kinerja Tinggi (KCKT)
Kromatografi Cair Kinerja Tinggi (KCKT) merupakan salah satu alat pemisah komponen-komponen dalam suatu senyawa berdasarkan interaksi komponen dengan fase gerak (cairan) dan fase diam. Fase gerak yang melewati komponen dibantu dengan adanya tekanan. Hasil dari alat ini berupa kromatogram atau sidik jari kromatografi. Kromatogram menggambarkan puncak-puncak dengan waktu retensi tertentu sesuai komponen yang terpisahkan. Kadar dari komponen yang terpisahkan ditunjukkan dengan luas area dari masing-masing puncak (Harvey 2000).
Parameter yang diukur pada analisis penciri KCKT meliputi waktu retensi, resolusi, jumlah puncak, dan luas puncak. Parameter tersebut dipengaruhi oleh berbagai faktor, antara lain metode ekstraksi dan instrumen kromatografi. Namun, parameter yang banyak dipakai adalah jumlah puncak yang dihitung dari banyaknya puncak yang muncul (Liang et al. 2004). KCKT dapat digunakan untuk menganalisis hampir seluruh komponen dalam obat herbal. Hal itu disebabkan hasil sidik jari kromatografinya dapat merepresentasikan senyawa aktif yang terdapat dalam obat herbal tersebut (Liang et al. 2004).
BAHAN DAN METODE
Alat dan Bahan
Peralatan yang digunakan adalah neraca analitik, eksikator, penguap putar, oven, inkubator, microplate reader, autoklaf,
96-well-plates, lampu UV, dan kromatografi cair kinerja tinggi (KCKT) (Shimadzu).
Bahan yang digunakan ialah rimpang temulawak (C. xanthorriza Roxb.) yang berasal dari kebun Biofarmaka, tanaman meniran (P. niruri L.) yang berasal dari kebun Biofarmaka, bakteri S. epidermidis, media
trypticase soy broth (TSB), etanol, metanol, n-heksana, kloroform, etil asetat, HCl, amil alkohol, serbuk Mg, CHCl3, H2SO4, NaOH,
FeCl3 1%, pereaksi Mayer, Wagner,
Dragendorf, DMSO, DPPH, katekin, kuersetin, tetrasiklin, TCC, standar xantorizol (dari Pusat Studi Biofarmaka), standar filantin
dan hipofilantin (dari Pusat Studi Biofarmaka), dan silika gel G60F254 dari
Merck.
Metode
Metode penelitian yang dilakukan mengikuti diagram alir pada Lampiran 1 yaitu penentuan kadar air, ekstraksi sampel dengan etanol 96%, uji fitokimia ekstrak temulawak dan meniran, dan membuat formula campuran berdasarkan rancangan simplex centroid. Formula yang didapat dilakukan uji aktivitas antioksidan dan anti bakteri. Selanjutnya, formula yang teraktif dilakukan analisis sidik jari dengan kromatografi lapis tipis (KLT) dan kromatografi cair kinerja tinggi (KCKT).
Penentuan Kadar Air (AOAC 2006)
Cawan porselin dikeringkan pada suhu 105ºC selama 30 menit lalu didinginkan dalam eksikator dan ditimbang. Sebanyak 3 g contoh daun kepel dimasukkan dalam cawan dan dipanaskan pada suhu 105ºC selama 3 jam sampai diperoleh bobot konstan, kemudian didinginkan dalam eksikator dan ditimbang. Penetapan kadar air ini dilakukan berdasarkan penentuan jumlah bobot kering contoh. Penentuan kadar air dilakukan sebanyak tiga kali ulangan (triplo).
Kadar air (%) = 100% A
B A
Keterangan:
A = bobot contoh sebelum dikeringkan (g)
B = bobot contoh setelah dikeringkan (g)
Ekstraksi (BPOM 2004)
Sebanyak 50 gram sampel yang sudah dikeringkan dan dihaluskan ditambah dengan 250 mL etanol 96%. Larutan tersebut dimaserasi secara dinamik selama 6 jam dan dimaserasi secara statik/diamkan selama 24 jam. Maserasi ekstrak dilakukan tiga kali ulangan. Selanjutnya filtrat dikumpulkan dan dipekatkan dengan penguap putar.
Uji Fitokimia (Harborne 1987)
5
untuk menganalisis berbagai macam sampel. Hampir lebih dari 30 noda dapat diamati secara simultan pada satu waktu di dalam satu pelat (Funk & Droeschel 1991).
Kromatografi Cair Kinerja Tinggi (KCKT)
Kromatografi Cair Kinerja Tinggi (KCKT) merupakan salah satu alat pemisah komponen-komponen dalam suatu senyawa berdasarkan interaksi komponen dengan fase gerak (cairan) dan fase diam. Fase gerak yang melewati komponen dibantu dengan adanya tekanan. Hasil dari alat ini berupa kromatogram atau sidik jari kromatografi. Kromatogram menggambarkan puncak-puncak dengan waktu retensi tertentu sesuai komponen yang terpisahkan. Kadar dari komponen yang terpisahkan ditunjukkan dengan luas area dari masing-masing puncak (Harvey 2000).
Parameter yang diukur pada analisis penciri KCKT meliputi waktu retensi, resolusi, jumlah puncak, dan luas puncak. Parameter tersebut dipengaruhi oleh berbagai faktor, antara lain metode ekstraksi dan instrumen kromatografi. Namun, parameter yang banyak dipakai adalah jumlah puncak yang dihitung dari banyaknya puncak yang muncul (Liang et al. 2004). KCKT dapat digunakan untuk menganalisis hampir seluruh komponen dalam obat herbal. Hal itu disebabkan hasil sidik jari kromatografinya dapat merepresentasikan senyawa aktif yang terdapat dalam obat herbal tersebut (Liang et al. 2004).
BAHAN DAN METODE
Alat dan Bahan
Peralatan yang digunakan adalah neraca analitik, eksikator, penguap putar, oven, inkubator, microplate reader, autoklaf,
96-well-plates, lampu UV, dan kromatografi cair kinerja tinggi (KCKT) (Shimadzu).
Bahan yang digunakan ialah rimpang temulawak (C. xanthorriza Roxb.) yang berasal dari kebun Biofarmaka, tanaman meniran (P. niruri L.) yang berasal dari kebun Biofarmaka, bakteri S. epidermidis, media
trypticase soy broth (TSB), etanol, metanol, n-heksana, kloroform, etil asetat, HCl, amil alkohol, serbuk Mg, CHCl3, H2SO4, NaOH,
FeCl3 1%, pereaksi Mayer, Wagner,
Dragendorf, DMSO, DPPH, katekin, kuersetin, tetrasiklin, TCC, standar xantorizol (dari Pusat Studi Biofarmaka), standar filantin
dan hipofilantin (dari Pusat Studi Biofarmaka), dan silika gel G60F254 dari
Merck.
Metode
Metode penelitian yang dilakukan mengikuti diagram alir pada Lampiran 1 yaitu penentuan kadar air, ekstraksi sampel dengan etanol 96%, uji fitokimia ekstrak temulawak dan meniran, dan membuat formula campuran berdasarkan rancangan simplex centroid. Formula yang didapat dilakukan uji aktivitas antioksidan dan anti bakteri. Selanjutnya, formula yang teraktif dilakukan analisis sidik jari dengan kromatografi lapis tipis (KLT) dan kromatografi cair kinerja tinggi (KCKT).
Penentuan Kadar Air (AOAC 2006)
Cawan porselin dikeringkan pada suhu 105ºC selama 30 menit lalu didinginkan dalam eksikator dan ditimbang. Sebanyak 3 g contoh daun kepel dimasukkan dalam cawan dan dipanaskan pada suhu 105ºC selama 3 jam sampai diperoleh bobot konstan, kemudian didinginkan dalam eksikator dan ditimbang. Penetapan kadar air ini dilakukan berdasarkan penentuan jumlah bobot kering contoh. Penentuan kadar air dilakukan sebanyak tiga kali ulangan (triplo).
Kadar air (%) = 100% A
B A
Keterangan:
A = bobot contoh sebelum dikeringkan (g)
B = bobot contoh setelah dikeringkan (g)
Ekstraksi (BPOM 2004)
Sebanyak 50 gram sampel yang sudah dikeringkan dan dihaluskan ditambah dengan 250 mL etanol 96%. Larutan tersebut dimaserasi secara dinamik selama 6 jam dan dimaserasi secara statik/diamkan selama 24 jam. Maserasi ekstrak dilakukan tiga kali ulangan. Selanjutnya filtrat dikumpulkan dan dipekatkan dengan penguap putar.
Uji Fitokimia (Harborne 1987)
selama 10 menit dengan keadaan tertutup. Jika terbentuk buih yang stabil berarti bahwa ekstrak mengandung saponin.
Uji Alkaloid. Sejumlah 1 gram ekstrak ditambah dengan 10 mL CHCl3 dan beberapa
tetes NaOH. Larutan tersebut disaring dan filtratnya ditambahkan 10 tetes H2SO4 2 M
serta dikocok. Lapisan asam dipisahkan dan masing-masing ditambahkan dengan pereaksi Mayer (positif jika terbentuk endapan putih), pereaksi Wagner (positif jika terbentuk endapan cokelat), dan pereaksi Dragendorf (positif jika terbentuk endapan merah jingga).
Uji Tanin. Sebanyak 10 mL ekstrak dipanaskan selama 10 menit. Larutan tersebut kemudian disaring dan filtratnya ditambahkan dengan FeCl3 1%. Jika terbentuk warna biru
tua atau hijau berarti bahwa ekstrak mengandung tanin.
Uji Steroid dan Terpenoid. Sampel diekstraksi dengan 10 mL etanol panas, disaring, dan diuapkan hingga kering. Residu yang dihasilkan dilarutkan dalam eter. Selanjutnya fase eter tersebut ditambahkan 1 tetes H2SO4 serta 3 tetes asetat anhidrat. Jika
terbentuk warna biru atau hijau berarti bahwa ekstrak positif mengandung steroid. Namun jika terbentuk warna ungu berarti bahwa ekstrak positif mengandung terpenoid.
Pembuatan Formula Campuran Ekstrak Temulawak dan Meniran
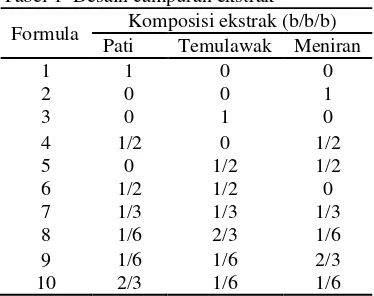
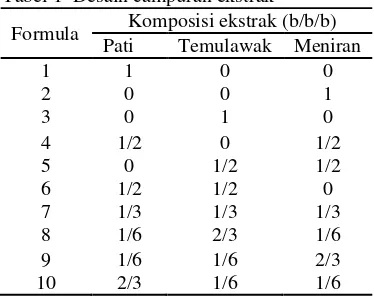
Campuran ekstrak dibuat dengan menggunakan tiga bahan, yaitu ekstrak temulawak, pati, dan ekstrak meniran. Pati digunakan sebagai bahan pengisi. Ketiga bahan tersebut dikombinasikan menggunakan desain simplex centroid (Gambar 6) berdasarkan ekstrak keringnya. Sepuluh hasil formula ekstrak dinyatakan pada desain campuran ekstak (Tabel 1).
Gambar 6 Sepuluh titik selektivitas simplex centroid
Tabel 1 Desain campuran ekstrak
Formula Komposisi ekstrak (b/b/b) Pati Temulawak Meniran
1 1 0 0
2 0 0 1
3 0 1 0
4 1/2 0 1/2 5 0 1/2 1/2 6 1/2 1/2 0 7 1/3 1/3 1/3 8 1/6 2/3 1/6 9 1/6 1/6 2/3 10 2/3 1/6 1/6
Uji Aktivitas Antibakteri (Batubara et al.
2009)
Bakteri yang digunakan untuk uji aktivitas antibakteri adalah Staphylococcus epidermidis. Media yang digunakan adalah
trypticase soy broth (TSB). Sebanyak 100 µ L medium steril, 40 µL sampel dilarutkan dalam DMSO 20% atau kontrol dan 5 µ L inokulum bakteri dimasukkan ke dalam masing-masing sumur (96-well plate). Inokulum telah disiapkan pada konsentrasi 10-2 CFU/mL.
S.epidermidis diinkubasi dalam media selama 48 jam pada suhu 37oC. Konsentrasi ekstrak yang tidak menunjukkan pertumbuhan bakteri (bening) secara visual dideskripsikan sebagai konsentrasi hambat minimum (KHM).
Sebanyak 100 µL dari media yang tidak menunjukkan pertumbuhan bakteri diinokulasikan pada 100 µL media baru. Kemudian diinkubasi selama 48 jam pada suhu 37oC. Konsentrasi yang tidak menunjukkan pertumbuhan bakteri setelah inokulasi kedua dideskripsikan sebagai konsentrasi bunuh minimum (KBM). Kontrol negatif yang digunakan adalah DMSO dan kontrol positifnya adalah tetrasiklin dan TCC.
Uji Aktivitas Antioksidan (Batubara et al.
2009)
Uji aktivitas antioksidan yang digunakan adalah uji penangkapan radikal bebas 2,2-difenil-1-pikrilhidrazil (DPPH). Sampel dilarutkan di dalam etanol hingga diperoleh konsentrasi 1,67; 3,33; 6,67; 10,00; 13,33; 16,67; 100,00; 133,33; dan 166,67 µg/mL. Alikuot sampel dan 100 µL larutan DPPH (11,8 mg DPPH dalam 100 mL etanol) ditambahkan ke masing-masing sumur
konsentrasi dan kontrol positif dilakukan tiga kali ulangan. Aktivitas inhibitor dihitung dengan persamaan:
Inhibisi (%) = [1-(Asampel– Akontrol) / (Ablangko–
Akontrol)] x 100%
di mana, Asampel adalah absorbans sampel,
Akontrol adalah absorbans dari (+)-katekin
sebagai kontrol dan Ablangko adalah absorbans
dari etanol sebagai blanko.
Analisis Penciri dengan Kromatografi Lapis Tipis (KLT)
Analisis Xantorizol (Asriani 2010). Pelat kromatografi lapis tipis (KLT) yang digunakan adalah pelat alumunium jenis silika gel G60F254 dari Merck. Ekstrak kasar
temulawak dan formulasi campuran ekstrak ditotolkan pada pelat KLT sebanyak 20 kali totolan. Setelah kering, pelat KLT tersebut langsung dielusi dalam bejana kromatografi yang telah dijenuhkan oleh uap eluen pengembang. Eluen yang digunakan yaitu n -heksana:etil asetat (10:1). Noda yang dihasilkan dari masing-masing eluen diamati di bawah lampu UV pada panjang gelombang 254 dan 366 nm.
Analisis Filantin (Depkes RI 2008). Pelat kromatografi lapis tipis (KLT) yang digunakan adalah pelat alumunium jenis silika gel G60F254 dari Merck. Ekstrak kasar meniran
dan formulasi campuran ekstrak ditotolkan pada pelat KLT sebanyak 20 kali totolan. Setelah kering, pelat KLT tersebut langsung dielusi dalam bejana kromatografi yang telah dijenuhkan oleh uap eluen pengembang. Eluen yang digunakan yaitu kloroform:metanol:air (80:12:2). Noda yang dihasilkan dari masing-masing eluen dicelupkan ke dalam AlCl3 dan diamati di
bawah lampu UV pada panjang gelombang 254 dan 366 nm. Standar yang digunakan sebagai pembanding adalah kuersetin.
Analisis Penciri dengan Kromatografi Cair Kinerja Tinggi (KCKT)
Analisis Xantorizol (Asriani 2010).
Sebanyak 100 mg formula yang memiliki aktivitas terbaik dilarutkan dengan 50 mL etanol dan disaring menggunakan kertas saring Whatman. Selanjutnya sampel diinjeksikan ke dalam KCKT (Shimadzu) dengan volume injeksi sebesar 20 µL. Fase gerak yang digunakan adalah H3PO4:metanol,
laju alirnya sebesar 1 mL/menit, kolom C18,
dan detektor UV pada panjang gelombang 224 nm. Konsentrasi standar xantorizol yang digunakan sebesar 100 ppm.
Analisis Filantin (Tripathi et al. 2006).
Sebanyak 100 mg formula yang memiliki aktivitas terbaik dilarutkan dengan 50 mL metanol dan disaring menggunakan kertas saring Whatman. Selanjutnya sampel diinjeksikan ke dalam KCKT (Shimadzu) dengan volume injeksi sebesar 20 µL. Fase gerak yang digunakan adalah metanol:air (70:30), laju alirnya sebesar 0.7 mL/menit, kolom C18, dan detektor photodiode array
(PAD) pada panjang gelombang 220 nm. Standar yang digunakan adalah filantin dan hipofilantin dengan konsentrasi masing-masing sebesar 50 ppm dan 50 ppm.
HASIL DAN PEMBAHASAN
Kadar air
Kadar air suatu sampel dapat diartikan sebagai banyaknya air yang terkandung dalam sampel sebagai persen bahan kering. Menurut Depkes RI (1995), penentuan kadar air berfungsi mengetahui masa simpan serbuk kering sampel dan sebagai salah satu syarat bahan baku herbal. Suatu sampel dikatakan baik dan dapat disimpan dalam jangka waktu yang lama apabila memiliki kadar air <10%, karena pada tingkat kadar air tersebut sampel dapat terhindar dari pertumbuhan jamur yang cepat (Harjadi 1986). Air yang terkandung dalam serbuk sampel dihilangkan dengan pemanasan pada suhu di atas titik didih air, yaitu 105oC. Air yang akan hilang dari sampel adalah air yang terikat secara fisik (Harjadi 1986).
Selain untuk mengetahui masa simpan, kadar air suatu bahan juga digunakan sebagai faktor koreksi pada perhitungan rendemen ekstrak. Sehingga kadar air secara tidak langsung memiliki peranan dalam jumlah rendemen ekstrak. Pada penelitian ini, kadar air serbuk temulawak dan meniran yang diperoleh masing-masing adalah sebesar 6.45 %(b/b) dan 6.36 %(b/b) (Lampiran 2 dan Lampiran 3). Kadar air tersebut kurang dari 10%, sehingga sampel tersebut memiliki waktu simpan dengan jangka waktu yang lama, dan memenuhi standar bahan baku herbal (Depkes RI 1995).
Analisis Hasil Ekstraksi
konsentrasi dan kontrol positif dilakukan tiga kali ulangan. Aktivitas inhibitor dihitung dengan persamaan:
Inhibisi (%) = [1-(Asampel– Akontrol) / (Ablangko–
Akontrol)] x 100%
di mana, Asampel adalah absorbans sampel,
Akontrol adalah absorbans dari (+)-katekin
sebagai kontrol dan Ablangko adalah absorbans
dari etanol sebagai blanko.
Analisis Penciri dengan Kromatografi Lapis Tipis (KLT)
Analisis Xantorizol (Asriani 2010). Pelat kromatografi lapis tipis (KLT) yang digunakan adalah pelat alumunium jenis silika gel G60F254 dari Merck. Ekstrak kasar
temulawak dan formulasi campuran ekstrak ditotolkan pada pelat KLT sebanyak 20 kali totolan. Setelah kering, pelat KLT tersebut langsung dielusi dalam bejana kromatografi yang telah dijenuhkan oleh uap eluen pengembang. Eluen yang digunakan yaitu n -heksana:etil asetat (10:1). Noda yang dihasilkan dari masing-masing eluen diamati di bawah lampu UV pada panjang gelombang 254 dan 366 nm.
Analisis Filantin (Depkes RI 2008). Pelat kromatografi lapis tipis (KLT) yang digunakan adalah pelat alumunium jenis silika gel G60F254 dari Merck. Ekstrak kasar meniran
dan formulasi campuran ekstrak ditotolkan pada pelat KLT sebanyak 20 kali totolan. Setelah kering, pelat KLT tersebut langsung dielusi dalam bejana kromatografi yang telah dijenuhkan oleh uap eluen pengembang. Eluen yang digunakan yaitu kloroform:metanol:air (80:12:2). Noda yang dihasilkan dari masing-masing eluen dicelupkan ke dalam AlCl3 dan diamati di
bawah lampu UV pada panjang gelombang 254 dan 366 nm. Standar yang digunakan sebagai pembanding adalah kuersetin.
Analisis Penciri dengan Kromatografi Cair Kinerja Tinggi (KCKT)
Analisis Xantorizol (Asriani 2010).
Sebanyak 100 mg formula yang memiliki aktivitas terbaik dilarutkan dengan 50 mL etanol dan disaring menggunakan kertas saring Whatman. Selanjutnya sampel diinjeksikan ke dalam KCKT (Shimadzu) dengan volume injeksi sebesar 20 µL. Fase gerak yang digunakan adalah H3PO4:metanol,
laju alirnya sebesar 1 mL/menit, kolom C18,
dan detektor UV pada panjang gelombang 224 nm. Konsentrasi standar xantorizol yang digunakan sebesar 100 ppm.
Analisis Filantin (Tripathi et al. 2006).
Sebanyak 100 mg formula yang memiliki aktivitas terbaik dilarutkan dengan 50 mL metanol dan disaring menggunakan kertas saring Whatman. Selanjutnya sampel diinjeksikan ke dalam KCKT (Shimadzu) dengan volume injeksi sebesar 20 µL. Fase gerak yang digunakan adalah metanol:air (70:30), laju alirnya sebesar 0.7 mL/menit, kolom C18, dan detektor photodiode array
(PAD) pada panjang gelombang 220 nm. Standar yang digunakan adalah filantin dan hipofilantin dengan konsentrasi masing-masing sebesar 50 ppm dan 50 ppm.
HASIL DAN PEMBAHASAN
Kadar air
Kadar air suatu sampel dapat diartikan sebagai banyaknya air yang terkandung dalam sampel sebagai persen bahan kering. Menurut Depkes RI (1995), penentuan kadar air berfungsi mengetahui masa simpan serbuk kering sampel dan sebagai salah satu syarat bahan baku herbal. Suatu sampel dikatakan baik dan dapat disimpan dalam jangka waktu yang lama apabila memiliki kadar air <10%, karena pada tingkat kadar air tersebut sampel dapat terhindar dari pertumbuhan jamur yang cepat (Harjadi 1986). Air yang terkandung dalam serbuk sampel dihilangkan dengan pemanasan pada suhu di atas titik didih air, yaitu 105oC. Air yang akan hilang dari sampel adalah air yang terikat secara fisik (Harjadi 1986).
Selain untuk mengetahui masa simpan, kadar air suatu bahan juga digunakan sebagai faktor koreksi pada perhitungan rendemen ekstrak. Sehingga kadar air secara tidak langsung memiliki peranan dalam jumlah rendemen ekstrak. Pada penelitian ini, kadar air serbuk temulawak dan meniran yang diperoleh masing-masing adalah sebesar 6.45 %(b/b) dan 6.36 %(b/b) (Lampiran 2 dan Lampiran 3). Kadar air tersebut kurang dari 10%, sehingga sampel tersebut memiliki waktu simpan dengan jangka waktu yang lama, dan memenuhi standar bahan baku herbal (Depkes RI 1995).
Analisis Hasil Ekstraksi
menguntungkan, artinya dalam jumlah sedikit sudah dapat melarutkan zat aktif suatu bahan (Depkes RI 1995). Pelarut yang digunakan dalam penelitian ini adalah etanol 96%, baik untuk temulawak maupun meniran. Etanol 96% dipilih sebagai pelarut karena pelarut tersebut bersifat polar, sebab umumnya senyawa aktif di dalam temulawak dan meniran bersifat polar. Proses maserasi sangat menguntungkan dalam isolasi senyawa bahan alam karena dengan perendaman akan terjadi pemecahan dinding dan membran sel. Hal tersebut terjadi akibat perbedaan tekanan antara di dalam dan di luar sel, sehingga metabolit sekunder yang ada dalam sitoplasma akan terlarut dalam pelarut.
Maserasi suatu bahan dipengaruhi pula oleh lamanya perendaman. Semakin lama waktu perendaman maka ekstrak yang diperoleh akan semakin sempurna. Pada penelitian ini, perendaman dilakukan selama 24 jam. Bobot serbuk temulawak dan meniran yang dimaserasi masing-masing sebanyak 50.0023 g dan 50.0014 g. Maserat dan residu dipisahkan dengan penyaringan kemudian maserat dipekatkan dengan penguap putar. Rendemen ekstrak temulawak dan meniran masing-masing sebesar 18.50%(b/b kering) dan 7.040%(b/b kering) (Lampiran 4 dan Lampiran 5). Ekstrak etanol 96% sampel temulawak lebih besar daripada meniran, artinya senyawa metabolit sekunder yang terdapat dalam temulawak lebih banyak terekstrak dibandingkan dengan metabolit sekunder pada meniran.
Uji Fitokimia
Uji fitokimia merupakan pemeriksaan kimia secara kualitatif terhadap senyawa metabolit sekunder yang terdapat dalam simplisia seperti alkaloid, flavonoid, terpenoid, tanin, terpenoid dan steroid (Markham 1988). Menurut Nur (2006), ekstrak temulawak yang tanamannya berasal dari kebun yang sama (kebun Biofarmaka) mengandung senyawa flavonoid, alkaloid, steroid, dan terpenoid Namun, dari hasil uji fitokimia yang telah dilakukan diketahui bahwa ekstrak temulawak mengandung flavonoid, alkaloid, dan terpenoid (Tabel 2). Hal itu menunjukkan bahwa ekstrak temulawak yang diperoleh tidak mengandung steroid. Menurut Puspita (2009) ekstrak meniran yang tanamannya berasal dari kebun Biofarmaka mengandung flavonoid, alkaloid, tanin, steroid dan terpenoid. Namun, dari hasil uji fitokimia yang telah dilakukan diketahui
bahwa ekstrak meniran mengandung flavonoid, alkaloid, tanin dan steroid (Tabel 2). Hal itu menunjukkan bahwa ekstrak meniran yang diperoleh tidak mengandung terpenoid. Ekstrak temulawak dan meniran sama-sama mengandung flavonoid dan alkaloid dengan intensitas yang sama pula. Intensitas tersebut dilihat dari kepekatan warna yang terbentuk saat dilakukan uji fitokimia.
Tabel 2 Hasil uji fitokimia
Uji Fitokimia Hasil uji Temulawak Meniran Flavonoida +++ +++ Saponin - - Alkaloida + + Tanin - +++ Steroida - ++ Terpenoida + -
-) negatif +) positif dengan intensitasnya
Aktivitas Antioksidan
Penelitian ini menggunakan metode DPPH untuk menguji aktivitas antioksidan dari sampel. Metode DPPH didasarkan pada kemampuan antioksidan untuk menghambat radikal bebas dengan mendonorkan atom hidrogen. Uji aktivitas antioksidan dengan metode DPPH menggunakan 1,1-difenil-2-pikrilhidrazil (DPPH) sebagai radikal bebas. Penangkapan radikal bebas DPPH dan aktivitasnya ditentukan menggunakan metode spektroskopi. Radikal bebas DPPH memiliki warna ungu yang ditunjukkan oleh absorpsi dalam pelarut etanol pada panjang gelombang 514 nm. Larutan DPPH diukur serapan cahayanya dan dihitung aktivitas antioksidannya dengan menghitung persentase inhibisi, yaitu banyaknya aktivitas senyawa antioksidan yang dapat menangkap radikal bebas DPPH. Parameter ini digunakan untuk menentukan nilai IC50, yaitu bilangan yang
menunjukkan konsentrasi ekstrak yang mampu menghambat radikal bebas sebesar 50%.
Penentuan IC50 menggunakan persamaan
kurva hubungan antara %inhibisi (sebagai sumbu y) dan konsentrasi (sebagai sumbu x). Nilai IC50 didapatkan dengan memasukkan
nilai 50% ke dalam persamaan garis dan dihitung nilai x-nya sebagai konsentrasi IC50.
Semakin rendah nilai IC50 maka aktivitas
antioksidannya semakin tinggi (Masuda et al.
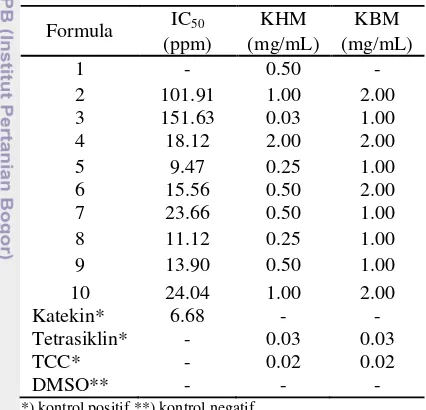
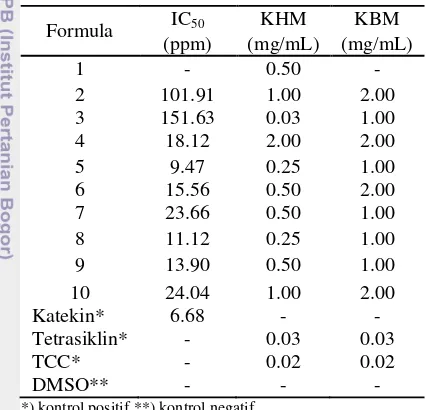
antioksidan yang tinggi dibandingkan dengan ekstrak temulawak (formula 3) dengan nilai IC50 sebesar 101.91 ppm (Tabel 2). Formula
campuran yang memiliki aktivitas antioksidan paling tinggi adalah formula 5, yaitu campuran antara ½ temulawak dan ½ meniran dengan nilai IC50 sebesar 9.47 ppm,
70,84% dari nilai IC50 katekin. Katekin
digunakan sebagai kontrol positif uji antioksidan dikarenakan senyawa katekin (Gambar 7) memiliki jumlah fenol yang lebih banyak dibandingkan dengan senyawa fenol lain, sehingga katekin dapat menangkap radikal bebas yang lebih banyak.
Tabel 3 Hasil uji aktivitas antioksidan dan antibakteri
Formula IC50 KHM KBM (ppm) (mg/mL) (mg/mL) 1 - 0.50 - 2 101.91 1.00 2.00 3 151.63 0.03 1.00 4 18.12 2.00 2.00 5 9.47 0.25 1.00 6 15.56 0.50 2.00 7 23.66 0.50 1.00 8 11.12 0.25 1.00 9 13.90 0.50 1.00 10 24.04 1.00 2.00 Katekin* 6.68 - - Tetrasiklin* - 0.03 0.03 TCC* - 0.02 0.02 DMSO** - - -
*) kontrol positif **) kontrol negatif
Formula campuran dengan bahan pengisi pati yang memiliki aktivitas antioksidan tertinggi adalah formula 8 (1/6 pati, 2/3 temulawak, dan 1/6 meniran) dengan nilai IC50 sebesar 11.12 ppm. Namun nilai IC50-nya
lebih rendah dibandingkan formula 5. Formula 5 memiliki aktivitas tertinggi disebabkan oleh adanya senyawa aktif dari meniran dan temulawak yang memiliki aktivitas sebagai antioksidan. Namun, jika ditambahkan pati (formula 8) maka aktivitasnya menjadi turun, karena pati tidak memiliki aktivitas sebagai antioksidan.
Pati merupakan zat tepung dari karbohidrat dengan suatu polimer dari monomer glukosa yang terdiri dari dua komponen utama, yaitu amilosa dan amilopektin. Sifat fungsional pati antara lain seperti gelatinisasi, retrogadasi, kelarutan, daya kembang, dan viskositas. Jika sifat-sifat tersebut dieksploitasi dengan baik maka pati dapat digunakan sebagai bahan pengisi, bahan
pengenyal, bahan karier, bahan pelapis yang dapat dimakan, dan sebagai bahan pembentuk tekstur (Cowd 1982). Penelitian ini menggunakan pati sebagai pengisi karena pati lebih umum dipakai dan lebih mudah didapat.
Gambar 7 Struktur katekin
Aktivitas Antibakteri
Formula campuran yang dirancang sesuai dengan simplex centroid diuji aktivitas antibakterinya menggunakan metode
microplate. Berdasarkan hasil pengujian, diketahui bahwa formula 3, 5, dan 8 merupakan formula teraktif. Formula 3 memiliki konsentrasi hambat minimum (KHM) sebesar 0.03 mg/mL dan konsentrasi bunuh minimum (KBM) sebesar 1 mg/mL, sedangkan formula 5 dan 8 sama-sama memiliki nilai KHM sebesar 0.25 mg/mL dan KBM sebesar 1.00 mg/mL (Tabel 3). Adanya penghambatan ditandai dengan beningnya media secara visual pada konsentrasi tertentu dibandingkan dengan kontrol negatif dan kontrol positif, begitu pula dengan penentuan KBM. Nilai KHM dan KBM berbanding terbalik dengan aktivitas. Semakin tinggi nilai KHM dan KBM yang diperoleh dari suatu sampel maka semakin kecil aktivitas dari sampel tersebut.
formula 5. Namun yang memiliki aktivitas antijerawat yang tinggi adalah formula 5.
Tanaman lain yang telah diketahui memiliki aktivitas sebagai antijerawat adalah ekstrak etanol 50% batang secang (Caesalpinia sappan) dengan nilai IC50 untuk
antioksidan sebesar 6.47 ppm, nilai KHM sebesar 0.13 mg/mL, dan nilai KBM sebesar 0.25 mg/mL (Batubara et al. 2009). Jika aktivitas antijerawat formula 5 dibandingkan dengan ekstrak etanol 50% batang secang, maka dapat dikatakan bahwa formula 5 memiliki aktivitas antijerawat yang lebih rendah dibandingkan ekstrak 50% batang secang.
Analisis Penciri dengan Kromatografi Lapis Tipis (KLT)
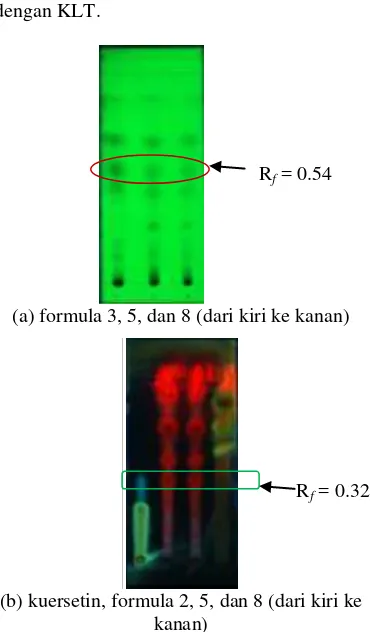
Formula yang memiliki aktivitas antioksidan dan antibakteri yang tinggi dilakukan analisis sidik jari dengan kromatografi lapis tipis (KLT). Analisis xantorizol dilakukan untuk formula 3, 5, dan 8 dengan n-heksana:etil asetat sebagai eluennya dan fase diam gel silika G60F254 (Merck). Hasil
kromatogram dari masing-masing formula terlihat pada Gambar 8. Menurut Asriani (2010), nilai Rf dari standar xantorizol adalah
sebesar 0.54. Berdasarkan kromatogram yang dihasilkan dapat diketahui bahwa noda yang dihasilkan dari masing-masing formula hampir sama. Jika dibandingkan dengan standar dari literatur, diketahui bahwa pada Rf 0.54 untuk masing-masing formula, telah terdeteksi noda dari xantorizol, yaitu bagian yang dilingkari warna jingga pada Gambar 6.
Analisis filantin dan kuersetin dilakukan untuk formula 2, 5, dan 8 dengan kloroform:metanol:air sebagai eluennya dan fase diam gel silika G60F254 (Merck). Filantin
dianalisis menggunakan data sekunder (Depkes RI 2008). Hasil kromatogram dari masing-masing formula juga terlihat pada Gambar 8. Menurut Depkes RI (2008) kuersetin digunakan sebagai standar teknis dalam mendeteksi keberadaan filantin sebab keberadaan kuersetin di alam lebih banyak dibandingkan filantin. Keberadaan filantin terdeteksi pada nilai Rf sebesar 0.3. Namun
pada hasil kromatogram terlihat bahwa noda filantin terdeteksi pada nilai Rf sebesar 0.32.
Formula 2 dan 5 memiliki noda pada nilai Rf
0.32, sedangkan formula 8 tidak memiliki noda pada nilai Rf tersebut. Hal itu dapat
disebabkan oleh konsentrasi ekstrak meniran dalam formula tersebut hanya 1/6 bagian,
sehingga tidak dapat terdeteksi pada analisis dengan KLT.
(a) formula 3, 5, dan 8 (dari kiri ke kanan)
(b) kuersetin, formula 2, 5, dan 8 (dari kiri ke kanan)
Gambar 8 Hasil analisis penciri dengan KLT, (a) analisis xantorizol pada λ=254 nm dan (b) analisis filantin λ=366 nm.
Analisis Penciri dengan Kromatografi Cair Kinerja Tinggi (KCKT)
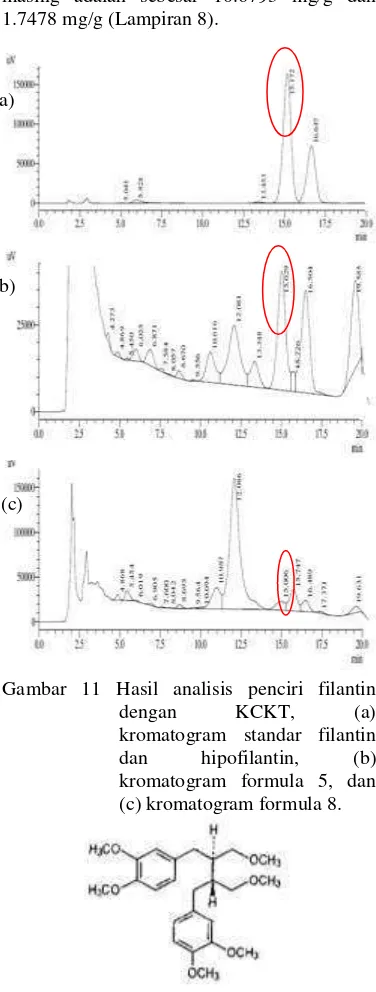
Formula yang telah dilakukan analisis penciri dengan kromatografi lapis tipis (KLT) dilanjutkan dengan analisis penciri dengan KCKT. Berdasarkan hasil kromatogram pada analisis xantorizol dengan KCKT (Gambar 9), diketahui bahwa waktu retensi untuk standar xantorizol 100 ppm adalah 6.423 menit. Namun, kromatogram yang dihasilkan tidak mencerminkan hanya ada satu senyawa. Hal itu disebabkan oleh adanya puncak dari pengotor dan pelarut. Seluruh formula yang dianalisis terdeteksi keberadaan xantorizolnya jika dibandingkan dengan larutan standar xantorizol 100 ppm. Formula 5 dan 8 terdeteksi keberadaan xantorizolnya pada waktu retensi masing-masing sebesar 6.386 menit dan 6.388 menit. Kadar senyawa xantorizol (Gambar 9) pada formula 5 dan 8 masing-masing adalah sebesar 202.5740 mg/g dan 166.8596 mg/g (Lampiran 7).
Rf = 0.54
Gambar 9 Hasil analisis penciri xantorizol dengan KCKT, (a) kromatogram standar xantorizol, (b) kromatogram formula 5, dan (c) kromatogram formula 8.
Gambar 10 Struktur xantorizol.
Analisis penciri filantin dengan KCKT menggunakan standar campuran, yaitu standar filantin 50 ppm dan hipofilantin 50 ppm. Berdasarkan hasil kromatogram pada analisis filantin dengan KCKT (Gambar 11), diketahui bahwa waktu retensi untuk standar filantin adalah 15.172 menit, sedangkan untuk hipofilantin memiliki waktu retensi pada 16.647 menit. Seluruh formula yang dianalisis terdeteksi keberadaan filantinnya jika dibandingkan dengan larutan standar filantin 50 ppm. Formula 5 dan 8 terdeteksi keberadaan filantinnya pada waktu retensi masing-masing sebesar 15.029 menit dan 15.006 menit. Kadar senyawa filantin (Gambar 11) pada formula 5 dan 8
masing-masing adalah sebesar 10.6793 mg/g dan 1.7478 mg/g (Lampiran 8).
Gambar 11 Hasil analisis penciri filantin dengan KCKT, (a) kromatogram standar filantin dan hipofilantin, (b) kromatogram formula 5, dan (c) kromatogram formula 8.
Gambar 12 Struktur filantin.
Pola kromatogram yang dihasilkan oleh formula 8 pada analisis filantin menunjukkan terdeteksinya senyawa filantin yang awalnya tidak terdeteksi pada KLT. Hal itu disebabkan oleh perbedaan standar yang digunakan pada analisis penciri filantin dengan KLT dan dengan KCKT. Jika dilihat dari profil kromatogramnya maka dapat diketahui bahwa formula 5 memiliki aktivitas sebagai antioksidan yang tinggi dibandingkan dengan formula 8 dikarenakan terdapat senyawa xantorizol dan filantin yang tinggi (a)
(b)
(c)
dibandingkan formula 8 dan senyawa filantin tersebut tidak terpisah sempurna dengan senyawa hipofilantin (waktu retensi pada 16.504 menit). Formula 8 juga terdeteksi adanya hipofilantin yang tidak terpisah sempurna, namun kadar filantin dan xantorizolnya lebih rendah dibandingkan dengan formula 5.
SIMPULAN DAN SARAN
Simpulan
Kadar air serbuk rimpang temulawak dan meniran masing-masing adalah sebesar 6.45% dan 6.36%. Kedua bahan memenuhi syarat sebagai bahan baku herbal. Rendemen ekstrak etanol 96% temulawak dan meniran masing-masing sebesar 18.50%(b/b kering) dan 7.04%(b/b kering). Formula campuran yang teraktif sebagai antioksidan dan antibakteri adalah formula 5, yaitu (½ temulawak dan ½ meniran), dengan nilai IC50 sebesar 9.47 ppm,
KHM sebesar 0.25 mg/mL , dan KBM sebesar 1.00 mg/mL. Hasil analisis penciri dengan KCKT, formula 5 menunjukkan bahwa dalam formula 5 terdapat senyawa xantorizol, filantin, dan hipofilantin. Formula 5 memiliki aktivitas yang tinggi sebagai antijerawat.
Saran
Perlu dilakukan pengembangan metode untuk menganalisis penciri KCKT dengan melakukan optimasi untuk menunjukkan jumlah puncak dengan keterpisahan yang baik.
DAFTAR PUSTAKA
[AOAC] Association of Official Analytical Chemist. 2006. Official Methods of Analysis. Ed ke-14. Arlington: Association of Official Analytical Chemist.
Afifah E. 2003. Khasiat dan Manfaat Temulawak. Jakarta: Agromedia Pustaka.
Asriani D. 2010. Isolasi xantorizol dari temulawak terpilih berdasarkan nomor harapan [tesis]. Bogor: Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Balistika A, Sutedja L, Agustina H. 2000. Isolasi senyawa aktif antibakteri dari meniran (Phyllanthus niruri L.) [Prosiding]. Bandung: Pusat Penelitian Kimia.
Batubara I, Mitsunaga T, Ohasi H. 2008. Anti acne potency of temulawak [Prosiding Simposium Internasional Pertama Temulawak]. Bogor: IPB International Convention Center (IICC).
Batubara I, Mitsunaga T, Ohasi H. 2009. Screening antiacne potency of Indonesian medicinal plants: antibacterial, lipase inhibition, and antioxidant activities. J Wood Sci 55: 230-235.
Borges CN, Bruns RE, Almeida AA, Scarminio IS. 2007. Mixture design for the fingerprint optimization of chromatographic mobile phases and extraction solution for Camellia sinensis.
Analytica Chimica Acta 595: 28-37.
[BPOM]. Badan Pengawas Obat dan Makanan. 2004. Monografi Ekstrak Tumbuhan Obat Indonesia. Jakarta: BPOM RI.
Brook GF, Butel JS, Morse SA. 2005.
Mikrobiologi Kesehatan. Jakarta: Salemba Medika.
Cowd MA. 1982. Kimia Polimer. Bandung: ITB-Press.
Craig WA. 1998. Choosing an antibiotic on the basis of pharmachodynamics. J Ear Nose Throat 77: 7-11.
Darusman LK, Djauhari E, Nurcholis W. 2006. Kandungan xantorizol temulawak (Curcuma xanthorrizha Roxb.) pada berbagai cara budidaya dan masa tanam. [Prosiding Simposium Internasional Pertama Temulawak]. Surakarta: Fakultas Kedokteran, Universitas Sebelas Maret.
Delaroza F, Scarminio IS. 2008. Mixture design optimization of extraction and mobile phase media for fingerprint analysis of Bauhinia variegate L. J Separation Science 31: 1031-1041.
dibandingkan formula 8 dan senyawa filantin tersebut tidak terpisah sempurna dengan senyawa hipofilantin (waktu retensi pada 16.504 menit). Formula 8 juga terdeteksi adanya hipofilantin yang tidak terpisah sempurna, namun kadar filantin dan xantorizolnya lebih rendah dibandingkan dengan formula 5.
SIMPULAN DAN SARAN
Simpulan
Kadar air serbuk rimpang temulawak dan meniran masing-masing adalah sebesar 6.45% dan 6.36%. Kedua bahan memenuhi syarat sebagai bahan baku herbal. Rendemen ekstrak etanol 96% temulawak dan meniran masing-masing sebesar 18.50%(b/b kering) dan 7.04%(b/b kering). Formula campuran yang teraktif sebagai antioksidan dan antibakteri adalah formula 5, yaitu (½ temulawak dan ½ meniran), dengan nilai IC50 sebesar 9.47 ppm,
KHM sebesar 0.25 mg/mL , dan KBM sebesar 1.00 mg/mL. Hasil analisis penciri dengan KCKT, formula 5 menunjukkan bahwa dalam formula 5 terdapat senyawa xantorizol, filantin, dan hipofilantin. Formula 5 memiliki aktivitas yang tinggi sebagai antijerawat.
Saran
Perlu dilakukan pengembangan metode untuk menganalisis penciri KCKT dengan melakukan optimasi untuk menunjukkan jumlah puncak dengan keterpisahan yang baik.
DAFTAR PUSTAKA
[AOAC] Association of Official Analytical Chemist. 2006. Official Methods of Analysis. Ed ke-14. Arlington: Association of Official Analytical Chemist.
Afifah E. 2003. Khasiat dan Manfaat Temulawak. Jakarta: Agromedia Pustaka.
Asriani D. 2010. Isolasi xantorizol dari temulawak terpilih berdasarkan nomor harapan [tesis]. Bogor: Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Balistika A, Sutedja L, Agustina H. 2000. Isolasi senyawa aktif antibakteri dari meniran (Phyllanthus niruri L.) [Prosiding]. Bandung: Pusat Penelitian Kimia.
Batubara I, Mitsunaga T, Ohasi H. 2008. Anti acne potency of temulawak [Prosiding Simposium Internasional Pertama Temulawak]. Bogor: IPB International Convention Center (IICC).
Batubara I, Mitsunaga T, Ohasi H. 2009. Screening antiacne potency of Indonesian medicinal plants: antibacterial, lipase inhibition, and antioxidant activities. J Wood Sci 55: 230-235.
Borges CN, Bruns RE, Almeida AA, Scarminio IS. 2007. Mixture design for the fingerprint optimization of chromatographic mobile phases and extraction solution for Camellia sinensis.
Analytica Chimica Acta 595: 28-37.
[BPOM]. Badan Pengawas Obat dan Makanan. 2004. Monografi Ekstrak Tumbuhan Obat Indonesia. Jakarta: BPOM RI.
Brook GF, Butel JS, Morse SA. 2005.
Mikrobiologi Kesehatan. Jakarta: Salemba Medika.
Cowd MA. 1982. Kimia Polimer. Bandung: ITB-Press.
Craig WA. 1998. Choosing an antibiotic on the basis of pharmachodynamics. J Ear Nose Throat 77: 7-11.
Darusman LK, Djauhari E, Nurcholis W. 2006. Kandungan xantorizol temulawak (Curcuma xanthorrizha Roxb.) pada berbagai cara budidaya dan masa tanam. [Prosiding Simposium Internasional Pertama Temulawak]. Surakarta: Fakultas Kedokteran, Universitas Sebelas Maret.
Delaroza F, Scarminio IS. 2008. Mixture design optimization of extraction and mobile phase media for fingerprint analysis of Bauhinia variegate L. J Separation Science 31: 1031-1041.
FORMULA CAMPURAN EKSTRAK TEMULAWAK (Curcuma
xanthorriza Roxb.) DAN MENIRAN (Phyllanthus niruri L.)
SEBAGAI ANTIJERAWAT
PUTRI WULANDARI
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
dibandingkan formula 8 dan senyawa filantin tersebut tidak terpisah sempurna dengan senyawa hipofilantin (waktu retensi pada 16.504 menit). Formula 8 juga terdeteksi adanya hipofilantin yang tidak terpisah sempurna, namun kadar filantin dan xantorizolnya lebih rendah dibandingkan dengan formula 5.
SIMPULAN DAN SARAN
Simpulan
Kadar air serbuk rimpang temulawak dan meniran masing-masing adalah sebesar 6.45% dan 6.36%. Kedua bahan memenuhi syarat sebagai bahan baku herbal. Rendemen ekstrak etanol 96% temulawak dan meniran masing-masing sebesar 18.50%(b/b kering) dan 7.04%(b/b kering). Formula campuran yang teraktif sebagai antioksidan dan antibakteri adalah formula 5, yaitu (½ temulawak dan ½ meniran), dengan nilai IC50 sebesar 9.47 ppm,
KHM sebesar 0.25 mg/mL , dan KBM sebesar 1.00 mg/mL. Hasil analisis penciri dengan KCKT, formula 5 menunjukkan bahwa dalam formula 5 terdapat senyawa xantorizol, filantin, dan hipofilantin. Formula 5 memiliki aktivitas yang tinggi sebagai antijerawat.
Saran
Perlu dilakukan pengembangan metode untuk menganalisis penciri KCKT dengan melakukan optimasi untuk menunjukkan jumlah puncak dengan keterpisahan yang baik.
DAFTAR PUSTAKA
[AOAC] Association of Official Analytical Chemist. 2006. Official Methods of Analysis. Ed ke-14. Arlington: Association of Official Analytical Chemist.
Afifah E. 2003. Khasiat dan Manfaat Temulawak. Jakarta: Agromedia Pustaka.
Asriani D. 2010. Isolasi xantorizol dari temulawak terpilih berdasarkan nomor harapan [tesis]. Bogor: Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Balistika A, Sutedja L, Agustina H. 2000. Isolasi senyawa aktif antibakteri dari meniran (Phyllanthus niruri L.) [Prosiding]. Bandung: Pusat Penelitian Kimia.
Batubara I, Mitsunaga T, Ohasi H. 2008. Anti acne potency of temulawak [Prosiding Simposium Internasional Pertama Temulawak]. Bogor: IPB International Convention Center (IICC).
Batubara I, Mitsunaga T, Ohasi H. 2009. Screening antiacne potency of Indonesian medicinal plants: antibacterial, lipase inhibition, and antioxidant activities. J Wood Sci 55: 230-235.
Borges CN, Bruns RE, Almeida AA, Scarminio IS. 2007. Mixture design for the fingerprint optimization of chromatographic mobile phases and extraction solution for Camellia sinensis.
Analytica Chimica Acta 595: 28-37.
[BPOM]. Badan Pengawas Obat dan Makanan. 2004. Monografi Ekstrak Tumbuhan Obat Indonesia. Jakarta: BPOM RI.
Brook GF, Butel JS, Morse SA. 2005.
Mikrobiologi Kesehatan. Jakarta: Salemba Medika.
Cowd MA. 1982. Kimia Polimer. Bandung: ITB-Press.
Craig WA. 1998. Choosing an antibiotic on the basis of pharmachodynamics. J Ear Nose Throat 77: 7-11.
Darusman LK, Djauhari E, Nurcholis W. 2006. Kandungan xantorizol temulawak (Curcuma xanthorrizha Roxb.) pada berbagai cara budidaya dan masa tanam. [Prosiding Simposium Internasional Pertama Temulawak]. Surakarta: Fakultas Kedokteran, Universitas Sebelas Maret.
Delaroza F, Scarminio IS. 2008. Mixture design optimization of extraction and mobile phase media for fingerprint analysis of Bauhinia variegate L. J Separation Science 31: 1031-1041.
[Depkes RI] Departemen Kesehatan Republik Indonesi. 2008. Farmakope Herbal IndonesiaJilid I. Jakarta: Depkes RI.
Funk W, Droeschel B. 1991. Modern TLC 4.
J. Planar Chromatogr. 123.
Fitzpatrick F, Humphreys H, O'Gara JP. 2005. The genetics of staphylococcal biofilm formation--will a greater understanding of pathogenesis lead to better management of device-related infection? Clin Microbiol Infect 11(12): 967-973.
Goldmann DA, Pier GB. 1993. Pathogenesis of infection related to intravascular catherization. Clin Microbiol Rev 6(2): 176-192.
Gunawan IWG, Bawa AG, Sutrisnayanti NL. 2008. Isolasi dan identifikasi senyawa terpenoid yang aktif antibakteri herba meniran (Phyllanthus niruri Linn). J Kimia
2(1): 31-39.
Gupta DR, Ahmed B. 1984. Nirurin: a new prenylated flavanone glycoside from
Phyllanthus niruri. J. Nat Prod 47(6): 958-963.
Halliwel B, Aeschbach R, Lolinger J, Auroma OI. 1995. Toxicology. J Food Chem
33:601.
Harborne JB. 1987. Metode Fitokimia. Edisi Ke-2. Padmawinata K, Soedira L, penerjemah; Bandung: Penerbit ITB. Terjemahan dari: Phytochemical Method.
Harish R, Shivanandappa T. 2006. Antioxidant activity and hepatoprotective potential of Phyllanthus niruri. Food Chem 95: 180-185.
Harjadi W. 1986. Ilmu Kimia Analitik Dasar. Jakarta: Gramedia Pustaka Utama.
Harvey D. 2000. Modern Analytical Chemistry. New York: McGraw-Hill.
Husein S, Parhusip A, Romasi EF. 2009. Study on antibacterial activity from
“Temulawak” (Curcuma xanthorriza
Roxb.) rhizomes against pathogenic microbes cell destruction. J App Ind Biotech 2(1).
Hwang JK, Shim JS, Pyun YR. 2000. Antibacterial activity of xanthorrhizol from Curcuma xanthorriza against oral pathogens. Fitoterapia 71: 321-323.
Jawetz E, Melnick JL, Adelberg EA. 1996.
Mikrobiologi Kedokteran. Ed ke-20. Penerjemah: Nugroho E, Maulany RF,. Jakarta : Buku Kedokteran EGC.
Jitoe A, Masuda T, Tengah IGP, Suprapta DN, Gara IWN, Nobuji. 1992. Antioxidant activity of tropical ginger extracts and analysis of the container curcuminoids. J Agri Food Chem 40: 1337-1340.
John MA, Pletch C, Hussain Z. 2002. In vitro activity of quinupristin/dalfopristin, linezolid, telithromycin and comparator antimicrobial agents against 13 species of coagulase-negative staphylococci. J Antimicrob Chemother 50(6):933-8.
Katzman M, logan AC. 2007. Acne vulgaris: nutritional factors may be influencing psychological sequelae. Med Hypotheses 69: 1080-1084.
Kirchhoff LV, Sheagren JN. 1985. Epidemiology and clinical significance of blood cultures positive for coagulase-negative staphylococcus. Infect Control
6(12):479-86.
Liang YZ, Xie P, Chan K. 2004. Quality control of herbal medicines. J Chromatogr
812: 53-70.
Madigan MT, Martinko JM, Dunlap PV, Clark DP. 2008. Biology of Microorganisms 12th edition. San Fransisco: Pearson.
Markham KR. 1988. Cara Mengidentifikasi Flavonoid. Padmawinata K, penerjemah. Bandung: ITB. Terjemahan dari:
Techniques of Flavonoid of Identification
Markom M, Hasan M, Daud WR, Singh H, Jahim JM. 2007. Extraction of hydrolysable tannins from Phyllanthus niruri Linn: Effects of solvent and extraction method. Sep pur tech 52: 487-496.
rhizomes of Curcuma xanthorrhiza.
Phytochemistry 31(10): 3645-3647.
Murugaiyah V, Chan KL. 2007. Analysis of lignans from Phyllanthus niruri L. in plasma using a simple HPLC method with fluorescence detection and its application in a pharmacokinetic study. J Chromatography B 852:138-144.
Nur SW. 2006. Perbandingan sistem ekstraksi dan validasi penentuan xantorizol dari temulawak secara kromatografi cair kinerja tinggi [skripsi]. Bogor: Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Otto M. 2009. Staphylococcus epidermidis. Nat Rev Microbiology 7 (8): 555-567.
Pelzhar MJ, Chan ESC. 2007. Dasar-dasar Mikrobiologi. Jakarta: UI-Press.
Petchnaree P. 1986. X-ray crystal and molecular structure of nirurine, a novel alkaloid related to the securinega alkaloid skeleton, from Phyllanthus niruri L. J Chem Soc 1: 1551-1556.
Puspita MDA. 2009. Pengoptimuman fase gerak kromatografi lapis tipis menggunakan desain campuran untuk pemisah komponen ekstrak meniran [skripsi]. Bogor: Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Rahman F, Logawa ED, Hegartika H, Simanjuntak P. 2008. Aktivitas antioksidan ekstrak tunggal dan kombinasinya dari tanaman Curcuma spp.
J Ilmu Kefarmasian Indonesia 6 (2): 69-74.
Rohman A, Riyanto S, Utari D. 2006. Aktivitas antioksidan, kandungan fenolik total dan kandungan flavonoid total ekstrak etil asetat buah mengkudu serta fraksi-fraksinya. Majalah farmasi Indo-nesia 17: 136-142.
Sumathi, Paravathi A. 2010. Antimicrobial activity of some traditional medicinal plants. J Med Plant Research 4(4): 316-321.
Tilaar M, Wong LH, Ranti AS, Wasistaatmadja SM, Maily, Suryaningsih, Junardy FD. 2008. Safety and efficacy evaluation on Curcuma xanthorriza Roxb extract in cosmetics [Prosiding Simposium Internasional Pertama Temulawak]. Bogor: IPB International Convention Center (IICC).
Tripathi AK, Verma RK, Gupta AK, Khanuja SPS. 2006. Quantitative determination of phyllanthin and hy