STUDI KEMAMPUAN NETRALISASI
ANTIBODI ANTI AI H5N1 ASAL INDUK
DALAM KUNING TELUR AYAM YANG DIVAKSINASI
BERBAGAI VAKSIN AI H5N1 KOMERSIAL
TERHADAP VIRUS AI H5N1 ISOLAT LAPANG
AGUNG PUJI HARYANTO
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
STUDI KEMAMPUAN NETRALISASI
ANTIBODI ANTI AI H5N1 ASAL INDUK
DALAM KUNING TELUR AYAM YANG DIVAKSINASI
BERBAGAI VAKSIN AI H5N1 KOMERSIAL
TERHADAP VIRUS AI H5N1 ISOLAT LAPANG
AGUNG PUJI HARYANTO
Tesis
Sebagai Salah Satu Syarat untuk memperoleh Gelar Magister Sains pada
Program Pascasarjana Institut Pertanian Bogor
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS
DAN SUMBER INFORMASI
Dengan ini saya menyatakan bahwa tesis Studi Kemampuan Netralisasi Antibodi Anti AI H5N1 Asal Induk Dalam Kuning Telur Ayam Yang Divaksinasi Berbagai Vaksin AI H5N1 Komersial Terhadap Virus AI H5N1 Isolat Lapang adalah karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka dibagian akhir tesis ini.
Bogor, 8 Agustus 2012
RINGKASAN
AGUNG PUJI HARYANTO. B253100051. Studi Kemampuan Netralisasi Antibodi Anti AI H5N1 Asal Induk Dalam Kuning Telur Ayam Yang Divaksinasi Berbagai Vaksin
AI H5N1 Komersial Terhadap Virus AI H5N1. Dibawah bimbingan RETNO D. SOEJOEDONO dan SRI MURTINI
Tahun 2011 terdapat 1.411 kasus avian influenza (AI) pada unggas di Indonesia. Vaksinasi merupakan strategi pemerintah sebagai salah satu cara
pengendalian AI di Indonesia (DITJENNAK 2007; 2008). Vaksinasi mampu
menginduksi antibodi protektif terhadap virus AI tantang homolog (Capua & Marangon 2007). Selain itu vaksinasi dapat menyebabkan tekanan tekanan
terhadap virus sehingga mengurangi peluang terjadinya mutasi alami melalui pengurangan jumlah virus yang bersirkulasi (Angi 2008). Kekebalan pasif (Passive Immunity) merupakan transfer kekebalan asal induk dari induk ke anak ayam melalui telur, yang berfungsi sebagai perlindungan awal setelah anak ayam lahir. Titer antibodi asal induk yang tinggi diperlukan agar anak ayam dapat terhindar dari infeksi virus dilingkungan kandang.
Hasil penelitian menunjukan bahwa antigen Nagrak (2009) dan Lawang (2010) dapat dinetralisasi oleh antibodi asal induk dari telur yang diinduksi oleh vaksin VS, VC, dan VM. Antibodi asal induk yang diinduksi oleh vaksin VV hanya dapat menetralisasi antigen Nagrak (2009). Titer antibodi dalam kuning telur yang dapat menetralisasi virus isolat lapang diatas 26. Kuning telur mengandung IgY dapat digunakan sebagai parameter kekebalan asal induk setelah dilakukan induksi vaksin pada induk.
ABSTRACT
AGUNG PUJI HARYANTO. Study of Maternal Antibody’s Neutralization Ability for Anti AI H5 in Chicken’s Egg Yolk Induce From Several Commercial
Vaccines Against Field of AI H5N1 Virus. Under the direction of RETNO D. SOEJOEDONO and SRI MURTINI.
The research was designed to study the capability of antibody anti H5N1
Avian Influenza from egg yolk to neutralize H5N1 AIV. Twenty five hens were divided into five groups, one group as a control group were unvaccinated
and four other groups were vaccinated with H5N1 AI inactive vaccine produced by several Indonesia vaccine company. Four H5N1 AI inactive vaccine code VS, VC, VV and VM were vaccinated twice for each group with a month,
interval. Group 2 were vaccinated with vaccine code VS, group 3, 4, 5 were vaccinated by vaccine code VC, VV and VM. A week after second
vaccination the egg were collected and analyzed the antibody titer against H5N1 AIV by heamagglutination test using H5N1 AIV field isolates as standard virus (Nagrak (2009) and Lawang (2010)). Egg yolk which contains high antibody titer
(above 26) were collected and tested against H5N1 AIV field isolates (Nagrak (2009) and Lawang (2010)) by serum neutralization test. The result
showed that H5N1 AIV Nagrak (2009) isolate were neutralized by antibody anti H5N1 AIV from egg yolk produced by hens vaccinated with VS,VC,VV and VM, but Lawang (2010) isolate were only neutralized by antibody anti H5N1 AIV
from egg yolk produced by hens vaccinated with VS, VC and VM. It is concluded that hens which were vaccinated with H5N1 AI inactive vaccine
were able to protect their off spring against H5N1 AIV from the field by transferred maternal antibody trough the egg yolk with titer above 26
Keywords : Maternal Antibody, Antigen, Vaccine, Egg yolk.
Judul Tesis : Studi Kemampuan Netralisasi Antibodi Anti AI H5N1
Asal Induk Dalam Kuning Telur Ayam Yang Divaksinasi Berbagai Vaksin AI H5N1 Komersial Terhadap Virus AI H5N1
Nama : Agung Puji Haryanto
NRP : B253100051
Program Studi : Mikrobiologi Medik (MKM)
Disetujui
Komisi Pembimbing
Prof. Dr. drh. Retno D. Soejoedono, MS
Ketua Anggota
Dr. drh. Sri Murtini, M.Si
Diketahui
Ketua Program Studi Dekan Sekolah Pascasarjana
Prof. Dr. drh. Fachriyan H. Pasaribu Dr. Ir. Dahrul Syah, M.Sc.Agr
Tanggal Lulus : Tanggal Ujian : 8 Agustus 2012
© Hak cipta milik Institut Pertanian Bogor, tahun 2012
Hak cipta dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa
mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah,
penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan
yang wajar IPB
vii
Riwayat Hidup
Penulis dilahirkan di Banjarnegara pada tanggal 25 Mei 1978, dari pasangan bapak Ir. Rusli Hamzah dan Ibu Dra. Tri Rahayu RPH, M.Pd.
Penulis merupakan putra pertama dari tiga bersaudara.
Tahun 1996 penulis lulus SMA Negeri 2 Purwokerto, pada tahun yang sama lulus seleksi masuk IPB melalui jalur Undangan Seleksi Masuk IPB.
Penulis memilih Fakultas Kedokteran Hewan, IPB - Bogor. Penulis lulus sebagai Sarjana Kedokteran Hewan pada tahun 2001 dan memperoleh Gelar Dokter Hewan pada tahun 2002. Selanjutnya pertengahan tahun 2010
penulis melanjutkan pendidikan ke Sekolah Pascasarjana IPB – Bogor, mengambil Program Studi Mayor Mikrobiologi Medik (MKM).
Sejak tahun 2002, penulis bekerja sebagai QA/QC Divisi Komersial
dan Kemitraan Broiler Farm, (Wilayah Jawa Barat – Banten), PT. Sierad Produce, Tbk. Pada tahun 2005, penulis bekerja sebagai Manager
Fasilitas dan Dokter Hewan Laboratorium Animal Biosafety Level-2
(Hewan Coba Macaca fascisularis dan Macaca nemestrina), PT. Bimana Indomedical-PSSP IPB. Pada tahun 2007, penulis bekerja sebagai
Health and Diseases Control, Poultry Trading Business Unit Division, (Wilayah
Jawa Barat, Banten dan Jawa Timur), Cheil Jedang Indonesia. Tahun 2009, penulis bekerja sebagai Business Development Analyst, Development Alternate
Inc. (DAI) – USAID. Pada tahun 2011, penulis sebagai praktisi Dokter Hewan. Selama mengikuti program S2, penulis menjadi pengurus Bidang Pengembangan Anggota dan Organisasi, Perhimpunan Dokter Hewan Indonesia (PDHI) Cabang Jawa Barat II. Bidang Hubungan Internasional, Asosiasi Dokter Hewan Perunggasan Indonesia (ADHPI). Selain itu penulis sebagai Auditor Halal Majelis Ulama Indonesia (MUI) Kabupaten Bogor (2010 – 2014) dan Konsultan ISO 9001;2008, PT. Tritis Bina Mandiri – TÜV pada BPTP Sumatera Utara,
viii
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah SWT atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Penulisan Tesis hasil penelitian ini berjudul “Studi Kemampuan Netralisasi Antibodi Anti AI H5N1 Asal Induk Dalam Kuning Telur Ayam Yang Divaksinasi Berbagai Vaksin AI H5N1
Komersial Terhadap Virus AI H5N1” diajukan sebagai Tesis untuk memenuhi syarat penyelesaian tugas akhir Program Magister (S2) pada Program Studi Mayor Mikrobiologi Medik, Sekolah Pascasarjana Institut Pertanian Bogor.
Tesis ini disusun untuk memberikan informasi dasar membantu dalam pembuatan program vaksinasi yang tepat bagi ayam indukan (parent stock),
sehingga terbentuk antibodi asal induk protektif terhadap DOC (final stock)
yang dihasilkan.
Pada kesempatan ini Penulis menyampaikan rasa hormat dan ucapan terima kasih yang sebesar-besarnya, kepada :
1. Ibu Prof. Dr. drh. Retno D. Soejoedono, MS, selaku Ketua Komisi Pembimbing.
2. Ibu Dr. drh. Sri Murtini, M.Si., selaku Anggota Komisi Pembimbing.
3. Bapak Prof. Dr. drh. I Wayan Teguh Wibawan, MS, selaku Penguji Luar Komisi Pembimbing.
4. Bapak Prof. Dr. drh. Fachriyan Hasmi Pasaribu, selaku Ketua Program Studi Pascasarjana Mikrobiologi Medik dan atas masukannya selama penelitian berlangsung.
5. Ibu drh. Okti Nadia Poetri, M.Si., drh. Tanti Gunadi, drh. Ita Krisanti, drh. Ratih, drh. Agustin, Bapak Kosasih dan Mas Lukman, atas bantuanya
selama penelitian di Laboratorium Mikrobiologi dan Imunologi serta Laboratorium Kandang Terpadu FKH IPB
ix
7. Ibu Zakiyah Widowati, S.Pi, Mbak Wiwin Mukti Andriyani, S.Pi dan rekan-rekan mahasiswa program studi MKM Sekolah Pascasarjana IPB, yang senantiasa memberikan dukungan semangat dan sarannya selama
penulis menyelesaikan tesis ini.
8. Ibunda – Ayahanda dan anakku Hanif Raditya Ardiansyah serta Aisha Aulia Hapsari, atas segala doa dan kasih sayangnya.
9. Kepada semua pihak yang telah membantu, yang tidak dapat Penulis sebutkan satu persatu.
Pepatah mengatakan tiada gading yang tak retak, oleh karena itu penulis mengharapkan kritik dan saran membangun demi penulisan karya ilmiah selanjutnya. Semoga karya ilmiah ini bermanfaat bagi pembacanya.
Bogor, 28 Agustus 2012
Agung Puji Haryanto
ix
Kajian Penyakit Avian Influenza (AI) pada Ayam... .. 6
Dampak Ekonomi Outbreak Avian Influenza (AI) Pada Ayam komersial... 8
Potensi dan Jenis Vaksin AI Komersial di Indonesia... .. 9
Ig Y dan Fungsinya... 10
Teknik Diagnosa Avian Influenza (AI) pada Ayam... .. 13
A. Hemaglutination Inhibition (HI)... 13
B. Serum Neutralization Test (SNT)... 14
METODE PENELITIAN... 15
Vaksin dan Antigen Virus AI H5N1... 18
Vaksinasi Ayam Petelur... 18
x
Uji Hemaglutinasi (HA) Mikrotitrasi... 19
Pemeriksaan Antibody Anti AI H5 dengan Uji Penghambatan Aglutinasi (Heamagglutination Inhibition Test/HI Test)... 21
Uji Serum Netralisasi (SNT)... 22
Analisa Data... 23
HASIL DAN PEMBAHASAN... 25
Pengujian Serum Netralisasi (SNT)... 31
SIMPULAN DAN SARAN... 35
xi
DAFTAR TABEL
Halaman
1. Panel Uji HI Kuning Telur Pada Masing-masing Kelompok ... 21 2. Panel Uji serum Netralisasi Kuning Telur Pada
xii
DAFTAR GAMBAR
Halaman
1. Morfologi Virus Avian Influenza A... 6 2. Struktur IgY dan IgG ... 11 3. Titer Antibodi Koleksi Telur Setelah Vaksinasi Kedua
Diuji Dengan Isolat Nagrak (2009)... 27 4. Titer Antibodi Koleksi Telur Setelah Vaksinasi Kedua
1
PENDAHULUAN
Latar Belakang
Virus Avian Influenza (AI) merupakan penyakit unggas menular berasal dari famili Orthomyxoviridae yang terbagi menjadi tiga tipe yaitu virus influenza
tipe A, B dan C. Virus Influenza tipe A diklasifikasikan berdasarkan antigenitas
glikoprotein yaitu : hemaglutinin (HA) dan neuraminidase (NA), yang diekspresikan pada permukaan partikel virus (Indriyani & Dharmayanti
2006). Virus AI memiliki 17 subtipe HA dan 9 subtipe NA yang terdeteksi pada mamalia, unggas dan burung liar didunia (Tong et al. 2012). Virus tersebut dapat menginfeksi berbagai macam spesies antara lain : unggas, babi, kuda dan manusia
(Dhamayanti et al. 2004). Berdasarkan patogenitasnya dibedakan menjadi 2 bentuk yaitu Low Pathogenic Avian Influenza (LPAI) dan Highly Pathogenic Avian Influenza (HPAI). Berdasarkan kombinasi genetik dan karakteristik antigenik isolat virus AI di Indonesia tergolong clade 2.1,
dengan mayoritas sub-clade 2.1.3 (80%). Beberapa virus sub-clade 2.1.1 dan tidak terdefinisi garis keturunanya (Mudigdo 2009).
Di Indonesia, pertengahan tahun 2003 hingga awal 2004 sekitar 16,2 juta ayam dari peternakan komersial mati dan dipotong paksa (stamping out), jumlah
tersebut belum termasuk ayam kampung yang dipelihara masyarakat (backyard farm). Nilai ekonomi akibat dampak penyakit AI unggas ini mencapai
16,2 - 32,4 juta US dollar. Kerugian tersebut selain akibat kematian juga penurunan permintaan anak ayam umur sehari atau Day Old Chicken (DOC) dan pakan ternak 45 - 60% pengurangan
Komisi Nasional Flu Burung dan Pandemi Influenza (Komnas FBPI), memperkirakan besarnya kerugian di Indonesia akibat wabah AI dari tahun 2004
-2008 sebesar Rp. 4,3 triliun, diluar kerugian dari hilangnya kesempatan kerja dan berkurangnya konsumsi protein hewani asal unggas bagi masyarakat. Perkiraan tersebut berdasarkan model standar Computable General Equilibrum
(CGE). Kerugian tersebut dihitung dari banyaknya ayam dimusnahkan, berkurangnya permintaan terhadap produk unggas, konsumsi telur dan ayam
2
di restoran, tambahan biaya yang dikeluarkan peternak dan pemerintah dalam penanganan AI, serta menurunnya kunjungan wisatawan (Basuno 2008).
Perkembangan kasus AI pada unggas tahun 2007 sampai dengan 2011, kasus secara bertahap menurun setiap tahun. Pada tahun 2011 masih terjadi 1.411 kasus AI di Indonesia. Jumlah tersebut lebih rendah dibanding tahun sebelumnya 1.502 (2010), 2.293 (2009), 1.413 (2008) dan 2.751 (2007). Jumlah kasus sebanyak 1.411 tersebut terjadi di 29 provinsi dengan urutan kasus
tertinggi hingga terendah yakni : Sumatra Barat, Sulawesi Selatan, Riau, Lampung, Jawa Tengah, Jawa Barat, Bali, Jambi, Gorontalo, DI. Yogyakarta, Jawa Timur, Banten, Bengkulu, NTB, Kalimantan Timur, Sumatra Utara, Sulawesi Barat, Aceh, Sulawesi Utara, Sulawesi Tengah, Bangka Belitung, Kalimantan Barat, Sumatera Selatan, Sulawesi Tenggara, Kalimantan Tengah,
NTT, Kepulauan Riau, DKI Jakarta dan Kalimantan Selatan. Wilayah yang tercatat tidak terjadi kasus AI di tahun 2011 adalah provinsi
Maluku, Papua, Papua Barat dan Maluku Utara. Provinsi yang saat ini masih berstatus bebas AI adalah Maluku Utara. Kasus AI pada unggas secara
nasional terjadi sepanjang bulan setiap tahunnya, namun berdasarkan data laporan
dari lapangan peningkatan kasus AI terjadi di bulan Januari sampai April setiap tahunnya. Pada bulan tersebut merupakan musim hujan sehingga terjadi perubahan suhu secara ekstrim. Perubahan suhu yang ekstrim
menyebabkan menurunnya daya tahan tubuh sehingga hewan mudah terserang berbagai penyakit unggas termasuk AI (DITJENAK 2012).
Gejala klinis yang menciri, diantaranya oedema muka dan leher; kepala membengkak; jengger, pial dan otot disekujur tubuh kebiruan serta muncul kelainan syaraf tortikolis dan ataxia (inkoordinasi syaraf). Perubahan patologi
anatomi diantaranya eksudat rongga hidung, perdarahan ovarium, proventrikulus
lemak jantung, abdominal, usus halus bagian atas, perdarahan dan pembengkakan bursa Fabricius. Kondisi ini tentu akan mengakibatkan
penurunan produksi telur maupun kematian.
Vaksinasi merupakan strategi pemerintah sebagai salah satu cara
3
tantang homolog (Capua & Marangon 2007). Selain itu vaksinasi dapat menyebabkan tekanan tekanan terhadap virus sehingga mengurangi peluang
terjadinya mutasi alami melalui pengurangan jumlah virus yang bersirkulasi (Angi 2008). Perubahan virus AI sejak tahun 2003 hingga tahun 2011 mengarah
kepada perubahan sifat biologis yang sangat nyata (Susanti et al. 2008),
sehingga vaksin AI yang beredar secara komersial di Indonesia diproduksi bentuk monovalen.
Ayam pedaging komersial di Indonesia umumnya tidak dilakukan vaksinasi AI karena masa panen ayam yang singkat (24 - 32 hari), kecuali wilayah Indonesia bagian tengah dan timur lebih menyukai pasar berat ayam 2.0 – 2.2 kg (panen berkisar umur 35 – 40 hari). Kedua Vaksin yang tersedia di Indonesia merupakan vaksin inaktif dengan respon pembentukan antibodi cukup lama dan perlu dilakukan vaksinasi ulangan (booster). Pada kenyataannya dalam masa
pemeliharaan relatif singkat, ayam pedaging komersial terserang virus AI. Untuk mengatasi hal tersebut, umumnya DOC ayam pedaging mendapatkan kekebalan pasif, yaitu melalui vaksinasi terhadap induknya dengan harapan DOC yang dihasilkan memiliki antibodi asal induk protektif terhadap serangan virus AI lapangan.
Kekebalan pasif (Passive Immunity) merupakan transfer kekebalan asal induk dari induk ke anak ayam melalui telur, yang berfungsi sebagai
perlindungan awal setelah anak ayam lahir. Pada ayam terdapat Imunoglobulin Y, Ig A dan Ig M (Hamal et al. 2006). Kekebalan pasif
memunculkan IgG, tetapi tidak memunculkan IgA atau Immunoglobulin M (IgM). Induk ayam dengan antibodi diturunkan melalui kuning telur IgY. Anak
ayam memiliki antibodi asal induk sebagai pertahanan tubuh hingga umur satu sampai dua minggu (Hamal et al. 2006).
Titer antibodi asal induk yang tinggi diperlukan agar anak ayam dapat terhindar dari infeksi virus dilingkungan kandang. Kemampuan netralisasi
antibodi asal induk DOC terhadap infeksi virus AI lapangan sampai saat belum
4
Tujuan penelitian
Penelitian ini bertujuan :
1. Mempelajari kemampuan netralisasi antibodi asal induk yang terkandung dalam kuning telur ayam terhadap virus AI isolat lapang.
2. Menentukan titer antibodi asal induk yang protektif terhadap infeksi virus AI.
Manfaat penelitian
Hasil penelitian ini diharapkan dapat membantu membuat program vaksinasi yang tepat bagi ayam indukan (parent stock), sehingga terbentuk
antibodi asal induk protektif terhadap DOC (final stock) yang dihasilkan.
Hipotesis
5
TINJAUAN PUSTAKA
Avian Influenza (AI)
Avian Influenza (AI) adalah penyakit yang disebabkan virus influenza tipe A. Virus ini menginfeksi unggas, manusia, babi dan kuda. Virus Influenza famili Orthomyxoviridae terdiri dari 3 genus Influenza A, B, dan C. Virus ini
tersusun atas asam inti RNA utas tunggal, polaritas negatif, bersegmen. Genom
virus tipe A dan B terdiri dari 8 segmen, sedangkan tipe C terdiri 7 segmen. Segmen tunggal C mengkode sebuah protein
haemaglutinin-esterase fusion (HEF) yang memiliki reseptor binding dan aktivitas membran
heamaglutinin dan aktifitas reseptor dari neuraminidase yang dikode secara terpisah oleh gen segmen influenza A dan B. Tidak seperti virus influenza
B dan C, virus influenza A mempunyai dua sifat yang mudah berubah, yaitu antigenic drift dan antigenic shift. Antigenic drift merupakan perubahan
pada satu titik dari genom virus influenza A, perubahan ini sebagai penyebab flu musiman yang sering terjadi. Antigenic shift melibatkan perubahan antigenik mayor pada HA dan atau NA (Angi 2008). Glikoprotein HA dan NA merupakan protein permukaan yang sangat berperan dalam penempelan dan pelepasan virus dari sel inang. Protein HA merupakan bagian terbesar dari serabut (spike) yaitu
80% dan NA sebesar 20% (Dharmayanti 2006).
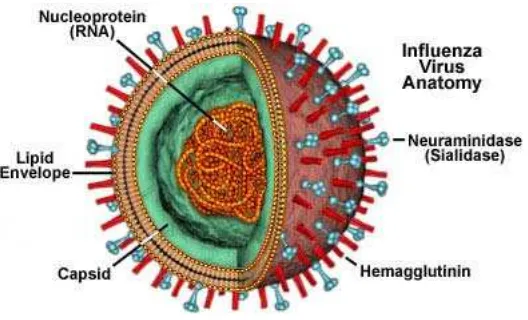
Struktur virus Avian influenza tipe A, terdiri dari asam inti RNA, Neuraminidase (NA), Hemaglutinin (HA), Kapsid dan amplop (lipid), sebagaimana pada Gambar 1. Struktur HA dan NA menentukan subtipe dari virus Avian Influenza, sedangkan NP dan M digunakan untuk membedakan antara virus Influenza A, B, atau C. Kandungan dalam virus influenza terdiri dari 0,8 - 1,1% RNA, 70 - 75% protein, 20 - 24% lipid dan 5 - 8% karbohidrat. Permukaan virus
avian influenza ditutupi oleh serabut protein setebal 10 - 12 nm. Penamaan subtipe ditetapkan berdasarkan antigenisitas pada dua buah
6
Protein Hemagglutinin memperantarai pengikatan virus ke sel-sel inang. Protein Neuraminidase berperan dalam pelepasan progeni virus baru dari sel-sel
yang telah terinfeksi (Manathan & Haryanto 2009).
Gambar 1. Morfologi Virus Avian Influenza A
(sumber : http//micro.magnet.fsu.edu/cells/viruses/influenzavirus.html)
Kajian Penyakit Avian Influenza (AI) pada Ayam
Avian Influenza (AI) menyebabkan angka kematian yang tinggi pada ayam di Italia pada tahun 1878. Namun, baru diketahui pada tahun 1955
bahwa penyebab fowl plague sebenarnya adalah virus AI yang memiliki
komposisi gen yang mirip dengan virus influenza manusia (Wibawan et al. 2009).
7
Periode inkubasi HPAI bervariasi dari beberapa jam hingga 2 - 3 hari,
tergantung pada sifat virulensi galur virus, dosis, cara pemaparan, spesies dan umur inang, status kekebalan tubuh inang. Avian influenza patogenisitas
tinggi (HPAI) memiliki tanda-tanda klinis berupa (keluar lendir dari hidung dan mata); (kepala bengkak), kelopak mata, jengger dan pial cyanosis (kebiruan),
diare berwarna hijau, tortikolis, paralisis dan inkoordinasi, produksi telur
menurun, cangkang lebih putih, lunak atau tanpa cangkang dan angka kematian tinggi mendadak sampai 100% dalam waktu 48 jam, hemorrhagi kulit kaki, telapak kaki dan dada. Pengaruh lain yang memperparah kejadian penyakit : spesies dan, umur inang serta penyakit lain pada saat bersamaan dan kondisi lingkunganya.
Avian influenza patogenisitas rendah (LPAI) bersifat subklinis. Replikasi
virus terjadi pada sistem pernafasan dan pencernaan. Tanda-tanda klinis berupa gangguan pernafasan ringan, penurunan produksi, berkomplikasi dengan
agen penyakit lain (Manathan & Haryanto 2009). LPAI terdiri dari subtipe : H1-H4, H6, H8-H16, sedangkan HPAI terdiri atas H5 dan H7 (Zarkasie 2010). Virus dalam konsentrasi tinggi diekskresi melalui feses dan cairan lendir oculonasal
mata dan hidung. Penularan melalui udara (airborne disease) jika ayam berada dalam jarak dekat. Infeksi terjadi melalui deposisi virus pada konjungtiva, nares
dan trachea. Belum terbukti penularan secara vertikal. Penyebaran antar flok terjadi dari perpindahan ayam terinfeksi, kontaminasi virus pada sepatu, pakaian, kendaraan dan peralatan (Manathan & Haryanto 2009).
Strategi pengendalian High Pathogenic Avian Influenza (HPAI) antara lain adalah identifikasi subtipe virus, mengoptimalkan biosekuriti,
8
Dampak Ekonomi Outbreak Avian Influenza (AI) Pada Ayam Komersial
Wabah AI subtipe H5N1 yang terjadi hingga akhir-akhir ini menjadi perhatian banyak pihak diseluruh dunia. Infeksi H5N1 menyerang unggas telah dilaporkan terjadi 60 negara hingga bulan April 2008, 14 negara diantaranya melaporkan kasus pada manusia (Krisnamurthi 2008). Di Indonesia sudah 31 dari 33 provinsi di Indonesia dan 293 dari 473 kabupaten/kota telah terjangkit virus AI H5N1 dengan wabah terberat di Jawa, Sumatera, Bali dan Sulawesi Selatan (Krisnamurthi 2008). Ancaman virus AI terbukti telah menjadikan peternak skala kecil maupun besar mengalami kerugian ekonomi yang tinggi, akibat terlilit hutang dan tidak mampu bangkit kembali. Kerugian ekonomi tersebut menjadikan daya beli dipedesaan dan perkotaan menurun, sehingga berimbas pada berkurangnya konsumsi pangan bergizi akibat harga yang tidak terjangkau (Basuno 2008).
Penyakit AI masuk ke Indonesia sekitar bulan Agustus 2003, yaitu dibeberapa peternakan ayam petelur (layer) di Legok Tangerang.
Wabah tersebut meluas ke-11 provinsi, antara lain di Pulau Jawa dan Bali sehingga menimbulkan dampak ekonomi yang luas. Angka mortalitas unggas mencapai 6 - 10 juta ekor dan produksi telur serta daging ayam mengalami penurunan antara 30 - 40%. Beberapa perusahaan peternakan, khususnya usaha rakyat rugi akibat penurunan permintaan daging ayam dan telur (Basuno 2008).
Dampak AI terhadap suplai day old chicken (DOC) ayam pedaging
(broiler) dan ayam petelur (layer) berupa penurunan suplai yang tajam sampai bulan Februari 2004. Pada bulan Maret sampai Juni 2004 suplai mulai pulih kembali, walaupun dibawah normal. Penurunan produksi DOC dalam negeri diperkirakan mencapai 9,6% ayam pedaging (broiler) dan 27,5% ayam petelur
(layer). Wabah AI tahun 2003 juga mempengaruhi angka ekspor DOC, sehingga mengalami penurunan sampai 30%, dibandingkan angka ekspor 2002.
Tahun 2004 tidak ada ekspor DOC karena penolakan negara importir akibat wabah AI di Indonesia, kecuali telur tetas yang jumlahnya setara 695 ribu
9
Potensi dan Jenis Vaksin AI Komersial di Indonesia
Metoda untuk mencegah dan mengendalikan wabah Avian Influenza (AI) adalah depopulasi ayam atau unggas yang terinfeksi, pelaksanaan biosekuriti terukur dan vaksinasi (Rahimi et al. 2007). Teknologi vaksinasi terdiri dari vaksin
konvensional homolog, vaksin konvensional heterolog, vaksin rekombinan.
Vaksin rekombinan terdiri vaksin rekombinan aktif dengan vektor virus lain dan vaksin rekombinan reverse genetics inaktif. Kebijakan Pemerintah Republik
Indonesia mengenai vaksin AI sebagian besar mengacu pada ketentuan
Office International des Epizooties (OIE) (OIE 2004) menyatakan bahwa vaksin
yang direkomendasikan penggunaanya adalah vaksin AI inaktif. Vaksin AI aktif konvensional tidak direkomendasikan. Vaksin AI inaktif konvensional hanya
boleh diproduksi dengan menggunakan seed virus low pathogenic.
Vaksin harus bersifat imunogenik, dilihat dari respon pembentukan antibodi tinggi
dan kemampuan pertumbuhan seed virus tinggi pada media kultur (Zarkasie 2010).
Vaksin konvensional homolog inaktif menggunakan subtipe virus AI H5N1, yang cocok dengan virus lapang. Program vaksinasi dengan sistem
Differentiating Infection and Vaccinated Animal (DIVA) menggunakan protein
NS1 memiliki kelemahan karena hingga saat ini tidak ada virus AI H5N1 yang bersifat Low Pathogenic sehingga berbahaya pada proses produksi.
Kemungkinan adanya beberapa partikel virus yg masih aktif setelah proses inaktivasi dapat menimbulkan infeksi atau wabah. Vaksin konvensional heterolog menggunakan subtipe virus AI H5N2 dan H5N9. Pada vaksin konvensional karena sifatnya Low Pathogenic sehingga tidak berbahaya pada proses produksi vaksin dan dapat menghasilkan titer virus tinggi yang dibutuhkan dalam formulasi vaksin inaktif. Program vaksinasi dengan Differentiating Infection and vaccinated
Animal (DIVA) menggunakan neuraminidase (NA) kelemahannya adalah antigenisitasnya tidak sepenuhnya cocok dengan virus lapang sehingga besar kemungkinan terbentuk mutant akibat tekanan imunologis
10
Teknologi rekombinan dapat dibuat seed vaksinnya non patogen H5N1, sehingga tidak berbahaya pada proses produksi vaksin dan dapat menghasilkan
titer virus tinggi yang dibutuhkan dalam formulasi vaksin inaktif (Zarkasie 2010).
Ig Y dan Fungsinya
Ayam memiliki sistem pertahanan cukup berkembang, sehingga sangat responsif terhadap antigen yang memaparnya. Sensitivitas tinggi
terhadap protein asing, sehingga dalam jumlah sedikit dapat memberikan respon
pembentukan antibodi (Wibawan et al. 2009). Keberadaan kelenjar Herderian di nasotrakheal dan bursa Fabricius memungkinkan unggas sangat responsif
terhadap berbagai protein asing dan ayam mampu menginduksi titer IgY yang tinggi dan bertahan lama pada telur (Gassmann et al. 1990). Imunoglobulin ayam yang terbentuk dalam darah akibat paparan antigen mudah ditransfer ke dalam
kuning telur dan dikenal dengan nama IgY (Yolk Immunoglobulin) (Poetri & Soejoedono 2006).
Imunoglobulin Y merupakan molekul imunoglobulin utama yang bersifat sistemik ditemukan juga pada duodenum, cairan trakhea maupun
plasma seminal. Imunoglobulin Y induk akan ditransfer secara vertikal kepada anak-anaknya melalui telur dan titer IgY dalam darah dan kuning telur tidak berbeda secara signifikan (Larsson et al. 1993). Transfer imunitas ini
melalui dua tahapan yaitu : IgY serum induk ditransfer ke kuning telur (analog dengan transfer cross placental pada mamalia), IgY dalam kuning telur
selanjutnya akan terserap pada saat embrio berkembang menjadi anak ayam. Konsentrasi IgY pada kuning telur dilaporkan konstan selama pematangan oosit.
Pada oosit matang mengandung 10 – 20mg/ml kuning telur. Reseptor IgY pada oosit berikatan dan memindahkan hampir seluruh populasi IgY dari serum
induk ke kuning telur. Jumlah populasi IgY yang dipindahkan tergantung dari konsentrasinya dari serum induk dan tidak terjadi seleksi serta penghancuran
selama proses pemindahan (Suartini 2005). Terdapat perbedaan waktu 3 – 4 hari saat pertama kali IgY ditemukan pada serum dengan IgY pada kuning telur (Woolley et al. 1995).
Pada ayam telah diketahui keberadaan tiga kelas imunoglobulin analog
11
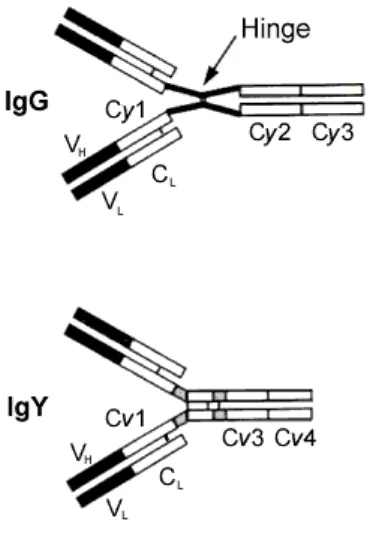
Narat (2003) melaporkan bahwa struktur IgY terdiri dari dua rantai berat dan dua rantai ringan. Rantai berat memiliki satu daerah variabel dan empat daerah
konstan. Berat molekul masing-masing rantai adalah 67 - 70 kilo Dalton (kDa) sedangkan rantai ringan 25 kDa. IgY mempunyai empat regio konstan yaitu Cv1 –
Cv4. Terdapat penambahan satu regio konstan sehingga berat molekul IgY menjadi lebih besar 180 kDa. Selain itu ditemukan regio tambahan antara
Cv1-Cv2 dan Cv1-Cv2 – Cv3 yang mengandung residu proline dan glisin (Gambar 1).
Regio tambahan ini menyebabkan fleksibilitas IgY terbatas (Narat 2003).
Gambar 2. Struktur IgY dan IgG (Schade et al. 1991)
Karakter penting IgY yang tidak dimiliki oleh antibodi mamalia lain : IgY lebih resisten terhadap pengaruh suhu dan pH, tidak berikatan dengan protein
A dan G. IgY juga tidak berikatan dengan faktor rheumatoid dalam darah,
12
IgY tidak berikatan dengan reseptor Fc pada permukaan sel, dan kemampuan mengikat antibodi sekunder 3 hingga 5 kali lebih kuat (Poetri & Soejoedono 2006).
Ayam umumnya bertelur 5 – 6 butir per minggu dan tiap butir kuning telur mempunyai volume 10 - 15 ml. Rata-rata tiap kuning telur mengandung 50 –
100 mg IgY, dengan kandungan antibodi spesifik berkisar 2% - 10% (Wibawan et al. 2009). IgY murni tersebut dapat diaplikasikan secara parenteral
dalam pencegahan atau pengobatan melalui pengebalan pasif. Pada hewan, pemanfaatan IgY pernah dilaporkan oleh Kermani-Arab et al. (2001), sebagai cara
pengebalan spesifik terhadap penyakit Marek, infeksi virus Rota dan virus Distemper (Wibawan et al. 2010). Dilaporkan pula bahwa penyakit kolibasilosis
dan influenza pada unggas dapat dicegah dengan pemberian IgY spesifik secara pasif. Selain itu IgY dapat dimanfaatkan untuk mencegah penyakit pernafasan (Wibawan et al. 2009). Pemanfaatan IgY telur ayam berkhasiat anti virus flu burung H5N1 sebagai bahan suplemen pangan atau nutricional food yang dapat
menetralkan virus flu burung H5N1 yang menginfeksi hewan coba telah dilaporkan pula oleh Soejoedono (2008).
Penggunaan IgY spesifik selain bermanfaat bagi pengobatan atau terapi juga dikembangkan untuk tujuan imunodiagnostik seperti pembuatan konjugat
Western Blot, ELISA dan reaksi imunopresipitasi. Di Indonesia sendiri
telah dilakukan beberapa penelitian mengenai IgY, diantaranya sebagai anti tetanus oleh Suartha (2006), anti adhesin pada pembentukan biofilm
oleh Chismirina (2006) dan anti EPEC oleh Rawendra (2005) serta Mustopa (2004). Ayam mampu memproduksi IgY anti S. mutans pada serum dan kuning
telur. Kemampuan IgY dalam menurunkan jumlah perlekatan bakteri S. mutans
menunjukan adanya peluang tentang penggunaan IgY dalam mengatasi masalah karies gigi akibat serangan S. mutans (Poetri & Soejoedono 2006).
Imunoglobulin Y yang diperoleh dari kuning telur ayam yang mengandung anti Streptococcus mutans dapat dikembangkan menjadi sediaan farmasi modern
berbentuk obat hisap dan obat pasta gigi yang berkhasiat sebagai antiplaque
13
Ayam petelur berespon sangat baik terhadap antigen vaksin virus H5N1 yang disuntikan. Pembentukan antibodi spesifik terhadap H5N1 dalam serum, telah dideteksi pada minggu pertama, dengan kisaran titer 22 - 24 setelah vaksinasi pertama. Reaksi presipitasi antara IgY dalam serum dengan antigen virus H5N1 belum terbentuk jelas pada uji imunodifusi. Titer antibodi H5N1 dalam serum meningkat dengan kisaran titer menjadi 27 - 29
Teknik Diagnosa Avian Influenza (AI) pada Ayam
setelah dilakukan penyuntikan kedua (booster). IgY dalam kuning telur memiliki kemampuan netralisasi
terhadap virus AI H5N1 dan memiliki peluang yang cukup besar sebagai
imunoterapi dalam pencegahan dan pengobatan penderita flu burung (Wibawan et al. 2009). Titer antibodi AI maksimum dalam serum dan kuning
telur terdeteksi masing pada 14 dan 35 hari setelah dilakukan vaksinasi. Telur mengandung antbodi tidak hanya melindungi terhadap ayam dari serangan
penyakit, tetapi juga mengurangi penularan virus AI, sehingga dapat mencegah terjadinya wabah AI(Rahimi et al. 2007).
Uji Hemaglutination Inhibition (HI)
Uji serologi merupakan uji menggunakan serum darah yang mengandung antibodi (Ab) dengan antigen (Ag) baik berupa virus, bakteri maupun benda yang dianggap asing bagi tubuh. Antibodi adalah molekul protein yang dihasilkan sel plasma akibat dari sel limfosit peka antigen. Antigen merupakan senyawa
yang dapat merangsang pembentukan antibodi. Fungsi uji serologis untuk kepentingan diagnosa terhadap penyakit yang melihat kandungan antibodi
dalam serum darah, penentuan jenis antigen baik virus, bakteri dan sebagainya (Soejoedono & Murtini 2009).
Sebagian besar spesies ayam yang terpapar virus AI atau telah divaksinasi, akan membentuk antibodi dalam serumnya sehingga bisa dideteksi keberadaannya dengan hambatan aglutinasi (HI). Uji HI berguna untuk mengindikasikan adanya
paparan agen yang menggumpalkan darah dan identifikasi isolat baru. Terdapat dua metode uji antibodi dengan HI yaitu menggunakan virus konstan
14
serum konstan dan virusnya diencerkan dikenal dengan metode α (Hitchner et al.
1975).
Serum Neutralization Test (SNT)
Uji netralisasi virus digunakan megukur titer antibodi secara kuantitatif
dan identifikasi virus yang tidak diketahui, dengan menggunakan antisera yang sudah diketahui. Uji netralisasi terdiri dua tahap. Tahap pertama adalah virus
dengan titer tertentu direaksikan dengan serum pada beberapa titer tertentu pada tabung uji. Campuran virus dan serum diinkubasikan bersama pada suhu
tertentu untuk jangka waktu tertentu. Tahap kedua, dilakukan pembiakan virus-virus yang tidak ternetralisasi ke sistem indikator (media biakan) media penumbuh virus diinkubasikan dan diamati sehingga dapat diketahui adanya netralisasi yang ditandai dengan tidak tumbuhnya virus pada sistem indikator.
Oleh karenanya diperlukan sistem indikator baik berupa hewan coba maupun telur tertunas serta biakan jaringan yang bersifat Spesific Pathogen Free
(SPF) (Soejoedono & Murtini 2009).
Uji netralisasi metode β dilakukan dengan mengencerkan serum yang diuji secara seri dan dicampurkan dengan virus standar titer tertentu. Keuntungan teknik ini penggunaan serumnya relatif sedikit, dapat digunakan untuk menguji virus dengan titer yang rendah dan menggambarkan secara signifikan perbedaan
netralisasi antibodi antara serum kondisi akut ataupun baru sembuh penyakit tertentu. Penghitungan indek netralisasi metode β dengan menghitung
respon quantal, titik akhir 50% dari netralisasi dihitung menggunakan metode Reed-Muench. Indek netralisasi mdihitung dari titik terakhir.
15
BAHAN DAN METODE PENELITIAN
Waktu dan Tempat Penelitian
Penelitian dibeberapa lokasi di Fakultas Kedokteran Hewan, Institut Pertanian Bogor. Pemeliharaan ayam petelur dilakukan di kandang
hewan coba Laboratorium Kadang Terpadu. Pemeriksaan titer antibodi dan uji serum netralisasi dari kuning telur dilaksanakan di Laboratorium Terpadu
Bagian Mikrobiologi Medik, Departemen Ilmu Penyakit Hewan dan Kesehatan Masyarakat Veteriner, Fakultas Kedokteran Hewan, Institut Pertanian Bogor pada bulan Oktober 2011 – Maret 2012.
Desain Penelitian
Kemampuan netralisasi maternal antibodi yang terkandung dalam kuning
telur ayam terhadap virus AI isolat lapang dan menentukan titer antibodi asal induk protektif terhadap infeksi virus AI diketahui dengan uji netralisasi
yang didesain melalui beberapa tahapan :
1. Pemeliharaan ayam petelur umur 22 minggu, pengambilan serum darah sebelum dilakukan vaksinasi AI (VS, VC, VV, VM dan kontrol).
2. Vaksinasi dengan vaksin VS, VC, VV dan VM, dua minggu kemudian ayam dari masing-masing kelompok diambil serumnya.
3. Deteksi menggunakan Uji HI pada serum ayam setelah 7 hari divaksin. Antigen yang digunakan isolat Nagrak (2009) dan Lawang (2010). Penggunaan kedua antigen tersebut berdasar adanya wabah didaerah Nagrak tahun 2009 dan Lawang tahun 2010 pada beberapa breeding farm, yang telah
divaksinasi AI tetapi tetap terinfeksi virus AI. 4. Koleksi telur.
5. Pemisahan kuning telur dengan putih telur. 6. Pengujian HI pada kuning telur.
16
Kerangka Konsep
Hewan Coba @ 5 ekor ayam petelur
divaksinasi dengan Vaksin H5N1 yang berbeda (VS, VC, VV, VM dan kontrol)
Koleksi Kuning Telur dari kelima kelompok VS, VC, VV, VM dan kontrol
Pengujian HI
(Haemaglutinin Inhibitor Test)
Pengujian terhadap Antigen isolat
Nagrak (2009) dan Lawang (2010)
SNT (Serum Neutralisasi Test)
Pengujian terhadap Antigen isolat Nagrak (2009) dan Lawang (2010) Titer Antibodi
17
Roadmap Penelitian
Koleksi Serum darah ayam petelur sebelum divaksinasi
Pengujian HI pada Serum Ayam petelur
Vaksinasi AI berdasarkan kelompok Ayam petelur (VS, VC, VV dan VM)
Pengujian HI terhadap serum, yang telah di vaksinasi AI (setelah 7 hari), Berdasarkan kelompok ayam petelur
Koleksi telur ayam, berdasarkan kelompok (VS, VC, VV, VM dan kontrol)
Pemisahan kuning telur, dan pemurnian kuning telur
Pengujian HI pada kuning telur yang sudah dimurnikan
18
Hewan Coba
Penelitian ini menggunakan 25 ekor ayam petelur strain Isa Brown umur 22 minggu (siap bertelur). Ayam tersebut selanjutnya dibagi menjadi lima
kelompok, masing-masing terdiri dari lima ekor ayam. Kelompok pertama tidak divaksinasi sebagai kelompok kontrol. Kelompok kedua divaksinasi dengan vaksin AI H5N1 inaktif komersial dengan kode VS. Kelompok ketiga
divaksinasi dengan vaksin AI H5N1 inaktif komersial dengan kode VC. Kelompok keempat divaksinasi dengan vaksin AI H5N1 inaktif komersial dengan kode VV, sedangkan kelompok kelima divaksinasi dengan vaksin AI H5N1 inaktif komersial dengan kode VM.
Vaksin dan Antigen Virus AI H5N1
Vaksin yang digunakan pada penelitian ini adalah vaksin AI H5N1 inaktif komersial yang diproduksi oleh produsen vaksin dalam negeri. Terdapat empat
jenis vaksin AI yang digunakan yaitu vaksin dengan kode VS, VC, VV dan VM. Pada penelitian ini juga akan digunakan antigen AI H5N1 sebagai virus standar
pada uji penghambatan hemaglutinasi (HI). Hasil titrasi ayam sebelum divaksin 23,60. Setelah ayam petelur diistirahatkan selama 2 (dua) hari dilakukan
penyuntikan antigen AI dan vaksin yang semuanya dalam bentuk inaktif. Jenis antigen AI H5N1 yang digunakan adalah antigen AI H5N1 isolat
A/Chicken/Nagrak/2009 dan A/Chicken/Lawang/2010 yang telah diinaktivasi. Penyuntikan antigen Nagrak (2009), dosis 0,2 ml (1024 HAU) dan antigen Lawang (2010), dosis 0,05 ml (104 HAU) masing-masing secara intra vena. Vaksinasi dilakukan secara subkutan pada masing-masing kelompok ayam yang divaksin. Dosis vaksinasi pada kelompok VS : 0,5ml per ekor, kelompok VM : 0,5 ml per ekor, kelompok VC : 0,3ml per ekor, sedangkan kelompok VV : 0,5ml per ekor.
Vaksinasi Ayam Petelur
19
yang akan dilakukan. Vaksinasi dilakukan ketika hasil uji HI dari ayam yang akan digunakan titernya lebih rendah dari 22. Ayam yang titer antibodi
terhadap AI-nya rendah selanjutnya dibagi dalam lima kelompok seperti diuraikan diatas.
Perlakuan vaksinasi secara subkutan pada masing-masing kelompok ayam yang divaksin. Dosis vaksinasi pada kelompok VS : 0,5 ml per ekor, kelompok VM : 0,5 ml per ekor, kelompok VC : 0,3ml per ekor, sedangkan
kelompok VV : 0,5ml per ekor. Vaksinasi dilakukan sebanyak dua kali dengan interval satu bulan. Seminggu setelah vaksinasi kedua setiap tujuh hari ayam diambil darahnya, diperiksa titer antibodinya terhadap AI H5 dengan uji HI menggunakan kedua jenis antigen. Pada saat titer antibodinya minimum 27 maka telurnya mulai dikumpulkan setiap hari.
Pengumpulan Antibodi Asal Induk dari Kuning Telur
Telur dari induk yang telah divaksin dikumpulkan dan diperiksa antibodi dalam kuning telur terhadap AI H5. Kuning telur yang telah mengandung antibodi terhadap AI dengan titer diatas 25 selanjutnya dikumpulkan berdasarkan kelompok dan hari pemanenan. Kuning telur tersebut dimasukan ke tabung mikro
(microtube) dan disimpan pada suhu -20oC sampai saat akan digunakan.
Koleksi kuning telur dalam microtube diencerkan menggunakan PBS pH 7,4
perbandingan 1:1 (Soejoedono & Murtini 2009). Suspensi kuning telur di-vortex
sampai homogen. Supernatan dari suspensi kuning telur tersebut selanjutnya diuji titer antibodinya terhadap AI H5.
Uji Hemaglutinasi (HA) Mikrotitrasi
Virus yang akan digunakan sebagai standar ditentukan titernya atau dititrasi menggunakan uji HA. Virus AI H5 yang digunakan sebagai virus
standar pengujian adalah isolat Nagrak (2009) dan Lawang (2010) yang merupakan isolat lapang. Prosedur HA (OIE 2004) sebagai berikut :
• Sebanyak 25 µl PBS menggunakan mikropipet dimasukan ke dalam baris A hingga F pada kolom 2 sampai 12.
20
• 25 µl virus AI dipindahkan dari sumur AI hingga E1 ke dalam sumur A2 sampai E2 dan dihomogenkan.
• PBS sebanyak 25 µl ke dalam sumur B2 dan dihomogenkan kemudian diambil sebanya 25 µl sehingga diperoleh pengenceran sepertiga.
• Selanjutnya ke dalam sumur C2 diambahkan PBS 75 µl, dihomogenkan kemudian diambil sebanya 75 µl sehingga diperoleh pengenceran seperlima, • Ke dalam sumur D2 ditambahkan PBS 125 µl dimasukan dan dihomogenkan,
dan diambil 125 µl sehingga diperoleh pengenceran sepertujuh.
• Ke dalam sumur E2 ditambahkan PBS 175 µl dan dihomogenkan, diambil 175 µl sehingga diperoleh pengenceran sepersembilan.
• Selanjutnya campuran pada sumur A2 hingga E2 diambil 25 µl ke dalam kolom A3 sampai E3, kemudian dihomogenkan demikian seterusnya dipindahan dari A3 sampai E3 ke sumur A4 sampai E4. langkah tersebut
hingga kolom A12 hingga E12. Setelah dihomogenkan kolom A12 hingga E12, diambil 25 µl dibuang.
• Ke semua sumur ditambahkan 25 µl PBS pada setiap sumur
• Selanjutnya kesemua sumur di tambahkan suspensi sel darah merah 1% sebanyak 25 µl.
• Campuran dalam plate dihomogenkan selama 10 detik menggunakan plate shaker.
• Plate diinkubasi selama 60 menit pada suhu 4°C.
21
Pemeriksaan Antibodi Anti AI H5 dengan Uji Penghambatan Aglutinasi
(Heamagglutination Inhibition Test / HI Test)
Penentuan titer antibodi anti AI H5 pada serum ayam petelur maupun
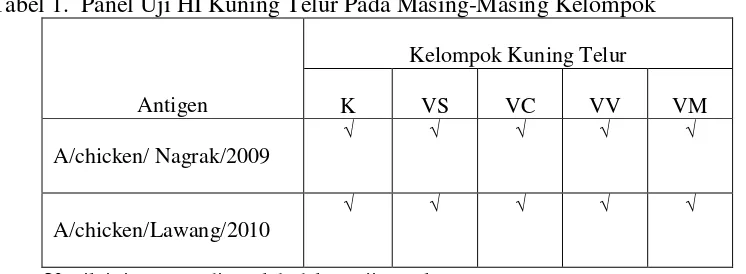
kuning telur dilakukan dengan uji HI menurut metode OIE (2004). Uji HI ini menggunakan dua jenis antigen seperti yang tersaji pada Tabel 1.
Pengujian serum ayam dan kuning telur dilakukan sebagai berikut :
• Sumur 1 – 12 dari microplate V bottom diisi dengan PBS. steril masing-masing 25 µl menggunakan mikropipet kapasitas 200 µl.
• Sebanyak 25 µl serum atau kuning telur yang akan diuji dan masukkan kedalam sumur pertama dan dihomogenkan. Campuran 25 µl serum/kuning telur sumur pertama dipindahkan ke sumur kedua kemudian dihomogenkan, seterusnya sampai sumur ke-12. Sumur ke-12 diambil 25 µl dan dibuang. • Masing-masing sumur ditambahkan suspensi virus standar (4 HAU) 25 µl.
Microplate dihomogenkan menggunakan plate shaker selama 10 detik
dan diinkubasikan pada suhu 40C selama 60 menit.
• Plate yang telah diinkubasi kemudian diisi 25 µl suspensi sel darah merah 1 % ke seluruh sumur.
• Microplate kembali digerakan menggunakan plate shaker selama 10 detik
dan diinkubasikan pada suhu 40C selama 60 menit.
• Titer antibodi ditentukan dari pengenceran tertinggi kuning telur yang mampu menghambat aglutinasi pada sel darah merah.
Tabel 1. Panel Uji HI Kuning Telur Pada Masing-Masing Kelompok
22
Uji Serum Netralisasi
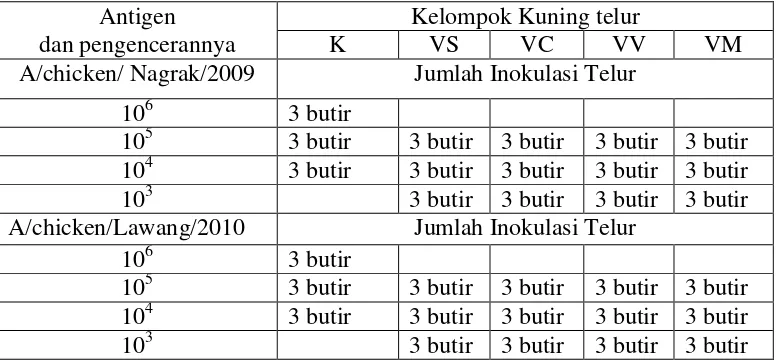
Kemampuan antibodi yang terdapat dalam kuning telur untuk menetralkan virus AI diuji dengan uji serum netralisasi. Uji serum netralisasi dilakukan terhadap kuning telur dari masing-masing kelompok dengan virus isolat lapang (A/chicken/Nagrak/2009 dan A/chicken/Lawang/2010). Titer virus yang digunakan 106 sampai dengan103 EID50. Uji serum netralisasi ini menggunakan
telur ayam berembrio bebas antibodi AI H5 (spesific antibody negative) umur 10
hari. Uji serum netralisasi menggunakan metode α dan dihitung dengan metode
Reed-Muench. Pada uji ini virus diencerkan sedangkan titer antibodi tetap. Rancangan uji serum netralisasi disajikan pada Tabel 2. Uji netralisasi dilakukan dengan cara sebagai berikut :
• Virus isolat lapang yang akan diuji dititrasi terlebih dahulu dengan uji titrasi pada telur ayam berembrio (titrasi EID50).
• Virus yang telah diketahui titernya diencerkan secara desimal menggunakan PBS antibiotik, sehingga titernya mencapai 106, 105, 104 dan 103EID50.
Virus yang telah diencerkan dimasukan ke tabung mikro (microtube)
masing-masing 0,5 ml. Tabung yang telah berisi suspensi virus ditambahkan kuning telur yang akan diuji dengan perbandingan 1:1 (0,5 ml virus; 0,5 kuning telur) (Soejoedono et al. 2011).
• . Campuran virus dengan kuning telur diinkubasikan pada suhu 370C selama 30 menit atau suhu kamar 40 menit.
• Masing-masing campuran diinokulasikan ke telur ayam berembrio melalui ruang alantois. Dosis inokulasi 0,2 ml/butir dan tiap pengenceran disuntikan pada tiga butir telur.
• Telur yang telah diinokulasi diinkubasi selama 4 hari pada suhu 37oC.
• Selama masa inkubasi diamati adanya kematian, setelah 4 hari embrio dalam telur dimatikan dengan menyimpan pada suhu 40C semalam.
23
Tabel 2. Panel Uji Serum Netralisai Kuning Telur Pada Masing-masing Kelompok
Antigen dan pengencerannya
Kelompok Kuning telur
K VS VC VV VM
A/chicken/ Nagrak/2009 Jumlah Inokulasi Telur
106 3 butir
105 3 butir 3 butir 3 butir 3 butir 3 butir 104 3 butir 3 butir 3 butir 3 butir 3 butir
103 3 butir 3 butir 3 butir 3 butir
A/chicken/Lawang/2010 Jumlah Inokulasi Telur
106 3 butir
105 3 butir 3 butir 3 butir 3 butir 3 butir 104 3 butir 3 butir 3 butir 3 butir 3 butir
103 3 butir 3 butir 3 butir 3 butir
Analisa Data :
25
HASIL DAN PEMBAHASAN
Penelitian ini mengamati antibodi yang diinduksi oleh berbagai jenis vaksin AI komersial yang beredar di Indonesia dalam menetralkan virus AI isolat lapang. Jenis vaksin AI yang beredar di Indonesia memiliki seed virus vaksin
yang berbeda-beda tergantung dari produsennya. Pada program vaksinasi efektif, seleksi strain seed vaksin merupakan bagian sangat penting untuk mendapatkan
perlindungan maksimal yang hanya dapat dicapai bila ada kecocokan antara antibodi dengan antigen bersirkulasi di lapang, dalam hal ini virus AI. Pada virus AI kecocokan terutama terhadap antigen HA-nya karena antigen tersebut merupakan target utama dari sistem kekebalan. Namun,virus AI adalah virus RNA
yang dapat bermutasi cepat pada protein HA dan NA, dan mutasi tersebut dapat menyebabkan perubahan antigenitas, sehingga membuat vaksin tidak efektif. Mutasi pada HA dan NA juga disebut antigenic drift (Cai et al.
2010). Keragaman antigen virus HPAI H5N1 tidak hanya mempersulit pengembangan vaksin tetapi juga permasalahan diagnostik, karena antigen tunggal (antiserum) diduga tidak dapat mendeteksi semua sampel isolat lapangan H5N1 (Ducatez et al. 2011).
Menghadapi kemungkinan tidak efektifnya vaksinasi ini disiasati oleh perusahaan vaksin dengan menggunakan seed vaksin tertentu untuk setiap
produksinya. Hal itu menyebabkan adanya perbedaan virus seed vaksin
pada produk vaksin yang beredar di Indonesia. Seed vaksin umumnya diseleksi
sedapat mungkin memiliki kesamaan antigenik dengan virus yang bersirkulasi di lapang. Seleksi seed vaksin influenza merupakan langkah – langkah
26
Uji HI digunakan untuk mengukur jarak antara dua antigen melalui uji
serologi antara antigen dengan antiserum standar yang sama, misalnya, jika salah satu uji antigen merupakan reaktor tinggi untuk antiserum standar
(contoh : titer 320) sementara antigen uji yang lain reaktor rendah (contoh : titer 40). Hasil pengujian tersebut merupakan jarak antigenik mencapai
3 unit, dengan pengenceran log2 (320/40). Pada kenyataannya jarak antigen biasanya diukur dengan antisera standar, tetapi perhitungannya relatif rumit. Penghitungan data HI umumnya digunakan untuk menentukan jarak antar antigen
standar dengan antigen yang diuji. Kartografi sebagai analogi geografis digunakan untuk menggambarkan dan mengukur jarak antigenik dari virus influenza.
Kriteria penting pada vaksin influenza baru merupakan antigen yang berbeda secara signifikan (misalnya 4 kali lipat perubahan pada uji HI) dari
strain vaksin saat ini. Kartografi antigenik Influenza dapat membantu kita
mengidentifikasi apakah pengujian antigen (virus) adalah antigen yang jauh dari strain spesifik vaksin atau cluster antigen spesifik (misalnya : sirkulasi strain
pada periode waktu tertentu)(Cai et al. 2010 ).
Pengujian titer antibodi anti AI H5 dalam kuning telur menggunakan antigen standar virus AI H5N1 isolat Nagrak (2009) dan Lawang (2010) menunjukkan adanya antibodi anti AI H5 dalam kuning telur semua kelompok
yang divaksinasi. Titer antibodi dalam kuning telur yang dikumpulkan pada minggu ke 6 setelah vaksinasi tersebut cukup tinggi yaitu mencapai 27,6
sampai 28 antigen isolat Nagrak (2009) dan 26,2 sampai 27,8 antigen isolat Lawang (2010) Semua jenis vaksin komersial yang digunakan mampu
menginduksi terbentuknya antibodi dengan titer tinggi. Hal ini menunjukkan bahwa perbedaan seed virus dari masing-masing vaksin tidak mempengaruhi
pembentukan antibodi. Titer antibodi dalam kuning telur dari masing-masing kelompok ketika diuji HI menggunakan virus standar isolat Lawang (2010) memberikan hasil berbeda dengan virus standar isolat Nagrak (2009) pada waktu
setiap pengamatannya. Namun perbedaan itu tidak melebihi selisih titer 22, sehingga dapat dinyatakan antigen vaksin secara antigenik kartografi tidak berbeda dalam keragaman karakteristik antigeniknya. Berdasarkan
27
dan titik antigen A sesuai dengan perbedaan antara log-2 dari maksimum titer yang diamati untuk antiserum S terhadap setiap antigen dan log-2 dari titer antiserum untuk S terhadap antigen A, diartikan masih memiliki kesamaan fenotipe (Fouchier et al. 2010).
Hasil pengujian semua antibodi anti AI dalam kuning telur menunjukan
hasil vaksinasi keempat kelompok dengan antigen isolat Nagrak (2009) maupun Lawang (2010) yang tidak sampai 22, maka dapat diklasifikasikan bahwa
belum ada perubahan fenotipe antara kedua antigen tersebut. Umumnya kartografi antigenik pada virus Influenza dapat digunakan sebagai identifikasi varian antigenik dan seleksi strain vaksin influenza. Kartografi antigenik Influenza analog dengan kartografi geografi. Hal tersebut memproyeksikan antigen influenza kedalam peta 2 dimensi berdasarkan titernya. Jarak antar antigen dapat diukur seperti jarak geografis pada peta geografis (Ducatez et al. 2011).
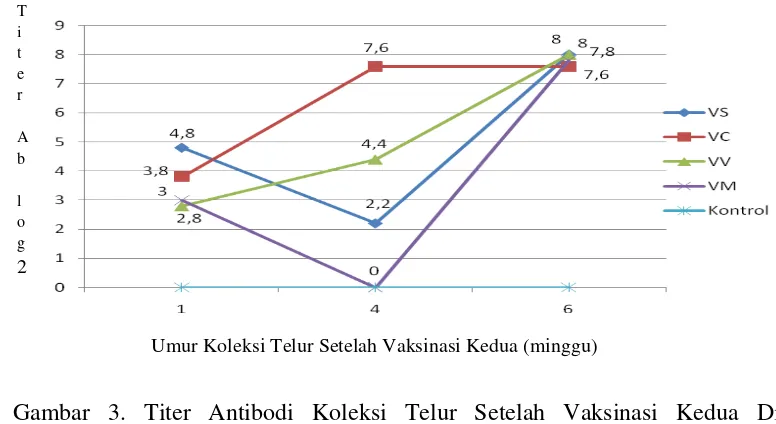
Gambar 3. Titer Antibodi Koleksi Telur Setelah Vaksinasi Kedua Diuji Dengan Antigen Isolat Nagrak (2009)
Pada Gambar 3. Menunjukan pada minggu ke-4 setelah vaksinasi kedua, kelompok vaksin VS dan VM mengalami penurunan titer antibodi masing-masing menjadi 22,2 serta 20. Berbeda dengan kelompok vaksin VC dan VV mengalami peningkatan titer antibodi, masing-masing menjadi 27,6 serta 24,4. Hal tersebut sejalan dengan hasil penelitian Soejoedono et al. (2011), yang mengamati adanya
28
penurunan titer antibodi pada serum darah ayam kelompok yang sama divaksin
dengan vaksin VS dan VM yang diuji HI menggunakan antigen isolat Nagrak (2009) didapatkan titer antibodinya masing-masing kelompok VS : 24,8
menjadi 22,2 dan VM : 22,8 menjadi 22,4. Pengamatan pada serum kelompok VV mengalami peningkatan titer antibodi dari 22,8 menjadi 24,4. Hasil pengujian tersebut menunjukan pada vaksinasi kedua antibodi dalam kuning telur dan serum g berbeda jauh titer antibodinya setelah diuji HI dengan antigen isolat Nagrak (2009). Hal ini dapat diartikan bahwa jumlah antibodi anti AI H5 dalam serum dan kuning telur pada saat yang sama memiliki titer sama. Dengan demikian untuk mendapatkan titer yang tinggi dalam tubuh anak ayam (DOC) maka titer antibodi dalam tubuh induk harus tinggi.
Pada kondisi anak ayam yang antibodi asal induknya atau antibodi dalam kuning telurnya rendah kurang dari 24 ayam rentan terhadap virus isolat
lapang seperti halnya AI H5N1 isolat Nagrak (2009) (FOHI 2008). Dengan demikian kelompok vaksin VS dan VM empat minggu setelah vaksinasi
masih belum dapat menahan infeksi paparan virus isolat lapang karena titer antibodi dalam kuning telur yang dihasilkan ≤ 2 2,2, menurut (FOHI 2008) konsentrasi titer virus cukup protektif bila nilai titer antibodinya mencapai ≥ 2 4. Berbeda dengan hasil pada kelompok yang divaksin dengan vaksin VV dan VC, kedua kelompok tersebut titer antibodi asal induknya dalam kuning telur cukup tinggi yaitu mencapai 27,6 (VC) dan 24,4 (VV). Pada kelompok ini titernya dapat digolongkan pada titer protektif menurut (FOHI 2008).
Pada minggu keenam setelah vaksinasi kedua, kelompok vaksin VS, VM dan VV mengalami peningkatan titer antibodi VS dan VM, masing-masing 28, VV 27,8. Kelompok vaksinasi VC memiliki titer antibodi tetap seperti minggu keempat setelah vaksinasi yaitu 27,6. Hasil ini sesuai dengan penelitian pada serum
setelah minggu keenam atau vaksinasi ketiga memiliki titer antibodi terhadap antigen isolat Nagrak (2009) semua kelompok vaksinasi VS, VC, VM
dan VV memiliki titer antibodi ≥ 28 sehingga vaksinasi dengan empat (4) vaksin
29
Umur Koleksi Telur Setelah Vaksinasi Kedua (minggu)
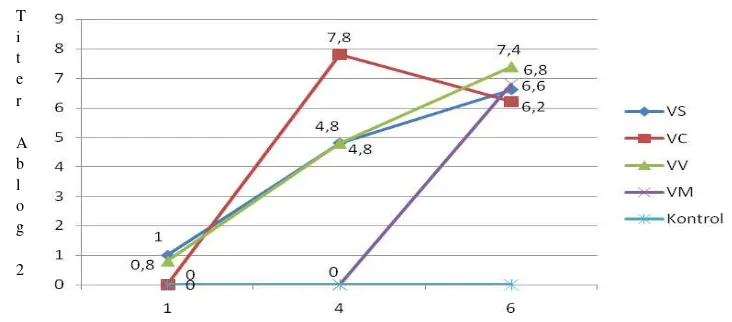
Gambar 4. Titer Antibodi Koleksi Telur Setelah Vaksinasi Kedua Diuji Dengan Antigen Isolat Lawang (2010)
Pengaruh hasil vaksinasi titer antibodi pada kuning telur hampir sama dengan serum. Pada Gambar 4. Menunjukan hasil vaksinasi kelompok vaksin VS, VC, VV dan VM, setelah dilakukan uji HI kuning telurnya minggu pertama masing-masing adalah 21; 20,8; 20; 20. Titer antibodi yang muncul masih sangat rendah karena vaksinasi menggunakan vaksin inaktif beremulsi dengan adjuvan minyak seperti halnya vaksin AI memerlukan pembentukan antibodi yang cukup lama yaitu 3 – 4 minggu setelah vaksinasi. Titer antibodi pada empat minggu setelah vaksinasi pada semua kelompok vaksinasi VS, VC, VV dan VM diperoleh masing-masing adalah 24,8; 27,8; 24,8 dan 20. Hasil tersebut menggambarkan hampir semua kelompok mengalami kenaikan titer antibodi bila dititrasi dengan virus isolat Lawang (2010) kecuali kelompok VM. Kondisi ini juga menggambarkan pada daerah yang memiliki virus AI H5N1 seperti isolat Lawang (2010) ketiga kelompok vaksin dapat melindungi ayam dari kematian namun pada kelompok VM tidak terlindungi karena titer antibodinya rendah dibawah 24 (FOHI 2008). Pada minggu keenam vaksinasi maternal antibodi menunjukan titer antibodi cukup protektif dengan nilai titer antibodi ≥ 24, sehingga vaksinasi dengan empat vaksin komersial dapat melindungi anak ayam dari induk yang divaksin. Berdasarkan hasil tersebut dapat disarankan pada peternak yang daerahnya memiliki virus isolat Lawang, maka vaksinasi menggunakan vaksin VM lebih baik dilakukan tiga kali vaksinasi (Soejoedono et al. 2011).
30
Kuning telur kelompok ayam kontrol tidak diberi perlakuan apapun setelah dilakukan uji HI dengan menggunakan antigen AI H5N1 isolat Nagrak (2009) dan Lawang (2010) pada minggu pertama, keempat dan keenam setelah vaksinasi
ditemukan titer antibodi 20. Kondisi ini menggambarkan bahwa antibodi dari ayam-ayam penelitian yang diamati hanya diperoleh dari induksi vaksin
yang diberikan bukan dari paparan lingkungan tempat ayam dipelihara. Hal ini dibuktikan dari tidak munculnya antibodi anti AI H5N1 pada ayam yang tidak divaksin.
Pada Gambar 3 dan 4. tampak bahwa satu minggu setelah vaksinasi kedua
antibodi dalam serum sudah mulai ditransfer kedalam kuning telur, hal itu ditandai dengan munculnya antibodi terhadap AI H5 dalam kuning telur
ayam yang divaksinasi sedangkan pada ayam kontrol tidak muncul antibodi
tersebut. Hasil ini sesuai dengan pernyataan Chalghoumi et al. (2009)
bahwa serum IgY secara selektif ditransfer dari induk melalui sistem sirkulasi darah melalui oolema ke oosit matang dalam folikel di ovarium. Transfer IgY
tersebut melalui reseptor spesifik pada permukaan membran kantung kuning telur dimana dapat mentransportasikan semua subpopulasi IgY induk.
Titer IgY di dalam darah tidak selalu setara dengan titer IgY yang ada dalam kuning telur, artinya tingginya titer IgY di dalam darah dalam satu saat,
tidak selalu berbarengan dengan tingginya titer IgY di dalam kuning telur. Hal tersebut sesuai dengan pengamatan dalam penelitian ini, bahwa dibutuhkan
waktu 1 minggu untuk dapat mendeteksi IgY dalam kuning telur setelah IgY terdeteksi positif pada serum. Fenomena ini belum sepenuhnya dapat dijelaskan, meskipun diketahui bahwa transfer IgY ke dalam kuning telur melalui 2 tahapan
yang tampaknya membutuhkan waktu tertentu untuk proses transfer ini, yang mungkin waktu transfernya bervariasi untuk setiap individu ayam.
Pertama, IgY ditransfer dari serum menuju kuning telur dengan proses yang analog dengan proses transfer antibodi (IgY) pada fetus melalui plasenta
31
konsentrasi IgY sekitar 10 – 20 mg/ml (Rose et al. 1974
dalam Wibawan et al. 2010).
Variasi respon pembentukan antibodi dalam individu dapat pula
disebabkan karena perbedaan kondisi fisiologis antar individu ayam. Hal tersebut menyebabkan adanya perbedaan kinerja makrofag, yang memiliki
peran penting dalam penyajian antigen (antigen presenting cells) mengoptimalkan
kerja sel limfosit Th (T helper) dalam menghasilkan sitokin dan kemudian
menginduksi sel B menjadi sel plasma yang secara spesifik menghasilkan IgY. Perbedaan kondisi fisiologis antar individu ayam secara kuantitatif tidak mudah
diukur, karena paparan toksin, logam berat, atau zat berbahaya lainnya sering terjadi secara subklinis. Di samping itu, perbedaan derajat inbreeding individu
dapat pula menyebabkan perbedaan respon kekebalan dan perbedaan respon kepekaan terhadap penyakit tertentu (Wibawan et al. 2010)
Berdasarkan gambaran titer antibodi dalam kuning telur, tampak bahwa maternal antibodi yang cukup tinggi baru diturunkan pada enam minggu setelah
vaksinasi kedua. Kuning telur yang mengandung antibodi tersebut dapat mengurangi penularan virus pada ayam dan mencegah terjadinya outbreak
AI (Rahimi et al. 2007).
Pengujian Serum Netralisasi Test (SNT)
Uji netralisasi serum merupakan uji identifikasi antigen dan antibodi
dengan melihat kemampuan netralisasi antibodi (Ab) terhadap antigen (Ag). Uji netralisasi virus lebih sensitif untuk mendeteksi antibodi spesifik H5 dan
terutama lebih spesifik pada antibodi dalam mendeteksi virus influenza sampai tingkat strain (Okuno et al. 1990).
Namun, tidak terdapat protokol standar mendeteksi penetralisasi antibodi yang ada, karena korelasi kekebalan terhadap perlindungan tubuh tidak dapat ditentukan secara pasti. Vaksin yang menghasilkan titer antibodi, belum tentu
mampu menetralisasi virus lapang. Hal tersebut seharusnya ditangani bagian
dari strategi untuk mengembangkan vaksin yang cocok terhadap AI (Stephenson et al. 2005). Antibodi, meskipun memiliki titer antibodi yang tinggi
32
Pada penelitian ini diamati kemampuan antibodi yang diinduksi oleh berbagai jenis vaksin AI di Indonesia dalam menetralkan virus AI isolat
lapang. Uji netralisasi serum ini menggunakan metode α yaitu antibodi dalam
kuning telur konsentrasinya konstan, sedangkan virus tantangnya diencerkan. Menurut DITJENAK (2007) standar indek netralisasi suatu vaksin dinilai
protektif bila nilainya lebih dari 2 (102).
Tabel 3. Hasil Pengujian Netralisasi Serum
Pada semua kelompok vaksin setelah dilakukan uji dengan antigen isolat Nagrak (2009) semua kelompok vaksin VS, VM, VC dan VV bersifat protektif hasil tersebut ditunjukan dengan tingginya angka indek netralisasi yaitu > 2. Hasil tersebut sejalan dengan penelitian Soejoedono et al. (2011) pada serum darah didapat indek netralisasi > 1,50 – 1,90 untuk masing-masing kelompok vaksin VS, VM, VC dan VV menunjukan bahwa bila paparan lapang virus Nagrak (2009), maka akan mampu menahan infeksi, sehingga bersifat protektif.
Pada antibodi kuning telur, asal keempat kelompok yang vaksin ketika diuji dengan antigen isolat Lawang (2010) VS, VM dan VC bersifat protektif karena memiliki indek netralisasi > 2, sedangkan kelompok VV
indek netralisasinya hanya 1,5. Hasil ini menunjukan bahwa meskipun antibodi dalam kuning telurnya memiliki titer antibodi yang tinggi dengan uji HI namun
antibodi tersebut tidak mampu menetralkan virus AI isolat Lawang (2010). Hasil tersebut berbeda dengan dengan penelitian Soejoedono et al. (2011) pada serum darah yang didapat dari indek netralisasi untuk kelompok vaksin VM
33
maka kelompok ayam yang mendapatkan vaksin VM akan mampu menahan
infeksi ; hal ini ditunjukkan bahwa hasil indek netralisasi > 1.50 - 1,90. Sedangkan vaksin VS, VV dan VC tidak protektif karena hasil indek netralisasi < 1.50 - 1,90.
Hasil tersebut sejalan dengan penelitian Kaverin et al. (2002) yang
mengamati adanya beberapa reaksi yang tidak biasa antara monoklonal antibodi anti protein asam sialik dari virus AI H3 dengan virus isolat lapang H3 yaitu adanya resistensi terhadap netralisasi sehingga masih meninbulkan infektivitas pada kultur sel tapi dengan uji ELISA antigen tersebut mampu mengikat kekebalan asal induk yang diuji.
Netralisasi virus terjadi adanya indikasi gagalnya infeksi virus secara
in-vitro akibat adanya antibodi yang mengikat antigen sehingga antigen target
tidak mampu menempel pada reseptor sel inang. Antibodi menghambat terjadinya interaksi antara virus dengan inang. Antibodi menghalangi proses infeksi virus
pada saat virus menempel pada permukaan inang. Antibodi AI merupakan bahan biologis yang dapat digunakan untuk kepentingan imunoterapi pasif dalam pengendalian penyakit AI (Esfandiari et al. 2008).
Wibawan et al. (2009) melaporkan bahwa IgY asal kuning telur ayam bertiter 24 mampu menetralisasi 100% virus H5N1 isolat 2005. Pada penelitian ini ditemukan bahwa titer IgY dalam kuning telur yang dapat menetralisasi virus isolat Nagrak dan Lawang bertiter lebih tinggi yaitu 26. Perbedaan tingkat efikasi ini dapat disebabkan oleh beberapa faktor, diantaranya adalah adanya perbedaan
konformasi dan konsentrasi antibodi dalam kuning telur ayam (IgY). Telur memiliki konsentrasi IgY berkisar antara 50 - 100 mg/butir telur dengan jumlah antibodi spesifik antara 2 - 10%. Perbedaan antigen yang digunakan dalam pengujian juga sangat berpengaruh terhadap kemampuan
netralisasi serum. Seperti hasil pengujian Kaverin et al. (2002)
yang membuktikan antibodi monoklonal terhadap antigen protein asam amino 26 dari virus AI H5 ketika dititrasi dengan uji HI, memiliki titer rendah, namun ketika diuji dengan uji netralisasi antibodi monoklonal tersebut mampu menghambat infeksi virus. Hasil pengamatan Kaverin et al. (2002)
34
dari epitop cp 58 dan 176, epitop cp 58 tidak dapat diikat oleh mAb tersebut hanya epitop 176 dan epitop 176-lah yang berperan pada mekanisme infeksi virus AI tersebut. Hal ini menyebabkan hasil uji yang menunjukan titer HI lebih rendah namun efektivitas netralisasi lebih baik.
Oleh karena itu penggunaan kelompok vaksin komersial VS, VM, VC dan VV hanya dapat digunakan pada daerah yang paparanya virus lapang Nagrak (2009). Daerah dengan paparan virus Lawang (2010), vaksinasi
menggunakan vaksin VS, VM, VC dan VV tidak menimbulkan kekebalan yang protektif sampai empat minggu setelah vaksinasi. Hal ini diperlukan
pengawasan titer antibodi pada kuning telur di breeding farm pada serum induk
dan dari kuning telur setelah dilakukan vaksinasi paling tidak 3 minggu setelah dilakukan vaksinasi. Pada DOC pemeriksaan dapat dilakukan setelah pool chick
(pengambilan DOC dari mesin tetas) secara rutin, sehingga diketahui titer maternal antibodi AI H5N1 pada anak ayam tersebut. Berdasarkan titer antibodi asal induk anak ayam tersebut dan penggunaan jenis vaksinnya, dilakukan distribusi DOC sesuai seed yang digunakan dalam vaksin tersebut.
35
SIMPULAN DAN SARAN
SIMPULAN
Hasil penelitian ini menunjukan bahwa kuning telur mengandung antibodi AI subtipe H5N1 hasil vaksinasi vaksin komersial Indonesia dapat menetralisasi
virus lapang isolat Nagrak (2009) dan Lawang (2010) kecuali vaksin dengan kode VV hanya dapat menetralisasi virus lapang isolat Nagrak (2009).
Titer antibodi dalam kuning telur yang dapat menetralisasi virus isolat lapang diatas 26. Kuning telur mengandung IgY dapat digunakan sebagai parameter kekebalan asal induk setelah dilakukan induksi vaksin pada induk.
SARAN