KARAKTERISTIK FILM EDIBEL PATI SAGU
CYNTHIA EMANUEL
SEKOLAH PASCA SARJANA
INSTITUT PERTANIAN BOGOR
Dengan ini saya menyatakan bahwa tesis yang berjudul: Pengaruh Fosforilasi dan Penambahan Asam Stearat Terhadap Karakteristik Film Edibel Pati Sagu adalah karya saya sendiri dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, April 2005
CYNTHIA EMANUEL. Pengaruh Fosforilasi dan Penambahan Asam Stearat Terhadap Karakteristik Film Edibel Pati Sagu. Dibimbing oleh AMAN WIRAKARTAKUSUMAH dan FERI KUSNANDAR.
Film edibel adalah suatu lapisan tipis yang dibuat dari bahan yang dapat dimakan. Umumnya film edibel digunakan sebagai kemasan primer untuk melindungi produk pangan didalamnya. Modifikasi pati sagu menggunakan reaksi ikatan silang dengan pereaksi fosforilasi (POCl3).Dalam pembuatan film edibel
digunakan campuran pati sagu dan asam stearat. Penggunaan asam stearat dalam pembuatan film edibel karena.asam stearat merupakan asam lemak rantai panjang (C18) yang bersifat hidrofobik.
Penelitian ini bertujuan untuk 1). mempelajari pengaruh ikatan silang pada pati sagu dan penambahan asam stearat terhadap karakteristik film edibel, 2). menentukan formulasi film edibel dari campuran pati sagu hasil reaksi ikatan silang dengan asam stearat dan 3). melakukan uji coba dalam mengaplikasikan film edibel untuk produk pangan.
Kegiatan penelitian pembuatan film edibel terdiri atas 3 tahapan, yaitu: 1). proses reaksi ikatan silang pada pati sagu, 2). pembuatan film edibel dengan penambahan asam stearat 1%, 2% dan 3%, 3). aplikasi pengemas. Parameter yang diamati untuk pati sagu yaitu: sifat birefrinjen, sifat amilograf sedangkan untuk film edibel yaitu: sifat mekanik, transmisi uap air dan gas.
Hasil penelitian menunjukkan bahwa pati sagu hasil reaksi ikatan silang menunjukkan suhu gelatinisasi dan viskositas yang lebih rendah dibandingkan pati sagu kontrol. Namun granula pati hasil reaksi ikatan silang menunjukkan sifat birefrinjen yang sama dengan granula pati tanpa ikatan silang. Adanya ikatan silang pada granula pati sagu menyebabkan penurunan persen pemanjangan dan transmisi uap air film edibel.
Film edibel dengan kombinasi pati sagu hasil ikatan silang dan asam stearat menghasilkan peningkatan kuat tarik, persen pemanjangan dan mempunyai ketahanan yang baik terhadap transmisi CO2. Semakin meningkatnya penambahan
konsentrasi asam stearat menghasilkan penurunan transmisi uap air tetapi untuk transmisi O2 pada konsentrasi 0.08% dan 0.12% POCl3 menghasilkan peningkatan
transmisi O2 film edibel. Uji coba film edibel sebagai pengemas bumbu instan
memperlihatkan penampakan bumbu instan dan film edibel yang baik selama penyimpanan suhu 29 0C pada RH 43% dan 33%.
Hak cipta milik Cynthia Emanuel, tahun 2005
Hak Cipta dilindungi
Dilarang mengutip dan memperbanyak tanpa izin tertulis dari Institut Pertanian Bogor, sebagian atau seluruhnya dalam bentuk apa pun, baik cetak, fotokopi,
microfilm, dan sebagainya
KARAKTERISTIK FILM EDIBEL PATI SAGU
CYNTHIA EMANUEL
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Program Studi Ilmu Pangan
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
NIM : F251020151
Disetujui
Komisi Pembimbing
Prof.Dr.Ir. M.Aman Wirakartakusumah, M.Sc. Dr. Ir. Feri Kusnandar, M.Sc. Ketua Anggota
Diketahui
Ketua Program Studi Ilmu Pangan Dekan Sekolah Pascasarjana
Prof. Dr.Ir. Betty Sri Laksmi Jenie, MS Prof. Dr.Ir. Syafrida Manuwoto, M.Sc.
sehingga tesis ini dapat diselesaikan dengan baik. Penulis bersyukur tesis ini dapat terselesaikan dengan lancar karena kasih dan rencanaNya yang besar.
Penelitian dengan judul Pengaruh Fosforilasi dan Penambahan Asam Stearat Terhadap Karakteristik Film Edibel Pati Sagu dilakukan selama kurang lebih 1 tahun sejak bulan Februari 2004. Penelitian ini merupakan salah satu penelitian, yang mendapatkan Bogasari Nugraha 2003.
Terima kasih penulis ucapkan kepada Bapak Prof. Dr. Ir. M. Aman Wirakartakusumah, M.Sc. dan Bapak Dr. Ir. Feri Kusnandar, M.Sc. selaku pembimbing, Dr. Ir. Yadi Haryadi, M.Sc. selaku dosen penguji, Ibu Prof. Dr. Ir. Betty Sri Laksmi Jenie, MS. selaku ketua Program Studi Ilmu Pangan dan PT. ISM Bogasari Flour Mills atas bantuan dana penelitian. Ucapan terima kasih juga disampaikan kepada teman-teman IPN 2002 serta papa, mama, kakak-kakak dan seluruh keluarga atas segala doa dan kasih sayangnya.
Semoga karya penelitian ini dapat bermanfaat bagi pembaca.
1974 dari ayah Henky Manansang dan ibu Lindayani Hartono. Penulis merupakan putri kedua dari tiga bersaudara.
Tahun 1993 penulis lulus dari SMA Negeri 3 Denpasar dan pada tahun yang sama diterima di Program Studi Teknologi Pertanian, Jurusan Teknologi Hasil Pertanian, Universitas Udayana Denpasar dan lulus sarjana pada Januari 1999. Kemudian pada bulan Februari 2002 penulis memperoleh kesempatan untuk melanjutkan ke Program Magister pada Program Studi Ilmu Pangan, Sekolah Pascasarjana IPB dengan program khusus Rekayasa Proses Pangan.
DAFTAR TABEL ……… ix
DAFTAR GAMBAR ……… x
DAFTAR LAMPIRAN ……… xi
PENDAHULUAN Latar Belakang ………..……….. 1
Tujuan Penelitian ……..……….. 3
Hipotesis ……….……… 3
TINJAUAN PUSTAKA Pati Sagu ………. 4
Modifikasi Pati …….……….. 9
Asam Stearat ……..……….... 13
Film Edibel ………. 14
METODE PENELITIAN Tempat dan Waktu Penelitian …………..……….. 21
Bahan dan Alat ……..………. 21
Metode Penelitian ….………. 21
Prosedur Analisis ……….……….. 29
HASIL DAN PEMBAHASAN Karakteristik Pati Sagu Ikatan Silang ………….……….………... 38
Karakteristik Film Edibel …..………. 42
Aplikasi Film Edibel ……….………. 51
SIMPULAN DAN SARAN Simpulan ………. 55
Saran ……….……….. 56
DAFTAR PUSTAKA .……….. 57
Halaman 1. Sifat fisiko-kimia pati sagu ……… 5 2. Efek gugus fungsional terhadap permeabilitas O2………... 19
Halaman 1. Struktur kimia pati, (1). amilosa, (2). amilopektin ……… 6 2. Skema model kluster amilopektin dalam matriks granula pati ………….. 8 3. Reaksi pati dan C3H6O dengan katalisator NaOH ……….. 9
4. Mekanisme pelepasan ion Cl dari POCl3 ……….. 12
5. Reaksi fosforilasi antara pati dan POCl3 membentuk senyawa diester …. 12
6. Reaksi fosforilasi antara pati dan POCl3 membentuk senyawa triester …. 12
7. Struktur asam stearat ……….. 14 8. Prosedur pembuatan pati sagu dengan reaksi ikatan silang ………... 23 9. Prosedur pembuatan film edibel ……… 26 10. Mikrostruktur film edibel (P1S1) kombinasi pati sagu dengan
0.04% POCl3 dan 1% asam stearat ……… ……… 50
11. Mikrostruktur film edibel (P2S3) kombinasi pati sagu dengan
0.08% POCl3 dan 3% asam stearat ………... 51
Halaman
1. Bentuk dan sifat birefrinjen granula pati ……….. 64
2. Pola amilograf pati sagu ………. ………….. 65
3. Pengolahan data ketebalan (mm) film edibel tahap 1 ……….. . 67
4. Pengolahan data kuat tarik (N/mm2) film edibel tahap 1 ……….. 68
5. Pengolahan data pemanjangan (%) film edibel tahap 1 ……… 69
6. Pengolahan data transmisi uap air (H2O gr/m2/24 jam) film edibel tahap 1 ………. 70
7. Pengolahan data ketebalan (mm) film edibel tahap 2 ……… 71
8. Pengolahan data kuat tarik (N/mm2) film edibel tahap 2 ……….. 72
9. Pengolahan data pemanjangan (%) film edibel tahap 2 ……… . 73
10. Pengolahan data transmisi uap air (H2O g/m2/24 jam) film edibel tahap 2 ………. 74
11. Pengolahan data transmisi O2 (g/m2/24 jam) film edibel tahap 2 ………. 75
12. Pengolahan data transmisi CO2 (cc/m2/24 jam) film edibel tahap 2 ……. 76
13. Hasil pengamatan penampakan film edibel yang digunakan sebagai pengemas bumbu pada berbagai RH lingkungan pada suhu penyimpanan ± 29 °C………..……….. 77
PENDAHULUAN
Latar Belakang
Pengemasan merupakan suatu cara dalam memberikan kondisi sekeliling yang tepat bagi bahan pangan. Mutu pangan meliputi mutu organoleptik, nutrisi maupun mutu fungsional sangat tergantung pada karakteristik kemasan yang digunakan. Karakteristik kemasan yang utama adalah kemampuan bahan kemasan sebagai penghambat uap air dan gas-gas dari atau ke lingkungan. Bahan kemasan tersebut berasal dari polimer yang tidak menimbulkan migrasi monomernya pada produk yang dikemasnya, dapat dihancurkan serta berasal dari bahan yang mudah diperoleh.
Pada mulanya bahan kemasan berasal dari bahan-bahan yang terdapat di alam seperti daun, batang bambu, tulang dan tanah liat. Dengan perkembangan teknologi, ilmu pengetahuan dan peradaban manusia, telah banyak ditemukan bermacam-macam kemasan buatan, seperti : gelas, plastik, kertas dan kaleng. Masing-masing kemasan tersebut mempunyai keunggulan dan kelemahan, sehingga dapat digunakan sesuai dengan produk yang dikemas. Kemasan buatan mempunyai keunggulan, antara lain : tahan panas, bentuk kemasan dapat dibuat fleksibel, harga relatif rendah serta kemudahan ketersediaan karena didukung industrialisasi yang besar. Akan tetapi kemasan buatan cenderung mempunyai kelemahan yaitu : sukar atau tidak dapat dihancurkan secara alami sehingga memerlukan proses daur ulang yang relatif mahal. Hal ini yang mendorong perkembangan industri pengemasan untuk menghasilkan bahan kemasan baru yang mudah dihancurkan secara alami sehingga bersifat ramah lingkungan dan salah satunya adalah film edibel.
Film edibel belum dapat menggantikan kemasan sintetik secara total. Namun demikian film edibel mempunyai potensi untuk mengurangi penggunaan kemasan sintetik. Selain itu kemasan film edibel mengurangi transmisi uap air, aroma dan lemak dari bahan pangan yang dikemas, merupakan karakteristik yang tidak didapat dari kemasan konvensional.
produk yang dikemas, memberikan zat gizi tambahan, meningkatkan karakteristik sensori dan dapat ditambah zat antimikroba. Film edibel umumnya digunakan sebagai kemasan primer untuk melindungi produk pangan di dalamnya.
Pati sagu merupakan polisakarida yang dapat digunakan dalam pembuatan film edibel. Polisakarida menghasilkan film dengan sifat mekanik yang baik tetapi sangat sensitif terhadap kelembaban dan mempunyai ketahanan yang rendah terhadap uap air. Sebaliknya film dari lemak mempunyai ketahanan yang baik terhadap uap air tetapi umumnya rapuh dan relatif tidak fleksibel (Guilbert et al. 1996). Dengan demikian pembuatan film edibel umumnya menggunakan kombinasi polisakarida dan lemak untuk melengkapi kelebihan dan kekurangan dari masing-masing bahan membentuk film.
Film edibel adalah suatu lapisan tipis yang dibuat dari bahan yang dapat dimakan. Umumnya film edibel digunakan sebagai kemasan primer untuk melindungi produk pangan di dalamnya. Asam stearat merupakan asam lemak rantai panjang dengan jumlah atom karbon (C) sebanyak 18 yang dapat digunakan dalam pembuatan film edibel karena bersifat hidrofobik yang dapat menurunkan laju transmisi uap air (Hernandez 1994). Laju transmisi uap air juga dipengaruhi oleh sifat kimia dan struktur bahan pembentuk film sehingga untuk memperbaiki sifat tersebut dilakukan modifikasi pati dengan ikatan silang (Nisperos-Carriedo 1994).
Ikatan silang pada pati secara kimia dapat memperbaiki sifat mekanik dan permeabilitas film. Fosfor oksiklorida, sodium trimetafosfat, sodium tripolifosfat, epiklorohidrin merupakan pereaksi ikatan silang yang banyak digunakan dalam penelitian untuk memperbaiki sifat pati. (Guner et al. 2001; Nabeshima & Grossmann 2001; Yoneya et al. 2003; Wattanachant et al. 2003).
Tujuan Penelitian
Penelitian ini bertujuan untuk mendapatkan informasi sebagai berikut : 1. Mempelajari pengaruh ikatan silang pada pati sagu dan penambahan asam
stearat terhadap karakteristik film edibel.
2. Menentukan formulasi film edibel dari campuran pati sagu ikatan silang dengan asam stearat.
3. Melakukan uji coba dalam mengaplikasikan film edibel untuk produk pangan.
Hipotesis
TINJAUAN PUSTAKA
Pati Sagu
Pohon sagu merupakan tanaman asli daerah tropis, yang dibagi dalam 9 spesies yaitu : Metroxylon sagus, Metroxylon rumpii, Metroxylon upulense, Metroxylon warbugi, Metroxylon squarosum, Metroxylon solomonensis dan
Metroxylon viriense (Kiew 1977). Di Indonesia spesies sagu yang banyak ditanam
adalah jenis Metroxylon sagus dan Metroxylon rumpii. Metroxylon sagus lebih disukai karena menghasilkan tepung yang lebih putih daripada Metroxylon rumpii (Anwar 1997).
Pati merupakan cadangan makanan yang terdapat di dalam biji, umbi tumbuh-tumbuhan dan empulur. Pati sagu diperoleh dari empulur batang sagu (Metroxylon spp.) dengan cara ekstraksi. Cara mengekstraks pati adalah sebagai berikut : empulur batang sagu diparut kemudian ditambah air dan diremas-remas di atas ayakan sehingga pati dan ampasnya terpisah. Suspensi pati dialirkan ke bak pengendapan dan dibiarkan beberapa saat sehingga pati sagu mengendap. Pati tersebut dikeringkan dengan cara penjemuran. Rendemen pati sagu yang dihasilkan adalah rata-rata 20.2% dengan kisaran antara 15-30%. Jumlah pati yang dihasilkan dari tiap pohon adalah rata-rata 150 kg dengan kisaran antara 90-325 kg (Flach 1983).
atau bereaksi dengan asam amino atau protein sehingga menghasilkan melanin yang berwarna coklat (Gonzales at al. 1995). Karakteristik fisiko-kimia pati sagu dapat dilihat pada Tabel 1.
Tabel 1. Sifat fisiko-kimia pati sagu. Parameter Kisaran Nilai Kadar pati (%)
Kadar amilosa (%) Rasio amilosa : amilopektin
Bentuk granula Ukuran granula (ì m) Suhu gelatinisasi (0C)
50-60 20-30 27 : 73
elips 20-60 60-72 Sumber : Knight (1989)
Sifat amilografi pati sagu (Metroxylon sagus) yang diamati pada konsentrasi 7% dengan Brabender Amilograf menghasilkan suhu gelatinisasi maksimum sebesar 79 °C dan kekentalan maksimum sebesar 750 BU. Pati sagu komersial dari Sarawak yang diamati pola amilografnya pada konsentrasi 6%, mempunyai suhu gelatinisasi yang hampir sama yaitu 70 °C (Takeda et al. 1989). Suhu gelatinisasi pati sagu secara umum berkisar antara 60 – 72 °C (Swinkels 1985). Perbedaan suhu gelatinisasi dan kekentalan kemungkinan disebabkan oleh perbedaan komposisi komponen yang terdapat pada masing-masing pati sagu, terutama struktur dan perbandingan amilosa dan amilopektin. Reologi sagu (Metroxylon sagu) dengan konsentrasi sagu 3.0-5.5 g tepung dalam 100 ml air menunjukkan shear-thinning atau sifat pseudoplastic (Nurul 1999).
Struktur pati
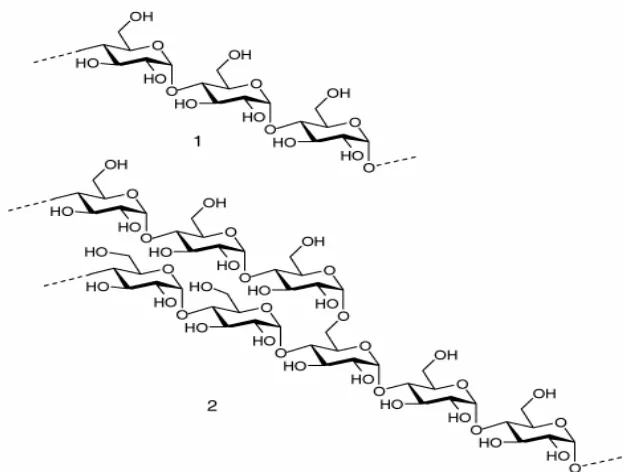
molekul amilosa terdiri atas 200 sampai 20000 unit glukosa yang berbentuk heliks pada ujung antara unit-unit glukosa, sedangkan amilopektin terdiri atas lebih dari 2 juta unit glukosa dan setiap 20 sampai 30 unit glukosa terikat dengan α -1,6 (Gambar 1).
Gambar 1. Struktur kimia pati, (1). amilosa, (2). amilopektin (Petersen et al. 1999).
Amilosa bersifat tidak mudah larut dalam air dingin, tetapi kelarutannya akan meningkat bila dilakukan pemanasan. Amilosa dapat mengalami retrogradasi dalam larutan encer (Flenche 1985). Amilopektin lebih stabil dalam larutan dibandingkan dengan amilosa karena tidak mengalami retrogradasi dan lebih sukar larut dalam air panas. Hal ini disebabkan ukuran amilopektin yang besar serta adanya rantai cabang yang menyebabkan mobilitas molekul menjadi berkurang sehingga mempengaruhi terbentuknya ikatan hidrogen dengan molekul air (Wurzburg 1989). Retrogradasi terjadi apabila antara ikatan hidrogen dan gugus hidroksil molekul amilosa yang berdekatan berikatan dalam larutan.
menunjukkan reaktifitas yang besar untuk berikatan dengan senyawa lain dibandingkan dengan gugus hidroksil pada atom C-6, sedangkan gugus hidroksil pada atom C-3 menunjukkan reaktifitas yang agak lemah (Rutenberg & Solarek 1984). Wurzburg (1989) menyatakan bahwa C-6 merupakan gugus hidroksil primer sedangkan C-2 dan C-3 merupakan gugus hidroksil sekunder.
Sifat birefrinjen
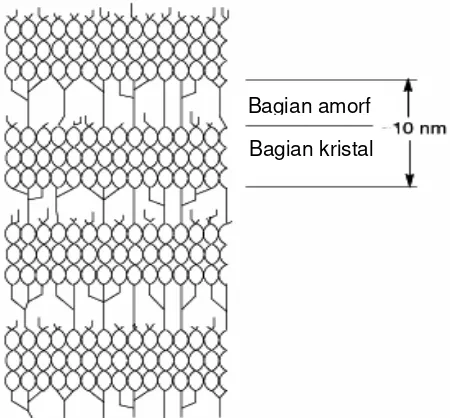
Sifat birefrinjen adalah sifat granula pati yang mampu merefleksikan cahaya terpolarisasi sehingga terlihat kontras gelap terang yang tampak sebagai warna biru-kuning. Sifat ini akan terlihat jika pati diamati di bawah mikroskop polarisasi (Hoseney 1998). Warna biru-kuning pada permukaan granula pati disebabkan adanya perbedaan indeks refraksi dalam granula pati. Indeks refraksi dipengaruhi oleh struktur amilosa dalam granula pati. Bentuk heliks dari amilosa dapat menyerap sebagian cahaya yang melewati granula pati. Jika arah getar dari gelombang cahaya paralel terhadap sumbu heliks amilosa, terjadi penyerapan cahaya secara intensif. Intensitas birefrinjen sangat tergantung pada derajat dan orientasi kristal (French 1984).
Lebih lanjut French (1984) menyatakan bahwa komponen yang bertanggung jawab terhadap sifat kristal adalah sepasang rantai amilopektin yang membentuk double heliks dengan derajat polimerisasi 15, sedangkan komponen yang bertanggung jawab terhadap sifat amorf granula pati adalah di daerah dengan ikatan α (1-6) dari amilopektin.
teratur dinyatakan sebagai daerah amorf. Gambar 2 menunjukkan daerah kristal dan amorf pada amilopektin.
Gambar 2. Skema model kluster amilopektin dalam matrik granula pati Biliaderis (1992) menyatakan bahwa sifat kristal pati berasal dari rantai cabang amilopektin yang berukuran pendek, sebesar : 14-20 unit glukosa dari ikatan α 1-6 dengan penjang 50-70 A°. Fase amorf terdiri dari amilosa dan senyawa yang terdapat diantara kristal, seperti senyawa kompleks fosfolipid-amilosa dan fosfolipid.
Sifat kristal pati dapat hilang apabila granula mengalami kerusakan. Hal ini disebabkan amilopektin dengan rantai pendek dan ukuran tertentu yang seharusnya tersusun secara teratur dalam granula menjadi tidak teratur (Billiaderis 1992). Menurut Lii et al. (1995) umumnya setiap jenis pati yang sudah terdegradasi, karena pemanasan atau oleh hidrolisis enzimatis, akan kehilangan sifat birefrinjen dan sifat kristal pati.
Fennema (1985) mengemukakan bahwa hilangnya sifat birefrinjen pati disebabkan pecahnya ikatan molekul pati sehingga ikatan hidrogen dapat mengikat lebih banyak molekul air. Penetrasi air menyebabkan peningkatan derajat ketidakteraturan dan molekul pati yang terpisah serta penurunan keberadaan sifat kristal, sehingga jika pemanasan dilanjutkan maka sifat kristal dan sifat birefrinjen akan hilang. Sifat birefrinjen pati dapat hilang dengan
Bagian amorf
pemanasan di atas suhu gelatinisasi pati. Adanya ikatan silang dalam molekul pati menurut Wurzburg (1989) akan memperkuat ikatan hidrogen dalam molekul pati, sehingga meminimalkan kerusakan granula pati dan menyebabkan pati tetap utuh.
Modifikasi Pati
Pati modifikasi adalah pati yang telah diubah sifat aslinya, yaitu sifat kimia dan/atau fisiknya sehingga mempunyai karakteristik yang sesuai dengan yang dikehendaki. Sifat-sifat yang diubah umumnya adalah karakteristik gelatinisasi, hubungan padatan dan kekentalan, kemampuan membentuk gel, kekuatan menahan air dispersi pati pada suhu rendah, sifat hidrofilik, ketahanan dispersi terhadap penurunan kekentalan oleh asam dan perusakan secara fisik serta memasukkan sifat ionisasi pati asal (Wurzburg 1989).
Modifikasi pati dapat dilakukan dengan mengubah struktur kimia pati secara fisik, kimia atau enzimatis. Modifikasi pati secara kimia meliputi esterifikasi, eterifikasi, hidrolisis, oksidasi dan ikatan silang (Fleche 1985).
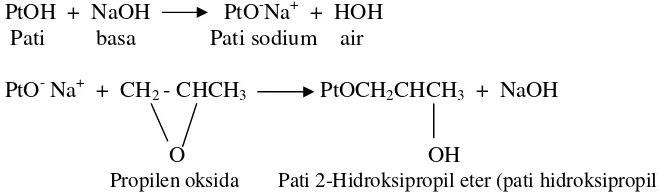
Hidroksipropilasi
Hidroksipropilasi merupakan modifikasi pati dengan propilen oksida (C3H6O) menghasilkan pati hidroksipropil yang digunakan untuk industri
makanan. Modifikasi ini meningkatkan stabilitas selama penyimpanan dingin, kejernihan dan tekstur pasta pati (Wurzburg 1989). Gambar 3 menunjukkan mekanisme reaksi pati dan C3H6O menggunakan katalisator NaOH.
PtOH + NaOH PtO-Na+ + HOH Pati basa Pati sodium air
PtO- Na+ + CH2 - CHCH3 PtOCH2CHCH3 + NaOH
O OH
Propilen oksida Pati 2-Hidroksipropil eter (pati hidroksipropil)
Gambar 3. Reaksi pati dan C3H6O dengan katalisator NaOH (Wurzburg 1989)
Wattanachant et al. (2003) reaksi hidroksipropilasi akan melemahkan ikatan antar molekul pati sehingga pereaksi ikatan silang dapat lebih banyak bereaksi dengan molekul pati. Wang dan Wang (2000) menyatakan bahwa struktur granula pati akan terbuka dengan penambahan gugus hidroksipropil sehingga pereaksi ikatan silang dapat masuk ke bagian dalam daerah amorf pada granula pati.
Pati hidroksipropil komersial yang khusus untuk industri makanan terdiri dari 1 gugus hidroksipropil dalam 10 unit glukosa (Wurzburg 1989). Pati hidroksipropil menggunakan pereaksi C3H6O 10-12% kemudian dilanjutkan
dengan reaksi ikatan silang menggunakan campuran sodium trimetafosfat (STMP) 2% dan sodium tripolifosfat (STPP) 5% menghasilkan pati modifikasi dengan sifat yang diinginkan, yaitu: tahan terhadap asam, kestabilan tinggi saat freeze-thaw dan meningkatkan tekstur gel (Wattanachant et al. 2003).
Ikatan silang
Pati hasil reaksi ikatan silang digunakan secara luas sebagai pengental dalam makanan terutama yang memerlukan kekentalan yang tinggi dan stabil. Ikatan silang pada pati dapat meminimalkan kerusakan granula selama pemasakan (Woo & Seib 1997). Menurut Wurzburg (1989) reaksi ikatan silang pada pati dapat meningkatkan sifat hidrofobik pati, stabilitas kekentalan dan ketahanan pati pada suhu dan gaya gesekan yang tinggi.
Ikatan silang terjadi dengan cara mereaksikan pati dengan pereaksi multifungsional. Pereaksi multifungsional adalah suatu komponen yang dapat bereaksi dengan dua atau lebih gugus fungsional dari molekul yang berbeda, seperti gugus hidroksil dari dua atau lebih unit glukosa molekul pati, atau dengan pati jenis lain seperti antar molekul pati bahkan dengan komponen lain yang berbeda, seperti antara pati dengan komponen hidrokoloid lain misalnya selulosa. Ikatan silang yang terbentuk pada senyawa karbohidrat dengan pereaksi multifungsional umumnya merupakan ikatan ester yang menjembatani atau menghubungkan dua gugus hidroksil atau lebih unit glukosa molekul pati (Wurzburg 1989).
anorganik, fosfor oksiklorida, sodium trimetafosfat, sodium tripolifosfat, sodium ortofosfat, aldehid, epoksi, etilen dan lain-lainnya (Davidek et al. 1990; Wurzburg 1989). Faktor-faktor yang mempengaruhi jumlah pereaksi ikatan silang yang akan memberikan sifat pati modifikasi yang diinginkan adalah jenis pati yang digunakan, jenis pereaksi ikatan silang, efisiensi reaksi yang dihasilkan dari pereaksi ikatan silang, level substitusi hidroksipropil eter dalam pati dan sifat spesifik pati modifikasi yang diinginkan sebagai produk akhir (Wattanachat et al. 2003).
Menurut Wurzburg (1989) reaksi ikatan silang pati menggunakan fosfor oksiklorida (POCl3) akan menghasilkan ikatan silang diesterfosfat. Rutenberg dan
Solarek (1984) mengatakan jenis ikatan silang yang terbentuk dipengaruhi oleh pH. Pada pH antara 8–12 terjadi pembentukan senyawa berikatan silang atau senyawa diesterfosfat yang lebih dominan sedangkan pada pH di bawah 6 terjadi
pembentukan monoesterfosfat. POCl3 adalah pereaksi yang sangat reaktif
sehingga menghasilkan reaksi dengan sangat cepat. Kondisi reaksi pembentukan
ikatan silang antara pati dengan POCl3 berlangsung pada suhu 20–50 °C dengan
pH reaksi antara 8–12.
Reaksi ikatan silang dapat memperkuat ikatan hidrogen dalam granula pati
melalui ikatan silang kimia yang berfungsi sebagai jembatan antar molekul pati.
Dengan demikian apabila pati yang mempunyai ikatan silang dipanaskan dalam
air, maka ikatan alami pati yaitu ikatan hidrogen akan melemah atau hancur tetapi
granula pati akan tetap utuh dengan berbagai derajat keutuhan disebabkan adanya
jembatan kimia. Hampir semua pati hasil reaksi ikatan silang terdiri kira-kira 1
ikatan silang untuk setiap 100 sampai 3000 unit glukosa (Wurzburg 1989).
Fosfor oksiklorida
Fosfor oksiklorida (POCl3) adalah suatu fosfor dengan golongan
halogenida (Cl). Di Amerika Serikat, POCl3, natrium trimetafosfat dan natrium
tripolifosfat digunakan untuk modifikasi pati dalam makanan sesuai dengan
persyaratan Code of Federal Regulations (CFR) 1991 dengan konsentrasi P
digunakan dalam reaksi ikatan silang pati untuk meningkatkan ketahanan terhadap suhu tinggi, pH rendah dan gaya gesekan yang tinggi (Wurzburg 1989).
Rutenberg dan Solarek (1984) mengemukakan bahwa reaksi ikatan silang menggunakan POCl3 sebagai pereaksi akan membentuk senyawa diesterfosfat
dengan molekul pati secara acak. Pendapat lain, menurut Wong (1984) bahwa satu molekul POCl3 dapat membentuk ikatan triester dengan tiga molekul pati.
Mekanisme pelepasan ion Cl dari POCl3 dapat dilihat pada Gambar 4 dan reaksi
ikatan silang pati dengan POCl3 menghasilkan ikatan diester dan triester dapat
dilihat masing-masing pada Gambar 5 dan 6. Karena derajat ikatan silang pada pati rendah maka secara kuantitatif sukar ditentukan dengan metode kimia.
O O O O H2O H2O H2O
Cl – P – Cl Cl – P – O O – P – O O – P - O HCl + H+ HCl + H+ HCl + H+ Cl Cl Cl O
Fosfor oksiklorida antara (1) antara (2) ion fosfat
Gambar 4. Mekanisme pelepasan ion Cl dari POCl3 (Matheis 1991)
O O
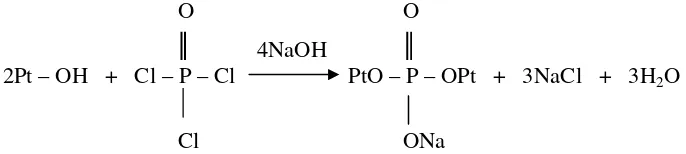
4NaOH
2Pt – OH + Cl – P – Cl PtO – P – OPt + 3NaCl + 3H2O
Cl ONa
Gambar 5. Reaksi fosforilasi antara pati dan POCl3 membentuk senyawa diester
(Rutenberg & Solarek 1984)
O O 3NaOH
3Pt – OH + Cl – P – Cl PtO – P – OPt + 3NaCl + 3H2O
Cl OPt
Gambar 6. Reaksi fosforilasi antara pati dan POCl3 membentuk senyawa triester
Pati umumnya mengandung sejumlah kecil fosfat (P). Pati yang berasal dari biji-bijian mengandung P antara 0.2–0.6% dari berat kering dalam bentuk monoesterfosfat dan fosfolipid, sedangkan pati yang berasal dari akar dan rimpang
umumnya mengandung P dalam bentuk monoesterfosfat (Lim et al. 1994). Pati
kentang mengandung 0.07–0.09% fosfat yang terikat kovalen pada amilopektin
dalam bentuk monoester. Sebesar 60-70% dari total fosfat terikat pada C-6,
sedangkan sisanya terikat pada C-3 dari unit glukosa (Wurzburg 1989).
Kandungan fosfat pada pati sagu dilaporkan oleh Muhammand (2000) sebesar ±
0.009%.
Asam Stearat
Penambahan lemak dalam pembuatan film edibel umumnya bertujuan
untuk menurunkan transmisi uap air film yang terbentuk. Banyak peneliti
menggunakan asam palmitat, asam laurat, asam oktanoat, asam oleat dan asam
stearat (Ayranci & Tunc 2001; Paramawati 2001; Lucia 2000) tristearin, stearil
alkohol, beewax (Fennema et al. 1994; Harris 1999) dalam pembuatan film
edibel.
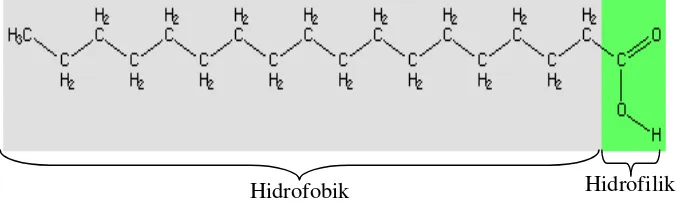
Asam stearat dikenal dengan nama octadecanoic acid merupakan asam
lemak jenuh dengan jumlah rantai karbon (C) sebanyak 18 buah, mempunyai titik
leleh (melting point) pada suhu 70.1 °C dan titik didih (boiling point) pada suhu
184 °C, dengan rumus molekul C18H36O2 dan berat molekul 284 (Gunstone &
Norris, 1983). Hagenmaier dan Shaw (1990) berpendapat bahwa pada pembuatan
film edibel umumnya ditambahkan asam stearat karena asam stearat mempunyai
titik leleh (melting point) yang tinggi dan bersifat hidrofobik.
Asam stearat merupakan asam lemak rantai panjang yang terdiri dari rantai
hidrokarbon dengan gugus karboksil diujung struktur molekulnya. Struktur
hidrokarbon molekul asam stearat yang panjang terdiri dari karbon dan hidrogen
yang bersifat nonpolar tidak berikatan dengan air, sehingga bersifat hidrofobik.
Sedangkan gugus karboksil bersifat polar yang dapat membentuk ikatan hidrogen
dengan air, sehingga mampu mengikat air dengan kuat bersifat hidrofilik. Apabila
asam stearat dilarutkan dalam air, maka bagian molekul yang bersifat hidrofilik
dengan bagian hidrofilik dalam air dan rantai hidrofobik berada diatas permukaan air. Struktur molekul asam stearat seperti pada Gambar 7.
Gambar 7. Struktur asam stearat (Fennema et al. 1994)
Adanya gugus hidrofobik pada asam stearat menurunkan nilai transmisi uap air film. Semakin panjang struktur rantai hidrokarbon asam lemak maka semakin meningkat sifat hidrofobik asam lemak. Selanjutnya mobilitas rantai asam lemak juga membantu terjadinya transmisi uap air film, penurunan transmisi uap air terjadi apabila mobilitas rantai menurun. Asam stearat mempunyai rantai hidrokarbon yang paling panjang (C18) sehingga mempunyai sifat yang paling hidrofobik dan mempunyai mobilitas rantai yang paling rendah dibandingkan dengan asam laurat (C12) dan asam palmitat (C16). Dengan demikian penambahan asam stearat dalam pembuatan film edibel akan menghasilkan nilai transmisi uap air yang paling rendah dibandingkan dengan asam laurat dan asam palmitat (Ayranci & Tunc 2001).
Film Edibel
Film edibel adalah suatu lapisan tipis yang dibuat dari bahan yang dapat dimakan, dibentuk untuk melapisi makanan (coating) atau diletakkan di antara komponen makanan (film) yang berfungsi sebagai penghalang terhadap perpindahan massa, misalnya kelembaban, oksigen, cahaya, lipid, zat terlarut dan atau sebagai pembawa aditif serta untuk meningkatkan penanganan suatu makanan (Krochta 1992). Menurut Krochta dan De Mulder-Johnston (1997) penggunaan lapisan edibel pada produk pangan dapat tetap menjaga mutu bahan pangan setelah kemasan dibuka karena terdapat lapisan yang berfungsi melindungi terhadap perubahan kelembaban, oksigen dan kehilangan aroma. Film
edibel yang diletakkan diantara komponen makanan juga dapat meningkatkan mutu makanan yang terdiri atas beberapa lapis komponen seperti pada pizza.
Film edibel merupakan lapisan tipis dan kontinyu yang dapat langsung dimakan dan penggunaannya pada makanan dengan cara pembungkusan. Menurut Baldwin et al. (1995) film edibel merupakan lapisan primer. Dengan komposisi yang tepat akan dapat berfungsi sebagai barrier yang baik terhadap O2, CO2 dan
uap air, sehingga jika diaplikasikan dapat melindungi produk dari kerusakan sehingga dapat memperpanjang umur simpan. Secara teoritis menurut Dominic et al. (1994) film edibel dapat menjadi penahan kehilangan air yang efisien,
mempunyai sifat permeabel terhadap keluar masuknya gas, mengendalikan perpindahan dari air ke larutan untuk mempertahankan warna pigmen alami dan nutrisi serta membawa zat tambahan yang diperlukan. Fungsi yang lain yaitu dapat membantu mempertahankan integritas struktural dan mencegah hilangnya senyawa-senyawa volatil penyebab aroma khas pada bahan pangan tertentu (Nisperos-Carriedo et al. 1994).
Ada tiga komponen penyusun film edibel, yaitu: hidrokoloid, lemak dan komposit. Hidrokoloid banyak diperoleh dari polimer polisakarida, protein atau turunan dari keduanya. Polisakarida dan turunannya antara lain adalah pati, alginat, pektin, gum arabik serta turunan atau modifikasinya. Sementara hidrokoloid berbasis protein antara lain adalah gelatin, casein, protein kedelai, whey, gluten gandum dan zein jagung (Krochta et al. 1994). Kelompok lemak yang sering digunakan adalah lilin asilgliserol dan asam lemak. Komposit adalah bahan yang didasarkan pada campuran hidrokoloid dan lemak (Danhowe & Fennema 1994).
Bahan dasar pembentuk film edibel sangat mempengaruhi sifat-sifat film edibel itu sendiri. Film edibel yang berasal dari hidrokoloid mempunyai ketahanan yang baik terhadap gas O2 dan CO2, meningkatkan kekuatan fisik namun
dan lemak agar diperoleh pengaruh yang lebih baik dari sifat-sifat pengemas yang dihasilkan. (Krochta et al. 1994).
Teknik pembuatan film edibel komposit ditentukan dari sifat bahan karbohidrat yang polar dan lemak yang bersifat non-polar sehingga didapatkan larutan yang homogen. Larutan film yang homogen akan menghasilkan film edibel dengan lemak yang terdispersi sempurna. Menurut Martin-Polo et al. (1992) kemampuan gugus hidrofobik pada senyawa lemak agar dapat memperlambat perpindahan uap air tergantung pada homogenitas larutan dan keseragaman distribusi substansi hidrofobik pada permukaan atau di dalam susunan coating.
Menurut Krochta et al. (1994) film edibel dari polisakarida dapat mencegah reaksi-reaksi yang menyebabkan kerusakan pada produk pangan, dengan jalan menghambat gas-gas reaktif, terutama O2 dan CO2, tahan terhadap
lemak karena sifatnya yang polar. Sebagian dari film edibel yang dibuat dari bahan hidrokoloid bahkan dapat dilarutkan sehingga dapat diterapkan pada produk-produk yang memerlukan perebusan/pengukusan sebelum digunakan.
Karboksimetilselulosa
Karboksilmetilselulosa (CMC) banyak digunakan sebagai bahan penstabil pada makanan. CMC bersifat larut dalam air panas maupun air dingin tetapi tidak larut dalam pelarut organic. CMC masih dapat larut dalam campuran air dan pelarut yang larut air seperti etanol dan aseton (Nisperos-Carriedo 1994).
CMC mempunyai gugus karboksil sehingga kekentalan larutan CMC dipengaruhi oleh pH larutan, pH optimum CMC adalah 5 dan pada pH <3 CMC akan mengendap. CMC banyak dipakai dalam industri makanan untuk mendapatkan tekstur yang baik dan untuk mencegah retrogradasi (Winarno 1992). CMC yang banyak dipakai pada industri makanan adalah garam Na karboksimetilselulosa yang dalam bentuk murninya disebut gum selulosa. Pembuatan CMC adalah dengan cara mereaksikan NaOH dengan selulosa murni kemudian ditambahkan Na kloroasetat (Winarno 1992).
ROH + NaOH R-ONa + HOH
Gliserol
Penambahan plastisizer penting dalam pembuatan biopolimer film karena plastisizer sangat berpengaruh terhadap sifat fisikokimia film. Tujuan utama penambahan plastisizer adalah untuk meningkatkan fleksibilitas dan menurunkan kerapuhan film. Guilbert (1986) menyatakan bahwa penambahan plastisizer mempunyai peranan penting untuk menurunkan gaya intermolekul sepanjang rantai polimer yang akan memperbaiki fleksibilitas dan juga memudahkan film untuk diangkat dari kaca. Plastisizer yang umumnya digunakan dalam pembuatan film edibel adalah gliserol, polietilen glikol 400 (PEG), sorbitol, propilen glikol dan etilen glikol (EG).
Gliserol merupakan senyawa alkohol polihidrat dengan tiga buah gugus hidroksil dalam satu molekul yang umumnya disebut alkohol trivalen. Rumus kimia gliserol adalah C3H8O3 dengan nama kimia 1,2,3-propanatriol. Berat
molekul gliserol adalah 92.10 dan titik didih 204 °C (Winarno 1992). Gliserol mempunyai sifat mudah larut dalam air, meningkatkan kekentalan larutan, mengikat air dan menurunkan aW (Lindsay 1985).
Gliserol efektif digunakan sebagai plastisizer pada hidrofilik film seperti pektin, gelatin, pati dan modifikasi pati, maupun pada pembuatan film edibel berbasis protein. Penambahan gliserol akan menghasilkan film yang lebih fleksibel dan halus. Menurut Gontard et al. (1993) gliserol dapat meningkatkan permeabilitas film terhadap uap air karena sifat gliserol yang hidrofilik. Adanya gugus polar (-OH) pada rantai plastisizer diyakini menghasilkan ikatan hidrogen polimer-plastisizer menggantikan interaksi polimer-polimer dalam biopolimer film (Gennadios et al. 1993), dimana gugus polar dapat mengabsorpsi dan mengikat air. Ukuran molekul, susunan dan jumlah bilangan fungsional gugus hidroksil dari plastisizer dan juga kesesuaian plastisizer dengan polimer dapat berpengaruh terhadap interaksi polimer dan plastisizer.
pada molekul gliserol menyebabkan mudah mengadsorpsi molekul air yang berperan dalam peningkatan transmisi uap air film (Lieberman & Gilbert, 1973).
Plastisizer larut dalam tiap-tiap rantai polimer sehingga akan mempermudah gerakan molekul polimer dan bekerja menurunkan suhu transisi gelas, suhu kristalisasi atau suhu pelelehan dari polimer (Sperling 1992). Plastisizer mampu mengurangi kerapuhan dan meningkatkan fleksibilitas film polimer dengan cara mengganggu ikatan hidrogen antara molekul polimer yang berdekatan sehingga kekuatan tarik-menarik intermolekuler di antara rantai polimer menjadi berkurang (Kester & Fennema, 1986).
Sifat mekanik serta sifat transmisi uap air dan gas film edibel
Sifat mekanik film edibel dinyatakan sebagai kuat tarik dan persen pemanjangan. Kuat tarik (tensile strength) adalah gaya tarik maksimum yang dapat ditahan oleh film sebelum film terputus. Hasil pengukuran kuat tarik berhubungan erat dengan plastisizer yang ditambahkan pada proses pembuatan film. Makin tinggi konsentrasi plastisizer maka makin kecil gaya stress yang dihasilkan sehingga semakin menurun nilai kuat tarik film (Harris 1999).
Persen pemanjangan (elongation) adalah perubahan panjang maksimum pada saat terjadi peregangan hingga film terputus. Pada umumnya makin tinggi konsentrasi plastisizer yang ditambahkan maka nilai persen pemanjangan suatu film meningkat lebih besar pula. Parris et al. 1995 melaporkan bahwa penambahan plastisizer kurang dari 10% tidak berpengaruh nyata pada peningkatan fleksibilitas film, namun penambahan plastisizer lebih dari 25% akan menyebabkan film yang terbentuk cenderung lengket.
disebabkan polimer dengan polaritas tinggi mempunyai ikatan hidrogen yang besar. Sebaliknya polimer kimia yang bersifat non polar seperti lipida mempunyai nilai permeabilitas terhadap uap air rendah, namun permeabilitas terhadap oksigen tinggi, sehingga menjadi penahan air yang baik tetapi tidak efektif dalam menahan gas (Callegarin et al. 1997).
Permeabilitas O2 dan CO2 didefinisikan sebagai laju transmisi O2 dan CO2
melalui suatu unit luasan dari material yang permukaannya rata dan datar sebagai akibat perbedaan tekanan udara pada kedua sisi permukaan film. Menurut Krochta et al. (1994), sifat permeabilitas O2 film berhubungan dengan kelembaban udara
dimana film edibel dari bahan baku protein mempunyai ketahanan terhadap gas O2 yang baik pada kondisi RH yang rendah, akan tetapi jika RH naik maka
permeabilitas O2 juga meningkat. Film edibel dari polisakarida dapat menahan O2
dengan baik pada RH rendah sedangkan dengan bahan baku lemak menunjukkan permeabilitas terhadap O2 yang sangat tinggi. Tabel 2. menunjukkan bahwa gugus
fungsional stuktur polimer (CH2-CHX)n berpengaruh pada permeabilitas O2.
Tabel 2. Efek gugus fungsional terhadap pemeabilitas O2.
Gugus X dalam (CH2-CHX)n Permeabilitas O2 a
Nilai relatif permeabilitas O2 dalam unit cm3. mil/d.100in2.atm
Sumber : McHugh dan Krochta (1994)
METODOLOGI PENELITIAN
Tempat dan Waktu Penelitian
Penelitian dilaksanakan di Laboratorium Kimia Pangan, Laboratorium Pengolahan Pangan, Departemen Teknologi Pertanian, FATETA-IPB, Laboratorium Rekayasa Proses Pangan, Kimia Pangan PAU-IPB, Laboratorium Pengemasan Balai Besar Industri Kimia, Pasar Rebo-Jakarta, Laboratorium PPMB, Jakarta. Penelitian berlangsung dari bulan Februari sampai dengan November 2004.
Bahan dan Alat
Bahan-bahan yang digunakan dalam penelitian ini meliputi : pati sagu, asam stearat, gliserol, CMC, C3H6O, POCl3, 5% NaOH, 10% HCl, ammonium
molibdat, ammonium vanadat, KH2PO4, AgNO3.
Peralatan yang digunakan adalah pelat kaca berukuran 30 cm x 20 cm x 5 mm, bingkai kaca dengan ukuran 30 cm x 2.5 cm x 3 mm, pH meter, mikrometer, tension testing Instron, gas transmission rate tester speedivac 2, water
transmission rate tester Bergerlahr metode cawan, mikroskop polarisasi, oven
berventilasi, termostat hot plate, timbangan digital, termometer, aluminium foil, plastik mika, plastik berkelium, pisau, alat-alat gelas dan stop watch.
Metode Penelitian
Kegiatan penelitian pembuatan film edibel terdiri atas 3 tahapan, yaitu : Proses reaksi ikatan silang pati sagu
Tahap ini bertujuan untuk mengetahui pengaruh penambahan POCl3
terhadap sifat pati sagu dan juga pengaruh pati sagu ikatan silang terhadap karakteristik film edibel.
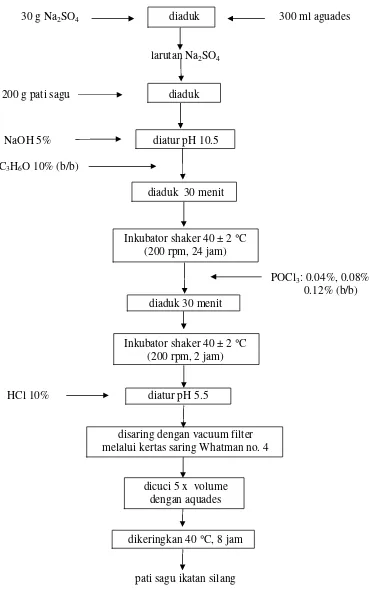
Perlakuan dalam penelitian ini adalah konsentrasi pereaksi ikatan silang (POCl3), yaitu : 0.04%, 0.08%, 0.12% (b/b). Reaksi ikatan silang pada pati sagu
dibuat sesuai prosedur dari Wattanachant et al. (2003). Na2SO4 sebanyak 30 gram
diaduk dengan magnetic stirrer skala 3, setelah larut sempurna ditambahkan pati sagu sebanyak 200 gram sambil tetap diaduk. Sebanyak 5% NaOH ditambahkan sambil diaduk dengan kuat pada skala 8, untuk mencegah pati tergelatinisasi dan untuk mengatur pH larutan sebesar 10.5 kemudian ditambahkan 10% C3H6O dan
diaduk 30 menit pada suhu ruang. Larutan diinkubasi dengan inkubator shaker pada suhu 40 ± 2 °C (200 rpm, 24 jam).
POCl3 sebagai perlakuan sebesar : 0.04%, 0.08%, 0.12% (b/b)
ditambahkan sambil diaduk menggunakan magnetic stirrer skala 8, selama 30 menit kemudian diinkubasi pada suhu 40 ± 2 °C (200 rpm, 2 jam). Keasaman larutan diatur pada pH 5.5 dengan 10% larutan HCl yang bertujuan untuk menghentikan reaksi. Pati disaring menggunakan vakum filter melalui kertas saring Whatman no.4 sambil dicuci dengan aquades sebanyak 5 kali volume. Pengeringan pati dilakukan pada suhu 40 °C selama 8 jam sehingga didapatkan kadar air 10-12%. Gambar 8 menjelaskan prosedur pembuatan pati sagu dengan reaksi ikatan silang.
30 g Na2SO4 diaduk 300 ml aguades
larutan Na2SO4
200 g pati sagu diaduk
NaOH 5% diatur pH 10.5
C3H6O 10% (b/b)
diaduk 30 menit
Inkubator shaker 40 ± 2 °C (200 rpm, 24 jam)
POCl3: 0.04%, 0.08%,
0.12% (b/b) diaduk 30 menit
Inkubator shaker 40 ± 2 °C (200 rpm, 2 jam)
HCl 10% diatur pH 5.5
disaring dengan vacuum filter melalui kertas saring Whatman no. 4
dicuci 5 x volume dengan aquades
dikeringkan 40 °C, 8 jam
pati sagu ikatan silang
Pembuatan film edibel
Pra pembuatan film edibel. Dalam pembuatan film edibel dilakukan penelitian pendahuluan untuk mendapatkan prinsip pembuatan, formulasi dan kondisi pembuatan film edibel yang tepat. Film edibel dibuat berdasarkan prosedur pembuatan film edibel oleh Harris (1999). Pengamatan dilakukan secara visual yaitu: dengan melihat tampilan film, kemudahan dikelupas dan waktu yang diperlukan untuk mengeringkan film edibel. Variabel perlakuan seperti pada Tabel 3.
Tabel 3. Perlakuan dalam penentuan cara dan kondisi pembuatan film. Perlakuan
Variabel Perlakuan
1 2 3
Persentasi pati sagu atau pati sagu
dengan ikatan silang % (b/v) 10 8.3 6.6 Suhu pengeringan (°C) 50, 60, 70
Gliserol % (b/v) 25, 30, 35
CMC % (b/b) 5, 10
Berdasarkan hasil pengamatan penelitian pendahuluan secara visual, pembuatan film edibel selanjutnya menggunakan perlakuan sebagai berikut: (1). persentasi pati sebesar 6.6% (b/v), (2). pengeringan dengan oven pada suhu 70 °C selama 6-7 jam, (3). penambahan gliserol 25%, (4). penambahan CMC 10%.
Setelah mendapatkan formulasi pembuatan film edibel yang sesuai maka film edibel yang dihasilkan dianalisa dengan parameter sebagai berikut : (1). ketebalan metode microcal messmer (ASTM 1983), (2). kuat tarik (ASTM 1983), (3). persen pemanjangan (ASTM 1983), (4). transmisi uap air, metode cawan (ASTM 1983).
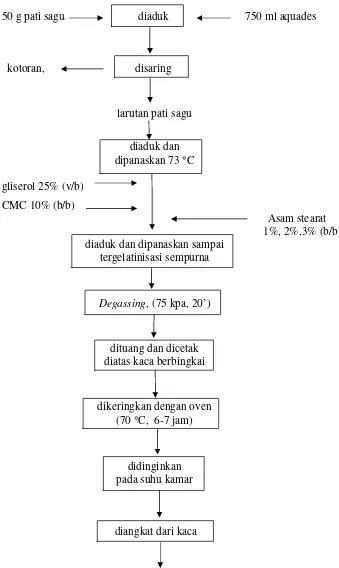
Pembuatan film edibel utama. Tahap ini bertujuan untuk mengetahui pengaruh pati sagu yang mempunyai ikatan silang dan penambahan asam stearat serta menentukan kombinasi konsentrasi yang sesuai yang akan menghasilkan film edibel dengan karakteristik terbaik. Perlakuan dalam penelitian adalah pati sagu dengan penambahan POCl3: 0%, 0.04%, 0.08%, 0.12% (b/b) dan asam
50 g pati sagu diaduk 750 ml aquades
kotoran, disaring
larutan pati sagu
diaduk dan dipanaskan 73 °C gliserol 25% (v/b)
CMC 10% (b/b) Asam stearat
1%, 2%,3% (b/b) diaduk dan dipanaskan sampai
tergelatinisasi sempurna
Degassing, (75 kpa, 20’)
dituang dan dicetak diatas kaca berbingkai
dikeringkan dengan oven (70 °C, 6-7 jam)
didinginkan pada suhu kamar
diangkat dari kaca
film edibel
Parameter yang diamati adalah : (1). ketebalan, metode microcal messmer (ASTM 1983), (2). kuat tarik (ASTM 1983), (3). persen pemanjangan (ASTM 1983), (4). transmisi uap air, metode cawan (ASTM 1983), (5). transmisi terhadap O2, metode monometer (ASTM 1983), (6). transmisi terhadap CO2, metode
monometer (ASTM 1983).
Berdasarkan parameter diatas maka akan didapatkan film edibel dengan karakteristik terbaik. Dua jenis film edibel dengan karakteristik terbaik akan dilakukan pengujian sebagai berikut : (1). uji kelarutan film dalam air (Ryu et al. 2002), (2). analisa mikrostruktur dengan Scaning Electron Microscopy(SEM).
Aplikasi film edibel
Tahap ketiga adalah aplikasi film edibel yang memiliki karakteristik terbaik untuk mengemas bumbu instan. Parameter yang diamati adalah ketahanan film edibel pada 5 kondisi RH lingkungan, yaitu : 65%, 58%, 43%, 33% dan 11% yang disimpan dalam ruangan pada suhu ± 29 °C dengan RH 70 ± 2%.
Rancangan percobaan
Rancangan penelitian untuk tahap pertama menggunakan rancangan acak lengkap faktor tunggal yang diulang 5 kali dengan 4 taraf perlakuan, yaitu reaksi ikatan silang pati sagu dengan penambahan POCl3: 0%, 0.04%, 0.08%, 0.12%.
Rancangan ini digunakan untuk uji statistik terhadap analisis ketebalan, kuat tarik, persen pemanjangan, transmisi uap air. Model rancangan percobaan yang digunakan :
Y ij = ì + τ i + å ij
dimana,
Y ij = pengamatan pada perlakuan ke-i dan ulangan ke-j
ì = nilai tengah umum τ i = pengaruh perlakuan ke-i
å ij = pengaruh galat pada perlakuan ke-i ulangan ke-j i = banyaknya perlakuan
Pada penelitian tahap kedua digunakan rancangan acak lengkap faktorial dengan 2 faktor perlakuan yang diulang 3 kali. Perlakuan yang akan diterapkan berturut-turut adalah reaksi ikatan silang pati sagu dengan penambahan POCl3:
0%, 0.04%, 0.08%, 0.12% (b/b) dan konsentrasi asam stearat : 1%, 2%, 3% (b/b). Rancangan ini digunakan untuk uji statistik terhadap analisis ketebalan, kuat tarik, persen pemanjangan, transmisi uap air, transmisi terhadap O2, transmisi terhadap
CO2. Model rancangan percobaan yang digunakan sebagai berikut :
Y ijk = ì + á i + â j + (á â) ij + å ijk
dimana :
Y ijk = pengamatan pada factor A taraf ke-i factor B taraf ke-j dan
ulangan ke-k ì = nilai tengah umum á = pengaruh utama faktor A â = pengaruh utama faktor B
(á â) = komponen interaksi dari faktor A dan faktor B
å ijk = pengaruh galat ke- j yang memperoleh perlakuan ke- i i = banyaknya perlakuan faktor A
j = banyaknya perlakuan faktor B k = ulangan
Prosedur Analisis
Bentuk granula pati
Bentuk granula dapat dilihat di bawah mikroskop yaitu : mikroskop polarisasi cahaya dan mikroskop cahaya (Olympus model BHB, Nippon Kogaku, Jepang) yang dilengkapi dengan kamera (Olympus model C-35A), dengan cara sebagai berikut :
Untuk pengamatan di bawah mikroskop polarisasi cahaya, suspensi pati disiapkan dengan mencampur butir pati dengan air destilasi kemudian ditambahkan larutan Iod untuk menambah daya kontras. Suspensi ini diteteskan di atas gelas obyek dan kemudian ditutup dengan gelas penutup. Objek diuji dengan meneruskan cahaya melalui alat polarisator dan selama pengamatan alat analisator diputar sehingga cahaya terpolarisasi sempurna yang ditunjukkan oleh butir-butir pati yang belum mengalami gelatinisasi dengan sifat birefrinjen. Bila pengamatan dilakukan tanpa menggunakan polarisator dan alat penganalisa (analisator) maka disebut mikroskop cahaya. Gambar akan dipotret menggunakan film berwarna (Fuji Film ASA 100, 35, Japan).
Pola amilograf
Penetapan fosfor, metode molibdat-vanadat (Apriyantono et al. 1989)
(1). Persiapan bahan pereaksi
Pereaksi vanadat-molibdat dibuat dengan cara : 20 g amonium molibdat dilarutkan dalam 400 ml aquades hangat (50 °C), dinginkan. Kemudian 1 g ammonium vanadat (ammonium metavanadat) dilarutkan dalam 300 ml aquades mendidih, dinginkan dan ditambahkan perlahan-lahan 140 ml asam nitrat pekat sambil diaduk. Setelah itu larutan molibdat dituangkan ke dalam larutan vanadat dan diaduk. Pengemceran dilakukan sampai volume 1 liter dengan aquades.
Larutan fosfat standar dibuat dengan cara: 3.834 g potassium dihidrogen fosfat kering dilarutkan dalam aquades sampai volume 1 liter. Kemudian 25 ml larutan tersebut diencerkan volume 250 ml dengan labu takar (1ml = 0.2 mg P2O5).
(2). Pembuatan kurva standar
Kedalam satu seri labu takar 100 ml, ditambahkan masing-masing : 0, 2.5, 5, 10, 20, 30, 40 dan 50 ml larutan fosfat standar, diencerkan masing-masing dengan 50-60 ml aquades dan ditambahkan 25 ml pereaksi vanadat-molibdat kemudian ditambahkan aquades sampai tanda tera. Larutan didiamkan selama 10 menit, kemudian diukur absorbansi masing-masing larutan di dalam kuvet gelas dengan spektrofotometer pada panjang gelombang 460 nm. Masing-masing larutan tersebut mengandung : 0, 0.5, 1.0, 2.0, 4.0, 6.0, 8.0 dan 10 mg P2O5/100
ml. Maka dapat dibuat kurva absorbansi vs mg P2O5/100 ml.
(3). Persiapan sampel
5 g sampel diabukan pada suhu 550 °C selama 24 jam kemudian setelah dingin ditambahkan 10 ml HCl 5 M, dinginkan. Saring larutan dengan kertas saring Whatman no. 41 masukkan filtrat ke dalam labu takar 250 ml, air bilasan cawan dengan aquades, disaring dimasukkan dalam labu takar juga, cuci endapan didalam kertas saring sebanyak 2 kali masing-masing dengan aquades 20 ml, kemudian diencerkan sampai tanda tera.
(4). Analisis sampel
10 ml larutan sampel yang telah disiapkan dimasukkan ke dalam labu takar 100 ml, ditambahkan 40 ml aquades dan 25 ml pereaksi vanadat molibdat dan diencerkan sampai tanda tera. Larutan didiamkan 10 menit kemudian diukur absorbansinya pada panjang gelombang 460 nm. Didapatkan konsentrasi fosfor dari kurva standar berdasarkan absorbansi yang terbaca. Perhitungan kadar fosfor sebagai berikut : W = berat sampel yg digunakan
Derajat substitusi, (Chang & Lii 1992)
Derajat substitusi (DS) dihitung dengan persamaan sebagai berikut :
D.S. =
Kadar pati, metode hidrolisa asam (AOAC 1984)
Sebanyak 2-5 mg contoh dimasukkan ke dalam gelas piala 250 ml, ditambahkan 50 ml alkohol 80% dan diaduk selama 1 jam. Suspensi disaring dengan kertas saring dan dicuci dengan air destilasi sampai volume filtrat 250 ml. Filtrat dibuang karena mengandung karbohidrat terlarut. Untuk bahan yang mengandung lemak, residu pada kertas saring dicuci 5 kali dengan 10 ml eter, kemudian dicuci dengan 150 ml alkohol 10 % untuk membebaskan karbohidrat terlarut.
dinetralkan dengan larutan NaOH 45% lalu diencerkan sampai volume 500 ml dengan air destilat. Campuran di atas disaring kembali dengan kertas saring.
Filtrat yang diperoleh ditentukan kadar glukosanya sesuai dengan penentuan gula pereduksi yaitu menitrasikan reagensia soxhlet dengan contoh (sebelumnya larutan soxhlet distandarisasi dengan larutan standar dekstrosa). Sebanyak 10 ml filtrat dimasukkan ke dalam Erlenmeyer, ditambahkan 10 ml larutan Fehling dan 5 ml larutan dekstrosa standar. Campuran dititrasi dengan larutan standar (sebelumnya Erlenmeyer diletakkan pada alat penanggas dan didihkan). Selama titrasi Erlenmeyer digoyang terus, setelah warna biru larutan Fehling menjadi berwarna merah muda ditambahkan 3-4 tetes larutan metilen biru 0.2% dan titrasi dilanjutkan sampai titik akhir (warna merah bata) kelihatan.
Berat pati dihitung dari berat glukosa dikali dengan 0.9. Angka 0.9 adalah factor konversi untuk pembentukan glukosa dari hidrolisis pati. Setiap mol glukosa yang dihasilkan dari hidrolisis pati terlihat pada setiap pembentukan 2 mol glukosa membutuhkan 2 mol air. Satu mol glukosa membutuhkan 1 mol air yang sama dengan 18 gram dan ini dikurangi dari berat 1 mol glukosa (180 gram) sehingga sisanya 162 gram, inilah yang sesungguhnya berasal dari pati yaitu 0.9 mol.
Kadar Pati = x 100%
D A x
B x C x 500 x 0.9
dimana,
A = ml larutan sampel untuk menitrasi 10 ml reagensia soxhlet B = kadar gula (mg/ml) dari larutan standar dekstrosa
C = ml larutan standar untuk standarisasi 10 ml reagensia soxhlet D = berat kering sampel (mg)
Kadar amilosa, metode IRRI (AOAC 1984)
(1). Penetapan kurva standar
dipindahkan ke dalam labu takar 100 ml dan ditepatkan dengan air destilat sampai tanda tera.
Masing-masing 1, 2, 3, 4, 5 ml larutan di atas dimasukkan ke dalam labu takar tersebut ditambahkan asam asetat 1 N masing-masing 0.2, 0.4, 0.6, 0.8 dan 1 ml. Lalu ditambahkan masing-masing 2 ml larutan iod. Campuran dalam labu takar ditepatkan sampai tanda tera dengan air destilasi dan dibiarkan selama 20 menit. Intensitas warna biru yang terbentuk di ukur dengan spektrofotometer pada panjang gelombang 625 nm. Kemudian dibuat kurva standar antara konsentrasi amilosa murni dengan absorbansi.
(2). Penetapan sampel
Sebanyak 100 mg contoh dimasukkan ke dalam rabung reaksi, ditambahkan 1 ml etanol 95% dan 9 ml NaOH 1 N. Campuran dipanaskan dalam air mendidih selama 10 menit sampai membentuk gel dan didinginkan. Campuran dipindahkan ke dalam labu takar 100 ml, dikocok dan ditepatkan dengan air destilasi sampai tanda tera.
Sebanyak 5 ml larutan di atas dimasukkan ke dalam labu takar 100 ml, ditambahkan 1 ml asam asetat 1 N dan 2 ml larutan iod. Campuran dalam labu takar ditepatkan sampai tanda tera dengan air destilasi, dikocok dan dibiarkan selama 20 menit. Intensitas warna biru yang terbentuk diukur dengan spektrofotometer pada panjang gelombang 625 nm. Kadar amilosa contoh dapat dihitung dengan rumus sebagai berikut :
Kadar amilosa % = x 100% W
100/5 x 100 A x
dimana,
A = konsentrasi amilosa dari persamaan kurva standar (mg/ml) B = berat contoh (mg)
Ketebalan film, metode microcal messmer (ASTM 1983)
empat lainnya mengelilingi parimeter film. Kemudian diambil rata-rata dari kelima pengukuran ketebalan film tersebut.
Pengukuran kuat tarik dan persen pemanjangan (ASTM 1983)
Kuat tarik dan persen pemanjangan diukur dengan Testing Machine MPY. Sebelum dilakukan pengukuran film dikondisikan dalam ruangan bersuhu 25 °C, kelembaban (RH) 50% selama 48 jam. Instron diset pada initial grip separation 50 mm, Crosshead speed 50 mm/menit dan Loadcell 50 kg.
Kuat tarik ditentukan berdasarkan beban maksimum dan persen pemanjangan dihitung pada saat film pecah atau robek.
Pengukuran laju transmisi terhadap O2 dan CO2, metode monometer (ASTM 1983)
Permeabilitas terhadap oksigen dan karbondioksida film diukur dengan menggunakan gass transmission rate tester speedivac 2. Sebelum dilakukan pengukuran film dikondisikan dalam ruangan bersuhu 25 °C, RH 50% selama 24 jam. Film yang akan diuji dipotong dengan diameter 105-108 mm. Film harus bebas dari kerusakan atau cacat. Contoh ditempatkan pada dasar sel, ditutup dan sekrup dikencangkan. Ujung alat pengukur dimiringkan kekiri maka tetesan merkuri pada dasar tabung pengukur akan menuju pipa kapiler. Kran-kran ditutup, kran A dan 4 dibuka serta pompa vakum dihidupkan.
Tabung tekanan kompresi dan tabung pengukuran divakumkan sesempurna mungkin kira-kira lima menit untuk mengurangi gas yang terabsorpsi dan teradsorpsi. Pemompaan dilanjutkan sampai tekanan dalam ruang kurang dari 0.2 mmHg (27 pa). Kran 4 ditutup dan pompa jangan dimatikan.
Laju transmisi gas (G) pada tekanan 1 atm dihitung dengan rumus :
dt
Po = tekanan atmosfer normal (1 atm) A = luas permukaan film uji (cm2) V = volume awal ruang 2 (cm3)
a = penampang melintang tabung kapiler (cm2)
h = tinggi merkuri dalam kapiler dibaca pada waktu mulai (cm) H = tinggi kolom merkuri dihubungkan dengan tekanan atmosfer (cm) C = faktor koreksi (1)
dh/dt = slope dari kurva pada titik t (cm/jam)
Uji transmisi uap air, metode cawan (ASTM 1983)
Laju transmisi uap air diukur dengan menggunakan water vapor transmission rate tester Bergerlahr metode cawan. Film yang akan diukur
dikondisikan sebelumnya pada ruangan yang bersuhu 25 °C dan kelembaban (RH) 50% selama 24 jam. Bahan penyerap uap air (desikan) diletakkan dalam cawan sedemikian rupa sehingga permukaan berjarak 3 mm dari film yang akan diuji. Tutup cawan diletakkan sedemikian sehingga bagian yang teralur menghadap keatas. Film diletakkan ke dalam tutup cawan, lalu cincin tersebut menekan film. Selanjutnya tutup dikerupkan pada cawan.
Cawan ditimbang dengan ketelitian 0.0001 g, kemudian diletakkan dalam humidity chamber, ditutup lalu kipas angin dijalankan. Cawan ditimbang tiap hari
pada jam yang hampir sama dan ditentukan pertambahan berat (mg) dan waktu (jam).
dimana :
m2 = pertambahan berat (mg per jam)
T = waktu antar 2 penimbangan terakhir (jam)
Uji kelarutan film dalam air (Ryu et al. 2002)
Kelarutan film dalam air dihitung sebagai persen dari berat kering film yang telah dilarutkan dalam air selama 24 jam. Berat kering dari film ditentukan dengan pengeringan pada suhu 100 °C selama 24 jam. Film dipotong 4 x 4 cm, ditimbang kemudian direndam dalam 50 ml air destilat yang telah diisi 0.02 g sodium azide/100 ml untuk mencegah tumbuhnya mikroorganisme, ditutup dengan aluminium foil. Di inkubator shaker selama 24 jam pada suhu 25 °C, 150 rpm. Film yang tidak larut dalam air diambil dan dikeringkan untuk mengetahui berat bahan kering. Test dilakukan dengan 3 ulangan dan kelarutan film dihitung dengan rumus sebagai berikut :
Kelarutan (%) = 100 x (DM0 – DM24) / DM0
dimana,
DM0 = berat kering film awal
DM24 = berat kering film yang tidak larut dalam air setelah 24 jam
Scaning electron microscopy (SEM)
Scanning electron microscopy (SEM) dilakukan untuk melihat
mikrostruktur film edibel. Analisis SEM menggunakan alat SEM 5200 (JEOL).
Film edibel sebelumnya dikeringkan dengan freeze drying selama 19 jam atau
sampai kadar air film edibel mencapai 2 % atau kurang. Film edibel dipotong
ukuran 0.5 x 0.5cm diletakkan pada tempat sampel yang telah dilapisi karbon.
Setelah sampel dilapisi dengan emas (Au) 300 A°, pengamatan dilakukan pada 20
Kv dan perbesaran 200 X.
Ketahanan film edibel terhadap berbagai RH
Aplikasi pengemasan. Film edibel dipotong dengan ukuran 8 cm x 6 cm.
Kemudian film edibel dilipat dua dan diseal dengan suhu 180 °C selama 5 detik
Dengan demikian didapatkan film edibel dengan ukuran 4 cm x 6 cm. Sebanyak 2 g bumbu instan dimasukkan ke dalam film edibel yang telah berbentuk kantong. Sisi tempat masuknya bumbu instan kemudian diseal.
Pengkondisian RH. Sejumlah garam jenuh sesuai dengan RH yang diujikan (Tabel 4) diletakkan pada dasar desikator. Garam jenuh tersebut ditetesin aquades sampai basah. Kemudian desikator dimasukkan dalam lemari yang tertutup (suhu 29 ± 1 °C, RH 70 ± 2 %) selama seminggu, dengan asumsi kondisi RH dalam desikator akan menjadi stabil.
Pengamatan secara visual. Bumbu instan yang telah dikemas dengan film edibel diletakkan dalam desikator. Parameter yang diamati meliputi: (1). penampakan film edibel yang digunakan sebagai pengemas bumbu, meliputi : keadaan permukaan film edibel normal (rata dan halus), berkerut, lunak, keadaan seal terlepas dan rapuh, dan (2). penampakan bumbu yang dikemas film edibel, meliputi : keadaan bumbu dari kering, basah, mencair dan keluar dari kemasan film edibel. Pengamatan secara visual dengan indrawi dilakukan setiap hari selama seminggu kemudian tiap 3 hari sampai 2 bulan.
Tabel 4. RH bermacam larutan garam jenuh
Garam RH (%)
Lithium klorida Magnesium klorida Potassium karbonat Sodium bromida
Sodium nitrit
HASIL DAN PEMBAHASAN
Karakteristik Pati Sagu Ikatan Silang
Pati sagu yang digunakan dalam reaksi ikatan silang mempunyai karakteristik kimia sebagai berikut : kadar air 12.3%, kadar pati 73.2%, kadar amilosa 15.9%, kadar amilopektin 57.3%, berwarna putih agak kecoklatan dan tidak berbau.
Bentuk, ukuran dan sifat birefrinjen
Granula pati sagu kontrol dan pati sagu ikatan silang diamati dengan menggunakan mikroskop polarisasi untuk melihat bentuk, ukuran dan sifat birefrinjen pati. Bentuk dan ukuran granula pati sagu ikatan silang tidak mengalami perubahan dibandingkan dengan pati sagu kontrol yaitu: berbentuk elips dengan ukuran 3-9 µm (Lampiran 1). Kim dan Lee (2002) juga menyatakan morfologi pati kentang hasil reaksi ikatan silang serupa dengan pati kentang kontrol walaupun konsentrasi pereaksi epiklorohidrin yang digunakan sangat tinggi. Menurut Wurzburg (1989) perubahan granula pati hasil reaksi ikatan silang tidak dapat ditentukan dengan menggunakan gliserol atau air pada suhu ruang melalui mikroskop, pengaruh ikatan silang pada granula pati baru terlihat apabila granula pati dipanaskan dalam air atau dengan proses gelatinisasi secara kimia.
Vasanthan dan Bhatty (1996) mengelompokkan granula pati gandum berdasarkan ukuran granula menjadi dua yaitu: granula pati berukuran kecil dengan diameter 2-10 µm dan granula pati berukuran besar dengan diameter 12-26 µm. Lebih lanjut dilaporkan granula pati gandum yang berukuran kecil mempunyai kemampuan membengkak dan viskositas yang lebih besar dibandingkan granula pati yang berukuran besar. Hal ini disebabkan pati yang berukuran kecil mempunyai ratio tinggi antara luas permukaan dan berat pati sehingga hidrasi dan pembengkakan akan lebih efektif. Akibatnya granula lebih cepat pecah dan menghasilkan larutan yang lebih kental daripada larutan pati berukuran besar setelah diamati melalui Brabender Amilograf.
pembuatan film edibel dilakukan penambahan volume aguades menjadi 1 : 15 (pati sagu : aquades) berbeda dengan yang telah dilakukan oleh Harris (1999) menggunakan pati sagu dengan ukuran rata-rata granula pati sagu 18 µm dan perbandingan pati sagu dan aquades sebesar 1 : 10.
Reaksi ikatan silang dengan POCl3 tidak mempengaruhi sifat birefrinjen
pati sagu (Lampiran 1). Menurut Cowd dan Stark (1991) sifat birefrinjen sangat tergantung pada derajat dan orientasi kristal pati, dimana daerah kristal dapat terbentuk, jika rantai-rantai polimer mampu saling mendekati sampai jarak sedemikian dekat sehingga menyebabkan gaya tarik antar rantai bekerja. Reaksi ikatan silang dengan pereaksi POCl3 menyebabkan terbentuknya ikatan silang
antar molekul pati dalam granula. Ikatan silang yang terbentuk menyebabkan penyusunan kembali sebagian rantai–rantai polimer dalam granula pati menjadi semakin dekat sehingga menghasilkan kembali bentuk kristal. Anwar (1997)
dalam penelitiannya menyatakan pati sagu yang kehilangan sifat kristal akibat
dihidrolisis secara enzimatis dapat terbentuk kembali setelah dilakukan fosforilasi
ikatan silang.
Pola amilograf
Pati sagu ikatan silang mempunyai pola amilograf yang sangat berbeda
dengan pati sagu kontrol (Tabel 5). Semakin tinggi konsentrasi POCl3 yang
ditambahkan maka semakin rendah suhu gelatinisasi dan kekentalan pati sagu
bahkan pada konsentrasi 0.12% POCl3 pati sagu tidak mempunyai suhu
gelatinisasi.
Tabel 5. Pola amilograf pati sagu ikatan silang. Konsentrasi POCl3
Perubahan pola amilograf disebabkan terjadinya perubahan sifat granula
mengubah karakteristik gelatinisasi hubungan padatan dan kekentalan, kecenderungan pembentukan gel pada dispersi pati serta sifat hidrofilik dari pati alami. Liu et al. (1999) dalam penelitiannya menyatakan bahwa modifikasi pati jagung melalui reaksi hidroksipropilasi menghasilkan penurunan suhu gelatinisasi dan kekentalan pati jagung dengan semakin bertambahnya konsentrasi pereaksi C3H6O. Pati jagung yang dimodifikasi dengan reaksi hidroksipropilasi
menggunakan 3 ml dan 5 ml C3H6O menghasilkan masing-masing suhu
gelatinisasi 64.8 °C dan 62.7 °C dengan kekentalan 195 RVU dan 183 RVU lebih rendah dibandingkan pati jagung kontrol dengan suhu gelatinisasi 69.4 °C dan kekentalan 301 RVU.
Pati sagu ikatan silang dibuat dengan mula-mula mereaksikan pati sagu dengan pereaksi C3H6O yang merupakan reaksi hidroksipropilasi, kemudian
dengan pereaksi POCl3 untuk reaksi ikatan silang. Menurut Wattanachant et al.
(2003) reaksi hidroksipropilasi akan melemahkan ikatan antara molekul pati sehingga pereaksi ikatan silang dapat lebih banyak bereaksi dengan molekul pati. Ikatan silang pada pati sagu akan memperkuat ikatan hidrogen antara molekul pati, sehingga memperlambat kecepatan granula membengkak dan menurunkan sensitifitas dari granula yang telah membengkak untuk pecah (Wurzburg 1989). Dengan demikian semakin meningkat konsentrasi POCl3 yang ditambahkan akan
menyebabkan penurunan suhu gelatinisasi dan kekentalan suspensi pati semakin besar. Pada konsentrasi yang lebih tinggi lagi, akan menyebabkan pati kehilangan sifat gelatinisasinya, dimana tidak terdeteksi lagi suhu gelatinisasi dan kekentalannya.
dalam 100 atau kurang unit glukosa maka adanya ikatan silang dapat mencegah hampir keseluruhan granula pati membengkak dalam air panas (Wurzburg 1989).
Amilogram pati sagu yang ditambahkan 0.12% POCl3 hanya menunjukkan
garis datar, sehingga tidak didapatkan data suhu awal gelatinisasi, suhu puncak gelatinisasi dan kekentalan (Tabel 5). Hal ini disebabkan konsentrasi POCl3 yang
ditambahkan sudah cukup banyak untuk mengikat unit glukosa dalam jumlah yang relatif kecil sehingga selama pemanasan dan pengadukan dalam Brabender Amilograf granula pati tidak mempunyai kemampuan untuk membengkak. Muhammand et al. (2000) juga menyatakan pati sagu fosforilat yang tidak mempunyai kemampuan sebagai pengental menunjukkan ikatan silang yang terbentuk terlalu banyak atau berlebihan. Lebih lanjut Wurzburg (1989) menyatakan semakin meningkat jumlah ikatan silang, maka granula pati menjadi lebih toleran terhadap perlakuan kimia dan fisik yang berlebihan.
Kadar fosfor
Senyawa fosfor ada secara alami di dalam kentang, gandum, sagu dan serealia dalam jumlah yang sangat kecil. Reaksi ikatan silang dengan pereaksi POCl3 menyebabkan senyawa fosfor dari POCl3 berikatan dengan molekul pati
sehingga kandungan fosfor dalam pati sagu bertambah.
Ada beberapa pendapat yang mengatakan bahwa senyawa fosfat yang terbentuk selama reaksi ikatan silang dapat ditentukan dari pola amilograf pati. Menurut Lim & Seib (1993) penurunan suhu awal pasting dan kenaikan kekentalan maksimum menunjukkan adanya senyawa monoesterfosfat. Muhammand et al. (2000) menyatakan penurunan kekentalan maksimum dan kenaikan suhu awal gelatinisasi memberikan informasi bahwa senyawa diesterfosfat lebih dominan. Berdasarkan pola Amilograf pada Tabel 5 dapat dikatakan bahwa reaksi ikatan silang dengan POCl3 dalam penelitian ini
membentuk campuran senyawa monoesterfosfat dan diesterfosfat.
diester (Kasemsuwan & Jane 1994; Rutenberg & Solarek 1984) atau senyawa triester (Wong 1989). Berdasarkan reaktifitas masing-masing gugus hidroksil yang terdapat pada unit glukosa maka atom C6 merupakan gugus hidroksil primer yang paling reaktif sedangkan C2 dan C3 yang merupakan gugus hidroksil sekunder.
Tabel 6 menunjukkan kandungan fosfor pati sagu dengan penambahan POCl3, yaitu: 0.04%, 0.08%, 0.12% (b/b) didapat sebesar: ± 5.75 x 10-3 % masih
dapat diterima karena berada di bawah standar kandungan fosfor maksimum yang diijinkan untuk modifikasi pati oleh Code of Federal Regulations (CFR) yaitu 0.4% (Lim & Seib, 1993).
Tabel 6. Kandungan fosfor pati sagu ikatan silang Konsentrasi POCl3 pada
pati sagu (%)
Fosfor (%) (x 10-3) 0.00
0.04 0.08 0.12
5.7551 5.7552 5.7565 5.7572
Berdasarkan kadar fosfor pati sagu ikatan silang, maka dapat diketahui derajat substitusi senyawa ikatan silang. Penambahan 0.04%, 0.08% dan 0.12% POCl3 dalam pati sagu menghasilkan derajat substitusi senyawa ikatan silang
sebesar ± 3.01 x 10-4. Hasil ini sangat kecil sehingga sukar untuk dianalisis jumlah ikatan silang yang terbentuk secara kuantitatif. Dengan demikian untuk mengetahui adanya ikatan silang pada pati dapat dilihat dari perubahan sifat fisik, seperti volume pasta, kekentalan pasta, kejernihan dalam air panas atau alkali dingin (Rutenberg & Solarek 1984; Wurzburg 1989).
Karakteristik Film Edibel
Penelitian pendahuluan
menghasilkan tampilan film edibel yang berbeda. Film edibel dari pati sagu kontrol menghasilkan tampilan sedikit transparan dan berwarna agak kecoklatan, sedangkan film edibel dari pati sagu ikatan silang menghasilkan tampilan yang lebih transparan dan berwarna agak kekuningan. Warna kuning disebabkan terjadinya reaksi pati sagu dan POCl3. Semakin tinggi konsentrasi POCl3 yang
ditambahkan pada pati sagu akan menghasilkan tampilan film edibel yang cenderung semakin kuning.
Kemudahan film edibel dikelupas dipengaruhi oleh konsentrasi plastisizer yang ditambahkan dalam pembuatan film edibel. Gliserol berfungsi sebagai plastisizer yang akan mengurangi kerapatan dan gaya antar molekul pati-gliserol sehingga film yang terbentuk lebih fleksibel dan halus (Harris, 1999). Menurut Parris (1995) penambahan plastisizer sebesar 10% belum dapat memperbaiki fleksibilitas film, sedangkan penambahan diatas 25% akan menyebabkan film yang terbentuk cenderung lengket. Pada penelitian ini, film edibel yang dihasilkan dari pati sagu kontrol dan penambahan gliserol 25% (b/v) atau 30% (b/v), serta pati sagu ikatan silang dan penambahan gliserol 25% (b/v) menghasilkan film yang halus dan fleksibel. Penambahan gliserol lebih tinggi dari konsentrasi di atas, akan menghasilkan film edibel yang agak lengket dan susah dikelupas dari cetakan. Hal ini disebabkan karena gliserol bersifat mengikat air dan melunakan permukaan film. Dengan demikian dalam pembuatan film edibel selanjutnya digunakan 25% (b/v) gliserol.