KANDUNGAN FITOKIMIA, AKTIVITAS ANTIOKSIDAN, DAN
SITOTOKSISITAS EKSTRAK BUAH HARENDONG
(
Melastoma affine
D. Don)
NOVILIA EKA SYAFITRI
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa skripsi berjudul Kandungan Fitokimia, Aktivitas Antioksidan, dan Sitotoksisitas Ekstrak Buah Harendong (Melastoma affine D. Don) adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Penelitian ini didanai oleh saya sendiri. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Agustus 2013
Novilia Eka Syafitri
ABSTRAK
NOVILIA EKA SYAFITRI. Kandungan Fitokimia, Aktivitas Antioksidan, dan Sitotoksisitas Ekstrak Buah Harendong (Melastoma affine D. Don). Dibimbing oleh MARIA BINTANG dan SYAMSUL FALAH.
Buah harendong diduga mengandung senyawa aktif termasuk fenolik dan flavonoid yang berperan sebagai antioksidan. Tujuan dari penelitian ini adalah menganalisis senyawa kimia, mencari ekstrak yang berpotensi sebagai antioksidan, serta menguji sitotoksisitas ekstrak buah harendong (Melastoma affine D. Don). Komponen fitokimia baik ekstrak buah harendong mentah maupun ekstrak buah masak meliputi alkaloid, triterpenoid, flavonoid, fenolik, dan tanin. Pengukuran secara kuantitatif terhadap total fenolik dan flavonoid pada 6 jenis ekstrak dengan hasil total fenolik tertinggi adalah ekstrak etanol 96% buah mentah sebesar 189,56 mg/g, sedangkan kandungan total flavonoid tertinggi adalah ekstrak etanol 70% buah mentah sebesar 225.50 mg/g. Ekstrak terbaik yang mampu menghambat 50% radikal bebas DPPH (2,2-diphenil-1-picryl hydrazil) adalah ekstrak etanol 70% buah mentah dengan IC50 sebesar 0.01 ppm.
Semua ekstrak bersifat tidak toksik terhadap Artemia salina Leach atau tidak aktif untuk uji antikanker dengan nilai LC50 lebih dari 1000 ppm.
Kata kunci: antioksidan, Melastoma affine, sitotoksisitas.
ABSTRACT
NOVILIA EKA SYAFITRI. Phytochemical Compound, Antioxidant Activity, and Cytotoxicity by Melastoma affine D. Don Fruit Extract. Supervised by MARIA BINTANG and SYAMSUL FALAH.
Melastoma affine D. Don fruit is predicted to contain active compounds such as phenolic and flavonoid that act as antioxidant. The aim of the study were to analyze chemical compound, to explore the extract that has potential function as antioxidant, and cytotoxicity test of Melastoma affine D. Don fruit extract. Component of Phytochemical both crude extracts unripe and ripe Melastoma affine D. Don fruit included alkaloid, triterpenoid, flavonoid, phenol, and tannin. Quantitative measurement of total phenols and flavonoids in 6 types extract which highest total phenol was 96% ethanol extract of the unripe fruit was 189.56 mg/g, while the highest content of total flavonoid was 70% ethanol extract of the unripe fruit was 225.50 mg/g. the best extract to inhibit the free radical DPPH by 50% was 70% ethanol extract of the unripe fruit by IC50 was 0.01 ppm. All extracts
were not toxic against Artemia salina Leach or inactive for testing anticancer because the LC50 values were more than 1000 ppm.
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains
pada
Departemen Biokimia
KANDUNGAN FITOKIMIA, AKTIVITAS ANTIOKSIDAN, DAN
SITOTOKSISITAS EKSTRAK BUAH HARENDONG
(
Melastoma affine
D. Don)
NOVILIA EKA SYAFITRI
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
Judul Skripsi: Kandungan Fitokimia, Aktivitas Antioksidan, dan Sitotoksisitas Ekstrak Buah Harendong (Melastoma affine D. Don).
Nama : Novilia Eka Syafitri NIM : G84090004
Disetujui oleh
Prof. Dr. drh. Maria Bintang, MS Pembimbing I
Dr. Syamsul Falah, S.Hut, M.Si Pembimbing II
Diketahui oleh
Dr. Ir. I Made Artika, M.App.Sc Ketua Departemen Biokimia
PRAKATA
Segala puji bagi Allah SWT atas segala rahmat dan karunia-Nya sehingga karya tulis ini berhasil diselesaikan. Penelitian dengan judul Kandungan Fitokimia, Aktivitas Antioksidan, dan Sitotoksisitas Ekstrak Buah Harendong (Melastoma affine D. Don) dilaksanakan sejak bulan Februari sampai Mei 2013 di Laboratorium Penelitian, Departemen Biokimia, Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Terima kasih penulis ucapkan kepada Prof. Dr. drh. Maria Bintang, MS selaku pembimbing 1 dan Dr. Syamsul Falah, S.Hut., M.Si. selaku pembimbing 2 yang telah memberikan bimbingan, motivasi, dan saran. Di samping itu, penghargaan penulis sampaikan kepada Adhi, Aila, Ika, Dina, Narita, Lusi, Yayuk, Mina, Dhian, Erika, Oki, Azra, dan pihak-pihak lain yang terlibat dalam memberikan bantuan ide maupun materi selama penelitian. Ucapan terima kasih juga penulis sampaikan kepada mama, papa, dan Dina atas segala doa, nasihat, dan dukungannya. Akhir kata penulis berharap tulisan ini dapat berguna bagi penulis sendiri maupun semua pihak demi kemajuan ilmu pengetahuan.
Bogor, Agustus 2013
DAFTAR ISI
DAFTAR GAMBAR xii
DAFTAR TABEL xii
DAFTAR LAMPIRAN xii
PENDAHULUAN 1
METODE 3
Bahan 3
Alat 3
Prosedur Percobaan 3
HASIL 6
PEMBAHASAN 9
SIMPULAN DAN SARAN 12
Simpulan 12
Saran 13
DAFTAR PUSTAKA 13
LAMPIRAN 15
DAFTAR GAMBAR
1 Buah harendong 2
2 Struktur radikal DPPH yang stabil 2
3 Kadar air buah harendong 6
3 Rendemen buah harendong 7
4 Kandungan total fenolik dalam ekstrak buah harendong mentah dan masak 8 5 Kandungan total flavonoid dalam buah harendong 8
DAFTAR TABEL
1 Uji fitokimia ekstrak buah harendong 7
2 Aktivitas antioksidan ekstrak buah harendong berdasarkan dalam IC50 9
3 Nilai LC50 ekstrak buah harendong 9
DAFTAR LAMPIRAN
1 Diagram alir penelitian 16
2 Kadar air buah harendong 17
3 Rendemen hasil ekstraksi 17
4 Hasil uji fitokimia 18
5 Kurva standar asam galat 19
6 Kandungan total fenolik ekstrak buah harendong 20
7 Kurva standar katekin 20
8 Kandungan total flavonoid ekstrak buah harendong 21 9 Contoh perhitungan IC50 ekstrak buah harendong 21
10 Pengaruh konsentrasi ekstrak terhadap % inhibisi 22 11 Contoh perhitungan LC50 ekstrak buah harendong 26
1
PENDAHULUAN
Gaya hidup yang tidak sehat seperti merokok, mengkonsumsi makanan yang tidak seimbang, dan terpapar polusi setiap hari menyebabkan peningkatan radikal bebas di dalam tubuh. Peningkatan radikal bebas yang disertai dengan jumlah antioksidan sedikit di dalam tubuh dapat membahayakan tubuh seperti risiko kanker, stroke, aterosklerosis, arthritis, iskemia, penyakit neurodegeneratif, dan AIDS (Kumpulainen dan Salonen 1999; Cook dan Samman 1996).
Senyawa radikal bebas dapat terbentuk setiap saat melalui berbagai cara. Radikal bebas atau oksigen reaktif secara umum terbentuk melalui 2 cara, yaitu secara endogen dan eksogen. Pembentukan secara endogen merupakan respon normal proses biokimia di dalam tubuh baik intraseluler maupun ekstraseluler, sedangkan pembentukan secara eksogen misalnya dari polusi, makanan, serta injeksi ataupun absorpsi melalui kulit (Supari 1996). Radikal bebas sifatnya sangat labil dan reaktif sehingga dapat menimbulkan kerusakan pada komponen sel seperti DNA, lipid, protein dan karbohidrat. Kerusakan tersebut dapat menimbulkan berbagai kelainan biologis seperti aterosklerosis, kanker, dan diabetes (Chen 1996).
Antioksidan adalah senyawa yang dapat menunda, menghambat, atau mencegah oksidasi lipid atau molekul dengan menghambat inisiasi dan penyebaran reaksi berantai oksidatif (Javanmardi 2003). Radikal bebas dapat direduksi oleh antioksidan, karena antioksidan memiliki elektron bebas yang dapat berpasangan dengan radikal bebas. Secara umum, antioksidan dikelompokkan menjadi 2, yaitu antioksidan enzimatis dan non enzimatis. Antioksidan enzimatis meliputi enzim superoksida dismutase (SOD), katalase, dan glutation peroksidase. Antioksidan non-enzimatis masih dibagi dalam 2 kelompok lagi yaitu antioksidan larut lemak seperti tokoferol, karotenoid, flavonoid, quinon, serta antioksidan larut air seperti asam askorbat, asam urat, protein pengikat logam, dan protein pengikat heme. Kedua jenis antioksidan tersebut bekerja sama dalam mencegah kerusakan di dalam tubuh akibat senyawa radikal (Miyazaki 2000).
Antioksidan non-enzimatis dapat diperoleh secara alami, yaitu dari tanaman. Senyawa-senyawa yang berpotensi sebagai antioksidan dapat diprediksi dari golongan fenolik, flavonoid, dan alkaloid, yang merupakan senyawa polar. Flavonoid memberikan efek penghambatan pada radikal bebas yang berlebihan. Hal ini berfungsi dalam mencegah efek merusak dari spesies oksigen reaktif yang mencakup peroksidasi lipid, oksidasi sulfidril dan kelompok rentan lainnya dalam protein (Sies 1985, 1991).
Gambar 1
Gambar 1 Buah harendong mentah (kiri) dan masak (kanan)
2
khasiatnya sebagai obat tradisional terutama pada bagian akar dan daun, sedangkan penelitian pada bagian buah tanaman ini masih jarang dilakukan. Di Pananjung Pangandaran, Jawa Barat, daun harendong dapat digunakan sebagai obat luka dengan cara dikunyah dan ditempelkan pada bagian yang luka (Zuhud 1995). Di Kampar, Riau, rebusan daun keduduk digunakan sebagai obat antimalaria (Uji 1995). Di kecamatan Pamarican, Kabupaten Ciamis, daun M.
malabathricum yang masih muda diseduh, kemudian digunakan untuk kumur pada saat sakit gigi (Purwantoro 1995). Menurut Munawaroh (1995), di Singkawang, rebusan daun cengkodok diminum sebagai obat penurun panas dan obat mual. Seduhan atau kunyahan daun harendong laki digunakan sebagai obat mencret/diare oleh suku Baduy di Banten. Rebusan daun harendong atau disebut risak oleh suku Dayak di kecamatan Beduai, Kalimantan Barat digunakan sebagai obat muntaber dan berak darah (Wardah dan Setyowati).
Semua tanaman mengandung senyawa metabolit baik metabolit primer (asam amino, karbohidrat, asam lemak, sitokrom, klorofil, dan metabolit intermediet dari jalur anabolik dan katabolik) maupun metabolit sekunder termasuk fenolik dan flavonoid yang memiliki berbagai fungsi dan dapat dimanfaatkan dalam bidang kesehatan (Heldt 2005). Senyawa-senyawa metabolit sekunder pada buah harendong belum pernah diteliti sebelumnya, sehingga pada penelitian ini dilakukan penapisan fitokimia. Buah harendong memiliki warna ungu pekat yang diduga mengandung flavonoid serta memiliki rasa manis pada buah masak dan pahit pada buah mentah yang dikendalikan oleh senyawa fenolik berupa asam fenolat atau tanin.
Flavonoid memiliki banyak fungsi termasuk sebagai antioksidan (Heldt 2005). Kandungan flavonoid dan fenolik pada setiap buah berbeda-beda dan fungsi kedua senyawa ini juga bervariasi. Oleh karena itu dilakukan uji aktivitas antioksidan terhadap ekstrak buah yang diduga mengandung kedua senyawa tersebut serta dianalisis hubungan antara kedua senyawa bioaktif dengan aktivitas antioksidan. Selain itu dicari ekstrak terbaik yang memiliki kandungan fenolik dan flavonoid tinggi dengan aktivitas antioksidan yang tinggi.
Metode yang digunakan untuk menguji aktivitas antioksidan adalah metode DPPH, yaitu menggunakan DPPH sebagai radikal bebas yang akan ditangkap oleh senyawa aktif yang berada dalam ekstrak. DPPH merupakan senyawa yang stabil pada suhu ruang. DPPH akan tereduksi dan kehilangan warna violetnya menjadi warna kuning pucat (Molyneux 2004). Proses penangkapan radikal ini melalui mekanisme pengambilan atom hidrogen dari senyawa antioksidan oleh radikal bebas, sehingga radikal bebas menangkap satu elektron dari antioksidan. Selanjutnya DPPH akan diubah menjadi DPPH-H (bentuk tereduksi DPPH) oleh senyawa antioksidan (Pine 1988).
Gambar 2 Struktur radikal DPPH yang stabil (Park2008)
3 yang bersifat toksik dikaitkan dengan kemampuan senyawa tersebut dalam membunuh sel kanker. Uji ini merupakan uji hayati yang dapat digunakan untuk menduga suatu ekstrak dapat berfungsi sebagai pembunuh sel kanker (Meyer et al.
1982).
Penelitian ini bertujuan menganalisis kandungan fitokimia, mencari ekstrak yang berpotensi sebagai antioksidan yang mengandung total fenolik dan flavonoid terbaik, serta menguji sitotoksisitas ekstrak buah harendong (Melastoma affine D. Don). Manfaat dari penelitian ini adalah mengetahui komponen senyawa aktif buah harendong dan fungsi senyawa tersebut sebagai antioksidan, serta mendapatkan ekstrak yang potensial sebagai antioksidan. Pengujian sitotoksisitas diharapkan dapat memberikan informasi lebih lanjut tentang penggunaan buah harendong sebagai antikanker jika sitotoksisitasnya tinggi.
METODE
Bahan
Bahan yang diteliti adalah buah harendong yang mentah dan masak yang berasal dari daerah Lebak-Banten. Bahan-bahan yang digunakan adalah pereaksi Meyers, Dragendorf, Wagner, Folin ciocalteu 10%, 7.5%, metanol pro-analis, NaOH 1 M, 5%, 10%, asam galat, katekin hidrat, larutan DPPH 0.1 mM, asam askorbat, Artemia salina Leach, air laut, dan air (aquabidest).
Alat
Alat-alat yang digunakan adalah cawan porselin, neraca analitik, eksikator/desikator, vortex, oven, blender, pipet mikro, rotary evaporator, penangas air, spektrofotometer UV/Vis, dan plate BSLT.
Prosedur Percobaan Preparasi Sampel
Sampel segar diambil sebanyak 2 kg buah harendong mentah dan 2 kg buah harendong masak. Semua bahan dipisahkan dari kotoran atau bahan-bahan asing lainnya dan dicuci hingga bersih. Sampel dikeringkan dengan oven pada suhu 40-50oC selama 4-5 hari hingga kadar air kurang dari 10% agar bahan yang diperoleh tidak mudah rusak. Sampel kering lalu dihaluskan dengan blender dan diayak dengan ukuran 100 mesh. Simplisia yang didapat dibungkus dengan plastik dan disimpan untuk pengujian selanjutnya.
Penentuan Kadar Air
4
Setelah didinginkan dalam desikator selama 30 menit, cawan beserta isinya ditimbang. Prosedur dilakukan berulang kali sampai didapatkan bobot tetap. Penentuan kadar air dilakukan sebanyak 3 kali ulangan (triplo). Penentuan kadar air dapat dihitung dengan menggunakan persamaan sebagai berikut :
=
Dimana
a = bobot sebelum dikeringkan (g) b = bobot setelah dikeringkan (g) Ekstraksi Sampel
Ekstraksi buah harendong menggunakan metode maserasi menurut Badan Pengawas Obat dan Makanan Republik Indonesia (BPOM RI 2004). Maserasi adalah metode ekstraksi dengan perendaman sampel dengan pelarut tertentu. Proses ekstraksi pada penelitian ini menggunakan pelarut etanol 70%, etanol 96%, dan air. Sebanyak 30 gram buah harendong yang telah menjadi bentuk simplisia ditambahkan pelarut dengan perbandingan 1:10, dimasukkan ke dalam maserator, direndam selama 6 jam sambil sekali-kali diaduk, dan didiamkan sampai 24 jam. Maserat dipisahkan dan proses diulang 2 kali dengan jenis dan jumlah pelarut yang sama. Semua maserat dikumpulkan dan dipekatkan menggunakan rotary evaporator pada suhu 50°C-80°C sampai diperoleh sampel yang menyerupai pasta atau serbuk.
Uji Fitokimia (Harborne 1987) a. Alkaloid
Ekstrak senbanyak 0.1 gram ditambahkan 10 mL kloroform dan ditambahkan beberapa tetes amoniak. Fraksi kloroform dipisahkan dan diasamkan dengan beberapa tetes H2SO4 pekat. Fraksi asam diambil dan dibagi menjadi 3
tabung, kemudian ditambahkan pereaksi Dragendorf, Meyer, dan Wagner. Terdapatnya alkaloid ditandai dengan terbentuknya endapan putih pada pereaksi Meyer, endapan merah pada pereaksi Dragendorf, dan endapan coklat pada endapan pereaksi Wagner.
b. Steroid/ triterpenoid
Sebanyak 1 g contoh dilarutkan dengan 25 mL etanol panas 50ᵒC,
kemudian disaring ke dalam pinggan porselin dan diuapkan sampai kering. Residu dilarutkan dengan eter dan dipindahkan ke dalam tabung reaksi, lalu ditambahkan 3 tetes asam asetat anhidrat dan 1 tetes H2SO4 pekat (Uji Lieberman Burchard).
Warna merah atau ungu menunjukkan adanya triterpenoid dan warna hijau atau biru menunjukkan adanya steroid.
c. Flavonoid
Sampel ditambahkan serbuk magnesium 0,1 mg dan 0,4 ml amil alkohol (campuran asam klorida 37 % dan etanol 95 % dengan volume yang sama) dan 4 ml alkohol kemudian campuran dikocok. Terbentuknya warna merah, kuning atau jingga pada lapisan amil alkohol menunjukkan adanya flavonoid.
d. Saponin (uji busa)
5 e. Tanin
Ekstrak sebanyak 1 gram ditambahkan 10 mL akuades kemudian dididihkan. Setelah dingin filtrat ditambahkan 5 mL FeCl3 1 % (b/v). Apabila
terjadi perubahan warna menjadi biru tua, berarti sampel mengandung tanin. f. Uji Fenolik hidrokuinon (pereaksi FeCl3)
Sebanyak 1 gram sampel diekstrak dengan 20 ml etanol 70%. Ekstrak sebanyak 1 ml kemudian ditambahkan 2 tetes larutan FeCl3 5%. Terbentuknya
warna hijau atau hijau biru menunjukkan adanya senyawa fenol dalam bahan. Pengukuran Total Fenolik dalam Ekstrak Buah Harendong
Konsentrasi fenolik yang terkandung dalam ekstrak buah harendong diukur menggunakan metode spektrofotometri (Singleton 1999). Ekstrak dengan konsentrasi 1 mg/ml atau setara dengan 10 mg dalam 10 ml metanol digunakan dalam analisis. Sebanyak 0.5 ekstrak yang telah dilarutkan dengan metanol diambil, ditambah dengan 2.5 ml reagen Folin Ciocalteu 10% yang dilarutkan dalam air, dan ditambah dengan 2.5 ml NaHCO3 7.5%. Blanko yang digunakan
berupa campuran 0.5 ml metanol, 2.5 ml reagen Folin Ciocalteu yang dilarutkan dalam air, dan 2.5 ml NaHCO3 7.5%. Sampel-sampel tersebut kemudian
diinkubasi pada suhu 450C selama 45 menit. Pengulangan dilakukan sebanyak tiga kali dan pengukuran absorbansi dilakukan pada panjang gelombang 765 nm. Prosedur yang sama dilakukan untuk membuat kurva standar asam galat. Berdasarkan pengukuran absorbansi, total fenolik dapat dibaca dari kurva standar, lalu total fenolik ekstrak ditunjukan dalam asam galat ekuivalen (mg GAE/g ekstrak).
Pengukuran Total Flavonoid
Pengukuran total flavonoid dilakukan dengan metode Kim et al. (2003) yang dimodifikasi. Sebanyak 10 mg ekstrak dilarutkan dalam 10 ml akuades, lalu sebanyak 5 ml larutan ekstrak diambil dan ditambah dengan 0.3 ml NaNO2 5%.
Tahap selanjutnya, ditambahkan 0.3 ml AlCl3 10% yang dilarutkan dengan
metanol dan diinkubasi pada suhu ruang selama 5 menit. Setelah inkubasi, tambahkan 2 ml NaOH 1 M dan volume dicukupkan hingga 10 ml dengan akuades. Pengukuran absorbansi dilakukan pada panjang gelombang 510 nm. Pengukuran dilakukan 3 kali ulangan dan penentuan total flavonoid dinyatakan dalam katekin ekuivalen (mg CE/g ekstrak).
Pengukuran Aktivitas Antioksidan Ekstrak Buah Harendong dengan Metode DPPH (2,2-diphenil-1-picryl hydrazil)
Pengukuran aktivitas antioksidan ini merupakan metode Aqil et al. (2006) dengan menggunakan DPPH dengan konsentrasi 0.1 mM dalam metanol. Ekstrak buah harendong sebanyak 1 ml dengan konsentrasi berbeda, yaitu 12.5, 25, 50, 100, dan 200 ppm ditambah dengan 1 ml DPPH 0.1 mM. campuran larutan diinkubasi selama 30 menit, kemudian diukur absorbansinya pada panjang gelombang 517 nm. Kontrol positif menggunakan asam askorbat dengan konsentrasi yang lebih kecil dibandingkan sampel, yaitu 1.25, 2.5, 5, 10, dan 20 ppm dalam metanol. Daya hambat ditentukan sebagai % inhibisi yang dihitung dengan rumus sebagai berikut:
6
Keterangan:
A0= absorbansi kontrol negatif/absorbansi larutan DPPH tanpa sampel
A =absorbansi sampel Uji Sitotoksisitas
Uji sitotoksisitas dengan Brine Shrimp Lethality Test (BSLT) ini menggunakan metode Modifikasi Meyer et al. (1982). Sebanyak ± 1 ml air laut yang berisi Artemia salina Leach sebanyak 10 ekor dipipet, dimasukkan ke dalam wadah uji, dan ditambahkan larutan sampel yang akan diuji masing-masing sebanyak 5 ml, dengan konsentrasi 10, 100, 200, 500 dan 1000 ppm yang dilarutkan dalam air laut. Kontrol negatif (blanko) disiapkan dengan perlakuan yang sama, tetapi tanpa mengandung ekstrak. Larutan dibiarkan selama 24 jam, kemudian dihitung jumlah larva yang mati dan masih hidup dari tiap lubang wadah uji. Uji potensi hayati ini dilakukan secara duplo untuk setiap kombinasi. Analisis Data
Nilai LC50 ditentukan melalui metode analisis probit dengan software SPSS
18 dengan selang kepercayaan 95%. Penentuan beda nyata dilakukan analisis dengan One-Way ANOVA, sedangkan korelasi data ditentukan secara bivarian dengan software SPSS 18.
HASIL
Kadar Air Buah Harendong
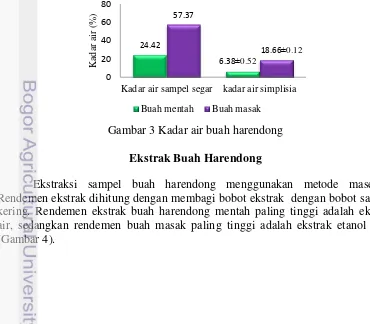
Penentuan kadar air meliputi pengukuran kadar air sampel segar dan kadar air simplisia. Buah mentah mengandung kadar air lebih rendah dibandingkan buah masak pada kondisi segar dan simplisia buah mentah juga memiliki kadar air yang lebih rendah dibandingkan dengan simplisia buah masak.
Gambar 3 Kadar air buah harendong Ekstrak Buah Harendong
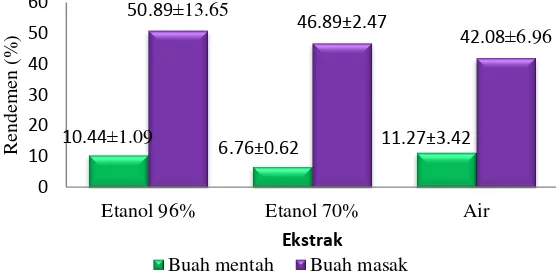
Ekstraksi sampel buah harendong menggunakan metode maserasi. Rendemen ekstrak dihitung dengan membagi bobot ekstrak dengan bobot sampel kering. Rendemen ekstrak buah harendong mentah paling tinggi adalah ekstrak air, sedangkan rendemen buah masak paling tinggi adalah ekstrak etanol 96%
Kadar air sampel segar kadar air simplisia
7
Gambar 4 Rendemen buah harendong Uji Fitokimia
Uji fitokimia meliputi uji alkaloid, triterpenoid/sterol, flavonoid, saponin, tannin, dan fenolik. Hasil uji fitokimia ekstrak buah harendong mentah dan masak positif untuk uji alkaloid, triterpenoid, flavonoid, tanin, dan fenolik, sedangkan bereaksi negatif untuk uji saponin (Tabel 1).
Tabel 1 Uji fitokimia ekstrak buah harendong Uji
Buah mentah Buah masak
Air EtOH
EtOH70%: ekstrak etanol 70%, ETOH96%: ekstrak etanol 96%
Total Fenolik
8
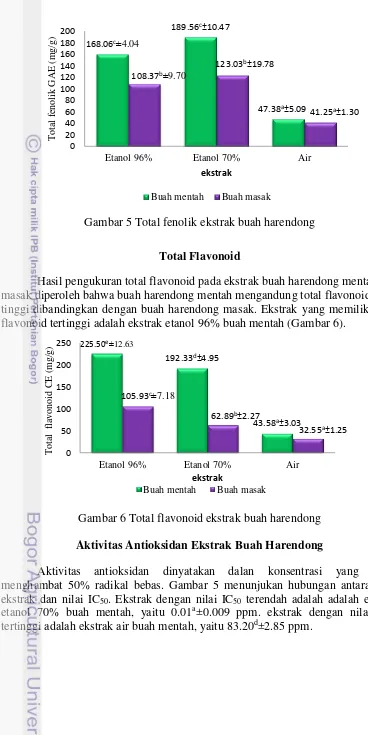
Gambar 5 Total fenolik ekstrak buah harendong Total Flavonoid
Hasil pengukuran total flavonoid pada ekstrak buah harendong mentah dan masak diperoleh bahwa buah harendong mentah mengandung total flavonoid lebih tinggi dibandingkan dengan buah harendong masak. Ekstrak yang memiliki total flavonoid tertinggi adalah ekstrak etanol 96% buah mentah (Gambar 6).
Gambar 6 Total flavonoid ekstrak buah harendong Aktivitas Antioksidan Ekstrak Buah Harendong
Aktivitas antioksidan dinyatakan dalan konsentrasi yang dapat menghambat 50% radikal bebas. Gambar 5 menunjukan hubungan antara jenis ekstrak dan nilai IC50. Ekstrak dengan nilai IC50 terendah adalah adalah ekstrak
etanol 70% buah mentah, yaitu 0.01a±0.009 ppm. ekstrak dengan nilai IC50
tertinggi adalah ekstrak air buah mentah, yaitu 83.20d±2.85 ppm.
9 Tabel 2 Aktivitas antioksidan ekstrak buah harendong berdasarkan nilai IC50
Ekstrak IC50 (ppm)
Keterangan untuk menunjukkan berbeda atau tidak berbeda nyata antar data
Sitotoksisitas Ekstrak Buah Harendong
Nilai konsentrasi yang menyebabkan kematian 50% populasi didapat dengan menghubungkan log konsentrasi ekstrak dengan % kematian larva udang. Ekstrak dengan nilai LC50 terendah adalah ekstrak etanol 70% buah mentah,
sedangkan ekstrak dengan nilai tertinggi adalah ekstrak air buah masak (Tabel 3). Tabel 3 Nilai LC50 ekstrak buah harendong
Ekstrak LC50.(ppm x 10
4 )
Etanol 96% buah mentah 0.2147a±0.1342
Etanol 70% buah mentah 0.1761a±0.0116
Air buah mentah 2.2268ab±0.0409
Etanol 96% buah masak 4.9415ab±1.6118
Etanol 70% buah masak 0. 4238a±0.2038
Air buah masak 6.9009b±4.3827
a,b
Keterangan untuk menunjukkan berbeda atau tidak berbeda nyata antar data
PEMBAHASAN
Tanaman harendong memiliki buah yang berwarna ungu kemerahan dan diduga memiliki senyawa bioaktif seperti flavonoid dan fenolik yang berperan dalam menangkal radikal bebas, sehingga berpotensi sebagai antioksidan. Buah harendong masak memiliki kadar air sampel segar dan kadar air simplisia yang lebih besar dibandingkan dengan buah mentah. Buah mentah mengandung sedikit air karena air yang ada pada tanaman sebagian besar tidak disimpan di buah mentah, namun digunakan untuk proses fotosintesis. Air, karbon dioksida, nitrat, dan sulfat berperan dalam proses fotosintesis untuk membentuk karbohidrat dan asam amino. Masa perkecambahan biasanya diinduksi oleh pengangkutan air yang menyebabkan bagian-bagian protein membentuk sebuah vakuola (Heldt 2006). Oleh karena, kemungkinan penyebab buah masak lebih banyak mengandung air berkaitan dengan pengangkutan air pada masa perkecambahan.
10
tertinggi adalah ekstrak etanol 96%. Hal ini mungkin dipengaruhi oleh kepolaran dari pelarut yang mempengaruhi banyaknya senyawa yang terlarut termasuk senyawa lain yang tidak diharapkan seperti gula pada ekstrak buah masak dan senyawa-senyawa lainnya pada ekstrak air. Berdasarkan fenomena yang terjadi ketika proses ekstraksi, simplisia buah mentah menyatu dengan pelarut air. Ini mungkin menjadi salah satu penyebab jumlah ekstrak air buah mentah lebih tinggi.
Analisis senyawa kimia buah harendong menggunakan dua metode pengujian, yaitu penapisan fitokimia sebagai uji kualitatif dan pengukuran total fenolik dan flavonoid sebagai uji kuantitatif. Penapisan fitokimia adalah uji kualitatif untuk mengetahui kandungan kimia suatu sampel. Hasil uji fitokimia menunjukan bahwa kedua sampel baik sampel buah mentah maupun buah masak memiliki kandungan senyawa kimia yang sama, yaitu alkaloid, triterpenoid, flavonoid, tanin, dan fenolik, namun tidak mengandung saponin. Ekstrak air buah mentah memiliki rendemen yang paling tinggi tetapi untuk semua uji fitokimia hanya memiliki tanda positif 1 atau memiliki warna yang tidak pekat. Hal ini diprediksi karena pada proses ekstraksi, simplisia buah mentah menjadi satu dengan pelarut air, sehingga pemisahan beberapa senyawa tertentu yang diharapkan menjadi tidak efektif karena banyak kontaminan yang ikut terlarut. Ekstrak lain selain ekstrak air memiliki rendemen yang rendah namun kandungan triterpenoid, flavonoid, dan taninnya banyak, karena senyawa-senyawa yang diharapkan terlarut dengan efektif dan mungkin mengandung sedikit kontaminan. Analisis senyawa kimia dilanjutkan dengan analisis secara kuantitatif meliputi pengukuran total fenolik dan total flavonoid.
Total fenolik dalam penelitian ini diduga sebagai asam fenolat atau biasa disebut dengan asam galat yang merupakan senyawa tanin. Senyawa tanin berperan dalam mengatur rasa buah. Buah mentah biasanya mengandung tanin lebih banyak dibandingkan buah masak, sehingga buah mentah cenderung memiliki rasa pahit. (Crozier et al. 2006). Hal ini dibuktikan dengan data hasil pengukuran total fenolik pada ekstrak buah harendong mentah lebih tinggi dibandingkan ekstrak buah harendong masak.
Kandungan total flavonoid ekstrak buah mentah lebih tinggi dibandingkan dengan ekstrak buah masak. Senyawa flavonoid yang diduga lebih banyak terkandung dalam buah harendong mentah adalah antosianidin yang diproduksi untuk melindungi buah dari sinar matahari dan serangga, sedangkan pada buah masak lebih banyak mengandung antosianin (turunan antosianidin) yang mengandung lebih banyak gula dan diproduksi untuk menarik serangga penyerbuk (Crozier et al. 2006).
Rendemen ekstrak buah mentah memang lebih kecil dibandingkan dengan ekstrak buah masak, namun memiliki total fenolik dan total flavonoid yang lebih tinggi dibandingkan ekstrak buah masak. Hal ini membuktikan bahwa kandungan gula mempengaruhi kandungan total fenolik dan total flavonoid yang terdapat dalam buah masak. Kandungan total fenolik dan flavonoid yang tinggi pada ekstrak buah mentah tidak dipengaruhi oleh kadar air. Hal ini karena proses pemekatan ekstrak dengan rotary evaporator dilakukan pada suhu 50-70oC, sehingga dapat menguapkan pelarut termasuk air.
11 etanol 70% buah mentah. Hal ini diduga dipengaruhi oleh kepolaran pelarut yang dapat dikaitkan dengan penelitian yang dilakukan oleh Stankovic et al. (2011) yang menyatakan bahwa kandungan fenolik tertinggi ada pada pelarut dengan kepolaran tinggi, sedangkan kandungan flavonoid tertinggi ada pada pelarut dengan kepolaran sedang. Etanol 70% adalah pelarut yang lebih polar dibandingkan dengan etanol 96%, sehingga senyawa fenolik akan cenderung untuk terlarut lebih banyak dalam etanol 70%, sedangkan senyawa flavonoid akan terlarut lebih banyak dalam etanol 96%.
Total fenolik untuk ekstrak etanol 96% dengan etanol 70% baik buah mentah maupun buah masak menunjukan data yang tidak berbeda nyata, sedangkan untuk ekstrak air kedua buah berbeda nyata. Jika dibandingkan antar jenis buah, maka ekstrak etanol 96% dan ekstrak etanol 70% buah mentah berbeda nyata dengan kedua ekstrak pada buah masak, namun tidak berbeda nyata untuk ekstrak air. Berdasarkan data total fenolik, ekstrak terbaik adalah ekstrak buah harendong mentah dengan pelarut etanol 70%.
Berdasarkan data total flavonoid, semua ekstrak menunjukan data yang berbeda nyata. Ekstrak etanol 96% buah mentah mengandung total flavonoid yang tertinggi dibandingkan dengan semua ekstrak, sedangkan ekstrak etanol 96% buah masak adalah ekstrak dengan total flavonoid tertinggi dibandingkan dengan buah masak dengan pelarut yang berbeda. Oleh karena itu, dapat dinyatakan bahwa total flavonoid lebih banyak terlarut dalam pelarut etanol 96% dan lebih banyak terkandung dalam buah mentah dibandingkan dengan buah masak.
Total fenolik dan total flavonoid dalam penelitian ini dikaitkan dengan aktivitas antioksidan. Senyawa radikal yang digunakan adalah DPPH sebagai senyawa radikal yang paling stabil. Prinsip dari pengukuran ini adalah kemampuan sampel dalam penangkap DPPH yang ditandai dengan perubahan warna dari ungu menjadi cokelat sampai kuning. Hasil uji aktivitas antioksidan berupa nilai IC50 yaitu konsentrasi penghabatan 50% senyawa radikal.
Berdasarkan data IC50 yang didapat, ekstrak buah harendong memiliki
kemampuan yang tinggi dalam menangkap radikal bebas dengan konsentrasi ekstrak yang rendah. Nilai IC50 terendah dimiliki oleh ekstrak etanol 70% buah
mentah, yaitu 0.01 ppm. Nilai IC50 ekstrak etanol 96% buah mentah sebesar 1.45
ppm. dan ekstrak etanol 70% buah masak sebesar 2.97 ppm yang tidak berbeda nyata dengan ekstrak etanol 70% buah mentah. Ekstrak lain memiliki nilai IC50
lebih besar dibandingkan ketiga ekstrak di atas, namun masih masuk ke dalam rentang nilai yang dianggap memiliki potensi sebagai antioksidan. Nilai kurang dari 200 ppm memiliki potensi sebagai antioksidan, sedangkan nilai IC50
antara 200-1000 ppm kurang aktif namun masih berpotensi sebagai zat antioksidan (Molyneux 2004). Berdasarkan nilai IC50 pada Tabel 4, aktivitas
antioksidan asam askorbat lebih rendah dibandingkan dengan ekstrak etanol 70% buah mentah.
Berdasarkan analisis data secara bivarian dengan software SPSS 18, maka korelasi total fenolik dan aktivitas antioksidan dalam IC50 serta korelasi total
flavonoid dan IC50 adalah berbanding terbalik. Hal ini karena koefisien korelasi
total fenolik dan IC50 maupun total flavonoid dan IC50 bernilai negatif, yaitu
12
Senyawa fenolik merupakan bagian dari buah yang penting karena dapat menunjukkan aktivitas antioksidan dengan menonaktifkan radikal bebas lipid atau mencegah dekomposisi hidroperoksida menjadi radikal bebas (Maisuthisakul et al. 2007). Senyawa ini termasuk senyawa antioksidan karena dapat menyumbangkan atom hidrogen atau elektron untuk radikal bebas (Bandoniene dan Murkovic 2002). Oleh karena itu, semakin tinggi total fenolik, maka semakin kecil nilai IC50 atau semakin besar aktivitas antioksidannya. Begitu pula dengan
total flavonoid. Flavonoid memiliki banyak fungsi, salah satunya adalah sebagai antioksidan (Crozier et al. 2006). Oleh karena itu, korelasi flavonoid dan IC50
berbanding terbalik atau dengan kata lain kandungan flavonoid yang tinggi memiliki aktivitas antioksidan yang tinggi.
Kemampuan ekstrak buah harendong sebagai antioksidan telah terbukti mampu menangkal radikal bebas sebesar 50% dengan konsentrasi < 200 ppm. Hasil dari uji ini biasanya akan diarahkan pada aplikasi. Oleh karena itu dibutuhkan uji lain untuk menduga efek farmakologi ekstrak yang diperoleh yang dinyatakan dengan nilai LC50. Pengujian ini telah banyak dihubungkan dengan sel
kanker pada manusia, tumor, dan leukemia sebagai pengujian awal aktivitas antikanker maupun antitumor. Larva udang Artemia salina Leach adalah organisme zoologi yang sederhana (berupa artropoda). Pemilihan larva udang sebagai objek percobaan ini karena larva udang tumbuh cepat, sederhana, dan tidak mahal. BSLT digunakan sebagai pengujian awal sitotoksisitas dari suatu ekstrak tanaman dan pengujian aktivitas pestisida dengan larva udang Artemia salina Leach. Sitotoksisitas dinyatakan dalam lethal concentration 50% (LC50).
Berdasarkan analisis statistika, data LC50 untuk ekstrak atanol 96% buah
mentah, ekstrak etanol 70% buah mentah, dan ekstrak etanol 70% buah masak berbeda nyata dengan ekstrak etanol 96% buah masak, ekstrak air buah mentah, dan ekstrak air buah masak. Namun, nilai LC50 semua ekstrak lebih dari 1000
ppm, sehingga dapat dinyatakan bahwa ekstrak buah harendong tidak bersifat toksik atau tidak aktif dalam membunuh sel kanker. Sampel dengan nilai LC50 <
200 ppm dalam bentuk ekstrak dan LC50 < 2 ppm dalam bentuk senyawa murni
dapat dinyatakan sebagai sifat toksik dengan keaktifan tinggi (Anderson et al.
1988).
SIMPULAN DAN SARAN
Simpulan
Ekstrak buah harendong mentah maupun masak mengandung alkaloid, triterpenoid, tanin, fenolik, dan flavonoid. Senyawa fenolik lebih larut dalam etanol 70% dan lebih banyak terkandung dalam buah mentah, sedangkan flavonoid lebih larut dalam etanol 96% dan lebih banyak terkandung dalam buah mentah. Buah harendong memiliki sifat antioksidan yang kuat dengan nilai IC50
13 Saran
Buah harendong mengandung senyawa bioaktif yang beragam, namun perlu diteliti lebih lanjut fungsi senyawa-senyawa tersebut juga mekanisme antioksidasi buah harendong secara in vivo.
DAFTAR PUSTAKA
Anderson JE, Chang CJ, McLaughlin JL. 1988. Bioactive component of
Allamanda schottii. J Nat Prod. 51:307-308.
[AOAC] Association of Official Analytical Chemist. 2006. Official Methods of Analysis. Washington DC (US): Association of Official Analytical Chemist. Aqil F, Ahmad I, Mehmood Z. 2006. Antioxidant and free radical scavenging
properties of twelve traditionally used Indian medicinal plants. Turk J Biol. 30:177-183.
Bandoniene D, Murkovic M, 2002. The detection of radical scavenging compounds in crude ekstract of Borage (Borago offivialis L.) by using en on-line HPLC-DPPH method. J Biochem Biophys Methods. 53:1-3.
[BPOM RI] Badan Pengawas Obat dan Makanan Republik Indonesia. 2004.
Ekstrak Tumbuhan Indonesia Vol. 2. Jakarta (ID): BPOM.
Chen HM, Koji M, Fumio Y, Kiyoshi N. 1996. Antioxidant activity of designed dalam teh. Majalah Kedokteran Indonesia. 52:361-364.
Cook NC, Samman S. 1996. Flavonoids- chemistry, metabolism,cardioprotective effects, and dietary sources. Nutritional Biochemistry. 7:66-76.
Crozier A, Clifford MN, Ashihara H. 2006. Plant Secondary Metabolites: Occurrence, Structure, and Role in the Human Diet. Lowa (US): Blackwell Publishing Ltd.
Harborne JB. 1987. Metode Fitokimia. Bandung (ID): Penerbit ITB.
Heldt HW. 2005. Plant Biochemistry. Third Edition. Burlington (US): Elsevier Academic Press.
Javanmardi J, Stushnoff C, Locke E, Vivanco JM. 2003. Antioxidant activity and total phenolic content of Iranian ocimum accessions. J Food Chem. 83:547-550.
Kim DO, Jeong SW, Lee CY. 2003. Antioxidant capacity of phenolic phytochemicals from various cultivars of plums. Food Chemistry. 81:321-326. Kumpulainen JT, Salonen JT. 1999. Natural antioxidants and anticarcinogens in
nutrition, health and disease. The Royal Society of Chemistry. 1:178-187. List PH, Schmidt PC. 1989. Phytopharmauceutical Technology. Boston (US):
CRC Press.
Maisuthisakul P, Suttajit M, Pongsawatmanit R. 2007. Assessment of phenolic content and free radical-scavenging capacity of some Thai indigenous plants.
Food Chemistry. 100:1409-1418.
Markham KR. 1988. Cara Mengidentifikasi Flavonoid. Bandung (ID): ITB. Padmawinata K, penerjemah. Terjemahan dari: PhytochemicalMethod.
14
Meyer BN, Ferrigni NR, Putman JE, Jacobson LB, Nichol DE, Mc Laughin JL. 1982. Brine Shrimps: A convenient general bioassay for active plant constituent. Planta Medica. 45:31-34.
Miyazaki H. 2000. Strenuous endurance training in humans reduces oxidative stress following exhausting exercise. European Journal of Applied Physiology.
84:1-6.
Molyneux P. 2004. The use of the stable free radicals diphenylpicrylhydrazyl (DPPH) for estimating antioxidant activity. Songklanakarin J Sci Technol.
26:211-219.
Munawaroh E. 1995. Pemanfaatan tumbuhan sebagai tanaman obat tradisional di Singkawang, Sambas, Kalimantan Barat. Di dalam: Prosiding Seminar dan Likakarya Etnobotani II. Yogyakarta, 24-25 Jan 1995. Yogyakarta: Ikatan Pustakawan Indonesia. Hlm: 145-151.
Park YS. 2008. Antioxidant and proteins in ethylene-treated kiwifruits. Food Chemistry. 107: 640-648.
Pine SH. 1988. Kimia Organik 2, diterjemahkan oleh Roehyati Joedodibroto dan Sasanti. Bandung (ID): ITB.
Purwanto Y, Walujo EB. 1992. Etnobotani suku Dani di lembah Baliem-Irian Jaya: suatu telaah tentang pengetahuan dan pemanfaatan sumber daya alam tumbuhan. Di dalam: Prosiding Seminar dan Lokakarya Nasional Etnobotani; Cisarua-Bogor, 19-20 Feb 1992. Bogor: Departemen Pendidikan dan Kebudayaan. hlm 132-148.
Sies H. 1985. Oxidative Stress. London (GB): Academic Press.
Sies H. 1991. Oxidative Stress: Oxidants and Antioxidants. London (GB): Academic Press.
Singleton VL, Orthofer R, Lamuela-Raventos RM. 1999. Analysis of total phenols and other oxidation substrates and antioxidants by means of Folin Ciocalteu reagent. Methods Enzymol. 299:152-178.
Stankovic MS, Niciforovic N, Topuzovic M, Solujic S. Total phenolic content, flavonoid noncentrations and antioxidant activity, of the whole plant and plant parts extracts from Teuchium montanum L. var. Montanum, F. supinum (L.) Reichenb [catatan penelitian]. 2011. Biotechnol. dan Biotechnol. Eq. 25:2222-2227.
Supari F. 1996. Radikal Bebas dan patofisiologi beberapa penyakit. Di dalam:
Prosiding Seminar Senyawa Radikal dan Sistem Pangan: Reaksi Biomolekuler, Dampak terhadap Kesehatan dan Penangkalan Jakarta, Des 1996. Bogor: Kerjasama Pusat Studi Pangan dan Gizi dengan Kedutaan Besar Perancis. Uji T. 1995. Pemanfaatan tumbuhan obat antimalaria pada beberapa suku di
Indonesia. Di dalam: Prosiding Seminar dan Lokakarya II; Yogyakarta, 24-25 Jan 1995. Yogyakarta: Ikatan Pustakawan Indonesia. hlm 89-95.
Wardah, Setyowati FM. 1995. Penelitian tumbuhan dalam pengobatan tradisional suku Dayak di kecamatan Beduai, Kalimantan Barat. Di dalam: Prosiding Seminar dan Lokakarya Etnobotani II; Yogyakarta, 24-25 Jan 1995. Yogyakarta: Ikatan Pustakawan Indonesia. hlm 152-160.
15
17 Lampiran 1 Diagram alir penelitian
Lampiran 2 Kadar air buah harendong
Sampel
Kadar air sampel segar Kadar air simplisia
Bobot
mentah 2000.5000 1511.9800 24.42
2.9925 2.8182 5.82
0.52
3.0010 2.7955 6.85
3.0007 2.8066 6.47
Rata-rata 24.42 6.38
Buah masak 2001.7200 1148.4100 57.37
3.3333 2.7078 18.77
Lampiran 3 Rendemen buah harendong
18
30.0020 24.4036 12.4000 50.8122
30.0005 24.4024 15.7570 64.5715
EtOH70% msk
30.0111 24.4110 12.0000 49.1582
46.89 2.47
30.0011 24.4029 10.8000 44.2570
30.0000 24.4020 11.5303 47.2514
Air msk
30.0010 24.4028 8.6047 35.2611
42.08 6.96
30.0023 24.4039 10.2000 41.7966
30.0008 24.4026 12.0000 49.1751
EtOH96% mth: ekstrak etanol 96% buah mentah, EtOH70% mth: ekstrak etanol 70% buah mentah, Air mth: ekstrak air buah mentah, EtOH96% msk: ekstrak etanol 96% buah masak, EtOH70% msk: ekstrak etanol 70% buah masak, Air msk: ekstrak air buah masak.
Contoh perhitungan: Lampiran 4 Hasil uji fitokimia
19 mth: ekstrak etanol 96% buah mentah, Air msk: ekstrak air buah masak, EtOH70% msk: ekstrak etanol 70% buah masak, EtOH96% msk: ekstrak etanol 96% buah masak.
0
Lampiran 5 Kurva standar asam galat
20
Contoh perhitungan : 1. Total fenolik ekstrak
Persamaan kurva standar asam galat : y=-0,0472+(9,5078. )x Absorbansi rata-rata= 0,0472+(9,5078. ) (total fenolik) 0.457 = -0,0472+(9,5078. ) (total fenolik)
c = konsentrasi total fenolik dari kurva standar V = volume ekstrak
m = berat ekstrak
Diketahui:c = 53.0301 mg/L, V = 10 ml = 0.01 L, m = 0.0129 g Total fenolik GAE (C) = 53.0301 mg/L (0.01 L/0.0112 g)
= 47.35 mg/g
Lampiran 6 Kandungan total fenolik ekstrak buah harendong
Ulangan
Absorbansi sampel
Buah mentah Buah masak
AB mth E70 mth E96 mth AB mtg E70 mtg E96 mtg
Total Fenolik (mg/L) 53.0301 210.5219 190.0124 51.9784 156.2506 134.4791
Total fenolik GAE
(mg/g) 47.35 189.66 160.15 41.25 123.03 108.45
Lampiran 7 Kurva standar katekin
21 Lampiran 8 Kandungan total flavonoid ekstrak buah harendong
Ulangan
Absorbansi sampel
Buah mentah Buah masak
AB mth E70 mth E96 mth AB mtg E70 mtg E96 mtg
(mg/g) 43.58 192.33 225.50 32.55 62.89 105.93
Contoh perhitungan : 1. Total flavonoid
Persamaan kurva standar katekin : y=0,0446+0,0131x Absorbansi rata-rata= 0,0446+0,0131(total flavonoid)
c = konsentrasi total flavonoid dari kurva standar V = volume ekstrak
m = berat ekstrak
Diketahui: c = 50.7939 mg/L, V = 20 ml = 0.02 L, m = 0.0233 g Total flavonoid CE (C) = 50.7939 mg/L (0.02 L/0.0233 g)
= 43.58 mg/g
Lampiran 9 Contoh perhitungan IC50 ekstrak buah harendong
1. % Inhibisi
% inhibisi = x 100%
=
x 100%
= 88.49%
Keterangan: = absorbansi DPPH setelah diinkubasi 20 menit
A = absorbansi sampel + DPPH setelah diinkubasi 20 menit 2. IC50
Y=0.24225+0.04245x
(% inhibisi) = 0.24225+0.04245(IC50)
IC50 =
=
22
Lampiran 10 Pengaruh konsentrasi ekstrak terhadap % inhibisi Ekstrak Etanol 96% Buah Mentah
Ekstrak Etanol 70% Buah Mentah
23 Ekstrak Air Buah Mentah
Ekstrak Etanol 96% Buah Masak
24
PLENO 1
Ekstrak Etanol 70% Buah MasakUlangan 1 Ulangan 2 Ulangan 3
Ekstrak Air Buah Masak
26
Lampiran 11 Contoh perhitungan LC50 ekstrak buah harendong
Y=-21.4286+14.2857x
% kematian=-21.4286+14.2857(log IC50) 50==-21.4286+14.2857(log IC50)
Log LC50 Log LC50= 5.0000 LC50= = 105 LC50=
= 3.1446.
Lampiran 12 Analisis statistika dengan SPSS 18 1. Analisis total fenolik
27 3. Analisis IC50
4. Korelasi IC50, total flavonoid, dan total fenolik
5. Analisis LC50
28
RIWAYAT HIDUP
Penulis dilahirkan di Metro, 18 Januari 1992 dari ayah Supandi dan Ibu Siti Ponisah. Penulis merupakan putri pertama dari dua bersaudara. Riwayat pendidikan penulis dimulai dari SDN 2 Cilangkahan, Provinsi Banten tahun 1997-2003, melanjutkan pendidikan ke SMPN 2 Panggarangan, Provinsi Banten tahun 2003-2006, dan menyelesaikan pendidikan menengah atas di SMAN 1 Malingping, Provinsi Banten tahun 2009. Pada tahun yang sama, penulis meneruskan pendidikan di Departemen Biokimia Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor. Pada saat semester 7, penulis melakukan praktik lapang di Laboratorium Research and Development (RnD) PT.
Saraswanti Indo Genetech dengan judul laporan “Homogenitas Kadar Pewarna