POTENSI FRAKSI AKTIF DAUN AMBALUN (Dysoxylum
acutangulum) SEBAGAI INSEKTISIDA BOTANI TERHADAP
Crocidolomia pavonana
AHMAD IZZUDDIN
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI
Dengan ini saya menyatakan bahwa tesis yang berjudul Potensi Fraksi Aktif
Daun Ambalun (Dysoxylum acutangulum) sebagai Insektisida Botani terhadap
Crocidolomia pavonana adalah karya saya dengan arahan dari Komisi Pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam daftar pustaka di bagian akhir tesis ini.
Bogor, Agustus 2011
ABSTRACT
AHMAD IZZUDDIN. Potential of Active Fractions of Dysoxylum acutangulum
Leaves as Botanical Insecticides against Crocidolomiapavonana. Under direction
ofSUMINAR S. ACHMADI and DJOKO PRIJONO.
The purpose of this study was to evaluate the insecticidal activity and
characterize active fraction of Dysoxylum acutangulum leaves. Extraction of D.
acutangulum leaves was done by two methods, i.e. sequential extraction using n -hexane, ethyl acetate, and methanol and direct extraction using methanol. In the sequential extraction, methanol fraction was the most active so that methanol extract from direct extraction was used in all further work. The direct methanol
extract was partitioned using n-hexane:methanol 95% (1:1). The direct methanol
extract of D. acutangulum leaves had strong insecticidal activity to Crocidolomia
pavonana larvae (LC50 = 0.24%, LC95 = 0.49%). Fractionation of this extract
using silica gel column chromatography yielded 10 fractions. Fraction 7 and 8 had
the strongest insecticidal activity to C. pavonana. Fraction 8 had lower LC50 and
LC95 (0.18% and 0.46%) than fraction 7. The result of phytochemical test, gas
chromatography-mass spectroscopy, and infrared spectroscopy analysis on fraction 8 showed that the fraction contains steroid compounds.
RINGKASAN
AHMAD IZZUDDIN. Potensi Fraksi Aktif Daun Ambalun (Dysoxylum
acutangulum) sebagai Insektisida Botani terhadap Crocidolomia pavonana.
Dibimbing olehSUMINAR S. ACHMADI dan DJOKO PRIJONO.
Ambalun (Dysoxylum acutangulum) merupakan salah satu tumbuhan famili
Meliaceae yang sangat potensial digunakan sebagai sumber insektisida botani. Beberapa informasi dasar tentang aktivitas ekstrak bagian tumbuhan tersebut telah diketahui. Ekstrak etanol kulit batang ambalun dilaporkan memiliki aktivitas
insektisida terhadap ulat krop kubis Crocidolomia pavonana. Fraksi kloroform
ekstrak daun dan rantingnya juga dilaporkan memiliki aktivitas yang tinggi
terhadap C. pavonana. Namun, senyawa aktif yang berperan belum diidentifikasi.
Oleh sebab itu tujuan penelitian ini ialah menguji aktivitas dan mengidentifikasi golongan senyawa aktif daun ambalun yang berpotensi sebagai insektisida botani
Ekstraksi daun ambalun dilakukan dengan metode perendaman melalui dua tahapan, yaitu ekstraksi bertingkat dan ekstraksi langsung dengan metanol dan partisi. Ekstraksi bertingkat dilakukan secara berurutan dengan tiga jenis pelarut
berdasarkan perbedaan kepolaran, yaitu n-heksana, etil asetat, dan metanol.
Ekstraksi ini menghasilkan rendemen ekstrak n-heksana, etil asetat, dan metanol
masing-masing 6.13%, 4.98%, dan 4.44%. Sementara itu, ekstraksi langsung dengan metanol menghasilkan rendemen 6.66%. Partisi menggunakan campuran
pelarut n-heksana dan metanol 95% dalam labu pemisah menghasilkan rendemen
ekstrak n-heksana-partisi dan metanol-partisi masing-masing 41.06% dan 64.38%.
Aktivitas insektisida uji dilakukan menggunakan metode residu pada daun
melalui dua tahapan, yaitu uji pendahuluan dan uji lanjutan. Larva instar 2 C.
pavonana digunakan sebagai serangga uji pada semua pengujian. Data mortalitas kumulatif sejak awal sampai 6 hari setelah perlakuan (HSP) diolah dengan analisis probit untuk menentukan hubungan antara konsentrasi ekstrak dan tingkat kematian larva. Analisis probit dilakukan dengan menggunakan program POLO-PC. Data lama perkembangan larva diolah dengan sidik ragam yang dilanjutkan dengan uji selang berganda Duncan pada taraf nyata 5%.
Ekstrak kasar teraktif difraksinasi menggunakan kromatografi kolom dengan fase diam silika gel. Fase gerak yang digunakan adalah eluen terbaik hasil
kromatografi lapis tipis, yaitu campuran n-heksana dengan aseton dengan nisbah
7:3. Fraksi hasil pemisahan kromatografi diuji aktivitas insektisidanya. Fraksi teraktif diidentifikasi berdasarkan hasil analisis dengan GC-MS dan FTIR.
Hasil uji pendahuluan dengan metode residu pada daun menunjukkan bahwa perlakuan dengan ekstrak metanol-partisi pada konsentrasi 0.5% dapat mematikan serangga uji 100%, sehingga ekstrak tersebut diuji lebih lanjut pada enam taraf konsentrasi. Uji lanjutan dilakukan dua kali dan hasilnya digabungkan. Penggabungan data hasil uji lanjutan pertama dan kedua dapat memperkecil
keragaman data. Mortalitas larva C. pavonana pada 1 HSP sangat rendah,
kemudian meningkat secara bertahap dari 2 HSP sampai 6 HSP dengan peningkatan mortalitas yang tajam terjadi antara 3 dan 4 HSP. Hasil analisis
probit menunjukkan bahwa LC50 dan LC95 terhadap instar 2+3 lebih kecil
3 masih terjadi peningkatan mortalitas yang cukup besar. LC50 dan LC95
partisi masing-masing 0.24% dan 0.49%. Perlakuan dengan ekstrak
metanol-partisi daun ambalun tidak hanya berpengaruh pada kematian larva C. pavonana
akibat toksisitas ekstrak uji, namun juga berpengaruh pada perkembangan larva.
Lama perkembangan larva C. pavonana akibat perlakuan dengan ekstrak daun
ambalun secara umum makin panjang dengan makin tingginya konsentrasi ekstrak uji.
Fraksionasi ekstrak daun ambalun dengan kromatografi kolom menghasilkan 10 fraksi. Hasil uji pendahuluan dengan metode residu pada daun menunjukkan bahwa fraksi 7 dan fraksi 8 pada konsentrasi 0.5% dapat mematikan serangga uji 100%, sehingga fraksi tersebut diuji lebih lanjut pada enam taraf konsentrasi. Fraksi 7 dan 8 yang diperoleh dari hasil fraksinasi ekstrak metanol daun ambalun memiliki aktivitas insektisida paling kuat di antara 10 fraksi yang
diperoleh. Nilai LC50 fraksi 8 lebih rendah daripada LC50 fraksi 7, sedangkan nilai
LC50 fraksi 7 lebih rendah daripada LC50 ekstrak daun ambalun. Namun nilai LC50
dan LC95 kedua fraksi tersebut tidak jauh berbeda dengan ekstrak metanol-partisi
sedangkan rendemen fraksi 7 dan 8 masing-masing hanya 5.92% dan 3.71%. Hal tersebut menunjukkan bahwa aktivitas insektisida ekstrak kasar bukan hanya disumbangkan oleh kedua fraksi tersebut tetapi juga oleh fraksi lain dan campuran berbagai komponen dalam ekstrak kasar kemungkinan bersifat sinergis.
Minyak mimba (Azadirachta indica, azadiraktin 6200 ppm) digunakan
sebagai pembanding positif ekstrak dan fraksi daun ambalun. Hasil uji pendahuluan dengan metode residu pada daun menunjukkan bahwa mimba pada
konsentrasi 0.5% dapat mematikan serangga uji lebih dari 90%. Nilai LC50 dan
LC95 mimba terhadap larva C. pavonana lebih kecil dibandingkan nilai LC50 dan
LC95 ekstrak dan fraksi daun ambalun. Hal ini kemungkinan toksisitas senyawa
aktif dalam minyak mimba, yaitu azadiraktin, lebih tinggi daripada senyawa aktif dalam ekstrak ambalun atau kandungan senyawa aktif dalam ekstrak ambalun lebih rendah daripada kandungan azadiraktin dalam minyak mimba yang digunakan.
Hasil pemeriksaan fitokimia pada fraksi 8 menunjukkan adanya senyawa triterpenoid dan steroid, tetapi hasil analisis dengan GC-MS dan FTIR hanya mendukung dugaan bahwa senyawa aktif yang bersifat insektisida dalam daun ambalun termasuk golongan steroid.
Kata kunci: Crocidolomia pavonana, Dysoxylum acutangulum, aktivitas
© Hak Cipta Milik IPB, tahun 2011
Hak Cipta dilindungi Undang-undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB.
POTENSI FRAKSI AKTIF DAUN AMBALUN (Dysoxylum
acutangulum) SEBAGAI INSEKTISIDA BOTANI TERHADAP
Crocidolomia pavonana
AHMAD IZZUDDIN
Tesis
Sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Program Studi Kimia
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
HALAMAN PENGESAHAN
Judul Tesis : Potensi Fraksi Aktif Daun Ambalun (Dysoxylum
acutangulum) sebagai Insektisida Botani terhadap Crocidolomia pavonana
Nama Mahasiswa : Ahmad Izzuddin
NRP : G451090031
Program Studi : Kimia
Disetujui Komisi Pembimbing
Prof. Dr. Ir. Suminar S. Achmadi Ir. Djoko Prijono, MAgrSc.
Ketua Anggota
Diketahui
Ketua Program Studi Kimia Dekan Sekolah Pascasarjana
Prof. Dr. Purwantiningsih Sugita, MS Dr. Ir. Dahrul Syah, M.Sc.Agr.
PRAKATA
Puji dan syukur penulis panjatkan ke hadirat Allah SWT atas rahmat dan karunia-Nya sehingga tesis ini dapat diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak Desember sampai Juli 2011 ini ialah Potensi
Fraksi Aktif Daun Ambalun (Dysoxylum acutangulum) sebagai Insektisida Botani
terhadap Crocidolomia pavonana.
Ucapan terima kasih yang tulus kepada Prof. Dr. Ir. Suminar S. Achmadi selaku Ketua Komisi Pembimbing, dan Ir. Djoko Prijono, MAgrSc. selaku Anggota Komisi Pembimbing, atas segala curahan waktu, bimbingan, arahan, serta dorongan moral kepada penulis, serta kepada Dr. Gustini Syahbirin, MS selaku penguji luar komisi yang telah memberikan saran untuk perbaikan tesis ini. Ucapan terima kasih juga penulis sampaikan kepada Pak Sobur, Bu Yeni, dan Pak Agus Sudrajat atas segala kerja sama yang diberikan.
Terima kasih tak terhingga penulis ucapkan kepada bapak, ummi, Kak Raihul Inayati, Maria Ulfa, S.Pd, M. Fathani, S.Pd.I, Adik Ulumuddin, Zainul Islam, dan ananda Ihdina atas doa, dukungan, kepercayaan, dan kasih sayang yang diberikan. Kepada Abdullah, M.Si., Achmad Muslim M.Si., Dadang Muhammad Hasyim, M.Si., Muslih Abdul Mujib, M.Si., Saipudin Rahmatullah, M.Si., dan teman-teman kimia angkatan 2009 penulis ucapkan terima kasih untuk segala bantuan, dan semangat yang diberikan. Serta rekan-rekan di Laboratorium Fisiologi dan Toksikologi Serangga Eka Candra Lina, M.Si., Herma Amalia, SP., Catur Hertika, S.Si., Nelly Nailufar, Ahmad Syifa, Hendi Irawan, Rizki
Arifiansyah, dan Sani Nihlatussania yang telah membantu memberi tenaga,
motivasi, saran, dan kebersamaan, penulis ucapkan terima kasih.
Penulis mengucapkan terima kasih kepada Kementerian Agama Republik Indonesia yang telah mendanai pendidikan penulis selama menjalani pendidikan
di Sekolah Pascasarjana Institut Pertanian Bogor. Semoga karya ilmiah ini bermanfaat.
Bogor, Agustus 2011
RIWAYAT HIDUP
Penulis dilahirkan di Bawak Bagik Desa Gunung Rajak, Kecamatan Sakra Barat, Kabupaten Lombok Timur pada tanggal 22 Agustus 1983 dari pasangan Bapak H. Abdul Wahab, A.Ma. dan Ibu Hj. Raihanun Ahmad. Penulis merupakan anak ketiga dari lima bersaudara.
DAFTAR ISI
Pengaruh Bahan Uji terhadap Lama Perkembangan Larva C. pavonana ... 18
Eluen Terbaik dalam Kromatografi Lapis Tipis ... 19
Fraksi Hasil Kromatografi Kolom ... 20
Toksisitas Fraksi Daun Ambalun ... 21
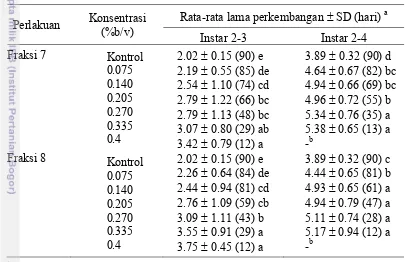
Pengaruh Fraksi 7 dan 8 Ambalun terhadap Lama Perkembangan Larva C. pavonana ... 24
Toksisitas Minyak Mimba ... 25
Pengaruh Pemberian Minyak Mimba terhadap Perkembangan Larva C. pavonana ... 27
Hasil Uji Fitokimia ... 28
Halaman
PEMBAHASAN ... 31
SIMPULAN DAN SARAN ... 36
DAFTAR PUSTAKA ... 37
DAFTAR TABEL
Halaman
1 Hasil uji pendahuluan pengaruh ekstrak daun ambalun terhadap
mortalitas larva C. pavonana ... 15
2 Penduga parameter regresi probit hubungan konsentrasi-mortalitas
ekstrak daun ambalun terhadap larva C.pavonana ... 18
3 Hubungan antara konsentrasi ekstrak metanol-partisi ambalun dan
lama perkembangan larva C. pavonana ... 19
4 Rendemen fraksi-fraksi ekstrak metanol-partisi daun ambalun hasil
kromatografi kolom ... 20
5 Hasil uji pendahuluan fraksi daun ambalun terhadap C. pavonana ... 21
6 Penduga parameter regresi probit hubungan konsentrasi-mortalitas
fraksi daun ambalun terhadap larva C. pavonana ... 24
7 Hubungan antara konsentrasi fraksi 7 dan 8 ambalun terhadap
lama perkembangan larva C. pavonana ... 25
8 Hasil uji pendahuluan minyak mimba terhadap C. pavonana ... 26
9 Penduga parameter regresi probit hubungan konsentrasi-mortalitas
minyak mimba terhadap larva C. pavonana ... 27
10Hubungan antara konsentrasi minyak mimba dan lama perkembangan
larva C. pavonana ... 28
DAFTAR GAMBAR
Halaman
1 Tumbuhan ambalun ... 4
2 Larva instar 3 Crocidolomia pavonana pada daun brokoli ... 5
3 Tingkat mortalitas larva akibat perlakuan ekstrak daun ambalun pada
uji lanjutan pertama (A); uji lanjutan kedua (B); gabungan uji lanjutan
pertama dan kedua (C) ... 17
4 Tingkat mortalitas larva C. pavonana akibat perlakuan fraksi 7 (A)
dan fraksi 8 (B) daun ambalun ... 23
5 Tingkat mortalitas larva C. pavonana akibat perlakuan minyak
mimba ... 26
6 Kromatogram GC-MS fraksi 8 daun ambalun ... 30
7 Spektrum FTIR fraksi 8 daun Ambalun ... 30
8
Struktur senyawa (23S)-etilkoles-5en-3β-ol ... 34DAFTAR LAMPIRAN
Halaman
1 Hasil determinasi tumbuhan ambalun ... 43
2 Uji fitokimia daun dan ekstrak ambalun ... 44
3 Diagram alir ekstraksi daun ambalun ... 45
4 Diagram alir ekstraksi langsung dan partisi daun ambalun ... 46
5 Diagram alir fraksionasi ekstrak teraktif dan identifikasi fraksi terpilih
daun ambalun ... 47
6 Kadar air daun ambalun ... 48
7 Kromatogram eluen terbaik ekstrak metanol-partisi dengan eluen n
-heksana:aseton 7:3 (a) dan fraksi hasil fraksionasi ekstrak metanol
daun ambalun (b) ... 48
8 Spektrum massa senyawa pada puncak dengan waktu retensi 23.56
PENDAHULUAN
Latar Belakang
Tumbuhan famili Meliaceae, Annonaceae, dan Piperaceae telah dikenal sebagai sumber insektisida botani yang potensial. Ekstrak berbagai jenis tumbuhan dalam famili tersebut memiliki aktivitas yang kuat terhadap serangga sehingga potensial untuk dikembangkan sebagai sumber insektisida botani
(Prijono et al. 2006). Salah satu marga dari famili Meliaceae yang mendapat
perhatian untuk diteliti aktivitas insektisidanya ialah Dysoxylum.
Masyarakat banyak menggunakan tumbuhan dalam genus ini sebagai obat tradisional, seperti distorsi wajah pada anak-anak, benjolan di bawah kulit, iritasi
kulit, dan sebagai obat untuk penyakit menular seksual (Laksmi et al. 2009).
Selain itu tumbuhan ini juga memiliki aktivitas sebagi racun ikan, antibakteri, dan analgesik. Berbagai senyawa kimia telah diisolasi dari genus ini, seperti terpenoid dan alkaloid. Terpenoid dari genus ini dilaporkan sitotoksik serta memiliki
aktivitas antitumor, antimakan, dan antibakteri (Fujioka et al. 1998; Luo et al.
2002; He et al. 2011), sedangkan senyawa alkaloidnya menunjukkan aktivitas
antiinflamasi dan imunomodulator (Naik et al. 1988).
Ekstrak metanol daun Dysoxylum malabaricum menunjukkan aktivitas
insektisida dan antioviposisi yang kuat terhadap nyamuk Anopheles stephensi
(Nathan et al. 2006). Selain itu senyawa 3β,24,25-trihidroksisikloartan dan
bedomilakton dari D. malabaricum dan D. beddomei mempengaruhi potensi
reproduksi nyamuk Anopheles stephensi dengan bertindak sebagai pencegah
oviposisi. Aktivitas hayati yang tinggi dari D. malabaricum dan D.beddomei bisa
dijadikan sebagai landasan dalam pengembangan bahan tumbuhan tersebut
sebagai insektisida botani (Nathan et al. 2008).
Penelitian aktivitas ekstrak tumbuhan ambalun (Dysoxylum acutangulum)
terhadap serangga masih terbatas di dalam negeri. Beberapa informasi dasar tentang aktivitas ekstrak bagian tumbuhan tersebut telah diketahui. Ekstrak etanol
kulit batang tumbuhan ini dilaporkan memiliki aktivitas insektisida terhadap C.
binotalis dengan LC50 112.2 ppm (Prijono et al. 1999). Sementara itu, salah satu
2
pavonana dengan LC50 6.6 ppm (Prijono et al. 2001). Fraksi kloroform ekstrak
daun dan rantingnya juga dilaporkan memiliki aktivitas yang tinggi terhadap C.
pavonana (Aliyah et al. 2001).
Senyawa aktif insektisida yang terkandung di dalam bagian tumbuhan
ambalun belum pernah dilaporkan, namun Nishizawa et al. (1983) telah
mengidentifikasi senyawa (+)-8-hidroksikalamenena (golongan seskuiterpena fenol) yang terkandung dalam biji ambalun sebagai senyawa aktif racun ikan dan
antibakteri. Selain itu, Ismail et al. (2009b) telah mengisolasi dua senyawa
triterpenoid baru dari daun ambalun, yaitu senyawa akutaksilina A dan B. Penelitian yang sudah dilakukan menunjukkan senyawa akutaksilina B aktif sebagai antikanker, sedangkan aktivitasnya sebagai insektisida belum pernah diuji. Syahputra (2001) melaporkan bahwa ekstrak etanol dan metanol kulit batang serta ekstrak metanol ranting dan daun ambalun memiliki aktivitas
insektisida yang kuat terhadap C. pavonana, tetapi senyawa aktif yang berperan
belum diidentifikasi. Berdasarkan paparan tersebut, perlu dilakukan penelitian
tentang aktivitas insektisida daun ambalun terhadap C. pavonana disertai dengan
identifikasi golongan senyawa aktifnya.
Tujuan Penelitian
Tujuan penelitian ini adalah menguji aktivitas dan mengidentifikasi golongan senyawa aktif daun ambalun yang berpotensi sebagai insektisida botani.
Manfaat Penelitian
Hasil penelitian ini diharapkan dapat memberikan informasi tentang potensi dan ciri senyawa bioaktif daun ambalun sebagai insektisida botani yang efektif dan ramah lingkungan.
TINJAUAN PUSTAKA
Senyawa Aktif dan Potensi Insektisida Genus Dysoxylum
Penelitian tentang aktivitas tumbuhan Meliaceae selama hampir 40 tahun terakhir telah menghasilkan banyak informasi baru. Hasil-hasil penelitian menunjukkan bahwa ekstrak dan/atau bahan aktif dari tidak kurang 54 jenis tumbuhan Meliaceae memiliki aktivitas pada berbagai serangga. Keseluruhan
tumbuhan tersebut tercakup dalam 16 marga, antara lain Dysoxylum. Ekstrak atau
senyawa aktif dari tumbuhan tersebut dapat bersifat insektisida, antimakan, dan
penghambat perkembangan (Isman 1995; Mikolajczak et al. 1989; Nathan et al.
2008; Prijono et al. 2000).
Berbagai senyawa aktif dari tumbuhan marga Dysoxylum telah berhasil
diisolasi dan diidentifikasi, di antaranya senyawa aktif nimania-3 dari tumbuhan
D. malabaricum. Senyawa ini memiliki aktivitas antimakan dan insektisida yang
kuat terhadap serangga Pericillia riicini. Aktivitas insektisidanya hampir sama
dengan senyawa aktif azadiraktin-A tetapi dengan konsentrasi dua kali lipat
(Govindachari et al. 1999). Senyawa aktif lainnya adalah homoritrinan dan
dibenzazekina yang diisolasi dari tumbuhan D. lenticellare, yang memiliki
aktivitas sebagai insektisida terhadap larva Lucilia cuprina (Hart et al. 2001).
Senyawa aktif disoksilumin yang diisolasi dari batang tumbuhan D. hainannense
memiliki aktivitas antimakan terhadap larva Pieris rapae (Luo et al. 2002).
Nathan et al. (2009) melaporkan bahwa triterpena 3β,24,25-trihidroksisikloartan
dan bedomilakton dari tumbuhan D. malabaricum dan D. beddomei memiliki
aktivitas antimakan dan penghambat pertumbuhan yang kuat terhadap larva Cnaphalocrocis medinalis.
Ambalun (Dysoxylum acutangulum)
Bioekologi
4
membalun, kayu kubu (Kalimantan); kayu trembalo, tembalo (Jawa); dan ngersaweran (Kepulauan Aru) (Heyne 1987).
Gambar 1 Tumbuhan ambalun
Dari daun dan kulit batang ambalun telah diisolasi dan diperoleh empat alkaloid kromona baru, yaitu krotakumina A-D, yang terdiri atas
5,7-dihidroksi-metilkromon, cincin N-Me piperidina, dan rantai samping ester (Ismail et al.
2009a). Selain itu, dari hasil isolasi daun diperoleh dua jenis terpenoid, yaitu
akutaksilina A dan B dimana akutaksilina B menunjukkan aktivitas sitotoksik in
vitro terhadap sel leukemia premilostik darah manusia, sedangkan akutaksilina A
tidak menunjukkan aktivitas tersebut (Ismail et al. 2009b).
Potensi Insektisida Botani
Tumbuhan ambalun memiliki berbagai aktivitas hayati, salah satunya aktivitas terhadap serangga. Beberapa informasi dasar tentang aktivitas ekstrak bagian tumbuhan tersebut telah diketahui. Ekstrak etanol kulit batang tumbuhan ini dilaporkan memiliki aktivitas penghambat perkembangan serangga yang kuat
terhadap C. pavonana [binotalis] dengan LC50 112 ppm (Prijono et al. 1999).
Lebih lanjut Prijono et al. (2000) melaporkan bahwa ekstrak kulit batang
tumbuhan ini bekerja terutama dengan menghambat perkembangan serangga yang
terkait dengan proses ganti kulit dan metamorfosis. Prijono et al. (2001) juga
melaporkan bahwa salah satu fraksi aktif kulit batang ambalun memiliki aktivitas
yang tinggi terhadap larva C. pavonana dengan LC50 6.6 ppm. Fraksi kloroform
5
sampai 100% dengan LC50 108 ppm (Aliyah et al. 2001). Syahputra (2001) juga
melaporkan ekstrak metanol dan etanol kulit batang ambalun memiliki aktivitas
insektisida terhadap C. pavonana lebih kuat dibandingkan dengan ekstrak metanol
ranting dan daun ambalun.
Crocidolomia pavonana (Lepidotera: Crambidae)
Crocidolomia pavonana (Gambar 2) yang sebelumnya dikenal sebagai C. binotalis merupakan salah satu hama utama yang menyerang tanaman Brassicaceae, seperti kubis, kubis bunga, kubis cina, mostar, lobak, dan sawi liar (Kalshoven 1981). Hama ini diklasifikasikan ke dalam kelas Heksapoda, ordo
Lepidoptera, famili Crambidae, genus Crocidolomia, spesies C. pavonana.
Daerah persebaran meliputi Asia Selatan, Asia Tenggara, Afrika Selatan, Australia, dan beberapa Kepulauan di Samudera Pasifik. Di Pulau Jawa, serangga ini ditemukan baik di dataran rendah maupun di dataran tinggi (Kalshoven 1981).
Gambar 2 Larva instar 3 Crocidolomia pavonana pada daun brokoli
Perkembangan C. pavonana bertipe holometabola (metamorfosis sempurna)
6
Setelah melewati fase telur, larva keluar dari telur. Fase larva C. pavonana
selama perkembangannya melewati empat instar. Larva instar 1 berwarna hijau kekuning-kuningan pada bagian tubuhnya berukuran panjang 0.1 cm, kepala dan toraks berwarna cokelat tua. Larva instar 2 berwarna hijau dan pada bagian kepala terdapat garis melintang berwarna cokelat. Larva instar ini mulai aktif dan menyebabkan kerugian. Larva instar 3 mempunyai tiga garis memanjang pada bagian dorsal dan satu garis putih memanjang pada bagian sisi tubuh. Larva instar 4 berwarna hijau dengan panjang 12-25 mm dan lebar 1.5-2.0 mm (Prijono & Hassan 1992).
Fase pupa berlangsung dengan cara membentuk benang sutera untuk melindungi tubuhnya. Menurut Prijono & Hassan (1992), fase pupa berlangsung selama 11-13 hari. Setelah itu terbentuk imago yang bersifat nokturnal (Kalshoven 1981). Imago ini memiliki toraks berwarna gelap dan abdomen berwarna merah kecokelatan. Imago jantan mudah dikenal dengan adanya sisik berwarna gelap/hitam pada tepi interior sayap depan. Rentang sayap imago betina sekitar 25 mm sedangkan imago jantan sekitar 24 mm. Ukuran tubuh imago jantan lebih panjang (sekitar 11.4 mm) daripada yang betina (sekitar 9.6 mm). Imago betina yang diberi makan larutan madu 10% menghasilkan telur 35-459 butir dan dapat hidup selama 1-2 minggu. Siklus hidup imago betina sekitar 23-28 hari, sedangkan imago jantan sekitar 24-29 hari (Prijono & Hassan 1992).
Larva C. pavonana sering digunakan sebagai hewan uji dalam pengujian
terhadap senyawa insektisida. Syahputra et al. (2004) menggunakan larva ini
untuk menguji aktivitas ekstrak etanol bagian tumbuhan Calophyllum soulattri.
Prijono et al. (2006) menggunakan larva ini untuk menguji aktivitas insektisida 43
jenis tumbuhan dari lima famili tumbuhan.
Tanaman yang bersifat insektisida terhadap hama C. pavonana sudah
banyak ditemukan, di antaranya tanaman famili Annonaceae seperti srikaya, famili Meliaceae seperti mimba, serta famili Piperaceae seperti cabai jawa. Perlakuan dengan ekstrak tersebut pada konsentrasi tidak lebih dari 0.5% dapat
BAHAN DAN METODE
Tempat Penelitian
Penelitian dilakukan di Laboratorium Kimia Organik, Departemen Kimia FMIPA dan Laboratorium Fisiologi dan Toksikologi Serangga, Departemen Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian Bogor (IPB).
Serangga Uji
Serangga yang digunakan dalam pengujian ini adalah larva Crocidolomia
pavonana, yang diperoleh dari perbanyakan di Laboratorium Fisiologi dan Toksikologi IPB. Serangga tersebut dipelihara menurut cara seperti yang diuraikan oleh Prijono & Hassan (1992).
Bahan Tanaman Uji
Bahan tanaman yang digunakan adalah daun ambalun (Dysoxylum
acutangulum) tua tetapi masih berwarna hijau, yang berasal dari Hutan Penelitian Yan Lappa, Desa Tepos, Kecamatan Jasinga, Kabupaten Bogor. Untuk keperluan identifikasi tanaman, sampel tanaman dikirim ke Herbarium Bogoriense, Bogor. Hasil identififikasi tanaman ditunjukkan pada Lampiran 1. Pada tahap awal daun ambalun dibersihkan dengan air kemudian dikeringudarakan tanpa terkena cahaya matahari langsung. Setelah kering, daun dihaluskan dengan menggunakan mesin penghancur hingga diperoleh serbuk.
Penyiapan Tanaman Pakan
Daun brokoli yang digunakan sebagai pakan berasal dari penanaman di polybag (kantung plastik hitam). Benih brokoli disemai pada nampan semai 50 lubang yang diisi media semai Super Metan. Pemupukan dengan pupuk majemuk pelepasan perlahan NPK 22-8-4 (“Dekastar”) dilakukan bersamaan dengan penyemaian, dengan dosis satu butir per lubang tanam. Bibit brokoli yang
berumur 4 minggu setelah semai dipindahkan ke polybag kapasitas 5 liter yang
8
pengendalian hama secara mekanis jika ditemukan hama pada tanaman. Tanaman
yang berumur sekitar 2 bulan digunakan sebagai sumber pakan larva C. pavonana.
Penentuan Kadar Air Daun Ambalun
Cawan porselin dikeringkan pada suhu 105 °C dalam oven selama 30 menit, kemudian didinginkan dalam eksikator dan ditimbang. Sebanyak 2 g daun ambalun dimasukkan ke dalam cawan dan dipanaskan dalam oven pada suhu 105 °C selama 3 jam, kemudian cawan diangkat dan didinginkan dalam eksikator selama 30 menit. Cawan dengan sampel ditimbang hingga diperoleh bobot konstan (AOAC 2006). Persentase kadar air ambalun dihitung dengan persamaan:
Kadar air (%) = × 100%
a = bobot sampel sebelum dikeringkan (g).
b = bobot sampel setelah dikeringkan (g).
Uji Fitokimia Daun dan Ekstrak Ambalun
Uji fitokimia dilakukan mengacu pada Harborne (1987). Kelompok senyawa yang ingin diketahui dalam pengujian ini ialah alkaloid, flavonoid, tanin, saponin, kuinon, triterpenoid, dan steroid. Sampel yang diuji ialah serbuk daun, ekstrak daun, dan fraksi teraktif daun ambalun.
Uji Alkaloid
Sebanyak 500 mg sampel dilarutkan dalam 5 mL kloroform dan dibasakan
dengan beberapa tetes NH4OH, kemudian disaring ke dalam tabung reaksi.
Ekstrak kloroform kemudian ditambahi 10 tetes H2SO4 2 M lalu dikocok sehingga
terbentuk dua lapisan. Lapisan asam kemudian diteteskan pada pelat tetes dan diuji berturut-turut dengan pereaksi Meyer, pereaksi Wagner, dan pereaksi Dragendrof. Uji positif bila didapat endapan berturut-turut putih, cokelat, dan merah jingga.
Uji Flavonoid
9 Mg, 1 mL HCl pekat, dan 1 mL amil alkohol kemudian dikocok dengan kuat. Uji positif ditandai dengan munculnya warna merah, kuning atau jingga pada lapisan amil alkohol.
Uji Tanin
Sebanyak 500 mg sampel ditambahkan ke dalam 50 mL air panas dan
dididihkan selama 15 menit lalu disaring. Filtratnya ditambahi 10 mL FeCl3 1%.
Uji positif ditandai dengan munculnya warna hijau kehitaman.
Uji Saponin
Pada 500 mg sampel ditambahkan 10 mL air panas dan dididihkan selama 5 menit lalu disaring. Sebanyak 10 mL fitrat dikocok dalam tabung reaksi tertutup selama 10 detik kemudian dibiarkan selama 10 menit. Adanya saponin ditunjukkan dengan terbentuknya buih yang stabil.
Uji Kuinon
Sebanyak 500 mg sampel ditambahkan ke dalam 10 mL air panas dan dididihkan selama 5 menit lalu disaring. Filtratnya ditambahi 3 tetes NaOH. Uji positif ditandai dengan munculnya endapan merah.
Uji Triterpenoid dan Steroid
10
Ekstraksi Daun Ambalun
Ekstraksi Bertingkat dengan Tiga Jenis Pelarut
Ekstraksi daun ambalun dilakukan secara berurutan dengan tiga jenis pelarut
berdasarkan perbedaan kepolaran, yaitu n-heksana, etil asetat, dan metanol. Pada
tahap pertama, 1 kg serbuk daun ambalun diekstraksi dengan maserasi
menggunakan pelarut n-heksana (1:10 b/v) selama 24 jam. Hasil rendaman
disaring untuk memisahkan filtrat dan residunya. Residu direndam kembali hingga larutan hasil penyaringan berwarna pudar (tidak berwarna). Seluruh filtrat hasil maserasi ditambahi natrium sulfat anhidrat, kemudian diuapkan sehingga
didapatkan ekstrak n-heksana, sedangkan residunya diangin-anginkan agar
terbebas dari n-heksana. Residu kering dimaserasi dengan etil asetat, kemudian
disaring. Residu diekstraksi ulang dengan etil asetat hingga filtrat hasil penyaringan tidak berwarna. Filtrat yang dihasilkan ditambahi natrium sulfat anhidrat, kemudian diuapkan sehingga didapatkan ekstrak etil asetat, sedangkan residunya di angin-anginkan agar terbebas dari etil asetat. Pada tahap terakhir, residu kering dimaserasi dengan metanol. Hasil rendaman disaring, kemudian dimaserasi kembali hingga filtratnya tidak berwarna. Seluruh filtrat ditambah natrium sulfat anhidrat, kemudian diuapkan sehingga didapatkan ekstrak metanol. Diagram alir ekstraksi ditunjukkan pada Lampiran 3.
Ekstraksi Langsung dengan Metanol dan Partisi
Sebanyak 300 g serbuk daun ambalun dimaserasi dalam pelarut metanol dengan nisbah 1:10 (%b/v) selama 24 jam. Hasil rendaman disaring untuk memisahkan filtrat dan residunya. Residu direndam kembali hingga larutan hasil penyaringan berwarna pudar (tidak berwarna). Seluruh filtrat diuapkan sehingga didapatkan ekstrak metanol. Ekstrak pekat yang dihasilkan dipartisi dalam
campuran pelarut n-heksana dan metanol 95% dalam labu pemisah. Fase metanol
dan fase n-heksana dipisah kemudian masing-masing diuapkan sehingga
didapatkan ekstrak n-heksana dan metanol hasil partisi. Diagram alir ekstraksi
11
Rendemen ekstrak (%) =
a : bobot ekstrak (g).
b : bobot sampel kering (g).
ka : kadar air.
Uji Aktivitas Insektisida Pengujian Awal
Metode pengujian yang digunakan adalah metode residu pada daun (Prijono et al. 2001). Pada tahap awal setiap ekstrak diuji pada konsentrasi 0.1% dan 0.5%
dengan tiga ulangan, dan pada setiap ulangan digunakan 15 ekor larva instar II C.
pavonana. Ekstrak n-heksana dan ekstrak etil asetat dilarutkan dalam pelarut aseton, sedangkan ekstrak metanol dilarutkan dalam pelarut aseton-metanol (3:1). Larutan ekstrak dioleskan pada kedua sisi permukaan potongan daun brokoli (diameter 3 cm) masing-masing sebanyak 25 µL dengan menggunakan mikrosemprit. Daun kontrol diolesi dengan pelarut saja dengan cara dan volume yang sama. Setelah kering, dua potong daun dimasukkan ke dalam cawan petri
(diameter 9 cm) yang telah dialasi kertas tisu, kemudian 15 ekor larva C.
pavonana yang baru ganti kulit dimasukkan ke dalam cawan petri tersebut. Larva dibiarkan makan daun perlakuan selama 48 jam, selanjutnya daun diganti dengan daun segar yang bebas pestisida. Larva yang bertahan hidup dipelihara sampai instar IV, sementara jumlah larva yang mati dicatat setiap hari.
Pengujian Lanjutan
Ekstrak yang paling aktif diuji lebih lanjut pada enam taraf konsentrasi yang diharapkan dapat mengakibatkan kematian antara 0% dan 100% (ditentukan berdasarkan uji pendahuluan). Konsentrasi yang digunakan adalah 0.1%, 0.18%, 0.26%, 0.34%, 0.42%, dan 0.5% untuk ekstrak dan 0.075%, 0.140%, 0.205%, 0.270%, 0.335%, dan 0.4% untuk fraksi. Cara pengujian dan pengamatan sama seperti pada uji pendahuluan. Setiap taraf konsentrasi dan kontrol dalam uji lanjutan terdiri atas enam ulangan, dan pada setiap ulangan digunakan 15 ekor
larva C. pavonana. Larva yang mati dicatat setiap hari dan larva yang bertahan
12
Data mortalitas kumulatif sejak awal perlakuan diolah dengan analisis probit (Finney 1971) untuk menentukan hubungan antara konsentrasi ekstrak dan tingkat kematian larva. Analisis probit dilakukan dengan menggunakan program POLO-PC (LeOra Software 1987). Data lama perkembangan larva diolah dengan sidik ragam yang dilanjutkan dengan uji selang berganda Duncan pada taraf nyata 5%.
Uji Pembanding Positif Minyak Mimba
Minyak mimba yang digunakan sebagai uji pembanding positif merupakan formulasi insektisida botani berbentuk cair. Metabolit sekunder utama yang berfungsi sebagai insektisida pada minyak mimba ialah azadiraktin yang terbentuk secara alami dan tergolong dalam senyawa tetranotriterpenoid. Kadar azadiraktin dalam minyak mimba yang digunakan adalah 6200 ppm.
Pengujian dilakukan melalui dua tahapan, yaitu uji pendahuluan dan uji lanjutan. Konsentrasi yang digunakan pada uji pendahuluan ialah 0.05%, 0.1%, dan 0.5%, sedangkan konsentrasi yang digunakan pada uji lanjutan ialah 0.1%, 0.18%, 0.26%, 0.34%, 0.42%, dan 0.5%. Cara pengujian dan pengamatan sama seperti pada uji aktivitas ekstrak ambalun. Data mortalitas kumulatif sejak awal perlakuan diolah dengan analisis probit (Finney 1971) untuk menentukan hubungan antara konsentrasi ekstrak dan tingkat kematian larva. Analisis probit dilakukan dengan menggunakan program POLO-PC (LeOra Software 1987). Data lama perkembangan larva diolah dengan sidik ragam yang dilanjutkan dengan uji selang berganda Duncan pada taraf nyata 5%.
Fraksionasi Ekstrak Teraktif dan Pencirian Fraksi Terpilih
Ekstrak kasar teraktif sebanyak 4 g difraksionasi menggunakan kromatografi kolom dengan fase diam silika gel. Fase gerak yang digunakan
adalah eluen n-heksana, aseton, dan metanol dengan metode step gradient
13 diidentifikasi berdasarkan data spektroskopi MS dan FTIR. Spektroskopi GC-MS yang digunakan ialah spektrofotometer massa Agilent Technologies 5973 Auto Sampler GC dan 6890 MSD (GC-MS). Alat ini menggunakan
Hewlett-Packard ultra 5 capilarry coloumn (0.25 mm × 30 m × 0.25 μm) sebagai fase diam
dan gas helium sebagai fase gerak. Alat dikondisikan pada suhu awal 100 °C
selama 5 menit kemudian dinaikkan sampai 330 °C dengan laju 4 °C/menit.
Volume injeksi 1 μL dan nisbah celah104:1. Spektroskopi FTIR yang digunakan
HASIL
Ekstrak Daun Ambalun
Daun ambalun dengan kadar air 6.48% (Lampiran 6) yang diekstraksi secara
bertingkat menggunakan tiga jenis pelarut, yaitu n-heksana, etil asetat, dan
metanol, memiliki hasil ekstrak (rendemen) yang beragam. Ekstrak n-heksana
yang diperoleh sebesar 62.3862 g (6.13%), ekstrak etil asetat 45.1684 g (4.98%), dan metanol 37.9333 g (4.44%).
Daun ambalun yang diekstraksi langsung dengan pelarut metanol menghasilkan ekstrak 18.6122 g (6.66%). Ekstrak metanol sebanyak 17.5103 g
dipartisi dalam campuran metanol 95% dan n-heksana. Setelah kedua fase tersebut
dipisahkan diperoleh ekstrak metanol dan ekstrak n-heksana masing-masing
sebesar 10.5831 dan 6.7234 g dengan rendemen 64.38% dan 41.06% terhadap ekstrak metanol-partisi.
Toksisitas Ekstrak Ambalun Uji Pendahuluan
Hasil uji pendahuluan dengan metode residu pada daun menunjukkan bahwa perlakuan dengan ekstrak metanol-partisi pada konsentrasi 0.5% dapat mematikan
serangga uji 100%. Fraksi n-heksana dan n-heksana-partisi pada konsentrasi 0.5%
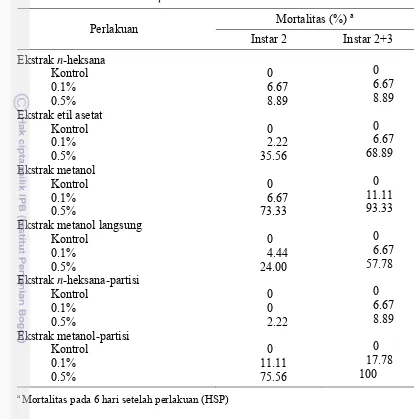
mengakibatkan kematian serangga uji tidak lebih dari 9%. Ekstrak etil asetat hasil ekstraksi bertingkat dan ekstrak metanol sebelum dipartisi pada konsentrasi 0.5% mengakibatkan kematian serangga uji sekitar 69% dan 58% (Tabel 1).
15
Tabel 1 Hasil uji pendahuluan pengaruh ekstrak daun ambalun terhadap
mortalitas larva C. pavonana
Perlakuan Mortalitas (%)
a
Instar 2 Instar 2+3
Ekstrak n-heksana
Kontrol
Ekstrak n-heksana-partisi
Kontrol
a Mortalitas pada 6 hari setelah perlakuan (HSP)
Uji Lanjutan
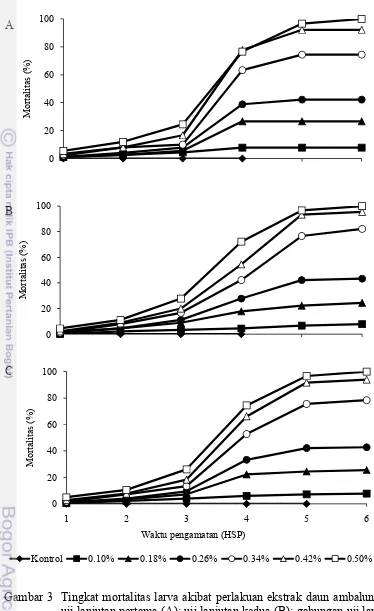
Hasil uji lanjutan pertama menunjukkan bahwa mortalitas larva C.
pavonana pada 1 hari setelah perlakuan (HSP) sangat rendah, kemudian meningkat secara bertahap pada 2 HSP. Perlakuan dengan ekstrak daun ambalun tidak segera mematikan larva uji. Kematian larva selalu terjadi menjelang atau pada saat ganti kulit. Secara visual, larva gagal melepas kutikula instar sebelumnya dan akhirnya mati.
16
beberapa hari berikutnya. Pada konsentrasi 0.1% dan 0.18% tingkat kematian larva mendekati nilai konstan sejak 4 HSP hingga akhir pengamatan. Sementara itu, pada konsentrasi lainnya, tingkat kematian larva mendekati konstan sejak 5 HSP (Gambar 3A).
Perlakuan ekstrak uji pada konsentrasi 0.1%-0.5% mengakibatkan mortalitas larva 4.44%-24.44% pada 3 HSP dan mortalitas meningkat menjadi 7.78%-100% pada 6 HSP. Secara umum tingkat kematian larva meningkat dengan
semakin tingginya konsentrasi. LC50 dan LC95 ekstrak daun ambalun terhadap
larva instar 2+3 (Tabel 2) lebih rendah dibandingkan dengan nilainya terhadap larva instar 2.
Hasil uji lanjutan kedua tidak berbeda jauh dengan hasil uji lanjutan yang pertama. Tingkat kematian larva pada uji lanjutan kedua juga berbanding lurus dengan konsentrasi ekstrak uji. Semakin tinggi konsentrasi ekstrak, semakin tinggi kematian larva uji. Selain itu, kematian larva uji pada setiap konsentrasi meningkat sesuai dengan lama hari setelah pengamatan. Pada konsentrasi 0.18% sampai 0.5% peningkatan kematian larva uji paling nyata terjadi pada 4 HSP, sedangkan pada konsentrasi 0.1% kematian larva uji rata-rata terjadi setiap hari (Gambar 3B).
LC50 dan LC95 ekstrak daun ambalun pada pengujian kedua ini tidak
berbeda jauh nilainya dibandingkan dengan nilai LC50 dan LC95 pada pengujian
pertama (Tabel 2). Nilai LC50 dan LC95 ekstrak daun ambalun terhadap larva
instar 2+3 pada pengujian kedua ini sebesar 0.23% dan 0.47%, yang juga lebih rendah daripada nilainya terhadap larva instar 2, yaitu 0.34% dan 0.75% (Tabel 2).
17
Gambar 3 Tingkat mortalitas larva akibat perlakuan ekstrak daun ambalun pada uji lanjutan pertama (A); uji lanjutan kedua (B); gabungan uji lanjutan pertama dan kedua (C).
0
Kontrol 0.10% 0.18% 0.26% 0.34% 0.42% 0.50%
A
B
18
Tabel 2 Penduga parameter regresi probit hubungan konsentrasi-mortalitas
ekstrak daun ambalun terhadap larva C.pavonana.
Uji lanjutan
a a = intersep regresi probit; b = kemiringan regresi probit; GB = galat baku; SK = selang
kepercayaan.
Pengaruh Bahan Uji terhadap Lama Perkembangan Larva C. pavonana Perlakuan dengaan ekstrak metanol-partisi ambalun tidak hanya
berpengaruh pada kematian larva C. pavonana, namun juga berpengaruh pada
perkembangan larva (Tabel 3). Perkembangan larva tersebut berkaitan dengan kemampuan larva berkembang menjadi instar berikutnya. Lama perkembangan larva instar 2-4 yang diberi ekstrak daun ambalun konsentrasi 0.5% tidak dapat ditentukan karena tidak satu pun larva uji yang mampu hidup dan berkembang hingga instar 4. Hal ini terjadi pada uji lanjutan pertama dan kedua.
19 Tabel 3 Hubungan antara konsentrasi ekstrak metanol-partisi ambalun dan lama
perkembangan larva C. pavonana
Perlakuan Konsentrasi
(%b/v)
Rata-rata lama perkembangan ± SD (hari) a
Instar 2-3 Instar 2-4
SD = standar deviasi. Rataan pada lajur yang sama yang diikuti oleh huruf yang sama tidak berbeda nyata berdasarkan uji rentang berganda Duncan (α = 0.05). Angka dalam kurung menunjukkan jumlah larva yang bertahan hidup.
b
Tidak ada larva yang berkembang sampai instar 4.
Eluen Terbaik dalam Kromatografi Lapis Tipis
Eluen terbaik dipilih menggunakan pelat KLT aluminium dengan ukuran 1
cm × 10 cm. Jarak pergerakan eluen 7.5 cm. Pelat KLT diaktifkan terlebih dahulu
pada suhu 105 °C selama 30 menit. Ekstrak metanol-partisi yang sudah dilarutkan menggunakan metanol ditotolkan pada pelat KLT menggunakan eluen tunggal maupun campuran. Eluen tunggal terdiri atas metanol, etanol, aseton,
diklorometana, kloroform, etil asetat, dan n-heksana. Eluen campuran yang
digunakan ialah campuran n-heksana dengan aseton dengan nisbah 7:3.
20
kesetimbangan antara cairan-uap sehingga komponen yang akan dipisahkan (noda) akan naik tanpa ada gangguan. Selain itu, proses ini bertujuan memperkecil penguapan pelarut dan diharapkan noda yang akan dihasilkan berupa bercak bundar dan baik. Kromatogram yang dihasilkan divisualisasi dengan menggunakan lampu UV 254 nm. Kromatogram terbaik mengandung 8 noda yang
terpisah dengan eluen n-heksana:aseton (7:3), dan nilai Rf berturut-turut 0.13,
0.33, 0.43, 0.51, 0.63, 0.73, 0.80, dan 0.91 (Lampiran 7).
Fraksi Hasil Kromatografi Kolom
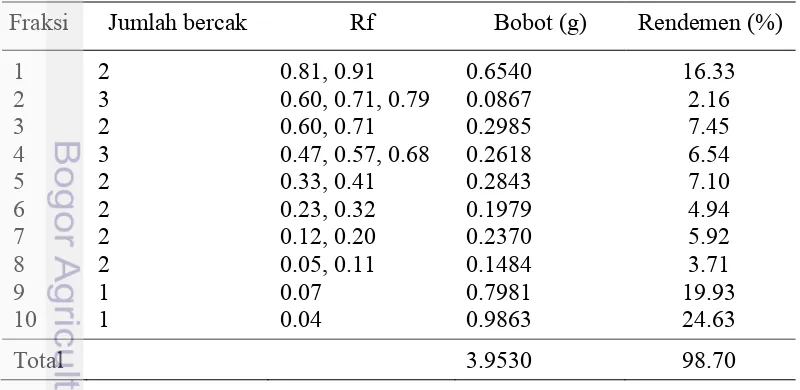
Ekstrak kasar metanol-partisi dipisahkan dalam kromatografi kolom Silika
Gel G-60 dengan eluen n-heksana, aseton, dan metanol dengan metode step
gradient (peningkatan kepolaran) agar dengan peningkatan polaritas sistem eluen semua komponen akan terbawa lebih cepat. Fraksionasi ekstrak daun ambalun menghasilkan 10 fraksi. Setiap fraksi dikeringkan lalu bobotnya ditimbang dan dihitung rendemennya. Total bobot semua fraksi adalah 3.9530 g (rendemen 98.7%, Tabel 4). Fraksi 10 memiliki rendemen yang paling besar, yaitu mendekati 25% dengan bobot 0.9863 g, sedangkan rendemen yang terkecil ialah fraksi 2 dengan bobot 0.0867 g (rendemen 2%).
21 Kesepuluh fraksi yang diperoleh diuji aktivitas insektisidanya. Uji aktivitas insektisida dilakukan dua tahap, yaitu uji pendahuluan dan uji lanjutan. Uji pendahuluan dilakukan untuk mengetahui fraksi yang teraktif. Uji ini dilakukan dengan menggunakan dua taraf konsentrasi, yaitu 0.1% dan 0.5%. Fraksi teraktif yang diperoleh diuji lanjutan untuk mengetahui hubungan konsentrasi-mortalitas.
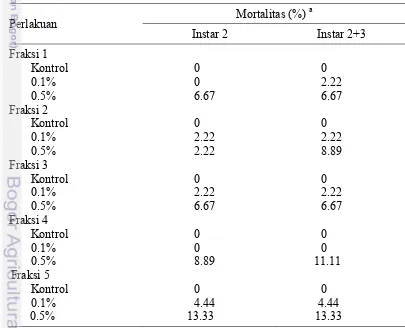
Toksisitas Fraksi Daun Ambalun Uji Pendahuluan
Hasil uji pendahuluan dengan metode residu pada daun (Tabel 5) menunjukkan bahwa fraksi 7 dan fraksi 8 pada konsentrasi 0.5% dapat mematikan serangga uji 100% (Tabel 5), sehingga ekstrak tersebut diuji lebih lanjut pada enam taraf konsentrasi. Fraksi-fraksi yang lain tidak diuji lebih lanjut karena untuk meningkatkan kematian serangga uji akan diperlukan konsentrasi ekstrak yang lebih tinggi.
Tabel 5 Hasil uji pendahuluan fraksi daun ambalun terhadap larva C. pavonana
Perlakuan Mortalitas (%)
22
Tabel 5 (lanjutan)
Perlakuan Mortalitas (%)
a
Mortalitas pada 6 hari setelah perlakuan.
Uji Lanjutan
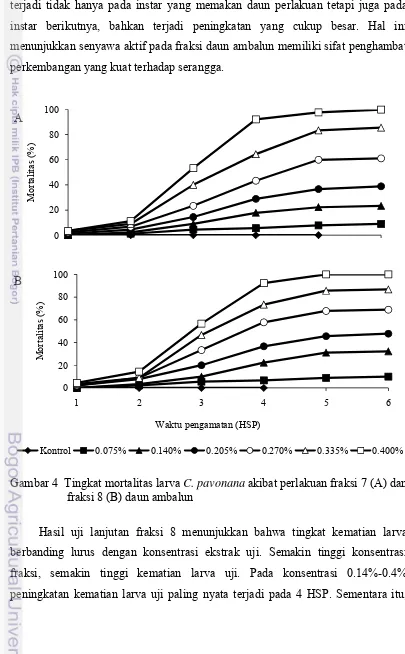
Hasil uji lanjutan fraksi 7 menunjukkan bahwa mortalitas larva untuk semua rentang konsentrasi yang diuji menunjukkan pola yang serupa. Pada hari pertama setelah perlakuan, hanya beberapa ekor larva yang mati, kemudian secara bertahap meningkat pada beberapa hari berikutnya. Tingkat kematian larva pada rentang konsentrasi 0.14%-0.4% mendekati nilai konstan sejak 5 HSP (Gambar 4A).
Perlakuan fraksi uji pada konsentrasi 0.075%-0.4% mengakibatkan mortalitas larva 4%-53% pada 3 HSP dan mortalitas meningkat menjadi 9%-100% pada 6 HSP (Gambar 4A). Secara umum tingkat kematian larva meningkat
dengan semakin tingginya konsentrasi. Seperti ekstrak kasarnya, LC50 dan LC95
23
Hasil uji fraksi 8 menunjukkan bahwa mortalitas larva C. pavonana pada 1
HSP sangat rendah, kemudian meningkat pada 2 HSP (Gambar 4B). Perlakuan dengan fraksi daun ambalun tidak segera mematikan larva uji. Mortalitas larva terjadi tidak hanya pada instar yang memakan daun perlakuan tetapi juga pada instar berikutnya, bahkan terjadi peningkatan yang cukup besar. Hal ini menunjukkan senyawa aktif pada fraksi daun ambalun memiliki sifat penghambat perkembangan yang kuat terhadap serangga.
Gambar 4 Tingkat mortalitas larva C. pavonana akibat perlakuan fraksi 7 (A) dan
fraksi 8 (B) daun ambalun
Hasil uji lanjutan fraksi 8 menunjukkan bahwa tingkat kematian larva berbanding lurus dengan konsentrasi ekstrak uji. Semakin tinggi konsentrasi fraksi, semakin tinggi kematian larva uji. Pada konsentrasi 0.14%-0.4% peningkatan kematian larva uji paling nyata terjadi pada 4 HSP. Sementara itu,
0
Kontrol 0.075% 0.140% 0.205% 0.270% 0.335% 0.400%
A
24
pada konsentrasi 0.075% kematian larva uji rata-rata terjadi setiap hari (Gambar
4B). Nilai LC50 dan LC95 fraksi 8 terhadap larva instar 2+3 sebesar 0.18% dan
0.46% lebih rendah daripada nilainya terhadap larva instar 2, yaitu 0.25% dan 0.71%.
Tabel 6 Penduga parameter regresi probit hubungan konsentrasi-mortalitas fraksi
daun ambalun terhadap larva C.pavonana.
Uji lanjutan,
a = intersep garis regresi probit, b = kemiringan regresi probit, GB = galat baku,
SK = sentang kepercayaan.
Pengaruh Fraksi 7 dan 8 Ambalun terhadap Lama Perkembangan Larva C. pavonana
Pengaruh konsentrasi fraksi 7 dan 8 ambalun terhadap lama perkembangan
instar 2-3 dan instar 2-4 C. pavonana menunjukkan pola yang teratur (Tabel 7).
Lama perkembangan larva instar 2 ke 3 akibat perlakuan fraksi 7 lebih panjang antara 0.17 dan 1.20 hari dibandingkan dengan kontrol. Perpanjangan lama perkembangan larva instar 2-4 pada konsentrasi 0.075%-0.335% berkisar antara
0.75 dan 1.49 hari dibandingkan dengan kontrol. Pada perlakuan fraksi 8,
perkembangan larva instar 2 ke 3 lebih lambat antara 0.24 dan 1.75 hari dibandingkan dengan kontrol. Perkembangan larva instar 2-4 pada konsentrasi 0.075%-0.335% lebih lambat antara 0.55 dan 1.28 hari dibandingkan dengan kontrol.
25 Perlakuan dengan fraksi 7 dan 8 pada semua taraf konsentrasi mengakibatkan lama perkembangan instar 2 ke instar 3 dan instar 2 ke instar 4 yang berbeda nyata dengan kontrol kecuali lama perkembangan dari instar 2 ke instar 3 pada perlakuan kedua fraksi 0.075% (Tabel 7). Secara umum lama perkembangan larva makin panjang dengan makin tingginya konsentrasi fraksi 7 dan 8.
Tabel 7 Hubungan antara konsentrasi fraksi 7 dan 8 ambalun terhadap lama
perkembangan larva C. pavonana
Perlakuan Konsentrasi
(%b/v)
Rata-rata lama perkembangan ± SD (hari) a
Instar 2-3 Instar 2-4
SD = standar deviasi. Rataan pada lajur yang sama yang diikuti oleh huruf yang sama tidak berbeda nyata berdasarkan uji rentang berganda Duncan (α = 0.05). Angka dalam kurung menunjukkan jumlah larva yang bertahan hidup.
b
Tidak ada larva yang berkembang sampai instar 4.
Toksisitas Minyak Mimba
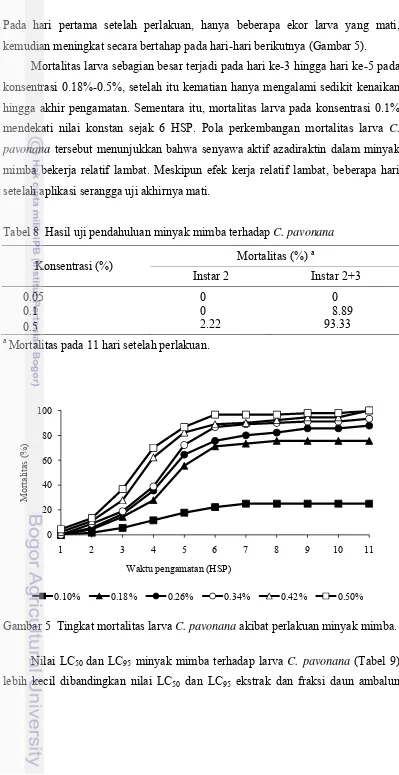
Minyak mimba digunakan sebagai pembanding positif ekstrak dan fraksi daun ambalun. Hasil uji pendahuluan dengan metode residu pada daun (Tabel 8) menunjukkan bahwa minyak mimba pada konsentrasi 0.5% dapat mematikan serangga uji lebih dari 90%.
Hasil uji lanjutan minyak mimba menunjukkan bahwa mortalitas larva C.
26
Pada hari pertama setelah perlakuan, hanya beberapa ekor larva yang mati, kemudian meningkat secara bertahap pada hari-hari berikutnya (Gambar 5).
Mortalitas larva sebagian besar terjadi pada hari ke-3 hingga hari ke-5 pada konsentrasi 0.18%-0.5%, setelah itu kematian hanya mengalami sedikit kenaikan hingga akhir pengamatan. Sementara itu, mortalitas larva pada konsentrasi 0.1%
mendekati nilai konstan sejak 6 HSP. Pola perkembangan mortalitas larva C.
pavonana tersebut menunjukkan bahwa senyawa aktif azadiraktin dalam minyak mimba bekerja relatif lambat. Meskipun efek kerja relatif lambat, beberapa hari setelah aplikasi serangga uji akhirnya mati.
Tabel 8 Hasil uji pendahuluan minyak mimba terhadap C. pavonana
Konsentrasi (%) Mortalitas (%)
a
Mortalitas pada 11 hari setelah perlakuan.
Gambar 5 Tingkat mortalitas larva C. pavonana akibat perlakuan minyak mimba.
Nilai LC50 dan LC95 minyak mimba terhadap larva C. pavonana (Tabel 9)
lebih kecil dibandingkan nilai LC50 dan LC95 ekstrak dan fraksi daun ambalun
0
27 (Tabel 2 dan 6). Hal ini kemungkinan karena toksisitas senyawa aktif terutama azadiraktin, lebih aktif daripada senyawa aktif dalam ekstrak/ fraksi daun ambalun atau kandungan azadiraktin dalam minyak mimba lebih tinggi daripada kandungan senyawa aktif dalam ekstrak/fraksi daun ambalun.
Tabel 9 Penduga parameter regresi probit hubungan konsentrasi-mortalitas
minyak mimba terhadap larva C.pavonana.
Stadium
a = intersep garis regresi probit, b = kemiringan regresi probit, GB = galat baku,
SK = sentang kepercayaan.
Pengaruh Pemberian Minyak Mimba terhadap Lama Perkembangan Larva C. pavonana
Pengaruh konsentrasi minyak mimba terhadap lama perkembangan instar
2-3 dan instar 2-4 C. pavonana menunjukkan pola yang teratur (Tabel 10). Lama
perkembangan larva instar 2 ke 3 akibat perlakuan minyak mimba lebih panjang antara 1.22 dan 4.02 hari dibandingkan dengan kontrol. Perpanjangan lama perkembangan larva instar 2-4 pada konsentrasi 0.1%-0.34% berkisar antara 0.91
dan 3.61 hari dibandingkan dengan kontrol. Lama perkembangan larva instar 2-4
28
Tabel 10 Hubungan antara konsentrasi minyak mimba dan lama perkembangan
larva C. pavonana
Konsentrasi (% b/v)
Rata-rata lama perkembangan ± SD (hari) a
Instar 2-3 Instar 2-4
a SD = standar deviasi. Rataan pada lajur yang sama yang diikuti oleh huruf yang sama
tidak berbeda nyata berdasarkan uji rentang berganda Duncan (α = 0.05). Angka dalam kurung menunjukkan jumlah larva yang bertahan hidup.
b Tidak ada larva yang berkembang sampai instar 4.
Hasil Uji Fitokimia
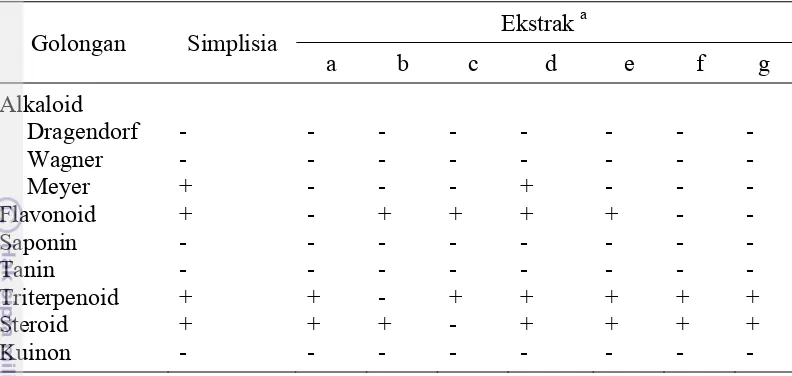
Uji fitokimia bertujuan menguji keberadaan golongan senyawa metabolit sekunder seperti alkaloid, flavonoid, saponin, tanin, steroid, triterpenoid, dan kuinon dalam sampel. Perbedaan kandungan metabolit sekunder pada jenis tanaman yang sama sering terjadi karena pengaruh lingkungan atau metode penentuan fitokimia yang berbeda.
Hasil uji kualitatif menunjukkan bahwa dalam serbuk daun terdeteksi senyawa-senyawa metabolit sekunder seperti alkaloid dengan pereaksi Meyer, flavonoid, triterpenoid, dan streoid. Flavonoid juga terdeteksi pada ekstrak etil asetat, metanol, metanol langsung dan metanol-partisi, sedangkan triterpenoid terdeteksi pada ekstrak metanol, metanol langsung, dan metanol-partisi. Steroid terdeteksi pada ekstrak metanol langsung, metanol-partisi, dan ekstrak etil asetat.
Pada ekstrak n-heksana dan n-heksana-partisi terdeteksi triterpenoid dan steroid
29 Tabel 11 Hasil uji fitokimia daun dan ekstrak daun ambalun
Golongan Simplisia Ekstrak
a
a (a) n-heksana; (b) etil asetat; (c) metanol; (d) metanol langsung (e) metanol-partisi (f) n
-heksana-partisi; (g) fraksi 8; (-) tidak terdeteksi; (+) terdeteksi
Identitas Senyawa Aktif Daun Ambalun
Identifikasi senyawa pada fraksi 8 daun ambalun menggunakan GC-MS dan
FTIR. Komponen senyawa pada fraksi 8 diidentifikasi dengan menggunakan
pelarut aseton pada berbagai kondisi pengaturan suhu pada alat GC-MS agar diperoleh pemisahan yang baik sehingga senyawa yang terdapat dalam fraksi 8 dapat diidentifikasi dengan MS dan hasil spektrum massanya dibandingkan juga dengan data pustaka Wiley 7 dan Wiley 8.
Hasil analisis ekstrak daun ambalun menggunakan GC-MS menunjukkan
adanya senyawa (23S)-etilkoles-5-en-3β-ol dan stigmast-4-en-3-on. Kromatogram
ion total dari senyawa-senyawa yang terkandung dalam fraksi 8 ditunjukkan pada Gambar 6. Keberadaan senyawa-senyawa tersebut dikuatkan dengan analisis gugus fungsi menggunakan FTIR (Gambar 7) yang menunjukkan puncak-puncak
spesifik pada bilangan gelombang 3445.61 cm-1 (regangan OH), 1455.92 cm-1
(regangan C-C aromatik), 2942.98 cm-1 (regangan C-H olefin), 1226.51 cm-1
(regangan C-C olefin), 1714 cm-1 (Uluran C=O), 1560.66 cm-1 (regangan C=C
aromatik), 1048.47 cm-1 (Tekukan C-H di dalam bidang), dan 640.78 cm-1
30
Gambar 6 Kromatogram GC-MS fraksi 8 daun ambalun
PEMBAHASAN
Proses ekstraksi daun ambalun dilakukan dengan metode maserasi.
Ekstraksi awal dilakukan dengan pelarut n-heksana yang bersifat nonpolar.
Tujuan penggunaan pelarut ini adalah untuk mendapatkan senyawa-senyawa yang bersifat nonpolar. Ekstraksi dengan etil asetat yang bersifat semipolar dilakukan untuk memisahkan senyawa-senyawa yang bersifat semipolar sedangkan metanol untuk mengekstraksi senyawa-senyawa polar (Harborne 1987).
Perlakuan dengan ekstrak methanol-partisi menyebabkan kematian serangga uji sampai 100%, sehingga ekstrak tersebut diuji lebih lanjut pada enam taraf
konsentrasi. Ekstrak n-heksana, n-heksana-partisi, dan etil asetat tidak diuji lebih
lanjut karena untuk meningkatkan kematian serangga uji akan diperlukan konsentrasi ekstrak yang lebih tinggi. Penggunaan ekstrak di lapangan pada konsentrasi lebih besar dari 0.5% untuk ekstrak pelarut organik biasanya kurang layak secara ekonomi maupun ekologi, seperti fitotoksik dan dapat beracun terhadap musuh alami (Prijono 1999).
Hasil penelitian ini menunjukkan bahwa senyawa aktif ekstrak daun ambalun memiliki sifat penghambat perkembangan yang kuat terhadap serangga. Gejala peracunan yang teramati dalam penelitian ini serupa dengan yang
dilaporkan Prijono et al. (2000) dan Syahputra (2001). Gejala peracunan berupa
kegagalan ganti kulit mencerminkan bahwa senyawa aktif ambalun mengganggu fungsi hormon yang terlibat dalam pengaturan proses ganti kulit serangga (Prijono et al. 2000). Proses pergantian kulit dan metamorfosis serangga melibatkan sedikitnya tujuh jenis hormon, yaitu hormon protorasikoptorik, hormon juvenil,
ekdison, hormon pemicu ekdisis, hormon eklosi, bursikon, dan crustacean
cardioactive peptide (Chapman 1998).
Setiap jenis hormon tersebut memiliki fungsi yang berbeda. Terganggunya fungsi salah satu hormon tersebut dapat berdampak pada fungsi sistem hormon secara keseluruhan (Chapman 1998). Adanya gangguan pada fungsi hormon yang
mengendalikan perkembangan C. pavonana akan mengakibatkan serangga
umumnya mati menjelang atau pada saat ganti kulit (Prijono et al. 2000). Gejala
32
dari tanaman mimba (Prijono et al. 2001). Mordue et al. (1998) melaporkan
bahwa azadiraktin bekerja sebagai ecdysone blocker yang menghambat serangga
untuk memproduksi dan melepas hormon-hormon yang terlibat dalam proses
metamorfosis. Perry et al. (1998) juga melaporkan bahwa racun azadiraktin
bekerja mengganggu proses fisiologi seperti mengganggu nafsu makan atau pertumbuhan serangga. Senyawa aktif yang bekerja mengganggu sistem hormon serangga karena spesifisitasnya yang tinggi akan lebih aman bagi organisme bukan sasaran, sehingga memiliki peluang yang baik untuk dikembangkan lebih lanjut (Syahputra 2001).
Secara umum tingkat kematian larva meningkat dengan semakin tingginya
konsentrasi. LC50 danLC95 ekstrak daun ambalun terhadap instar 2+3 lebih rendah
dibandingkan dengan larva instar 2. Hal ini menunjukkan masih terjadi peningkatan kematian yang nyata pada instar 3. Kecenderungan tersebut memperkuat dugaan bahwa senyawa aktif ambalun bekerja sebagai penghambat perkembangan serangga yang kuat, sehingga walaupun hanya instar 2 yang diberi makan daun perlakuan, pengaruh ekstrak tersebut masih terlihat sampai instar 3.
Prijono et al. (2000) melaporkan bahwa ekstrak etanol kulit batang ambalun yang
sebelumnya diidentifikasi sebagai Aglaia angustifolia dapat menyebabkan
gangguan ganti kulit pada larva C. pavonana. Aktivitas yang sama juga terdapat
pada ekstrak mimba yang memiliki senyawa aktif azadiraktin (Prijono dan Hassan 1993). Senyawa aktif tersebut mengakibatkan gangguan pada pengaturan perkembangan dan reproduksi serangga.
Nilai LC50 ekstrak daun ambalun pada penelitian ini lebih tinggi
dibandingkan LC50 ekstrak bagian tumbuhan yang lain seperti kulit batang,
ranting, dan tangkai daun. Prijono et al. (1999) melaporkan bahwa LC50 ekstrak
etanol kulit batang ambalun sebesar 112 ppm. Pada penelitian lain, Aliyah et al.
(2001) melaporkan bahwa ekstrak kloroform ranting ambalun memiliki LC50
sebesar 108 ppm. Selain itu, LC50 ekstrak daun ambalun pada penelitian ini lebih
tinggi daripada LC50 ekstrak daun ambalun yang dilaporkan oleh Syahputra
33
menyebabkan perbedaan LC50 ekstrak daun pada penelitian ini kemungkinan
disebabkan oleh perbedaan kondisi daun ambalun pada saat pengambilan sampel akibat perbedaan kondisi cuaca dan kesuburan tanah. Leatemia dan Isman (2004)
melaporkan bahwa ekstrak biji srikaya (Annona squamosa) dari Namlea, Buru,
yang sampel bijinya diambil pada tahun berbeda memiliki aktivitas yang beragam
terhadap larva Spodoptera litura.
Fraksi 7 dan 8 yang diperoleh dari hasil fraksionasi ekstrak metanol daun ambalun memiliki aktivitas insektisida paling kuat di antara 10 fraksi yang
diperoleh. Nilai LC50 fraksi 8 lebih rendah daripada LC50 fraksi 7, sedangkan LC50
fraksi 7 lebih rendah daripada LC50 ekstrak daun ambalun. Namun LC50 dan LC95
kedua fraksi tersebut tidak jauh berbeda dengan ekstrak metanol-partisi sedangkan rendemen fraksi 7 dan 8 masing-masing hanya 5.92% dan 3.71% (Tabel 4). Hal tersebut menunjukkan bahwa aktivitas insektisida ekstrak kasar bukan hanya disumbangkan oleh kedua fraksi tersebut tetapi juga oleh fraksi lain dan campuran berbagai komponen dalam ekstrak kasar kemungkinan bersifat sinergis.
Minyak mimba digunakan sebagai pembanding positif ekstrak dan fraksi daun ambalun. Hasil uji pendahuluan dengan metode residu pada daun menunjukkan bahwa mimba pada konsentrasi 0.5% dapat mematikan serangga uji
100%. Nilai LC50 dan LC95 mimba terhadap larva C. pavonana lebih kecil
dibandingkan nilai LC50 dan LC95 ekstrak dan fraksi daun ambalun. Hal ini
kemungkinan karena toksisitas senyawa aktif dalam minyak mimba, yaitu azadiraktin lebih tinggi daripada senyawa aktif dalam ekstrak ambalun atau kandungan senyawa aktif dalam ekstrak ambalun lebih rendah daripada kandungan azadiraktin dalam minyak mimba yang digunakan.
Pemeriksaan fitokimia pada serbuk daun dan ekstrak daun ambalun bertujuan mendeteksi keberadaan golongan senyawa alkaloid, flavonoid, triterpenoid, steroid, tanin, dan kuinon pada sampel awal daun ambalun sebelum tahap ekstraksi dan uji pada ekstrak kasar dilakukan untuk mengevaluasi efektivitas pelarut dalam mengekstrak senyawa-senyawa tersebut. Uji alkaloid memberikan hasil positif terhadap serbuk daun dan ekstrak metanol langsung, meskipun secara kuantitatif jumlahnya sedikit. Hasil uji alkaloid ini sesuai dengan
34
kandungan senyawa alkaloid. Uji triterpenoid memberikan hasil positif untuk
serbuk daun, ekstrak n-heksana, n-heksana partisi, metanol, metanol langsung,
dan metanol-partisi. Hasil ini sesuai dengan hasil penelitian Ismail et al. (2009b)
yang melaporkan kandungan triterpenoid pada daun ambalun. Kandungan senyawa lain yang terdeteksi di antaranya flavonoid pada serbuk daun, ekstrak etil asetat, metanol, metanol langsung, dan metanol-partisi serta steroid pada ekstrak
n-heksana, etil asetat, metanol langsung, dan metanol-partisi.
Hasil analisis dengan GC-MS dan FTIR hanya mendukung dugaan bahwa senyawa aktif yang bersifat insektisida dalam daun ambalun termasuk golongan steroid. Hasil spektrum massa yang dihubungkan dengan GC menunjukkan bahwa fraksi 8 menghasilkan beberapa puncak dengan waktu retensi yang berbeda-beda. Satu puncak yang berhasil diidentifikasi adalah puncak dengan waktu retensi 23.56 menit, karena memiliki kelimpahan yang lebih besar dibandingkan
puncak-puncak yang lainnya. Puncak ion molekul (M+) spektrum massa pada puncak
tersebut adalah pada m/z 414 (Lampiran 8). Hal ini mengindikasikan bahwa senyawa pada puncak tersebut mempunyai bobot molekul 414.
Pola pemenggalan dari spektrum massa senyawa pada puncak dengan waktu
retensi 23.56 menit juga menunjukkan adanya pemenggalan H2O, yaitu pada m/z
396 (M+-H2O) yang mengindikasikan senyawa sterol yang mengandung satu
gugus 3β. Adanya pemenggalan pada m/z 329 (M+-85) dan m/z 303 (M+-111)
(Lampiran 7), mengindikasikan senyawa sterol dengan ikatan rangkap pada posisi
C5 (Goad & Akihisa 1997). Berdasarkan database Wiley 7 dan 8, senyawa
turunan sterol yang mengadung satu gugus hidroksil pada posisi 3β dan
mempunyai ikatan rangkap pada C-5 adalah (23S)-etilkolest-5-en-3β-ol (Gambar
8).
Spektrum FTIR dari fraksi 8 menunjukkan adanya beberapa gugus fungsi. Berdasarkan pengukuran dengan FTIR, dapat terlihat pada daerah sekitar
3600-3100 cm-1 yang memperlihatkan regangan OH, yaitu pada 3445.61 cm-1. Puncak
pada 2942.98 cm-1 menunjukkan uluran simetri metilena (-CH2-) atau –CH alkana
alifatik. Selain itu, adanya serapan pada 1455.92 cm-1 dan 1379.50 cm-1
menunjukkan vibrasi -CH ke dalam bidang dan spesifik untuk gem dimetil yang
35
HO
H H
H
Gambar 8 Struktur senyawa (23S)-etilkoles-5-en-3β-ol
Hasil penelitian ini sejalan dengan penelitian yang dilakukan Sugita et al.
(2000) yang mengisolasi senyawa steroid dari ekstrak Hopea mengerawan yang
memiliki aktivitas terhadap rayap Cryptotermes cynochephalus. Sementara itu,
Céspedes et al. (2005) melaporkan bahwa beberapa senyawa sterol memiliki
aktivitas insektisida dan menghambat perkembangan larva Spodoptera frugiperda
SIMPULAN DAN SARAN
Simpulan
Ekstrak metanol-partisi daun ambalun (D. acutangulum) menunjukkan
aktivitas insektisida terhadap C. pavonana dengan LC50 0.24% (b/v) dan LC95
0.49% (b/v). Fraksi 8 yang dipisahkan menggunakan kromatografi kolom memiliki aktivitas insektisida lebih kuat dibandingkan dengan ekstrak kasarnya
dengan LC50 0.18% (b/v) dan LC95 0.46% (b/v). Berdasarkan hasil analisis
spektrofometer GC-MS dan FTIR, fraksi 8 mengandung senyawa yang termasuk golongan steroid.
Saran
DAFTAR PUSTAKA
[AOAC] Association of Official Analytical Chemists. 2006. Official Methods of
Analysis of the Association of Official Analytical Chemists. Edisi ke-18.
Washinton DC: AOAC.
Aliyah L, Prijono D, Widodo. 2001. Aspek teknis dalam penyiapan insektisida
botani dari tanaman Dysoxylum acutangulum Miq. Untuk penggunaan di
tingkat petani. Dalam Sukartana P et al. editor. Prosiding Seminar Nasional
III PEI: Pengelolaan Serangga yang Bijaksana Menuju Optimasi Produksi; Bogor, 6 November 2001. Bogor: Perhimpunan Entomologi Indonesia. hlm 102-111.
Céspedes CL, Salazar JR, Martínez M, Aranda E. 2005. Insect growth regulatory
effect of some extracts and sterols from Myrtillocacus geometrizans
(Cactaceae) against Spodoptera frugiferda and Tenebrio molitor.
Phytochemistry 66:2481-2493.
Chapman RF. 1998. The Insects: Structure and Function. Ed ke-4. Cambridge:
Cambridge University Press.
Finney DJ. 1971. Probit Analysis, Ed. Ke-3. Cambridge: Cambridge University.
Fujioka T, Yamamoto M, Kashiwada Y, Fujii Hiroko, Mihashi K et al. 2001.
Novel cytotoxic diterpenes from the stem of Dysoxyum kuskusense. Bioorg
Med Chem Lett 8:3479-3482.
Goad LJ dan Akihisa T.1997. Analysis of Sterols. London: Blackie Academic &
Profesional.
Govindachari TR, Suresh G, Kumari GNK, Rajamannar T, Partho PD. 1999.
Nymania-3: a bioactive triterpenoid from Dysoxylum malabaricum.
Fitoterapia 70:83-86.
Harborne JB. 1987. Metode Fitokimia: Penuntun Cara Modern Menganalisis
Tumbuhan. Padmawinata K, Soediro I, penerjemah; Bandung: Penerbit ITB.
Terjemahan dari: Phytochemical Methods.
Hart JB, Mason JM, Gerard PJ. 2001. Semi-synthesis and insecticidal activity of
dyshomoerythrine derivatives. Tetrahedron 57:10033-10038.
Heyne K. 1987. Tumbuhan Berguna Indonesia Jilid II. Badan Litbang Kehutanan,
penerjemah Jakarta: Yayasan Sarana Warna Jaya. Terjemahan dari: De
Nuttige Planten van Indonesie.
He XF, Wang XN, Yin S, Dong L, Yue JM. 2011. Ring a-seco triterpenoids with
antibacterial activity from Dysoxylum hainanense. Bioorg Med Chem Lett
21:125-129.
Ismail IS, Nagakura Y, Hirasawa Y, Hosoya T, Lazim MIM et al. 2009a.
Chrotacumine A-D, Chromone alkaloids from Dysoxylum acutangulum. J