AKTIVITAS EKSTRAK TAMBELO (Bactronophorus sp.)
DAN SELULOLITIK MIKROORGANISME SIMBIONNYA
RIVIANI
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI DISERTASI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis berjudul Aktivitas Ekstrak Tambelo (Bactronophorus sp.) dan Selulolitik Mikroorganisme Simbionnya adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
RINGKASAN
RIVIANI. Aktivitas Ekstrak Tambelo (Bactronophorus sp.) dan Selulolitik Mikroorganisme Simbionnya. Dibimbing oleh SRI PURWANINGSIH dan KUSTIARIYAH TARMAN.
Tambelo merupakan moluska yang hidup di dalam kayu mangrove telah digunakan untuk tujuan pengobatan oleh masyarakat pesisir. Tujuan penelitian ini adalah menentukan aktivitas biologis yaitu aktivitas antioksidan, inhibitor -glukosidase, dan antibakteri, serta mendapatkan mikroorganisme simbion yang diisolasi dari tambelo, dan menentukan aktivitas selulolitik mikroorganisme simbion.
Tambelo diekstrak menggunakan tiga pelarut yaitu metanol, etil asetat, dan heksana. Aktivitas antioksidan ekstrak diuji berdasarkan kemampuan ekstrak dalam mereduksi radikal bebas (DPPH) dengan menggunakan konsentrasi ekstrak 50, 100, 500, 1000, dan 5000 µg/mL. Aktivitas inhibisi -glukosidase ekstrak dengan konsentrasi ekstrak 25, 50, 100, 500, dan 1000 µg/mL. Aktivitas antibakteri ekstrak diukur menggunakan metode difusi agar dengan konsentrasi ekstrak 0.5, 1, dan 2 mg/sumur terhadap bakteri Escherichia coli dan Staphylococcus aureus. Mikroorganisme yang berasosiasi dengan tambelo diisolasi dari saluran pencernaannya. Isolat yang diperoleh diuji aktivitas selulolitik dengan media yang mengandung selulosa.
Rendemen daging dan jeroan tambelo yang dihasilkan sebesar 93.98%. Kadar air, abu, lemak, dan protein masing-masing sebesar 73.93%, 1.24%, 0.47%, dan 6.22%. Rendemen ekstrak metanol sebesar 3.12% ± 0.62, etil asetat 0.68% ± 0.07, dan heksana 0.41% ± 0.13. Aktivitas antioksidan tertinggi pada ekstrak etil asetat dengan nilai IC50 sebesar 1072.19 µg/mL. Aktivitas inhibisi -glukosidase ekstrak menurun pada konsentrasi yang semakin tinggi. Aktivitas antibakteri tertinggi diperoleh pada ekstrak etil asetat dengan zona hambat sebesar 10.5 mm terhadap bakteri E. coli pada konsentrasi 2 mg/sumur. Ekstrak terpilih adalah ekstrak etil asetat yang mengandung flavonoid, tanin, saponin dan steroid. Ekstrak tersebut tergolong toksik dengan nilai LC50 sebesar 425.908 µg/mL. Mikroorganisme yang terisolasi terdiri dari 8 kapang dan 9 bakteri. Indeks selulolitik tertinggi ditunjukkan oleh isolat kapang TJ21 dengan indeks 4.53, serta isolat bakteri S3B sebesar 2.25.
SUMMARY
RIVIANI. Activity of Tambelo (Bactronophorus sp.) Extracts and Cellulolytic of Their Associated Microorganisms. Supervised by SRI PURWANINGSIH and KUSTIARIYAH TARMAN.
Tambelo is a mollusc living inside the mangrove trees which has been used for medicinal purposes by the coastal people. The aims of this study were to determine the activities of tambelo extracts as antioxidant, α-glucosidase inhibitor, and antibacterial, to obtain the associated microorganisms isolated from tambelo, and to determine the cellulolytic activity of the associated microorganisms.
Tambelo was extracted by three solvents such as methanol, ethyl acetate, and hexane. Antioxidant activity of the extracts was determined based on the ability of the extract to reduce free radical (DPPH) as concentrations of 50, 100, 500, 1000, dan 5000 µg/mL. The α-glucosidase inhibition activity of the extract was determined with the concentrations of 25, 50, 100, 500, dan 1000 µg/mL. The antibacterial activity of the extract used agar plate difussion method with concentrations of 0.5, 1, 2 mg/well against Escherichia coli and Staphylococcus aureus. Tambelo associated microorganisms were isolated from the digestive tract. The isolates were then investigated for their cellulolytic activity using cellulose based medium.
The yield of meat and offal of tambelo was 93.98%. The contents of moisture, ash, fat, and protein were 73.93%, 1.24%, 0.47%, and 6.22%, respectively. The yield of methanol extract was 3.12% ± 0.62, etyl acetate 0.68% ± 0.07, and hexane 0.41% ± 0.13. The highest antioxidant activity was showed by ethyl acetate extract with IC50 of 1072.19 µg/mL. The α-glucosidase inhibition activity of the extract decreased when the concentration increased. The highest antibacterial activity was exhibited by the ethyl acetate extract with the inhibition zone of 10.5 mm against E. coli with the concentration of 2 mg/well. Ethyl acetate extract consisted of flavonoids, tanins, saponins, and steroids. This extract was toxic with LC50 of 425.908 µg/mL. Isolated microorganisms consisted of 8 fungi and 9 bacteria. The highest cellulolytic index was showed by the fungal isolate TJ21 with the index of 4.53, while the bacterial isolate S3B was 2.25.
© Hak Cipta Milik IPB, Tahun 2016
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Teknologi Hasil Perairan
AKTIVITAS EKSTRAK TAMBELO (Bactronophorus sp.)
DAN SELULOLITIK MIKROORGANISME SIMBIONNYA
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2016
Judul Tesis : Aktivitas Ekstrak Tambelo (Bactronophorus sp.) dan Selulolitik Mikroorganisme Simbionnya
Nama : Riviani NIM : C351130081
Disetujui oleh Komisi Pembimbing
Prof Dr Ir Sri Purwaningsih, MS Ketua
Dr Kustiariyah Tarman, SPi, MSi Anggota
Diketahui oleh
Ketua Program Studi Teknologi Hasil Perairan
Dr Ir Wini Trilaksani, MSc
Dekan Sekolah Pascasarjana
Dr Ir Dahrul Syah, MSc Agr
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang telah dilaksanakan sejak bulan Juni 2015 ini ialah Aktivitas Ekstrak Tambelo (Bactronophorus sp.) dan Selulolitik Mikroorganisme Simbionnya.
Terima kasih penulis ucapkan kepada Ibu Prof Dr Ir Sri Purwaningsih, MS dan Ibu Dr Kustiariyah Taman, SPi, MSi selaku pembimbing yang telah banyak
memberi saran. Ucapan terimakasih penulis sampaikan kepada Dr Desniar, SPi, MSi selaku penguji, Dr Eng Uju, SPi, MSi selaku GKM,
Dr Ir Wini Trilaksani, MSc selaku ketua Program Studi Teknologi Hasil Perairan, Dekan Sekolah Pascasarjana IPB, dan Direktorat Jenderal Dikti. Ucapan terima kasih kepada Bapak dan Ibu dosen staf pengajar, staf administrasi dan seluruh staf laboratorium yang telah membantu pelaksanaan penelitian ini.
Terima kasih penulis sampaikan kepada kedua orang tua, kaka dan adik tersayang, serta keluarga besar Bapak Dasuki dan Ibu Wagini, keluarga PPR, keluarga THP Pascasarjana 2013, Wulandari, Alif Kholifatul Jannah, Nurhasanah, Penghuni Forum Wacana, dan teman-teman yang telah mendukung penulis selama ini.
DAFTAR ISI
Ruang Lingkup Penelitian ... 3
Roadmap Penelitian ... 4
2 METODE ... 115
Waktu dan Tempat Penelitian ... 5
Bahan dan Alat ... 5
Prosedur Penelitian ... 5
Preparasi sampel ... 7
Analisis Proksimat ... 7
Ekstraksi Tambelo ... 8
Uji Aktivitas Antioksidan (Salazar-Aranda et al. 2009) ... 9
Uji Aktivitas Inhibisi α-Glukosidase (Sancheti et al. 2009) ... 9
Uji Antibakteri (Moorthy et al. 2007) ... 10
Uji Komponen Aktif (Harbone 2006) ... 10
Uji Toksisitas dengan Metode BSLT (Meyer et al. 1982) ... 11
Isolasi Bakteri dan Kapang dari Tambelo ... 12
Penapisan Bakteri dan Kapang dari Tambelo ... 12
Analisis Data ... 13
3 HASIL DAN PEMBAHASAN ... 13
Karakteristik Tambelo ... 13
Ekstrak Tambelo ... 14
Aktivitas Antioksidan ... 15
Aktivitas Inhibisi α-Glukosidase... 16
Aktivitas Antibakteri ... 18
Komponen Bioaktif dan Toksisitas Ekstrak Etil Asetat Tambelo ... 19
Isolat Mikroorganisme Simbion dari Tambelo ... 21
Isolat Mikroorganisme Simbion... 21
Aktivitas Selulolitik Mikroorganisme Simbion ... 22
4 SIMPULAN DAN SARAN ... 24
Simpulan ... 24
Saran ... 24
DAFTAR TABEL
1 Komposisi kimia daging tambelo ... 14
2 Diameter zona hambat (mm) ekstrak tambelo ... 18
3 Komponen bioaktif ekstrak etil asetat tambelo ... 19
4 Indeks selulolitik kapang dari tambelo ... 23
5 Indeks selulolitik bakteri dari tambelo ... 23
DAFTAR GAMBAR
1 Roadmap penelitian ... 42 Diagram alir penelitian ... 6
3 Tambelo (A); palet dan cangkang tambelo (B) ... 13
4 Aktivitas antioksidan ekstrak metanol (A), ekstrak etil asetat (B), ekstrak heksana tambelo (C), dan vitamin C (D) ... 16
5 Aktivitas inhibisi α-glukosidase ekstrak metanol (A), ekstrak etil asetat (B), ekstrak heksana tambelo (C), dan glukobay (D) ... 17
6 Isolat kapang tambelo ... 21
7 Isolat bakteri tambelo ... 22
DAFTAR LAMPIRAN
1 Karakteristik tambelo ... 33312 Rendemen ekstrak tambelo ... 31
3 Contoh perhitungan nilai IC50... 31
4 Aktivitas antibakteri ekstrak tambelo ... 31
5 Analisis probit toksisitas ekstrak etil asetat tambelo ... 32
6 Hasil mikroskopik kapang simbion ... 32
1 PENDAHULUAN
Latar Belakang
Hutan mangrove di Indonesia merupakan salah satu ekosistem pesisir yang memiliki keanekaragaman hayati khas. Terdapat berbagai macam organisme yang hidup dan dapat dimanfaatkan tidak hanya sebagai bahan baku makanan saja, tetapi juga digunakan sebagai obat oleh masyarakat. Moluska merupakan salah satu biota yang banyak dijumpai di perairan mangrove dan dipercaya sebagai obat. Hal tersebut dibuktikan bahwa pada golongan moluska ditemukan berbagai macam komponen bioaktif. Menurut Grienke et al. (2014), moluska dengan genus Mytilus dan Perna memiliki komponen yang teridentifikasi seperti peptida, squalene, alkaloid, terpenoid, komponen nitrogen, turunan asam amino, dan komponen lainnya yang memiliki bioaktif spesifik. Beberapa studi mengungkapkan pada bivalva dan gastropoda merupakan golongan moluska yang
potensial sebagai sumber nutraseutika dan farmaseutika. Menurut Zhou et al. (2011), produk alami yang dihasilkan dari moluska dapat digunakan
sebagai antioksidan, antitumor, antivirus, antibakteri, antijamur, antikanker, dan inhibitor enzim.
Kearifan lokal merupakan salah satu indikator penting dalam pengembangan obat alami. Masyarakat di beberapa wilayah pesisir Indonesia misalnya Papua, Kendari, dan Bangka Belitung memiliki tradisi mengonsumsi salah satu moluska laut yang disebut dengan tambelu atau tambelo atau shipworm yang dipercaya memiliki banyak manfaat. Menurut Hardinsyah et al. (2006), dengan konsumsi tambelo (Bactronophorus sp.) dapat menyembuhkan berbagai macam penyakit, seperti sakit pinggang, rematik, batuk, flu, malaria, serta meningkatkan produksi air susu ibu, menambah nafsu makan, dan vitalitas pria. Tambelo sudah diteliti oleh Leiwakabessy (2011), dan dilaporkan memiliki aktivitas antioksidan yang sangat kuat dengan nilai IC50 sebesar 15 µg/mL. Penelitian tambelo hingga saat ini masih sangat sedikit, sehingga perlu adanya kajian aktivitas bioaktif lainnya agar dapat menggali potensi tambelo sebagai bahan obat secara ilmiah.
2
mikroorganisme simbion. Senyawa metabolit ini dapat berpengaruh terhadap komposisi kimia tambelo yang berpotensi menunjukkan aktivitas biologis. Hasil penelitian Trindade-Sliva et al. (2009), mikroorganisme yang berasosiasi dengan shipworm (Neoteredo reynei) berupa bakteri selulolitik dengan kode CS30 memiliki aktivitas antibiotik terhadap bakteri Gram-negatif (Sphingomonas sp. dan Stenotrophomonas maltophilia) dan Gram-positif (Bacillus cereus dan Staphylococcus sciuri). Isolasi mikroorganisme simbion dari tambelo sendiri belum pernah dilakukan. Hal ini perlu dilakukan untuk meminimalisir pemanfaatan tambelo secara langsung, agar keberadaan tambelo di alam tetap terjaga dan senyawa bioaktif yang sama dapat diperoleh dari mikroorganisme simbionnya.
Rumusan Masalah
Area pesisir Indonesia sangat luas yang di dalamnya terdapat ekosistem mangrove. Pada ekosistem ini ada flora dan fauna yang khas. Salah satu fauna yang khas adalah tambelo (Bactronophorus sp.). Tambelo oleh masyarakat pesisir dipercaya dapat mencegah dan menyembuhkan penyakit. Pengalaman empiris ini perlu dibuktikan dengan dilakukannya kajian tentang aktivitas biologis ekstrak. Selain itu, dugaan adanya mikroorganisme simbion yang membantu dalam mendegradasi selulosa dapat menghasilkan senyawa bioaktif yang sama dengan inangnya. Senyawa metabolit yang dihasilkan oleh mikroorganisme ini dapat berpengaruh terhadap komposisi kimia tambelo sehingga perlu adanya isolasi mikroorganisme simbion yang ada pada tambelo.
Tujuan Penelitian
Tujuan dari penelitian “Aktivitas Ekstrak Tambelo (Bactronophorus sp.) dan Selulolitik Mikroorganisme Simbionnya” adalah :
1. Menentukan aktivitas antioksidan, inhibisi α-glukosidase, dan antibakteri ekstrak tambelo (Bactronophorus sp.).
2. Mendapatkan isolat mikroorganisme simbion yaitu kapang dan bakteri dari tambelo (Bactronophorus sp.).
3. Menentukan aktivitas selulolitik isolat mikroorganisme simbion dari tambelo (Bactronophorus sp.).
Manfaat Penelitian
Manfaat dari penelitian “Aktivitas Ekstrak Tambelo (Bactronophorus sp.) dan Selulolitik Mikroorganisme Simbionnya” adalah :
1. Memberikan informasi ilmiah dan dasar bagi penelitian lanjutan tentang aktivitas antioksidan, inhibisi α-glukosidase, dan antibakteri tambelo (Bactronophorus sp.).
3 Ruang Lingkup Penelitian
Ruang lingkup penelitian “Aktivitas Ekstrak Tambelo (Bactronophorus sp.) dan Selulolitik Mikroorganisme Simbionnya” adalah :
1. Karakterisasi tambelo (Bactronophorus sp.) meliputi identifikasi bahan baku, penghitungan rendemen, dan analisis proksimat (air, abu, protein, dan lemak).
2. Ekstraksi tambelo (Bactronophorus sp.) dengan metode maserasi dengan pelarut tunggal menggunakan 3 pelarut (metanol, etil asetat dan heksana). 3. Uji aktivitas antioksidan, inhibisi α-glukosidase, dan antibakteri diawali
dengan penapisan awal dari 3 jenis ekstrak yang berbeda (metanol, etil asetat dan heksana) untuk menentukan ekstrak teraktif dengan pengukuran persentase DPPH, inhibisi enzim α-glukosidase untuk antidiabetes, kemudian aktivitasnya diuji kembali dengan beberapa seri konsentrasi ekstrak untuk menentukan nilai IC50 (Konsentrasi ekstrak yang dapat mereduksi aktivitas antioksidan dan inhibisi α-glukosidase sebesar 50%). Uji aktivitas antibakteri dilakukan dengan menghitung zona bening yang terbentuk.
4. Uji toksisitas dengan metode BSLT (Brine Shrimp Lethality Test) dilakukan pada ekstrak teraktif dengan beberapa seri konsentrasi untuk menentukan nilai LC50.
5. Skrining fitokimia dilakukan pada ekstrak teraktif meliputi uji alkaloid, flavonoid, tanin, saponin, triterpenoid, hidrokuinon, dan steroid.
4
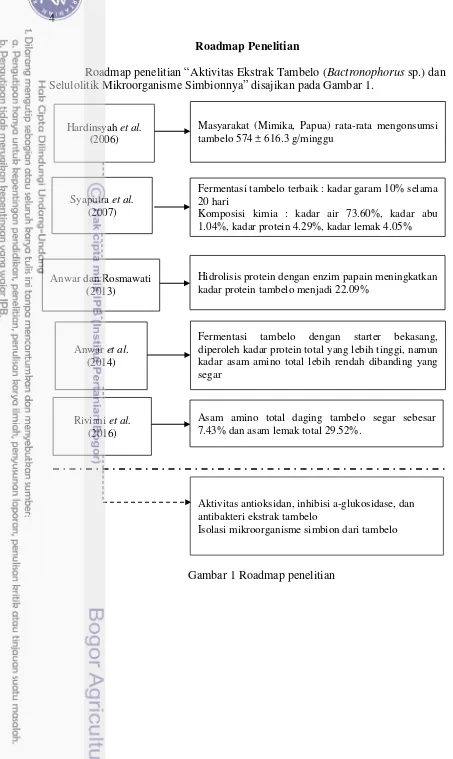
Roadmap Penelitian
Roadmap penelitian “Aktivitas Ekstrak Tambelo (Bactronophorus sp.) dan Selulolitik Mikroorganisme Simbionnya” disajikan pada Gambar 1.
Gambar 1 Roadmap penelitian Riviani et al.
(2016)
Asam amino total daging tambelo segar sebesar 7.43% dan asam lemak total 29.52%.
Hardinsyah et al.
(2006)
Masyarakat (Mimika, Papua) rata-rata mengonsumsi tambelo 574 ± 616.3 g/minggu
Syaputra et al.
(2007)
Fermentasi tambelo terbaik : kadar garam 10% selama 20 hari
Komposisi kimia : kadar air 73.60%, kadar abu 1.04%, kadar protein 4.29%, kadar lemak 4.05%
Anwar dan Rosmawati (2013)
Hidrolisis protein dengan enzim papain meningkatkan kadar protein tambelo menjadi 22.09%
Anwar et al. (2014)
Fermentasi tambelo dengan starter bekasang, diperoleh kadar protein total yang lebih tinggi, namun kadar asam amino total lebih rendah dibanding yang segar
Aktivitas antioksidan, inhibisi a-glukosidase, dan antibakteri ekstrak tambelo
5
2 METODE
Waktu dan Tempat Penelitian
Penelitian ini akan dilaksanakan pada bulan Juni 2015 sampai Maret 2016 di Laboratorium Biokimia dan Laboratorium Mikrobiologi Departemen Teknologi Hasil Perairan, Laboratorium Kimia Analitik Departemen Kimia, Institut Pertanian Bogor dan Pusat Studi Biofarmaka, Laboratorium Terpadu, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor.
Bahan dan Alat
Bahan baku yang digunakan dalam penelitian ini adalah tambelo (Bactronophorus sp.) yang berasal dari Desa Torobulu, Kec. Laeya, Kab. Konawe Selatan, Kendari, Sulawesi Tenggara. Bahan untuk analisis proksimat diantaranya selenium, H2SO4 pekat, aquades, NaOH 40%, H3BO3 2%, indikator bromcresol green-methyl red, HCl 0.1 N dan benzena. Bahan yang digunakan pada tahap ekstraksi diantaranya metanol, etil asetat, dan heksana. Bahan untuk uji aktivitas biologis diantaranya, Dimethyl Sufoxide (DMSO), 1,1-diphenil-2-picrlhylhydrazyl (DPPH), vitamin C, Bovine serum albumin (BSA), p-Nitrophenyl α -D-glucopyranoside (p-NPG), buffer fosfat, enzim α-glukosidase, Na2CO3, akarbosa (glukobay), Escericia coli, Aspergillus aureus, kloramfenikol, dan Mueller Hinton Agar (MHA) (oxoid), pereaksi Meyer, Wagner, dan Dragendorff, pereksi Lieberman-Burchard, HCl, kloroform, Artemia salina, Potato Dextrose Agar (PDA) (BD company), Congo red 0.1%, Cellulolytic Medium Basal (CMB), NaCl, Sea Water Complete (SWC), media CarboxyMethyl Cellulose (CMC), Nutrient Agar (NA) (oxoid), dan Nutrient Broth (NB) (oxoid).
Peralatan yang digunakan dalam penelitian diantaranya kamera digital (NIKON D3200), cawan porselen, oven, desikator, tanur, timbangan digital, kjeldahl sistem, alat destruksi, alat titrasi, destilator, dan soxlet, kertas saring Whatman 42, shaker, rotary evaporator (EYELA N1001T), microplate dan elisa reader (Epoch), pipet mikro (Eppendorf), clean bench (Thermo Scientific 1300 Series A2), autoklaf (Yamato SM52), inkubator (Thermolyne type 42000), dan mikroskop.
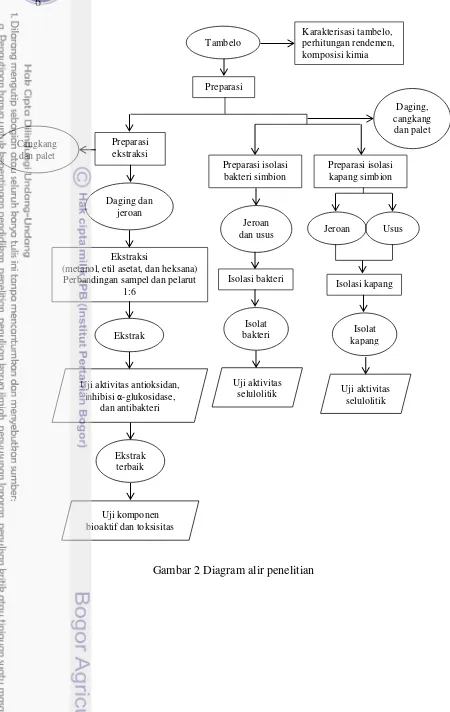
Prosedur Penelitian
7 Preparasi Sampel
Tahap penelitian diawali dengan preparasi sampel serta persiapan bahan dan alat untuk analisis yang akan dilakukan. Bahan baku utama yang digunakan dalam penelitian ini adalah tambelo (Bactronophorus sp.) yang diperoleh dari perairan Kendari. Bahan baku dibawa menuju laboratorium dalam keadaan beku, dengan menggunakan styrofoam. Identifikasi bahan baku dilakukan di Pusat Penelitian Oseanografi LIPI. Pengamatan morfometrik dilakukan meliputi panjang, lebar, dan berat. Bahan baku kemudian dicuci dengan air bersih lalu dilakukan pemisahan antara bagian cangkang, daging dan jeroan serta dihitung rendemennya.
Analisis Proksimat
a. Kadar air (AOAC 2005)
Cawan porselen dikeringkan dalam oven pada suhu 105ºC selama 1 jam. Cawan tersebut diletakkan ke dalam desikator pada suhu ruang selama 15 menit dan dibiarkan sampai dingin. Cawan tersebut ditimbang hingga beratnya konstan. Sebanyak 5 gram daging tambelo dimasukkan ke dalam cawan tersebut, kemudian dikeringkan dalam oven pada suhu 105ºC selama 5 jam. Cawan tersebut kemudian dimasukkan ke dalam desikator dan dibiarkan sampai dingin dan selanjutnya ditimbang kembali.
C = Berat cawan dengan sampel yang sudah dikeringkan (g) b. Kadar abu (AOAC 2005)
Cawan pengabuan dikeringkan dengan oven selama 1 jam pada suhu 105ºC, kemudian didinginkan di dalam desikator selama 15 menit dan ditimbang hingga berat konstan. Daging tambelo sebanyak 5 gram dimasukkan ke dalam cawan pengabuan dan dipijarkan di atas nyala api bunsen hingga tidak berasap. Cawan kemudian dimasukkan ke dalam tanur pengabuan dengan suhu 600ºC selama 6 jam, kemudian ditimbang hingga berat konstan.
Perhitungan kadar abu:
Keterangan :
A = Berat cawan porselen kosong (g) B = Berat cawan dengan sampel (g)
C = Berat cawan dengan sampel setelah dikeringkan (g) c. Kadar protein (AOAC 2005)
8
jernih lalu didinginkan. Setelah dingin, ke dalam labu Kjeldahl ditambahkan 50 mL akuades dan 20 mL NaOH 40%, kemudian dilakukan proses destilasi dengan suhu destilator 100ºC. Destilat ditampung dalam labu Erlenmeyer 125 mL yang berisi campuran 10 mL asam borat (H3BO3) 2% dan 2 tetes indikator bromcresol green-methyl red yang berwarna merah muda, setelah volume destilat mencapai 40 mL dan berwarna hijau kebiruan, maka proses destilasi dihentikan. Destilat kemudian dititrasi dengan HCl 0.1 N sampai terjadi perubahan warna merah muda. Volume titran dibaca dan dicatat. Larutan blanko dianalisis seperti contoh. Perhitungan kadar protein: selanjutnya dimasukkan ke dalam selongsong lemak, kemudian selongsong lemak digabungkan dengan labu lemak yang sudah ditimbang berat tetapnya (B). Selongsong lemak dimasukkan ke dalam ruang ekstraktor tabung soxhlet dan disiram dengan pelarut lemak (benzena). Refluks dilakukan selama 6 jam. Pelarut lemak yang ada dalam labu lemak didestilasi hingga semua pelarut lemak menguap. Pelarut akan tertampung di ruang ekstraktor dan dikeluarkan sehingga tidak kembali ke dalam labu lemak, selanjutnya labu lemak dikeringkan dalam C= Berat labu lemak dengan lemak (g) Ekstraksi Tambelo
Tahap ekstraksi diawali dengan preparasi sampel serta persiapan bahan dan alat untuk ekstraksi tambelo yang akan dilakukan. Bahan baku utama yang digunakan dalam penelitian ini adalah tambelo (Bactronophorus sp.) yang diperoleh dari hutan bakau di Kendari. Bahan baku dibawa menuju laboratorium dalam keadaan beku, menggunakan kemasan styrofoam.
9 dipotong kecil-kecil, lalu dimasukkan erlenmeyer. Sampel kemudian ditambahkan pelarut sebanyak 200 mL, lalu erlenmeyer ditutup dengan alumunium foil. Sampel dimaserasi dan diaduk menggunakan shaker dengan kecepatan 120 rpm selama 24 jam. Larutan ekstrak yang diperoleh disaring dengan kertas saring untuk memisahkan filtrat dan residunya. Residu direndam kembali dengan 200 mL pelarut selama 24 jam dan disaring dengan menggunakan kertas saring, kemudian diulang kembali dengan proses yang sama. Filtrat dievaporasi dengan rotary evaporator pada suhu 40ºC, sehingga menghasilkan ekstrak dalam bentuk pasta.
Ekstrak yang diperoleh kemudian dihitung rendemennya. Rendemen merupakan perbandingan antara berat ekstrak yang dihasilkan dengan berat awal bahan yang dinyatakan dalam persen (%).
Penghitungan rendemen:
Uji Aktivitas Antioksidan (Salazar-Aranda et al. 2009)
Uji aktivitas antioksidan yang digunakan berdasarkan kemampuan ekstrak/sampel dalam mereduksi radikal bebas DPPH. Uji aktivitas antioksidan ekstrak tambelo pada konsentrasi 50, 100, 500, 1000, 5000 µg/mL dengan kontrol positif vitamin C pada konsentrasi 1.25, 2.5, 5, 10, dan 20 µg/mL.
Ekstrak tambelo ditimbang sebanyak 50 mg kemudian ditambahkan etanol hingga 10 mL. Sebanyak 1.3 mg DPPH diencerkan dengan 25 mL etanol. Sebanyak 500 µL larutan DPPH dimasukkan ke dalam microwell plate, kemudian ditambahkan 500 µL ekstrak dengan berbagai konsentrasi. Setelah campuran homogen, diinkubasi pada suhu 30 oC selama 30 menit. Hasil inkubasi diukur dengan elisa reader pada panjang gelombang 517 nm.
Persentase inhibisi dapat dihitung dengan rumus berikut:
Nilai absorbansi dapat diperoleh dari persentase penghambatan aktivitas radikal bebas. Persamaan regresi diperoleh dari hubungan antara konsentrasi sampel dengan persentase penghambatan aktivitas radikal bebas. Sumbu x sebagai nilai konsentrasi dan sumbu y sebagai presentase penghambatan aktivitas radikal bebas. Persamaan yang diperoleh dalam bentuk y = b ln (x) + a. Persamaan tersebut digunakan untuk mencari inhibition concentration 50% (IC50) dengan memasukkan nilai 50 sebagai y sehingga didapatkan nilai x sebagai IC50.
Uji Aktivitas Inhibisi α-Glukosidase (Sancheti et al. 2009)
10
Sebanyak 50 µL buffer fosfat 0.1 M (pH 7.0) dicampurkan dengan 25 µL 4-nitrophenyl α-D-glukopyranoside 0.5 mM, 10 µL ekstrak uji pada berbagai konsentrasi (25, 50, 100, 500, 1000 µg/mL), dan 25 µL larutan α-glukosidase (0.04 unit mL-1) kemudian diinkubasi selama 30 menit pada suhu 37 oC. Reaksi kemudian dihentikan dengan penambahan 100 µL Na2CO3 (0.2 M). Akarbosa (glukobay) sebagai kontrol positif dengan konsentrasi 0.1, 0.5, 1, 5, 10 µg/mL. Hasil inkubasi diukur dengan menggunakan elisa reader pada panjang gelombang 410 nm.
Persentase inhibisi α-glukosidase ditentukan dengan menggunakan persamaan: [(B-S)/B] x 100%, dimana B adalah absorbansi blanko (tanpa adanya sampel), S : (S1-S0) dimana S1 adalah absorbansi sampel dengan penambahan enzim dan S0 adalah absorbansi sampel tanpa penambahan enzim.
Uji Aktivitas Antibakteri (Moorthy et al. 2007)
Aktivitas antimikroba ekstrak tambelo (metanol, etil asetat, dan heksana) dilakukan terhadap dua mikroba uji, yaitu Escherichia coli (bakteri Gram-negatif) dan Staphylococcus aureus (bakteri Gram-positif). Uji dilakukan dengan menggunakan metode difusi sumur (well diffusion method). Sebelum uji aktivitas antimikroba, dilakukan persiapan mikroba uji terlebih dahulu. Persiapan mikroba uji dilakukan dengan cara bakteri uji ditumbuhkan dalam media NA dan diinkubasi selama 24 jam pada suhu 37 oC. Selanjutnya mikroba uji dikultur pada media NB steril dan diinkubasikan selama 24 jam pada suhu 37 oC. Kultur bakteri diukur kekeruhannya menggunakan spektrofotometer UV-VIS pada panjang gelombang 600 nm. Sebanyak 20 µL bakteri uji ditambahkan ke dalam 20 mL media MHA steril. Media MHA yang mengandung bakteri uji dihomogenisasi menggunakan vortex kemudian dituang pada cawan petri steril. Media didiamkan hingga memadat, lubang (sumur) dibuat dengan diameter 6 mm secara aseptis. Ekstrak tambelo dimasukkan ke dalam lubang masing-masing 20 µL dengan konsentrasi 0.5 mg, 1 mg, dan 2 mg, beserta kontrol positif dan kontrol negatif. Kontrol positif menggunakan antibiotik kloramfenikol 30 µg dan kontrol negatif menggunakan pelarut yang digunakan dalam proses ekstraksi. Masing-masing perlakuan dilakukan secara duplo. Selanjutnya cawan diinkubasi pada suhu 37 oC selama 24 jam. Kemudian dilakukan pengukuran diameter zona bening yang terbentuk di sekeliling lubang dengan cara mengurangi diameter zona hambat yang terbentuk dengan diameter lubang (6 mm).
Uji Komponen Aktif (Harborne 2006)
a. Uji alkaloid
11 b. Uji flavonoid
Sampel sebanyak 0.1 g ditambah 10 mL air panas, dididihkan selama 5 menit, kemudian disaring. Filtrat sebanyak 10 mL ditambahkan 0.5 g serbuk Mg, 1 mL HCl pekat, dan 1 mL amil alkohol. Campuran dikocok kuat. Uji positif ditandai dengan timbulnya warna merah, kuning, atau jingga pada lapisan amil alkohol.
c. Uji tanin
Sampel sebanyak 0.1 g ditambah 10 mL air panas, dididihkan selama 5 menit, kemudian disaring. Filtrat sebanyak 10 mL ditambahkan tiga tetes FeCl3 10%. Uji positif ditandai dengan timbulnya warna hitam kehijauan.
d. Uji saponin
Sebanyak 0.1 g sampel ditambah dengan 20 mL aquades, kemudian dipanaskan selama 5 menit. Larutan dituang ke dalam tabung reaksi dalam keadaan panas. Larutan diambil sebanyak 10 mL, kemudian dikocok kuat secara vertical selama 10 detik. Adanya saponin ditandai dengan terbentuknya busa yang stabil setinggi 1-10 cm selama 10 menit dan tidak hilang pada saat ditambahkan dengan satu tetes HCl 2 N.
e. Uji steroid dan triterpenoid
Sebanyak sebanyak 0.1 g sampel ditambah dengan 25 mL etanol panas (50 OC), kemudian disaring. Filtrat dipanaskan hingga kering, lalu ditambahkan 1 mL Dietil eter. Larutan homogen kemudian ditambahkan 1 tetes H2SO4 pekat dan 1 tetes asam asetat anhidrat. Terbentuknya warna merah menandakan adanya senyawa triterpenoid dan terbentuknya warna hijau atau biru menandakan adanya senyawa steroid.
f. Uji hidrokuinon
Sebanyak 0.1 g sampel diekstrak dengan 20 mL etanol 70 % kemudian dipanaskan. Larutan disaring dan diambil sebanyak 1 mL kemudian ditambahkan 3 tetes larutan NaOH 10%. Terbentuknya warna merah menunjukkan adanya senyawa hidro kuinon dalam bahan.
Uji Toksisitas dengan Metode BSLT (Meyer et al. 1982)
12
Isolasi Bakteri dan Kapang dari Tambelo (Bactronophorus sp.) (Wenzel et al. 2002; Li et al. 2003; Upadhayaya et al. 2012; Tarman 2011)
Mikroorganisme simbion yang diisolasi berupa bakteri dan kapang. Isolasi bakteri simbion dilakukan dengan sterilisasi tambelo menggunakan etanol 70%, dicuci dengan PBS steril, diambil bagian jeroan dan usus dengan cara dibuka menggunakan gunting steril, ditimbang sebanyak 10 g kemudian ditambah dengan 90 mL akuades steril dan dihomogenisasi (Li et al. 2003). Beberapa kali pengenceran dari 10-1 sampai 10-5 (Wenzel et al. 2002) disiapkan, kemudian masing-masing pengenceran ditanam pada media selektif dengan metode pour plate. Media selektif Sea Water Complete (SWC) dibuat dan disterilisasi menggunakan autoklaf. Selanjutnya larutan isi usus dan lambung tambelo masing-masing diambil sebanyak 1 mL dan dituang ke dalam cawan dan ditambahkan media SWC, kemudian dihomogenkan dengan cara menggoyang cawan secara perlahan. Setelah itu diinkubasi selama 24 jam pada suhu 35 oC. Koloni bakteri yang tumbuh kemudian dimurnikan dengan menanam kembali beberapa kali pada media Nutrient Agar dalam cawan petri dengan cara digores dan diinkubasikan selama 24 jam pada suhu 35 oC sampai didapatkan seluruh biakan tersebut benar-benar murni.
Isolasi kapang simbion dilakukan dengan menempatkan tambelo utuh pada petri steril, kemudian disterilisasi menggunakan etanol 70%, diambil bagian jeroan dan usus dengan cara dibuka menggunakan gunting steril, dan diinokulasi dengan loop (Upadhayaya et al. 2012). Bagian usus dipotong sebesar 1 cm dengan ditanam di dalam media PDA air tawar yang telah ditambahkan kloramfenikol 1 mg/L dan diinkubasi pada suhu ruang selama 3 hari (Tarman 2011). Isolasi dilakukan sebanyak lima kali ulangan masing-masing dari jeroan dan usus. Dalam satu cawan terdapat enam titik peletakan sampel dari jeroan maupun usus. Isolat kapang yang berbeda (warna dan bentuk) dipisahkan pada cawan yang berbeda. Penapisan Bakteri dan Kapang dari Tambelo (Bactronophorus sp.) (Ji et al. 2003; Purwadaria et al. 2003; Andhikawati et al. 2014)
Masing-masing isolat bakteri dan kapang yang diperoleh dilakukan uji aktivitas selulolitik. Isolat-isolat bakteri yang sudah murni, selanjutnya ditumbuhkan pada media CMC yang terdiri dari MgSO4.7H2O 0.05 g/100 mL, Na2HPO4.2H2O 0.5 g/100 mL, NaCl 0.23 g/100 mL, yeast extract 0.2 g/100 mL, CMC 1 g/100 mL. Sebanyak 1 ose koloni bakteri ditanam dan diinkubasi selama 24 jam pada suhu 35 oC, diwarnai dengan congo red 0.1% dan diinkubasi selama 30 menit kemudian dibilas dengan larutan NaCl 1% (Ji et al. 2003). Zona bening yang terbentuk di sekitar koloni diukur diameternya.
Penapisan kapang selulolitik dengan metode zona bening (Purwadaria et al. 2003) dilakukan menggunakan pewarnaan merah kongo 0.1%.
13 Analisis Data
Data kuantitatif yang diperoleh dari penelitian ini diolah menggunakan rata-rata dan standar deviasi. Data kualitatif yang diperoleh diolah dengan menganalisis secara deskriptif.
3 HASIL DAN PEMBAHASAN
Karakteristik Tambelo (Bactronophorus sp.)
Tambelo merupakan dekomposer kayu yang penting, khususnya di perairan mangrove produktivitasnya semakin meningkat. Tambelo termasuk ke dalam golongan moluska dimana dibagian kepala terdapat cangkang. Cangkang ini memiliki fungsi untuk mengebor kayu hingga menjadi serbuk sehingga kayu dapat dicerna lebih mudah. Terdapat palet pada ujung tubuhnya yang berfungsi untuk membuat lubang selama kondisi berbahaya atau ketika pengeboran bermasalah. Palet merupakan bagian yang penting dalam proses indentifikasi tambelo. Menurut Syaputra (2003), palet yang berbentuk jangkungan merupakan genus Bactronophorus.
Gambar 3 Tambelo (A); palet dan cangkang tambelo (B)
Secara lengkap tambelo dikelompokkan ke dalam filum Moluska, kelas Bivalva, ordo Myoida, famili Teredinidae, genus Bactronophorus (Turner 1971). Habitat biota ini adalah tumbuhan mangrove yang sudah mati. Tumbuhan mangrove dengan spesies Rhizopora apiculata sangat disukai dibandingkan dengan jenis mangrove lainnya.
Tambelo pada penelitian ini memiliki rendemen daging dan jeroan yang tinggi sebesar 93.98% ± 2.08 dan rendemen cangkang dan palet sebesar 6.02% ± 2.08. Pengukuran rendemen dilakukan dengan menimbang berat cangkang dan palet dengan berat tambelo utuh. Menurut Syaputra et al. (2007), tambelo yang diperoleh dari Kabupaten bangka memiliki rendemen daging sebesar 94.87%, hasil ini tidak berbeda jauh dengan tambelo pada penelitian ini. Karakteristik tambelo dapat dilihat pada Lampiran 1.
14
Tabel 1 Komposisi kimia daging tambelo
Proksimat Tambelo segar (%)
Kadar air 73.93 ± 3.83
Kadar abu 1.24 ± 0.19
Kadar lemak 0.47 ± 0.18
Kadar protein 6.22 ± 0.13
Ket : Data dinyatakan sebagai rata-rata ± SD dari 3 ulangan
Daging tambelo pada penelitian memiliki komposisi kimia (Tabel 1) dengan kadar air 73.9%, kadar abu 1.24%, kadar lemak 0.47%, dan kadar protein 6.22%, sedangkan pada penelitian Syaputra et al. (2007), melaporkan bahwa kandungan proksimat tambelo untuk kadar air 73.60%, kadar abu 1.04%, kadar lemak 4.05%, dan kadar protein 4.29%. Tambelo pada penelitian ini memiliki kadar air, kadar abu, dan kadar protein lebih tinggi, sedangkan untuk kadar lemak lebih rendah. Hal ini dikarenakan tambelo diambil dari tempat yang berbeda sehingga berpengaruh terhadap komposisi tambelo. Menurut Periyasamy et al. (2011), menyatakan bahwa faktor yang berpengaruh terhadap komposisi kimia moluska, yaitu kondisi lingkungan, jenis sampel, ukuran sampel, jenis makanan, musim, kematangan seksual, dan suhu.
Komposisi kimia yang dihasilkan berhubungan dengan senyawa bioaktif pada tambelo, dimana senyawa bioaktif yang terbentuk merupakan derivat dari komponen kimia tersebut dan berpotensi sebagai antioksidan, antikanker, dan sebagainya. Menurut Grienke et al. (2014), pada moluska ditemukan senyawa bioaktif seperti peptida, dipeptida, squalene, seskuiterpen, terpen, alkaloid, polipropionat, komponen nitrogen, derivat asam lemak, makrolide, dan komponen lainnya yang mempunyai bioaktivitas spesifik. Penelitian Hasan et al. (2015) juga diperoleh pada ekstrak protein dari kerang kepah (Atactodea striata) memiliki asam amino yang lengkap dan mempunyai aktivitas sebagai antioksidan. Aktivitas antioksidan tertinggi pada fraksi ekstrak protein (kejenuhan ammonium sulfat 30-50%) dengan nilai IC50 sebesar 183.75 µg/mL.
Tambelo sendiri memiliki protein lebih rendah dibandingkan dengan moluska lainnya seperti keong taman (Helix aspersa) sebesar 9.87% (Cagiltay et al. 2011), oyster (Crassostrea rivularis) sebesar 8.06%, kerang (Meretrix meretrix) sebesar 10.67%, papia (Paphia papilionacea) sebesar 10.19% (Chen et al. 2012). Golongan moluska termasuk tambelo, memiliki kadar protein lebih rendah dengan biota laut lainnya. Kadar protein pada ikan sebesar 20% (Fuentes et al. 2010) dan krustasea sebesar 15-19% (Marques et al. 2010). Tambelo memiliki kadar lemak yang rendah sama halnya dengan penelitian yang dilakukan oleh Chen et al. (2012), dimana kandungan lemak pada semua sampel moluska dibawah 3%. Hal ini menunjukkan bahwa moluska merupakan sumber energi yang baik karena memiliki daging yang rendah lemak. Nilai Kadar abu moluska sekitar 1.57-1.72%, tidak berbeda jauh dengan tambelo.
Ekstrak Tambelo
15 yang dilakukan diharapkan dapat mengekstrak senyawa yang sesuai dengan kepolaran pelarut. Sarastani (2002) menyatakan bahwa pelarut dapat melarutkan ekstrak yang memiliki sifat kepolaran yang sama.
Filtrat dari hasil ekstraksi dievaporasi, sehingga diperoleh ekstrak dalam bentuk pasta. Rendemen ekstrak (Lampiran 2) metanol tambelo sebesar 3.12% ± 0.62, ekstrak etil asetat 0.68% ± 0.07, dan ekstrak heksana 0.41% ± 0.13. Ekstrak metanol memiliki rendemen lebih banyak dibandingkan dengan dua ekstrak yang lainnya. Hal ini menunjukkan bahwa senyawa yang terdapat pada tambelo lebih banyak yang bersifat polar, sedangkan senyawa yang bersifat semi-polar dan non-polar lebih sedikit. Menurut Setyawan dan Yudha (2013) menyatakan bahwa pelarut polar dapat melarutkan senyawa polar maupun non-polar karena mempunyai momen dipole yang besar. Menurut Hart et al. (2003), metanol yang bersifat polar juga memiliki berat molekul yang rendah sehingga mudah membentuk ikatan hidrogen pada jaringan sampel yang dapat melarutkan seluruh golongan metabolit sekunder.
Ketiga ekstrak yang dihasilkan, masing-masing di uji aktivitas biologis, seperti aktivitas antioksidan, inhibisi α-glukosidase, dan antibakteri. Ekstrak terpilih ditentukan berdasarkan hasil dari aktivitas biologis, yang kemudian diperoleh komponen bioaktif dan toksisitas dari ekstrak tersebut.
Aktivitas Antioksidan
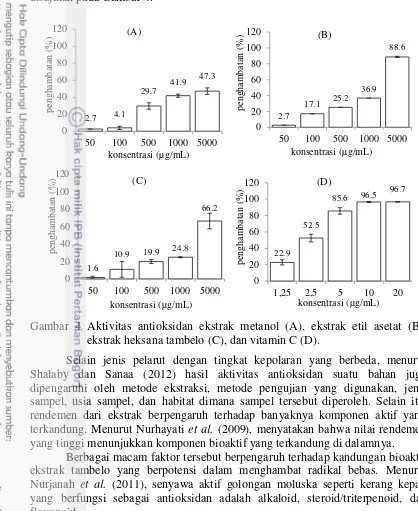
Uji aktivitas antioksidan dilakukan dengan melihat efektivitas ekstrak tambelo dalam mereduksi radikal bebas DPPH menggunakan elisa reader dengan panjang gelombang 517 nm. Vitamin C digunakan sebagai pembanding (kontrol positif).
Aktivitas ekstrak menunjukkan bahwa semakin tinggi konsentrasi ekstrak maka semakin besar persentase penghambatan radikal bebas DPPH (Gambar 4). Persen penghambatan dari variasi konsentrasi digunakan untuk mendapatkan nilai IC50 masing-masing ekstrak. Nilai IC50 menunjukkan konsentrasi sampel yang diperlukan untuk menghambat aktivitas radikal bebas DPPH sebanyak 50%. Nilai IC50 ekstrak metanol, etil asetat, dan heksana masing-masing sebesar 4072.59 µg/mL, 1072.19 µg/mL, dan 3081.03 µg/mL, sedangkan kontrol positif (vit. C) memiliki nilai lebih tinggi sebesar 2.21 µg/mL. Ketiga ekstrak tambelo memiliki nilai IC50 > 150 µg/mL, sehingga termasuk ke dalam aktivitas antioksidan yang lemah. Vitamin C tergolong dalam aktivitas antioksidan yang sangat kuat, karena memiliki nilai IC50 < 50 µg/mL (Blois 1958). Mekanisme kerja vitamin C sebagai antioksidan, yaitu peredam singlet oksigen dan menangkap radikal peroksil (Suranto 2011).
16
Berdasarkan hasil tersebut maka ekstrak etil asestat merupakan ekstrak terpilih yang digunakan pada tahap selanjutnya. Aktivitas antioksidan ekstrak tambelo disajikan pada Gambar 4.
Gambar 4 Aktivitas antioksidan ekstrak metanol (A), ekstrak etil asetat (B), ekstrak heksana tambelo (C), dan vitamin C (D).
Selain jenis pelarut dengan tingkat kepolaran yang berbeda, menurut Shalaby dan Sanaa (2012) hasil aktivitas antioksidan suatu bahan juga dipengaruhi oleh metode ekstraksi, metode pengujian yang digunakan, jenis sampel, usia sampel, dan habitat dimana sampel tersebut diperoleh. Selain itu, rendemen dari ekstrak berpengaruh terhadap banyaknya komponen aktif yang terkandung. Menurut Nurhayati et al. (2009), menyatakan bahwa nilai rendemen yang tinggi menunjukkan komponen bioaktif yang terkandung di dalamnya.
Berbagai macam faktor tersebut berpengaruh terhadap kandungan bioaktif ekstrak tambelo yang berpotensi dalam menghambat radikal bebas. Menurut Nurjanah et al. (2011), senyawa aktif golongan moluska seperti kerang kepah yang berfungsi sebagai antioksidan adalah alkaloid, steroid/triterpenoid, dan flavonoid.
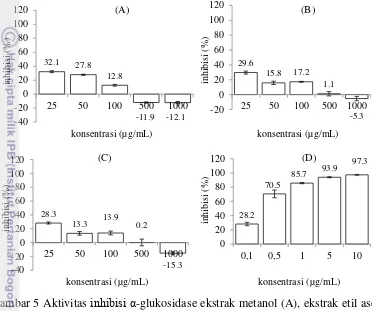
Aktivitas Inihibisi α-Glukosidase
17 Ketiga ekstrak tambelo (Gambar 5) menunjukkan persentase inhibisi enzim semakin menurun dengan semakin tingginya konsentrasi. Persen inhibisi yang diperoleh dari setiap ekstrak memiliki nilai inhibisi < 50%, sehingga nilai IC50 ekstrak terhadap aktivitas inhibisi α-glukosidase tidak dapat ditentukan. Ekstrak tambelo mampu menghambat kerja enzim sampai dengan konsentrasi 500 µg/mL pada ekstrak etil asetat dan heksana, sedangkan ekstrak metanol mampu menghambat kerja enzim sampai dengan konsentrasi 100 µg/mL. Aktivitas antioksidan ekstrak tambelo disajikan pada Gambar 5.
Gambar 5 Aktivitas inhibisi α-glukosidase ekstrak metanol (A), ekstrak etil asetat (B), ekstrak heksana tambelo (C), dan glukobay (D).
Ekstrak dengan pelarut metanol merupakan ekstrak yang memiliki persen inhibisi tertinggi (32.1%) pada konsentrasi 25 µg/mL. Perbedaan jenis pelarut dengan tingkat kepolaran yang berbeda dapat berpengaruh terhadap aktivitas inhibisi enzim, dimana pelarut metanol yang bersifat polar lebih efektif dibandingkan dengan dua pelarut lainnya. Hal ini menunjukkan bahwa senyawa aktif yang efektif dalam menghambat kerja enzim lebih bersifat polar.
Sesuai dengan penelitian yang dilakukan oleh Cahyani et al. (2015), bahwa aktivitas inhibisi enzim α-glukosidase dipengaruhi oleh senyawa aktif yang terkandung di dalam keong matah merah (Cerithidea obtusa). Senyawa yang dihasilkan dengan pelarut polar (metanol) seperti alkaloid, flavonoid, dan triterpenoid. Menurut Kim et al. (2008), senyawa-senyawa ini dapat bekerja secara kompetitif, dimana senyawa tersebut dapat meniru posisi transisi unit piranosidik dari substrat glukosidase alami.
Hasil aktivitas inhibisi enzim α-glukosidase ekstrak tambelo menurun seiring dengan tingginya konsentrasi, bahkan diperoleh persen inhibisi yang bernilai negatif. Penurunan persentase inhibisi α-glukosidase diduga karena
18
adanya peningkatan pembentukan produk berupa glukosa. Produksi glukosa ini diduga disebabkan oleh adanya enzim yang dihasilkan tambelo. Beberapa biota lain juga dapat memproduksi enzim ini, salah satunya rayap. Menurut Upadhyaya et al. (2012), rayap yang merupakan organisme pemakan kayu seperti tambelo dapat menghasilkan enzim selulase yang diekskresi dari kelenjar ludah maupun lambung rayap. Enzim selulase ini menurut Syamsudin et al. (2008) terbagi menjadi tiga enzim utama yaitu endoglukanase, eksoglukanase, dan selobiose. Endoglukanase ini dapat menghidrolisis ikatan β-1,4-glikosidik pada daerah amorf selulosa menjadi glukosa, selobiosa, dan selodekstrin. Eksoglukanase menghidrolisis selodekstrin dengan memutus unit selobiosa dari ujung rantai polimer, sedangkan selobiose menghidrolisis selobiosa dan selo-oligosakarida menjadi glukosa.
Aktivitas Antibakteri
Sampai saat ini telah banyak organisme laut yang dihasilkan memiliki akivitas antibakteri. Tambelo merupakan salah satu organisme laut yang belum banyak diteliti dan perlu dikaji aktivitas antibakteri. Tiga ekstrak tambelo diuji aktivitas antibakteri dengan menggunakan dua jenis bakteri yaitu E. coli (Gram-negatif) dan S. aureus (Gram-positif). Pada penelitian ini digunakan kloramfenikol untuk kontrol positif dan pelarut (metanol, etil asetat, heksana) untuk kontrol negatif. Gambar hasil uji antibakteri dapat dilihat pada Lampiran 4. Diameter zona hambat ekstrak tambelo disajikan pada Tabel 2.
Tabel 2 Diameter zona hambat (mm) ekstrak tambelo Ekstrak
Ket : (-) Pelarut (metanol, etil asetat, dan heksana); (+) kloramfenikol
19 Ekstrak etil asetat tambelo memiliki aktivitas antibakteri tertinggi terhadap bakteri E. coli (konsentrasi 2 mg/sumur) dibandingkan dengan ekstrak heksana. Hal ini dapat disimpulkan bahwa senyawa yang terkandung pada ekstrak etil asetat tambelo secara spesifik menghambat bakteri E. coli yang termasuk ke dalam bakteri Gram-negatif dengan dinding sel kompleks. Penelitian Dewi et al. (2010) menunjukkan hal yang sama, ekstrak teripang (Holothuria scabra) dapat menghambat bakteri E. coli namun tidak dapat menghambat bakteri B. subtilis dan Salmonella. Aktivitas penghambatan bakteri ini dapat dipengaruhi oleh kandungan zat yang ada di dalam ekstrak. Menurut Nimah et al. (2012) teripang pasir (H. scabra) memiliki senyawa metabolit sekunder berupa saponin, steroid, alkaloid, dan triterpenoid yang berpotensi sebagai senyawa antibakteri.
Hasil penelitian Faikoh et al. (2013), ekstrak heksana sponge (Geodia sp.) memiliki aktivitas antibakteri (terhadap E. coli) lebih rendah dibandingkan dengan ekstrak tambelo, dengan zona hambat sebesar 7.23 pada konsentrasi 2 mg/mL. Penelitian lainnya (Haryati et al. 2015) ekstrak total dan fraksi etil asetat daun merah (Syzygium myrtifolium) diperoleh zona hambat lebih rendah (8.70 mm dan 8.23 mm pada konsentrasi 2%) dibandingkan dengan ekstrak tambelo terhadap bakteri E. coli.
Komponen Bioaktif dan Toksisitas Ekstrak Terpilih
Aktivitas biologis yang telah diuji dari ketiga ekstrak tambelo diperoleh ekstrak etil asetat memiliki aktivitas antioksidan tertinggi dengan nilai IC50 sebesar 1072,19 µg/mL. Pada uji aktivitas inhibisi α-glukosidase diperoleh persen inhibisi tertinggi pada ekstrak metanol sebesar 32.1% dengan konsentrasi 25 µg/mL. Pada uji antibakteri diperoleh ekstrak heksana memiliki aktivitas penghambatan terhadap kedua bakteri (E. coli dan S. aureus) dan ekstrak etil asetat secara spesifik dapat menghambat bakteri E. coli dengan zona hambat tertinggi sebesar 10.5 mm (konsentrasi 2 mg/sumur). Berdasarkan hasil dari aktivitas biologis ketiga ekstrak tambelo, dapat disimpulkan bahwa ekstrak terpilih adalah ekstrak etil asetat tambelo. Senyawa aktif yang ada pada ekstrak tambelo memiliki pengaruh terhadap berbagai aktivitas biologis yang sudah dilakukan, terutama pada ekstrak etil asetat. Komponen bioaktif ekstrak etil asetat tambelo disajikan pada Tabel 3.
Tabel 3 Komponen bioaktif ekstrak etil asetat tambelo
Fitokimia Hasil
20
terhadap aktivitas antioksidan. Menurut Permatasari et al. (2013), senyawa ini juga mampu merusak permeabilitas dinding sel bakteri, mikrosom, dan lisosom sebagai hasil interaksi antara flavonoid dengan DNA bakteri.
Tanin merupakan salah satu senyawa fenolik yang dapat berpengaruh terhadap pertumbuhan bakteri. Menurut Rachmawati et al. (2011), senyawa fenolik pada konsentrasi rendah mampu merusak membran sitoplasma dan dapat menyebabkan kebocoran inti sel, sedangkan pada konsentrasi tinggi senyawa fenol berkoagulasi dengan protein seluler.
Menurut Permatasari et al. (2013), saponin merupakan zat antibakteri yang dapat menghambat fungsi membran sel mikroba. Senyawa ini membentuk senyawa kompleks dengan membran sel melalui ikatan hidrogen. Hal ini akan menghancurkan dinding sel bakteri yang bersifat permeabel, sehingga menyebabkan pelepasan isi sel dan menimbulkan kematian sel bakteri.
Senyawa aktif lain yang terdeteksi adalah steroid. Steroid diduga berpengaruh dalam aktivitas biologis yang diperoleh. Menurut Bangham dan Horne (2006), senyawa ini mampu berinteraksi dengan membran fosfolipid sel yang bersifat impermeabel terhadap senyawa-senyawa lipofilik sehingga menyebabkan integritas membran menurun, morfologi membran sel berubah, kemudian membran sel menjadi rapuh dan lisis. Menurut Dewi et al. (2010), steroid yang ada dapat meningkatkan vitalitas pria, sehingga banyak diminati sebagai bahan makanan kesehatan. Senyawa steroid yang terdeteksi pada tambelo menjelaskan bahwa kepercayaan masyarakat pesisir terhadap biota ini sebagai peningkat vitalitas pria terbukti secara ilmiah.
Senyawa bioaktif yang diperoleh berhubungan dengan sifat toksisitas suatu ekstrak. Nilai LC50 ekstrak terpilih yaitu ekstrak etil asetat tambelo sebesar 425.908 µg/mL. Nilai LC50 ekstrak ini kurang dari 1000 µg/mL, hal ini menunjukkan bahwa ekstrak etil asetat tambelo bersifat toksik. Menurut Meyer et al. (1982), menyatakan suatu zat dinyatakan bersifat toksik apabila nilai LC50 < 1000 µg/mL untuk ekstrak dan ≤ 30 µg/mL untuk suatu senyawa. Analisis probit toksisitas ekstrak etil asetat tambelo dapat dilihat pada Lampiran 5.
Menurut Sanjayasari dan Pliliang (2011), adanya senyawa bioaktif terutama golongan flavonoid berpengaruh terhadap nilai toksisitas. Senyawa flavonoid terdapat gugus hidroksil yang mampu berikatan dengan protein integral membran sel sehingga mengganggu transpor aktif Na+ dan K+, serta menyebabkan pecahnya membran sel pada larva udang Artemia salina sebagai bahan uji.
Ekstrak tambelo memiliki sifat toksik lebih rendah dibandingkan dengan
moluska lainnya. Ekstrak kasar pada empat jenis teripang yaitu Actinopyga miliaris, Holothuria leucospilota, Bohadschia argus, dan Bohadschia
21 Isolat Mikroorganisme Simbion dari Tambelo
Isolat Mikroorganisme Simbion
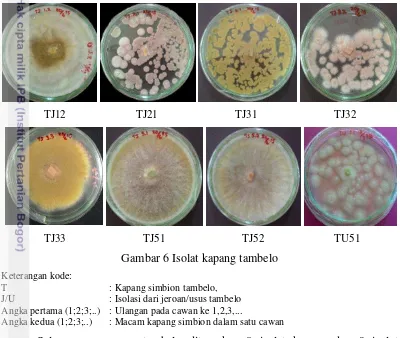
Tambelo dapat mencerna 80% selulosa dan 45% lignin (Purchon 1958), sehingga biota ini diduga dapat menghasilkan enzim yang dapat memecah selulosa. Enzim yang dapat mendegradasi selulosa adalah enzim selulase. Enzim selulase yang dihasilkan tambelo diduga berasal dari mikroorganisme yang berasosiasi dalam mendegradasi selulosa. Menurut Arora et al. (1991), hewan yang dapat mendekomposisi selulosa, diduga memiliki aktivitas enzim yang diproduksi oleh mikroorganisme pada saluran pencernaannya. Kemungkinan mikroorganisme seperti kapang dan bakteri sangat berperan dalam mendegradasi selulosa. Morfologi dari 8 isolat kapang disajikan pada Gambar 6.
TJ12 TJ21 TJ31 TJ32
TJ33 TJ51 TJ52 TU51
Gambar 6 Isolat kapang tambelo Keterangan kode:
T : Kapang simbion tambelo,
J/U : Isolasi dari jeroan/usus tambelo
Angka pertama (1;2;3;..) : Ulangan pada cawan ke 1,2,3,...
Angka kedua (1;2;3;..) : Macam kapang simbion dalam satu cawan
Saluran pencernaan tambelo ditemukan 8 isolat kapang dan 9 isolat bakteri. Isolat kapang yang diperoleh yaitu kode TJ12, TJ21, TJ31, TJ32, TJ33, TJ51, TJ52, dan TU51. Hasil mikroskopik kapang simbion dapat dilihat pada Lampiran 6.
Menurut Santhakumaran (2000), menyatakan bahwa di dalam saluran pencernaan tambelo terdapat mikroorganisme simbion salah satunya adalah mikroflora berupa kapang. Mikroflora ini berasal dari kayu mangrove yang dicerna, kemudian menetap di dalam saluran pencernaan dan membantu mendegradasi selulosa dengan menghasilkan enzim selulase.
22
isolat oleh Tarman et al. (2013). Lima isolat kapang didapatkan satu isolat yang menonjol dan memiliki aktivitas antibakteri dengan zona hambat > 20 mm pada konsentrasi 1-2 mg/mL. Penelitian tersebut memungkinkan bahwa kapang yang di isolasi dari saluran pencernaan tambelo memiliki aktivitas antibakteri.
Saluran pencernaan tambelo juga diisolasi mikroorganisme simbion berupa bakteri. Isolat bakteri yang diperoleh sebanyak 9 isolat meliputi S2A, S2B, S2D, S2F, S3A, S3B, S3C, S3D, dan S3E (Gambar 7). Sembilan isolat diperoleh terdapat empat isolat yang termasuk ke dalam bakteri Gram-negatif yaitu S2A, S2B, S2D, dan S3D. Lima isolat lainnya termasuk ke dalam bakteri Gram-positif yaitu S2D, S3A, S3B, S3C, dan S3E. Hasil mikroskopik bakteri simbion dapat dilihat pada Lampiran 7. Bakteri simbion yang diperoleh diduga memiliki hubungan dengan aktivitas biologis ekstrak tambelo, dimana bakteri simbion membantu dalam mendegradasi selulosa sekaligus memproduksi senyawa sekunder yang terserap oleh tambelo sehingga mempengaruhi aktivitas biologis yang didapat.
Menurut hasil penelitian Pringgenies (2010), skrining terhadap isolat bakteri simbion pada moluska jenis Conus miles, Stramonita armigera, dan Cymbiola vespertilo diperoleh tiga isolat bakteri aktif yang mampu dalam menghambat bakteri MDR lebih dari satu jenis meliputi Klebsiella, Pseudomonas, Staphylococcus, E. coli, dan Enterobacter.
Isolasi mikroorganisme simbion diharapkan dapat menunjukkan aktivitas biologis yang lebih baik dibandingkan dengan biota inangnya. Hal ini merupakan salah satu solusi dalam pengembangan senyawa bioaktif avertebrata laut, dimana menurut Proksch et al. (2002), menyatakan bahwa karena senyawa bioaktif yang dihasilkan sangat terbatas sehingga dapat mengancam keberadaan avertebrata laut itu sendiri. Isolat bakteri yang diperoleh disajikan pada Gambar 7.
Gambar 7 Isolat bakteri tambelo
Ket kode:
S : Bakteri simbion tambelo, 1;2;3;.. : Pengenceran ke 1,2,3,...
A;B;C;.. : Macam bakteri simbion dalam satu cawan
Aktivitas Selulolitik Mikroorganisme Simbion
Aktivitas selulolitik mikroorganisme simbion menunjukkan adanya produksi enzim selulase dalam mendegradasi selulosa, dimana diperoleh nilai indeks selulolitik (nisbah daerah bening). Menurut Purwadaria et al. (2003) nisbah daerah bening (indeks selulolitik) ditentukan dengan membagi diameter daerah
23 bening dengan diameter koloni. Isolat kapang dan bakteri simbion yang diperoleh kemudian diuji aktivitas selulolitik dengan menggunakan media selektif.
Isolat kapang simbion diinkubasi selama dua hari, setelah itu di tambahkan pewarna Congo red untuk mendapatkan zona bening. Tabel 4 menunjukkan aktivitas selulolitik yang ditandai dengan adanya zona bening yang dihasilkan dihitung indeks selulolitik. Indeks selulolitik kapang simbion disajikan pada Tabel 4.
Tabel 4 Indeks selulolitik kapang dari tambelo Kode Indeks selulolitik kapang
Kapang yang memiliki indeks selulolitik tertinggi yaitu TJ21 dengan nilai indeksnya sebesar 4.53, sedangkan kapang dengan indeks selulolitik terendah adalah TJ51 sebesar 1.07. Hasil penelitian Handayani dan Purwantisari (2015), diperoleh indeks selulolitik dari berbagai macam jenis kapang. Indeks selulolitik pada Aspergillus flavus, Fusarium oxysporum, Aspergillus awamori, dan Trichoderma sebesar 2.06, 1.8, 1.77, dan 1.73. Beberapa kapang yang dihasilkan dari tambelo pada penelitian ini memiliki indeks selulolitik lebih tinggi dengan nilai indeks > 3 diantaranya TJ21, TJ32, dan TJ33.
Sembilan isolat bakteri simbion yang diperoleh, hanya tiga isolat yang memiliki aktivitas selulolitik. Bakteri simbion dengan indeks selulolitik tertinggi adalah S2B sebesar 2.25 dan indeks selulolitik terendah adalah S3C sebesar 0.25 (Tabel 5). Indeks selulolitik bakteri dari tambelo disajikan pada Tabel 5.
Tabel 5 Indeks selulolitik bakteri dari tambelo Kode Indeks selulolitik bakteri
24
4 SIMPULAN DAN SARAN
Simpulan
Ekstrak tambelo memiliki aktivitas antioksidan yang tergolong lemah. Ketiga ekstrak tambelo mengalami penurunan aktivitas inhibisi α-glukosidase pada konsentrasi yang semakin tinggi. Ekstrak etil asetat dan heksana tambelo mempunyai aktivitas antibakteri. Isolasi mikroorganisme simbion pada saluran pencernaan tambelo diperoleh delapan isolat kapang dan semua isolat memiliki aktivitas selulolitik. Isolasi mikroorganisme simbion pada saluran pencernaan tambelo diperoleh sembilan isolat bakteri dan tiga isolat memiliki aktivitas selulolitik.
Saran
25
DAFTAR PUSTAKA
Albuntana A, Yasman, Wardhana W. 2011. Uji toksisitas ekstrak empat jenis teripang suku Holothuriidae dari Pulau Penjaliran Timur, Kepulauan Seribu, Jakarta. Jurnal Ilmu dan Teknologi Kelautan Tropis. 3(1): 65-72. Andhikawati A, Oktavia Y, Ibrahim B, Tarman K. 2014. Isolasi dan penapisan
kapang laut endofit penghasil selulase. Jurnal Ilmu dan Teknologi Kelautan Tropis. 6(1): 219-227.
Anwar LO, Hardjito L, Desniar. 2014. Fermentasi tambelo dan karakteristik produknya. Jurnal Pengolahan Hasil Perairan Indonesia. 17(3).
Anwar LO, Rosmawati. 2013. Karakteristik hidrolisat protein tambelo (Bactronophorus sp.) yang dihidrolisis menggunakan enzim papain. Jurnal ilmiah biologi. 1(2): 133-140.
Arora DK, Rai B, Mukerji KG, Knudsen GR. 1991. Handbook of Applied Mycology Soil and Plant Volume 1. Marcel Dekker Inc. 270 Madison Avenuue, New York.
Association of Official Analytical Chemist [AOAC]. 2005. Official Methods of Analysis (18 Edn). USA. Associaton of Official Analytic Chemist Inc. Mayland.
Bangham AD, Horne RW. 2006. Action of saponins on biological cell membranes. Journal Nature. 196: 952-953.
Blois MS. 1958. Antioxidant determinations by the use of a stable free radical. Nature. 181: 1199-1200.
Cagiltay F, Erkan N, Tosun D, Selcuk A. 2011. Amino acid, fatty acid, vitamin and mineral contents of the edible garden snail (Helix aspersa). Journal Article. 5(4): 354-363.
Cahyani RT, Purwaningsih S, Azrifitria. 2015. Antidiabetic potential and secondary metabolites screening of mangrove gastropod Cerithidea obtusa. Journal of Coastal Life Medicine. 3(5): 356-360.
Chen DW, Su J, Liu XL, Yan DM, Lin Y, Jiang WM, Chen XH. 2012. Amino acid profile of bivalve mollusks from Beibu Gulf, China. Journal of Aquatic Food Product Technology. 21: 369-379.
Dewi KH, Susanti L, Markom M, Yanti EN. 2010. Pengaruh kecepatan sentrifugasi pada proses pemisahan hasil ekstrak teripang pasir (Holothuria scabra) sebagai sumber testosteron alami dan antigen.
Prosiding Seminar Teknik Kimia “Kejuangan” Pengembangan
Teknologi Kimia untuk Pengolahan Sumber Daya Alam Indonesia. 1693-4393.
26
Faikoh EN, Yuliana DE, Suhendriani S, Aini HQ. 2013. Studi daya antibakteri ekstrak karang lunak (Geodia sp.) segar terhadap bakteri Escherechia coli dan Vibrio parahaemolyticus serta kandungan senyawa aktifnya. Jurnal Teknologi Pertanian. 14(3) : 201-208.
Fidrianny I, Harnovi M, Insanu M. 2014. Evaluation of antioxidant activities from various extracts of sweet orange peel using DPPH, FRAP assays, and correlation with phenolic, flavonoid, carotenoid content. Asian Journal of Pharmaceutical and Clinical Research. 7(3): 0974-2441.
Grienke U, Silke J, Tasdemis D. 2014. Bioactive compounds from marine mussels and their effect on human health. Food Chemistry. 142: 48-60.
Handayani T, Purwantisari S. 2015. Isolation and identification of mold contaminants on mushroom growing medium (Bag Log) and their cellulolytic perfomance test. Jurnal Sains dan Matematika. 23(2): 55-58. Harborne, J.B. 2006. Metode Fitokimia: Penuntun Cara Modern Menganalisis Tumbuhan. Edisi IV. Kokasih P, Soediro I, penerjemah. Bandung : ITB. Hardinsyah, Sumule A, Letsoin J. 2006. Jenis dan jumlah konsumsi tambelo,
siput, dan kerang oleh penduduk di kawasan Muara Mimika, Papua. Jurnal Gizi dan Pangan. 1: 1-12.
Hart H, Craine LE, Hart DJ. 2003. Kimia organik: suatu kuliah singkat. Achmadi SS, penerjemah. Jakarta (ID): PT. Erlangga.
Haryati NA, Saleh C, Erwin. 2015. Uji toksisitas dan aktivitas antibakteri ekstrak daun merah tanaman pucuk merah (Syzygium myrtifolium Walp.) terhadap bakteri Staphylococcus aureus dan Escherichia coli. Jurnal Kimia Mulawarman. 13(1): 35-40.
Hasan T, Wahab AW, Djide N, Zakir M. Antioxidant activity of bioactive protein of kerang kepah (Atactodea striata) from South Sulawesi. American Journal of Biomedical and Life Sciences. 3(6): 111-114.
Ji W, Ming D, Yan Hong L, Qing Xi C, Gen Jun X, Fu Kun Z. 2003. Isolation of multifunctional endogenous cellulase gene from mollusc, Ampullaria crossean. Acta Biochimica et Biophysica Sinica. 35(10) 941-946.
Katzung BG. 2004. Farmakologi Dasar dan Klinik. Jakarta (ID): Salemba Medika.
Kim KY, Nam KA, Kurihara H, Kim SM. 2008. Potent α-glukosidase inhibitors purified from red alga Grateloupia elliptica. Phytochemistry. 69: 2820-2825.
Lechene CP, Luyten Y, McMahon G, Distel DL. 2007. Quantitative imaging of nitrogen fixation by individual bacteria within animal cells. Science. 317: 1563-1566.
27 Leiwakabessy J. 2011. Komposisi kimia dan identifikasi senyawa antioksidan dari ekstrak tambelo (Bactronophorus thoracites). [tesis]. Program Pascasarjana, IPB, Bogor.
Marques A, Teixeira B, Barrento S, Anacleto P, Carvalho ML, Nunes ML. 2010. Chemical compotition of atlantic spider crab Maja brachydactyla: Human health implications. Journal of Food Competition Analysis. 23(3): 230-237.
Meyer BN, Ferrigni NR, Putnam JE, Jacobsen LB, Nicholas DE, McLaughlin JL.1982. Brine shrimp: a convenient general bioassay for active plant constituents. Planta Medica. 45(3):31-34.
Moorthy K, Srinivasan K, Subramanian, Palaniswamy M, Mohanasundari C. 2007. Phytochemical screening and antibacterial evaluation of stem bark of Mallotus philippinensis var. Tomentosus. African Journal of Biotechnology. 6(13): 1521-1523.
Nazeer RA, Naqash SY. 2011. In vitro antioxidant activity of two mollusc, Loligo duvauceli Orbigny and Donax cuneatus Linnaeus, by solvent extraction methods. Mediterranean Journal of Nutrition Metabolism. 6: 17-21. Nimah S, Ma’ruf WF, Trianto A. 2012. Uji bioaktivitas ekstrak teripang pasir
(Holothuria scabra) terhadap bakteri Pseudomonas aeruginosa dan Bacillus cereus. Jurnal Perikanan. 1(2): 1-9.
Nurhayati T, Aryanti D, Nurjanah. 2009. Kajian awal potensi ekstrak spons sebagai antioksidan. Jurnal Kelautan Nasional. 2: 43-51.
Nurjanah, Izzati L, Abdullah A. 2011. Aktivitas antioksidan dan komponen bioaktif kerang pisau (Solen spp). Jurnal Ilmu Kelautan. 16(3): 119-124. Periyasamy N, Srinivasan M, Devanathan K, Balakrishnan S. 2011. Nutritional
value of gastropod Babylonia spirata (Linnaeus 1758) from Thazhanguda, Southeast Coast of India. Asian Pasific Journal of Tropical Biomedicine. 1(2): S249-S252.
Permatasari GAAA, Besung INK, Mahatmi H. 2013. Daya hambat perasan daun sirsak terhadap pertumbuhan bakteri Escherichia coli. Indonesia Medikus Veterinus. 12(2): 162-169.
Pringgenies D. 2010. Karakteristik senyawa bioaktif bakteri simbion moluska dengan GC-MS. Jurnal Ilmu dan Teknologi Kelautan Tropis. 2(2): 34-40.
Proksch P, Erdrada RA, Ebel R. 2002. Drugs from the seas current status and microbiological implications. Applied Microbiology and Biotechnology. 59: 125-134.
Purchon RD. 1986. The Stomach in The Bivalvia. Phil. Trans. R. Soc. London. 316: 183-276.
28
Rachmawati F, Nuria MC, Sumantri. 2011. Uji aktivitas antibakteri fraksi kloroform ekstrak etanol pegagan (Centella asiatica L Urb) serta identifikasi senyawa aktifnya. Prosiding Seminar Nasional Peranan dan Kontribusi Herbal dalam Terapi Penyakit Degeneratif ; Semarang, Indonesia. Semarang (ID): e-Publikasi Ilmiah Fakultas Farmasi Universitas Wahid Hasyim. hlm 7-13.
Riviani, Purwaningsih S, Tarman K. 2016. Pofil asam amino, asam lemak, kandungan mineral tambelo (Bactronophorus sp.) dari Kendari Sulawesi Tenggara. Jurnal Pengolahan Hasil Perikanan Indonesia. 19(1): 51-57. Salazar-Aranda R, Perez-L’opez LA, L’opez-Arroyo J, Alanis-Garza BA, Torres
NW. 2009. Antimicrobial and antioxidant activities of plants from northeast of mexico. Evidence-Based Complementary and Alternative Medicine. 2011: 1-6.
Sancheti S, Sancheti S, Seo SY. 2009. Chaenomeles sinensis: a potent α-and β-glucosidase inhibitor. American Journal of Pharmacology and
Toxicology. 4(1): 8-11.
Sanjayasari D, Pliliang WG. 2011. Skrining fitokimia dan uji toksisitas ekstrak daun katuk (Saoropus androgenus L Merr) terhadap larva udang Artemia salina: potensi fitokimia pada ikan. Berkala Perikanan Terubuk. 39(1): 91-100.
Santhakumaran LN. 2000. Wood-borer. Scientist-SG (Retd.), Institute of Wood Science and Technology. 425-437.
Sastrani D, Soekarto ST, Muchtadi TR, Fardiaz D, Apriyantono A. 2002. Aktivitas antioksidan ekstrak dan fraksi ekstrak biji antung (Parinarium glaberrimum). Jurnal Teknologi dan Industri Pangan. 13(2).
Setyawan PE, Yudha S. 2013. Optimalisasi ekstraksi dan uji stabilitas phycocyanin dari mikroalga Spirulina platensis. Jurnal Teknologi Kimia dan Industri. 2(2): 61-67.
Shalaby EA, Sanaa MMS. 2012. Comparison of DPPH and ABTS assays for determining antioxidant potential of water and methanol extracts of Spirulina platensis. Indian Journal of Geo-Marine Sciences. 45(5): 556-564.
Sukumaran RK, Singhania RR, Pandey A. 2005. Microbial cellulases production, application, and challenges. Journal of Science and Industrial Research. 64: 832-844.
Suranto A. 2011. Terbukti Pome Tumpas Penyakit. Puspa Swara.
Syamsudin S, Purwati, Taufik AR. 2008. Efektifitas aplikasi enzim dalam sistem lumpur aktif pada pengolahan limbah pulp dan kertas. Berita selulosa. 43(2): 83-92.