AKTIVITAS EKSTRAK CACING LAUT Siphonosoma australe
SEBAGAI ANTIHIPERGLIKEMIK PADA TIKUS GALUR
Sprague Dawley YANG DIINDUKSI STREPTOZOTOCIN
GESTI RIZKA ANINDA
DEPARTEMEN TEKNOLOGI HASIL PERAIRAN
FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR
BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN SUMBER
INFORMASI SERTA PELIMPAHAN HAK CIPTA *
Dengan ini saya menyatakan bahwa skripsi yang berjudul Aktivitas Ekstrak Cacing Laut Siphonosoma australe sebagai Antihiperglikemik pada Tikus Galur Sprague Dawley yang Diinduksi Streptozotocin adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini. Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Maret 2016
Gesti Rizka Aninda NIM C34110080
ABSTRAK
GESTI RIZKA ANINDA. Aktivitas Ekstrak Cacing Laut Siphonosoma australe sebagai Antihiperglikemik pada Tikus Galur Sprague Dawley yang Diinduksi Streptozotocin. SRI PURWANINGSIH dan EKOWATI HANDHARYANI.
Siphonosoma australe merupakan salah satu spesies cacing laut yang termasuk ke dalam filum Sipuncula dan belum dimanfaatkan secara optimal. Tujuan penelitian ini adalah untuk menentukan aktivitas ekstrak cacing laut Siphonosoma australe sebagai antihiperglikemik pada tikus galur Sprague Dawley yang diinduksi streptozotocin serta mengetahui pengaruhnya terhadap kadar SGOT, SGPT, dan MDA. Hasil penelitian menunjukkan bahwa ekstrak etanol cacing S. australe memiliki aktivitas antihiperglikemik terbaik pada dosis 45 mg/kgBB yang dapat menurunkan kadar glukosa darah tikus sebesar 104±38,59 mg/dL dan meningkatkan bobot tubuh sebesar 18,2±19,49 g. Perlakuan ekstrak cacing S. australe memberikan efek pemulihan terbaik pada dosis 45 mg/kgBB dengan kadar SGOT 152,67±17,21 U/L, kadar SGPT sebesar 16,33 ± 28,01 U/L, dan kadar MDA 0,54±0,1 nmol/mL. Kandungan senyawa bioaktif ekstrak etanol cacing S. australe yang diduga dapat memberikan efek antihiperglikemik yaitu flavonoid, alkaloid, saponin, dan steroid.
Kata kunci: antihiperglikemik, Siphonosoma australe, streptozotocin.
ABSTRACT
GESTI RIZKA ANINDA. The Activity of Marine Worms Siphonosoma australe Extract as Antihyperglycemic in Sprague Dawley Rat Strain were Induced by Streptozotocin SRI PURWANINGSIH and EKOWATI HANDHARYANI.
Siphonosoma australe is one species of marine worms belonging to the phylum Sipuncula and is not used optimally yet. The purpose of this study was to determine the activity of marine worms (Siphonosoma australe) ethanol extract as antihyperglycemic in Sprague Dawley rat strain were induced by streptozotocin and determine its influence on the levels of SGOT, SGPT, and MDA. The results showed that the ethanol extract of S. australe worm had the best antihyperglycemic activity at a dose of 45 mg/kg body weight could decrease blood glucose levels of rat by 104 ± 38.59 mg /dL and increased the body weight of 18.2 ± 19.49 g. S. australe worm extract treatment gave the best recovery effect at a dose of 45 mg/kg body weight with SGOT levels of 152.67±17.2 U/L, SGPT levels of 16.33 ± 28.01 U/L, and MDA levels of 0.54 ± 0.1 nmol/mL. The bioactive compounds of S. australe ethanol extract that could provide antihyperglycemic effect were flavonoids, alkaloids, saponins and steroids.
© Hak Cipta Milik IPB, Tahun 2016
Hak Cipta Dilindungi Undang
–
Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa menyantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah dan pengutipan tersebut tidak merugikan kepentingan IPB
AKTIVITAS EKSTRAK CACING LAUT Siphonosoma australe
SEBAGAI ANTIHIPERGLIKEMIK PADA TIKUS GALUR
Sprague Dawley YANG DIINDUKSI STREPTOZOTOCIN
GESTI RIZKA ANINDA
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Perikanan pada
Departemen Teknologi Hasil Perairan
DEPARTEMEN TEKNOLOGI HASIL PERAIRAN
FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR
BOGOR
KATA PENGANTAR
Puji dan syukur penulis panjatkan kehadirat Allah SWT, atas berkat dan rahmat-Nya penulis dapat menyelesaikan skripsi yang berjudul “Aktivitas Ekstrak Cacing Laut Siphonosoma australe sebagai Antihiperglikemik pada Tikus Galur Sprague Dawley yang Diinduksi Streptozotocin”.
Penulis mengucapkan terima kasih kepada semua pihak yang telah membantu dalam proses penyusunan karya ilmiah ini, terutama kepada:
1 Dr Ir Sri Purwaningsih, MSi dan Prof Dr Ekowati Handharyani, PhD APVet selaku dosen pembimbing atas segala saran, arahan, motivasi dan ilmu yang diberikan kepada penulis,
2 Dr Desniar, SPi MSi selaku dosen penguji, terima kasih atas segala saran, bimbingan, arahan, dan ilmu yang diberikan kepada penulis,
3 Prof Dr Ir Joko Santoso, MSi selaku Komisi Pendidikan dan Ketua Departemen Teknologi Hasil Perairan atas segala saran dan bimbingan yang diberikan,
4 Orang tua dan keluarga yang telah memberikan doa serta dukungannya baik secara moril maupun materil,
5 Laboran dan teknisi yang telah membantu penulis selama penelitian, 6 Teman–teman Teknologi Hasil Perairan atas segala doa, bantuan,
semangat dan dukungan yang diberikan.
Penulis menyadari bahwa karya ilmiah ini masih ada kekurangan. Penulis mengharapkan kritik dan saran yang membangun untuk perbaikan skripsi ini. Semoga karya ilmiah ini dapat bermanfaat.
Bogor, Maret 2016
DAFTAR ISI
DAFTAR TABEL ... vii
DAFTAR GAMBAR ... vii
DAFTAR LAMPIRAN ... vii
PENDAHULUAN ... 1
Latar Belakang ... 1
Perumusan Masalah ... 2
Tujuan Penelitian ... 2
Manfaat Penelitian ... 2
Ruang Lingkup Penelitian ... 2
METODE PENELITIAN ... 3
Bahan ... 3
Alat ... 3
Prosedur Penelitian ... 4
Prosedur Analisis ... 6
Analisis Data ... 9
HASIL DAN PEMBAHASAN ... 9
Karakteristik Cacing Siphonosoma australe ... 9
Komposisi Kimia Cacing Siphonosoma australe ... 10
Rendemen Ekstrak Cacing Siphonosoma australe ... 12
Komponen Aktif Ekstrak Cacing Siphonosoma australe ... 12
Aktivitas Antihiperglikemik Ekstrak Cacing Siphonosoma australe ... 14
SGOT dan SGPT Serum Darah Tikus ... 19
MDA Hati Tikus ... 20
KESIMPULAN DAN SARAN ... 22
Kesimpulan ... 22
Saran ... 22
DAFTAR PUSTAKA ... 22
LAMPIRAN ... 29
DAFTAR TABEL
1 Hasil pengukuran morfometrik cacing S. australe ... 10
2 Hasil analisis proksimat cacing S. australe ... 11
3 Hasil analisis komponen bioaktif ekstrak cacing S. australe ... 13
DAFTAR GAMBAR
1 Diagram alir prosedur penelitian ... 42 Pengukuran morfometrik cacing S. australe ... 9
3 Grafik kadar glukosa darah hari ke 1, 7, dan 14 hari pada kelompok perlakuan kontrol normal, diabet, metformin, E22,5, E45, E90 15 ... 15
4 Grafik perubahan kadar glukosa darah setelah 14 hari perlakuan pada kelompok N= normal, D= diabet, M= metformin, E22,5= ekstrak 22,5 mg/kgBB, E45= ekstrak 45 mg/kgBB, E90= ekstrak 90 mg/kgBB ... 16
5 Grafik bobot tubuh tikus hari ke 1, 7, dan 14 hari pada kelompok perlakuan kontrol normal, diabet, metformin, E22,5, E45, E90 ... 17
6 Grafik perubahan bobot tubuh setelah 14 hari perlakuan pada kelompok N= normal, D= diabet, M= metformin, E22,5= ekstrak 22,5 mg/kgBB, E45= ekstrak 45 mg/kgBB, E90= ekstrak 90 mg/kgBB ... 17
7 Grafik rata-rata jumlah kebutuhan minum selama 14 hari pada kelompok perlakuan kontrol normal, kontrol diabet, metformin, 22,5, E45, E90 ... 18
8 Grafik rata-rata kadar SGOT dan SGPT pada tikus kontrol normal, kontrol diabet, metformin, E22,5= ekstrak 22,5 mg/kgBB, E45= ekstrak 45 mg/kgBB, E90= ekstrak 90 mg/kgBB ... 19
9 Grafik rata-rata kadar MDA pada tikus kontrol normal, kontrol diabet, metformin, E22,5= ekstrak 22,5 mg/kgBB, E45= ekstrak 45 mg/kgBB, E90= ekstrak 90 mg/kgBB ... 21
DAFTAR LAMPIRAN
1 Data pengukuran morfometrik cacing S. australe ... 312 Perhitungan analisis proksimat cacing S. australe ... 32
3 Perhitungan rendemen ekstrak cacing S. australe ... 32
PENDAHULUAN
Latar Belakang
Siphonosoma australe merupakan salah satu cacing laut yang termasuk dalam filum Sipuncula. Sipuncula sering dikonsumsi oleh masyarakat pesisir dan digunakan para nelayan sebagai umpan untuk memancing. Masyarakat di daerah Bangka menjual Sipuncula sebagai produk pangan dan mayoritas pembelinya merupakan masyarakat Tionghoa. Cacing Sipuncula bernilai ekonomis tinggi namun belum dimanfaatkan secara optimal di Indonesia. Cacing Sipuncula hingga kini belum terdaftar sebagai komoditas hasil laut dalam statistik hasil perairan Indonesia (Fakhrurrozi 2011).
Masyarakat banyak yang belum mengetahui perihal pemanfaatan cacing Sipuncula, padahal cacing Sipuncula berpotensi dijadikan sebagai bahan baku obat-obatan (Fakhrurrozi 2011). Zhang dan Zi (2011) menyebutkan Sipuncula telah lama digunakan sebagai obat tradisional Cina untuk pengobatan penyakit tuberkulosis, pengatur fungsi lambung dan limpa, serta pemulihan kesehatan yang disebabkan oleh patogen. Menurut Zhang et al. (2011), ekstrak Sipunculus nudus dengan dosis 50 mg/kgBB memiliki aktivitas antiinflamasi yang baik. Purwaningsih (2014) menyatakan ekstrak Siphonosoma australe memiliki potensi sebagai antidiabates yang diperoleh melalui uji in vitro yang dapat menghambat
aktivitas enzim α-glukosidase sebesar 16-24 ppm. Penghambatan enzim
α-glukosidase diperlukan bagi penderita diabetes melitus karena dapat menghambat penyerapan glukosa di usus sehingga dapat mengontrol kadar glukosa dalam darah.
Diabetes Melitus (DM) merupakan salah satu dari enam penyebab utama morbiditas dan mortalitas di dunia (WHO 2006). International Diabetes Federation (IDF) mengemukakan bahwa pada tahun 2013 sebanyak 382 juta menderita DM usia 20-79 tahun dan diperkirakan akan meningkat menjadi 592 juta jiwa pada tahun 2035. Prevalensi penyakit DM di Indonesia pada tahun 2013 adalah 8,5 juta jiwa dan pada tahun 2035 diperkirakan akan meningkat menjadi 21,3 juta jiwa (IDF 2013).
Akbarzadeh et al. (2007) menyatakan penyakit DM biasanya disebut silent killer karena hampir sepertiga penderita DM tidak mengetahui mereka menderita DM. Menurut Fitriah et al. (2013), penyakit DM ditimbulkan oleh ketidakmampuan tubuh untuk menggunakan insulin yang diproduksi dengan efektif atau insulin yang diproduksi oleh pankreas tidak cukup untuk mengikat glukosa darah. Penyakit DM ditandai dengan tingginya kadar glukosa darah dari normal atau hiperglikemia akibat kerusakan sekresi insulin, kerja insulin, atau keduanya.
2
perut, dan terjadinya komplikasi jangka panjang yang dapat membahayakan otak. Terapi farmakologi juga membutuhkan biaya yang mahal, sehingga banyak penderita yang berusaha mengendalikan kadar glukosa darahnya dengan pengobatan berbahan alami (Dalimunthe 2004).
Cacing S. australe diharapkan dapat menjadi salah satu alternatif sumber pengobatan diabetes berbahan alami. Pengujian aktivitas ekstrak S. australe sebagai antihiperglikemik secara in vivo perlu dilakukan untuk mendukung hasil penelitian secara in vitro Hasil penelitian ini diharapkan dapat memberikan informasi ilmiah mengenai khasiat antihiperglikemik S. australe secara in vivo, serta dapat dijadikan dasar pengembangan cacing laut menjadi produk obat yang dapat digunakan secara luas oleh masyarakat.
Perumusan Masalah
Cacing S. australe dimanfaatkan oleh masyarakat Tionghoa sebagai obat tradisional berbahan alami, namun informasi ilmiah dari cacing S. australe belum banyak dikaji. Penelitian ilmiah tentang cacing S. australe perlu dilakukan agar dapat diketahui lebih lanjut untuk pemanfaatannya. Ekstrak cacing S. australe belum dilakukan uji aktivitas antihiperglikemik sehingga perlu dilakukan penelitian tentang hal tersebut.
Tujuan Penelitian
Tujuan penelitian ini adalah untuk menentukan aktivitas ekstrak cacing laut S. australe sebagai antihiperglikemik pada tikus galur Sprague Dawley yang diinduksi streptozotocin.
Manfaat Penelitian
Manfaat penelitian ini adalah memberikan nilai tambah terhadap cacing laut S. australe sebagai bahan baku hasil perairan. Hasil penelitian diharapkan menjadi sumber informasi baru dan sebagai bahan nutraseutika maupun farmaseutika.
Ruang Lingkup Penelitian
3
darah. Serum darah digunakan untuk mengukur kadar serum glutamic oxaloacetic transaminase (SGOT) dan serum glutamic pyruvic transaminase (SGPT). Organ hati digunakan untuk pengujian malondialdehida (MDA).
METODE PENELITIAN
Penelitian ini dilaksanakan pada bulan Mei hingga Desember 2015. Penelitian dilakukan di Laboratorium Biokimia Hasil Perairan, Departemen Teknologi Hasil Perairan, Fakultas Perikanan dan Ilmu Kelautan. Analisis fitokimia dilaksanakan di Laboratorium Kimia Analitik, Depatemen Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam. Pengujian aktivitas antihiperglikemik ekstrak cacing S. australe secara in vivo dilakukan di Rumah Sakit Hewan Institut Pertanian Bogor, serta Laboratorium Patologi, Fakultas Kedokteran Hewan, Institut Pertanian Bogor. Analisis biokimia darah dilakukan di laboratorium klinis Mandapa, Bogor. Analisis MDA organ hati dilakukan di Laboratorium Biokimia, Fakultas Kedokteran, Universitas Indonesia, Jakarta.
Bahan
Bahan-bahan yang digunakan adalah cacing S. australe, etanol 95%, selenium, H2SO4 pekat, aquades, NaOH 40%, H3BO3 2%, indikator brom
cherosol green-methyl red, HCl 0,1 N, n-heksana, pereaksi Dragendorff, pereaksi Meyer, pereaksi Wagner, kloroform, anhidra asam asetat, asam sulfat pekat, serbuk magnesium, amil alkohol, larutan HCl 2 N, larutan FeCl3 5%,
streptozotocin (STZ), metformin, Phosphate Buffer Saline (PBS), buffer sitrat, TRIS buffer, L-aspartate, L-alanine, LDH, MDH, NADH, α-Ketoglutaric, tiobarbiturat acid (TBA) 0,67%, trikloroasetat (TCA) 20%.
Alat
4
Prosedur Penelitian
Penelitian ini terdiri dari dua tahap. Tahap pertama yaitu ekstraksi cacing laut S. australe dan tahap kedua yaitu pengujian aktivitas antihiperglikemik ekstrak cacing S. australe pada tikus galur Sprague Dawley. Diagram alir prosedur penelitian dapat dilihat pada Gambar 1.
Gambar 1 Diagram alir prosedur penelitian Filtrasi
Cacing Laut S. australe
Preparasi bahan baku
Lumatan halus cacing S. australe
Maserasi
Perhitungan rendemen Analisis fitokimia Uji aktivitas
antihiperglikemik secara in vivo
Analisis SGOT SGPT serum darah
Analisis MDA hati Ekstrak cacing
S. australe
Perlakuan selama 14 hari pada tikus
Serum darah dan organ hati Pemanenan
Evaporasi
Residu Filtrat
5
Karakterisasi dan Preparasi Bahan Baku
Bahan baku yang digunakan adalah cacing S. australe. Cacing S. australe dilakukan pengukuran morfometrik sebanyak 30 ekor yang meliputi pengukuran panjang, diameter, dan bobot tubuh. Pengukuran panjang dan diameter menggunakan jangka sorong, pengukuran bobot menggunakan timbangan digital. Sampel yang telah diukur morfometriknya selanjutnya dicuci menggunakan air mengalir. Sampel cacing yang sudah bersih dihaluskan menggunakan blander. Cacing S. australe yang sudah dihaluskan tersebut digunakan untuk proses ekstraksi.
Ekstraksi (Purwaningsih et al. 2008)
Proses ekstraksi dilakukan dengan metode maserasi 24 jam. Lumatan halus cacing direndam menggunakan pelarut etanol dengan perbandingan 1:4 (b:v), dimaserasi selama 24 jam menggunakan orbital shaker 24 jam pada suhu ruang kemudian disaring menggunakan kertas saring Whatman no.42. Filtrat yang dihasilkan dipisahkan pelarutnya menggunakan rotary vacuum evaporator pada suhu 40 oC selama 6 jam. Ekstrak yang dihasilkan kemudian ditimbang bobotnya. Persentase rendemen ekstrak cacing S. australe dapat dihitung dengan rumus:
Rendemen (%) = Berat ekstrak (g)
Berat sampel (g) x 100%
Pengujian Aktivitas Antihiperglikemik Ekstrak Cacing S. australe
Pengujian aktivitas antihiperglikemik dilakukan secara in vivo menggunakan hewan uji, yaitu tikus putih (Rattus norvegicus) galur Sprague Dawley dengan jenis kelamin jantan. Tikus yang digunakan memiliki bobot tubuh 150-250 g dengan umur 8 minggu. Hewan coba diperoleh dari Badan Pengawas Obat dan Makanan, Jakarta.
Hewan coba sebelum digunakan diaklimatisasi selama kurang lebih tujuh hari untuk beradaptasi dengan lingkungan yang baru. Hewan coba diberi makan dengan pakan standard dan minum secara ad libitum. Tikus ditimbang dan dikelompokkan menjadi 6 kelompok (n=3) di dalam kandang secara terpisah pada hari terakhir adaptasi. Kelompok perlakuan adalah sebagai berikut:
K = kontrol normal, diberi larutan aquades.
D = diabetes; diberi streptozotocin (STZ) secara intraperitoneal dengan dosis 50 mg/kgBB pada hari ke-0 dan hari selanjutnya diberi aquades.
M = perlakuan sama dengan kelompok D. Dosis metformin yang diberikan 45 mg/kgBB/hari.
E22,5 = perlakuan sama dengan kelompok D. Dosis ekstrak yang diberikan 22,5 mg/kgBB/hari.
E45 = perlakuan sama dengan kelompok D. Dosis ekstrak yang diberikan 45 mg/kgBB/hari.
E90 = perlakuan sama dengan kelompok D. Dosis ekstrak yang diberikan 90 mg/kgBB/hari.
6
dengan kelompok yang telah ditentukan. Pemberian obat metformin dan ekstrak cacing dilakukan secara peroral. Perlakuan diberikan selama 14 hari. Pengukuran bobot dan glukosa darah diamati pada hari ke-1, hari ke-7 dan hari ke-14 perlakuan. Pengukuran bobot tubuh menggunakan timbangan digital. Pengukuran kadar glukosa darah menggunakan glucometer.
Semua tikus dikorbankan dengan cara eutanasi intraperitoneal setelah 14 hari perlakuan, untuk mendapatkan organ hati serta dilakukan pengambilan sampel darah dari jantung untuk mendapatkan serum darah. Serum darah
Analisis kadar air dilakukan dengan mengeringkan cawan porselen dalam oven pada suhu 105 oC selama 1 jam. Cawan tersebut diletakkan ke dalam desikator (kurang lebih 15 menit) dan dibiarkan sampai dingin kemudian ditimbang.. Sebanyak 1 g sampel dimasukkan ke dalam cawan tersebut, kemudian dikeringkan dengan oven pada suhu 105 °C selama 8 jam atau hingga beratnya konstan. Setelah selesai, cawan tersebut kemudian dimasukkan ke dalam desikator dan dibiarkan sampai dingin dan selanjutnya ditimbang kembali.
Perhitungan kadar air:
Kadar air (%)= Berat sampel awal (g) – Berat sampel kering (g)
Berat contoh awal (g) x 100%
b) Analisis Kadar Abu
Cawan abu porselen dibersihkan dan dikeringkan di dalam oven bersuhu sekitar 105 oC selama 1 jam. Cawan abu porselen tersebut dimasukkan ke dalam desikator (15 menit) dan kemudian ditimbang. Sampel sebanyak 1 g ditimbang kemudian dimasukkan ke dalam cawan abu porselen. Selanjutnya dibakar di atas kompor listrik sampai tidak berasap dan dimasukkan ke dalam tanur pengabuan dengan suhu 600 oC selama 6 jam. Cawan dimasukkan ke dalam desikator dibiarkan sampai dingin dan kemudian ditimbang.
Perhitungan kadar abu:
Kadar abu (%)= Bobot setelah tanur (g) – Cawan kosong (g)
Berat sampel awal x 100%
c) Analisis Kadar Protein
Tahap-tahap yang dilakukan dalam analisis protein terdiri dari tiga tahap yaitu destruksi, destilasi, dan titrasi. Pengukuran kadar protein dilakukan dengan metode mikro Kjeldahl. Sampel ditimbang sebanyak 0,25 g kemudian dimasukkan ke dalam labu Kjeldahl 100 ml, lalu ditambahkan 0,25 g selenium dan 3 ml H2SO4 pekat. Contoh didestruksi pada suhu 410 oC selama kurang lebih
7
Kjeldahl ditambahkan 50 ml aquades dan 20 ml NaOH 40%, kemudian dilakukan proses destilasi dengan suhu destilator 100 oC. Hasil destilasi ditampung dalam labu Erlenmeyer 125 ml yang berisi campuran 10 ml asam borat (H3BO3) 2% dan
2 tetes indikator bromocresol green-methyl red yang berwarna merah muda. Setelah volume destilat mencapai 10 ml dan berwarna hijau kebiruan, maka proses destilasi dihentikan. Destilat kemudian dititrasi dengan HCl 0,1 N sampai terjadi perubahan warna merah muda. Volume titran dibaca dan dicatat.
Perhitungan kadar protein: ujung bungkus ditutup dengan kapas bebas lemak dan selanjutnya dimasukkan ke dalam labu lemak yang sudah ditimbang berat tetapnya (W2). Kemudian disambungkan dengan tabung Soxhlet lalu dilakukan refluks selama 6 jam dengan pelarut lemak berupa n-heksana 150 mL. Pelarut lemak yang ada dalam labu lemak didestilasi hingga semua pelarut lemak menguap. Pada saat destilasi pelarut akan tertampung di ruang ekstraktor, pelarut dikeluarkan sehingga tidak kembali ke dalam labu lemak, selanjutnya labu lemak dikeringkan dalam oven pada suhu 105 oC selama 1 jam setelah itu labu didinginkan dalam desikator sampai beratnya konstan (W3).
e) Analisis Karbohidrat by Difference
Kadar karbohidrat total ditentukan dengan metode by difference yaitu: Karbohidrat (%)= 100% - (kadar air + abu + protein + lemak)
Analisis Fitokimia (Harborne 1987)
Analisis fitokimia dilakukan untuk mengetahui komponen aktif pada suatu bahan. Analisis yang dilakukan terhadap ekstrak etanol daun bakau hitam ini meliputi pemeriksaan senyawa alkaloid, flavonoid, saponin, tanin, fenol hidrokuinon, steroid dan triterpenoid.
a) Alkaloid
Sebanyak 0,05 g sampel dimasukkan ke dalam tabung reaksi lalu dilakukan penambahan H2SO4 2 N 2 tetes dan dikocok hingga benar–benar tercampur.
8
Dragendorff dengan endapan jingga, jika terdapat endapan tersebut maka sampel dikatakan positif.
b) Flavonoid
Sebanyak 0,05 g sampel ditambahkan serbuk Mg sebanyak 0,05 mg, setelah itu ditambahkan 0,2 mL amil alkohol dan 4 mL alkohol 70%. Hasil uji positif bila larutan berwarna merah, kuning atau jingga pada lapisan amil alkohol.
c) Saponin
Uji saponin dapat dideteksi dengan uji busa dalam air panas. Sebanyak 0,05 g sampel diletakkan dalam tabung reaksi. Ditambahkan air panas kemudian tabung reaksi dikocok. Setelah tabung dikocok, dibiarkan selama 30 menit dan ditambahkan HCl 2 N sebanyak 1 tetes. Hasil uji positif saponin ditunjukkan dengan adanya busa yang stabil.
d) Tanin
Sebanyak 0,05 g sampel ditambah air panas, kemudian sampel tersebut ditetesi dengan FeCl3 1% sebanyak 2 tetes. Hasil uji positif jika larutan berwarna
biru tua atau hijau kehitaman. e) Fenol hidrokuinon
Sebanyak 0,05 g sampel dimasukkan kedalam tabung reaksi. Kemudian dicampurkan dengan 0,25 mL etanol 70%. Selanjutnya ditambahkan FeCl3 5%
sebanyak 2 tetes. Hasil uji positif jika terbentuknya warna hijau atau hijau biru. f) Steroid/ Triterpenoid
Sebanyak 0,05 g sampel ditambah dengan 2 mL kloroform kemudian ditetesi dengan anhidrida asam asetat sebanyak 5 tetes. Setelah itu ditetesi dengan H2SO4 2 N sebanyak 3 tetes. Hasil uji steroid positif bila warna larutan berubah
menjadi biru, sedangkan hasil uji triterpenoid positif bila terbentuk warna merah kecoklatan pada lapisan permukaan sampel.
Analisis Biokimia Darah (IFCC 2002)
Pembuatan serum darah diawali dengan pengambilan sampel darah hewan percobaan. Sampel darah diambil dari jantung. Sampel darah didiamkan selama 3 jam. Sampel darah yang diperoleh kemudian disentrifus dengan kecepatan 3000 rpm selama 10 menit untuk mendapatkan serum darah. Serum tersebut kemudian dipisahkan ke dalam tabung ependorff. Serum darah digunakan untuk pengujian kadar SGOT dan SGPT dengan menggunakan alat spektrofotometer.
Pengujian biokimia darah diawali dengan pencampuran dua reagen. Reagen satu untuk uji SGOT dilakukan dengan pencampuran 100 mmol/L TRIS buffer, 330 mmol/L L-aspartate, 2000 U/L LDH, dan 1000 U/L MDH. Reagen satu untuk uji SGPT meliputi 120 mmol/L TRIS buffer, 550 mmol/L L-alanine, dan 1700 U/L LDH. Reagen dua untuk uji SGOT dan SGPT meliputi 1,1 mM NADH, 78 mM α-Ketoglutaric. Pencampuran reagen tersebut sebanyak 200 µL reagen satu dan 50 µL reagen dua. Serum darah dan yang digunakan pada uji SGOT dan SGPT dipipet masing-masing sebanyak 25 µL dengan reagen masing-masing sebanyak 250 µL. Serum darah dan reagen diukur menggunakan spektrofotometer pada suhu 25 ºC, pada panjang gelombang 340 nm.
Analisis kadar MDA hati (Wills 1987)
9
sebanyak 400 µL dimasukkan ke dalam tabung reaksi, selanjutnya sampel ditambahkan 200 µl TCA 20%. Kemudian divorteks dan sentrifus dengan kecepatan 5000 rpm selama 10 menit. Supernatan yang terbentuk diambil dan tambahkan 400 µL TBA 0,67%. Selanjutnya diinkubasi dalam pemanas air pada suhu 96 °C selama 10 menit kemudian angkat dan dinginkan pada suhu ruang. Kemudian baca serapan pada panjang gelombang 530 nm.
Analisis Data
Analisis data diperlukan untuk mendapatkan kesimpulan dari percobaan yang dilakukan. Analisis yang digunakan pada penelitian ini adalah secara deskriptif. Analisis deskriptif menggunakan rata-rata dari tiga ulangan yang ditunjukkan dalam hasil berupa grafik atau tabel.
HASIL DAN PEMBAHASAN
Karakteristik Cacing Siphonosoma australe
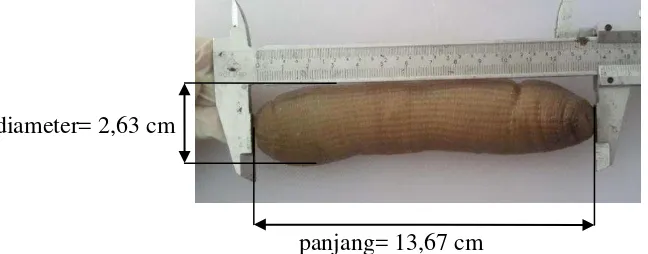
Sampel cacing S. australe yang digunakan pada penelitian ini diperoleh dari Desa Toronipa, Kecamatan Toronipa, Kabupaten Konawe, Sulawesi Tenggara. Cacing S. australe termasuk filum Sipuncula. Sipuncula dalam bahasa Latin berarti tabung kecil atau menyedot. Sipuncula sering dikaitkan dengan Annelida, namun Sipuncula tidak memiliki segmen tubuh (Cutler 1994). Pengukuran morfometrik cacing S. australe disajikan pada Gambar 2.
diameter= 2,63 cm
panjang= 13,67 cm
Gambar 2 Pengukuran morfometrik cacing S. australe
10
Tabel 1 Pengukuran morfometrik cacing S. australe
No. Parameter Nilai berbentuk silindris dan memiliki panjang maksimal dapat mencapai 80 cm setelah dikeringkan (Fakhrurrozi 2011). Chen dan Ru (2011) menyatakan bahwa Sipunculus nudus yang diperoleh dari pesisir Teluk Beibu, China memiliki panjang 10 ± 2 cm.
Tubuh cacing Sipuncula terbagi menjadi badan utama (trunk) dan belalai (introvert). Belalai Sipuncula dapat ditarik ke belakang menggunakan dua pasang retractor muscle dalam keadaan terancam yang dapat melindungi seluruh bagian tubuh sehingga menyerupai kacang, oleh karena itu Sipuncula sering disebut cacing kacang. Panjang badan utama dan belalai berbeda-beda pada tiap jenis. Warna tubuh putih, kelabu atau kecoklatan (Cutler dan Gibbs 1985).
Mulut Sipuncula terletak di ujung anterior belalai yang dikelilingi oleh tentakel bersilia. Tentakel digunakan untuk mengumpulkan detritus organik yang terdapat di air atau substrat. Sipuncula tidak mempunyai sistem pembuluh darah maupun organ pernafasan. Cairan rongga tubuh (coelomic fluid) berfungsi mengedarkan nutrisi keseluruh tubuh. Sistem ekskresi melalui metanephridia berbentuk kantung besar. Sistem saraf terdiri dari cincin saraf (ganglion cerebral) sekitar kerongkongan, yang berfungsi sebagai otak, dan tali saraf ventral tunggal (Cutler 1994).
Reproduksi seksual Sipuncula dengan cara pembuahan diluar. Telur dan sperma dikeluarkan melalui metanephridia. Perkembangan langsung atau melalui stadia trochophore yang berenang bebas sampai satu bulan, kemudian mengalami metamorfosa menjadi cacing muda dan turun ke dasar laut. Beberapa jenis Sipuncula melakukan reproduksi aseksual dengan membuat sekatan dan membelah dua pada bagianposterior badan (Cutler 1994).
Karakteristik khusus yang membedakan S. australe dengan Sipuncula lain yaitu S. australe memiliki panjang tubuh berkisar antara 200 mm dan belalai dapat mencapai seperempat panjang total tubuh. Otot dinding tubuh dapat terlihat dari bagian luar kulit. Daerah distribusi S. australe di perairan tropis hingga sub tropis seperti Madagascar, India, Indonesia, Vietnam, Australia, New Zealand. Cacing ini dapat ditemukan di perairan berair tenang, daerah berlumpur dan berpasir, dalam lubang tidak permanen, dalam cangkang siput, atau dalam celah karang (Cutler 1994).
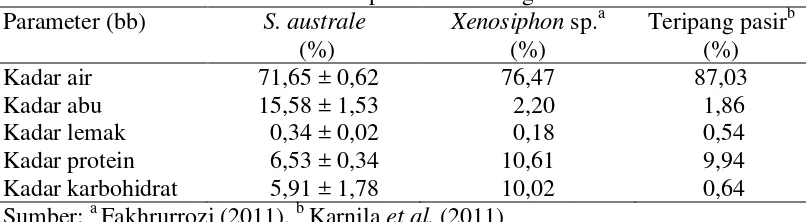
Komposisi Kimia Siphonosoma australe
11
kimia tertinggi terdapat pada kadar air. Hasil analisis proksimat S. australe disajikan dalam Tabel 2 dan Lampiran 2.
Tabel 2 Hasil analisis proksimat cacing S. australe Parameter (bb) S. australe persentase terbesar dibandingkan kadar abu, lemak, protein, dan karbohidrat. Karnila et al. (2011) menjelaskan kondisi perairan laut memiliki kelarutan garam anorganik tinggi yang dapat mengakibatkan terjadinya peristiwa hipotonik air pada biota laut, yaitu keluarnya air dari dalam tubuh ikan menuju larutan garam. Organisme laut beradaptasi dengan melakukan osmoregulasi dengan meminum air laut sebanyak-banyaknya dan sedikit mengeluarkan urin untuk menjaga agar kondisi tubuh tetap isotonik.
Hasil pengujian kadar abu cacing S. australe diperoleh hasil 15,58 ± 1,53%. Hasil penelitian Karnila (2011) pada teripang pasir yang diperoleh dari Perairan Lampung memiliki kadar abu sebesar 1,86%. Nilai ini berbeda dengan hasil penelitian Lewerissa (2014) pada sampel yang sama namun dari Perairan Saparua, Maluku Tengah memiliki kadar abu sebesar 27,6%.
Arifin (2008) menjelaskan tinggi rendahnya kadar abu dapat disebabkan oleh perbedaan jenis organisme dan lingkungan hidup dari organisme tersebut. Masing-masing organisme memiliki kemampuan yang berbeda-beda dalam meregulasi dan mengabsorb mineral, sehingga akan memberikan pengaruh pada kadar abu dalam masing-masing bahan. Hermawan et al. (2015) menyatakan substrat sangat mempengaruhi kadar abu cacing laut. Substrat pasir pada dasar perairan mengandung berbagai mineral. Substrat pada perairan yang berbeda terdapat kandungan mineral yang berbeda. Cacing laut bersifat deposit feeder sehingga mengandung banyak mineral ditubuhnya karena memakan semua endapan yang terdapat di substrat. Menurut Lewerissa (2014), substrat pasir Perairan Timur Indonesia kaya akan kandungan zat besi, magnesium, kalsium, natrium, phospor serta mineral lainnya.
Hasil pengujian kadar lemak cacing S. australe yaitu sebesar 0,34±0,02%. Menurut Syaputra et al. (2007), peranan lemak dalam bahan pangan adalah sebagai sumber energi yang dapat menyediakan energi sekitar 2,25 kali lebih banyak dibandingkan karbohidrat atau protein. Lemak yang terdapat pada ikan dan hewan laut lain tidak membahayakan tubuh meskipun mengandung kadar lemak sekitar 0,1-2,2%. Lemak yang terkandung dalam hewan laut merupakan asam lemak tidak jenuh yang sangat dibutuhkan manusia
12
kandungan protein pada cacing Nereis sp. berasal dari plankton yang dikonsumsinya. Plankton diketahui sebagai sumber protein sekaligus simbion dalam sistem pencernaan pada Nereis sp.
Hasil analisis proksimat pada cacing S. australe memiliki kadar karbohidrat sebesar 5,91 ± 1,78%. Kadar karbohidrat hasil penelitian Syaputra et al. (2007) pada sampel cacing kapal (tembilok) sekitar 16%. Kadar karbohidrat tembilok mirip seperti kerang-kerangan yang cenderung menyimpan hasil pencernaan dalam bentuk glikogen (gula otot).
Rendemen Ekstrak Cacing Siphonosoma australe
Ekstraksi menurut Mukhriani (2014) yaitu proses pemisahan bahan dari campurannya dengan menggunakan pelarut yang sesuai. Proses ekstraksi dihentikan ketika tercapai kesetimbangan antara konsentrasi senyawa dalam pelarut dengan konsentrasi dalam sel sampel. Pelarut dipisahkan dari sampel dengan penyaringan. Ekstrak perlu dipisahkan ke dalam fraksi yang memiliki polaritas dan ukuran molekul yang sama.
Rendemen ekstrak cacing S. australe didapati dari hasil perhitungan banyaknya ekstrak yang dihasilkan dengan bobot total bobot bahan yang digunakan. Besar kecilnya nilai rendemen menurut Mukhraini (2014) menunjukkan keefektivan proses ekstraksi. Faktor-faktor yang mempengaruhi efektivitas proses ekstraksi adalah jenis pelarut yang digunakan, ukuran partikel bahan, metode, dan lamanya ekstraksi.
Hasil penelitian menunjukkan bahwa rendemen ekstrak etanol S. australe sebesar 1,71%. Perhitungan rendemen ekstrak dapat dilihat pada Lampiran 3. Menurut Heath dan Reineccius (1986), etanol mampu mengekstrak senyawa organik yang menyebabkan hasil ekstraksi etanol cukup kuat. Pelarut etanol memiliki nilai kostanta dielektrik tinggi sehingga pelarut etanol dapat membuka dinding sel yang mengakibatkan hampir semua senyawa dapat tertarik keluar dari dalam sel.
Hasil penelitian Leiwakabessy (2011) didapatkan hasil rendemen ekstrak metanol tambelo memiliki rendemen sebesar 5,72%. Perbedaan rendemen hasil ekstrak diduga karena perbedaan jenis pelarut yang digunakan. Wirda et al. (2011) menyatakan pelarut etanol memiliki tingkat kepolaran yang lebih rendah dibandingkan dengan metanol sehingga rendemen yang dihasilkan lebih sedikit. Mukesh et al. (2012) menjelaskan pelarut etanol memiliki toksisitas yang rendah dan banyak digunakan dalam industri farmasi.
Komponen Aktif Ekstrak Cacing Siphonosoma australe
13
Tabel 3 Hasil analisis komponen aktif ekstrak cacing S. australe
Uji Hasil Parameter
Alkaloid
a. Dragendroff + Terbentuk endapan jingga
b. Meyer + Terbentuk endapan putih
c. Wagner + Terbentuk endapan coklat
Tanin - Tidak terjadi perubahan warna
Saponin + Busa stabil
Fenol hidroquinon - Tidak terjadi perubahan warna
Flavonoid + Kuning kemerahan
Steroid + Hijau kebiruan
Triterpenoid - Tidak terjadi perubahan warna Keterangan : (+) = terdeteksi, (-) = tidak terdeteksi
Hasil analisis komponen aktif pada Tabel 3 menunjukkan bahwa ekstrak etanol cacing S. australe mengandung alkaloid, flavonoid, saponin, dan steroid. Alkaloid dapat dideteksi dengan cara pengendapan menggunakan pereaksi Mayer, Wagner, dan Dragendorff (Harborne 1987). Tiong et al. (2013) menyebutkan bahwa alkaloid sering digunakan untuk pengobatan seperti antimalaria, antioksidan, obat asma serta alkaloid radikamin memiliki efek sebagai antihiperglikemik. Menurut Firdaus et al. (2004), alkaloid yang berkhasiat sebagai antihiperglikemik antara lain leurosine, leurosine sulfat, vindoline, dan vindolinine.
Flavonoid merupakan senyawa polar karena mempunyai gugus hidroksil atau gula, sehingga dapat larut dalam pelarut polar seperti etanol, metanol, butanol, aseton, dimetilsulfoksida, dan air (Harborne 1987). Flavonoid menurut Dheer dan Bhatnagar (2010) merupakan zat yang mampu meregenerasi sel beta pankreas dan membantu merangsang sekresi insulin. Brahmachari (2011) menyatakan bahwa flavonoid memiliki efek hipoglikemik yaitu dengan mengurangi penyerapan glukosa dan mengatur aktivitas ekspresi enzim yang terlibat dalam metabolisme karbohidrat. Flavonoid yang berperan sebagai antihiperglikemik yaitu apigenin dan aminoguanidin.
Firdous et al. (2009) menyatakan saponin adalah senyawa aktif dengan permukaan yang kuat dan dapat menimbulkan busa jika dikocok dengan air. Strukturnya terdiri dari aglycone (triterpene atau steroid) dan gugus glukosa. Menurut Yoshikawa et al. (2005), saponin memiliki banyak fungsi biologi dan farmakologi diantaranya sebagai hemolisa, kardiotonik, hipoglikemik, hipokolesterolemik, modulator imun, hepatoproteksi, antioksidan, dan antikardiogenik. Saponin berfungsi sebagai antihiperglikemik mekanismenya yaitu untuk mencegah pengosongan lambung dan mencegah peningkatan uptake glukosa pada brush border membran di intestinal. Saponin juga bekerja untuk mencegah penyerapan glukosa dengan cara mencegah transpor glukosa menuju brush border intestinal di usus halus yang merupakan tempat penyerapan glukosa.
14
mempunyai khasiat menurunkan kolesterol dalam darah dan mendorong aktivitas antidiabetes. Nurulita et al. (2008) menyebutkan senyawa steroid merupakan komponen aktif yang telah digunakan untuk pengobatan penyakit diabetes, gangguan menstruasi, antibakteri dan antivirus.
Hasil pengujian komponen bioaktif yang dilakukan Sari et al. (2014) pada ekstrak metanol teripang hitam (Holothuria edulis) terdapat hasil positif pada triterpenoid, steroid, flavonoid, dan saponin. Perbedaan hasil yang diperoleh menurut Iswantini et al. (2011) diduga karena adanya perbedaan kondisi lingkungan hidup. Kondisi lingkungan hidup yang berbeda dapat menyebabkan perbedaan jenis dan jumlah dari metabolit sekunder yang terkandung dalam suatu bahan. Sompong et al. (2010) menyatakan bahwa perbedaan spesies dan tempat tumbuh menghasilkan komponen bioaktif yang berbeda. Widarta et al. (2013) menyebutkan perbedaan jenis dan tingkat kepolaran pelarut dapat menghasilkan rendemen ekstrak dan komponen bioaktif yang berbeda.
Aktivitas Antihiperglikemik Ekstrak Cacing Siphonosoma australe
Hiperglikemia merupakan salah satu gejala klinis penyakit diabetes melitus. Diabetes melitus (DM) didefinisikan sebagai suatu penyakit atau gangguan metabolisme kronis yang ditandai dengan tingginya kadar gula darah disertai dengan gangguan metabolisme karbohidrat, lipida dan protein sebagai akibat insufisiensi fungsi insulin. Insufisiensi fungsi insulin dapat disebabkan oleh gangguan atau defisiensi produksi insulin oleh sel-sel beta Langerhans kelenjar pankreas, atau disebabkan oleh kurang responsifnya sel-sel tubuh terhadap insulin (WHO 2006).
Menurut Erwin et al. (2013), pankreas merupakan organ yang bertanggung jawab dalam mengatur kadar glukosa darah dengan menghasilkan hormon insulin. Perubahan kadar glukosa darah mengakibatkan penyesuaian sekresi insulin untuk mengembalikan kadar glukosa darah pada rentang yang normal. Insulin membantu meningkatkan kerja enzim mengubah glukosa menjadi bentuk cadangan energi yang lebih stabil yaitu glikogen.
Fitriah et al. (2013) menjelaskan antihiperglikemik merupakan zat atau senyawa yang dapat menetralkan atau menurunkan kadar glukosa yang tinggi dalam darah. Mekanisme agen antihiperglikemik dalam menurunkan kadar glukosa darah yaitu dengan merangsang sekresi insulin atau melalui penghambatan aktivitas α-glukosidase. Matuputun et al. (2013) menjelaskan penghambatan aktivitas α-glukosidase dapat menunda penyerapan glukosa pada saluran pencernaan, sehingga dapat mencegah peningkatan kadar glukosa darah setelah makan. Pengujian aktivitas antialfaglukosidase dapat dilakukan secara in vitro menggunakan metode spektrofotometri.
15
menjalakan penelitian yang tidak bisa secara langsung dilakukan dalam tubuh manusia. Hewan coba diasumsikan memiliki jaringan, sel-sel penyusun tubuh, serta enzim-enzim yang terdapat dalam tubuh sama dengan manusia.
Kadar Glukosa Darah
Glukosa darah adalah gula yang terdapat dalam darah yang terbentuk dari karbohidrat dalam makanan dan disimpan sebagai glikogen di hati dan otot rangka. Energi untuk sebagian besar fungsi sel dan jaringan berasal dari glukosa (Dalimunthe 2004). Seseorang dikatakan DM apabila konsentrasi glukosa darah
sesaat ≥ 200 mg/dL dan glukosa darah puasa ≥ 126 mg/dL (ADA 2013).
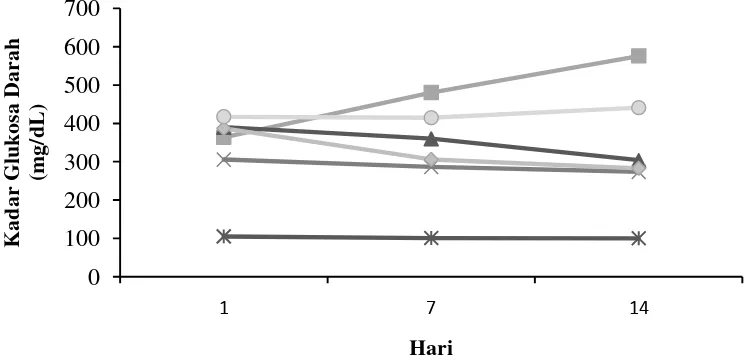
Pengukuran kadar glukosa darah setelah induksi STZ menunjukkan semua tikus yang diinduksi STZ telah menderita hiperglikemia (Gambar 3). Tikus yang telah mengalami hiperglikemia diberikan ekstrak cacing S. australe, metformin dan aquades setiap hari selama 14 hari. Pengukuran kadar glukosa darah dilakukan pada hari ke-1, hari ke-7, dan hari ke-14 perlakuan. Kadar glukosa darah tikus setelah induksi STZ berkisar antara 200-600 mg/dL.
Gambar 3 Grafik kadar glukosa darah hari ke 1, 7, dan 14 hari pada kelompok perlakuan kontrol normal, diabet, metformin, E22,5,
E45, E90
Kelompok N memiliki kadar glukosa darah yang normal selama 14 hari perlakuan. Kelompok N memiliki kadar glukosa darah yang normal karena tidak diinduksi STZ. Kelompok diabet mengalami peningkatan kadar glukosa darah pada hari ke 7 dan 14. Kelompok metformin, E22,5 dan E45 dapat menurunkan kadar glukosa darah pada hari ke 7 dan 14, sedangkan kelompok E90 mengalami penurunan kadar glukosa darah pada hari ke 7, namun mengalami peningkatan kembali pada hari ke 14.
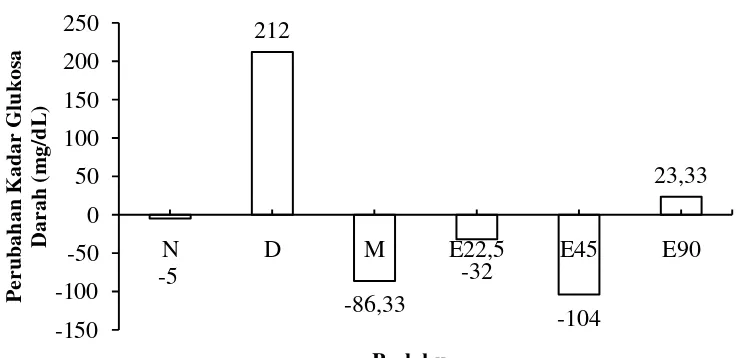
Kadar glukosa darah mengalami perubahan setelah 14 hari perlakuan. Nilai perubahan kadar glukosa darah merupakan hasil perhitungan kadar glukosa darah setelah 14 hari perlakuan dengan kadar glukosa darah pada hari ke-1. Hasil perubahan kadar glukosa darah dapat dilihat pada Gambar 4.
16
Gambar 4 Grafik perubahan kadar glukosa darah setelah 14 hari perlakuan pada kelompok N= normal, D= diabet, M= metformin, E22,5= ekstrak 22,5 mg/kgBB, E45= ekstrak 45 mg/kgBB, E90= ekstrak 90 mg/kgBB
Peningkatan kadar glukosa darah kelompok D sebesar 212±36 mg/dL setelah 14 hari perlakuan. Akbarzadeh et al. (2007) menyatakan injeksi streptozotocin (STZ) dengan dosis 40-60 mg/kgBB pada tikus dapat
menyebabkan kerusakan sel β-pankreas dan menginduksi DM dalam 2-4 hari. Tikus dapat dinyatakan DM apabila dalam 2-4 hari post induksi STZ kadar
glukosa darah sesaat ≥ 200 mg/dL. Streptozotocin disintesis oleh Streptomycetes acrhomogenes. Streptomicin yang terkandung dalam STZ dapat membantu mengobati sel metastatis dari tumor di pankreas, tumor karsinoid malignan dan mempunyai efek sebagai antibakteri, namun setelah diteliti lebih lanjut senyawa ini memiliki efek negatif yaitu menyebabkan kerusakan sel β-pankreas. Menurut Elsner et al. (2000), Streptozotocin bekerja dengan cara membentuk radikal bebas sangat reaktif yang dapat menimbulkan kerusakan pada membran sel, protein, dan deoxyribonucleic acid (DNA), sehingga menyebabkan gangguan produksi insulin oleh sel beta Langerhans pankreas. Szkudelski (2001) menyatakan bahwa streptozotocin memasuki sel β-Langerhans pankreas melalui glucose transporter 2 (GLUT 2) dan menyebabkan fragmentasi DNA.
Pemberian metformin dengan dosis 45 mg/kgBB dapat menurunkan kadar glukosa darah sebesar 86,33±4,75 mg/dL setelah 14 hari perlakuan. Menurut Diani dan Aman (2010), metformin merupakan obat antidiabetika oral golongan biguanida. Mekanisme kerja golongan biguanida yaitu dengan menekan produksi glukosa yang diproduksi hati dan mengurangi resistensi insulin. Pengobatan dengan metformin tidak akan menyebabkan hipoglikemia berat.
Penurunan kadar glukosa darah kelompok E45 sebesar 104±38,59 mg/dL setelah 14 hari perlakuan. Hal ini diduga berkaitan dengan adanya kandungan senyawa aktif pada ekstrak S. australe berupa senyawa flavonoid dan saponin. Brahmachari (2011) menyatakan senyawa flavonoid mempunyai mekanisme yang seperti obat antihiperglikemik oral golongan sulfonilurea dalam menurunkan kadar glukosa darah tikus dengan cara meningkatkan sekresi insulin. Menururt Firdous et al. (2009), saponin mampu meregenerasi pankreas yang menyebabkan
17
Bobot Tubuh Tikus
Pengamatan terhadap bobot tubuh tikus dilakukan pada hari ke 1, 7 dan 14 perlakuan. Pengamatan bobot tubuh tikus menggunakan timbangan digital. Hasil pengamatan terhadap bobot tubuh tikus dapat dilihat pada Gambar 5.
Gambar 5 Grafik bobot tubuh tikus hari ke 1, 7, dan 14 hari pada kelompok mengalami peningkatan bobot tubuh kembali setelah 14 hari perlakuan.
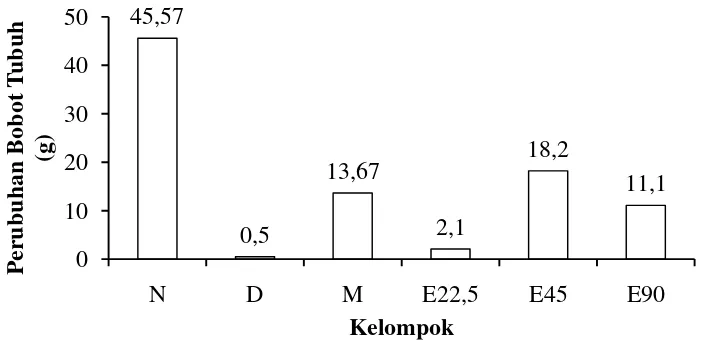
Bobot tubuh tikus mengalami perubahan setelah 14 hari perlakuan. Nilai perubahan bobot tubuh merupakan hasil perhitungan bobot tubuh setelah 14 hari perlakuan dengan bobot tubuh pada hari ke-1. Hasil perubahan bobot tubuh dapat dilihat pada Gambar 6.
Gambar 6 Grafik perubahan bobot tubuh tikus setelah 14 hari perlakuan pada kelompok N= normal, D= diabet, M= metformin, E22,5= ekstrak 22,5 mg/kgBB, E45= ekstrak 45 mg/kgBB, E90= ekstrak 90 mg/kgBB
18
Kelompok N mengalami peningkatan bobot tubuh sebesar 45,47 g setalah 14 hari perlakuan. Archer et al. (2003) menjelaskan tikus normal mengalami peningkatan bobot tubuh ±20 g dalam tujuh hari. Peningkatan bobot tubuh pada tikus dapat dijadikan sebagai indikator tikus dalam keadaan sehat dan tidak dalam kondisi stres.
Kelompok D memiliki peningkatan bobot tubuh sebesar 0,5 g setelah 14 hari perlakuan. Wikanta et al. (2008) menyatakan salah satu gejala diabetes adalah penderita kehilangan bobot tubuh, walaupun nafsu makan sangat baik. Menurut Widowati et al. (2006), glukosa tidak dapat masuk ke dalam sel karena adanya gangguan insulin, akibatnya terjadi poliphagia (banyak makan) dan glukoneogenesis. Sel yang kekurangan glukosa untuk metabolisme akan merangsang pusat lapar di hipotalamus menyebabkan rasa lapar yang berlebihan. Glukoneogenesis dapat berasal dari asam amino hasil degradasi protein di otot sehingga berkurangnya massa otot yang ditunjukan dengan penurunan bobot tubuh.
Pemberian ekstrak cacing S australe dapat meningkatkan bobot tubuh tikus selama 14 hari perlakuan dan peningkatan tertinggi terdapat pada kelompok E45 yaitu sebesar 18,2 g. Hal ini disebabkan karena adanya kandungan zat gizi pada cacing S. australe seperti protein, karbohidrat, dan lemak. Cahyono (2007) menjelaskan kandungan protein, karbohidrat, dan lemak dapat dimanfaatkan untuk meningkatkan bobot tubuh. Asupan tinggi protein dapat meningkatkan massa otot. Asupan karbohidrat dapat mencegah penggunaan energi dari protein yang terdapat di otot. Lemak tidak jenuh yang terdapat pada produk hasil laut dapat meningkatkan selera makan sehingga dapat meningkatkan bobot tubuh.
Jumlah Kebutuhan Air Minum
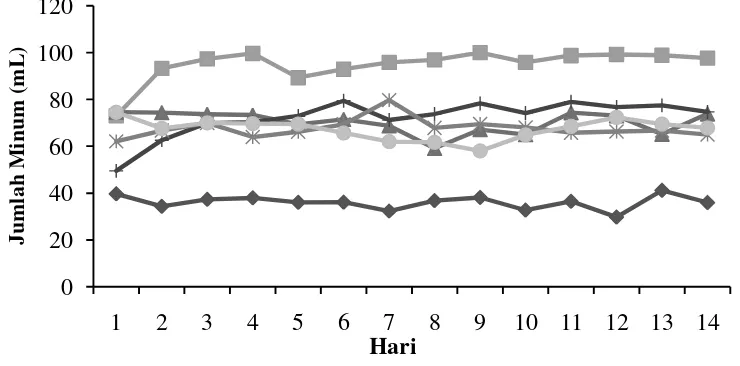
Pengukuran jumlah kebutuhan minum dilakukan untuk melihat adanya gejala polidipsia pada tikus yang menderita diabetes. Polidipsia merupakan haus berlebihan secara terus menerus. Polidipsia adalah bentuk mekanisme kompensasi untuk mengatasi dehidrasi. Hasil pengukuran jumlah kebutuhan minum disajikan pada Gambar 7.
19
Kelompok kontrol normal memiliki kebutuhan minum yang paling sedikit yaitu 36,09±09 mL. Kelompok metformin, E22,5, E45, dan E90 memiliki kebutuhan minum sebanyak 70,23±4,68 mL; 72,15±7,92 mL; 67,7±4,1 mL; dan 67,26±4,44 mL. Kelompok kontrol diabet memiliki kebutuhan minum sebanyak 94,9±6,99 mL.
Kelompok diabet memiliki kebutuhan minum yang paling banyak. Widowati et al. (2006) menjelaskan banyak minum (polidipsia) merupakan akibat reaksi tubuh karena banyak mengeluarkan urin (poliuria). Gejala ini merupakan usaha tubuh untuk menghindari kekurangan cairan (dehidrasi). Banyaknya air (dalam bentuk urin) yang dikeluarkan oleh tubuh menimbulkan rasa haus untuk mengganti cairan yang keluar. Polidipsia akan terus timbul selama kadar gula dalam darah belum terkontrol dengan baik.
SGOT dan SGPT Serum Darah
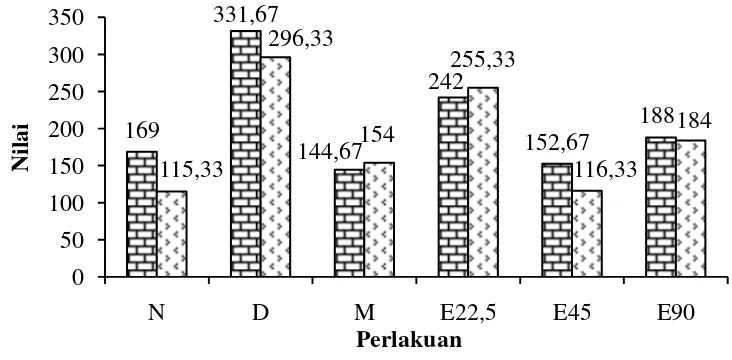
Krysanti dan Simon (2014) menyatakan uji fungsi hati merupakan salah satu pemeriksaan kimia yang sering kali dianggap sangat penting untuk menilai kesehatan. Serum glutamic oxaloacetic transaminase (SGOT) merupakan sebuah enzim yang biasanya terletak didalam sel-sel hati. SGOT dilepaskan ke dalam darah ketika hati atau jantung rusak. Enzim SGOT terdapat dalam mitokondria dan sebagian kecil di sitosol. Serum glutamic pyruvic transaminase (SGPT) adalah enzim yang dibuat dalam sel hati (hepatosit), sehingga lebih spesifik digunakan sebagai indikasi adanya penyakit hati dibandingkan dengan enzim lain. Enzim ini akan mengalami kenaikan jika terjadi kerusakan hati. Hasil uji serum darah kadar SGOT dan SGPT dapat dilihat pada Gambar 8.
Gambar 8 Grafik rata-rata kadar SGOT dan SGPT pada pada kelompok N= normal, D= diabet, M= metformin, E22,5= ekstrak 22,5 mg/kgBB, E45= ekstrak 45 mg/kgBB, E90= ekstrak 90 mg/kgBB
Menurut Bigoniya et al. (2002), peningkatan kadar enzim SGPT yang sangat tinggi disertai adanya kenaikan enzim SGOT merupakan indikator yang
20
menunjukkan adanya kerusakan hati. Kelompok D memiliki kadar SGOT dan SGPT tertinggi. Reddy et al. (2014) menyatakan kerusakan hati merupakan indikasi efek hepatotoksik dari STZ. Peningkatan glukoneogenesis dan ketogenesis karena kondisi hiperglikemik mengindikasi adanya kerusakan hati. Peningkatan kadar SGOT dan SGPT dalam serum darah disebabkan oleh kebocoran enzim SGOT dan SGPT dari sitosol hati ke aliran darah. Menurut Latha et al. (2014), hati berperan dalam menjaga konsentrasi normal glukosa darah. Peningkatan glukosa darah mengubah fungsi normal hati dan selanjutnya akan meningkatkan kadar SGOT dan SGPT. Kadar SGOT dan SGPT pada awal kerusakan hati akan meningkat sangat tinggi dan kemudian menurun ketika penyebab kerusakan dihilangkan atau ketika nekrosis sangat parah, yaitu ketika hanya sedikit hepatosit yang tersisa. tikus menurut Petterino dan Storino (2006) berkisar antara 56,1-201,89 U/L.
Kelompok E45 dapat memberikan pemulihan kadar SGPT mendekati kelompok N setelah 14 hari perlakuan dan dapat mengembalikan ke batas normal kadar SGPT tikus. Kadar SGPT tikus normal menurut Derelanko (2008) yaitu 34,9-218,1 U/L. Penurunan kadar SGOT dan SGPT diduga berkaitan dengan senyawa kimia saponin dan steroid dalam ekstrak etanol cacing S. australe. Menurut Krysanti dan Simon (2014), kandungan saponin dan steroid dapat membantu memperbaiki sel hati dan menurunkan aktivitas SGOT dan SGPT serum darah dengan menghambat peningkatan konsentrasi lemak. Ekstrak cacing S. australe dengan dosis 22,5 mg/kgBB memiliki kadar SGOT dan SGPT yang tinggi diduga karena dosis tersebut belum mencukupi untuk pemulihan fungsi hati tikus.
Kandungan karbohidrat, protein, dan lemak yang terkandung dalam cacing S. australe diduga dapat memperbaiki fungsi hati. Menurut Cahyono (2007), pasien dengan gangguan fungsi hati membutuhkan pemilihan nutrisi yang tinggi karbohidrat, protein, dan lemak. Karbohidrat dapat membantu menyediakan energi dan mencegah pemecahan protein untuk energi. Protein diperlukan untuk membangun sel dan jaringan yang baru. Protein juga mencegah kerusakan akibat infiltrasi lemak dalam jaringan hati. Lemak tidak jenuh yang terdapat pada produk hasil laut dan minyak tumbuhan dapat meningkatkan selera makan dan baik untuk pemulihan fungsi hati.
MDA Hati Tikus
21
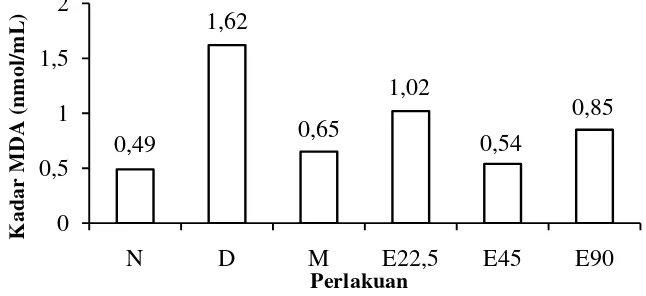
produk dekomposisi dari asam amino, karbohidrat kompleks, pentosa, dan heksosa. Malondialdehida dapat dihasilkan oleh radikal bebas melalui reaksi ionisasi dalam tubuh dan produk sampah biosintesis protaglandin yang merupaka peoduk akhir oksidasi lipida membran. Kadar MDA hati tikus pada masing-masing kelompok tikus disajikan pada Gambar 9.
Gambar 9 Grafik rata-rata kadar MDA pada kelompok N= normal, D= diabet, M= metformin, E22,5= ekstrak 22,5 mg/kgBB, E45= ekstrak 45 mg/kgBB, E90= ekstrak 90 mg/kgBB
Hasil pengamatan setelah 14 hari perlakuan memperlihatkan bahwa tikus yang diinduksi STZ dan tidak mendapatkan pengobatan (kelompok D) mengalami peningkatan kadar MDA hati jika dibandingkan dengan tikus yang tidak diinduksi STZ (kelompok N). Adanya peningkatan kadar MDA hati merupakan indikator adanya kerusakan sel hati yang disebabkan oleh peroksida lipida akibat induksi STZ. Menurut Adji (2008), sumber utama radikal bebas adalah logam, pelarut, pestisida, dan obat-obatan. Radikal bebas merupakan molekul yang sangat reaktif yang dihasilkal oleh reaksi redoks biokimia yang terjadi pada sel normal. Produksi radikal bebas yang berlebihan atau kurangnya jumlah antioksidan akan menyebabkan oksidasi lemak. Peningkatan kadar MDA menunjukkan adanya
oksidasi lemak jenuh yang terdapat pada sel β pankreas, sehingga menyebabkan
gangguan terhadap sekresi insulin. Nurhasanah dan Syamsudin (2005) menyatakan STZ dapat mengaktivasi reactive oxygen species (ROS) seperti superoksida, radikal hidroksil, dan hidrogen peroksida.
Pemberian ekstrak etanol cacing laut menyebabkan efek pemulihan yang ditunjukkan dengan penurunan kadar MDA hati. Pemulihan terbaik kadar MDA hati ditunjukkan pada dosis 45 mg/kg BB setelah 14 hari perlakuan dengan aktivitas 0,54±0,1 nmol/mL dan mendekati kadar MDA kelompok N. Pemberian ekstrak cacing S. australe dapat menurunkan kadar MDA diduga karena adanya peningkatan superoksida dismutase (SOD) dalam sel darah merah tikus. Nurhasanah dan Syamsudin (2005) menjelaskan SOD adalah enzim yang terdapat pada sitoplasma dan mitokondria. SOD adalah salah satu antioksidan enzimatik yang memiliki fungsi menetralkan radikal bebas menjadi H2O2 dan O2. Menurut
22
Kandungan antioksidan ekstrak cacing S. australe diduga berkaitan dengan senyawa flavonoid, alkaloid, saponin, dan steroid. Adji (2008) menyebutkan senyawa bioaktif terutama yang mengandung gugus fenolik seperti flavonoid mempunyai kemampuan antioksidan yang mampu mencegah peroksidasi lipida sehingga dapat mengurangi pembentukan produk peroksidasi lipida seperti malonaldehida. Menurut Durgo et al. (2007), flavonoid dapat melindungi membran lipida dari kerusakan oksidatif, sehingga peroksidasi lipida dapat dihambat dan peningkatan kadar MDA dapat dicegah.
KESIMPULAN DAN SARAN
Kesimpulan
Hasil penelitian menunjukkan bahwa ekstrak cacing S. australe dengan dosis 45 mg/kgBB dapat menurunkan kadar glukosa darah tikus sebesar 104±38,59 mg/dL dan meningkatkan bobot tubuh sebesar 18,2±19,49 g. Ekstrak cacing S. australe memberikan efek pemulihan terbaik pada dosis 45 mg/kgBB dengan kadar SGOT sebesar 152,67±17,21 U/L, kadar SGPT 16,33 ± 28,01 U/L, dan kadar MDA 0,54±0,1 nmol/mL. Komponen aktif yang terkandung dalam ekstrak cacing S. australe diantaranya adalah flavonoid, alkaloid, saponin, dan steroid.
Saran
Ekstraksi cacing S. australe menggunakan berbagai jenis pelarut perlu dilakukan agar dapat membandingkan rendemen yang dihasilkan serta menguji komponen bioaktif yang terkandung di dalamnya. Pemurnian ekstrak etanol cacing S. australe perlu dilakukan untuk mengetahui senyawa murni yang berperan sebagai antihiperglikemik pada ekstrak tersebut. Berbagai pengujian perlu dikaji untuk mengetahui aktivitas lain yang dimiliki oleh ekstrak S. australe.
DAFTAR PUSTAKA
[ADA] American Diabetes Association. 2013. Standards of medical care in diabetes-2030. Diabetes Care. 36(1): 511-566.
Adji D. 2008. Hubungan konsentrasi malondialdehida, glukosa dan total kolesterol pada tikus putih yang diinjeksi dengan streptozotocin. Jurnal Sains Veteriner. 26(2):73-77.
23
[AOAC] Association of Official Analytical Chemist. 2005. Official Method of Analysis of The Association of Official Analytical of Chemist. Arlington (US): The Association of Official Analytical Chemist, Inc.
Archer ZA, Rayner DV, Rozman J, Klingenspor M, Mercer JG. 2003. Normal distribution of body weight gain in male Sprague Dawley rats fed a high-energy diet. Obesity Research. 11(11): 1376-1384.
Arifin Z. 2008. Beberapa unsur mineral esensial mikro dalam sistem biologi dan metode analisisnya. Jurnal Litbang Pertanian. 27 (3):99-105.
Bigoniya P, Singh CS, Shukla A. 2002. A comprehensiv review of different liver toxicants used in experimental pharmacology. International Journal of Pharmacy Science and Drug Research. 1(3):124-135.
[BPOM] Badan Pengawas Obat dan Makanan. 2011. Peraturan Kepala Badan Pengawas Obat Dan Makanan Republik Indonesia Nomor HK.03.1.23.12.11.10217 Tahun 2011 Tentang Obat Wajib Uji Ekivalensi. Jakarta (ID): Badan Pengawas Obat dan Makanan
Brahmachari G. 2011. Bio-flavonoids with promising antidiabetic potentials: a critical survey. Research Signpost. 661(2): 187-212.
Cahyono JBSB.2007. Manajemen perioperatif pada pasien dengan penyakit hati. Majalah Kedokteran Indonesia. 57(1): 397-403.
Chen XZ, Ru ZD. 2011. Immunomodulatory activities on macrophage of polysaccharide from Sipunculus nudus L. Food and Chemical Toxicology. 49: 2961-2967.
Cutler EB. 1994. The Sipuncula, Their Systematics, Biology, and Evolution. New York (US): Cornel Univ. Press. hlm 24-59.
Cutler EB, Gibbs PE. 1985. A phylogenetic of higher taxa in the phylum Sipuncula. Systematic Zoology 34: 162-173.
Dalimunthe D. 2004. Diabetes Melitus: Peranan Insulin, Reseptor Insulin, dan Penanganannya. Medan (ID): USU Press.
Derelanko MJ. 2008. The Oxicologist’s Pocket Handbook. New York (US): CRC Press.
Dheer R, Bhatnagar P. 2010. A study of the antidiabetic activity of Barleria prionitis Linn. Indian Journal of Pharmacology. 42(2): 1-5.
Diani A, Aman BP. 2010. Tata laksana metformin diabetes melitus tipe 2 pada anak dibandingkan dengan obat anti diabetes oral yang lain. Sari Pediatri. 11(6):395-400.
Durgo K, Lidija V, Gordana R, Maja O, Jasna FC. 2007. Effect of flavonoids on glutathione level, lipid peroxidation and Cytochrome P450 CYP1A1 expression in human laryngeal carcinoma cell lines. Food Technology Biotechnology. 45(1): 69-79.
24
Erwin, Etriawati, Muttaqien, Pangestiningsih TW, Widyarini S. 2013. Ekspresi insulin pada pankreas mencit (Mus musculus) yang diinduksi dengan streptozotocin berulang. Jurnal Kedokteran Hewan. 7(2): 97-100.
Fakhrurrozi Y. 2011. Studi etnobiologi, etnoteknologi dan pemanfaatan kekuak (Xenosiphon sp.) oleh masyarakat di Kepulauan Bangka-Belitung [disertasi]. Bogor (ID): Sekolah Pascasarjana, Institut Pertanian Bogor. Firdaus RT, Suhartono E, Qamariah N. 2004. Pemodelan reaksi glikolsilasi dan
peran infus daun tapak dara (Catharantus roseus [L] G. Don) sebagai penghambat kerusakan protein. Berkala Ilmu Kedokteran. 36(1): 1-6. Firdous M, Koneri R, Sarvaraidu CH, Shubhapriya KH. 2009. NIDDM
antidiabetic activity of saponins of Momordica cymbalaria in streptozotocin-nicotinamide NIDDM mice. Journal of Clinical and Diagnosis Research. 3: 1460-1465.
Fitriah, Theodorus, Kamaluddin MT. 2013. Efek pemberian serbuk teripang (Stichopus variegatus) jangka panjang terhadap kadar gula darah tikus putih jantan galur Wistar model hiperglikemik. Makalah Kedokteran Sriwijaya. 45(1): 5-10.
Harborne JB. 1987. Metode Fitokimia. Edisi ke-2. Padmawinata K, Soediro I, penerjemah. Bandung (ID): Institut Teknologi Bandung. Terjemahan dari: Phytochemical Methods.
Heath HB, Reineccius G. 1986. Flavor Chemistry and Technology. New York (US): Van Nostrand Reinhold Company Publication.
Hermawan D, Saifullah, Herdiyana D. 2015. Pengaruh perbedaan jenis substrat pada pemeliharaan cacing laut (Nereis sp.). Jurnal Perikanan dan Kelautan. 5(1): 41-47.
[IDF] International Diabetes Federation. 2013. IDF Diabetes Atlas-Sixth Edition . Brussel (BE): International Diabetes Federation.
[IFCC] International Federation of Clinical Chemistry. 2002. Commitee on reference system for enzymes, Chemical Clinic Laboratorium Medic. 40(7): 725-733.
Iskandar A, Loeki EF, Andrean AN. 2009. Efek pemberian kombinasi Artemisinin dan N-Acetylycysteine (NAC) terhadap kadar 30 malondialdehida ginjal mencit galur BALB/c yang diinfeksi plasmodium berghei. Jurnal Majalah Kesehatan. FKUB 2(1): 11-13.
Iswantini D, Silitonga RF, Martatilofa E, Darusman LK. 2011. Zingiber cassumunar, Guazuma ulmifolia, and Murray paniculata extracts as antiobesity: in vitro inhibitory effect on pancreatic lipase activity. Hayati Journal of Bioscience. 18 (1): 6-10.
25
Krysanti A, Simon BW. 2014. Toksisitas subakut tepung glukomanan (A. Muelleri Blume) terhadap SGOT dan natrium tikus Wistar secara in vivo. Jurnal Pangan dan Agroindustri. 2(1): 1-7.
Leiwakabessy J. 2011. Komposisi kimia dan identifikasi senyawa antioksidan dari ekstrak tambelo (Bactronophorus thoracites) [tesis]. Bogor (ID): Sekolah Pascasarjana, Institut Pertanian Bogor.
Lewerissa YA. 2014. Studi ekologi sumberdaya teripang di Negeri Porto Pulau Saparua Maluku Tengah. Biopendix. 1(1): 32-43.
Mataputun SP, Rorong JA, Pontoh J. 2013. Aktivitas inhibitor α-glukosidase ekstrak kulit batang matoa (Pometia pinnata. Spp.) sebagai agen antihierglikemik. Jurnal MIPA UNSRAT Online. 2(2): 119-123.
Mukesh P, RN Jadhav, BI Jadhav. 2012. Evaluation of antimicrobial principles of Rhizophora species along Mumbai Coast. Journal of Advanced Scientific Research. 3(3): 30-33.
Mukhriani. 2014. Ekstraksi, pemisahan senyawa, dan identifikasi senyawa aktif. Jurnal Kesehatan. 7(2): 361-367.
Munairi A, Abida IW. 2012. Studi kepadatan dan pola distribusi cacing lur (Nereis sp.) di Perairan Pesisir Kecamatan Kwanyar Kabupaten Bangkalan. Jurnal Kelautan. 5(1): 47-51.
Ndraha S. 2014. Diabetes melitus tipe 2 dan tatalaksana terkini. Medicinus. 27(2): 9-16.
Nurhasanah F, Syamsudin. 2005. Efek antioksidan dari ekstrak biji petai cina (Leucaena leucocephala L.) pada tikus putih. Jurnal Ilmu Kefarmasian Indonesia. 3(1): 13-16.
Nurulita Y, Haryanto D, Andreanus AS. 2008. Penapisan aktivitas dan senyawa antidiabetes ekstrak air daun dandang gendis (Clinacanthus nutans). Jurnal Natur Indonesia. 10(2): 98-103.
Petterino C, Storino AA. 2006. Clinical chemistry and haematology historical data in control Sprague-Dawley rats from pre-clinical toxicity studies. Experimental and Toxicologic Pathology. 57: 213-219.
Purwaningsih S. 2014. Pengembangan pangan fungsional sebagai antidiabetes dari beberapa moluska yang mempunyai aktivitas antioksidan tinggi [laporan akhir penelitian]. Bogor (ID): Institut Pertanian Bogor
Purwaningsih S, Rimbawan, Priosoeryanto BP. 2008. Ekstraksi komponen aktif sebagai antikanker pada sel lestari keong matah merah (Cerithidea obtusa). Jurnal Ilmu-Ilmu Perairan dan Perikanan Indonesia. 15(2): 103-108.
26
Sani M. 2010. Aktivitas ekstrak etil asetat daun mimba sebagai antihiperglikemik pada tikus yang diinduksi aloksan [skripsi]. Bogor (ID): Fakultas Kedokteran Hewan, Institut Pertanias Bogor.
Sari EM, Maruf WF, Sumardianto. 2014. Kajian senyawa bioaktif ekstrak teripang hitam (Holothuria edulis) basah dan kering sebagai antibakteri alami. Jurnal Pengolahan dan Bioteknologi Hasil Perikanan. 3(4):16-24. Scalecsky E, Prechl J, Feher J, Somogy. 1999. Alteration in enzymatic antioxidant defence in diabetes mellitus. Post Graduate Medical Journal. 75:15-17. Sompong R, Siebenhandl ES, Linsberger MG, Berghofer E. 2011.
Physicochemical and antioxidative properties of red and black rice varieties from Thailand, China and Sri Lanka. Journal of Food Chemistry. 124: 132-140.
Steel RGD, Torrie JH. 1991. Principles and Procedures of Statistics: A Biometrical Approach. Sumantri B, Penerjemah. Jakarta (ID): PT Gramedia Pustaka Utama.
Syaputra D, Ibrahim B, Poernomo D. 2007. Produk fermentasi dari cacing kapal Bactronophorus sp. segar. Jurnal Sumberdaya Perairan. 1:12-14.
Tiong SH, Looi CY, Hazni H, Arya A, Paydar M, Wong WF, Cheah SC, Mustafa MR, Awang K. 2013. Antidiabetic and antioxidant properties of alkaloids from Catharantus roseus (L.) G. Don. Molecules. 18: 9770-9780.
[WHO] World Health Organization. 2006. Definition and Diagnosis of Diabetes Mellitus and Intermediate Hyperglycemia. Geneva (CH): WHO Press.
Widarta IWR, Nocianitri KA, Sari LPIP. 2013. Ekstraksi komponen bioaktif bekatul beras lokal dengan beberapa jenis pelarut. Jurnal Aplikasi Teknologi Pangan. 2(2): 75-79.
Widowati L, Sumali W, Pudjiastuti. 2006. Pengaruh ekstrak etanol biji klabet (Trigonella foenum-graecum L.) terhadap kadar gula darah tikus NIDDM. Buletin Penelitian Kesehatan. 32: 172-182.
Wikanta T, Rahma D, Lestari R. 2008. Pengaruh pemberian -karahenan dan -karagenan terhadap penurunan kadar glukosa darah tikus hiperglikemia. Jurnal Pascapanen dan Bioteknologi Kelautan dan Perikanan. 3(2): 131-138.
Wills ED. 1987. Biochemical Toxicology, a Practical Approach. Oxford (UK): IRL Press Limited.
Wirda Z, Hakimah H, Tanwirul M, Rahmi Z. 2011. Pengaruh berbagai jenis pelarut dan asam terhadap rendemen antosianin dari kubis merah (Brassica oleraceae capitata). Agroscientiae. 18(2): 57-63.
27
Zhang CX, Zi RD, Qiu XC. 2011. Anti-inflammatory and anti-nociceptive activities ofSipunculus nudus L. extract. Journal of Ethnopharmacology. 137:1177-1182.
29
31
Lampiran 1 Data Pengukuran morfometrik cacing S. australe
No Panjang (cm) Diameter (cm) Bobot (gram)
1 2 3 1 2 3 1 2 3
1 13,66 13,65 13,67 2,64 2,63 2,62 38,514 38,513 38,512 2 16,73 16,74 16,75 2,47 2,48 2,46 42,792 42,793 42,791 3 15,62 15,61 15,60 2,62 2,63 2,62 41,358 41,357 41,356 4 14,44 14,42 14,43 2,16 2,17 2,15 40,225 40,224 40,226 5 13,81 13,82 13,80 2,21 2,20 2,19 43,691 43,690 43,689 6 17,40 17,41 17,39 2,37 2,38 2,39 51,907 51,906 51,908 7 17,10 17,11 17,09 2,61 2,60 2,59 45,416 45,415 45,416 8 15,63 15,64 15,62 2,68 2,67 2,68 39,938 39,937 39,936 9 12,24 12,25 12,26 2,79 2,78 2,76 42,544 42,543 42,542 10 12,28 12,29 12,30 2,26 2,24 2,25 29,345 29,346 29,347 11 15,12 15,11 15,13 2,65 2,66 2,67 39,109 39,110 39,108 12 13,21 13,22 13,20 2,99 2,98 2,97 52,297 52,298 52,299 13 12,97 12,98 12,99 3,41 3,42 3,40 44,942 44,943 44,944 14 17,30 17,31 17,32 2,76 2,77 2,78 56,405 56,404 56,403 15 12,76 12,74 12,75 2,26 2,25 2,24 30,823 30,822 30,821 16 15,64 15,63 15,62 2,26 2,25 2,27 50,748 50,747 50,749 17 14,74 14,73 14,75 2,05 2,03 2,04 34,144 34,145 34,143 18 16,18 16,17 16,19 2,54 2,53 2,52 53,991 53,990 53,989 19 14,51 14,52 14,50 2,29 2,28 2,27 36,776 36,777 36,775 20 11,54 11,53 11,52 1,86 1,87 1,88 30,848 30,849 30,850 21 16,42 16,43 16,41 3,11 3,12 3,10 54,316 54,315 54,314 22 16,74 16,73 16,75 2,74 2,73 2,74 52,016 52,015 52,014 23 16,68 16,69 16,67 2,96 2,95 2,97 51,478 51,479 51,477 24 16,79 16,77 16,78 2,52 2,53 2,54 45,144 45,143 45,143 25 12,44 12,43 12,42 1,93 1,92 1,91 30,405 30,406 30,407 26 12,77 12,78 12,76 2,30 2,29 2,31 33,406 33,407 33,405 27 12,49 12,48 12,49 2,20 2,19 2,18 31,388 31,389 31,390 28 15,54 15,53 15,55 2,94 2,95 2,96 50,087 50,088 50,086 29 12,06 12,07 12,05 2,26 2,25 2,27 26,949 26,948 26,950 30 15,43 15,44 15,42 2,61 2,63 2,62 45,579 45,578 45,577
Rata-rata 14,67 2,51 42,22
Standard