MENGGUNAKAN VAKSIN SEL UTUH
TIPE β-HEMOLITIK DAN NON-HEMOLITIK
Streptococcus agalactiae
LA PATURUSI LA SENNUNG
PROGRAM STUDI ILMU AKUAKULTUR
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
BOGOR
ii
PERNYATAAN MENGENAI TESIS DAN SUMBER
INFORMASI
Dengan ini saya menyatakan bahwa tesis Pengendalian Penyakit Streptococcosis pada Ikan Nila Oreochromis niloticus dengan MenggunakanVaksin Sel Utuh Tipe β-hemolitik dan Non-hemolitik Streptococcus agalactiae adalah karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini
Bogor, Juli 2012
iii
La Paturusi La Sennung. The Prevention of Streptococcal Disease on Nila (Oreochromis niloticus) with Whole Cell β-haemolytic and Non-haemolytic Type
Streptococcus agalactiae Vaccine. Under direction of Sukenda, Munti Yuhana, Angela Mariana Lusiastuti.
This research aimed to know the effectiveness of a Streptococcus agalactiae
vaccine to prevent Streptococcosis caused by S. agalactiae on Nila (Oreochromis niloticus). The vaccine was prevared prom whole cell β-haemolytic type, haemolytic type and bivalen (mixture of 50% of β-haemolytic and 50% non-haemolytic whole cell).
Vaccinated trial was done through intra peritonial (ip) injection into fish having mean weight of 15 g. Control positif nila were injected with PBS. Vaccinated fish challenged by IP injection 106 colony forming unit (CFU)/fish of β-haemolytic,
105 CFU/fish of non-haemolytic, and 105,5 CFU/fish of bivalen (β-haemolytic and
non-haemolytic) S. agalactiae.
Fish vaccinated with whole cell β-haemolytic had a relative percent survival (RPS) of 67% when challenged with β-haemolytic and 50% challenged with non-haemolytic. A RPS of 63% from fish vaccinated with whole cell non-haemolytic challenged with non-haemolytic and 63% challenged with β-haemolytic. Whereas nila vaccinated with bivalen had a RPS of 64% challenged with bivalen, 74%
challenged with β-haemolytic, and 68% challenged with non-haemolytic of
S. agalactiae. The conclution is vaccination S. agalactiae bivalen have highest protection against S. agalactiae infection.
iv
RINGKASAN
LA PATURUSI LA SENNUNG. Pengendalian penyakit Streptococcosis pada Ikan Nila (Oreochromis niloticus) dengan Menggunakan Vaksin Sel Utuh Tipe β-Hemolitik dan Non-Hemolitik Streptococcus agalactiae
Streptococcus agalactiae merupakan bakteri patogen yang saat ini menjadi salah satu masalah utama pada budidaya ikan nila dan menyebabkan kematian yang tinggi serta kerugian ekonomi yang cukup besar.
Kontrol dan penanggulangan penyakit secara konvensional sering dilakukan dengan menggunakan bahan kimia seperti obat-obatan antimikroba dan desinfektan. Penggunaan antibiotik dan bahan kimia yang tidak terkendali untuk pengobatan penyakit, dapat menyebabkan gangguan pada keseimbangan dinamika alami mikroorganisme dalam pemeliharaan ikan. Oleh karena itu, perlu dicari alternatif lain dalam pengendalian penyakit yang disebabkan oleh bakteri S. agalactiae. Salah satu cara yang cukup efektif dan prospektif yang dapat dilakukan dalam pengendalian penyakit S. agalactiae pada ikan nila adalah membuat kekebalan spesifik pada ikan dengan cara pemberian vaksin.
Penelitian ini dilaksanakan selama enam bulan, mulai dari bulan November 2010 sampai April 2011, di Laboratorium Kesehatan ikan, Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor. Penelitian ini dibagi tiga bagian yaitu 1) Efikasi vaksinasi bakteri S. agalactiae tipe β-hemolitik; 2) Efikasi vaksinasi bakteri S. agalactiae tipe non-hemolitik ; 3) Efikasi vaksinasi bakteri S. agalactiae tipe bivalen. Pada penelitian bagian satu dan dua terdiri dari empat perlakuan dan tiga ulangan, sedangkan penelitian bagian tiga terdiri dari lima perlakuan dan tiga ulangan. Penelitian bagian satu dengan perlakuan yaitu; A (kontrol -), B (kontrol +), C (β-hemolitik) dan D (β-hemolitik). Penelitian bagian dua yaitu; E (kontrol -), F (Kontrol +), G (non-hemolitik) dan H (non-hemolitik). Penlitian bagian tiga dengan pelakuan yaitu; K (kontrol -), L (kontrol +), M (bivalen), N (bivalen) dan P (bivalen).
v
(kontrol positif) menunjukkan angka mortalitas yang sangat tinggi yaitu 95%, perlakuan G dan H angka mortalitasnya 35%. Sedangkan nila RPS pada pelakuan yang divaksinasi yaitu perlakuan G (vaksin sel utuh non-hemolitik) diuji tantang dengan bakteri non-hemolitik dan perlakuan H (vaksin sel utuh non-hemolitik) diuji tantang dengan bakteri β-hemolitik menunjukkan angka RPS yang sama yaitu 63%. Hasil penelitian mengenai total leukosit, aktivitas fagosit dan titer antibodi menunjukkan bahwa perlakuan yang divaksinasi berbeda dengan yang tidak divaksinasi. Perlakuan yang divaksinasi yaitu perlakuan G dan H dengan total leukosit pada hari ke nol G(1,16) dan H(1,32), hari ke tujuh menjadi G(1,81) dan H(1,52) dan pada hari ke 14 mengalami penurunan yaitu G(1,07) dan H(1,15). Sedangkan perlakuan E dan F yang tidak divaksinasi total leukositnya berfluktuasi. Aktivitas fagosit mengalami peningkatan pada hari ke-nol perlakuan G(18) dan perlakuan H(18), hari ke-tujuh perlakuan G(20) dan H(24) dan hari ke 14 setelah uji tantang yaitu perlakuan G(21) dan H(20). Demikian pula dengan uji titer antibodi, perlakuan yang tidak divaksinasi (E dan F) titer antibodinya tidak terdeteksi mulai dari hari ke nol sampai hari ke 14 setelah uji tantang.
Hasil penelitian bagian tiga memperlihatkan bahwa perlakuan L(kontrol +) diuji tantang dengan bakteri bivalen menunjukkan mortalitas yang paling tinggi yaitu 95%. Sedangkan P(vaksin bivalen) diuji tantang dengan bakteri bivalen (30%) disusul dengan N (vaksin bivalen) diuji tantang dengan bakteri β-hemolitik (25%) dan M (15%). Nilai RPS tertinggi ditunjukkan oleh perlakuan M (84%) disusul N dan P dengan nilai masing-masing 74% dan 68%. Total leukosit, aktivitas fagositik dan titer antibodi terlihat bahwa perlakuan yang divaksinasi menujukkan perbedaan dengan perlakuan yang tidak divaksinasi. Perlakuan L (kontrol +) pada hari ke nol menunjukkan angka (0,92), hari ke tujuh (0,85) dan hari ke 14 (0 80). Sedangkan perlakuan M (1,77), N (2,09) dan P (1,99) pada hari ke nol. Hari ke tujuh mengalami peningkatan yaitu M(1,80), N (2,19) dan P (2,01). Hari ke 14 mengalami penurunan yaitu M (1,47), N (1,56) dan P (1,36). Aktivitas fagositik mengalami peningkatan sejak hari ke nol sampai hari ke tujuh pada perlakuan yang divaksinasi yaitu M(20), N (20) dan P (19). Pada hari ke tujuh setelah uji tantang M(23), N (25) dan P (25). Sedangkan pada hari ke-14 mengalami penurunan yaitu M (19), N (20) dan P (19). Perlakuan yang tidak divaksinasi titer antibodinya tidak terdeteksi mulai hari ke-nol sampai hari ke-14 setelah uji tantang, sedang perlakuan yang divaksinasi pada hari ke-nol M (4), N(5) dan P (4). Pada hari ke-tujuh M (5), N (5)) dan P (%). Sedangkan pada hari ke-14 titer antibodinya mengalami penurunan yaitu M (2), N (3) dan P (2). Kesimpulan, vaksin terbaik adalah vaksin bivlen (gabungan dari 50% sel utuh tipe S. agalactiae tipe β-hemolitik dengan 50% sel utuh tipe S. agalactiae non-hemolitik).
vi
© Hak Cipta milik IPB, tahun 2012
Hak Cipta dilindungi Undang-undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah, dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB.
vii
PENGENDALIAN PENYAKIT STREPTOCOCCOSIS PADA
IKAN NILA Oreochromis niloticus DENGAN MENGGUNAKAN
VAKSIN SEL UTUH TIPE β-HEMOLITIK DAN
NON-HEMOLITIK Streptococcus agalactiae
LA PATURUSI LA SENNUNG
Tesis
Sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Program Studi Ilmu Akuakultur
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
viii
Judul Penelitian : Pengendalian Penyakit Streptococcosis pada Ikan Nila
Oreochromis niloticus dengan Menggunakan Vaksin Sel Utuh Tipe β-Hemolitik dan Non-Hemolitik
Streptococcus agalactiae
Nama Mahasiswa : La Paturusi La Sennung
NIM : C 151 080 161
Program Studi : Ilmu Akuakultur
Disetujui Komisi Pembimbing
Dr. Ir. Sukenda, M.Sc. Ketua
Dr. Munti Yuhana, S.Pi. M.Si. Dr. drh. Angela Mariana Lusiastuti,M.Si. Anggota Anggota
Diketahui
Ketua Program Studi Ilmu Akuakultur Dekan Sekolah Pascasarjana
`
Prof. Dr. Ir. Enang Harris, MS. Dr. Ir. Dahrul Syah, M.Sc. Agr.
ix
Penguji Luar komisi pada Ujian Tesis : Dr. Sri Nuryati, S.Pi, M.Si
x
PRAKATA
Puji syukur disampaikan kehadirat Tuhan Yang Maha Esa karena atas rakhmat dan hidayah-Nya sehingga penulisan tesis yang berjudul ”Pengendalian Penyakit Streptococcosis pada Ikan Nila Oreochromis niloticus dengan Menggunakan Vaksin Sel Utuh Tipe β-Hemolitik dan Non-Hemolitik
Streptococcus agalactiae ” dapat terselesaikan.
Pada kesempatan ini penulis mengucapkan terima kasih kepada Dr. Sukenda M.Sc selaku ketua komisi pembimbing, Dr. Munti Yuhana M. Si dan Dr. drh. Angela Mariana Lusiastuti M. Si masing-masing sebagai anggota komisi pembimbing atas arahan, bimbingan dan masukan dalam penyelesaian tesis ini. Terima kasih juga saya sampaikan untuk Politeknik Pertanian Negeri Pangkajene Kepulauan (Pangkep) yang telah memberikan izin untuk menempuh pendidikan S2 ini, juga kepada Departemen Pendidikan Nasional Direktorat Jendral Pendidikan Tinggi RI yang telah memberikan beasiswa melalui Beasiswa Program Pascasarjana (BPPS). Ungkapan terima kasih juga saya sampaikan kepada rekan-rekan mahasiswa Program Studi Ilmu Akuakultur atas kekompakan dan kerja sama yang baik serta saran, koreksi dan bantuannya dalam penyelesaian tesis ini.
Penulis menyadari bahwa dalam penulisan tesis ini masih terdapat kekurangan di dalamnya sehingga kritik dan saran yang sifatnya membangun sangat diharapkan demi kesempurnaan dan perbaikan tulisan ini. Penulis juga berharap semoga tesis ini dapat bermanfaat bagi yang membutuhkan.
Bogor, Juli 2012
xi
RIWAYAT HIDUP
Penulis dilahirkan di Pinrang pada tanggal 21 Agustus 1957 sebagai anak keenam dari tujuh bersaudara dari pasangan alm. La Sennung dan Hj. Djampu alm.
Pendidikan Sekolah Dasar diselesaikan pada tahun 1969 di SD Negeri 17 Mattirobulu Pinrang, Sekolah Menengah Pertama pada tahun 1973 di SMP Negeri I Maros, dan Sekolah Menengah Atas pada tahun 1976 di SMA Negeri I Makassar. Sejak Juli 1979 penulis tercatat sebagai mahasiswa di Program Studi Akuakultur, Jurusan Perikanan, Fakultas Peternakan, Universitas Hasanuddin Makassar. Pada tahun 1985 penulis menyelesaikan program studi S1.
Pada tahun 1986 mengikuti Teaching Methodology course di berbagai Universitas di Australia yang dibiayai oleh Asian Development Bank (ADB) bekerja sama dengan Departemen Pendidikan Nasional, Direktorat Jenderal Pendidikan Tinggi. Tahun 1987 bekerja sebagai Staf Pengajar pada Politeknik Pertanian Negeri Pangkep dan tahun 1989/1990 mengikuti training Fish Processing di Italia yang dibiayai oleh FAO bekerjasama dengan Bank Dunia.
xii
DAFTAR ISI
Halaman
DAFTAR TABEL ... ix
DAFTAR GAMBAR ... x
DAFTAR LAMPIRAN ... xi
1. PENDAHULUAN Latar Belakang ... 1
Rumusan Masalah ... 2
Tujuan dan Manfaat ... 2
Hipotesis ... 3
2. TINJAUAN PUSTAKA Bakteri Streptococcus agalactiae ... 4
Ikan Nila Oreochromis niloticus... 5
Imunologi Ikan... 6
Vaksinasi ... 9
Parameter Imunologi ... 10
3. METODE PENELITIAN Waktu dan Tempat ... 13
Pemeliharaan Ikan Uji ... 13
Persiapan Bakteri Streptococcus agalactiae ... 14
Persiapan Vaksin ... 14
Palaksanaan Penelitian ... 14
Penelitian Bagian Pertama (Vaksin β-hemolitik) ... ... 14
Penelitian Bagian Kedua (Vaksin non- hemolitik) .... ... 15
Panelitian Bagian Ketiga (Vaksin bivalen / gabungan)... ... 15
Paramater yang Diukur... 15
Mortalitas ... 16
xiii
Titer antibodi ... 17
Analisa Data ... 18
4. HASIL DAN PEMBAHASAN Penelitian Bagian Pertama (Vaksin β-hemolitik) ... ... 19
Mortalitas ... ……… 19
Gambaran darah . ………. 20
Total leukosit .... ... 21
Aktivitas fagositik ... 21
Titer antibodi ... 23
Penelitian Bagian Kedua (Vaksin non- hemolitik) .... ... 25
Mortalitas .... ... 26
Gambaran darah .... ... 27
Total leukosit ... 27
Aktivitas fagositik ... 28
Titer antibodi ... ... 29
Penelitian Bagian Ketiga (Vaksin bivalen / gabungan) .. ... 31
Mortalitas ... 31
Gambaran darah ... ... 33
Total leukosit ... 33
Aktivitas fagositik ... ... 34
Titer antibodi .. ... 35
Kualitas Air.. ... 36
5. KESIMPULAN DAN SARAN Kesimpulan ... 38
Saran .. ... 38
6. DAFTAR PUSTAKA ... 39
xiv
DAFTAR TABEL
Halaman
1. Karakteristik S. agalactiae yang menyerang sapi dan ikan .. ... 5 2. Tingkat RPS dan mortalitas ikan nila yang divaksin dengan S. agalactiae tipe β-hemolitik ... ... 20 3. Total leukosit, aktivitas fagositik, dan titer antibodi setelah vaksinasi
vaksin β- hemolitik pada hari ke-0, 7 dan 14 pasca uji tantang ... 25 4. Tingkat RPS dan mortalitas ikan nila yang divaksinasi dengan
S. agalactiae tipe non hemolitik ... 27 5. Total leukosit, aktivitas fagositik, dan titer antibodi setelah vaksinasi
vaksin non hemolitik pada hari ke-0, 7 dan 14 pasca uji tantang ... 30 6. Tingkat RPS dan mortalitas ikan nila yang divaksinasi dengan
S. agalactiae tipe bivalen (gabungan bakteri tipe β-hemolitik dan
non hemolitik) ... 32 7. Total leukosit, aktivitas fagositik, dan titer antibodi setelah vaksinasi
vaksin bivalen (gabungan vaksin tipe β hemolitik dan non hemolitik)
xv
Halaman
1. Mortalitas ikan nila yang divaksinasi dengan S. agalactiae tipe
β-hemolitik ... 19 2. Mortalitas ikan nila yang divaksinasi dengan S. agalactiae tipe
non-hemolitik .. ……… 26 3. Mortalitas ikan nila yang divaksinasi dengan S. agalactiae tipe
bivalen (gabungan β-hemolitik dan non- hemolitik) ... 32
xvi
DAFTAR LAMPIRAN
Halaman 1. Tingkat kelangsungan hidup ikan nila (%) setelah diuji tantang dengan
S. agalactiae ... 43 2. Analisis statistik terhadap kelangsungan hidup ikan nila yang divaksin
β-hemolitik pasca uji tantang ... 44 3. Analisis statistik terhadap kelangsungan hidup ikan nila yang di vaksin
non hemolitik pasca uji tantang ... 45 4. Analisis statistik terhadap kelangsungan hidup ikan nila yang divaksin
bivalen pasca uji tantang ... 46 5. Grafik total leukosit, aktivitas fagositik, dan titer antibodi setelah
vaksinasi vaksin β-hemolitik pada hari ke- 0, 7, dan 14 pasca uji
tantang ... 47 6. Grafik total leukosit, aktivitas fagositik, dan titer antibodi setelah
vaksinasi vaksin non hemolitik pada hari ke- 0, 7, dan 14 pasca
uji tantang ... ... 48 7. Grafik total leukosit, aktivitas fagosit, dan titer antibodi setelah vaksinasi
vaksin bivalen (gabungan vaksin β-hemolitik dan non hemolitik) pada
PENDAHULUAN
Latar Belakang
Ikan nila Oreochromis niloticus merupakan jenis ikan yang mempunyai nilai ekonomis tinggi dan merupakan komoditas penting dalam budidaya ikan air tawar dunia. Beberapa hal yang mendukung pentingnya komoditas nila adalah memiliki resistensi yang relatif tinggi terhadap penyakit, memiliki toleransi yang luas terhadap kondisi lingkungan, memiliki kemampuan yang efisien dalam membentuk protein dari bahan organik, limbah domestik dan pertanian, memiliki kemampuan tumbuh yang baik dan mudah tumbuh dalam sistem budidaya intensif (Sucipto 2007). Berbagai keunggulan pada ikan nila membuat permintaan terus meningkat, akibatnya penerapan intensifikasi budidaya tidak dapat dihindarkan. Namun, intensifikasi budidaya yang kurang memperhatikan kondisi lingkungan budidaya dapat menimbulkan berbagai dampak negatif antara lain timbulnya penyakit. Salah satu penyakit yang sedang mewabah dan menjadi salah satu masalah utama pada budidaya ikan nila saat ini yaitu Streptococcosis yang disebabkan oleh bakteri Streptococcus agalactiae.
Bakteri S. agalactiae dapat menyebabkan kematian yang tinggi dan menyebabkan kerugian ekonomi yang cukup besar dalam budidaya ikan nila. Berdasarkan penelitian yang dilakukan Evans et al. (2006), bakteri S. agalactiae menyebabkan 90% kematian ikan 6 hari setelah injeksi. Infeksi S. agalactiae bersifat septicemia dan koloninya menyebar di beberapa organ dalam seperti pada otak, mata dan ginjal (Sheehan 2009). Menurut Conroy (2009), S. agalactiae menginfeksi dan lebih virulen pada kondisi lingkungan dengan suhu 24oC – 29oC.
Mengingat suhu di Indonesia umumnya berada pada kisaran tersebut, maka penyebaran serangan S. agalactiae dapat meningkat bila tidak segera ditanggulangi.
Kontrol dan penanggulangan terhadap penyakit secara konvensional sering dilakukan dengan menggunakan bahan-bahan kimia seperti obat-obatan antimikroba dan desinfektan. Penggunaan antibiotik yang tidak terkendali untuk pengobatan penyakit, dapat menyebabkan gangguan pada keseimbangan dinamika alami mikroorganisme dalam pemeliharaan ikan. Oleh karena itu, penggunaan
2
bahan-bahan kimia tersebut saat ini dibatasi dan tidak dianjurkan. Bardasarkan kelemahan tersebut, maka perlu dicari alternatif untuk menanggulangi permasalahan penyakit tanpa menggunakan antibiotik dan bahan kimia lainnya (Weston 1996; Esiobu et al. 2002).
Pada kondisi ini, salah satu cara yang cukup efektif dan prospektif yang dapat dilakukan dalam pengendalian penyakit S. agalactiae pada ikan nila adalah membuat kekebalan spesifik pada ikan dengan pemberian vaksin. Vaksinasi adalah salah satu alternatif pengendalian penyakit yang dikenal cukup efektif dan efisien serta memberikan perlindungan yang cukup lama. Dalam hal ini ikan akan merespon dan mensintesa antibodi yang dikenal sebagai imunoglobulin. Penelitian dan pengembangan vaksin Streptococcus saat ini masih sedikit, terutama pada isolat-isolat lokal Indonesia. Berdasarkan hal itu, perlu dilakukan pembuatan dan penyediaan vaksin sebagai salah satu upaya pengendalian streptococcosis pada ikan nila.
Rumusan Masalah
Penyakit Streptococcosis yang terjadi pada budidaya ikan nila mengalami peningkatan sebagai konsekuensi kegiatan akuakultur intensif yang menyebabkan kerugian dalam industri budidaya ikan nila baik pada usaha pembenihan maupun pembesaran. Salah satu upaya yang dapat dilakukan untuk pengendalian penyakit ini adalah vaksinasi. Peningkatan efikasi vaksin untuk memberikan proteksi terbaik terhadap serangan bakteri S. agalactiae terhadap ikan nila terus dikaji. Penggunaan vaksin menguntungkan bagi organisme budidaya, diantaranya dapat meningkatkan sistem imun dan tidak bersifat patogen pada ikan. Mengingat berbagai keuntungan tersebut maka perlu dikembangkan lebih lanjut.
Tujuan dan Manfaat
Hipotesis
Hipotesis yangdiajukan dalam penelitian ini ada 2 yaitu :
1. Vaksin sel utuh dari S. agalactiae tipe β-hemolitik mampu memproteksi ikan nila terhadap bakteri S. agalactiae β-hemolitik dan vaksin sel utuh
S. agalactiae non-hemolitik mampu memproteksi ikan nila terhadap
bakteri S. agalactiae non-hemolitik .
2. Vaksin bivalen (gabungan) antara 50% sel utuh S. agalactiae β-hemolitik dan 50% sel utuh S. agalactiae non-hemolitik mampu memproteksi ikan nila terhadap penyakit Streptococcosis yang disebabkan oleh bakteri
4
TINJAUAN PUSTAKA
Bakteri Streptococcus agalactiae
Streptococcus agalactiae dapat menyebabkan neonatal meningitis pada
manusia dan mastitis pada beberapa hewan terestrial misalnya pada sapi (Lindahl
et al. 2005). Streptococcus agalactiae tergolong kedalam grup GBS (Grup B
Streptococcal) yang dapat menyebabkan kematian besar pada ikan budidaya dan ikan diperairan umum, di antaranya ikan Striped bass (Morone saxatilis) (Baya et al. 1990) dan ikan nila (Oreochromis niloticus). S. agalactiae biasanya menyerang bagian otak, mata dan organ lain yang umumnya mengandung cairan (Evans et al. 2002).
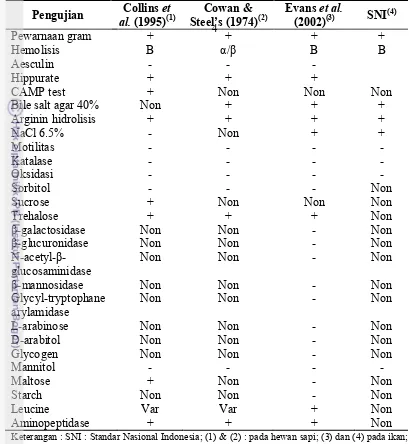
Berdasarkan hasil pengujian oleh Evans et al. (2002), S. agalactiae termasuk dalam bakteri Gram positif, oksidasi negatif, katalase negatif, isolat menunjukkan hasil positif pada reaksi leucine aminopeptidase, arginin deaminase dan trehalose. Negatif pada tes reaksi β-galactosidase, β-glucuronidase, N-acetyl β-glucosaminidase, β-mannosidase, glycyl-tryptophane arylamidase, sorbitol, L-arabinosa, D-arabitol, glycogen, dan hidrolisis amilum.
Serangan penyakit yang disebabkan oleh S. agalactiae dapat memberikan efek kronis dan akut tergantung pada tingkat serangan. Serangan pada tingkat kronis ditandai dengan adanya luka di permukaan tubuh, bercak-bercak merah pada sirip, berenang lambat dan nafsu makan ikan menjadi menurun. Sedangkan serangan akut menyebabkan kematian yang diduga karena ikan kehilangan cairan pada saluran pencernaan bagian belakang. Sebelum mengalami kematian, ikan menunjukkan gejala klinis berenang lemah dan berada di dasar akuarium, respon terhadap pakan lemah, berenang whirling (berputar-putar/menggelepar), tubuh membentuk huruf ”C”, perubahan pada warna tubuh, dan bukaan operkulum lebih cepat (Evans 2006).
Tabel 1. Karakteristik S. agalactiae yang menyerang Sapi dan Ikan. Keterangan : SNI : Standar Nasional Indonesia; (1) & (2) : pada hewan sapi; (3) dan (4) pada ikan;
non : tidak dilakukan; Var : bervariasi
Ikan Nila Oreochromis niloticus
Ikan nila merupakan ikan yang berasal dari Afrika yaitu Sungai Nil di Nigeria. Ikan nila terdiri atas 3 genus yaitu :Oreochromis, Sarotherodon dan
Tilapia (Fitzsimmons 2000; Chapman 2000). Karakteristik yang membedakan
diantara ketiganya adalah dalam hal melindungi telur/larvanya. Spesies dari genus Sarotherodon dan Oreochromis mengerami dan melindungi larva di mulut induknya, pada umumnya untuk spesies Oreochromis pada mulut induk betina. Sedangkan spesiesdari genus nila menginkubasi telur pada sarang yang dibuatnya
6
di dasar kolam. Untuk selanjutnya, penggunaan nama dari ketiga genus tersebut adalah tilapia, nila tilapia diperuntukkan bagi spesies Oreochromis niloticus.
Ikan nila dapat mencapai ukuran 40 cm.Ikan ini dapat mencapai matang telur pada umur 4-5 bulan dengan berat 120-180 g, dan dapat memijah beberapa kali dalam setahun.Pada kebanyakan ikan nila, ikan jantan umumnya berukuran lebih besar dari ukuran ikan betina. Hal ini disebabkan karena ikan betina secara teratur akan memijah walaupun telur tidak dibuahi sehingga energi untuk pertumbuhan digunakan untuk memproduksi telur. Bila ada ikan jantan dan telur dibuahi maka ikan betina akan berpuasa selama pengeraman telur di dalam mulutnya, sehingga ikan akan kurus (Angka et al. 1990).
Lingkungan ekologis ikan nila merupakan bentopelagik yang hidup diperairan tawar maupun perairan payau.Di daerah tropis ikan tilapia tahan pada temperatur 8– 42oC. Ikan nila merupakanikan pemakan phytoplankton dan alga
bentos. Antigenisitas dari bakteri Streptococcusakan meningkat seiring dengan peningkatan salinitas. Ikan nila pada salinitas 15–30 ppt dengan suhu perairan 25–30oC telah rentan terhadap Streptococcus dari pada nila yang dipelihara pada
perairan tawar dengan suhu yang sama (Chang and Plumb 1996).
Imunologi Ikan
Sistem pertahanan spesifik membutuhkan waktu untuk mengenal antigen terlebih dahulu sebelum meresponnya. Spesifik berarti hanya dapat menghancurkan benda asing yang sudah dikenal sebelumnya. Benda asing pertama, segera dikenali kemudian terjadi sensitasi sistem pertahanan tubuh. Benda asing kedua, akan dikenal lebih cepat kemudian dihancurkan. Sistem pertahanan spesifik disebut juga sistem pertahanan ketiga dimana yang berperan adalah antibodi (Kamiso 2001). Menurut Nurcahyo (2001), mekanisme pertahanan spesifik berfungsi untuk menetralisasi infeksi virus, aktivasi komplemen dan opzonisasi partikel.
Seperti halnya pada mamalia, ikan juga mempunyai sistem kekebalan untuk mengantisipasi infeksi mikroorganisme. Pada ikan terdapat populasi sel B dan sel T yang sangat berperan dalam respon imunitas baik seluler maupun humoral (Alifuddin 2002). Respon seluler merupakan respon yang bersifat non spesifik dilakukan oleh cell mediated imunity, sedangkan respon humoral ikan bersifat spesifik dilakukan oleh substansi yang dikenal sebagai antibodi atau imunoglobulin (Anderson 1974; Ellis 1988). Bastiawan (1995) menyatakan bahwa salah satu bahan utama material protektif induk yang diberikan pada keturunannya adalah antibodi.
Menurut Tizard (1982), proses terbentuknya antibodi yang spesifik terjadi karena adanya rangsangan antigen penginfeksi. Bila antigen disuntikkan maka akan dibentuklah antibodi yang dapat bereaksi dengan antigen tersebut. Antibodi biasanya hanya berikatan khusus dengan antigen yang merangsang pembentukannya. Yahya (2000) mengungkapkan bahwa antibodi memiliki 3 fungsi, yaitu menetralisasikan toksin agar tidak lagi bersifat toksik, mengikatkan diri kepada sel-sel musuh, yaitu antigen dan fungsi terakhir adalah membusukkan struktur biologi antigen tersebut lalu menghancurkannya. Antibodi akan terbentuk jika sel limfosit (sel B) telah berfungsi dengan baik.
8
penting, yaitu : 1) Pengenalan musuh yang dihadapi. Dalam hal ini musuh yang dihadapi adalah antigen (mikroorganisme), bisa berupa bakteri ataupun virus, 2) Penghancuran antigen oleh sistem pertahanan, 3) Kembali ke keadaan normal (Roth. 1988).
Respon imun pada ikan terdiri dari respon imun nonspesifik dan spesifik. Sistem imun nonspesifik jumlahnya dapat meningkat oleh karena infeksi, misalnya jumlah leukosit meningkat selama fase akut pada infeksi penyakit. Sistem imun nonspesifik merupakan pertahanan terdepan dalam menghadapi serangan berbagai mikroba dan dapat memberikan respon langsung. Sistem imun nonspesifik resistensinya tidak mengalami perubahan untuk setiap infeksi yang menyerang. Sistem pertahanan spesifik dan nonspesifik pada ikan terdiri dari pertahanan seluler dan humoral. Berbagai bahan dalam sirkulasi seperti komplemen, interferon, CRP dan kolektin berperan dalam pertahanan nonspesifik humoral. Sedangkan fagosit, makrofag dan sel NK berperan dalam sistem imun nonspesifik seluler (Baratawidjaja 2006).
hati. Menurut Anderson (1974), Pada imunitas spesifik seluler, sel T akan mengaktifkan makrofag untuk menghancurkan mikroba atau menghancurkan sel Tc untuk memusnahkan sel terinfeksi.
Ginjal merupakan organ produksi antibodi yang utama, mengandung jaringan hemotopoietik yang kaya akan limfosit dan plasma sel (sel yang memproduksi antibodi), sedangkan timus adalah organ limfoid pertama yang menghasilkan limfosit (Bastiawan 1995). Pada awal kehidupannya, sistem pertahanan ikan yang mulai berfungsi adalah sistem pertahanan non spesifik, sedangkan pertahanan spesifik ikan baru berkembang dan berfungsi dengan baik pada umur beberapa minggu setelah telur menetas (Ellis 1988).
Vaksinasi
Vaksinasi merupakan suatu upaya untuk menimbulkan ketahanan tubuh yang bersifat spesifik dengan jalan pemberian vaksin (Alifuddin 2002). Menurut Tizard (1982), vaksinasi adalah suatu usaha untuk memberikan antigen ke dalam tubuh organisme inang dengan harapan akan terjadi rangsangan kekebalan pada organisme inang sehingga tahan terhadap jasad penginfeksi yang dimasukkan tersebut. Ada beberapa macam vaksin yang biasa digunakan dalam budidaya ikan antara lain vaksin sel utuh, vaksin dari komponen sel dan vaksin DNA. Pemilihan vaksin yang digunakan tergantung pada jenis bakteri yang digunakan, kondisi ikan dan lingkungan. Beberapa hal yang perlu dipertimbangkan dalam pembuatan vaksin seperti antigen yang heterogen, imunitas yang relatif rendah, dan cara aplikasi dilapangan (Pasaribu et al. 1990). Selain itu efikasi vaksin sangat tergantung pada jenis dan kualitas vaksin, teknik pemberian, kondisi ikan dan lingkungan.Dalam hal ini vaksin berfungsi sebagai antigen stimulan untuk memacu sel-sel terspesialisasi untuk memproduksi antibodi dan sel-sel tersebut umumnya adalah limfosit (Anderson 1974).
10
pencegahan efek samping kemoterapeutika, proteksi terhadap serangan penyakit tertentu, keamanan lingkungan budidaya dari bahan kemoterapeutika dan keamanan konsumen dari residu antibiotik.
Secara umum terdapat 2 jenis vaksin, yaitu vaksin mati yang berasal dari patogen yang dimatikan, ekstrak atau bagian-bagiannya. dan vaksin hidup yang berasal dari patogen yang dilemahkan atau diatenuasi. Untuk mencapai sasaran vaksinasi yaitu terbentuknya antibodi spesifik dan kelangsungan hidup yang tinggi maka vaksin harus bersifat antigenik, imunogenik, dan protektif. Sifat-sifat ini menunjukkan bahwa vaksin yang diberikan harus memacu terbentuknya antibodi yang menyebabkan ikan tahan terhadap patogen tertentu. Disamping itu, vaksin harus aman dan tidak boleh menimbulkan tanda-tanda sakit secara spesifik diakibatkan oleh patogen tersebut .
Ada beberapa cara vaksinasi yang dapat dilakukan yaitu dengan cara suntikan, makanan (oral), perendaman dan penyemprotan dengan tekanan tinggi, dimana masing-masing cara memiliki kekurangan dan kelebihan (Ellis 1988; Rukyaniet al. 1993; Supriyadi et al. 1990). Namun cara yang paling umum dan mudah adalah dengan cara suntikan melalui intraperitonial (rongga perut) atau intramuskular (otot punggung). Cara ini sangat efektif dalam menimbulkan antibodi dan tidak memerlukan vaksin dalam jumlah yang banyak untuk pemakaiannya.
Parameter Imunologi
Benda asing (antigen) yang masuk ke dalam tubuh akan direspon langsung oleh tubuh. Respon tanggap kebal tubuh meliputi perubahan tingkah laku ikan, penurunan nafsu makan, aktivitas renang, dan perubahan gambaran darah ikan. Pemeriksaan darah penting artinya untuk meneguhkan diagnosa suatu penyakit. Penyimpangan fisiologis ikan akan menyebabkan komponen-komponen darah juga mengalami perubahan. Perubahan gambaran darah dan kimia darah secara kualitatif maupun kuantitatif dapat menentukan kondisi ikan atau status kesehatannya.
Sel darah putih (leukosit) dalam darah ikan berfungsi untuk membersihkan tubuh dari benda asing, jumlahnya berkisar antara 20.000-150.000 sel/mm3
Fagositosis adalah proses penyerapan dan eliminasi mikroba atau partikel lain oleh sel-sel khusus yang disebut fagosit. Fagosit adalah sel-sel darah putih atau sel-sel yang berasal dari sel-sel darah putih tersebut, yang terdapat di dalam aliran darah. Peningkatan kekebalan tubuh dapat diketahui dari aktivitas sel fagosit dari hemosit. Sel fagositik berfungsi untuk melakukan fagositosis terhadap benda asing yang masuk ke dalam tubuh ikan (Brown 2000).
Vertebrata memiliki mekanisme untuk mengontrol patogen penyebab penyakit. Namun ikan termasuk organisme primitif yang memiliki sistem imun yang sederhana dan berbeda dengan mamalia umumnya. Menurut Anderson (1974), Rijkers (1982), Clem et al. (1985) dan Ellis (1989) respon imun pada ikan terdiri dari respon seluler dan respon humoral. Menurut Corbel (1975) respon humoral merupakan respon spesifik sedangkan respon seluler bersifat non spesifik.
Respon imunitas dibentuk oleh jaringan limfoid pada ikan, jaringan limfoidnya menyatu dengan jaringan myeloid, sehingga dikenal sebagai jaringan limfomyeloid. Menurut Fange (1982), organ limfoid pada ikan teleost adalah GALT yaitu gut associated limfoid tissue. Produk jaringan limfoid adalah sel-sel darah dan respon imunitas baik seluler maupun humoral. Respon pertahanan seluler ikan merupakan respon yang bersifat non spesifik (Anderson, 1974). Respon ini meliputi pertahanan mekanik dan kimiawi (mukus, sisik, kulit dan insang) dan pertahanan seluler (sel makrofag, leukosit seperti monosit, neutrofil, eosinofil dan basofil).
Mekanisme pertahanan tubuh yang sinergis antara pertahanan humoral dan seluler dimungkinkan oleh adanya interleukin, interferon dan sitokin. Anderson (1974) mengemukakan mengenai hubungan interleukin, interferon dan sitokin tersebut berperan sebagai komunikator dan amplikasi dalam mekanisme pertahanan humoral dan seluler ikan.
Menurut Anderson (1974), mekanisme kekebalan non spesifik merupakan kekebalan alamiah (innate immunity) pertahanan inang yang responnya tidak tergantung kontak antigen tertentu. Sedangkan respon kekebalan spesifik
(humoral mediated immunity and cellular mediated immunity) tergantung
12
METODE PENELITIAN
Waktu dan Tempat
Penelitian ini dilakukan pada bulan November 2010 – April 2011. Penelitian dilaksanakan dalam tiga bagian dan dilakukan di Laboratorium Kesehatan Ikan Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor.
Pemeliharaan Ikan Uji
Ikan uji yang digunakan adalah ikan nila BEST Oreochromis niloticus yang berukuran 15 gram sebanyak 20 ekor setiap perlakuan. Ikan yang digunakan diadaptasikan dalam akuarium uji selama 7 hari sebelum dilakukan perlakuan. Ikan ini berasal dari satu sumber dan selama masa karantina diamati gejala klinis, agar ikan bebas dari penyakit.
Persiapan Bakteri Streptococcus agalactiae
Bakteri yang digunakan untuk pembuatan vaksin dan uji tantang, yaitu isolat bakteri S. agalactiae β-hemolitik (N14G) dan S. agalactiae non-hemolitik
(NK1) yang berasal dari ikan nila. Isolat bakteri diperoleh dari koleksi Balai
Riset Budidaya Perikanan Air Tawar (BRBPAT) Sempur Bogor, yang diambil dari ikan yang menunjukkan gejala klinis seperti mata menonjol atau mengkerut, berenang whirling, clear operculum dan warna tubuh menjadi lebih gelap.
Bakteri ditumbuhkan pada media BHI cair pada suhu 29OC- 30OC di
dalam water bath shaker. Keseluruhan bakteri kultur disimpan dalam lemari pendingin pada suhu -800C dalam media BHI cair dengan menambahkan 20%
gliserol steril sebagai stok bakteri.
Sebelum bakteri stok digunakan untuk uji patogenisitas, dilakukan postulat Koch terlebih dahulu sebanyak dua kali. Hal ini bertujuan untuk meningkatkan virulensi dari masing-masing isolat. Stok bakteri yang ada diuji terlebih dahulu untuk melihat keberadaan kontaminan dengan cara pasase yaitu bakteri isolat dikembangbiakkan pada 10 ml media BHI cair selama 24 jam. Setelah itu, masing-masing bakteri diinjeksikan ke 10 ekor ikan sebanyak 0,1 ml dengan
14
kepadatan 106 CFU/ml secara intra peritoneal (i.p). Ikan dipelihara selama 5 hari
dan diamati gejala klinis yang muncul. Ikan yang menunjukkan gejala klinis
S. agalactiae diambil dan diisolasi organ otak, mata dan ginjal di dalam BHIA.
Apabila memberikan hasil yang positif, maka isolat yang baru ini dapat dipastikan bersifat patogen dan dapat digunakan untuk pengujian selanjutnya.
Persiapan Vaksin
Isolat bakteri S. agalactiae tipe β-hemolitik dan non-hemolitik masing – masing diambil satu ose secara terpisah dikultur di dalam 10 ml BHI cair dan diinkubasi pada suhu 29-30OC selama 48 jam dalam water bath shaker. Biakan
bakteri diambil satu ml dimasukkan ke dalam sembilan ml BHI cair, diinkubasi pada suhu 29-30OC selama 48 jam. Setelah itu ke dalam biakan ditambahkan
formalin sebanyak 3% dan diinkubasi selama 24 jam. Untuk pembuatan vaksin biakan bakteri disentrifugasi pada 7.000 rpm selama 30 menit. Larutan
supernatan dan endapan pelet dipisahkan. Supernatan dibuang dan pelet dicuci dua kali dengan PBS. Pelet kemudian ditambahkan PBS hingga larutan mencapai 10 ml. Vaksin yang telah dibuat masing-masing diuji viabilitas dengan cara mengkultur dalam media BHIA, bila tidak ditemukan adanya koloni bakteri yang tumbuh dalam waktu 72 jam maka vaksin tersebut siap digunakan. Vaksin yang digunakan dalam penelitian ini terdiri dari 1) vaksin sel utuh β-hemolitik, 2) vaksin sel utuh non hemolitik dan 3) vaksin bivalen (gabungan dari 50% vaksin sel utuh β-hemolitik dan 50% vaksin sel utuh non-hemolitik).
Pelaksanaan Penelitian
Penelitian ini dibagi menjadi tiga bagian yaitu: Penelitian bagian satu dan dua dengan empat perlakuan dan tiga ulangan, sedangkan bagian tiga dengan lima perlakuan dan tiga ulangan.
Penelitian Bagian Pertama (Vaksin β-hemolitik)
Perlakuan A, ikan tidak divaksin dan tidak diuji tantang (Kontrol -).
Perlakuan B, ikan tidak divaksin tetapi diuji tantang dengan bakteri β-hemolitik (Kontrol +).
Perlakuan C, ikan divaksin dengan β-hemolitik dan diuji tantang dengan bakteri β-hemolitik.
Perlakuan D, ikan divaksin dengan β-hemolitik dan diuji tantang dengan bakteri non-hemolitik.
Penelitian Bagian Kedua (Vaksin non-hemolitik)
Pada penelitian bagian kedua dilakukan pengujian dalam empat perlakuan dan setiap perlakuan diulang tiga kali. Perlakuan yang diujikan adalah :
Perlakuan E, ikan tidak divaksin dan tidak diuji tantang (Kontrol -).
Perlakuan F, ikan tidak divaksin tetapi diuji tantang dengan bakteri non- hemolitik (Kontrol +).
Perlakuan G, ikan divaksin dengan non-hemolitik dan diuji tantang dengan bakteri non-hemolitik.
Perlakuan H, ikan divaksin dengan non-hemolitik dan diuji tantang dengan bakteri β-hemolitik.
Penelitian Bagian Ketiga (Vaksin bivalen / gabungan)
Pada penelitian bagian ketiga dilakukan pengujian dalam lima perlakuan dan setiap perlakuan diulang tiga kali. Perlakuan yang diujikan adalah :
Perlakuan K, ikan tidak divaksin dan tidak diuji tantang (Kontrol -)
Perlakuan L, ikan tidak divaksin tetapi diuji tantang dengan bakteri bivalen (Kontrol +)
Perlakuan M, ikan divaksin dengan bivalen dan diuji tantang dengan bakteri bivalen
Perlakuan N, ikan divaksin dengan bivalen dan diuji tantang dengan bakteri β- hemolitik.
Perlakuan P, ikan divaksin dengan bivalen dan diuji tantang dengan bakteri non-hemolitik.
Parameter yang Diukur
16
kelangsungan hidup relatif, dan gambaran darah yang meliputi total leukosit, aktivitas fagositik dan titer antibodi.
Mortalitas
Perhitungan jumlah ikan yang mati dilakukan pada awal terinfeksi S.
agalactiae sampai akhir penelitian. Tingkat kematian (mortalitas) ikan dihitung
dengan menggunakan rumus berdasarkan Effendie (1979). M = (N0-Nt)/N0 x 100% Keterangan :
M : Mortalitas (%)
N0 : Jumlah ikan yang hidup pada awal pengamatan (ekor) Nt : Jumlah ikan yang hidup pada akhir pengamatan (ekor)
Sedangkan tingkat kelangsungan hidup relatif (relative percent survival/RPS) dihitung pada akhir penelitian dengan menggunakan rumus Ellis (1988).
RPS =
Alat suntik dan tabung eppendorf dibilas antikoagulan Na-sitrat 3,8%. Darah ikan diambil dengan menggunakan syringe yang ditusukkan sampai tulang
vertebrae yang terdapat vena caudalis. Darah didiamkan mengalir secara kapiler
lalu dihisap dengan ditarik secara perlahan. Darah yang telah diambil, dimasukkan ke dalam tabung eppendorf untuk segera diamati gambaran darahnya.
Jumlah sel darah putih (Total leukosit)
Aktivitas Fagositik
Pengukuran aktivitas fagositik dilakukan dengan cara mengikuti Anderson & Siwicki (1993) yaitu, sebanyak 50 µl sampel darah dimasukkan ke dalam eppendorf, ditambahkan 50 µl suspensi Staphylococcus aureus dalam PBS (108
cfu/ml). Sampel darah dihomogenkan dan diinkubasi dalam suhu ruang selama 0 menit. Selanjutnya 5 µl sampel darah dibuat sediaan ulas dan dikering- udarakan, kemudian difiksasi dengan metanol selama 5 menit dan dikeringkan. Sediaan ulas direndam dalam pewarna Giemsa selama 15 menit, kemudian dicuci dengan air mengalir dan dikeringkan dengan tissue. Selanjutnya dihitung jumlah sel yang menunjukkan proses fagositosis dari 100 sel fagosit yang teramati dengan rumus :
Jumlah sel fagosit yang melakukan fagositosis
Aktivitas Fagositik = x 100% Jumlah sel fagosit
Titer antibodi
Pengukuran titer antibodi dilakukan terhadap ikan uji sebelum dan sesudah uji tantang. Darah ikan diambil pada vena caudalis dan ditampung dalam effendorf, kemudian disentrifugasi pada 7.000 rpm selama lima menit. Setelah serum terpisah dari sel darah, serum dipisahkan dan diinkubasi pada suhu 44oC selama 20 menit untuk menginaktifasi komplemen. Serum dapat disimpan dalam refrigerator pada suhu 4oC untuk pengamatan titer antibodi. Pengukuran titer
antibodi dilakukan dengan meneteskan larutan PBS sebanyak 25 μl pada masing-masing lubang mikroplate dari lubang 1 sampai 12, selanjutnya dimasukkan serum darah pada lubang 1 sebanyak 25 μl, dilakukan pengadukan kemudian pengenceran bertingkat hingga lubang ke- 11. Bakteri sebanyak 25 μl dimasukan ke dalam lubang 1 sampai 12, campuran dihomogenkan dengan cara menggoyang mikroplate secara perlahan. Selanjutnya disimpan selama 2 jam dalam inkubator pada suhu 37oC, kemudian disimpan dalam refrigerator suhu 4oC semalaman.
18
bereaksi spesifik dengan antigen membentuk senyawa kompleks berupa endapan (presipitat) dan gumpalan (aglutinat).
Analisis Data
HASIL DAN PEMBAHASAN
Penelitian Bagian Pertama (Vaksin β-hemolitik)
Vaksinasi dilakukan untuk meningkatkan kekebalan spesifik ikan nila untuk mencegah infeksi S. agalactiae. Dari hasil pengamatan beberapa parameter imunitas ikan diketahui bahwa vaksinasi dengan menggunakan vaksin sel utuh β-hemolitik meningkatkan imunitas baik spesifik maupun non spesifik ikan nila.
Mortalitas
Ikan diuji tantang dengan S. agalactiae pada hari ke-10 setelah vaksinasi (hari ke-0) setelah uji tantang. Pada Gambar 1 dan Tabel 2 terlihat bahwa perlakuan C yaitu ikan diberi vaksin sel utuh S. agalactiae tipe β-hemolitik dan diuji tantang dengan bakteri β-hemolitik menunjukkan mortalitas yang rendah yaitu 30%, perlakuan D yang divaksinasi dengan vaksin sel utuh S. agalactiae non-hemolitik menunjukkan mortalitas 45%. Sedangkan perlakuan B (kontrol +) yaitu ikan tidak divaksinasi tetapi diuji tantang dengan bakteri β-hemolitik menunjukkan mortalitas ikan yang sangat tinggi yaitu 90%. Perbedaan perlakuan yang diberikan berpengaruh terhadap mortalitas yang terjadi.
Gambar 1. Mortalitas ikan nila yang divaksinasi dengan vaksin S. agalactiae tipe β-hemolitik.
Kontrol (-) Kontrol (+) Bakteri β-hemolitik Bakteri non-hemolitik
20
Berdasarkan hasil analisis variansi antar perlakuan menunjukkan perbedaan yang nyata (p<0.05) dan dari uji Duncan antar semua perlakuan berbeda nyata (lampiran 2). Berdasarkan Tabel 2 terlihat bahwa perlakuan C, yaitu ikan divaksin dengan S. agalactiae tipe β-hemolitik dan diuji tantang dengan bakteri β-hemolitik memberikan tingkat kelangsungan hidup relatif (RPS) 67%, kemudian disusul perlakuan D (RPS 50%). Vaksinasi yang dilakukan menggunakan vaksin sel utuh β-hemolitik, setelah 14 hari pasca uji tantang menggunakan bakteri sel utuh β-hemolitik dan nonhemolitik ternyata mampu mencegah infeksi dari kedua tipe bakteri. Ini menandakan bahwa vaksin dari tipe β-hemolitik mampu meningkatkan respon imun spesifik dan saat bakteri S.
agalactiae menginfeksi, antibodi tertentu aktif untuk mengeliminir bakteri
patogen. Hal tersebut disebabkan karena permukaan sel bakteri tipe β-hemolitik lebih banyak tersusun atas protein yang bersifat imunomodulator yang meningkatkan sistem imun baik spesifik maupun non spesifik.
Tabel 2. Tingkat RPS, dan mortalitas ikan nila yang divaksin dengan S. agalactiae tipe β-hemolitik Vaksin sel utuh dari β-hemolitik memberikan proteksi yang lebih baik saat ikan terinfeksi dengan S. agalactiae yang bertipe sama dengan vaksin yang diberikan. Menurut Ellis (1988), suatu vaksin dikatakan efektif apabila nilai RPS pada saat pengujian efikasi vaksin memiliki nilai > 50%
Gambaran darah
Keberhasilan vaksinasi dapat dilihat dari nilai RPS yang dihasilkan. Namun untuk menjawab mengapa terjadi keberhasilan maupun kegagalan dari vaksinasi dapat dilihat dari beberapa parameter pendukung seperti total leukosit, aktivitas fagositik dan titer antibodi.
Perubahan pada parameter pendukung efikasi vaksinasi menggunakan vaksin β-hemolitik dijabarkan pada Tabel 3, dan grafik secara lengkap dijabarkan pada Lampiran 5.
Total leukosit
Berdasarkan Tabel 3 terlihat bahwa total leukosit sebagai respon seluler, pertahanan non spesifik juga mengalami peningkatan pasca uji tantang dengan bakteri tipe β-hemolitik. Respon kekebalan spesifik tergantung kontak inang dengan antigen tertentu sebelumnya. Fungsi sistem kekebalan non spesifik juga terlibat dalam sistem kekebalan spesifik.
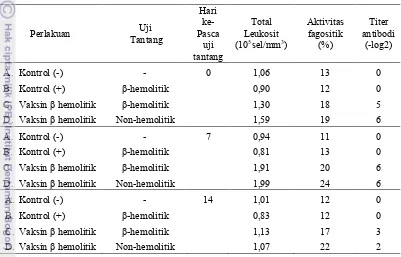
Peningkatan total leukosit terlihat pada hari ke-0 pasca uji tantang pada perlakuan C (1,30) dan D (1,59). Pada hari ke-7 pasca uji tantang terjadi perbedaan total leukosit yang sangat mencolok antara perlakuan yang divaksinasi perlakuan C (1,91) dan D (1,99) dengan vaksin sel utuh S. agalactiae tipe β-hemolitik dengan yang tidak divaksinasi yaitu perlakuan A(0,94) dan B (0,81). Perbedaan masih terjadi setelah hari ke-14 infeksi, dimana total leukosit perlakuan ikan yang divaksin mengalami penurunan sedangkan perlakuan A dan B (kontrol – dan +) masih relatif stabil. Hal ini diduga saat ada infeksi, total leukosit meningkat untuk memfagosit bakteri setelah 7 hari pasca infeksi, bakteri berhasil difagosit dan tidak mampu untuk tumbuh dan berkembang sehingga ikan banyak yang hidup. Lain halnya dengan ikan kontrol yang tidak divaksin, tidak terdapat peningkatan total leukosit ikan yang terinfeksi sehingga mortalitas mencapai 90% karena ikan tidak mampu menghalangi berkembangnya S. agalactiae.
Menurut Spector (1993) antibodi adalah protein yang dihasilkan sebagai akibat dimasukkannya zat yang dikenal sebagai benda asing yang dikenal sebagai antigen. Beberapa karbohidrat dan lipid juga antigenik baik dalam keadaan murni maupun jika dikombinasikan dengan molekul protein. Jadi apabila kekurangan limfosit maka konsentrasi antibodi juga akan menurun.
Aktivitas fagositik
Aktivitas sel pada kekebalan non spesifik jika antigen masuk ke dalam tubuh ikan yaitu mempertahankan diri dengan menghancurkan antigen melalui proses fagositosis yang dilakukan oleh sel-sel fagositik monosit dan neutrofil.
22
bakteri penyebab infeksi. Peningkatan aktivitas fagositik terjadi karena vaksin yang diberikan dari sel utuh β-hemolitik ternyata mampu meningkatkan komponen respon imunitas non spesifik.
Pada fagositosis, antigen dideteksi tanpa pengenalan terlebih dahulu melalui reseptor spesifik, ini merupakan mekanisme bawaan sebelum terjadinya aktivitas sel limfosit-T spesifik maupun terbentuknya antibodi. Menurut Hardi 2011, sel fagosit menghancurkan antigen melalui tiga tahap yaitu: (1) pelekatan, (2) fagosit dan (3) pencernaan.
Proses fagosit terjadi apabila berada dalam jarak dekat dengan antigen. Antigen harus melekat pada permukaan sel fagosit, sehingga fagosit bergerak menuju sasaran. Mekanisme tersebut terjadi karena dilepaskannya zat/mediator tertentu yang disebut faktor leukotaktik/kemotaktik dari antigen/komplemen. Hal ini disebabkan karena antigen terlebih dahulu dilapisi oleh Ig atau komplemen (opsonisasi), agar lebih mudah ditangkap oleh sel fagosit. Patogen masuk ke dalam sel dengan cara endositosis dan oleh proses pembentukan fagosom, patogen terperangkap dalam kantong fagosom seolah-olah ditelan untuk dihancurkan, baik dalam proses oksidasi-reduksi maupun oleh derajat keasaman yang ada dalam fagosit (Anderson 1974).
Meningkatnya aktivitas fagositosis merupakan indikator peningkatan kekebalan tubuh. Brown (2000) menyatakan bahwa peningkatan kekebalan tubuh dapat diketahui dari peningkatan aktivitas sel fagosit dari hemosit. Antibodi adalah suatu molekul immunoglobulin yang spesifik yang diproduksi oleh sistem kekebalan organisme karena pengaruh antigen (Anderson 1974). Yahya (2000) mengungkapkan bahwa antibodi memiliki tiga fungsi, yaitu menetralisasikan toksin agar tidak lagi bersifat toksik, mengikatkan diri kepada sel-sel musuh, yaitu antigen dan fungsi terakhir adalah membusukkan struktur biologi antigen tersebut lalu menghancurkannya. Antibodi akan terbentuk jika sel limfosit (sel B) telah berfungsi dengan baik.
Proses fagositosis diawali oleh fase pergerakan (kemotaktik), perlekatan
(adhesi/attachment), penelanan (ingestion), degranulasi & pembunuhan (killing).
berada di lokasi antigen. Proses penempelan hingga penghancuran dilakukan oleh sel-sel fagosit seperti monosit dan neutrofil (Roth, 1988).
Proses penelanan bakteri terjadi karena fagosit membentuk tonjolan pseudopodia, membentuk kantung mengelilingi bakteri sehingga terperangkap dalam vakuola fagosom. Fagosom terdiri atas dinding bagian luar fagosit. Granula intraseluler berisi berbagai jenis enzim dan protein lain yang mampu membunuh, bergabung (fusi) dengan fagosom, terjadi degranulasi dan respiratory burst (Roth, 1988):
Sel makrofag dan netrofil memiliki mekanisme pertahanan non spesifik melalui proses kemotaksis dan pinositosis. Kemotaksis adalah sel fagosit dipancing oleh molekul untuk melakukan migrasi ke lokasi terjadinya inflamasi, kerusakan jaringan atau reaksi antigen-antibodi (immune reactions). Molekul atau induktor kemotaksis dihasilkan patogen atau komponen kekebalan tubuh seperti faktor komplemen. Pinositosis mekanismenya mirip fagositosis, tetapi melalui proses pemasukan partikel (antigen) yang berukuran jauh lebih kecil daripada yang dilakukan pada proses fagositosis. Fenomena ini ditandai oleh proses pembukaan membran sel membentuk lubang (vakuola) kecil melalui proses endositosis (Roth 1988).
Titer antibodi
24
Pada Tabel 3 terlihat bahwa perlakuan C dan D dimana ikan divaksinasi dengan vaksin sel utuh S. agalactiae tipe β-hemolitik mampu memproduksi antibodi saat diuji tantang dengan bakteri tipe β-hemolitik dan non-hemolitik sejak hari ke-0 setelah uji tantang yaitu perlakuan C (5) dan D (6). Berbeda dengan pelakuan A dan B (kontrol – dan +) dimana titer antibodinya tidak terdeteksi mulai dari hari ke-0 sampai hari ke-14 setelah diuji tantang dengan bakteri β-hemolitik maupun yang diuji dengan bakteri non-hemolitik. Titer tertinggi dicapai ikan rata-rata pada hari ke-7 pasca uji tantang. Hal ini menunjukkan bahwa berbagai jenis vaksin yang diberikan mampu membantu tubuh untuk mengeliminasi patogen yang menginfeksi meskipun bakteri yang menginfeksi berbeda tipe dengan jenis bakteri yang dijadikan vaksin.
Titer antibodi tertinggi dihasilkan oleh perlakuan C dan D yaitu masing-masing 6, dimana ikan yang divaksinasi oleh vaksin sel utuh S. agalactiae tipe β-hemolitik dan diuji tantang baik dengan bakteri β-β-hemolitik maupun bakteri non-hemolitik pada hari ke-7 pasca uji tantang. Menurut Subowo (1993) protein merupakan makromolekul yang imunogen yang dapat merangsang limfosit untuk menghasilkan antibodi. Protein dengan berat molekul lebih besar dari 10 kDa biasanya imunogenik. Walaupun demikian, Almendras (2001) menyatakan bahwa hanya daerah-daerah permukaan tertentu dari molekul itu (epitop) yang menentukan spesifisitas reaksi antigen antibodi dan juga sebagai - penentu timbulnya respon imun. Di samping itu, protein dengan berat molekul yang besar diduga mempunyai jumlah epitop yang banyak. Ikan yang divaksin tetap mampu memproduksi antibodi saat diuji aglutinasi dengan bakteri tipe β-hemolitik dan non-hemolitik pada hari ke-14 pasca uji tantang. Pada akhir pengamatan masih ditemukan adanya antibodi yang terbentuk pada ikan yang divaksinasi namun mulai menurun, hal ini menunjukkan bahwa berbagai jenis vaksin yang diberikan mampu membantu tubuh untuk mengeliminasi patogen yang menginfeksi meskipun bakteri yang menginfeksi berbeda tipe dengan jenis bakteri yang dijadikan vaksin.
komplemen dan fagosit. Antibodi juga dapat menetralisir tantangan secara langsung dengan melilit toksin bakteri atau dengan mengganggu reseptor yang digunakan virus dan bakteri untuk menginfeksi sel (Anderson, 1974; Kresno, 1996).
Tabel 3. Total leukosit, aktivitas fagositik, dan titer antibodi setelah vaksinasi vaksin β-hemolitik pada hari ke-0, 7 dan 14 pasca uji tantang.
Penelitian Bagian Kedua (Vaksin non-hemolitik)
Dari hasil pengamatan beberapa parameter imunitas ikan diketahui bahwa vaksinasi dengan menggunakan vaksin sel utuh non-hemolitik juga memberikan proteksi terhadap infeksi S. agalactiae. Hal tersebut disebabkan karena dinding
sel S. agalactiae tipe non-hemolitik lebih banyak tersusun atas karbohidrat,
walaupun karbohidrat kurang bersifat imunomodulator atau kurang dapat
meningkatkan imunitas ikan secara baik dibandingkan protein.
Mortalitas
Pada Gambar 2 dan Tabel 4 terlihat tingkat kematian (mortalitas) ikan nila yang divaksinasi dengan sel utuh S. agalactiae tipe non-hemolitik. Mortalitas tertinggi 95% pada perlakuan F (kontrol +) yaitu ikan tidak divaksinasi dengan vaksin sel utuh S. agalactiae tipe non-hemolitik tetapi diuji tantang dengan bakteri
S. agalactiae non hemolitik. Sedangkan perlakuan G dan H divaksinasi dengan
26
vaksin sel utuh S. agalactiae tipe non hemolitik dan masing-masing diuji tantang dengan bakteri non hemolitik dan bakteri β-hemolitik menunjukkan mortalitas yang sama yaitu 35%
Gambar 2 Mortalitas ikan nila yang divaksinasi dengan Streptococcus
agalactiae tipe non-hemolitik.
Berdasarkan hasil analisis variansi (Lampiran 3) menunjukkan perbedaan yang nyata antar perlakuan (p<0.05) dan dari uji Duncan antar semua perlakuan berbeda nyata, kecuali antara perlakuan G (vaksin non-hemolitik) diuji tantang dengan bakteri non-hemolitik berbeda tidak nyata dengan perlakuan H (vaksin non-hemolitik) diuji tantang dengan bakteri β-hemolitik.
Nilai RPS yang dihasilkan pada vaksinasi dengan menggunakan beberapa jenis vaksin terlihat pada Tabel 4. Dari tabel tersebut tampak bahwa kematian ikan tetap terjadi pasca uji tantang, dan jumlah kematian ikan yang tidak divaksin dengan sel utuh S. agalactiae tipe non hemolitik (perlakuan F) lebih banyak yaitu 95%, jika dibandingkan dengan ikan yang divaksin menggunakan sel utuh S.
agalactiae tipe non-hemolitik (perlakuan G dan H).
Tabel 4. Tingkat RPS, dan mortalitas ikan nila yang divaksin dengan S. agalactiae tipe non-hemolitik
Perlakuan Uji Tantang Mortalitas (%) RPS (%)
E. Kontrol (-) - 10 -
F. Kontrol (+) Non-hemolitik 95 -
G. Vaksin non-hemolitik Non-hemolitik 35 63 H. Vaksin non-hemolitik β-hemolitik 35 63
0
Vaksin sel utuh S. agalactiae tipe non-hemolitik, sama seperti vaksin sel utuh β-hemolitik, juga memberikan proteksi yang baik pada infeksi dari S.
agalactiae yang setipe dengan vaksin maupun yang tidak setipe. Berdasarkan
tingkat kematian yang terjadi dapat dilihat bahwa perbedaan jenis vaksin yang diberikan berpengaruh terhadap tingkat ketahanan tubuh.
Vaksin dari sel utuh S. agalactiae tipe non-hemolitik memiliki RPS 63% saat diuji tantang dengan bakteri S. agalactiae tipe non-hemolitik dan 63% saat diuji tantang dengan S. agalactiae tipe β-hemolitik. Artinya vaksin sel utuh dari non-hemolitik memberikan proteksi yang sama baik saat ikan terinfeksi dengan S.
agalactiae yang bertipe sama dan bertipe tidak sama dengan vaksin yang
diberikan.
Gambaran darah
Keberhasilan vaksinasi dapat dilihat dari nilai RPS yang dihasilkan. Namun untuk menjawab mengapa terjadi keberhasilan maupun kegagalan dari vaksinasi dapat dilihat dari beberapa parameter pendukung seperti total leukosit, aktivitas fagositik dan titer antibodi.
Perubahan pada parameter pendukung efikasi vaksinasi menggunakan vaksin non-hemolitik dijabarkan pada Tabel 5 dan grafik secara lengkap dijabarkan pada Lampiran 6.
Total leukosit
Total leukosit sebagai respon seluler pertahanan non spesifik juga mengalami peningkatan pasca vaksinasi dengan bakteri tipe non-hemolitik. Respon kekebalan spesifik tergantung kontak inang dengan antigen tertentu sebelumnya. Fungsi sistem kekebalan non spesifik juga terlibat dalam sistem kekebalan spesifik.
28
perlakuan vaksin mengalami penurunan. Hal ini didukung oleh Martin et al. (2004) bahwa ikan yang tidak terinfeksi lagi bakteri maka total leukosit kembali seperti semula. Lain halnya dengan perlakuan F yang tidak divaksinasi, tidak terdapat peningkatan total leukosit ikan yang terinfeksi bakteri sehingga 90% ikan mati karena tidak mampu menghalangi berkembangnya S. agalactiae dalam tubuhnya.
Aktivitas fagositik
Aktivitas sel fagositik pada kekebalan non spesifik jika antigen masuk ke dalam tubuh ikan yaitu mempertahankan diri dengan menghancurkan antigen melalui proses fagositosis yang dilakukan oleh sel-sel fagositik monosit dan neutrofil.
Setelah vaksinasi, aktivitas fagositik mengalami peningkatan pada hari ke-0 setelah uji tantang. Aktivitas fagositik mengalami peningkatan pada perlakuan G dan H masing-masing 18 sedangkan perlakuan F hanya 13. Proses ini membantu tubuh untuk menghancurkan bakteri penyebab infeksi. Peningkatan aktivitas fagositik terjadi karena vaksin sel utuh S. agalactiae tipe non hemolitik yang diberikan ternyata mampu meningkatkan komponen respon non spesifik.
mudah ditangkap oleh sel fagosit. Patogen masuk ke dalam sel dengan cara endositosis dan oleh proses pembentukan fagosom, patogen terperangkap dalam kantong fagosom seolah-olah ditelan untuk dihancurkan, baik dalam proses oksidasi-reduksi maupun oleh derajat keasaman yang ada dalam fagosit (Anderson, 1974).
Proses fagositosis diawali oleh fase pergerakan (kemotaktik), perlekatan
(adhesi/attachment), penelanan (ingestion), degranulasi & pembunuhan (killing).
Inisiasi pergerakan karena dilepaskannya zat mediator tertentu yaitu faktor leukotaktik/kemotaktik dari antigen/neutrofil makrofag yang sebelumnya telah berada di lokasi antigen. Proses penempelan hingga penghancuran dilakukan oleh sel-sel fagosit seperti monosit dan neutrofil.
Titer antibodi
Berdasarkan pengamatan titer antibodi didapatkan hasil seperti tercantum dalam Tabel 5 dan Lampiran 6. Pengamatan perlakuan titer antibodi dilakukan pada hari ke- 0, 7 dan ke-14 setelah uji tantang. Pada hari ke-0 sudah terlihat adanya peningkatan titer antibodi ikan pada perlakuan G (4) dan H (5). Titer antibodi tertinggi dicapai ikan pada hari ke-7 pasca uji tantang yaitu perlakuan G dan H masing-masing 5. Sedangkan pada perlakuan F (kontrol +) tidak terdeteksi (0), dan pada hari ke-14 setelah uji tantang, titer antibodi mulai menurun. Hasil titer antibodi terlihat bahwa ikan mampu memproduksi antibodi saat diuji aglutinasi dengan bakteri tipe β-hemolitik dan non hemolitik sejak hari ke-0 pasca uji tantang. Perlakuan G yang divaksinasi dengan vaksin sel utuh S.
agalactiae tipe non-hemolitik dan diuji tantang dengan bakteri non hemolitik
30
Menurut Subowo (1993) protein merupakan makromolekul yang imunogen yang dapat merangsang limfosit untuk menghasilkan antibodi. Protein dengan berat molekul lebih besar dari 10 kDa biasanya imunogenik. Walaupun demikian, Almendras (2001) menyatakan bahwa hanya daerah-daerah permukaan tertentu dari molekul itu (epitop) yang menentukan spesifisitas reaksi antigen antibodi dan juga sebagai - penentu timbulnya respon imun. Di samping itu, protein dengan berat molekul yang besar diduga mempunyai jumlah epitop yang banyak. Ikan yang divaksin tetap mampu memproduksi antibodi saat diuji aglutinasi dengan bakteri tipe non-hemolitik dan β-hemolitik pada hari ke-24 pasca vaksinasi. Pada akhir pengamatan masih ditemukan adanya antibodi yang terbentuk pada perlakuan yang divaksinasi, ini menunjukkan bahwa berbagai jenis vaksin yang diberikan mampu membantu tubuh untuk mengeliminasi patogen yang menginfeksi meskipun bakteri yang menginfeksi berbeda tipe dengan jenis bakteri yang dijadikan vaksin.
Tabel 5 Total leukosit, aktivitas fagositik, dan titer antibodi setelah vaksinasi dengan vaksin non-hemolitik pada hari ke-0, 7 dan 14 pasca uji tantang
Perlakuan Uji Tantang
G.Vaksin non hemolitik Non-hemolitik 1,16 18 4
H.Vaksin non hemolitik β-hemolitik 1,32 18 5
E.Kontrol (-) - 7 0,94 9 0
F.Kontrol (+) Non-hemolitik 0,98 16 0
G.Vaksin non hemolitik Non-hemolitik 1,81 20 5
HVaksin non hemolitik β-hemolitik 1,52 24 5
E.Kontrol (-) - 14 1,01 8 0
F.Kontrol (+) Non-hemolitik 0,82 14 0
G.Vaksin non hemolitik Non-hemolitik 1,07 21 2
Penelitian Bagian Ketiga (Vaksin bivalen/gabungan)
Berdasarkan hasil pengamatan beberapa parameter imunitas ikan diketahui bahwa vaksinasi dengan menggunakan vaksin bivalen yaitu gabungan sel utuh β-hemolitik dan non-hemolitik memberikan proteksi yang sangat baik
terhadap infeksi S. agalactiae. Hal tersebut disebabkan karena dinding sel
S. agalactiae tipe β-hemolitik lebih banyak tersusun atas protein dan S. agalactiae
tipe non-hemolitik lebih banyak tersusun atas karbohidrat, sehingga perpaduan kedua tipe vaksin dari bakteri tipe β-hemolitik dan non-hemolitik tersebut dapat meningkatkan imunitas ikan secara baik dibandingkan yang diberikan secara terpisah dan tunggal.
Mortalitas
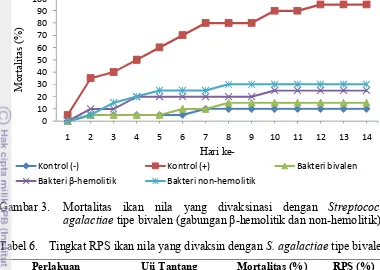
Pada Gambar 3 dan Tabel 6 terlihat bahwa mortalitas tertinggi pada ikan kontrol positif (perlakuan L) yang tidak divaksinasi tetapi diuji tantang dengan
S. agalactiae tipe bivalen (gabungan β-hemolitik dan non-hemolitik) yaitu 95%.
Sedangkan perlakuan yang paling rendah mortalitasnya adalah perlakuan M (15%) yang disusul perlakuan N (25%) dan P (30%) yang divaksinasi dengan vaksin bivalen dan masing-masing diuji tantang berturut-turut dengan bakteri bivalen, bakteri β-hemolitik dan bakteri non-hemolitik. Hal ini sesuai dengan pendapat Hardi (2011) bahwa bakteri tipe non-hemolitik lebih virulen dibandingkan dengan tipe β-hemolitik dilihat dari jumlah kematian yang lebih cepat dan banyak, perubahan pola renang, pola makan dan patologi anatomi secara makro dan mikroskopis.
32
Gambar 3. Mortalitas ikan nila yang divaksinasi dengan Streptococcus
agalactiae tipe bivalen (gabungan β-hemolitik dan non-hemolitik).
Tabel 6. Tingkat RPS ikan nila yang divaksin dengan S. agalactiae tipe bivalen
Perlakuan Uji Tantang Mortalitas (%) RPS (%)
Berdasarkan Tabel 6 terlihat bahwa perlakuan M, dimana ikan divaksin bivalen dan diuji tantang dengan bakteri bivalen memiliki RPS 84%, disusul perlakuan N 78% dan perlakuan P, 64%. Perlakuan vaksin terbaik adalah vaksin bivalen/gabungan. Artinya penggunaan vaksin dari tipe β-hemolitik dan non-hemolitik secara terpisah kurang memberikan proteksi terhadap infeksi S.
agalactiae tidak sebaik vaksin dari tipe β-hemolitik dan non-hemolitik yang
diberikan secara gabungan.
Lambatnya peningkatan respon imunitas pada ikan yang divaksinasi dengan sel utuh β-hemolitik atau non-hemolitik maupun gabungan keduanya dari
S. agalactiae diduga disebabkan karena kapsul yang menyelubungi sel bakteri.
setipe dengan tipe bakteri vaksin yang diberikan (specific biotype protection). Dari Tabel 6 terlihat adanya specific biotype protection, bahwa vaksin dari tipe bivalen memberikan proteksi lebih baik pada infeksi S. agalactiae tipe bivalen (gabungan antara β-hemolitik dan non-hemolitik).
Gambaran darah
Nilai RPS yang dihasilkan pada vaksinasi dengan menggunakan vaksin bivalen terlihat pada Tabel 6 bahwa kematian ikan tetap terjadi pasca vaksinasi. Jumlah kematian ikan yang divaksin lebih sedikit jika dibandingkan dengan ikan yang tidak divaksin menggunakan S. agalactiae tipe β hemolitik dan non hemolitik secara sendiri-sendiri dan tunggal.
Total leukosit
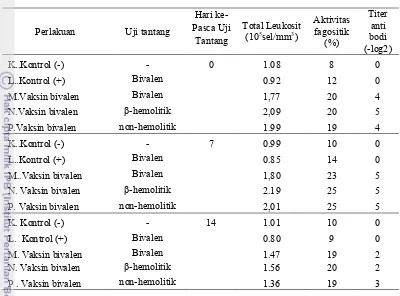
Bedasarkan Tabel 7 terlihat bahwa total leukosit sebagai respon seluler pertahanan non spesifik mengalami peningkatan pasca vaksinasi dengan bakteri bivalen (gabungan tipe β-hemolitik dan non-hemolitik). Peningkatan total leukosit terjadi pada hari ke-0 setelah uji tantang, disemua perlakuan vaksin yaitu M(1,77), N(2,09) dan P(1,99). Tidak seperti pada perlakuan L (kontrol +) yang tidak divaksin, tetapi diuji tantang dengan bakteri bivalen. Perlakuan L(0,92) tidak mengalami peningkatan total leukosit sehingga 95% ikan mati karena tidak mampu menghalangi berkembangnya S. agalactiae dalam tubuh. Hal ini diduga saat ada infeksi total leukosit menurun drastis sehingga tidak dapat memfagosit bakteri infeksi dan setelah 7 hari pasca infeksi, bakteri mampu untuk tumbuh dan berkembang sehingga ikan banyak yang mati. Sedangkan pada perlakuan M, N, dan P yang diberi vaksinasi, diduga saat ada infeksi total leukositnya meningkat, sehingga dapat memfagosit bakteri infeksi dan bakteri tidak mampu tumbuh dan berkembang sehingga ikan banyak yang hidup.
Memasuki hari ke-7 pasca uji tantang total leukosit mengalami peningkatan pesat yaitu perlakuan M (1,80) N (2,19)dan P (2,01) dan pada perlakuan L (0,85) tidak mengalami peningkatan bahkan terjadi penurunan. Pada hari ke-14 pasca uji tantang total leukosit mengalami penurunan, ini menandakan bahwa infeksi bakteri mulai berkurang dan juga leukosit berada dalam jaringan yang terinfeksi untuk memfagosit bakteri. Dengan meningkatnya total leukosit