KISARAN INANG Zucchini yellow mosaic virus ISOLAT
KABOCA HIJAU (Cucurbita pepo L.)
TITAH NURJANNAH
DEPARTEMEN PROTEKSI TANAMAN
FAKULTAS PERTANIAN
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa skripsi berjudul Kisaran Inang Zucchini yellow mosaic virus Isolat Kaboca Hijau (Cucurbita pepo L.) adalah benar karya saya dengan arahan dari pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Februari 2015
Titah Nurjannah
ABSTRAK
TITAH NURJANNAH. Kisaran Inang Zucchini yellow mosaic virus Isolat Kaboca Hijau (Cucurbita pepo L.). Dibimbing oleh TRI ASMIRA DAMAYANTI.
Zucchini yellow mosaic virus (ZYMV) memiliki arti penting secara ekonomi karena menurunkan produksi Cucurbitaceae. Gejala yang muncul akibat infeksi ZYMV pada tanaman adalah mosaik kuning, nekrosis, malformasi,
blistering, dan pengurangan ukuran lamina. Sifat biologi ZYMV isolat kaboca hijau belum banyak diketahui di Indonesia. Sehingga, penelitian ini bertujuan mengetahui sifat biologi khususnya kisaran inang ZYMV isolat kaboca hijau. Uji kisaran inang dilakukan dengan cara menginokulasi ZYMV secara mekanis pada 18 spesies tanaman dari 5 famili. Peubah yang diamati yaitu masa inkubasi, tipe gejala dan insidensi penyakit. Deteksi serologi inokulum dan tanaman uji tidak bergejala dengan Dot immunobinding assays (DIBA) menggunakan antiserum ZYMV. Insidensi penyakit mosaik di lapangan pada beberapa lokasi pertanaman yaitu Bogor (Ciawi, Cikabayan, Cipanas), dan Bandung (Cikole, Cibogo) antara 7.1% hingga 54.1%. ZYMV isolat kaboca hijau dapat menginfeksi sistemik semangka, melon, timun, kaboca merah, pare dan labu siam (Cucurbitaceae) dan
Nicotiana benthamiana (Solanaceae). ZYMV menginfeksi lokal bunga kenop (Amaranthaceae), Chenopodium amaranticolor dan Chenopodium quinoa
(Chenopodiaceae). Namun, ZYMV tidak menginfeksi oyong (Cucurbitaceae), buncis dan kacang panjang (Leguminosae) dan cabai, tomat, ciplukan, tembakau, dan kecubung (Solanaceae).
ABSTRACT
TITAH NURJANNAH. Host Range of Zucchini yellow mosaic virus Pumpkin (Cucurbita pepo L.) Isolate. Supervised by TRI ASMIRA DAMAYANTI.
Zucchini yellow mosaic virus (ZYMV) is an important virus economically since it caused Cucurbitaceae yield loss significantly. Symptom on infected plants is yellow mosaic, necrosis, malformation, blistering and reduce lamina size. The biological character of ZYMV pumpkin isolate is still limited known in Indonesia. Thus, the aim of the research is to study the biological characters of ZYMV pumpkin isolate particularly its host range. Host range of ZYMV tested by mechanical inoculation of 18 species from 5 families. Serological detection of inoculum and symptomless tested plants conducted by dot immunobinding assay (DIBA) using ZYMV antiserum. The disease incidence of mosaic symptoms at cultivation areas in Bogor (Ciawi, Cikabayan, Cipanas), and Bandung (Cikole, Cibogo) ranged from 7.1% to 54.1%. ZYMV pumpkin isolate could infect sistemically on Citrullus lanatus, Cucumis melo, Cucumis sativus, Cucurbita pepo, Momordica charantia, Sechium edule (Cucurbitaceae) and symptomless on
Nicotiana benthamiana. The pumpkin isolate was locally infect Gomphrena globosa (Amaranthaceae), Chenopodium amaranticolor and Chenopodium quinoa
(Chenopodiaceae). However, ZYMV could not infect Luffa acutangula
(Cucurbitaceae), Phaseolus vulgaris and Vigna sinensis (Leguminosae) and
Capsicum annuum, Lycopersicon esculentum, Nicotiana tabacum, Datura stramonium, and Physalis floridiana (Solanaceae).
KISARAN INANG Zucchini yellow mosaic virus ISOLAT
KABOCA HIJAU (Cucurbita pepo L.)
TITAH NURJANNAH
Skripsi
Sebagai salah satu syarat memperoleh gelar Sarjana Pertanian
pada
Departemen Proteksi Tanaman
Judul Skripsi : Kisaran Inang Zucchini yellow mosaic virus Isolat Kaboca Hijau (Cucurbita pepo L.)
Nama : Titah Nurjannah NIM : A34100043
Disetujui oleh
Dr. Ir. Tri Asmira Damayanti, M.Agr. Dosen Pembimbing
Diketahui oleh
Dr. Ir. Abdjad Asih Nawangsih, M.Si. Ketua Departemen Proteksi Tanaman
PRAKATA
Penulis panjatkan puji syukur kepada Allah subhanahu wa ta’ala atas rahmat dan hidayah-Nya sehingga skripsi yang berjudul “Kisaran Inang Zucchini yellow mosaic virus Isolat Kaboca Hijau (Cucurbita pepoL.)” dapat diselesaikan
sebagai syarat untuk memperoleh gelar Sarjana Pertanian, di Departemen Proteksi Tanaman, Institut Pertanian Bogor.
Ucapan terima-kasih penulis sampaikan kepada Ibunda Ernawati dan Ayahanda Suprih Edhi serta adik atas doa dan semangat yang diberikan selama penyelesaian tugas akhir. Terima kasih sebesar-besarnya penulis ucapkan kepada Dr Ir Tri Asmira Damayanti MAgr selaku dosen pembimbing yang telah memberikan arahan dan saran selama pelaksanaan penelitian hingga penulisan skripsi, serta Dr Ir Ali Nurmansyah MSi selaku dosen pembimbing akademik yang telah memberi bimbingan dan saran selama masa studi. Terima-kasih penulis ucapkan pula pada Dr Ir I Wayan Winasa MSi selaku dosen penguji tamu atas saran dan masukannya.
Terima-kasih juga kepada Egi Puspita Sari, Siti Nurul Benowati, Endah Wahyuni, Rian Andini, Suci Addmas Kalasyank dan Rizky Marcheria Ardiyanti yang telah membantu penulis selama proses penelitian. Terima-kasih pula kepada Sari Nurulita SP MSi, Susanti Mugi Lestari SP, seluruh anggota laboratorium Virologi Tumbuhan dan teman-teman Proteksi Tanaman angkatan 47.
Bogor, Februari 2015
DAFTAR ISI
PENDAHULUAN 1
Latar Belakang 1
Tujuan Penelitian 2
Manfaat Penelitian 2
BAHAN DAN METODE 3
Tempat dan Waktu Penelitian 3
Metode 3
Lokasi pengambilan Sampel Tanaman Sakit 3
Pengambilan Sampel 3
Deteksi Sumber Inokulum ZYMV 3
Inokulasi Mekanis 3
Penanaman dan Pemeliharaan Tanaman Uji 4
Peubah Pengamatan 5
Deteksi Virus dengan Dot Immunobinding Assay (DIBA) 5
HASIL DAN PEMBAHASAN 6
Pengamatan Kejadian Penyakit 6
Sumber Inokulum Virus 7
Kisaran Inang 8
SIMPULAN 14
SARAN 14
DAFTAR PUSTAKA 15
DAFTAR TABEL
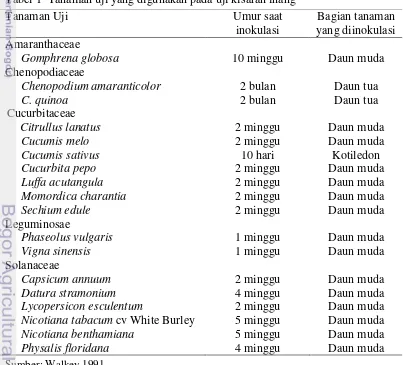
1 Tanaman uji yang digunakan pada uji kisaran inang 4
2 Hasil pengamatan kejadian penyakit mosaik pada lokasi yang berbeda 6 3 Hasil deteksi serologi inokulum dari beberapa lokasi 7 4 Hasil penularan mekanis ZYMV isolat labu kuning pada 18 spesies
tanaman uji 8
DAFTAR GAMBAR
1 Gejala tanaman kaboca hijau positif ZYMV yang ditemukan pada dua lokasi berbeda. a,b,c: Cikabayan, d: Cikole 6
2 Sumber sumber inokulum kaboca hijau 7
3 Gejala tanaman kaboca hijau setelah diinokulasi ZYMV secara mekanis. a:vein clearing, b: mosaik hijau-kuning dan malformasi daun, c: tanaman
sehat 7
4 Gejala hasil penularan mekanis pada G. globosa. a: tanaman sehat, b: lesio lokal nekrosis, c: lesio lokal nekrosis berat 10 5 Gejala hasil penularan mekanis pada C. amaranticolor. a: tanaman sehat,
b: lesio lokal klorosis ringan, c: lesio lokal nekrosis berat dengan halo merah kecoklatan.Gejala hasil penularan mekanis pada C. quinoa d: tanaman sehat, e: lesio lokal klorosis ringan, f: lesio lokal klorosis berat 10 6 Gejala hasil penularan mekanis pada (a-c) semangka, (d-f) melon, (g-i)
timun. a,d,g: tanaman sehat, b: mosaik hijau gelap-terang ringan, c: mosaik dan malformasi daun, e: vein clearing diikuti dengan lepuhan berukuran kecil, f: daun menguning dan terdapat lepuhan berwarna hijau, h: mosaik hijau gelap-terang ringan, i: mosaik hijau gelap-terang berat
diikuti dengan malformasi daun 11
7 Gejala hasil penularan mekanis pada (a-c) kaboca merah, (d-f) pare, (g-i) labu siam. a,d,g: tanaman sehat, b: vein clearing, c: vein clearing
diikuti dengan mosaik hijau terang berat, e: mosaik hijau terang ringan, f: mosaik hijau terang berat, h: mosaik hijau gelap-terang ringan, i: mosaik hijau gelap-gelap-terang ringan dan terdapat
lepuhan-lepuhan pada daun 12
8 Tanaman tidak menunjukkan gejala (a,b) oyong, (c,d) buncis, (e,f) kacang panjang, (g,h) cabe, (i,j) kecubung, (k,l) tomat, (m,n) tembakau, (o,p) ciplukan. a,c,e,g,i,k,m,o: tanaman kontrol, b,d,f,h,j,l,n,p: daun yang
PENDAHULUAN
Latar Belakang
Kaboca hijau (Cucurbita pepo L.) merupakan salah satu anggota famili Cucurbitaceae yang penting secara ekonomi di seluruh dunia. Kaboca hijau yang berasal dari Mexico, bentuknya mirip labu Indonesia dengan warna kulit hijau atau oranye dan daging buah berwarna kuning. Kaboca hijau bermanfaat sebagai bahan konsumsi dan obat kesehatan (Nee 1990).
C. pepo banyak dibudidayakan di Indonesia. Ada lebih dari 20 virus yang dapat menginfeksi tanaman C. pepo (Desbiez dan Lecoq 1997). Virus yang umum menginfeksi pertanaman Cucurbitaceae adalah Cucumber mosaic virus (CMV),
Cucumber green mottle mosaic virus (CGMMV), Squash mosaic virus (SqMV),
Zucchini yellow mozaic virus (ZYMV), dan Watermelon mosaic virus (WMV) (Ali dan Osama 2012).
ZYMV diisolasi pertama kali di Italia tahun 1973, dideskripsikan pada tahun 1981, dan kemudian diidentifikasi keseluruhan komponen genomnya. ZYMV merupakan virus penting yang menyerang tanaman Cucurbitaceae di seluruh dunia dan memiliki pengaruh penting pada tanaman Cucurbitaceae karena menurunkan hasil secara ekonomi (Lin et al. 2000; Simmons et al. 2011). Kerugian infeksi tergantung pada waktu infeksi, dan dapat mengakibatkan kerugian hasil mencapai 100% (Babadoost 2012). Gejala yang ditimbulkan ZYMV pada daun tanaman adalah mosaik dengan klorosis yang dominan, nekrosis, pengurangan ukuran lamina daun, malformasi dan blistering (Zitter et al. 1998). Pada buah labu dan squash, infeksi ZYMV menyebabkan perubahan warna dan benjol-benjol yang menyebabkan perubahan bentuk buah (Providenti 1996; Tobias et al 2003; Coutts 2006).
ZYMV secara umum ditularkan melalui dua cara yaitu secara horisontal melalui vektor kutudaun, dan secara vertikal melalui transmisi dari benih generasi pertama yang terinfeksi ZYMV ke generasi selanjutnya (Simmons et al. 2011; Tobias et al. 2003). Beberapa spesies kutudaun merupakan vektor ZYMV yang menularkan virus secara non persisten seperti A. gossypii, Myzus persicae (Coutts 2006), Asyrthosiphon pisum, A. kondoi, Aphis craccivora, A. citricola, A. middletonii, A. spiraecola, Macrosiphum euphorbiae, Toxoptera aurantii, dan
Uroleucon ambrosiae (Providenti 1996). ZYMV juga dapat ditularkan secara mekanik dengan mudah melalui alat-alat pemotong yang telah terkontaminasi virus tersebut (Providenti 1996; Zitter et al. 1998).
2
Kisaran inang merupakan salah satu cara identifikasi untuk mengetahui sifat biologi suatu virus (Hull 2002). Tanaman uji kisaran inang yang biasa digunakan dalam uji kisaran inang ZYMV yaitu, Gomphrena globosa L.,
Chenopodium amaranticolor Coste et Reyn, C. quinoa L., Citrullus lanatus,
Cucumis melo L., Cucumis sativus L., Luffa acutangula, Momordica charantia,
Sechium edule, Phaseolus vulgaris L., Vigna sinensis, Capsicum annuum, Datura stramonium, Lycopersicon esculentum, Nicotiana tabacum L. cv. White barley,
N. benthamiana, Physalis floridana. (Jaroszewska et al. 2013; Dukic et al 2002). Menurut Aulia (2005) pertanaman oyong dan labu siam di Kotamadya Bogor terdeteksi terinfeksi ZYMV berturut-turut dengan insidensi penyakit (IP) antara 16.161% sampai dengan 60.3% dan 6.1% sampai dengan 8.9%. Namun sampai saat ini belum dilakukan identifikasi lengkap terkait sifat biologi (gejala, kisaran inang, penularan), sifat fisik sifat protein dan asam nukleat untuk ZYMV isolat Indonesia.
Tujuan
Tujuan penelitian ini adalah mengetahui salah satu sifat biologi ZYMV isolat kaboca hijau (Cucurbita pepo L.) khususnya kisaran inang.
Manfaat Penelitian
3
BAHAN DAN METODE
Tempat dan Waktu Penelitian
Penelitian akan dilakukan di Laboratorium Virologi Tumbuhan, Departemen Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian Bogor, dari bulan Februari sampai dengan November 2014.
Metode Lokasi Pengambilan Sampel Tanaman Sakit
Sampel daun tanaman kaboca hijau (Cucurbita pepo L.) sakit diambil dari desa Ciawi, Cibanteng, Cikabayan, Cipanas, Kabupaten Bogor serta desa Cikole dan Cibogo Kecamatan Lembang, Bandung.
Pengambilan Sampel
Daun kaboca hijau diambil yang menunjukkan gejala terserang virus dengan gejala kombinasi dari pemucatan tulang daun, mosaik dan malformasi daun. Sampel yang didapat disimpan pada suhu -80 oC untuk dideteksi menggunakan metode DIBA.
Inokulasi Mekanis
Sebanyak 0.2 gram daun digerus dalam bufer fosfat yang mengandung 1%
β-merkaptoetanol dengan perbandingan 1:10 (b/v). Inokulasi dilakukan pada daun pertama yang telah membuka lebar yang telah ditaburi dengan karborundum (600 mesh) dengan cara mengoleskan sap tanaman sakit pada permukaan daun. Setelah inokulasi, bagian tanaman yang diinokulasi tersebut dibilas dengan air mengalir (Bos 1990).
Perbanyakan Inokulum ZYMV
Perbanyakan dilakukan sebelum dideteksi dengan salah satu tujuan untuk membebaskan virus yang hanya dapat ditularkan oleh serangga pada daun yang bergejala di lapangan. ZYMV diperbanyak pada tanaman kaboca hijau (Cucurbita pepo L.) pada 10 tanaman yang diinokulasikan secara mekanis. Cairan perasan tanaman ditularkan pada tanaman kaboca hijau yang berumur 1 minggu setelah tanam. Tanaman yang telah diinokulasi dipelihara sampai gejala muncul.
Deteksi Sumber Inokulum
4
Penanaman dan Pemeliharaan Tanaman Uji
Tanaman yang digunakan untuk kisaran inang yaitu bunga kenop (Gomphrena globosa L.), Chenopodium amaranticolor Coste et Reyn, C. quinoa
L., semangka (Citrullus lanatus), melon (Cucumis melo L.), timun (Cucumis sativus L.), kaboca merah (Cucurbita pepo), oyong (Luffa acutangula), pare (Momordica charantia), labu siam (Sechium edule), buncis (Phaseolus vulgaris
L.), kacang panjang (Vigna sinensis), cabai(Capsicum annum), kecubung (Datura stramonium), tomat (Lycopersicon esculentum), tembakau (Nicotiana tabacum L. cv. White Burley), N. benthamiana, dan ciplukan (Physalis floridana). Masing-masing benih ditanam sebanyak 10 tanaman sebagai ulangan.
Media tanam disiapkan yaitu berupa campuran tanah steril dan pupuk kandang (1:1). Polybag berukuran 35cm x 35cm diisi dengan media sebanyak ¾ bagian. Benih ditanam pada kedalaman 3cm. Tiap polybag ditanam sebanyak 3 benih. Setelah 1 MST dipilih tanaman yang pertumbuhannya baik. Pupuk NPK 15:15:15 diberikan 1 minggu setelah inokulasi (Mayasari 2006). Penyiraman dilakukan setiap pagi hari. Penyiraman diberikan sesuai kebutuhan tanaman dan memenuhi standar waktu, cara, dan jumlah yang tepat. Bagian tanaman yang diinokulasi sesuai dengan umur tanaman yang dianjurkan oleh Walkey (1991) (Tabel 1).
Tabel 1 Tanaman uji yang digunakan pada uji kisaran inang
Tanaman Uji Umur saat
inokulasi
Bagian tanaman yang diinokulasi Amaranthaceae
Gomphrena globosa 10 minggu Daun muda Chenopodiaceae
Chenopodium amaranticolor 2 bulan Daun tua
C. quinoa 2 bulan Daun tua
Cucurbitaceae
Citrullus lanatus 2 minggu Daun muda
Cucumis melo 2 minggu Daun muda
Cucumis sativus 10 hari Kotiledon
Cucurbita pepo 2 minggu Daun muda
Luffa acutangula 2 minggu Daun muda
Momordica charantia 2 minggu Daun muda
Sechium edule 2 minggu Daun muda
Leguminosae
Phaseolus vulgaris 1 minggu Daun muda
Vigna sinensis 1 minggu Daun muda
Solanaceae
Capsicum annuum 2 minggu Daun muda
Datura stramonium 4 minggu Daun muda
Lycopersicon esculentum 2 minggu Daun muda
5
Peubah Pengamatan
Pengamatan dilakukan terhadap masa inkubasi, insidensi penyakit dan tipe gejala. Insidensi penyakit untuk setiap spesies tanaman uji dihitung dengan menggunakan rumus sebagai berikut:
% Insidensi penyakit = Jumlah tanaman terserang (n)
Jumlah tanaman yang diamati (N)
Deteksi Virus dengan Dot Immunobinding Assay (DIBA)
Deteksi serologi dengan DIBA dilakukan untuk mendeteksi sumber inokulum dan tanaman uji kisaran inang yang tidak menunjukkan gejala (untuk mengkonfirmasi insidensi penyakit. DIBA dilakukan berdasarkan metode yang digunakan Asniwita (2012). Masing-masing sampel digerus dalam tris buffer saline (TBS) (TBS: Tris-HCl 0.02 M dan NaCl 0.15 M, pH 7.5) dengan perbandingan 1:10 (b:v). Sap tanaman diteteskan ke atas membran nitrocelulose
sebanyak 2 µl. Setelah tetesan sap kering, membran direndam di dalam larutan
blocking (non fat milk 2% dalam TBS yang mengandung 2% Triton X-100). Membran kemudian diinkubasi pada suhu ruang sambil digoyang dengan kecepatan 50 rpm selama 1 jam dengan menggunakan EYELA multi shaker.
Membran kemudian dicuci 5 kali dengan dH2O, tiap pencucian berlangsung
5 menit sambil digoyang dengan kecepatan 100 rpm. Membran selanjutnya direndam dalam TBS yang mengandung non fat milk 2% dan antiserum pertama ZYMV (1:5000) kemudian membran diinkubasi semalam pada suhu 4 oC.
Membran kemudian dicuci sebanyak 5 kali dengan TBST (TBS yang mengandung Tween-20 0.05%). Tiap pencucian berlangsung 5 menit. Membran selanjutnya direndam dalam TBS yang mengandung antiserum kedua (1:5000) dan non fat milk 2%. Kemudian membran diinkubasi selama 60 menit pada suhu ruang sambil digoyang dengan shaker pada kecepatan 50 rpm.
Membran selanjutnya dicuci kembali dengan TBST sebanyak 5 kali dan direndam selama 5 menit dalam bufer AP (Tris-HCl 0.1 M, NaCl 0.1 M, MgCl2 5
mM pH 9.5) yang mengandung NBT (75 mg/ml) dan BCIP (50 mg/ml) (NBT dan BCIP digunakan sesuai kebutuhan tergantung ukuran membran, dengan pedoman dalam 10 ml bufer AP digunakan sebanyak 45 µl NBT dan 35 µl BCIP). Bila reaksi positif akan terjadi perubahan warna putih menjadi ungu pada membran
nitrocelulose yang telah ditetesi sap. Reaksi dihentikan dengan merendam membran dalam dH2O setelah terjadi perubahan warna menjadi ungu.
6
HASIL DAN PEMBAHASAN
Pengamatan Insidensi Penyakit
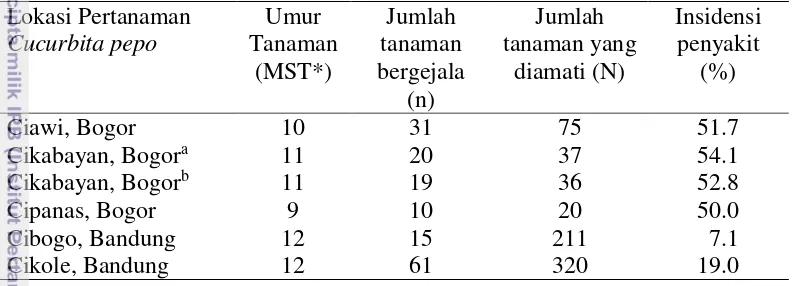
Pengamatan insidensi penyakit mosaik yang diduga disebabkan oleh ZYMV dilakukan pada beberapa lokasi, diantaranya: Desa Cibogo dan Desa Cikole, Kecamatan Lembang, Bandung serta Desa Ciawi, Cikabayan, dan Cipanas, Bogor. Insidensi penyakit yang ditemukan pada tiga lokasi yaitu berkisar 7.1% hingga 54.1% (Tabel 2).
Tabel 2 Hasil pengamatan insidensi penyakit mosaik pada lokasi yang berbeda Lokasi Pertanaman
*) MST: minggu setelah tanam, aCucurbita pepo cv Suprema, bCucurbita moschata (butternut)
Gejala yang ditunjukkan pada beberapa lokasi beragam. Gejala pada labu kuning di Ciawi dan Cipanas, Bogor, berbeda. Tanaman dari Ciawi menunjukkan gejala berupa pemucatan tulang daun (vein clearing) dan mosaik hijau-kuning. Sedangkan tanaman sampel di Cipanas ditemukan gejala vein clearing, mosaik hijau-kuning berat dan malformasi daun. Pada lokasi Cikabayan gejala labu kuning (Cucurbita pepo cv Suprema) dan butternut berupa vein clearing, mosaik hijau-kuning dan malformasi daun. Berbeda dengan gejala pada kaboca merah tanaman sampel dari Cibogo, Bandung, yaitu mosaik hijau gelap-terang ringan. Sedangkan pada kaboca hijau di Cikole, Bandung, gejala berupa daun dominan berwarna klorosis atau hijau terang dan terdapat lepuhan seperti cacar berwarna hijau tua. Beragam gejala yang ditunjukkan dari beberapa lokasi dideteksi dan beberapa gejala yang menunjukkan hanya positif ZYMV (Gambar 1).
7
Sumber Inokulum Virus
Hasil deteksi sumber inokulum dari berbagai lokasi inokulum berasal dari Desa Cibanteng, Desa Cikabayan dan Desa Cikole didapatkan hasil positif ZYMV dan negatif CMV dan SqMV (Tabel 3).
Tabel 3 Hasil deteksi serologi inokulum dari beberapa lokasi
Asal Inokulum Deteksi Serologi
*deteksi menggunakan DIBA dan RT-PCR, aCucurbita pepo cv Suprema,
bCucurbita moschata (butternut)
Gejala suber inokulum dari desa Cibanteng berupa mosaik hijau-kuning (Gambar 1a). Inokulum diperbanyak di rumah kaca pada tanaman kaboca hijau menunjukkan gejala pada 5 hari setelah inokulasi. Gejala diawali dengan adanya
vein clearing (Gambar 2a), gejala lanjut berupa mosaik hijau-kuning dan malformasi daun (Gambar 2b). Selanjutnya, sebagai sumber inokulum untuk uji kisaran inang digunakan ZYMV dari desa Cibanteng, Bogor.
a b c
e d
8
Kisaran inang
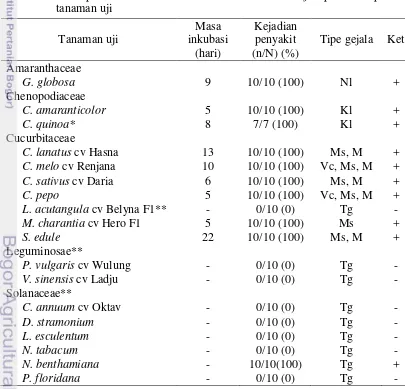
Hasil penularan secara mekanis ZYMV isolat kaboca hijau menunjukkan sebanyak 10 spesies tanaman dari 3 famili berbeda yaitu Amaranthaceae, Chenopodiaceae dan Cucurbitaceae dapat diinfeksi oleh ZYMV (Tabel 4).
9
Ket: n : Jumlah tanaman bergejala M : Malformasi N : Total tanaman yang diinokulasi Vc : Vein clearing
Ms : Mosaik sistemik (+) : positif terinfeksi ZYMV (DIBA) Kl : Klorosis lokal (-) : negatif terinfeksi ZYMV (DIBA) Nl : Nekrosis lokal (*) : 3 tanaman mati karena damping off Tg : Tanpa gejala (**) : Insidensi penyakit dikonfirmasi
dengan DIBA
Hasil uji kisaran inang menunjukkan bahwa rata-rata masa inkubasi tanaman inang selama 9 hari. Masa inkubasi paling singkat terjadi pada tanaman kaboca merah dengan masa inkubasi selama 5 hari, sedangkan masa inkubasi paling lama ditunjukkan pada tanaman labu siam yaitu selama 22 hari. Menurut Walkey (1991), masa inkubasi dan tipe gejala yang muncul pada tanaman dapat dipengaruhi oleh faktor inang, konsentrasi virus dan faktor lingkungan. Berdasarkan pernyataan tersebut diduga perbedaan masa inkubasi disebabkan faktor inang dan faktor lingkungan.
Gejala yang ditimbulkan pada masing-masing tanaman uji sangat beragam. Variasi gejala infeksi virus dapat terjadi tergantung pada faktor strain virus, varietas tanaman, lingkungan, dan mekanisme infeksi campuran virus (Agrios 2005). Gejala yang timbul pada bunga kenop berupa bercak nekrosis hanya pada daun yang diinokulasi (lesio lokal). Bercak nekrosis tersebut berawal berukuran lingkaran kecil (Gambar 3b) kemudian gejala berlanjut dengan melebarnya daerah nekrosis (Gambar 3c).
Gejala yang timbul pada famili Chenopodiaceae berupa lesio lokal klorosis. Pada tanaman C. amaranticolor gejala diawali dengan munculnya bintik-bintik klorosis (Gambar 4b) kemudian gejala berlanjut dengan adanya titik nekrotik pada bagian tengah bintik klorosis dan disertai munculnya halo berwarna merah kecoklatan di sekeliling bintik nekrotik (Gambar 4c). Pada tanaman C. quinoa
gejala diawali adanya bintik klorosis (Gambar 4e) kemudian gejala berlanjut dengan melebarnya daerah klorosis (Gambar 4f).
10
benthamiana menunjukkan tanpa gejala (gejala laten), namun positif terinfeksi ZYMV (Gambar 6j-k).
Tanaman yang tidak menunjukkan gejala adalah oyong (Cucurbitaceae) (Gambar 7b), Leguminosae (Gambar 7d,f), dan Solanaceae (Gambar 7h,j,l,n,p,r). ZYMV isolat timun dilaporkan tidak menginfeksi oyong (Lesemann et al. 1983). ZYMV isolat labu juga dilaporkan tidak menginfeksi L. cylindrica (Dukic et al.
11
Gambar 3 Gejala hasil penularan mekanis pada G. globosa. a: tanaman sehat, b: lesio lokal nekrosis, c: lesio lokal nekrosis berat.
Gambar 4 Gejala hasil penularan mekanis pada C. amaranticolor. a: tanaman sehat, b: lesio lokal klorosis ringan, c: lesio lokal nekrosis berat dengan halo merah kecoklatan.Gejala hasil penularan mekanis pada
12
13
14
17
SIMPULAN
ZYMV isolat kaboca hijau dapat menimbulkan gejala sistemik pada tanaman semangka, melon, timun, kaboca merah, pare, labu siam dan N. benthamiana, dan menimbulkan gejala lokal tanaman G. globosa, C. amaranticolor dan C. quinoa. ZYMV tidak dapat menimbulkan gejala oyong, buncis, kacang panjang, cabai, tomat, tembakau, ciplukan dan kecubung.
SARAN
DAFTAR PUSTAKA
Agrios GN. 2005. Plant Pathology. 5th edition. New York (US): Elsevier Academic Press.
Ali A, Osama A. 2012. Occurence of viruses infecting watermelon, other cucurbits, and weeds in the parts of Southern United States [Internet]. Oklahoma (US): Department of Biological Sciences; [diunduh 2014 April 11]. Doi: 10.1094/PHP-2012-0824-01-RS.
Aulia R. 2005. Inventarisasi dan deteksi virus penyebab penyakit mosaik pada famili Cucurbitaceae di Kotamadya Bogor, Pasir Muncung, dan Cibodas [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Asniwita, Hidayat SH, Suastika G, Sujiprihati S, Susanto S, Hayati I. 2012. Eksplorasi isolat lemah Chili veinal mottle virus pada tanaman cabai di Jambi, Sumatra Barat dan Jawa Barat. Jurnal Hortikultura 22(2):181-186. Babadoost M. 2012. Viral diseases of cucurbits [Internet]. Champaign (US):
Department of Crop Sciences; [diunduh 2015 Februari 3]. http:// extension.cropsci.illinois.edu/fruitveg/pdfs/949_viral_diseases.pdf.
Bos L. 1990. Pengantar Virologi Tumbuhan. Triharso, penerjemah. Yogyakarta (ID): Gadjah Mada University Press. Terjemahan dari: Introduction to Plant Virology.
Coutts B. 2006. Virus disease of cucurbit crops [Internet]. Sidney (AU): Department of Agriculture; [diunduh 2014 Agustus 28]. Tersedia pada:http://www.agric.wa.gov.au/objtwr/imported_assets/content/hort/veg/p w/fn2006_viruscucurbits_bcoutts.pdf.
[CPC] Crop Protection Compendium. 2005. Crop Protection Global Module. Edisi 2005. Wallingford (GB): CABI.
Dezbiez C, Lecoq H. 1997. Zucchini Yellow Mosaic Virus. Plant Pathology
46(1):809-829.
Dukic N, Branka K, Ivana V, Nikolaos K, Chryssa P, Berenji J. 2002. Biological and serological characterization of viruses of summer squash crops in Yugoslavia. Agricultural Sciences 47(2):149-160.
Hull R. 2002. Plant Virology. 4th edition. California (US): Academic Press. Jaroszewska BH, Natalia R, Natasha B, Henryk P. 2013. Biological and molecular
characterization of the polish Zucchini yellow mosaic virus isolates. Acta Sciences 12(2):75-85.
Lasemann DE, Makkouk KM, Koenig R, Natafji SE. 1983. Natural infection of cucumbers by Zucchini yellow mosaic virus in Lebanon.
Phytopathologische Zeitschrift 108(1):13-304.
Lecoq H, Desbiez C, Wipf-Scheibel C, Girard M. 2003. Potential involvement of melon fruit in the long distance dissemination of cucurbit potyviruses. Plant Diseases 87(1):955-959.
17
Nee M. 1990. The domestication of Cucurbita (Cucurbitaceae). Economic Botany. 44(3): 56-68.
Providenti R, Gonsalves D, Humaydan HS. 1984. Occurence of Zucchini yellow mosaic virus in cucurbits from Connecticut, Florida, and California. Plant Diseases 68(1):443-446.
Providenti R. 1996. Diseases Caused by Viruses. Di dalam: Zitter TA, Hopkins DL, Thomas CE editor. Compendium of Cucurbit Diseases. New York (US): APS Press.
Simmons HE, Holmes EC, Gildow FE, Bothe-Goralczyk MA, Stephenson AG. 2011. Experimental verification of seed transmission of Zucchini yellow mosaic virus. Plant Diseases 95(1):751-754.
Sumarni, E. 2002. Kisaran Inang dan Uji Serologi Virus Penyebab Mosaik Kuning pada Tanaman Kaboca [Skripsi]. Bogor (ID): Institut Pertanian Bogor.
Tobias I, Palkovics L. 2003. Characterization of Hungarian isolates of Zucchini yellow mosaic virus (ZYMV, potyvirus) transmitted by seeds of Cucurbita pepo var. styriaca. Pest Management Sciences 59(1):493-497.
Walkey DSA. 1991. Applied Plant Virology. Second Edition. London (GB): Chapman and Hall.
RIWAYAT HIDUP
Penulis merupakan anak pertama dari dua bersaudara dari pasangan Bapak Suprih Edhi dan Ibu Ernawati yang dilahirkan pada tanggal 23 Februari 1993 di Pangkalan Bun, Kalimantan Tengah.
Penulis menyelesaikan pendidikan sekolah dasar di SDN Raja 1 Pangkalan Bun (2004), sekolah menengah pertama di SMP Negeri 1 Arut Selatan (2007), dan sekolah menengah atas di SMA Negeri 1 Pangkalan Bun (2010), serta diterima di Institut Pertanian Bogor pada Departemen Proteksi Tanaman pada tanggal 28 Juni 2010 melalui jalur USMI (Undangan Seleksi Masuk IPB).