1. PENDAHULUAN
1.1. Latar Belakang
Saribuah nenas rnerupakan salah satu produk khas buah tropika yang berpotensi untuk rnendukung Pernbangunan Ekonomi Nasional rnelalui peningkatan pendapatan sektor nonrnigas. Hodgson dan Hodgson (1 993) melaporkan bahwa total perdagangan saribuah nenas d i dunia rnencapai US$ 3,8 rnilyar, d i mana Arnerika Serikat (USA) sebagai irnportir terbesar senilai US$ 174 juta per tahun.
Menurut Hodgson dan Hodgsan (1 9 9 3 ) pula, Thailand, Filipina dan Australia adalah eksportir utarna saribuah nenas, masing-masing tahun 1991 rnemproduksi 86, 5 4 dan 44 juta ton. Indonesia dilaporkan belurn sebagai pengekspor saribuah nenas, tetapi dinya- takan berpotensi besar sebagai pengekspor berdasarkan dukungan alam dan iklirnnya. Hal ini didukung oleh data produksi buah nenas lndonesia yang pada tahun 1 9 9 2 rnencapai 376,3 ribu t o n (BPS, 1994). Ekspor nenas kalengan dalam sepuluh tahun terakhir rneningkat rata-rata 26 persen (Haryanto dan Hendarto, 1996), dengan nilai ekspor tahun 1 9 9 5 sebesar US$ 60 juta (BPS, 1996).
produk tersebut, selain berbeda dalam ha1 kornposisi bahannya, saribuah nenas juga bersifat lebih asam dengan p H 3,7 (Mehrlich dan Felton, 1980).
Optimasi dan pengembangan proses memerlukan informasi model dan parameter kinetika, khususnya yang berkaitan dengan bahan yang
-
diproses maupun proses yang digunakan. lnformasi kinetika berrnanfaat untuk pembuatan model optirnasi dan perencanaan proses (Lenz dan Lund, 1980). Optirnasi proses dengan program linier selarna ini dilakukan dengan basis pendekatan model Bigelow, sehingga terjadi bias jika perubahan m u t m y a tidak mengikuti model kinetika orde kesatu. Untuk menghindari kelernahan tersebut perlu dibuat terobosan baru yang memungkinkan optimasi proses yang dapat menampung berbagai model kinetika perubahan mutu. Metoda optimasi proses berbasis kinetika reaksi kimia dengan pendekatan Arrhenius diduga dapat rnenampung model-model tersebut.
digunakan sebagai salah satu dasar untuk optirnasi proses aseptik saribuah nenas dengan rnenekan sekecil mungkin destruksi asam askorbat rnaupun peningkatan kecoklatannya.
Proses aseptik pada bahan pangan berasam tinggi dengan HTST pada dasarnya dirancang untuk inaktivasi bakteri toleran asarn, kapang dan kharnir (Cousin dan Rodriguez, 1 9 8 7 ) . Datam kondisi anaerob produk aseptik dengan Aw dan keasarnan tinggi, bakteri berpeluang lebih besar rnerusak saribuah nenas dibandingkan kapang dan kharnir. Lactobacillus sp. merupakan bakteri toleran asarn yang diternukan dalam buah nenas (Hodgson dan Hodgson, 1 9 9 3 ) , marnpu hidup pada p H
3,5-4,O
(Parish dan Higgins, 1 9 8 8 ) , dan terrnasuk golongan bakteri mikroaerofiiik sampai anaerobik. Dalarn saribuah nenas bakteri tersebut dapat rnenyebabkan kerusakan flavor, tekstur dan penarnpakan saribuah. Selama ini, Lactobacillus sp. telah digunakan sebagai indikator dalarn pasteurisasi saribuah jeruk dan konsentratnya, karena peranan bakteri tersebut yang marnpu hidup dan rnerusak saribuah jeruk.(Nagy, etal., 1 9 7 7 ) .Proses aseptik saribuah nenas diharapkan dapat rnernpertahankan rnutu saribuah nenas di sarnping rnenjamin keamanannya dengan menginaktivasi rnikroba dan enzirn yang tidak dikehendaki. Proses aseptik dapat mernperkecil kerusakan m u t u yang lazim terjadi dalam proses konvensional, walaupun rnasih dimungkinkan terjadi kerusakan rnutu akibat proses suhu tinggi (Sadler, 1 9 8 7 ) .
tetapi jarang yang mengungkap perubahan mutu saribuah dalam proses aseptiknya sehingga optimasi proses relatif sulit dilakukan karena keterbatasan data kinetika. Dalam penelitian ini dipelajari kinetika perubahan mutu saribuah nenas, yang meliputi perubahan indeks kecoklatan, kadar asam askorbat dan inaktivasi enzim pektinesterase.
Kecoklatan akibat pemanasan suhu tinggi sebagian besar disebabkan karena terjadi degradasi gula, yang ditandai dengan adanya produk antara lain seperti hidroksimetilfurfuraI (HMF) dan furfural (Sadler, 1987). Oleh karena itu dalam penelitian ini juga diteliti mengenai perubahan gula dan HMF serta furfural dalam saribuah nenas.
Proses aseptik pada dasarnya merupakan suatu proses yang bersifat kontinu, oleh karena itu sifat reologi yang berupa viskositas dan perilaku aliran berpengaruh terhadap kecepatan aliran bahan dan pendugaan waktu proses (Lund, 1987). Penggunaan suhu tinggi dalam proses tersebut diduga mempengaruhi viskositas, indeks perilaku dan sifat aliran saribuah nenas dalam proses aseptik, sehingga penting untuk diteliti.
1.2. Tujuan Penelitian
Adapun tujuan khusus penelitian ini adalah untuk mempelajari: a. Reologi saribuah nenas pada suhu tinggi, yang berupa viskositas, indeks perilaku dan sifat alirannya, serta penggunaannya dalam rancangan proses aseptik saribuah nenas.
b. Pengaruh w a k t u proses aseptik terhadap kadar gula, HMF dan furfural saribuah nenas.
c. Kinetika perubahan mutu fisiko-kimia saribuah nenas dalarn proses aseptik yang mencakup:
1. Kinetika perubahan kadar asam askorbat.
2.
Kinetika perubahan warna saribuah nenas yang diukur dengan indeks kecoklatannya.--
d. Kinetika inaktivasi enzim pektinesterase saribuah nenas dalam proses aseptik.
e. Mengembangkan metode formulasi model perubahan mutu dan evaluasi kondisi optimum yang dapat digunakan untuk optimasi dengan program linier.
f. Mengembangkan rnetode optimasi proses dengan program linier berbasis model kinetika perubahan mutu dengan pendekatan Arrhenius, untuk memperoleh suhu dan waktu optimum proses
2. TINJAUAN PUSTAKA
2.1. Saribuah Nenas
2.1.1. Sifat Umum dan Pembuatan Saribuah
Nenas terrnasuk kategori tanarnan tropis yang sangat cocok dikembangkan di Indonesia (Pracaya, 1985). Daerah-daerah berpo- tensi untuk produksi nenas terutarna adalah wilayah Jawa Barat, Sumatra Bagian Selatan dan Tengah, dan Jawa Tirnur (BPS, 1994).
Kualitas buah nenas tergantung antara lain dari varietas, nutrisi, kontak dengan cahaya, intensitax cahaya, fluktuasi suhu lingkungan, kernatangan dan penyakit (Mehrlich dan Felton, 1980). Kornposisi kimia buah nenas pada urnurnnya adalah air 80-85 persen, kandungan gula 12-1 5 persen (dua pertiganya adalah sukrosa, sisanya glukosa dan fruktosa), protein 0,4 persen, 0,6 persen asam, 0,l persen lernak, dan sisanya berupa serat dan berbagai jenis vitamin (Samson, 1980).
atau pengepresan. Sebutan saribuah tanpa keterangan apapun berarti SS (single strength) yang mempunyai total padatan terlarut antara delapan sampai 1 5 "Brix (Hodgson dan Hodgson, 1993).
2.1.2.
Mutu dan Kearnanan SaribuahM u t u didefinisikan sebagai kelompok sifat atau faktor yang membedakan tingkat pemuas atau aseptabilitas dari suatu komoditas bagi pembeli atau konsumen (Kramer 1966; Soekarto, 1990). Komoditas saribuah nenas yang diperdagangkan harus memenuhi persyaratan m u t u atau standar yang ditetapkan. Codex Alimentarus Commission FAOIWHO ( 1 9 9 6 ) telah merekomendasikan standar mutu saribuah nenas (tampiran 1 ), yang mensyaratkan saribuah nenas mempunyai total padatan terlarut minimal 1 0 "Brix dengan warna, flavor dan penampakan umum tidak menyimpang dari keadaan umum saribuah nenas yang biasa dikenal orang.
Warna, flavor dan penampakan saribuah nenas pada umumnya ditentukan secara subyektif, dan merupakan bagian pokok yang
-
-
dicermati dalam menjamin standar saribuah nenas (Hodgson dan Hodgson, 1993). Batasan standar m u t u secara obyektif terhadap penampakan urnum, warna maupun flavor saribuah nenas hingga saat ini belum disebutkan secara eksplisit.
tidak dicanturnkan dalarn rekornendasi rnutu saribuah nenas oleh Codex, narnun dalam persyaratan urnurn produk akhir saribuah secara urnurn oleh Codex disebutkan harus mengandung asarn askorbat minimal 400 rnglkg (Codex, 1992).
Berdasarkan standar dari Codex (1992) dan Codex
(1996)
tersebut diatas, rnaka rnutu saribuah nenas dipertimbangkan berdasarkan berbagai jenis parameter rnutu secara fisik, kirnia dan biologis. Dalarn rnernpelajari pengaruh proses terhadap rnutu pangan urnurnnya tidak semua parameter rnutu diukur, tetapi hanya diukur satu atau beberapa parameter yang disebut indeks mutu. lndeks rnutu diharapkan dapat rnernberikan garnbaran parameter rnutu lain sebanyak-banyaknya baik yang biasa dinilai secara subyektif rnaupun secara obyektif.
Warna, indeks kecoklatan, kadar asarn askorbat, dan kadar gula pernah digunakan sebagai indeks rnutu dalarn pernbuatan konsentrat nenas (Braddock dan Marcy, 1985). Warna merupakan indeks rnutu penting, karena terlihat konsurnen lebih awal. Warna dan kadar gula dapat rnencerrninkan penerimaan konsumen terhadap saribuah nenas dari konsentrat, dengan model pendugaan yang dinyatakan Fontana et a/. (1 993) sebagai berikut:
di rnana:
P : Penerirnaan konsurnen pada saribuah nenas, dengan skor
dG: Perubahan glukosa (%)
dR: Perubahan gula pereduksi (%)
dHunter-L: Perubahan skala warna Hunter-L (%)
Kadar asarn askorbat bukan hanya sering digunakan sebagai indeks rnutu saribuah tetapi juga produk bahan pangan lain yang diolah dengan panas dan disimpan. Hal ini karena asarn askorbat rnerupakan zat gizi yang relatif sensitif pada pernanasan (Lund, 1 9 7 7 ) dan mengalarni kerusakan akibat oksidasi rnaupun enzirnatis dalarn penyimpanan (Labuza, 1982). Penurunan kadar asam askorbat yang besar merupakan suatu peringatan kernungkinan terjadinya kerusakan zat gizi lainnya akibat pernanasan maupun selarna penyirnpanan.
lndeks kecoklatan sering digunakan sebagai indikator rnutu untuk rnenyatakan warna saribuah, rnisalnya pada saribuah ape1 (Toribio dan Lozano, 1984; Bayindirli
et
a/., 19951, saribuah wortel (Sirnslainnya seperti asarn amino dan asarn askorbat (Sadler, 1987). lndeks kecoklatan umurnnya diukur secara spektrofotornetrik dan dinyatakan dengan satuan nilai absorbansi pada 420nrn (Meydav et a/., 1977).
Penarnpakan saribuah nenas secara urnurn bersifat cloudy (tidak jernih atau tidak transparan), tetapi jika terjadi pengendapan partikel akan menjadi jernih sehingga rnenyirnpang dari standar Codex. lndeks rnutu yang dikaitkan dengan ha1 ini adalah inaktivasi enzirn pektinesterase dan telah digunakan sebagai indeks rnutu dalarn pasteurisasi saribuah jeruk (Holland et a/., 1976).
Menurut standar Codex (1 9961, saribuah nenas harus bebas dari mikroorganisme yang dapat hidup dalarn kondisi penyimpanan normal. Dengan p H 3,5-3,7, bakteri patogen tidak mernproduksi racun bahkan tidak dapat hidup dan rnikroba yang berpeluang besar hidup pada saribuah tersebut adalah jenis Lactobacil/us, bakteri asam Iaktat, kapang dan khamir (Cousin dan Rodriguez, 1987).
Lactobacillus telah digunakan sebagai indeks m u t u dalarn proses
pengolahan saribuah jeruk (Nagy et
at.,
1977), konsentrat pasta tomat (Villari et a/., 1984) dan mikroba indikator daalam rancangan proses HTST dengan oven gelombang rnikro (Nikdel et al., 1994).2.1.2. Aspek Fisiko-kimia Saribuah
diatas 22"Brix berubah menjadi pseudoplastik jika padatan terlarutnya bertambah (Hodgson dan Hodgson, 1993).
Saribuah nenas mengandung sukrosa 8-10 g1100g. glukosa 1,7 g l 1 OOg, fruktosa 0,7-1,8 g1100g dan asam askorbat 3,3-5,3 mgI100rnL (Braddock dan Marcy, 1985). Nilai p H saribuah nenas relatif stabil, berkisar antara 3.3-3.7, dengan kandungan asam nonvolatil yang didominasi asam sitrat dan malat (Singleton dan Gortner, 1965). Dalam saribuah nenas juga terdapat lebih dari 45 senyawa .volatil, seperti aldehida, ester dan turunannya, senyawa- senyawa furan dan turunannya, furfurai dan hidroksimetilfurfural (Flat dan Forrey, 1970).
Mehrlich dan Felton (1980) juga melaporkan adanya sejumlah mineral dan vitamin dalam saribuah nenas. Kalsium, fosfor, magne- sium dan potasium terdapat lebih dari 8 mgllOOg, sedangkan niasin dan asam pantotenat masing-masing 0,29 dan 0.16 mg1100g. Nenas juga dilaporkan mengandung sejumlah pigmen klorofil, karotenoid dan
antosianin (Gortner, 1965).
2.1.3. Aspek Biokimia dan Mikrobiologi Saribuah
Tabel 1 . Kadar asam amino dalarn saribuah nenas (Hodgson dan Hodgson, 1993)
- -
No. Narna Asarn Amino Konsentrasi tppm)
Alanin
Alpha-aminobutirat Gamma-aminobutirat Arginin
[image:22.545.47.472.90.701.2]Enzim peroksidase juga dijumpai pada nenas muda, tetapi keberadaannya rnenurun terus pada proses pematangan buah. Selain peroksidase, dalam buah nenas juga dilaporkan terdapat poliga- lakturonase, fosfatase, oksidase dan dehidrogenase (Gortner dan Singleton, 1965). Beberapa jenis enzim dapat menjadi masalah dalam proses bahan pangan berasam tinggi, antara lain : lipase, fenolase, lipoksigenase, katalaso, peroksidase, pektinase, oksidase, protease, dan fosfatase. Pektinase, peroksidase, protease dan fosfatase berpengaruh pada mutu produk (Sadler, 1987). Pada golongan buah secara alami tgrdapat enzim pektinesterase yang keadaannya bervariasi tergantung jenisnya (Reed, 1975).
Pektinesterase adalah golongan enzim pektinase yang mengka- talisis deesterifikasi hidrolitik pektin sehingga membentuk pektin tanpa gugus metoksil. Menurut Kulp (1975), enzim pektinesterase tidak hanya diproduksi oleh tanaman, tetapi juga diproduksi mikroba seperti Fusariurn sp., Clostridium sp. dan sebagainya.
Mikroflora yang mungkin terdapat dalam buah nenas dan produknya, antara lain berupa bakteri seperti Clostridium paste-
urianum, Lactobacillus plantarum, Leucostoc mecenteroides, dan
beberapa jenis bakteri grampositif yang belum teridentifikasi.
Clostridium pasteurianum tidak mampu hidup pada produk nenas
yang rnempunyai pH kurang dari 4,2 (Hodgson dan Hodgson, 1993). Mereka juga rnencatat adanya sejumlah kapang dan khamir pada saribuah nenas yang dibuat dari konsentrat (Aw rendah), seperti:
Khamir bersama sporanya dapat dieleminasi dengan rnudah menggunakan pasteurisasi, tetapi kapang yang berspora perlu pernanasan lebih lama jika produk berupa konsentrat. Kadar gula yang tinggi dalarn konsentrat akan rneningkatkan daya tahan khamir terhadap panas (Frazier dan Westhoff, 1978). Kapang lebih dorninan pada jenis konsentrat, tetapi pada buah dan sayuran dengan Aw tinggi, bakteri umumnya mengambil peran pertama merusak dalam ferrnentasi, kemudian diikuti kapang dan kharnir (Gilliland, 1986).
2.2. Mekanisme Perubahan Mutu Saribuah
Perubahan warna dan flavor saribuah nenas diduga akibat degradasi gula, pemanasan dan penyimpanan (Mehrlich dan Felton, 1980). Perubahan rnutu saribuah menurut faktor penyebabnya yang dorninan dapat terjadi akibat reaksi kimia, aktivitas biokirnia dan kerja mikroba. Berlandaskan indeks mutu saribuah nenas yang diuraikan dibagian 2.1 maka perubahan mutu saribuah nenas yang penting dikemukakan rnekanismenya adalah kecoklatan dan perubahan gula, degradasi asarn askorbat, perubahan mutu akibat aktivitas kerja enzim dan mikroba.
2.2.1. Kecoklatan dan Degradasi Gula
dibedakan atas empat golongan, yaitu kecoklatan akibat karamelisasi, reaksi Maillard, degradasi asam askorbat dan degradasi lipid (Sadler, 1987).
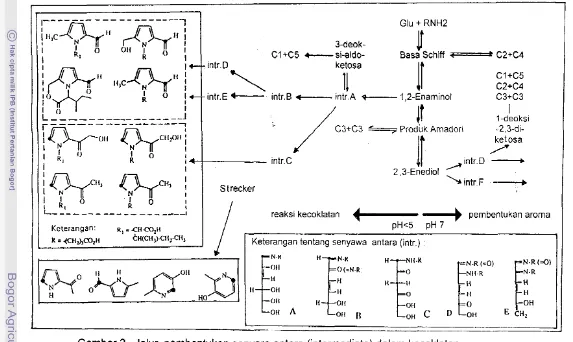
Kecoklatan reaksi Maillard diawali oleh reaksi gula pereduksi dengan asam amino membentuk glikosilamin, yang kemudian membentuk produk Amadori. Selanjutnya terjadi reaksi-reaksi dan pembentukan senyawa antara hingga berakhir pada pembentukan senyawa kecoklatan (Gambar 1). Saat ini telah diketahui bahwa produk Amadori dapat menjadi berbagai senyawa dengan melalui berbagai senyawa antara sebagaimana diperlihatkan dalam Gambar 2 (Tressl et a/.
,
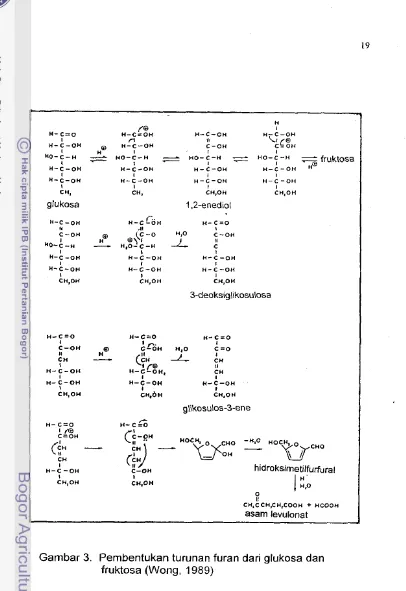
1994)Sukrosa tidak terrnasuk gula pereduksi (BeMiller dan Whistler, 1996), tetapi dapat menghasilkan fruktosa dan glukosa yang merupakan gula pereduksi. Pembentukan produk antara berupa HMF dalam Gambar 1 merupakan indikator kuat telah terjadi degradai gula pereduksi seperti fruktosa dan glukosa tersebut (Sadler, 1987). Akibat degradasi gula bukan hanya terbukanya peluang kecoklatan reaksi Maillard, tetapi juga dapat menghasilkan berbagai senyawa, sebagaimana diperlihatkan dalam Tabel 2. Monosakarida pada pemanasan suhu tinggi dalarn suasana asam kuat dapat mengalami dehidrasi, hingga menjadi furfural seperti dalam Gambar 3 (Wong,
16
+amin, -H20
Glikosilamin
rearangemen
1 -amino-I -deok- si-2-ketosa
Basis Schiff, Hasil fisi
HMFIFurfural Redukton (asetal, diase- til, dll.)
Dehidro- redukton
HMF atau furfural
Aldehid
+amin
Melanoidin
polirner dan kopolimer kecoklatan yang mengandung nitrogen
3-deok-
C l +C5 t si-aldo- Basa
Y
Schiff t--- C2+C4Keterangan: R, = c~rco,ii
K = I C l l ~ C O , l I ktI(cli,)€..
I
S trecker
11
,
intr D-
2,3-Ened~ollntr F
-
I .
reaksi kecoklatan1
-
---)
pernbentukan aromapH<5 pH 7
"'-'"'
j
/
I
Keterangan tentang senyawa antara (intr.) :N-K N-K H NI1.K
0 1 1 011 01i
0Ii A
[image:27.742.77.650.101.443.2]1
LTabel 2 . Beberapa senyawa hasil degradasi gula (Lee
dan Nagy, 1988)
Asam asetat
Asetilformoin
Asam format
2-Asetilfuran
2-Asetilpirol
a-Angelica lactone
B-Angelica lactone
N-Etilpropil-2-karboksaldehid
2,3-Dihidro-3,5-dihidroksi-6-metil-4H-piranon 2,5-Dimetil-4-hidroksi-3(2H)-furanon
Furfural
Furfuril alkohol
2-Hidroksiasetil furan
2-Hidroksiasetil furan format
5-Hidroksimetil furfural
4-Hidroksi-2-(hidroksimetil)-5-metil-3(2H)-furanon Metilsiklopentenolon
5-Metil-2-furaldehid
[image:28.547.49.506.12.720.2].l
H
I
H- C=O H - C S O H H - C - O H H - C - O H
I n 15 < I [e
H - C - O H H - C - O H C - O H C - O H I
HO-:-H
2
n o - A - H=
H O - C - H 0 - H f frukto~aI I I
-
H - C - O H n - c - o n n - C - o n n - i - 0 " H@
I I I
H - C - O H H - C - O H H - C - O H H - C - O H
I I ! I
C H, CH, CH.OH CH,OH
glukosa 1.2-enediol
H - C - O H H - C G H H - C = O
$4 .(I 5
C - O H H @ @+Yo H,O C - O H I
NO-C-H
-
H,O-C-HI I
A
:
I
H - C - O H H - C - O H H - C - O H
I I I
H - C - O H H - C - O H H - C - O H
I I I
CH,OH CH,OH CH,OH
3-deoksiglikosulosa
H - C = O H - C = O H - C = O
I I I
C - O H (D CGH H.0 C =o
I, H
C H
-
I ' r e -L i n
H - C - O H H - C - O H , CH
I I
H - C - O H H - C - O H H - C - O H
I I I
CH,OH CH.~H CH,OH
glikosulos-3-ene
H - c = o H- C =O r I F?J
C = O H (:-OH
""'pJ",,
-"so HOC& 0G H
-
(id
-
O H
CH I
ucHO
H - C - O H
,
C-OH hidroksimetilfurfuraj ICH,OH CH.OH
1
O;:0
I1
CH,CCH,CH,COOH + HCOOH
aSam levulonat
I
[image:29.550.85.491.43.634.2]Perbedaan pokok kecoklatan akibat reaksi Mailtard, asam askorbat dan lipida pada dasarnya hanya bertumpu pada asal karbonil reaktifnya. Pada reaksi Maillard, karbonil reaktif berasal dari gula pereduksi, sedangkan kecoklatan dari lipid bermula dari autooksidasi asam lemak tidak jenuh dan umumnya mempunyai Ea dibawah 5 Kkallmol (Sadler, 1987). Peristiwa kecoklatan yang mempunyai E a d i bawah 5 Kkallmol pernah ditemukan dalam penelitian Priyanto (1991), yaitu sebesar 2,5 Kkalfmol pada kecoklatan kerak roti tawar dalam pemanggangan selama 5-30 menit dengan suhu 250-280
"C.
2.2.2. Degradasi Asam Askorbat
Kehilangan asam askorbat dapat berlangsung secara enzimatis dan nonenzimatis yang bersifat oksidatif maupun nonoksidatif. Jalur kerusakan secara enzimatis pada produk sterilisasi dan paste- urisasi dapat diabaikan, karena enzim askorbikase yang mengka- talisis kerusakan tersebut inaktif atau kehilangan kemampuannya dalam pemanasan ringan (Wong, 1989).
Asam askorbat ( t i 2 A - u ~ ~ o )
yang selanjutnya rnelalui 3-deoksipentose (DP) atau xilosone (X) dapat rnernbentuk senyawa coklat.
Dalarn Garnbar 4 tersebut terlihat bahwa setelah pernbentukan DKG relatif sulit dibedakan antara kerusakan yang berasal dari proses oksidatif rnaupun nonoksidatif, bahkan juga ada sebagian senyawa yang rnungkin berasal dari degradasi gula. Narnun dernikian dalarn tahap awal kerusakan asarn askorbat, terdapat perbedaan nyata terutama dalarn peranan oksigen, asarn dan produk reaksinya. Kerusakan asarn askorbat nonoksidatif dapat dipercepat dengan pH yang diturunkan atau kondisi asam (Wong, 1989).
2.2.3. Kerusakan Saribuah Akibat Enzirn dan Mikroba
2.2.3.1. Kecoklatan Enzimatis
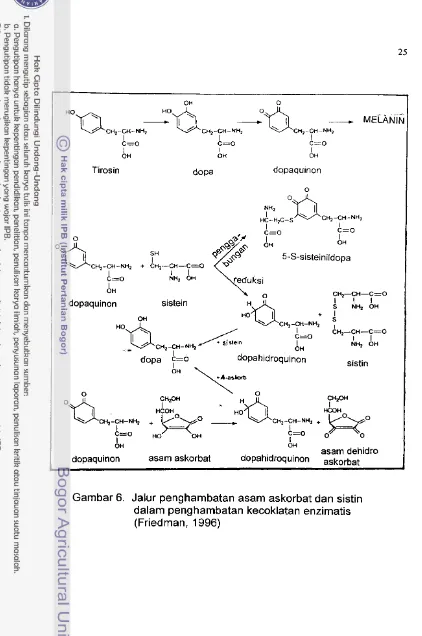
Kecoklatan enzirnatis disebabkan oleh reaksi yang dikatalisis oleh enzirn fenolase. Reaksi yang dikatalisis enzim tersebut ada dua tipe, yaitu reaksi hidroksilasi yang menghasilkan ortofenol dan reaksi oksidasi yang rnenghasilkan ortoquinon (Richardson dan Hyslop, 1976). Jika substratnya berupa tirosin, maka reaksi pertama menghasilkan o-dihydroxyphenylalanine (DOPA) dan reaksi kedua rnenghasilkan DOPA quinon, yang jika berlanjut dapat terjadi kecoklatan sebagairnana terlihat dalam Garnbar
5.
-
-
MELANINCHI-CH-NY CH~-CH-NH, Cn>-Cn-E(H1
I I !
C Z O C=O c=o
I ! I
OH OH OH
Tirosin dopa dopaquinon
I
HC-HzC-S CH,-CH-NH)
I I
c=o c=o I
OH SH
5-S-sisteinildopa
c=o N b
I
OH
dopaquinon sistein
CH2-CH-NY
,
W2-CH-C=0
c=o
I N& 1 OH I
. * I OH
dopahidroquinon sistin
F
m;on CHI-W-NH> +
I
c=o 0
I
OH OH
asam dehidro dopaquinon asam askorbat dopahidroquinon askohat
[image:35.538.45.467.43.679.2]2.2.3.2.
Penjernihan EnzimatisSaribuah nenas secara normal berpenampakan keruh (cloudy) atau tidak jernihltransparan. Kekeruhan saribuah bukan hanya penting dalarn penarnpakan saribuah, tetapi juga rnemberikan citra khas dalarn pengecapan (mouthfeelness). Pektin juga merupakan komponen utarna dalarn mempertahankan penarnpakan kekeruhan tersebut (Holland et
at.,
1976).2.2.3.3.
Kerusakan M u t u Akibat Kerja MikrobaKeasaman saribuah nenas yang tinggi, p H
33-3.7.
merupakan keuntungan tersendiri karena dengan p H kurang dari 3.9 mencegah mikroba patogen dan sporanya untuk hidup. Proses pada saribuah nenas diarahkan untuk membunuh sel vegetatif, hingga dicapai standar m u t u bebas dari mikroba sesuai rekomendasi Codex.Lactobacillus merusak mutu saribuah, karena menimbulkan penyim- pangan rasa dan bau, lebih tahan p H rendah dan relatif tahan pemanasan dibandingkan mikroba dapat hidup pada p H rendah lainnya. LactobaciNos tersebut-masih dapat tumbuh baik pada p H 3.6, sedangkan Leuconostoc sangat lambat pertumbuhannya dan baru membaik pertumbuhannya pada p H lebih besar dari 3,9 (Nagy e t a/., 1977). Dominasi dan ketahanan panas kapang dan khamir lebih banyak terjadi pada bahan pangan dengan Aw rendah (konsentrat), tetapi pada saribuah dan produk ber-Aw tinggi bakteri lebih dominan (Labuza, 1982).
Garnbar
8 .J a l u r fermentasi g u l a o l e h b a k t e r i
L a c t o b a c i l l u s
s.
(Flamming
'et a/..1986)
1
r u k t o s s
l u k o s e
Fruktgsa-1,6P
Glukosa-6P
."
" *
0'
i
MDH
6P Ccukon~r
UnH
X t ~ u ~ o s r SP +
i
"'I
2
v h
::
2 T a ~ o r a 3P Tllosa-3P + A s r r r ~ P
-
Aurrr0
ATP NADH
"5
MD+
IIG**lra.]
Jalur
Jalur
G l i k o l i t i k
F o e f o l i t i k
2.3.
Proses Aseptik 2.3.1. Prinsip DasarProses (process) didefinisikan sebagai pemanasan terhadap bahan pangan dalam waktu dan suhu tertentu yang ditentukan secara ilmiah untuk mencapai kecukupan sterilisasi komersial (The Food Processor Institute, 1988). Proses aseptik adalah suatu pemanasan secara kontinu dalam tempo singkat dalam rangka sterilisasi (UHT) atau pasteurisasi (HTST) bahan pangan diluar kemasan. Pengernasan aseptik diawali dengan sterilisasi kemasan tanpa produk, diikuti dengan pengisian produk proses aseptik dan ditutup secara hermetis dalam kondisi aseptik. Hubungan antara pengemasan aseptik dan proses aseptik sangat erat, sehingga sering dianggap sebagai satu pengertian sebagai pengemasan dan proses aseptik (aseptic processing and packaging). Untuk menghindari kerancuan pengertian tersebut, Nelson et a/. (1 987) memberikan diagram sistem proses dan pengemasan aseptik sebagaimana terlihat dalam Gambar 9.
Proses aseptik dan pengantaran bahannya
Pengisian dan penu- tupan aseptik , dan
Sterilisasi kemasan dan pengantaran kemasan
[image:40.553.48.477.81.708.2]Keuntungan proses aseptik adalah tersedianya peluang menggu- nakan suhu lebih tinggi dibandingkan proses konvensional. Dengan suhu tinggi tersebut dan didukung oleh sistem kontinu, maka waktu proses dapat diperpendek (Lund, 1987). Keuntungan lain adalah kenyamanan produksi dan desain kernasan, m u t u produk dapat diharapkan lebih baik, dan relatif hemat energi (Toledo dan Chang,
1990).
Disamping keuntungan diatas, terdapat keterbatasan dalam penggunaan proses aseptik yaitu bahan harus bersifat fluida (pumpable) dan penentuan w a k t u prosesnya perlu mempertim- bangkan sifat aliran bahan. Berdasarkan pertimbangan keamanan pangan untuk masyarakat umum, maka waktu dan suhu proses yang diperlukan untuk destruksi mikroba hanya dievaluasi pada perioda dibagian tempat target pemanasan (holding tube) pada kondisi isotermal (Toledo, 1986). Waktu proses ditentukan berdasarkan kecepatan maksimal fluida (Vrnax) sebagai berikut (Lund, 1987):
dimana:
0
: Waktu proses aseptik (detik) L : Panjang holdingtube
(cm)Besar V ~ . X dipengaruhi oleh profil atau distribusi kecepatan. Vmax
untuk aliran laminer (bilangan Reynolds, Re, kurang dari 2100) fluida Newtonian sebesar dua kali kecepatan rata-ratanya (V), sedangkan untuk nonNewtonian diduga dengan model hubungan sebagai berikut (Lund, 1987):
dimana:
V : kecepatan rata-rata fluida (cmldetik) n : indeks perilaku aliran (tanpa satuan).
2.3.2.
Sterilisasi dalam Proses AseptikProses aseptik pada dasarnya dirancang untuk menghilangkan aktivitas mikroba yang tidak dikehendaki dalam bahan pangan. Namun demikian dalam perkembangannya proses tersebut juga dituntut untuk rnempertahankan mutu dan meningkatkan keawetan produk dengan menginaktifkan enzim pengganggu (Toledo dan Chang,
1990). Kecukupan pemanasan proses aseptik pada dasarnya diperhitungkan pada kemampuan sistem pemanasan (Lund, 1977), dan rnikroba indikatornya menurut golongan p H bahan pangan yang diproses (Cousin dan Rodriguez,
6
987).Bahan pangan dikelompokkan dalam tiga golongan berdasarkan pH-nya, yaitu berasam rendah (pH lebih besar dari 4'61, asam (pH
4-
4,6)
dan berasam tinggi(pH
kurang dari 4,O). Penentuan waktu dan suhu dalam proses aseptik tergantung jenis mikroba indikator, yang ditetapkan berdasarkan ketahanan panas dan p H bahan pangannya. Stumbo (1 9 7 3 ) merangkum alternatif mikroba indikator dan ketahanan panasnya menurut golongan p H bahan pangan sebagaimana terlihat dalam Tabel 3.Tabel 3. Nilai D dan grup mikroba dalam bahan pangan (Sturnbo, 1973)
Kelompok Bahan Pangan dan rnikrobanya
Ketahanan panas (rnenit)
Bahan pangan berasarn rendah: Terrnofilik (berspora)
Grup flatsour (B.stearotherrnophilus) 4,O-5.0 Gru p gaseous (C. therrnosaccharolyticum) 3,O-4,O
Grup sulfit (C.nigrican) 2,0-3,0
Mesofilik (berspora)
C.botulinurn (A dan B) 0,l-0,2
Grup C. sporogenes (termasuk PA36791 0,l-1.5 Bahan pangan asarn:
Terrnofilik (berspora) 0,Ol-0,07
Mesofilik (berspora) Anaerob fakultatif
Butirat anaerob (C.pasteurianum)
Bahan pangan berasarn tinggi: D(66"C) Lactobacillus,
f
euconostoc dan 0,5-1,O
[image:45.547.39.474.27.688.2]Pada bahan pangan berasam rendah, seperti susu, sterilisassi proses aseptik dilakukan dengan UHT yaitu pernanasan pada suhu 135-1 50°C selarna 2-5 detik. Pada produk berasam tinggi, seperti saribuah pH 3,5-4, dilakukan dengan HTST yaitu pernanasan pada suhu 85-95°C selarna 15-30 detik (Fardiaz, 1992). Penggunaan waktu proses yang lebih singkat dalarn proses aseptik HTST dimungkinkan dengan menaikkan suhu proses. Proses aseptik dalarn waktu tiga detik pada 104 OC telah dicobakan pada saribuah jeruk dan apel, dengan hasil relatif sama dengan saribuah yang diproses hotfill
85°C selarna tiga menit (Toledo dan Chang, 1986).
Gambar 1 1 . Waktu inaktivasi faktor bio-
logis bahan pangan (Toledo dan
Chang,
1990)
85 90 9%
Suhu
*c
I
[image:47.538.103.457.67.640.2]2.4. Kinetika Reaksi Kimia dan M u t u Pangan
Penggunaan kinetika dalarn bidang pangan pada dasarnya rnerupakan penerapan prinsip kinetika yang digunakan dalarn reaksi kirnia. Kinetika kirnia ialah suatu telaah rnengenai laju reaksi kirnia dan perubahannya pada berbagai kondisi (Labuza, 1983). Kinetika kirnia juga berkaitan dengan perubahan suatu sifat kimia dalarn suatu waktu (Steinfeld et
a/.,
1 989).Kinetika dalarn bidang pangan telah rneluas penggunaannya, bukan hanya mernpelajari perubahan kimia tetapi juga fenornena fisik dalarn bahan pangan yang dapat dijelaskan dengan kinetika seperti pendugaan waktu kedaluwarsa (Labuza, 1982), gelatinisasi pati dan penyerapan air (Wirakartakusurnah, 1 9 8 1 ) dan perubahan warna kerak roti (Priyanto et al., 1990). Manfaat inforrnasi kinetika terutama dalarn perencanaan proses, pengembangan produk dan penyirnpanan bahan pangan, sebagaimana terangkum pada Tabel 4 berikut (Lenz dan Lund, 1980).
Tabel 4. Manfaat kinetika dalarn teknologi pangan No. Kategori rnanfaat KeteranganIContoh kasus
1. Perbaikan produk Minirnalisasi kerusakan pangan 2. Pengernbangan pro- ldentifikasi peluanglalternatif
duk baru produk baru dengan desain proses dan rnetode pengemasan 3. Penyimpanan pro- Pendugaan umur sirnpan dan
[image:48.550.44.471.48.729.2]2.4.1. Landasan Teori Laju dan Orde Reaksi
Perubahan kirnia dapat terjadi dalarn bentuk sederhana hingga yang kornpleks yaitu yang terdiri atas beberapa tahap dan urnurn-nya mencakup satu atau lebih senyawa antara. Reaksi kimia yang hanya berlangsung satu tahap disebut reaksi elernenter yaitu reaksi yang produknya langsung dibentuk dari reaktan. Reaksi elementer dapat dinyatakan dalam rnolekuleritasnya, sehingga dikenal reaksi unimolekuler, birnolekuler dan seterusnya. Model kinetika bentuk sederhana diawali dengan model yang didasarkan reaksi elementer dengan persamaan-persarnaan berikut (Steinfeld et a/., 1989). Reaktan A bereaksi dengan reaktan B menghasilkan X dan Y, dan persarnaan stoikiometrinya dapat dituliskan sebagai:
dimana :
a, b, x dan y adalah jumlah rnol A, B, X dan Y
dimana:
d0 : perubahan waktu (detik atau jam, dsb.) dCi: perubahan konsentrasi zat i (mol/L)
Dalam bentuk yang lebih umum laju reaksi dapat dinyatakan sebagai fungsi (f) dari konsentrasi reaktan A dan B, sebagai berikut:
Dengan pendekatan yang sama,
R
dapat pula dinyatakan sebagai fungsi produk X dan Y. Selanjutnya dalam hubungan R sebagai fungsi reaktan atau produk yang sering ditemui adalah bahwa laju reaksi proporsional terhadap hasil kali perpangkatan aljabar dari konsentrasi individual, sehingga dapat disusun kesetaraan sebagai beri kut :dimana m dan n adalah orde reaksi terhadap A dan B. Orde reaksi secara keseluruhan adalah m
+
n.dimana :
k : adalah konstanta laju reaksi.
Persamaan (2-5) disebut persamaan laju (rate equation), dan k dikenal sebagai konstanta laju perubahan (rate constant). Dengan pendekatan yang sama dapat dibuat model persamaan laju berdasarkan produk, untuk reaksi unimolekuler, termolekuler dan sebagainya. Dari reaksi unimolekuler misalnya, dengan persamaan stoikiometri dari A+ B, dapat diperoleh:
Persamaan (2-6) dapat dinyatakan dalam bentuk hasil integrasinya sebagai persamaan berikut (Steinfeld et a / . , 1 9 8 9 ) :
Konsep laju dan orde reaksi dalarn reaksi kornpleks pada dasarnya sarna dengan reaksi sederhana, tetapi karena jurnlah reaktan dan produk lebih banyak maka diperlukan modifikasi pada beberapa bagian persarnaan. Dalarn ha1
ici terrnasuk reaksi kornpleks adalah
reaksi bolak-balik, reaksi dengan percabangan produk, reaksi dengan percabangan reaktan dan reaksi berantai. Reaksi-reaksi tersebut beserta dengan persarnaan lajunya dalarn bentuk hasil terintegrasi dengan asumsi orde kesatu telah diungkapkan oleh Sweinbourne ( 1 97 1 ), dan hasilnya terangkurn dalarn Tabel5.
2.4.2. Kinetika Perubahan Mutu Pangan
Tabel 5. Reaksi kompleks dan bentuk integrasi dari persamaan laju perubahannya (dirangkum dari Sweinbourne, 1971 )'
Reaksi Hasil lntegrasi persamaan laju
CX = C~~[k1/(k~-k~)I[exp(-k10)-exp(-kz8)1 4. A
k l x
b ykzexp(-ki8)-kiexp(-kz0) C v = C ~ o { l
+
ki-kn
I
') Keterangan :
o (indeks):menunjukkan keadaan awal
[image:53.545.39.481.8.737.2]eksperimen kinetika adalah pengembangan model matematis untuk rnenggambarkan laju reaksi sebagai fungsi variabel eksperimen tersebut (Hill dan Grieger-Block, 1980). Dalam ha1 ini, model matematis yang diperlukan dalam kinetika perubahan m u t u pangan merupakan suatu bentuk pernyataan atau persamaan aljabar yang rnarnpu menggambarkan keadaaan pangan tersebut (Saguy dan Karel, 1980).
Dalam kinetika perubahan m u t u pangan, umurnnya dilakukan penyederhanaan reaksi-reaksi yang kornpleks dengan menjadi reaksi sederhana dengan orde reaksi kenol atau kesatu. Hal ini dimungkinkan dengan asumsi reaktan banyak dan berlimpah keter- sediaannya (surplus), reaksi irriversibel, reaksi tidak berbentuk siklis atau tanpa percabangan yang banyak, dan sebagainya (Thompson,
1982). Penyederhanaan dari reaksi kompleks atau orde tinggi telah diulas oleh Swinbourne (1971) dan Steinfeld et a/. (19891, sehingga dapat diperoleh reksi sederhana dengan orde kenol, kesatu atau kedua.
Sebagai contoh rnisalnya dari persamaan (2-5) dengan dasar reaksi persamaan (2-I), jika m = I dan n =
I
maka reaksi tersebut adalah orde kedua. Namun demikian jika reaktan B ketersediaannya berlebih (surplus) maka CB dapat dianggap konstan. Jika didefi- nisikan k.= kCe, rnaka persamaan (2-5) menjadi persamaan (2-1 1 )yang sarna dapat disederhanakan reaksi orde ketiga rnenjadi orde kedua atau kesatu bahkan kenol.
dirnana:
ka : konstanta laju nyata (apparent)
Reaksi kornpleks yang terdapat dalarn Tabel 5 dengan mernper- hatikan peran atau kontribusi reaktan dan jalur reaksinya dapat disederhanakan. Reaksi no.1 bersifat reversibel, tetapi jika kz jauh lebih kecil dibandingkan ki, rnaka kz dapat diabaikan dan dapat dianggap irriversibel. Reaksi no.2 merupakan reaksi paralel, tetapi jika pernbentukan Y dan Z relatif kecil dibanding X rnaka kebera- daannya dapat diabaikan dan reaksi dapat dianggap hanya rnengha- silkan produk X. Dengan pendekatan yang sarna reaksi no.3 sarnpai' no.5. juga dapat disederhanakan.
dimana:
Q : indeks mutu bahan pangan (sim') Qo: indeks mutu awal (sim')
0
: w a k t u perubahan m u t u (sw')k : koefisien atau konstanta laju (Ismi)'"" sw-'1
Catatan: ' sim=satuan indeks mutu, s w = satuan waktu, tergantung dari indeks m u t u dan waktu yang digunakan. Misalkan Q: asam askorbat, sim adalah mg11 OOmL, s w = detik atau menit.
dimana:
N : jumlah mikroba setelah w a k t u T (cfulmL)
No
: jumlah mikroba awal (cfu/mL)9
: waktu inaktivasi mikroba (menit)D : waktu yang diperlukan untuk inaktivasi 9 0 % mikroba pada suhu d i mana perubahan terjadi (menit).
Dalam perkembangannya model Bigelow juga diadopsi untuk model kinetika inaktivasi enzim (Richardson dan Hyslop, 1976).
2.4.3. Pendugaan Model dan Parameter
Secara teoritis orde reaksi dapat sampai orde tertinggi (tak terhingga), namun dalam eksperimen kinetika kimia yang diketemukan hanya sampai orde ketiga (Steinfeld
et
a/., 1989), sedangkan untuk perubahan mutu pangan umumnya mengikuti orde kenol atau kesatu (Labuza, 1983) dan beberapa ada juga yang orde kedua (Bellet a / . ,
1991 ).yang telah dibuat Labuza (1980) dan Thompson (1982) sebagian besar juga menunjukkan perubahan rnutu bahan pangan termasuk orde kenol dan kesatu. Dengan demikian dalam perubahan rnutu pangan dapat dikemukakan akan mengikuti salah satu dari model yang pernah diperoleh diatas, yaitu model orde kenol, orde kesatu atau orde kedua.
Model perubahan mutu pangan dan orde reaksi perubahannya dapat dianalisis dengan berbagai rnetode (Sweinbourne, 1 9 7 1 ), d i antaranya dengan integrasi yang dilanjutkan dengan analisis model atau fungsi dugaannya. Dari persamaan 2-8 sampai 2-10, dapat dibuat fungsi dugaan hubungan Cn=f(0) untuk orde kenol, Ln(Cn) = f
(0)
untuk orde kesatu dan ( 1 /CAI = f (0) untuk orde kedua. Pengujian atas ketepatan model atau fungsi dugaan dapat dilihat dari koefisien deterrninasi (r2) (Steinfeld, 1989). jumlah kuadrat beda terkecil (Cohen et a/., 1994) serta uji penyirnpangan model (lack of fit) (Draper dan Smith, 1981; Box et a/., 1978). Dengan mengetahui model tersebut dapat diperoleh informasi kinetika yang berupa orde reaksi (n) dan konstanta laju (k) yang berlaku pada suhu tertentu.dirnana:
ko : konstanta preekponensial (sim~'"~"sw")
*
E.
: energi aktivasi (Kkallrnol)R
: tetapan gas (1,986 10-3
Kkal/mol/K) T : suhu mutlak (K)* ) Lihat keterangan pers. 2-12 tentang satuan sim dan s w .
Dalam kaitannya dengan D, ketergantungannya terhadap suhu lebih tepat dinyatakan dalam bentuk sebagai berikut (Ball dan Olson, 1957):
dirnana :
DO : nilai D pada suhu to (menit) to : suhu awal ("C)
t : suhu pada nilai D yang dikehendaki ("C)
z : suhu yang diperlukan untuk merubah satu log(D) ("C)
Tabel 6. Nilai D dan z destruksi termal kornponen pangan (Cousin dan Rodriguez, 1987)
Grup indeks mutu D ( l 20°C), rnn. z r c )
Komponen warna 1 0 - 2 0 20-60
Vitamin 1 20-1 2 0 0 25-45
Enzim 1-1 5 6 - 6 0
Spora rnikroba 0,2-4 6-1 2
Galur tahan panas
>
5 0 6-1 2Komponen rnutu 5 - 5 0 0 8-1 8
Tabel 7. Energi aktivasi (E.) perubahan m u t u pangan (Saguy dan Karel, 1980)
Tipe reaksi
E.
(Kkallmol)Reaksi di bawah kontrol difusi Reaksi enzimatis
Hidrolisis Oksidasi lipid
Flavor, tekstur dan warna Vitamin
Kecoklatan nonenzimatis Destruksi enzim
Destruksi sel vegetatif Destruksi spora
[image:60.538.44.482.51.709.2]suhu dikonversikan dalam suhu mutlak
(K),
sehingga dapat diperoleh persamaan sebagai berikut (Lund,I 977; Toledo, 1986):Pengaruh suhu dalam kinetika perubahan m u t u atau kerusakan pangan juga sering dinyatakan dalam bentuk Qlo, yaitu rasio laju perubahan
jika suhunya berbeda 10°C, yang dinyatakan dalam persamaan berikut (Labuza, 1983):
Tabel 8. Parameter kinetika dan keterangannya
Parameter Definisi Satuan Jenis
D Waktu yang diperlukan pada detik 1 suhu tertentu untuk mere-
duksi populasi bakteri 90%'
k Laju reaksi detik" 1
Ea Energi aktivasi, ditentukan Kkallmol 2 dari slope plot Arrhenius
ko Konstanta preekspoqensial detik 2 persamaan Arrhenius
.
-
z Perubahan suhu ("C) yang
"C
2 diperlukan untuk merubahnilai D 90%
0 1 0 Rasio laju perubahan mutu 2
jika suhunya berbeda 10°C
') perkembangan selanjutnya dapat untuk selain bakteri, misalnya enzim
[image:62.538.41.469.23.716.2]2.5. Optimasi Proses
2.5.1. Tinjauan Urnurn
Optimasi adalah suatu prosedur atau cara yang dikernbangkan untuk mernperoleh pilihan terbaik dalam suatu kasus (Sidel dan Stone, 1983). Optimasi juga rnengandung pengertian pengendalian, prosedur yang baik dan perencanaan hati-hati sehingga diperoleh hasil yang terbaik (Norback dan Evans, 1983).
Program linier rnerupakan salah satu teknik yang efektif dan banyak digunakan (Maarif et a / . , 1989). Dalarn bidang pangan antara lain pernah digunakan untuk optirnasi dan kontrol kesetirnbangan protein (Cavin et al., 19721, pernbuatan rnayonaise (Bender et
a/.,
1982) dan perencanaan ransurn pakan ikan (Sjafaat, 1989). dan sebagainya. Prosedur optirnasi tersebut dalam operasionalnya lebih cocok untuk rnasalah-masalah proses dan formulasi produk, karena kornponen perrnasalahannya dapat dinyatakan dalarn bentuk linier (Norback dan Evans, 1983).
2.5.2. Penyusunan Model Linier
Optimasi proses diperlukan untuk mencari alternatif kornbinasi suhu dan w a k t u proses sehingga dapat rnenginaktivasi faktor biologis (mikroba dan enzirn) tercapai tanpa rnerusak rnutu pangan (Lund, 1977). lnaktivasi mikroba dapat digarnbarkan dengan persamaan:
Untuk dapat digunakan dalam program linier rnaka bentuk fungsi atau hubungan harus memenuhi-syarat linieritas (Asri dan Widayat, 1986). Dalam ha1 ini dengan rnemanfaatkan hubungan ketergan- tungan D terhadap suhu, persamaan (2-19) dapat diubah rnenjadi persarnaan (2-201, kernudian ditransformasi dan disusun kembali hingga rnenjadi persarnaan (2-21) yang dapat rnemenuhi aspek linieritas.
1
Dengan cara yang sama dapat dibuat model-model linier untuk inaktivasi enzirn dan kerusakan mutu pangan. Model tersebut telah digunakan oleh Saguy (1 988) untuk menyusun faktor pernbatas dalarn optirnasi proses aseptik dengan HTST. Model dikembangkan berdasar asumsi perubahan mutu rnengikuti model kinetika orde kesatu. Dalam ha1 perubahan mutu tidak mengikuti orde kesatu, maka model dan faktor pernbatas tersebut kurang tepat digunakan. Dengan demikian perlu dicari alternatif linierisasi fungsi perubahan mutu. Salah satu bentuk alternatif adalah mernrnanfaatkan ketergantungan k terhadap suhu, yang secara eksplisit d a ~ a t dinyatakan dalam bentuk hasil integrasi model kinetika orde kesatu:
Log[ln(Q,IQ)I =logko
+
I(Ea/2,303R) ( T - ~) I
+
loge (2-24)Jika didefinisikan y = log[ln(Q,/Q)1, x l =loge, x 2 = T - ~ , bo=logko, b l
= I
dan b2=Ea/(2,303R), rnaka persamaan (2-24) rnerupakan fungsi linier sebagai berikut:Dalam optirnasi dengan program linier terdapat tiga kornponen penting , yaitu peubah keputusan (decision variable), faktor pemba-tas (constraints) dan fungsi tujuan (objective function). Peubah keputusan adalah suatu besaran yang akan ditentukan dalarn berba- gai langkah alternatif. Faktor pembatas yaitu suatu kondisi yang telah ditetapkan sebagai acuan untuk melaksanakan kajian alternatif. Fungsi tujuan adalah ukuran yang digunakan untuk mempertim- bangkan apakah suatu kombinasi terpilih suatu kombinasi yang optimal. Berdasarkan definisi tersebut d i atas ditetapkan pengertian alternatif optimal adalah s p e s i f i k a ~ i yang layak dari peubah keputusan yang mernberikan hasil terbaik bagi fungsi tujuan (Norback dan Evans,
1983). Format dasar penyusunan fungsi tujuan dengan peubah keputusan dan faktor pernbatasnya disarikan dalarn Tabel 9 (Asri dan Widayat, 1986). di mana fungsi tujuan dinyatakan dalam persarnaan (2-26) dan faktor pernbatas dalam persamaan (2-27) dan (2-28) berikut ini.
z
=x
c j x jI = 1
dimana:
X, : tingkat aktivitas ke-j
Cj : kenaikan nilai Z apabila ada penambahan aktivitas (X,) satu satuan, atau merupakan sumbangan setiap satuan output aktivitas j terhadap nilai Z.
aij: banyaknya masukan ke-i yang diperlukan untuk menghasilkan setiap unit luaran aktivitas ke-j
b i : banyaknya masukan ke-i yang tersedia untuk dialoka- sikan pada setiap unit aktivitas (i = 1.2, ... m)
....
i : nomor setiap macam masukan (i= 1,2,3, m)
j : nomor setiap macam aktivitas .(j = 1.2.3
...
n)n : macarn aktivitas yang menggunakan masukan tersedia m : macam batasan masukan yang tersedia
Tabel 9. Data untuk program linier (Asri dan Widayat, 1986)
Aktivitas Penggunaan masukan per Kapasitas
Ma- unit aktivitas masukan
sukan 1 2 3
...
nm l a, am2 am3
...
a m n b m dZ pertam-bahan tiap
unit C1 C2 C3
...
CnTingkat
[image:67.538.50.476.35.705.2]Penyelesaian optimasi program linier dengan dua peubah dapat dilakukan dengan rnetode grafik, tetapi jika lebih banyak variabelnya diselesaikan dengan metoda sirnplek (Bender dan Krarner, 1983). Program linier dengan dua peubah selain dapat diselesaikan dengan metode grafik juga dapat diselesaikan dengan rnetode simpleks.
Dalam penyelesaian dengan metode sirnpleks, bentuk persamaan standar program linier (pers.2-26 sarnpai 2-28, dan uraian dalarn Tabel 9), perlu diadakan penyesuaian (Asri dan Widayat, 1 9 8 6 ) berupa:
(1) Perubahan bentuk fungsi tujuan, dalarn ha1 ini peubah di sebelah tanda = dipindahkan ke kiri, sehingga fraksi-fraksi di sebelah kanan bernilai nol.
(2) Fungsi yang berupa pertidaksarnaan diubah menjadi persamaan dengan penambahan peubah slack atau surplus ( S ) .
[image:68.542.38.476.46.716.2]3. METODE PENELITIAN
3.1. Waktu. Tempat dan Tahapan Penelitian
Penelitian dilakukan dalam dua tahap, yaitu tahap pertama dila- kukan d i Department of Food Science North Carolina State University (Januari-Maret 1994), sedangkan tahap kedua dilakukan d i PAU Pangan dan Gizi IPB serta Jurusan Teknologi Pangan dan Gizi IPB (Mei-Desember 1995).
Pada tahap pertama dilakukan penelitian tentang reologi saribuah pada suhu tinggi dan pengaruh w a k t u proses aseptik terhadap gula, furfural dan HMF. Penelitian reologi diharapkan dapat mengungkap viskositas dan sifat aliran saribuah nenas pada suhu tinggi. Hal ini berguna dalam pendugaan w a k t u proses aseptik. Pengaruh waktu proses aseptik terhadap gula, HMF dan furfural dilakukan untuk mengetahui perubahannya, d i mana adanya perubahan tersebut merupakan salah satu indikasi peluang besar terjadinya perubahan indeks keco klatan saribuah.
1. Kendali laju aliran 2 . Kendali tekanan uap 3. Penunjuk besar tekanan uap 4. Termokopel inlet holding tube 5. Termokope! outlet holding tube 6. Pemasukan produk
[image:70.550.95.446.71.627.2]7. Pengeluaran produk 6. Termokopel produk keluar 9. Switch;display suhu produk 10. Display suhu produk 11. Display tekanan produk 12. Katup backpressure 13. Ruang holding tube 14. Saluran air pendingin 15. Saluran uap pemanas 16. Saluran elektrik 17. Kontrol daya dan pornpa 16. Saluran pembuangan
3.2. Metode Percobaan
3.2.1. Reologi Saribuah Nenas pada Suhu Tinggi
3.2.1.1.
Saribuah nenas dibuat dengan cara mengencerkan konsentrat nenas (grade komersial) yang diperoleh dari Dole Company, Cali- fornia. Konsentrat diencerkan dengan aquades, sehingga diperoleh saribuah dengan total padatan terlarut 12,5 OBrix dan p H 3,7.
3.2.1 .2. Alat dan Prosedur
Peralatan utarna yang digunakan adalah Bohlin-VOR-Rheometer Version 1 .O-891201 (Bohlin Reologi AB, Swedia) yang dilengkapi dengan kontrol suhu dan kornputer. Pengamatan shear-stress
dilakukan untuk setiap sarnpel dengan kornbinasi perlakuan suhu bahan dan shear-rate. Perlakuan berupa suhu saribuah masing- rnasing adalah: 60, 70, 80 dan 90°C, sedangkan pengukuran shear- stress dilakukan pada interval shear-rate antara 500-1 5 0 0 per detik. Percobaan diulang dua kali. Model dan sifat reologi saribuah nenas ditentukan berdasarkan hubungan shear rate dengan shear stress
(Heldrnan dan Singh, 1980).
3.2.2.
Pengaruh Waktu Proses Aseptik terhadap Kadar Gula danFurfural Saribuah Nenas pada Suhu 90°C
3.2.2.1. Bahan
hidroksimetilfurfural (HMF) dan sebagainya diperoleh dari Aldrich Chemical Co. (USA).
3.2.2.2. AIat dan Prosedur
Saribuah nenas diproses secara aseptik dengan suhu proses 90°C, dengan w a k t u proses 0, 20, 40 dan 6 0 detik. Peralatan pokok berupa alat proses aseptik skala kecil (Microthermic Co.lnc. Raleigh, North Carolina, USA). Alat dilengkapi dengan kontrol suhu dan kecepatan aliran. Saribuah yang telah diproses disimpan pada suhu 4OC sebelum dianalisa. Percobaan diulang dua kali.
3.2.2.3. Pengukuran Kadar Gula
Kadar gula saribuah dianalisis dengan metode HPLC (Lee dan Nagy, 1988). Analisis menggunakan HPLC (Waters Model 51 0, injector model U6K, dengan detektor indeks refraksi Model R-401, Waters Assoc. MA). Kolorn yang digunakan Zorbax-NH2 2 5 0 ~ 4 . 6 m m (DuPont, DE) yang dilengkapi dengan kolom penyangga (guard column). HPLC dilengkapi pernroses data dan integrator (Dynamax, NY). Kondisi operasi menggunakan laju aliran 1,5 mllmenit, fase mobil asetonitrillair (8811 2) dengan volume injeksi 2 0 pL.
dimana:
[GI
: kadar gula (mg/ml)Ls : luas kurva pengukuran sampel @V-det) Li : luas kurva standar @V-det)
Ci : konsentrasi standar (mglml) Va : volume akhir (ml)
Gi : jumlah standar gula yang ditambahkan pada Va (mg) Vs : volume saribuah dalam larutan akhir (ml)
3.2.2.3. Pengukuran Furfural dan HMF
Kadar furfural dan HMF saribuah dianalisis dengan metode HPLC (Lee, Rouseff dan Nagy, 1986). Analisis menggunakan HPLC (Waters Model 510, injector model U ~ K , Waters Assoc. MA), dengan detektor UVlspectromonitor (LCD, Milton Roy, FL). Kolom yang digunakan Zorbax-ODs 250x4,6 m m (DuPont, DE) dengan kolom penyangga RP- 1 8 30x4,6 mrn. HPLC dilengkapi dengan pemroses data dan integrator (Dynamax, NY). Kondisi operasi: laju aliran 2.0 mllmenit, volume injeksi 2 0 pL, dan fase mobil asetonitrillair (1 5/85) dengan penyesuaian pH = 4 menggunakan asarn asetat.
Milford, MA), dan dicuci dengan heksana (0,5ml) dan etil asetat (2x3ml). Hasil pencuciannya ditarnpung, kernudian dikeringkan dengan sodium sulfat anhidrat, lalu disaring (filter disc 0,45firn) dan dipekatkan menjadi I ml dengan gas nitrogen. Sebelum diinjeksikan sarnpel difilter rnelalui rnilipore 0,2 prn (Fisher Sci.Co.). Kadar HMF atau furfural saribuah nenas dihitung sebagai berikut:
Ls
[F] = [
-
x Ci x V a-
Fil 1 Vs Lidirnana:
[Fl
: kadar furfural (pprn)Ls : luas kurva pengukuran sarnpel @V-det) Li : luas kurva standar @V-det)
Ci : konsentrasi standar (pprn) Va : volume akhir (rnl)
Fi : jumlah standar furfural ditambahkan pada Va (pg) V, : volume saribuah akhir yang digunakan (rnl)
3.2.3. Kinetika Perubahan Sifat Fisiko-Kimia Saribuah
3 . 2 . 3 . 1
.
Persiapan Bahanpada suhu 4OC, hingga siap digunakan untuk proses aseptik (jika lebih dari 2 4 jam disirnpan pada suhu beku).
3.2.3.2. Proses Aseptik
Proses aseptik dilakukan dengan rnenggunakan peralatan proses aseptik skala kecil buatan Microtherrnic.Co.lnc. Raleigh North Carolina USA, yang dilengkapi dengan kontrol suhu dan kecepatan aliran. Waktu proses (resident time) diatur berdasarkan kecepatan rata-rata produk, sedangkan suhu proses diatur berdasar kontrol tekanan uap pada pipa pemanas (holding tube). Perlakuan berupa w a k t u dan suhu proses. Waktu proses terdiri dari tujuh taraf: 0, 10, 20, 30, 40, 5 0 dan 60 detik, sedangkan suhu prosesnya ernpat taraf: 87, 90, 9 3 dan 9 6 OC. Parameter sifat fisiko-kimia yang diukur dalam percobaan ini adalah indeks kecoklatan dan kadar asam askorbat. Percobaan diulang tiga kali, dengan pengukuran duplo.
3.2.3.3. Pengukuran Kecoklatan Saribuah
Kecoklatan diukur dan dinyatakan dalam bentuk indeks kecoklatan. Bagian serum saribuah (5ml) diarnbil, dan ditarnbah etil alkohol 9 5 % (5rnl) kernudian disentrifusi. Supernatan diarnbil dan dirnasukkan dalarn kuvet dan diukur absorbansinya pada 420nm dengan spektrofotorneter (model Shirnadzu UV160, Japan). Nilai absorbansi pada 4 2 0 nrn dinyatakan sebagai indeks kecoklatan saribuah (Meydav et a / . , 1977; Cohen et at., 1994).
3.2.3.4. Pengukuran Kadar Asam Askorbat
diarnbil 10 rnl dan dititrasi dengan larutan standar indofenol. Blanko dibuat dengan rnengganti saribuah dengan aquades. Kadar asam askorbat dihitung dengan mernbandingkan jurnlah indofenol yang diperlukan untuk titrasi tersebut dengan yang digunakan untuk titrasi larutan asam askorbat standar, sbb.:
v a 100 I A A I = Vtitran x [AA-std) x - X
-
vs vsb
[AA] : kadar asam askorbat (rdg/lOO rnl saribuah)
[AA-std] : standar asam askorbat, rng AA yang setara dengan 1 m l indophenol (terkoreksi blanko)
Vtitran : m l indophenol (terkoreksi blanko) yang digunakan untuk titrasi sarnpel.
"a : volume awal/campuran (rnl) vs : volume sampel yang dititrasi (rnl) Vsb : volume saribuah yang digunakan (ml)
3.2.4. Kinetika Inaktivasi Enzim Pektinesterase (PEI
3.2.4.1
.
PersiapanBahan
Persiapan bahan dilakukan seperti pada bagian 3.2.3. rnengenai kinetika perubahan mutu fisikokirnia saribuah.
3.2.4.2. Proses Aseptik
proses, dengan tiga kali ulangan. Suhu proses dilakukan dalarn ernpat taraf, yaitu: 87, 90, 9 3 dan 96OC. sedangkan waktu proses dalarn tujuh taraf, yaitu: 0, 10, 20, 30, 40, 5 0 dan 60 detik. Kontrol (waktu proses nol) diukur dengan melewatkan saribuah pada sistern proses aseptik tanpa pemanasan.
3.2.4.3. Pengukuran Aktiviras PE
Pengukuran aktivitas PE dilakukan dengan rnetode titirnetri (Ranganna, 1979). Pada saribuah (40rnl) ditarnbahkan NaCl (0,591 dan 2-3 tetes indikator Hilton. lndikator Hilton adalah campuran 20rnl 0.4% biru bromtirnol, 60ml 0.4% rnerah fenol, 20rnl 0.4% rnerah kresol, dan 20rnl aquades. Sarnpel (30°C) disesuaikan pHnya rnenjadi 7,5 dengan NaOH 0,02 N. Sebelumnya dibuat larutan pektin 1 % dalarn 0,l M NaCl (30°C) dan pHnya disesuaikan menjadi p H 7.5.
Sarnpel bersama-sarna 5rnl larutan pektin distabilkan suhunya (30°C) dengan waterbath, kemudian dicarnpurkan larutan pektin ke dalarn sarnpel, dan dititrasi dengan NaOH 0,02N supaya p H carnpuran tetap 7,5. Waktu dan jurnlah rnl NaOH yang dipakai untuk titrasi tersebut dicatat. Aktivitas pektinesterase (U) didefinisikan sebagai rnikroekivalen asarn yang dibebaskan per menit pada pH 7.5 dan suhu 30°C. Aktivitas pektinesterase saribuah nenas dihitung sebagai berikut.:
ml NaOH x3,1
Upe =---
VS x 81
Vs : volume saribuah dalarn sampel dititrasi (rnl)
Bt : waktu titrasi (menit)
3.2.5.
Optimasi Proses Asep tikBahan-input: Hasil percobaan studi kinetika, inforrnasi rnengenai model kinetika dan parameter kinetikanya.
Alat : unit kornputer (perangkat keras dan lunak seperti prgrarn Lotus Ver.2.3, Statistica for Windows 9 5 )
ProsedurlPendekatan Analisis:
Optirnasi proses aseptik sistem HTST dalarn penelitian ini diupayakan dengan program linier menggunakan software untuk perhitungan dan simulasi berupa Lotus Ver.2.3, ExceN Ver. 7 dan
Statistica for Windows '95. Hasil yang diharapkan adalah
diternukannya kornbinasi perlakuan suhu dan waktu proses optimum. Faktor pernbatas adalah inaktivasi enzim pektinesterase, tingkat destruksi asam askorbat, peningkatan indeks kecoklatan dan batasan peubah proses. Dalam optimasi ini, perubahan m u t u fisiko-kimia saribuah nenas dirninimurnkan. Fungsi tujuan ( Z ) dalarn program linier untuk proses aseptik saribuah nenas ini dinyatakan sebagai persamaan (3-5) berikut.
dimana:
4. HASIL D A N PEMBAHASAN
4.1. Reologi Saribuah Nenas Pada Suhu Tinggi~
Dalam penelitian ini parameter yang dipelajari dalarn kaitannya dengan sifat reologi adalah indeks konsistensi atau viskositas saribuah nenas beserta model hubungan shear stress dengan shear rate yang relevan, bilangan Reynolds yang berkaitan dengan proses aseptik saribuah nenas, dan model pendugaan waktu proses. Berkenaan dengan ha1 tersebut di atas telah dilakukan eksperimen pengukuran
shear stress dalam berbagai nilai shear rate pada suhu saribuah nenas
pada rentang suhu 60-90 OC. Dengan diperolehnya data hubungan
shear rate dengan shear stress dapat diketahui viskositasnya
(Heldman dan Singh, 1980).
4.1.1. Viskositas Saribuah pada Suhu Tinggi
Dalarn penelitian ini model reologi saribuah nenas dikaji dengan pendekatan model fluida Newtonian dan model powerlaw. Bentuk umum model tersebut secara teoritis dapat dinyatakan dengan persamaan berikut (Rha, 1978) :
dimana :
y : shear-stress (Pa)
b : indeks konsistensi (Pa.det), b =viskositas ( p ) jika n = 1 dan yo = 0.
Y : shear-rate (det-I), Y = (-duldr) dimana
o
kecepatan lokal dan radalah jarak radial dari pusat pipa (Palmer dan Jones, 1 9 7 6 )
Hasil percobaan menunjukkan bahwa nilai shear stress akan bertambah besar pada nilai shear rate yang makin tinggi, seba- gaimana terlihat dalam Gambar 13. Analisis lebih lanjut, berdasarkan koef isien determinasi dan analisis penyimpangan model (Tabel 10) rnenunjukkan bahwa model Newtonian dapat untuk menggambarkan hubungan shear stress dengan shear rare saribuah nenas.
Analisis dengan pendekatan model powerlaw (Tabel 10) juga diperoleh indeks perilaku aliran sebesar satu (0,98-1'0) dengan yield
stress bernilai nol, dan viskositasnya bervariasi antara 2,O-3,2 cP.
Daiam hal ini pendekatan model Newtonian lebih tepat digunakan, karena kuadrat penyimpangan modelnya (SS) lebih kecil. Hasil uji lack
of fit model Newtonian yang tidak nyata (Lampiran 2) juga
rnendukung kesimpulan tersebut. Karena itu untuk selanjutnya saribuah nenas (1 2.5 'Brix) pada suhu tinggi disimpulkan berperilaku sebagai fluida Newtoman. Sebelumnya, Hodgson dan Hodgson (1 9 9 3 ) melaporkan saribuah nenas pada suhu kamar sebagai fluida Newtonian jika padatan terlarutnya sekitar 7 "Brix, kemudian menjadi pseudoplastik rnenjelang 2 2 "Brix.
Tabel 1 0 . Model hubungan Shear-stress (y) dengan Shear-rate (Y) saribuah nenas
2
No. Suhu Model r SS /.l(cP)
Model Newtonian : y = pY 6 0 OC y = 3 , 2 1 x 1 0 - ~ ~ 7 0 OC y = 2 , 4 6 x 1 0 ' ~ ~
80
OC y = 1 , 9 1 x 1 0 ~ ~ ~ 9 0 OC y = 1 , 6 3 x 1 0 ' ~ ~Model Powerlaw : y = bYn
-3 0.999
6 0 ° C y = 3 , 2 1 x I O Y
-3 0.999
7 0 ° C y = 2 , 5 0 x 1 0 Y
-3 0,988 80 OC y = 2 , 0 7 x 1 0
Y
-3 0,977
9 0 ° C y = 1 , 9 O x l O Y
Viskositas saribuah nenas rnenurun lebih dari 4 8 persen pada suhu pernanasan 9 0 ' C dibandingkan dengan viskositas pada suhu 6 0 OC.
Hasil penelitian rnengenai viskositas diatas sejalan dengan beberapa hasil penelitian terhadap saribuah lain yang dilakukan sebelurnnya. Misalnya, viskositas saribuah jeruk pada suhu 8 0 ' C
rnenurun lebih dari 6 0 persen dibandingkan viskositas pada suhu karnar (Bayindirli, 1993). Sebelumnya, Henderson dan Perry (1 9 5 5 ) melaporkan bahwa larutan sukrosa 2 0 persen pada suhu 7 0 "C akan menurun viskositasnya sebesar 5 0 persen dari viskositas suhu karnar viskositasnya sehingga rnenjadi 1.92
cP.
Pengaruh suhu terhadap viskositas urnumnya dapat dijelaskan dengan pendekatan Arrhenius (Heldrnan dan Singh, 1980; Rao dan Anantheswaran, 1982). Pendekatan tersebut telah digunakan dan valid untuk menggambarkan pengaruh suhu terhadap viskositas saribuah jeruk (Mizrahi dan Bech, 1972; Bayindirli, 1993), dan saribuah tarnarin (Manohar et a / . , 1991).
Pendekatan dengan model Arrhenius dalam ha1 ini juga digunakan untuk rnenyatakan ketergantungan viskositas saribuah nenas terha- dap suhu, yang dapat dinyatakan dengan persarnaan (4-2) sebagai
2
berikut (r = 0,993) :
di rnana:
Energi aktivasi (Ea) untuk viskositas dari persamaan (4-2) sebesar 5,48 Kkallrnol. Nilai Ea tersebut rnasih dalarn kisaran umurn nilai Ea yang diperoleh para peneliti terdahulu terhadap saribuah lainnya, seperti Ea pada saribuah jeruk grapefruit sebesar 3,62 Kkallrnol (Bayindirli, 19931, saribuah jeruk orange sebesar 6,40 Kkal/rnol (Mizrahi dan Bech, 1972) dan saribuah asarn (tamarind) sebesar 4,5 Kkallrnol (Manohar et a/., 1991). Berdasarkan nilai Ea tersebut diketahui bahwa viskositas saribuah nenas lebih sensitif terhadap perubahan suhu dibandingkan dengan saribuah grapefruit rnaupun
tamarind, tetepi tidak terhadap saribuah orange.
Dari hasil percobaan di atas t'erlihat bahwa kenaikan suhu 1 0
OC
rnenghasilkan penurunan viskositas tidak kurang dari 1 5 persen. Dengan demikian penggunaan data reologi yang perbedaan suhunya lebih dari
10
OC dengan keadaan nyata bahan dapat rnengakibatkan kesalahan pendugaan sehingga terjadi kesalahan proses. Dalam ha1 ini jika dilakukan untuk penghitungan bilangan Reynolds (Re) dapat rnenghasilkan bilangan Re yang berbeda. Misalnya, bilangan Re untuk saribuah nenas pada 9 0 OC hasilnya dapat berbeda 9 0 persen jika data viskositasnya pada suhu kamar ( 3 0 OC).4.1.2. Sifat Aliran dan Pendugaan WaMu Proses
Berdasarkan model ketergantungan viskositas terhadap suhu saribuah (persamaan 4-21 dapat diduga viskositas saribuah nenas untuk suhu 87, 90, 9 3 dan 9 6 OC