APRILIANA WAHYU HARTANTI
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI
Dengan ini saya menyatakan bahwa tesis Evaluasi Aktivitas Antidiare Isolat
Lactobacillus Dari Air Susu Ibu adalah karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, Agustus 2010
Apriliana Wahyu Hartanti
ABSTRACT
APRILIANA WAHYU HARTANTI. Evaluation on Anti-Diarrhea Activity of
Lactobacillus Isolates From Breast Milk. Under direction of LILIS NURAIDA and ENDANG PRANGDIMURTI
Some of Lactobacillus species isolated from breast milk are known to have anti-microbes activities, including against E. coli. Based on previous research, the isolates are also known to have good probiotic properties, such as ability to survive in acidic environment and bile salt resistant. The aims of this study were to evaluate the antimicrobial activity of Lactobacillus species isolated from breast milk against enteropathogenic E. coli strain (EPEC K1.1), and to evaluate the effectiveness of Lactobacillus isolates to prevent diarrhea on animal experiment. The present study was conducted in three stages. The first stage was the evaluation the antimicrobial activity of Lactobacillus isolates against EPEC K1.1 (using contact method). The second method was the determination of EPEC K1.1 infection dose to induce diarrhea without causing death of the experiment animal. The third stage was evaluation of effectiveness of Lactobacillus to prevent diarrhea on rats. Based on antimicrobial activity study there were three isolates of Lactobacilli with good inhibition against EPEC K1.1, they were L. rhamnosus
R14, L. rhamnosus R23, and L. rhamnosus B16 (R14, R23 and B16). The determination of EPEC dose shows that 108 cfu of EPEC K1.1 was sufficient to induce diarrhea on rat without causing death. Animal experiment indicated that
Lactobacillus isolates show an activity to prevent diarrhea, but Lactobacillus rhamnosus R23 had the best capabilities of preventing diarrhea in rats compared to two other isolates of Lactobacillus. The numbers of diarrhea rats and severity level in group treated with Lactobacillus were lower than on EPEC K1.1 control group. Count of E. coli on negative control group tend to stable whereas on EPEC K1.1 control group increased sharply at first day after administration of EPEC K1.1. Treatment of R14 and B16 isolate increased slightly the amount of E. coli at first day after administration of EPEC K1.1 and decreased until last period. Treatment of R23 isolate decreased the amount of E. coli at first day after administration of EPEC K1.1 and continuesly until last period. The count of
Lactobacillus on rat feces a long the evaluation period was sufficient to perform significant effect. Treament of Lactobacillus isolate increased the amount of
Lactobacillus in rat feces. This indicated that three Lactobacillus isolates could survive on the gastrointestinal track of rats. Based on result evaluation of treatment Lactobacillus and EPEC K1.1 isolate toward the amount of
Lactobacillus and E. coli on rats cecum and colon shows not significant effect. Based on this study it was concluded that the three Lactobacillus isolated from breast milk had good inhibition againts EPEC K1.1, but Lactobacillus rhamnosus
R23 had the best capabilities of preventing diarrhea in rats compared to two other isolates of Lactobacillus.
RINGKASAN
APRILIANA WAHYU HARTANTI. Evaluasi Aktivitas Antidiare Isolat
Lactobacillus dari Air Susu Ibu. Dibimbing oleh LILIS NURAIDA dan ENDANG PRANGDIMURTI.
Sebagian besar isolat Lactobacillus yang berasal dari air susu ibu (ASI) diketahui memiliki sifat antimikroba termasuk terhadap E. coli. Berdasarkan hasil penelitian sebelumnya, isolat-isolat tersebut mampu bertahan dalam lingkungan asam dan garam empedu sehingga menjadi kandidat probiotik. Penelitian ini bertujuan mengetahui aktivitas antimikroba isolat Lactobacillus asal ASI terhadap isolat E. coli patogenik (EPEC K1.1) dan mengetahui efektivitas isolat
Lactobacillus asal ASI untuk mencegah kejadian diare pada tikus percobaan serta untuk menentukan tiga isolat Lactobacillus asal ASI yang dapat mencegah diare pada tikus percobaan.
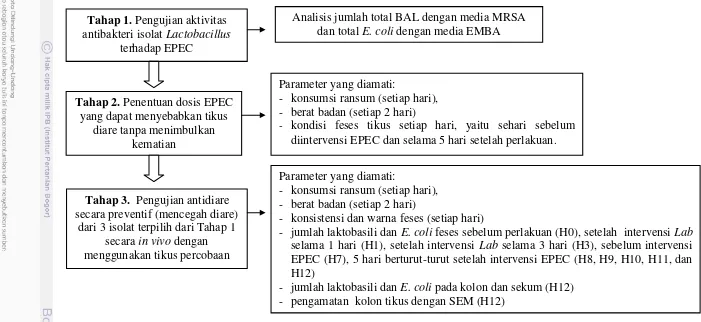
Penelitian mengenai aktivitas antidiare isolat Lactobacillus asal ASI ini dilakukan dalam tiga tahap. Tahap pertama adalah pengujian aktivitas antibakteri isolat Lactobacillus asal ASI terhadap EPEC K1.1 dengan metode kontak. Tahap kedua adalah pengujian dosis EPEC K1.1 yang dapat menimbulkan diare tanpa menimbulkan kematian yang dilakukan secara in vivo menggunakan tikus percobaan. Selanjutnya dosis yang diperoleh dari tahap dua dan tiga isolat
Lactobacillus terpilih dari tahap pertama yang memiliki penghambatan terbaik terhadap EPEC K1.1 diuji aktivitasnya sebagai antidiare dengan menggunakan tikus percobaan Sprague Dawely jantan berumur 28 hari.
Tahap pertama adalah pengujian aktivitas antimikroba Lactobacillus
terhadap EPEC K1.1 yang dilakukan dengan metode kontak. Pada awalnya jumlah bakteri yang dikontakkan adalah sebesar 106 cfu/ml untuk Lactobacillus
dan 105 cfu/ml untuk EPEC K1.1. Selanjutnya beberapa isolat Lactobacillus yang menunjukan penghambatan EPEC K1.1 yang relatif tinggi (menurunkan jumlah EPEC K1.1 sekitar 2 log cfu/ml) diuji kembali penghambatannya dengan jumlah
Lactobacillus yang dikontakkan lebih tinggi, yaitu sebesar 108 cfu/ml, untuk melihat apakah akan dihasilkan penghambatan yang lebih besar.
Pada tahap pengujian dosis dilakukan pemberian EPEC K1.1 dengan dosis 106 cfu, 107 cfu, dan 108 cfu dengan cara disonde sebanyak 1ml. Pada uji ini tikus percobaan terbagi dalam 4 kelompok, yaitu kelompok kontrol yang hanya diberikan larutan fisiologis (NaCl 0,85%), kelompok tikus yang diberi EPEC sebanyak 106 cfu, kelompok tikus yang diberi EPEC sebanyak 107 cfu, dan kelompok tikus yang diberi EPEC sebanyak 108 cfu. Pengamatan dilakukan terhadap feses tikus setiap hari selama lima hari setelah pemberian EPEC K1.1.
Pada tahap pengujian aktivitas antidiare secara in vivo, tikus dibagi menjadi 5 kelompok, yaitu kelompok tikus yang tidak diintervensi Lactobacillus maupun EPEC (kontrol negatif), kelompok tikus yang diintervensi EPEC tetapi tidak diintervensi isolat Lactobacillus (kontrol EPEC), dan tiga kelompok tikus yang diintervensi baik oleh EPEC maupun salah satu dari tiga jenis isolat Lactobacillus.
feses sebelum perlakuan (H0), setelah intervensi Lactobacillus selama 1 hari (H1), setelah intervensi Lactobacillus selama 3 hari berturut-turut (H3), sebelum intervensi EPEC (H7), 5 hari berturut-turut setelah intervensi EPEC (H8, H9, H10, H11, dan H12), jumlah laktobasili dan E. coli pada kolon dan sekum (H12), pengamatan kolon tikus dengan SEM (H12).
Dari pengujian aktivitas antimikroba Lactobacillus terhadap EPEC K1.1 yang dilakukan dengan metode kontak diperoleh tiga isolat dengan nilai penghambatan tertinggi terhadap EPEC K1.1, yaitu isolat L. rhamnosus R14, L. rhamnosus R23, dan L. rhamnosus B16 yang mampu menghambat perumbuhan EPEC K1.1 sekitar 3 log cfu/ml. Ketiga isolat tersebut dan digunakan dalam pengujian aktivitas antidiare dengan tikus percobaan.
Berdasarkan hasil pengujian dosis EPEC K1.1 yang dapat menimbulkan diare tanpa menimbulkan kematian, diperoleh bahwa pada kelompok tikus yang diberi EPEC dengan dosis 108 cfu terdapat jumlah tikus yang mengalami diare lebih banyak dibandingkan kelompok lainnya. Dengan demikian, dosis EPEC K1.1 yang digunakan dalam pengujian aktivitas antidiare dengan tikus percobaan adalah 108 cfu.
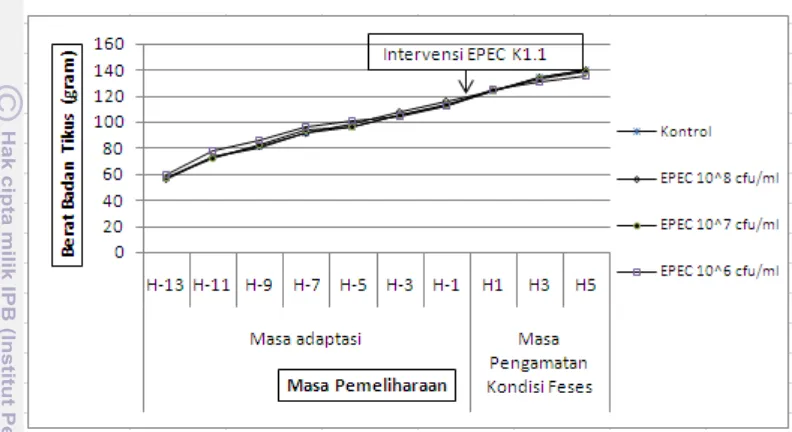
Hasil pengujian pengaruh intervensi isolat Lactobacillus terhadap kejadian diare akibat infeksi EPEC K1.1 menunjukkan manfaat pencegahan diare akibat infeksi EPEC K1.1 oleh konsumsi isolat Lactobacillus. Pada kelompok kontrol EPEC K1.1 terdapat tiga ekor tikus yang mengalami diare pada hari pertama setelah intervensi EPEC dan satu ekor tikus diare pada hari kedua setelah intervensi EPEC. Pada kelompok tikus perlakuan isolat R23 tidak terdapat satu ekor tikuspun yang mengalami diare. Pada kelompok tikus perlakuan isolat R14 terdapat satu ekor tikus yang mengalamai diare pada hari ketiga dan dua ekor tikus pada hari keempat setelah intervensi EPEC, sedangkan pada kelompok tikus perlakuan isolat B16 terdapat dua ekor tikus yang mengalami diare pada hari pertama setelah intervensi EPEC, meskipun diare yang terjadi pada kelompok tikus perlakuan isolat Lactobacillus memiliki tingkat keparahan yang lebih rendah dibandingkan dengan tikus kelompok control EPEC. Gejala diare yang ditimbulkan oleh infeksi EPEC K1.1 tidak menyebabkan penurunan berat badan tikus meskipun dapat sedikit menurunkan tingkat konsumsi ransum tikus.
Jumlah E. coli pada feses tikus selama masa pengujian aktivitas pencegahan diare oleh isolat Lactobacillus cukup menunjukkan perbedaan yang berarti. Pada kelompok kontrol negatif jumlah E. coli relatif stabil meski ada sedikit kenaikan dan penurunan. Jumlah E. coli pada kelompok kontrol EPEC terjadi kenaikan yang sangat tajam pada hari pertama setelah intervensi EPEC (kenaikan 0,83 log cfu/g) dan mengalami penurunan sampai 1,23 log cfu/g hingga akhir pengujian. Pada kelompok perlakuan isolat Lactobacillus rhamnosus R14 terjadi sedikit kenaikan jumlah E. coli pada hari pertama setelah intervensi EPEC (kenaikan 0,45 log cfu/g) dan mengalami penurunan sampai 0,67 log cfu/g hingga akhir pengujian. Pada kelompok perlakuan isolat Lactobacillus rhamnosus R23 jumlah
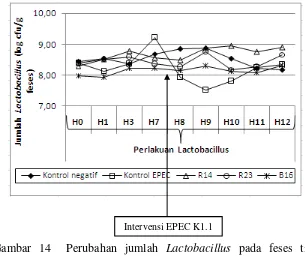
Jumlah Lactobacillus pada feses tikus selama masa pengujian aktivitas pencegahan diare oleh isolat Lactobacillus cukup menunjukkan perbedaan yang berarti. Pada kelompok kontrol negatif jumlah Lactobacillus cenderung stabil. Pada kelompok kontrol EPEC jumlah Lactobacillus mengalami penurunan yang cukup drastis terutama pada H1, H2, dan H3 setelah intervensi EPEC K1.1. Sedangkan pada kelompok perlakuan isolat Lactobacillus, jumlah Lactobacillus
cenderung stabil bahkan terdapat sedikit kenaikan. Hal ini mengindikasikan bahwa ketiga isolat Lactobacillus dapat bertahan dalam saluran pencernaan.
Dari hasil pengujian pengaruh perlakuan isolat Lactobacillus dan EPEC K1.1 terhadap jumlah Lactobacillus pada sekum dan kolon tikus tampak bahwa jumlah Lactobacillus pada sekum tikus hampir sama dengan jumlah Lactobacillus
pada kolon tikus (perbedaan tidak signifikan), baik antara kelompok kontrol maupun kelompok perlakuan isolat Lactobacillus, meskipun sebagian besar kelompok memiliki jumlah Lactobacillus yang lebih tinggi di dalam sekum dibandingkan di dalam kolon, kecuali pada kelompok tikus yang diintervensi EPEC K1.1 dan isolat Lactobacillus rhamnosus R23 yang memiliki jumlah
Lactobacillus di dalam kolon sedikit lebih tinggi dibandingkan di dalam sekum. Dari hasil pengujian pengaruh perlakuan isolat Lactobacillus dan EPEC K1.1 terhadap jumlah E. coli pada sekum dan kolon dapat terlihat bahwa jumlah
E. coli pada kelompok perlakuan isolat Lactobacillus cenderung lebih rendah dibandingkan dengan kelompok kontrol negatif maupun kelompok kontrol EPEC pada sekum dan kolon. Hal ini berkorelasi dengan tingginya jumlah Lactobacillus
dalam sekum pada kelompok perlakuan, yang berarti bahwa Lactobacillus
tersebut dapat menekan jumlah E. coli dalam sekum.
Dari penelitian aktivitas antidiare isolat Lactobacillus asal ASI yang telah dilakukan dapat disimpulkan bahwa terdapat tiga isolat Lactobacillus asal ASI yang bersifat antibakteri terhadap EPEC K1.1, yaitu L. rhamnosus R14, L. rhamnosus R23, dan L. rhamnosus B16. Akan tetapi, isolat Lactobacillus rhamnosus R23 merupakan isolat yang dapat mencegah terjadinya diare secara sempurna pada tikus percobaan, meskipun kedua isolat BAL lain juga cukup dapat mencegah terjadinya diare. Hal ini juga sejalan dengan kemampuan isolat L. rhamnosus R23 dalam menurunkan jumlah E. coli pada feses tikus kelompok perlakuan jika dibandingkan dengan kelompok control EPEC dan dua kelompok perlakuan isolat Lactobacillus lainnya.
© Hak Cipta milik IPB, tahun 2010
Hak Cipta dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB.
EVALUASI AKTIVITAS ANTIDIARE ISOLAT
Lactobacillus DARI AIR SUSU IBU
APRILIANA WAHYU HARTANTI
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Program Studi Ilmu Pangan
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Judul Tesis : Evaluasi Aktivitas Antidiare Isolat Lactobacillus Dari Air Susu
Nama : Apriliana Wahyu Hartanti
NRP : F251080121
Disetujui
Komisi Pembimbing
Dr. Ir. Lilis Nuraida, M.Sc. Dr. Ir. Endang Prangdimurti, M.Si.
Ketua Anggota
Diketahui
Ketua Program Studi Dekan Sekolah Pascasarjana Ilmu Pangan
Dr. Ir. Ratih Dewanti, M.Sc. Prof. Dr. Ir. Khairil A. Notodiputro, M.S.
PRAKATA
Segala puji bagi Allah SWT atas karunia dan rahmatNya-lah sehingga
penulis dapat menyelesaikan tesis dengan judul “Evaluasi Aktivitas Antidiare Isolat Lactobacillus Dari Air Susu Ibu” ini. Tesis ini dibuat sebagai salah satu
syarat bagi mahasiswa pascasarjana program S2 untuk meraih gelar Megister
Sains pada Program Studi Ilmu Pangan, Institut Pertanian Bogor.
Pada kesempatan ini penulis menyampaikan penghargaan dan ucapan terima
kasih kepada Dr. Ir. Lilis Nuraida, MSc selaku ketua komisi pembimbing atas
segala waktu, pikiran, dan saran yang diberikan selama proses pembimbingan.
Kepada Dr. Ir. Endang Prangdimurti, MSi selaku anggota komisi pembimbing,
kami ucapkan terima kasih atas segala waktu, pikiran, dan saran yang telah
diberikan kepada kami, sehingga tesis ini dapat diselesaikan. Ucapan terima kasih
juga penulis sampaikan kepada Prof. Dr. Ir. Winiati Pudji Rahayu, M.S. atas
kesediaannya sebagai dosen penguji luar komisi dalam ujian tesis.
Ucapan terima kasih juga penulis sampaikan kepada DIKTI yang telah
mendanai penelitian ini melalui Hibah Kompetitif Penelitian Sesuai Prioritas
Nasional Tahun 2009, sehingga penelitian dapat berjalan lancar. Kepada Dr. dr.
Sri Budiarti dari Lab. Bioteknologi Hewan dan Biomedis, Pusat Penelitian
Bioteknologi IPB, penulis ucapkan terima kasih atas kesediaan untuk memberikan
koleksinya berupa isolat E. coli Enteropatogenik K.1.1 (EPEC K.1.1) sebagai
bakteri uji pada penelitian ini. Kepada SEAFAST Center IPB, penulis ucapkan
terima kasih atas bantuan fasilitas yang diberikan selama penelitian ini
berlangsung. Kepada Lembaga Ilmu Pengetahuan Indonesia (LIPI) Cibinong yang
telah memberikan bantuan kepada penulis dalam menyelesaikan pengamatan
menggunakan Scanning Electron Microscope (SEM). Kepada Mbak Hana,
penulis juga ucapkan terima kasih atas segala bantuan, masukan, dan saran yang
diberikan selama penelitian berlangsung.
Kepada bapak dan ibu tercinta, terima kasih atas doa yang tulus, semangat,
dan nasihat yang diberikan kepada penulis. Terima kasih juga penulis ucapkan
kepada Mbak Maya dan Dek Tria tercinta yang selalu memberikan segala kritik,
kepada Dwi Suprastyo atas segala doa, semangat, dan nasihat yang diberikan pada
penulis.
Kepada Mbak Dhenok, Mbak Ari, Sofah, Yeris, dan rekan-rekan di
SEAFAST Center IPB yang tidak bisa disebutkan satu persatu, penulis ucapkan
terima kasih atas segala bantuan, dukungan, semangat, dan waktu yang
diluangkan untuk berdiskusi selama penulis melakukan penelitian dan penyusunan
tesis ini. Kepada rekan-rekan IPN 2008, penulis ucapkan terima kasih atas segala
kebersamaan yang telah memberikan semangat tak terlupakan bagi penulis.
Semoga Allah SWT memberikan balasan yang berlipat ganda dan semoga
penelitian ini dapat memberi manfaat.
Bogor, Agustus 2010
RIWAYAT HIDUP
Penulis dilahirkan di Lumajang pada tanggal 10 April 1985 dari pasangan
Ir. Siyari Suhartono dan Sri Hardini. Penulis menghabiskan masa kanak-kanaknya
di TK Sekar Indah Batang. Penulis melanjutkan belajarnya di SDN Kauman 07
Batang, kemudian di SLTPN 3 Batang, dan SMUN 1 Batang. Penulis melanjutkan
pendidikannya di Institut Pertanian Bogor, Departemen Ilmu dan Teknologi
Pangan, lulus pada tahun 2007.
Pada tahun 2007-2008 penulis bekerja sebagai staf Research and
Development di PT. Adijaya Guna Satwatama-JAPFA FOOD Cirebon. Pada
September 2008 penulis melanjutkan studi S2 di Institut Pertanian Bogor,
Program studi Ilmu Pangan. Sebagai syarat untuk memperoleh gelar Magister
Sains, penulis menyelesaikan tesisnya dengan judul Evaluasi Aktivitas Antidiare
DAFTAR ISI
D. Probiotik dan Peranannya dalam Mencegah Diare ... 12
E. Bakteri Asam Laktat Asal Air Susu Ibu (ASI) ... ... 17
2. Pengujian Aktivitas Antibakteri Lactobacillus terhadap E. coli Enteropatogenik (EPEC)... 24
3. Penentuan dosis E.coli yang Menyebabkan Tikus Diare... 24
4. Pengujian Aktivitas Antidiare Isolat Lactobacillus asal ASI ... . 26
a. Pengambilan dan Persiapan Sampel Feses Tikus... 28
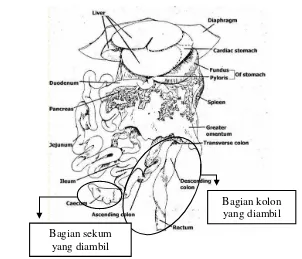
b. Pengambilan dan Persiapan Sampel Sekum dan Kolon... 28
c. Penghitungan Jumlah Laktobasili dan E. coli pada Feses, Sekum, dan Kolon Tikus... 29
d.Preparasi Spesimen Kolon Untuk Analisis SEM (Scanning Electron Microscope ... 30
e. Pewarnaan Gram Isolat Bakteri ... 30
IV. HASIL DAN PEMBAHASAN A. Pengujian Aktivitas Antibakteri Lactobacillus terhadap E.coli Enteropatogenik (EPEC) ... 32
B. Penentuan Dosis E. coli Patogenik yang Menyebabkan Tikus Diare ... 36
Berat Badan dan Konsumsi Ransum Tikus ………... 43 3. Pengaruh Perlakuan Isolat Lactobacillus dan EPEC K1.1
terhadap Jumlah E. coli pada Feses Tikus ... 44 4. Pengaruh Perlakuan Isolat Lactobacillus dan EPEC K1.1
terhadap Jumlah Lactobacillus pada Feses Tikus ………. 46 5. Pengaruh Perlakuan Isolat Lactobacillus dan EPEC K1.1
terhadap Jumlah Lactobacillus pada Sekum, Kolon, dan
Feses Tikus pada Akhir Masa Pengujian ……….. 48 6. Pengaruh Perlakuan Isolat Lactobacillus dan EPEC K1.1
terhadap Jumlah E. coli pada Sekum, Kolon, dan
Feses Tikus pada Akhir Masa Pengujian ……….. 52 7. Pengaruh Perlakuan Isolat Lactobacillus dan EPEC K1.1
terhadap Kondisi Mikrobiota Kolon Tikus ………... 56
V. KESIMPULAN DAN SARAN………... 61
DAFTAR PUSTAKA ... 63
DAFTAR TABEL
Halaman
1. Faktor yang mengontrol komposisi flora bakteri usus ... 6
2. Komposisi ransum yang digunakan dalam penelitian ……….... 22
3. Perlakuan tikus percobaan selama pengujian antidiare preventif ... 28
4. Hasil uji dosis EPEC K1.1 yang menyebabkan tikus diare ………... 37
5. Pengaruh intervensi isolat Lactobacillus terhadap kejadian diare akibat infeksi EPEC K1.1 ……….. 41
6. Hasil pengujian pengaruh perlakuan isolat Lactobacillus dan EPEC K1.1 terhadap jumlah Lactobacillus pada sekum, kolon, dan feses tikus pada H12 ……….. 49
DAFTAR GAMBAR
Halaman
1. Skema kerusakan mikrovili usus oleh EPEC ………... 10
2. Diagram alir tahapan penelitian antidiare Lactobacillus asal ASI ... 23
3. Skema Perlakuan dan Pengamatan Dalam Uji Dosis EPEC ... 25
4. Skema Perlakuan dan Pengamatan Dalam Uji Aktivitas Antidiare ... 27
5. Skema saluran pencernaan tikus ……….. 29
6. Penurunan jumlah EPEC K1.1 oleh 19 isolat Lactobacillus asal ASI selama 24 jam ………. 32 7. Penurunan jumlah EPEC K1.1 oleh 5 isolat Lactobacillus asal ASI selama 24 jam ………. 33
8. Penggolongan feses berdasarkan kondisi fisik ……… 36
9. Pertambahan berat badan tikus selama pengujian dosis EPEC K1.1 yang menyebabkan tikus diare ……… 39
10. Jumlah ransum yang dikonsumsi tikus selama pengujian dosis EPEC K1.1 yang menyebabkan diare ……….. 40
11. Pertambahan berat badan tikus selama pengujian aktivitas antidiare ….. 44
12. Jumlah ransum yang dikonsumsi tikus selama pengujian aktivitas antidiare ……… 44
13. Perubahan jumlah E. coli pada feses tikus pada kelompok kontrol negatif, kontrol EPEC, perlakuan isolat Lactobacillus rhamnosus R14, Lactobacillus rhamnosus R23, dan Lactobacillus rhamnosus B16 ... 45
14. Perubahan jumlah Lactobacillus pada feses tikus pada kelompok kontrol negatif, kontrol EPEC, perlakuan isolat Lactobacillus rhamnosus R14, Lactobacillus rhamnosus R23, dan Lactobacillus rhamnosus B16 ... 47
15. Kondisi mikrobiota kolon tikus pada akhir masa pengujian aktivitas antidiare dengan Scanning Electron Microscope Model –JSM 5310 LV menggunakan perbesaran 10000x ……….. 57
dari pewarnaan Gram beberapa isolat yang digunakan
dalam pengujian aktivitas antidiare ………. 58
17. Hasil pewarnaan Gram isolate EPEC K1.1 dan Lactobacillus
DAFTAR LAMPIRAN
Halaman
1. Metode Perhitungan Ransum Standar ……… 70
2. Perhitungan Komposisi Ransum Standar ……… 71
3. Kondisi feses tikus selama masa pengujian dosis EPEC K1.1 ………... 72
4. Kondisi feses tikus selama masa pengujian aktivitas antidiare ………. 73
5. Hasil analisis ragam jumlah Lactobacillus dalam sekum tikus ………... 74
6. Hasil analisis ragam jumlah Lactobacillus dalam kolon tikus ………… 75
7. Hasil analisis ragam jumlah Lactobacillus dalam feses tikus …………. 76
8. Hasil analisis ragam jumlah Lactobacillus dalam sekum, kolon, dan feses tikus ………... 77
9. Hasil analisis ragam jumlah E. coli dalam sekum tikus ………... 78
10. Hasil analisis ragam jumlah E. coli dalam kolon tikus ……….. 79
11. Hasil analisis ragam jumlah E. coli dalam feses tikus ………... 80
A. Latar Belakang
Diare masih merupakan salah satu masalah kesehatan utama di Indonesia.
Penyakit ini tidak dapat dianggap sepele dengan banyaknya kematian yang terjadi
terutama pada bayi dan balita, serta seringnya menimbulkan kejadian luar biasa
(KLB). Diare dan gastroentritis karena infeksi tertentu menjadi urutan pertama
penyebab rawat inap di rumah sakit Indonesia, bahkan pada tahun 2006 penyakit
ini menempati urutan ke-3 penyakit utama penyebab kematian di rumah sakit di
Indonesia setelah stroke dan perdarahan intrakranial (Depkes RI 2008).
Di negara-negara berkembang, penyakit diare pada anak-anak disebabkan
oleh berbagai macam patogen seperti Escherichia coli, Shigella, Vibrio cholerae,
Salmonella, dan termasuk rotavirus (Semba 2002). Laporan Dirjen P2M & PLP
DepKes RI tahun l984 menyebutkan bahwa propinsi Jawa Barat merupakan
daerah dengan jumlah kasus diare terbesar dibandingkan dengan propinsi lainnya
di Indonesia. Daerah lain di Indonesia yang memiliki prevalensi cukup tinggi
terhadap diare adalah Jakarta yang disebabkan oleh infeksi bakteri E. coli patogen
sebanyak 12,2%, V. parahaemlyticus sebanyak 1,6%, Campylobacter sebanyak
1,2%, Vibrio cholera sebanyak 0,8%, Shigella sebanyak 0,6%, Salmonella
sebanyak 4,0%; terlihat bahwa penyebab terbesar adalah E. coli patogen. Untuk
daerah Yogyakarta infeksi enterobakteri patogen pada penderita diare anak terdiri
dari V. cholera, Salmonella, Shigella dan E. coli patogen. Dirjen PP & PL DepKes
RI tahun 2008 menyatakan bahwa pada tahun 2007 propinsi Jawa Timur memiliki
kasus diare terbesar dengan 1.468 penderita dan 8 kematian, disusul dengan
propinsi Banten dengan 1.057 penderita dan 3 kematian, sedangkan propinsi Jawa
Barat pada tahun 2007 tidak diketahui terdapat kasus diare pada masyarakatnya.
Sebagian besar kejadian diare pada masyarakat ini disebabkan oleh adanya infeksi
bakteri (Depkes RI 2008).
Kondisi dan fungsi saluran pencernaan yang sehat sangat penting bagi
kehidupan manusia. Sistem pertahanan tubuh sepanjang saluran ini sangat penting
dalam tubuh. Mikrobiota dalam saluran percernaan ini amat penting dalam
pencegahan penyakit, khususnya infeksi. Beberapa waktu belakangan ini terapi
intervensi bakteri probiotik untuk masalah infeksi maupun penyakit lainnya
semakin mendapat perhatian untuk terus diteliti dan dikembangkan. Bengmark
(1998) menyebutkan bahwa WHO merekomendasikan pengembangan berbagai
pendekatan yang dapat mengurangi penggunaan antibiotik untuk mengatasi
infeksi, termasuk diantaranya penggunaan intervensi bakteri probiotik. Hal ini
berkaitan dengan meningkatnya kejadian resistensi terhadap antibiotik. Muncul
kekhawatiran bahwa pengembangan antibiotik oleh pihak industri tidak akan
mampu menyaingi kecepatan timbulnya resistensi mikroba. Bengmark (1998)
juga menyebutkan bahwa kerentanan akibat perubahan komposisi flora (yang
disebabkan oleh antibiotik) turut meningkatkan perhatian terhadap metode
intervensi mikroba dalam melawan infeksi.
Bakteri probiotik kini semakin diakui secara efektif dapat mengontrol
pertumbuhan mikroorganisme yang berpotensi patogen dan dapat menyebabkan
diare. Bakteri probiotik diketahui dapat mengontrol berbagai bakteri patogen
enterik, seperti Salmonella typhimurium, Shigella, Clostridium difficile,
Campylobacter jejuni dan Escherichia coli (Bengmark 1998). Selain itu berbagai
penelitian juga telah menunjukkan potensi isolat bakteri asam laktat untuk
mengurangi kejadian diare, baik yang disebabkan oleh infeksi bakteri patogen,
virus, maupun diare yang disebabkan oleh konsumsi antibiotik (Heyman &
Menard 2002).
ASI (Air Susu Ibu) merupakan sumber isolat probiotik karena mengandung
glikoprotein dan bifidogenic factor berupa N-acetylglucosamine yang dapat
menunjang pertumbuhan BAL, khususnya Bifidobakteria (Salminen et al. 2004).
Bifidobacterium ditemukan pertama kali pada tahun 1889 oleh Tissier sebagai
bakteri yang mendominasi saluran usus bayi yang meminum ASI (Holzapfel
2006). Kelebihan lain yang dimiliki probiotik dari ASI adalah penerimaan
konsumen yang lebih baik daripada probiotik yang berasal dari sumber lain
(hewan, feses).
FAO/WHO (2002) juga menyebutkan bahwa salah satu kriteria suatu
mikroorganisme tersebut berasal dari spesies yang sama dengan inang yang
ditujukan sebagai pengguna probiotik tersebut. Dengan demikian, isolat
Lactobacillus yang berasal dari ASI menjadi sangat potensial untuk lebih lanjut
dikembangkan sebagai produk fungsional probiotik bagi konsumsi manusia.
Potensi dan keunggulan ASI tersebut dijadikan sebagai pertimbangan untuk
melakukan isolasi bakteri probiotik. Nuraida et al. (2008) telah mengisolasi
bakteri asam laktat (BAL) dari Air Susu Ibu (ASI) yang sebagian besar berpotensi
sebagai probiotik. Sebagian besar isolat menunjukkan ketahanan yang baik
terhadap asam lambung dan atau garam empedu serta dapat menghambat
pertumbuhan bakteri patogen. Pada penelitian ini akan diuji potensi aktivitas
antidiare beberapa isolat Lactobacillus asal air susu ibu melalui pengujian in vivo
menggunakan tikus percobaan.
B. Tujuan
Penelitian ini bertujuan untuk:
1. Mengetahui aktivitas antimikroba isolat Lactobacillus asal ASI terhadap
isolat E. coli patogenik (EPEC K1.1).
2. Mengetahui efektivitas isolat Lactobacillus asal ASI untuk mencegah
kejadian diare pada tikus percobaan.
C. Hipotesis
Isolat Lactobacillus dari Air Susu Ibu (ASI) memiliki aktivitas antimikroba
terhadap enteropatogenik E. coli baik secara in vitro maupun in vivo. Melalui
aktivitasnya sebagai antimikroba ini, isolat Lactobacillus dari ASI diduga dapat
II TINJAUAN PUSTAKA
A. Mikrobiota Usus dan Perlindungan terhadap Infeksi
Usus merupakan sebuah ekosistem kompleks yang terdiri atas tiga
komponen yang saling berhubungan yaitu sel inang, nutrisi, dan mikrobiota.
Fungsi usus antara lain untuk proses pencernaan makanan, penyerapan zat gizi,
dan pertahanan terhadap serangan dari luar. Komponen pertahanan usus terdiri
atas 3 jenis yaitu mikrobiota, mucosal barrier, dan sistem imun lokal (Bourlioux
et al. 2002).
Manusia mulai memiliki mikrobiota usus sejak dilahirkan dari kandungan.
Janin hidup dan tumbuh dalam kondisi steril dalam kandungan. Janin akan
terekspos oleh mikroba yang berasal dari saluran genital, feses, mikroba kulit
ibunya, dan lingkungan setelah dilahirkan. Mikrobiota usus ini terdiri dari
bermacam-macam mikroba yang memiliki fungsi penting bagi inangnya (Brassart
& Schiffrin 2000).
Di dalam usus manusia terdapat sekitar 100 spesies dan sekitar 1014 bakteri
merupakan mikrobiota usus. Berat keseluruhan bakteri-bakteri tersebut dapat
mencapai 1-1,5 kg atau 1/50 sampai 1/60 berat tubuh orang dewasa. Mikrobiota
usus dapat tumbuh pada kondisi anaerob dan berkoloni pada bagian-bagian
tertentu dari sistem pencernaan manusia (Yughuci et al. 1992). Fungsi utama dari
mikrobiota usus yaitu aktivitas metaboliknya yang menyebabkan penyimpanan
energi dan nutrisi, efek nutrisi bagi epitel usus, dan perlindungan atas inang
terhadap serangan bakteri merugikan (Harish & Varghese 2006).
Peranan mikrobiota usus dapat dibagi dua yaitu yang aktivitasnya
menguntungkan dan merugikan. Bifidobakteria, Lactobacillus spp. dan Eubacteria
hanya memiliki aktivitas menguntungkan sedangkan Clostridium perfingens,
Veillonella spp., dan Proteus spp. hanya memiliki efek merugikan. Beberapa
bakteri usus memiliki sifat menguntungkan maupun merugikan, contohnya adalah
Bacteroides, Streptococcus spp., Escherichia coli, serta Enterococcus (Yughuchi
Bakteri yang merugikan dalam usus dapat menghasilkan senyawa-senyawa
karsinogen, toksin, NH3, H2S, amin, serta fenol. Berbagai pengaruh buruk yang
dapat ditimbulkannya adalah penyakit-penyakit seperti diare, konstipasi,
kerusakan hati, penurunan kekebalan, kanker, hipertensi, dan sebagainya
(Yughuchi et al. 1992). Sedangkan bakteri asam laktat sebagai salah satu
mikrobiota normal manusia mempunyai peran yang menguntungkan bagi
kesehatan manusia yaitu untuk mencegah infeksi usus yang diakibatkan oleh
bakteri enterik patogen dan infeksi pada saluran urogenital, mencegah intoleransi
laktosa dan pertumbuhan kanker/tumor usus, dan untuk menstimulasi sistem imun
dan gerakan usus (Yuguchi et al. 1992).
Lima kelompok utama bakteri yang terdapat pada saluran pencernaan
mamalia normal adalah Lactobacillus, Enterococcus, Bacteriodes,
Enterobacteriaceae, serta kelompok bakteri Gram positif yang anaerob dan tidak
berspora. Pada bagian jejunum, kelima kelompok tersebut memiliki jumlah yang
relatif sama sekitar 102-103 cfu/g. Jumlah bakteri pada bagian jejunum relatif
rendah karena lokasinya paling dekat dengan sekresi garam empedu. Pada bagian
ileum mulai terjadi pertumbuhan bakteri. Jumlah bakteri di dalam ileum sekitar
102 cfu/g (kelompok Gram positif) sampai 105 cfu/g (Lactobacillus dan
Enterococcus). Jumlah di dalam kolon dapat mencapai 106-107 cfu/g dan
didominasi oleh Enterococcus dan Bacteroides (Salminen & Wright 1998). Kolon
merupakan ekosistem yang sarat dengan kolonisasi mikrobiota yang dapat
mencapai 50 genera bakteri sehingga usus besar menjadi bagian tubuh dengan
aktivitas metabolik paling tinggi. Diperkirakan 95% dari semua sel hidup dalam
tubuh manusia adalah bakteri usus besar (Gibson 2000). Sedangkan jumlah
bakteri akhir di dalam feses didominasi oleh Bacteroides (109 cfu/g) (Salminen et
al. 2004).
Pada manusia dewasa yang sehat, mikrobiota usus berada dalam
keseimbangan walaupun terdapat perbedaan antara individu yang satu dengan
individu yang lain. Komposisi mikrobiota usus berubah seiring meningkatnya
umur seseorang. Pada bayi, Bifidobacterium spp. merupakan bakteri yang paling
dominan. Pada saat bayi disapih, beberapa bakteri anaerob seperti Bacteroidaceae,
Pada periode tersebut, Bifidobacterium spp. akan semakin menurun jumlahnya
sedangkan Clostridium perfringens, Escherichia coli, Streptococcus spp., serta
Lactobacillus semakin meningkat jumlahnya (Mizutani 1992).
Mitsuoka (1990) menyatakan bahwa perubahan yang terjadi pada mikroflora
disebabkan oleh berbagai faktor, antara lain bertambahnya usia, stres, konstipasi,
dan diare. Salminen dan Wright (1998) menyatakan komposisi mikroflora usus
pada lokasi spesifik ditentukan oleh lingkungan fisik (gerakan usus) dan
lingkungan kimia (perubahan pH). L. acidophilus, L. reuteri, dan Bifidobacteria
merupakan mikroba yang dominan terdapat pada flora bayi yang diberi ASI,
sedangkan bayi yang diberi susu formula memiliki flora yang lebih beragam
meliputi Bifidobacteria, mikroba aerobik dan anaerobik (Mitsuoka 1990).
Menurut Hill (1998) terdapat beberapa faktor yang mengontrol komposisi
flora bakteri usus, dapat dilihat pada Tabel 1.
Tabel 1 Faktor yang mengontrol komposisi mikrobiota usus (Hill 1998)
Fisikokimia pH
Potential oksidasi-reduksi
Tekanan oksigen
Suplai nutrisi
Interaksi inang-bakteri Saliva
Cairan empedu
Sekresi asam lambung
Sekresi pankreatik
Sistem imun
Interaksi
mikroba-mikroba
Bacteriophage
Bakteriosin
Toksik metabolit
Kemampuan mikrobiota usus dalam mencegah infeksi patogen diantaranya
melalui kompetisi nutrisi, memanfaatkan musin dan polisakarida dari bahan
pangan yang mikroba dari luar tidak dapat memanfaatkannya. Mikrobiota usus
menurunkan keasaman usus, menghasilkan bakteriosin, mempercepat
mengeluarkan kotoran dengan menstimulir motalitas dan juga menstimulir
imunitas usus (Surono 2004).
Sebagai saluran pencernaan, usus memiliki aktivitas imunologis yang sangat
tinggi. Usus dilapisi oleh suatu membran mukosa yang dilindungi oleh lapisan
musin yang dihasilkan oleh sel-sel goblet. Musin bertindak sebagai pelumas yang
melindungi kerusakan membran mukosa dari makanan dan partikel-partikel lain
serta berperan sebagai penghalang bakteri sebelum mencapai membran mukosa.
Membran mukosa mempunyai sistem imun spesifik. Dikenal dua sistem imun
pada membran mukosa, yaitu Gastrointestinal-Associated Lymphoid Tissue
(GALT), yang tidak dimiliki oleh semua permukaan dan Mucosa-Associated
Lymphoid Tissue (MALT). MALT merupakan pusat perlindungan kolonisasi
bakteri dan infeksi pada tahap awal. Aktivitas MALT menghasilkan antibodi sIgA
(imunoglobulin A sekretori). Selain sebagai penghalang, musin juga
menghasilkan substansi yang dapat membunuh bakteri dan menghambat
pertumbuhannya, diantaranya adalah lisozim (Salyer & Whitt 1994).
Bila bakteri melekat pada permukaan mukosa usus, bakteri akan berhadapan
dengan sel-sel imunitas. Bakteri akan didegradasi oleh makrofag dan
menghasilkan reruntuhan (debris) yang akan dikeluarkan oleh makrofag, dan
fragmen peptida dari protein bakteri akan ditransfer ke permukaan makrofag.
Selanjutnya akan dibentuk kompleks peptida-MHC (Major Histocompatibility
Complex). Kompleks ini akan menstimulasi sel T helper yang akan menstimulasi
sel B untuk membentuk antibodi (Bellanti 1995).
B. Enteropatogenik Escherichia coli (EPEC)
Escherichia coli termasuk genus Escherichia dan famili Enterobacteriaceae.
Bakteri ini berbentuk batang, berukuran lebar 1.1-1.5 mikron dan panjang 2.0-6.0
mikron, terdapat dalam bentuk berpasangan atau tunggal, bersifat motil dengan
flagela peritrikat atau non motil (Buchanan & Gibbons 1974).
Bakteri ini merupakan bakteri Gram negatif yang bersifat anaerobik
fakultatif (Fardiaz 1989). Pada kondisi aerobik, bakteri ini dapat menggunakan
mekanisme reaksi. Pada keadaan anaerobik, bakteri memfermentasi gula melalui
jalur glikolisis. Produk akhir glikolisis, yaitu asam piruvat, dipecah menjadi asam
laktat, asetat, dan format. Sebagian dari asam format akan dipecah oleh enzim
format hidrogeniliase menjadi CO2 dan H2 (VanDemark & Batzing 1987).
Menurut modifikasi bagan Kauffman, serotipe E. coli dibagi berdasarkan
profil antigen permukaan O (somatic), H (flagellar), dan K (capsular)-nya
(Nataro & Kaper 1998). Totalnya terdapat 170 antigen O yang berbeda dimana
masing-masing didefinisikan sebagai satu serogrup. Analisis serotipe ini yang
dijadikan fektor virulensi spesifik untuk identifikasi strain E. coli penyebab diare.
Antigen O dan K merupakan polisakarida yang melindungi mikroba dari efek
bakterisidal dari komplemen dan sel fagosit pada kondisi tidak adanya antibodi
spesifik (Gross 1995).
EPEC (Enteropatogenik E. coli) merupakan salah satu penyebab diare yang
paling banyak di beberapa negara selain lima strain E. coli lain, yaitu
enterotoxigenic E. coli (ETEC), enterohemorrhagic E. coli (EHEC),
enteroaggregative E. coli (EAEC), enteroinvasive E. coli (EIEC), dan diffusely E.
coli (DAEC), serta beberapa bakteri lain seperti Shigella, Vibrio cholerae,
Salmonella, dan termasuk rotavirus (Semba 2002). Pada suatu outbreak diare
terjadi pada 32 anak berumur kurang dari 2 tahun di daerah tropis Australia Utara
dan teridentifikasi kurang lebih 59% kejadian diare tersebut disebabkan oleh
enteropatogenik E. coli di samping patogen lain yang ditemukan, yaitu Salmonella
spp. (16%), Campylobacter spp. (3%), Giardia (3%), dan Shigella spp (3%)
(Barlow et al. 1999).
Pada kurun waktu 8 sampai 13 Juli 2007, suatu outbreak gastroenteritis akut
terjadi pada 117 orang (anak-anak dan dewasa) di suatu perkemahan Romania
yang diinvestigasi oleh Constanta District Public Health Authority (CDPHA).
Kompleks perkemahan tersebut memiliki kapasitas 4,200 orang dan empat kantin.
Dari beberapa sampel feses yang diuji memberikan hasil positif akan keberadaan
EPEC dan Salmonella enteridis (Ibram et al. 2007).
EPEC adalah salah satu dari kelas patogen yang dapat menyebabkan lesi
attaching dan effacing (A/E) pada sel usus. Ciri dari patogen A/E adalah terletak
mikrofili usus. EPEC melekat dan berkolonisasi pada epitel mukosa duodenum
dan proximal jejunum. Menimbulkan kerusakan pada epitel jejunal melalui
pembentukan mikrokoloni yang ditunjukkan dengan pelekatan yang terlokalisasi
(Moat et al. 2002).
EPEC dapat menyebabkan diare pada bayi yang berumur di bawah 2 tahun.
Diare tersebut disebabkan oleh pembentukan lesi attaching dan effacing pada
mikrovili usus. Pada model tikus balita, pemberian EPEC dengan dosis 106 cfu/ml
menunjukkan difusi adhesi sebagian pada sel epitelial usus dan menunjukkan A/E
lession dalam 24 jam (Bhunia & Wampler 2005). Menurut Janda dan Abbot
(2006), dosis infeksi dari EPEC berkisar antara 106-1010 cfu/ml, dengan periode
inkubasi berkisar 9-19 jam, dan lamanya diare (durasi diare) yang ditimbulkan
oleh infeksi EPEC kurang lebih terjadi selama 5 hari.
C. Diare Akibat Infeksi EPEC
Diare adalah buang air besar (defekasi) dengan tinja berbentuk cair atau
setengah cair (setengah padat), kandungan air tinja lebih banyak dari biasanya
lebih dari 200 g atau 200 ml/24 jam. Definisi lain memakai kriteria frekuensi,
yaitu buang air besar encer lebih dari 3 kali per hari. Buang air besar encer
tersebut dapat/tanpa disertai lendir dan darah (Guerrant et al. 2001).
Diare akut adalah diare yang onset gejalanya tiba-tiba dan berlangsung
kurang dari 14 hari, sedangkan diare kronik yaitu diare yang berlangsung lebih
dari 14 hari. Diare dapat disebabkan infeksi maupun non infeksi. Penyebab diare
yang terbanyak adalah diare infeksi. Diare infeksi dapat disebabkan virus, bakteri,
dan parasit. Diare akut sampai saat ini masih merupakan masalah kesehatan, tidak
saja di negara berkembang tetapi juga di negara maju. Penyakit diare masih sering
menimbulkan KLB (Kejadian Luar Biasa) dengan penderita yang banyak dalam
waktu yang singkat (Lung 2003).
Diare akut infeksi diklasifikasikan secara klinis dan patofisiologis menjadi
diare non inflamasi dan diare inflamasi. Diare inflamasi disebabkan invasi bakteri
dan sitotoksin di kolon dengan manifestasi sindroma disentri dengan diare yang
disertai lendir dan darah. Gejala klinis yang menyertai keluhan abdomen seperti
dan tanda dehidrasi. Pada pemeriksaan tinja rutin secara makroskopis ditemukan
lendir dan/atau darah, serta mikroskopis didapati sel leukosit polimorfonuklear.
Pada diare non inflamasi, diare disebabkan oleh enterotoksin yang mengakibatkan
diare cair dengan volume yang besar tanpa lendir dan darah. Keluhan abdomen
biasanya minimal atau tidak ada sama sekali, namun gejala dan tanda dehidrasi
cepat timbul, terutama pada kasus yang tidak mendapat cairan pengganti. Pada
pemeriksaan tinja secara rutin tidak ditemukan leukosit (Lung 2003).
Diare dapat terjadi akibat lebih dari satu mekanisme. Pada infeksi bakteri
paling tidak ada dua mekanisme yang bekerja, yaitu peningkatan sekresi usus dan
penurunan absorbsi di usus. Infeksi bakteri menyebabkan inflamasi dan
mengeluarkan toksin yang menyebabkan terjadinya diare. Infeksi bakteri yang
invasif mengakibatkan perdarahan atau adanya leukosit dalam feses (Lung 2003).
Pada dasarnya mekanisme terjadinya diare akibat bakteri enteropatogen
meliputi penempelan bakteri pada sel epitel dengan atau tanpa kerusakan mukosa,
invasi mukosa, dan produksi enterotoksin atau sitotoksin. Satu bakteri dapat
menggunakan satu atau lebih mekanisme tersebut untuk dapat mengatasi
pertahanan mukosa usus (Lung 2003).
Gambar 1 Skema kerusakan mikrovili usus inang oleh EPEC
Sumber : Nataro dan Kaper (1998)
Diare oleh infeksi EPEC (enteropatogenik E. coli) termasuk dalam diare
infeksi non-invasif. Mekanisme adhesi yang terjadi pada infeksi enteropatogenik
E.coli (EPEC), yang melibatkan gen EPEC adherence factor (EAF) melalui BFP Mikrovili usus
(Bundle Forming Pili), menyebabkan perubahan konsentrasi kalsium intraselluler
dan arsitektur sitoskleton di bawah membran mikrovilus. Invasi intraseluler yang
ekstensif tidak terlihat pada infeksi EPECini (Zein et al. 2004). Skema kerusakan
mikrovili usus inang oleh infeksi EPEC dapat dilihat pada Gambar 1.
Diare seringkali terjadi ketika sodium klorida (NaCl) tidak dapat diserap
dari nutrient selama dalam saluran pencernaan. Penyerapan NaCl terjadi melalui
transport membran sel usus yang disebut sebagai coupled ion exchange. Proses ini
menjaga muatan netral dalam sel usus ketika penyerapan muatan sodium (Na+)
dan klorida (Cl-). Pada kejadian diare yang disebabkan oleh infeksi EPEC
pengeluaran klorida oleh sel-sel usus berkurang karena adanya EPEC. EPEC
mensekresi molekul-molekul bacterial ke dalam sel inang yang merusak transport
protein penukar ion klorida. Ketidakseimbangan ion sodium dan klorida dalam sel
menyebabkan diare berair (watery diarrhea) (Gill et al. 2007).
Bakteri EPEC melekat pada permukaan sel epitelial usus dengan merusak
mikrovili inang dan menyusun kembali sitoskeleton sel untuk membentuk
tumpuan pada permukaan sel inang (Donnenberg et al. 1997). Penyebab
terjadinya diare selama infeksi EPEC lebih kompleks dibandingkan hilangnya
area penyerapan yang disebabkan oleh attachment and effacement lesions.
Collington et al. (1998) menyatakan bahwa setelah pengikatan (attachment) awal,
dengan cepat EPEC mengatur transport elektrolit sel inang pada sel monolayer
Caco-2. Di samping sekresi klorida, yang dapat mengkontribusi diare selama
infeksi, EPEC kemungkinan dapat memfasilitasi suatu influx sodium dan
asam-asam amino ke dalam sel inang.
Munculnya gejala diare ini sangat dipengaruhi oleh kemampuan mikroba
patogen untuk melekat pada epitelium usus dan menimbulkan sakit pada inang.
Selain itu juga dipengaruhi oleh ketersediaan nutrisi pada sisi kolonisasi dan
mekanisme pertahanan inang. Nutrisi yang terbatas mempengaruhi sensitifitas
mikroorganisme terhadap antibiotik, fagositosis, lisozim, dan faktor lainnya. Pada
kondisi tertentu, meskipun mikroorganisme patogen dalam jumlah besar dapat
bertahan terhadap respon imun inang dan dapat berkembang biak dalam waktu
yang cepat dalam tubuh inang, tetapi tidak menimbulkan penyakit pada inang
carrier dan menjadi berperan seperti mikroflora normal. Adanya kemampuan
mikroflora usus untuk mempertahankan keseimbangan ekosistem usus juga
menjadi pertimbangan dalam hal ini (Tannock 1999). Oleh karena itu, pada
konsentrasi tertentu mungkin berpengaruh terhadap kecepatan timbulnya gejala
diare, tetapi jika konsentrasinya ditingkatkan menjadi tidak berarti.
D. Probiotik dan Peranannya dalam Mencegah Diare
Probiotik didefinisikan sebagai sediaan sel mikroba hidup yang memiliki
pengaruh menguntungkan terhadap kesehatan dan kehidupan inangnya (Schmid et
al. 2006). Sebagai bahan konsumsi manusia, lebih khusus probiotik didefinisikan
sebagai suplemen atau komponen makanan berupa mikroba hidup yang telah
terbukti memiliki efek menguntungkan bagi kesehatan manusia.
Mikroorganisme probiotik sebagian besar merupakan bakteri dari galur
Lactobacillus dan Bifidobacterium. Salminen et al. (2004) menyebutkan beberapa
bakteri asam laktat yang telah digunakan sebagai probiotik komersial antara lain
Lactobacillus casei, Lactobacillus rhamnosus, Lactobacillus acidophillus,
Bifidobacterium longum dan Bifidobacterium bifidum.
Beberapa syarat yang harus dipenuhi oleh bakteri asam laktat yang
berfungsi sebagai mikroba probiotik antara lain (Salminen et al. 2004):
(1) Suatu probiotik harus nonpatogenik yang mewakili mikrobiota normal usus
dari inang tertentu, dan masih aktif pada kondisi asam lambung dan
konsentrasi garam empedu yang tinggi dalam usus halus
(2) Suatu probiotik yang baik harus mampu tumbuh dan bermetabolisme dengan
cepat dan terdapat dalam jumlah yang tinggi dalam usus
(3) Probiotik yang ideal dapat mengkolonisasi beberapa bagian dari saluran usus
untuk sementara
(4) Probiotik dapat memproduksi asam-asam organik secara efisien dan memiliki
sifat antimikroba terhadap bakteri merugikan
(5) Mudah diproduksi, mampu tumbuh dalam sistem produksi skala besar, dan
hidup selama kondisi penyimpanan.
Ketahanan terhadap asam lambung merupakan syarat penting suatu
rendah (sekitar 2.5) (Jacobsen et al 1999). Toleransi BAL terhadap asam
disebabkan oleh kemampuannya untuk mempertahankan pH sitoplasma lebih basa
daripada pH ekstraseluler. Menurut Siegumfeldt et al. (2000), pada BAL terjadi
perubahan dinamis pH intraseluler seiring dengan terjadinya penurunan pH
ekstraseluler sehingga tidak terjadi gradien proton yang besar. Gradien proton
yang besar akan merugikan karena translokasi proton menggunakan banyak
energi. Selain itu, gradien proton yang besar mengakibatkan akumulasi anion,
asam organik dalam sitosol yang bersifat toksik bagi sel tersebut.
Bakteri asam laktat merupakan mikroorganisme fermentatif yang dapat
hidup pada kisaran pH luas. Pertahanan utama sel bakteri dari lingkungannya
adalah membran seluler yang terdiri atas struktur lemak dua lapis. Bila sel bakteri
terpapar pada kondisi asam, maka membran sel dapat mengalami kerusakan dan
berakibat hilangnya komponen-komponen intraseluler, seperti Mg, K, dan lemak
dari sel. Biasanya kerusakan ini menyebabkan kematian pada sel. Kondisi ini
dapat dideteksi dengan cara mengukur konsentrasi komponen intraseluler yang
keluar dari dalam sel. Bakteri yang toleran terhadap asam, membran selnya lebih
tahan terhadap kebocoran akibat pH rendah dibandingkan dengan bakteri yang
tidak tahan asam. Penelitian yang dilakukan Bender et al. (1987) yang dikutip
oleh Hutkins dan Nannen (1993) menyatakan bahwa pada galur streptokoki yang
kurang tahan terhadap asam, ion Mg keluar dari dalam sel ketika pH ekstraseluler
4.0, sedangkan pada L.casei hal tersebut terjadi pada pH ekternal di bawah 3.0.
Bender et al. (1987) menyatakan bahwa perbedaan ketahanan terhadap kerusakan
membran yang disebabkan oleh pengasaman tampak bervariasi untuk setiap
organisme dan derajat toleransi asam.
Toleransi bakteri asam laktat yang cukup tinggi terhadap asam biasanya
juga disebabkan karena bakteri tersebut mampu mempertahankan pH sitoplasma
lebih alkali daripada pH ekstraseluler (Hutkins & Nannen 1993). Untuk
mempertahankan pH sitoplasma supaya lebih basa sel harus mempunyai barier
terhadap aliran proton. Barier ini umumnya adalah membran sitoplasma.
Perbedaan kerentanan membran sitoplasma terhadap kondisi asam menentukan
toleransi bakteri tersebut pada pH rendah. Menurut Siegumfeldt et al. (2000),
penurunan pH ekstraseluler sehingga tidak terjadi gradien proton yang besar. Bagi
BAL gradien proton yang besar tidak menguntungkan sebab translokasi proton
menggunakan banyak energi. Selain itu gradien proton yang besar mengakibatkan
akumulasi anion, asam organik dalam sitosol yang bersifat toksik bagi sel
tersebut.
Komposisi asam lemak penyusun membran sitoplasma beragam diantara
spesies bakteri dimana keragaman tersebut mempengaruhi karakteristik dan
permeabilitasnya. Beberapa protein dalam membran secara spesifik juga
memfasilitasi pergerakan senyawa melewati membran. Komposisi dan struktur
protein berbeda pada membran sitoplasma juga menentukan karakteristik dan
permeabilitas membran tersebut. Keragaman asam lemak dan protein pada
membran sitoplasma diduga juga mempengaruhi keragaman ketahanan bakteri
terhadap pH rendah. Menurut Booth et al. (1989) pada beberapa bakteri Gram
positif terjadi peningkatan sintesis asam amino fosfolipid yang bermuatan positif
jika ditumbuhkan pada media yang ber-pH rendah. Perubahan ini diduga karena
ionisasi asam amino pada pH rendah menyebabkan permukaan membran
bermuatan positif sehingga dapat bertindak sebagai barrier proton.
Setelah bakteri tersebut berhasil melalui lambung, mereka akan memasuki
saluran usus bagian atas dimana garam empedu disekresikan sehingga ketahanan
BAL terhadap garam empedu juga sangat penting. Seperti halnya ketahanan
terhadap asam, menurut Zavaglia et al. (1998) dan Jacobsen et al. (1999), semua
mikroba yang berhasil hidup setelah tumbuh dalam MRSA yang ditambah 0.3%
oxgal, dinyatakan bersifat tahan terhadap garam empedu. Konsentrasi garam
empedu sebesar 0.3% merupakan konsetrasi yang kritikal, nilai yang cukup tinggi
untuk menyeleksi isolat yang resisten terhadap garam empedu.
Pada saat bakteri memasuki bagian atas saluran usus, bakteri akan terpapar
cairan empedu yang disekresikan ke dalam usus. Cairan empedu merupakan
campuran dari asam empedu, kolesterol, asam lemak, fosfolipid, pigmen empedu
dan sejumlah xenobiotik terdetoksifikasi. Sekresi pankreas juga mengandung
serangkaian enzim pencernaan, dimana enzim yang bersifat lipolitik diaktifkan
mikroorganisme komensal dalam tubuh manusia kecuali bagi beberapa genus
penghuni usus yang tahan terhadap empedu.
Gilliland (1984) menyatakan bahwa derajat toleransi terhadap empedu
merupakan karakteristik yang penting bagi bakteri asam laktat sebab hal tersebut
berpengaruh terhadap aktivitasnya dalam saluran pencernaan. Pada penelitian
yang dilakukan Gilliland (1984) terbukti bahwa sel yang diinkubasi pada larutan
penyangga yang mengandung oxgal mengalami peningkatan kebocoran materi
intraseluler yang terabsorbsi pada panjang gelombang 260 nm, yang berarti terjadi
perubahan sifat permeabilitas pada membran sel bakteri.
Isolat yang tidak tahan garam empedu kemungkinan mengalami kebocoran
materi intraseluler sehingga menyebabkan kematian. Isolat-isolat yang relatif
resisten terhadap garam empedu kemungkinan memiliki karakteristik biologis
yang membuatnya bertahan terhadap keberadaan garam empedu. Smet et al.
(1995) menyatakan bahwa beberapa Lactobacillus mempunyai enzim untuk
menghidrolisa garam empedu (bile salt hydrolase). Enzim ini mampu mengubah
kemampuan fisika kimia yang dimiliki garam empedu, sehingga tidak bersifat
racun bagi bakteri asam laktat.
Berbagai penelitian telah menunjukkan potensi isolat bakteri asam laktat
untuk mengurangi kejadian diare, baik yang disebabkan oleh infeksi bakteri
patogen, virus, maupun diare yang disebabkan oleh konsumsi antibiotik. Michail
dan Abernathy (2002) menemukan bahwa Lactobacillus plantarum dapat
menurunkan respon sekretori dari sel epitelial usus karena infeksi enteropatogenik
E. coli. Lactobacillus rhamnosus GG juga ditemukan dapat mencegah dan
menyembuhkan diare akut akibat rotavirus pada anak-anak (Szajewska et al.
2001; Shornikova et al. 1997).
Probiotik juga diketahui mempunyai pengaruh yang baik terhadap diare
yang disebabkan oleh penggunaan antibiotik. Laktobasili seringkali dilaporkan
memiliki efek yang menguntungkan bagi diare jenis ini. Pada orang dewasa,
pemberian L. acidophillus dan L. bulgaricus secara profilaktik efektif mencegah
diare pada pasien yang mendapat perawatan ampisilin. Selain itu ditemukan pula
samping (diare) pada pasien yang menjalani iradiasi abdomen (Heyman &
Menard 2002).
De Roos dan Katan (2000) menyebutkan bahwa probiotik kemungkinan
mencegah diare karena menghambat pertumbuhan bakteri patogen dengan
memproduksi bakteriosin atau dapat berkompetisi dengan patogen untuk berikatan
dengan sel epitel. Qin et al. (2005) menemukan bahwa terdapat peningkatan
integritas ikatan epitel usus dan mikrofili pada kelompok tikus yang diberi
probiotik L. acidophilus. Ikatan kompleks tersebut memungkinkan masih
terjadinya difusi paraseluler ion dan solut lainnya tetapi tidak untuk
mikroorganisme dan makromolekul yang berpotensi toksik. Penempelan galur
Lactobacillus tertentu pada sel epitel usus dapat menghambat pengikatan patogen
enterik secara signifikan melalui eksklusi kompetitif. Penghambatan patogen
enterik ini dapat berhubungan dengan induksi ekspresi gen musin usus dan
kemampuan bakteri probiotik untuk berikatan dengan mukus dan galur sel kolon
manusia (Heyman & Menard 2002).
De Roos dan Katan (2000) juga menyebutkan bahwa probiotik dapat
mencegah atau meringankan diare melalui pengaruhnya terhadap sistem imun.
Infeksi oleh bakteri menginduksi pembentukan antibodi humoral yang
disekresikan oleh plasma darah pada nodus limfe regional dan pada submukosa
saluran pernapasan dan pencernaan. Antibodi IgA sekretori spesifik untuk struktur
bakteri tertentu dapat memblok penempelan bakteri pada sel epitel mukosa dan
merupakan pertahanan inang utama terhadap penempelan bakteri. IgA sekretori
berperan penting sebagai fungsi efektor pada permukaan membran, yang
merupakan tempat masuk utama organisme patogen. Pengikatan IgA sekretori
pada permukaan bakteri dan virus mencegah penempelan patogen pada sel
mukosa sehingga mencegah infeksi dan kolonisasi (Goldsby et al. 2007).
Beberapa studi telah menunjukan adanya pengaruh konsumsi probiotik
terhadap sistem imun inang. Beberapa jenis bakteri asam laktat seperti L. casei, L.
rhamnosus dan L. plantarum dapat meningkatkan imunitas sistemik maupun
imunitas mukosa. Bahan pangan yang mengandung bakteri probiotik dapat
menstimulasi respon imun immunoglobulin A (IgA) (Galdeano & Perdigon 2006).
pada relawan yang divaksinasi Salmonella typhimurium dan mengkonsumsi
yogurt yang mengandung B. bifidum dan L. acidophilus terjadi peningkatan
konsentrasi IgA dalam serum darahnya. Antibodi IgA terarah untuk melawan
antigen O dan K Escherichia coli dan enterotoksin (Hanson 1976).
Bakteri asam laktat mampu menstimulasi sistem imun karena adanya
senyawa peptidoglikan dan lipopolisakarida dalam dinding sel. Bakteri asam
laktat melakukan kontak dengan sistem imun saluran usus melalui sel M atau sel
folikel epitelium dari Peyer’s patch atau melalui sel epitelial saluran usus halus
atau usus besar. Interaksi antara bakteri asam laktat dengan sel M hanya
menstimulasi respon imun spesifik, sedangkan interaksi antara bakteri asam laktat
dengan sel folikel epitel menstimulasi respon imun non spesifik atau peradangan
meskipun juga dapat meningkatkan respon imun spesifik (Surono 2004).
Probiotik selain mempunyai efek modulasi flora normal saluran pencernaan,
probiotik juga mampu berperan sebagai modulator sistem imun (Gorbach 2000).
Lactobacilli meningkatkan fungsi imunitas seluler dan humoral (Vanderhoof
2001). Bakteri ini mampu menstimulasi sistem imun antara lain meningkatkan
fungsi fagositosis makrofag, sel natural killer (NK), monosit dan netrofil.
Lactobacillus GG mampu merangsang sekresi IgM setelah vaksinasi rotavirus dan
meningkatkan produksi IgA dengan hasil akhir meningkatkan produksi
imunoglobulin (Walker 2000).
E. Bakteri Asam Laktat Asal Air Susu Ibu (ASI)
Menurut Young (1998) ASI mengandung banyak oligosakarida
(fruktooligosakarida), yaitu suatu karbohidrat tidak dicerna yang merupakan
makanan bagi bakteri menguntungkan. Selain itu, ASI juga mengandung
laktoferin, yaitu protein yang berikatan dengan zat besi sehingga dapat menunjang
pertumbuhan BAL dan menghambat pertumbuhan bakteri patogen tertentu, seperti
Staphylococcus aureus dan E. coli (Salminen et al 2004).
Salah satu bakteri asam laktat (BAL) yang ditemukan di dalam ASI adalah
Bifidobacteria bifidum (yang kemudian dikenal dengan Lactobacillus bifidus)
(Ballongue 2004). Menurut Mitsuoka (1989) bifidobakteria merupakan genus
bayi yang diberi susu formula memilki mikrobiota yang lebih beragam meliputi
Bifidobakteria¸ dan beberapa mikroba aerobik dan anaerobik.
Isolasi BAL dari ASI yang dilakukan oleh Martin et al. (2005) berhasil
mendapatkan dua isolat Lactobacillus gasseri dan satu isolat L. fermentum yang
berpotensi sebagai probiotik. Hasil pengujian tersebut menunjukkan potensi
probiotik isolat L. gasseri dan L. fermentum mempunyai kemiripan dengan produk
komersial. Spesies Lactobacillus yang diisolasi dari ASI sampai saat ini adalah L.
gasseri, L. rhamnosus, L. acidophilus, L. plantarum, L. fermentum, dan L
salivarius (Heikkila & Saris 2003; Martin et al. 2003 ; Martin et al. 2005).
Nuraida et al. (2008) mengisolasi bakteri asam laktat yang berasal dari air
susu ibu (ASI). Dari tiga puluh satu sampel air susu ibu (ASI) diperoleh 88 isolat
macam kultur bakteri asam laktat (BAL). Kultur tersebut diidentifikasi
berdasarkan pengamatan morfologi, ciri-ciri fisiologis, dan sifat-sifat biokimia
bakteri. Dengan uji fisiologis dan biokimia yang dilakukan pada uji identifikasi
awal diperoleh 54 isolat yang teridentifikasi sebagai Lactobacillus
homofermentatif, 18 isolat teridentifikasi sebagai Lactobacillus heterofermentatif,
9 isolat teridentifikasi sebagai Bifidobacterium, 1 isolat teridentifikasi sebagai
Pediococcus, serta 6 isolat teridentifikasi sebagai Streptococcus. Bakteri asam
laktat yang bersifat heterofermentatif kurang baik untuk dikembangkan menjadi
produk probiotik yang berupa susu fermentasi. Hal ini disebabkan gas CO2 yang
dihasilkan akan merusak tekstur produk probiotik yang berupa susu fermentasi.
Sehingga dalam pengujian ketahanan terhadap asam hanya BAL yang bersifat
homofermentatif yang diikutsertakan.
Nuraida et al. (2008) selanjutnya juga melakukan pengujian ketahanan
terhadap kondisi asam yang dilakukan pada 54 isolat Lactobacillus asal ASIyang
bersifat homofermentatif. Dari 54 isolat tersebut terdapat 35 isolat yang bersifat
tahan terhadap asam dengan penurunan log < 3,0 log cfu/ml. Pengujian ketahanan
terhadap garam empedu 35 isolat Lactobacillus asal ASI yang bersifat terhadap
kondisi asam juga dilakukan. Hasil pengujian menunjukkan terdapat 30 isolat
Lactobacillus yang bersifat tahan terhadap garam empedu dengan penurunan log
< 3,0 log cfu/ml. Isolat-isolat Lactobacillus yang memiliki total penurunan log
penelitian aktivitas antidiare secara in vivo menggunakan tikus percobaan ini.
Nuraida et al. (2008) melaporkan bahwa 25 isolat Lactobacillus, yaitu L.
rhamnosus A15, L. fermentum A20, L. acidophilus 1 A22, L. rhamnosus A23, L.
rhamnosus A24, Lactobacillus A27, L. rhamnosus A29, Lactobacillus A38, L.
rhamnosus R12, L. rhamnosus R14, L. rhamnosus R21, L. rhamnosus R22, L.
rhamnosus R23, L. rhamnosus R24, Lactobacillus R25, L. rhamnosus R26,
Lactobacillus R27, L. rhamnosus R28, Lactobacillus R32, L. rhamnosus R34,
Lactobacillus B3, L. rhamnosus B10, L. fermentum 2 B11, Lactobacillus B13, dan
L. rhamnosus B16 memiliki kemampuan yang sangat baik untuk bertahan dari
kondisi asam lambung dan garam empedu melalui pengujian secara in vitro.
Isolat-isolat BAL asal ASI juga memiliki aktivitas antimikrobial terhadap
beberapa bakteri patogen seperti Escherichia coli, Salmonella typhimurium,
Bacillus cereus, dan Staphylococcus aureus. Nuraida et al. (2008) juga
melaporkan bahwa isolat-isolat BAL asal ASI yang diperoleh memiliki aktivitas
penghambatan yang baik terhadap keempat bakteri patogen tersebut.
Martin et al. (2005) menyatakan bahwa beberapa isolat asal ASI yang
diperoleh menghasilkan sejumlah komponen yang diduga berkemampauan
sebagai antimikroba. L. gasseri CECT 5714, L. gasseri CECT 5715, dan L.
johnsonii La1 dilaporkan positif menghasilan hydrogen peroksida. Selain itu, juga
dilaporkan bahwa L. gasseri CECT 5714, L. gasseri CECT 5715, dan L.
fermentum CECT 5716 secara signifikan menghasilkan asam laktat enantiomer
(sekitar 50% untuk masing-masing enantiomer). L. rhamnosus GG dan L. casei
juga menghasilkan L-asam laktat, sedangkan pada L. johnsonii La1 dihasilkan
D-asam laktat. Produksi D-asam asetat hanya terjadi pada dua isolat, yaitu L.
fermentum CECT 5716 dan L. rhamnosus GG.
Mekanisme aktivitas penghambatan antimikroba menurut Branen dan
Davidson (1993) dapat melalui beberapa faktor, antara lain (1) mengganggu
komponen penyusun dinding sel, (2) bereaksi dengan membran sel sehingga
mengakibatkan peningkatan permeabilitas dan menyebabkan kehilangan
komponen penyususn sel, (3) menginaktifkan enzim esensial yang berakibat pada
terhambatnya sintesis protein dan destruksi atau kerusakan fungsi material