ABSTRACT
THE EFFECT OF TANNIN AND GALIC ACID COPIGMENTS ON COLOR OF TAMARILLO JUICE (Cyphomandra betaceaSendtn)
By
Elfrida Enzelina
concentrations of anthocyanin juice were significantly affected by molar ratio of copigments to anthocyanin. Furthermore, the molar ratio of 100 produced the best color retention (65,70%). Kinetic reaction parameters of copigmented juice indicated that galic acid was a more effective copigment indicated by lower value of kinetic constant (0,055 mM/hour) and longer half time (12,60 hours) at molar ratio of copigment to anthocyanin of 100.
ABSTRAK
PENGARUH KOPIGMEN TANIN DAN ASAM GALAT TERHADAP WARNA JUS TERUNG BELANDA (Cyphomandra betaceaSendtn)
Oleh Elfrida Enzelina
dibandingkan jus tidak dikopigmentasi (kontrol). Kopigmentasi pada rasio molar 100 mampu mempertahankan warna jus yang ditunjukkan oleh retensi warna paling tinggi (65,70%). Berdasarkan kinetika reaksi, kopigmen asam galat pada rasio molar 100 lebih efektif mempertahankan warna jus yang terlihat dari nilai konstanta (k) lebih kecil (0,005 mM/jam) dan waktu paruh yang lebih panjang (12,60 jam).
PENGARUH KOPIGMEN TANIN DAN ASAM GALAT TERHADAP WARNA JUS TERUNG BELANDA (Cyphomandra betaceaSendtn)
Oleh
ELFRIDA ENZELINA
Skripsi
Sebagai Salah Satu Syarat untuk Mencapai Gelar SARJANA TEKNOLOGI PERTANIAN
Pada
Jurusan Teknologi Hasil Pertanian Fakultas Pertanian Universitas Lampung
FAKULTAS PERTANIAN UNIVERSITAS LAMPUNG
PENGARUH KOPIGMEN TANIN DAN ASAM GALAT TERHADAP WARNA JUS TERUNG BELANDA (Cyphomandra betaceaSendtn)
(Skripsi)
Oleh
ELFRIDA ENZELINA
FAKULTAS PERTANIAN UNIVERSITAS LAMPUNG
DAFTAR GAMBAR
Gambar Halaman
1. Buah Terung Belanda (Cyphomandra betaceaSendtn) ... 7
2. Struktur dasar antosianin ... 9
3. Bentuk-bentuk struktur antosianidin ... 11
4. Struktur delphinidin-3-rutinosida ... 11
5. Struktur antosianin pada kondisi pH yang berbeda ... 13
6. Berbagai bentuk kesetimbangan antosianin ... 14
7. Degradasi antosianin monoglukosida pada pH 3,7 oleh panas ... 15
8. Mekanisme reaksi kopigmentasi pada antosianin ... 17
9. Interaksi intermolekul melalui ikatan hidrogen (A) dan hidrofobik (B) antara antosianin dan kopigmen... 18
10. Pembentukan ikatan melalui transfer muatan antosianin dengan senyawa fenolik (pirokatekol) ... 18
11. Efek hiperkromik dan batokromik dari proses kopigmentasi A). Sianidin-3-Glukosida, B) Sianidin-3-glukosida + asam rosmarinat… 19 12. Struktur dasar tanin ... 22
13. Struktur dasar asam galat ... 23
14. Jus terung Belanda ... 30
15. Pengaruh tanin terhadap batokromik dan hiperkromik jus terung Belanda terkopigmentasi ... 31
17. Rasio molar kopigmen terhadap konsentrasi antosianin ... 33
18. Faktor rasio molar kopigmen terhadap retensi warna antosianin jus terung Belanda. ... 36
19. Grafik kinetika reaksi degradasi antosianin jus terung Belanda terkopigmentasi tanin ... 38
20. Grafik kinetika reaksi degradasi antosianin jus terung Belanda terkopigmentasi asam galat ... 38
21. Proses pembuatan jus terung Belanda ... 61
22. Sampel setelah dikopigmentasi ... 61
23. Persiapan sampel... 61
24. Sampel dalam larutanbufferHCL-KCl pH 1 ... 62
25. Sampel dalam larutanbuffersitrat pH 4,5 ... 62
26. Sampel dalam larutanbuffersitrat pH 3,5 ... 62
DAFTAR ISI
Halaman
DAFTAR TABEL ... v
DAFTAR GAMBAR ... vi
I. PENDAHULUAN ... 1
1.1 Latar Belakang ... 1
1.2 Tujuan Penelitian ... 3
1.3 Kerangka Pemikiran ... 4
1.4 Hipotesis ... 5
II. TINJAUAN PUSTAKA ... 6
2.1 Terung Belanda (Cyphomandra betaceaSendtn) ... 6
2.2 Antosianin. ... 8
2.3 Stabilitas Antosianin ... 11
2.4 Kopigmentasi ... 16
2.4.1 Mekanisme reaksi kopigmentasi ... 16
2.4.2 Faktor yang mempengaruhi kopigmentasi ... 19
2.4.3 Kopigmen ... 20
III. BAHAN DAN METODE ... 24
3.1 Tempat dan Waktu Penelitian ... 24
3.2 Alat dan Bahan ... 24
3.3 Metode Penelitian ... 25
3.4 Pelaksanaan Penelitian ... 25
3.4.1 Pembuatan larutanbufferpH 1, pH 3,5 dan pH 4,5 ... 25
3.4.2 Pembuatan jus terung Belanda ... 26
3.4.3 Kopigmentasi antosianin jus terung Belanda ... 26
3.5 Pengamatan ... 27
3.5.1 Pengamatan efek batokromik dan hiperkromik ... 27
3.5.2 Analisis konsentrasi antosianin ... 27
3.5.3 Retensi warna ... 28
IV. HASIL DAN PEMBAHASAN ... 30
4.1 Kadar Antosianin Jus Terung Belanda (Cyphomandra betacea Sendtn) ... 30
4.2 Efek Batokromik dan Hiperkromik pada Jus Terung Belanda Terkopigmentasi ... 31
4.3 Konsentrasi Antosianin setelah Kopigmentasi ... 33
4.4 Retensi Warna ... 35
4.5 Kinetika Reaksi Degradasi Antosianin ... 37
V. KESIMPULAN DAN SARAN ... 41
5.1 Kesimpulan ... 41
5.2 Saran ... 41
DAFTAR TABEL
Tabel Halaman
1. Komposisi kimia terung Belanda ... 7
2. Konstanta laju reaksi dan waktu paruh antosianin jus terung Belanda terkopigmentasi ... 39
3. Datapengamatan analisis konsentrasi antosianin ... 48
4. Konsentrasi antosianin ... 49
5. Uji kesamaan ragam (Bartlett's test) konsentrasi antosianin ... 49
6. Analisis ragam konsentrasi antosianin ... 50
7. Uji BNT terhadap faktor rasio ... 50
8. Data pengamatan analisis retensi warna ... 51
9. Hasil analisis retensi warna antosianin.... 52
10. Uji kesamaan ragam (Bartlett's test) retensi warna ... 53
11. Analisis ragam retensi warna antosianin ... 54
12. Uji BNT terhadap faktor rasio ... 54
13. Data pengamatan analisis kinetika reaksi antosianin ... 55
Dengan penuh syukur Kupersembahkan
Karya Sederhana ini
Kepada
Kedua orang tuaku Tercinta, Mama dan Alm.
Bapak Sebagai tanda bakti, kasih sayang, dan
cintaku atas segala doa, kasih sayang dan
perjuangan yang sangat luar biasa selama ini
RIWAYAT HIDUP
Penulis dilahirkan di Sidoharjo pada tanggal 17 November 1993, sebagai putri
pertama dari empat bersaudara pasangan Bapak B. Sitorus (Alm) dan Ibu D.
Siagian. Penulis memulai pendidikan di Sekolah Dasar Negeri 3 Negararatu pada
tahun 1999-2005; Sekolah Menengah Pertama Negeri (SMPN) 1 Natar pada tahun
2005–2008; Sekolah Menengah Atas (SMA) Yadika Natar pada tahun 2008–
2011. Pada tahun 2011 penulis diterima sebagai mahasiswa Jurusan Teknologi
Hasil Pertanian Fakultas Pertanian Universitas Lampung melalui jalur Ujian
Mandiri (UM).
Selama kuliah di Jurusan Teknologi Hasil Pertanian Unila, penulis mengikuti
kegiatan organisasi dan kemahasiswaaan Himpunan Mahasiswa Jurusan (HMJ)
THP FP Unila sebagai anggota Bidang IV Dana dan Usaha Periode 2013/2014.
Pada tahun 2014 penulis melaksanakan Praktik Umum di PT. Indofood Sukses
Makmur Tbk. BogasariFlour Mills-Jakarta dengan judul”Mempelajari Penerapan
Good and Halal Manufacturing Practice (GHMP) di PT. Indofood Sukses
Makmur Tbk. Bogasari Flour Mills–Jakarta Divisi Pasta”. Pada tahun 2014
penulis juga melaksanakan Kuliah Kerja Nyata (KKN) Tematik di Desa Tanjung
SANWACANA
Puji syukur penulis ucapkan kehadirat Tuhan Yang Maha Esa atas segala berkat
dan kasih karunia-Nya sehingga penulis dapat menyelesaikan skripsi dengan judul
“Pengaruh Kopigmen Tanin dan Asam Galat terhadap Warna Jus Terung Belanda
(Cyphomandra betacea Sendtn)’’ sebagai salah satu syarat untuk memperoleh
gelar Sarjana Teknologi Pertanian pada Jurusan Teknologi Hasil Pertanian
Fakultas Pertanian Universitas Lampung.
Pada kesempatan ini dengan segala kerendahan hati, penulis ingin mengucapkan
terima kasih yang tulus kepada:
1. Bapak Prof. Dr. Ir. Wan Abbas Zakaria, M.S. selaku Dekan Fakultas Pertanian
Universitas Lampung.
2. Ibu Ir. Susilawati, M.Si. selaku Ketua Jurusan Teknologi Hasil Pertanian yang
telah memberikan izin penyusunan skripsi.
3. Ibu Prof. Dr. Tirza Hanum selaku pembimbing akademik sekaligus dosen
pembimbing atas segala kebaikan, motivasi, bimbingan, dukungan, saran dan
pengarahan kepada penulis sehingga tugas akhir ini dapat terselesaikan.
4. Bapak Ir. Ribut Sugiharto, M.Sc. selaku anggota komisi pembimbing atas
segala dukungan, saran, arahan, motivasi dan bimbingan yang diberikan
5. Bapak Drs. Azhari Rangga, M.App.Sc. selaku penguji utama yang telah
banyak memberikan masukan, saran dan bimbingan terhadap karya skripsi
penulis.
6. Seluruh Bapak dan Ibu dosen THP serta seluruh karyawan yang telah sangat
membantu selama perkuliahan dan penelitian, serta atas semua bimbingan dan
disiplin ilmu yang diberikan selama penulis menjalani studi.
7. Mama dan Alm. Bapak tercinta serta adik-adikku tersayang (Dewi, Lestari,
Kristiani) atas segala pengorbanan, doa, perhatian, motivasi, serta kasih
sayang yang tiada henti demi keberhasilanku.
8. Sahabat tersayang Ani, Artha, Neri, Via, dan Pawe atas segala bantuan,
semangat, kebersamaan, dan kebahagiaan selama ini.
9. Keluargaku angkatan 2011 “Janji Gerhana” terima kasih atas kekeluargaan
dan kebersamaan yang sangat berharga 4 tahun ini.
10. Teman satu tim penelitian Mba Dian dan Algi terimakasih atas semangat,
bantuan, dan menjadi tempat berbagi selama penelitian.
Penulis berharap semoga Tuhan Yang Maha Esa membalas segala kebaikan kalian
dan penulis berharap skripsi ini dapat memberikan informasi yang bermanfaat.
Bandar Lampung, Oktober 2015 Penulis
I. PENDAHULUAN
1.1 Latar Belakang dan Masalah
Warna merupakan salah satu faktor penting dalam menentukan mutu suatu produk
pangan. Menurut Jettanapornsumran (2009), warna menjadi salah satu
karakteristik utama sensori minuman jus yang dapat mempengaruhi penerimaan
konsumen. Jus terung Belanda merupakan salah satu produk olahan yang terbuat
dari buah terung Belanda atauTamarillo(Cyphomandra betaceaSendtn),
tanaman yang sangat terkenal di New Zealand dan di Indonesia tanaman ini dapat
di jumpai di daerah Sumatera Utara. Jus terung Belanda memiliki rasa agak asam
hingga manis yang banyak disukai masyarakat. Jus ini mengandung sejumlah
nutrisi yang baik untuk kesehatan, seperti vitamin, karotenoid, dan serat
(Sembiring, 2013). Selain itu, secara alami jus terung Belanda juga mengandung
antosianin berupa delphinidin-3-rutinosida yang memberikan warna merah
keunguan pada jus (Listeret al., 2005).
Antosianin adalah satuan gugus glikosida yang terdiri dari gugus aglikon dan
glikon yang merupakan hasil hidroksilasi dan turunan metoksilasi dari
2-benzopirilium atau garam flavilium (Jettanapornsumran, 2009). Antosianin
sangat mudah mengalami degradasi yang mengakibatkan warna menjadi pudar.
2
cenderung meningkat selama proses penyimpanan yang diiringi oleh kenaikan
suhu sehingga menyebabkan mutu jus menurun. Hal tersebut mendorong banyak
produsen menggunakan bahan tambahan makanan berupa pewarna untuk
meningkatkan warna alami produk. Umumnya pewarna yang digunakan adalah
pewarna sintetis yang berbahaya jika digunakan dalam jangka waktu panjang
karena bersifat toksik bahkan karsinogenik (Sembiring, 2013). Oleh karena itu,
penggunaan pewarna alami mulai menjadi perhatian konsumen. Selain
penambahan pewarna alami, warna produk minuman jus juga dapat diperkuat atau
dipertahankan dengan penambahan senyawa kopigmen yang berinteraksi dengan
zat warna alami dalam jus membentuk ikatan yang menstabilkan warna yang
disebut kopigmentasi (Rein, 2005).
Kopigmentasi adalah suatu interaksi antara pigmen dengan senyawa lain
(kopigmen) seperti senyawa polifenol, flavonoid, alkaloid, asam amino, asam
organik, logam bahkan molekul antosianin itu sendiri (Del Pozo-Insfran, 2006)
melalui ikatan lemah (hidrofobik atau ikatan hidrogen) (Talcottet al., 2003).
Menurut Rein (2005), pada saat kopigmentasi akan terbentuk suatu ikatan baru
antar molekul-molekul kopigmen dengan molekul antosianin yang akan
melindungi kation flavilium antosianin yang reaktif dari serangan molekul air,
sehingga warna pigmen antosianin menjadi lebih kuat dan stabil. Fenomena
kopigmentasi ditunjukkan oleh pergeseran panjang gelombang maksimum kurva
spektrofotometri atau biasa disebut efek batokromik (∆λmax) dan peningkatan
absorban maksimum kurva spektrofotometri (∆A, intensitas warna) yang disebut
3
Efektifitas suatu kopigmentasi dapat dipengaruhi oleh jenis kopigmen yang
ditambahkan pada antosianin (Schwarzet al., 2005). Tanin dan asam galat
merupakan kopigmen yang berinteraksi dengan antosianin melalui interaksi
intermolekul. Kopigmen-kopigmen ini dapat diperoleh secara mudah di alam,
dengan cara memanfaatkan limbah kulit tanaman dan buah-buahan, seperti pada
kulit kayu (tanin) dan kulit anggur (asam galat) dengan cara diekstraksi.
Kopigmentasi tanin pada antosianin ekstrak kulit terung Belanda (Cyphomandra
betaceaSendtn) dilaporkan mampu menstabilkan warna ekstrak antosianin
sampai 40 hari penyimpanan (Wahyuni, 2014). Namun, kopigmen ini belum
diteliti pada jus terung Belanda. Selain tanin, asam galat juga dilaporkan efektif
dalam mempertahankan warnared currant juiceselama 30 hari penyimpanan
(Kopjaret al., 2009). Berdasarkan hasil penelitian tersebut, kedua kopigmen ini
diharapkan dapat mempertahankan warna jus. Oleh karena itu, pada penelitian ini
akan diteliti efektivitas jenis kopigmen (tanin dan asam galat) dalam
mempertahankan warna jus terung Belanda (Cyphomandra betaceaSendtn)
melalui interaksi intermolekul.
1.2 Tujuan Penelitian
Penelitian ini bertujuan untuk :
1. Menentukan jenis kopigmen (tanin atau asam galat) terbaik, dalam
mempertahankan warna jus terung Belanda (Cyphomandra betacea
4
2. Menentukan rasio molar kopigmen (tanin atau asam galat) terhadap
antosianin terbaik, dalam mempertahankan warna jus terung Belanda
(Cyphomandra betaceaSendtn).
1.3 Kerangka Pemikiran
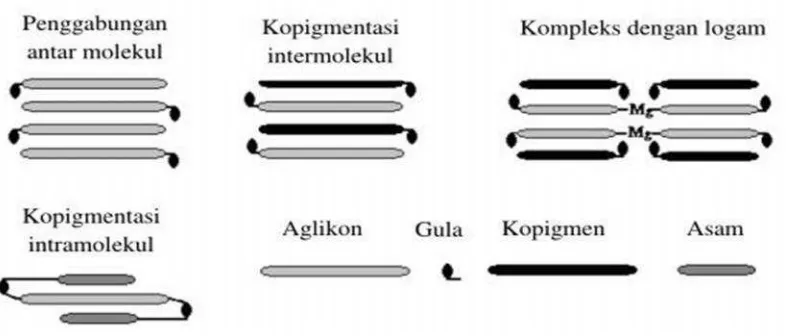
Kopigmentasi secara alami dapat menstabilkan warna antosianin dengan cara
melindungi kation flavilium dari serangan molekul air (Kopjar dan Pilizota,
2009). Menurut Rein (2005), kopigmentasi dapat terjadi melalui empat
mekanisme interaksi yaitu intermolekul, intramolekul,pembentukan kompleks
dengan logam dan interaksi molekul sejenis. Jenis interaksi antara kopigmen dan
antosianin akan menghasilkan kekuatan kopigmentasi yang berbeda-beda dalam
melindungi kation flavilium dari serangan molekul air, sehingga kecocokan jenis
kopigmen untuk antosianin tertentu perlu diteliti satu per satu (Heet al., 2012).
Menurut Del Pozo-Insfran (2006), kopigmentasi intermolekul merupakan jenis
kopigmentasi yang paling sering diteliti dan dilaporkan mampu menghambat laju
degradasi antosianin. Interaksi intermolekul terjadi melalui ikatan hidrogen dan
interaksi hidrofobik (Jettanapornsumran, 2009). Tanin dan asam galat merupakan
jenis kopigmen yang berinteraksi dengan antosianin melalui interaksi
intermolekul (Heet al., 2012). Kedua jenis kopigmen ini memiliki gugus
hidroksil yang kelebihan elektron, sehingga terjadi transfer elektron dari tanin dan
asam galat yang memiliki elektron bebas ke kation flavilium (kekurangan
elektron) membentuk kesetimbangan elektron (Castenada-Ovandoet al., 2009),
5
(Jettanapornsumran, 2009). Kopigmen-kopigmen ini dapat ditemukan dengan
mudah di alam.
Efek kopigmentasi juga dipengaruhi oleh faktor lain seperti rasio molar kopigmen
terhadap antosianin (Boulton, 2001). Menurut Kopjar dan Pilizota (2009)
penambahan kopigmen pada rasio yang berbeda yaitu 50:1 dan 100:1
mempengaruhi konsentrasi antosianin, kinetika reaksi, dan retensi warna
antosianin. Wahyuni (2014) juga melaporkan bahwa rasio molar tanin terhadap
ekstrak antosianin terbaik adalah 100. Pada penelitian ini (jus) akan diteliti rasio
molar yang lebih besar untuk mengetahui rasio molar yang paling optimal dalam
mempertahankan warna jus terung Belanda (Cyphomandra betaceaSendtn). Oleh
karena itu, melalui penelitian ini diharapkan dapat diketahui efektifitas dari setiap
jenis kopigmen pada rasio molar kopigmen terhadap antosianin terbaik, dalam
mempertahankan warna jus terung Belanda (Cyphomandra betaceaSendtn).
1.4 Hipotesis
Hipotesis yang diajukan pada penelitian ini adalah :
1. Terdapat jenis kopigmen (tanin atau asam galat) terbaik yang dapat
mempertahankan warna jus terung Belanda (Cyphomandra betaceaSendtn).
2. Terdapat rasio molar kopigmen (tanin atau asam galat) terhadap antosianin
terbaik, dalam mempertahankan warna jus terung Belanda (Cyphomandra
II. TINJAUAN PUSTAKA
2.1 Terung Belanda (Cyphomandra betaceaSendtn)
Terung Belanda (Cyphomandra betaceaSendtn) atau disebut jugaTamarillo
merupakan tanaman jenis terung-terungan yang berasal dari familySolanaceae
dan termasuk salah satu jenis tanaman semak atau perdu yang dapat tumbuh
dengan baik pada ketinggian 1000-2000 m dpl, dengan tinggi batang 2-3 m dan
diameter batang 4 cm. Buah terung Belanda berbentuk oval seperti telur dengan
ukuran panjang sekitar 5-6 cm (Gambar 1) dan terletak pada ujung batang
biasanya dalam bentuk berkelompok. Terung ini berwarna merah muda, orange
atau kuning sampai biru terung atau ungu gelap dengan diameter 1 cm, serta
memiliki biji buah yang pipih, tipis dan keras. Warna terung ini akan berubah
menjadi merah kecoklatan ketika sudah matang (Kumalaningsih dan Suprayogi,
2006).
Terung Belanda banyak dijumpai di daerah Sumatera Utara dan banyak
dimanfaatkan sebagai buah yang dikonsumsi segar, bumbu masak serta dibuat
7
Gambar 1. Buah terung Belanda (Cyphomandra betaceaSendtn)
Terung Belanda memiliki banyak manfaat yang baik bagi kesehatan. Kandungan
gizi terung Belanda dapat dilihat pada Tabel 1.
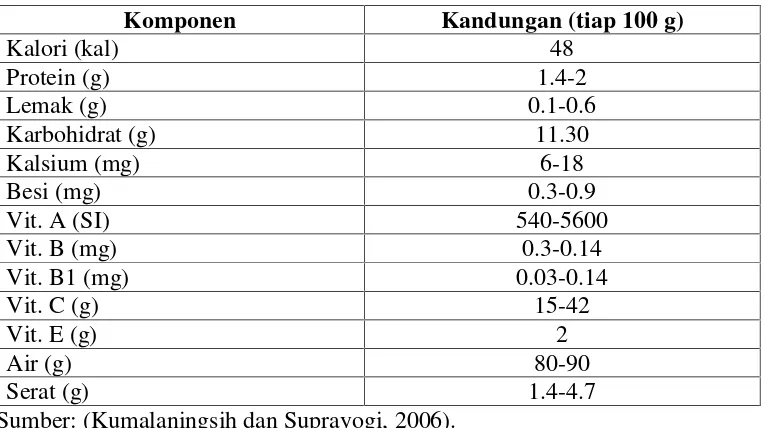
Tabel 1. Komposisi kimia terung Belanda
Komponen Kandungan (tiap 100 g)
Kalori (kal) 48
Sumber: (Kumalaningsih dan Suprayogi, 2006).
Menurut Kumalaningsih dan Suprayogi (2006) terung Belanda mengandung
betakaroten yang sangat berperan penting dalam menangkal radikal bebas. Selain
itu, vitamin C yang terkandung dalam terung Belanda juga bermanfaat untuk
8
untuk menurunkan kolesterol (Syariahet al., 2011). Buah ini juga dilaporkan
mengandung antosianin (Listeret al., 2005). Antosianin terung Belanda
merupakan sumber antioksidan alami yang dapat digunakan untuk memperkecil
reaksi oksidasi dan menangkal radikal bebas (Herani dan Rahardjo, 2005).
Pigmen antosianin yang terkandung dalam terung Belanda dapat dijadikan sebagai
salah satu alternatif pewarna alami (Diniyahet al., 2010).
2.2 Antosianin
Antosianin adalah zat warna alami yang bersifat sebagai antioksidan yang terdapat
dalam tumbuh-tumbuhan (Wrolstad, 2001). Pigmen ini larut dalam air, berwarna
merah sampai biru dan terdapat pada buah-buahan, bunga dan sayur-sayuran yang
termasuk dalam kelompok flavonoid (Jettanapornsumran, 2009). Antosianin
dapat ditemui pada sejumlah besar buah-buahan, sayur, maupun umbi seperti :
cherry, raspberry, mulberry, bluberry, blackberry, strawberry (Boulton, 2001),
java plum (duwet) (Satyatama, 2008), rosella (Catrien, 2009), katul beras ketan
hitam (Hanum, 2000), kulit terung ungu (Diniyahet al., 2010), ubi jalar ungu
(Santoso dan Teti, 2014). Antosianin telah banyak dimanfaatkan dalam proses
pengolahan pangan, baik untuk makanan maupun minuman (Satyatama, 2008).
Menurut Sembiring (2013), pewarna sintetis diketahui bersifat toksik dan
karsinogenik, maka keberadaan antosianin sebagai pewarna alami sangat penting.
Clifford (2000) dan JEFCA (Joint FAO/WHO Expert Committee on Food
Additives) menyatakan bahwa ekstrak yang mengandung antosianin memiliki efek
toksisitas yang rendah. Antosianin dapat digunakan sebagai pewarna alami untuk
9
pada produk pangan. Selain sebagai pewarna alami, antosianin juga berperan
penting sebagai antioksidan (Listeret al., 2005) yaitu zat yang dapat menangkal
atau mencegah reaksi oksidasi dari radikal bebas (Changet al., 2002),cardio
protective capacity, dan memiliki kemampuan untuk menghambat tahap inisiasi
reaksi kimiawi yang menyebabkan karsinogenesis (Smithet al., 2000).
Antosianin secara kimia memiliki struktur utama berupa dua cincin aromatik
benzena (C6H6) yang dihubungkan dengan tiga atom karbon yang membentuk
cincin (Rein, 2005) merupakan hasil turunan dari glikosilasi polihidroksi dan/atau
polimetoksi dari garam 2-benzopirilium atau dikenal dengan struktur kation
flavilium atau benzilflavilum (3,5,7,4’-tetrahidroksiflavilum) (Jettanapornsumran,
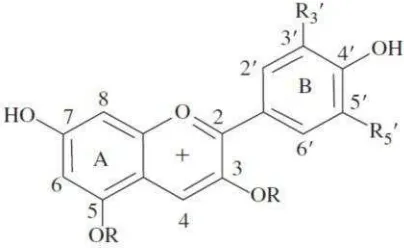
2009). Struktur dasar antosianin dapat dilihat pada Gambar 2.
Gambar 2. Sruktur dasar antosianin (Brouillard, 1982)
Keterangan : R3’ dan R5’ : Gugus substitusi
R : Jenis glikon (gula atau gula terasilasi)
Antosianin terdiri dari gugus gula (glikon) dan antosianidin (aglikon). Subsituen
gula pada antosianin biasanya glukosa, ramnosa, galaktosa, xilosa, fruktosa, dan
arabinosa (Del Pozo-Insfran, 2006). Keragaman antosianin dapat terjadi karena
10
gulanya (Catrien, 2009). Selain gula, molekul lain yang terdapat pada inti kation
flavilium adalah gugus asil antara lain asam kumarat, asam ferulat, asam asetat,
asam malonat, asam galat, asam kafeat, asam sinapat, asam malat, asam oksalat
dan asam suksinat. Satu atau lebih molekul tersebut terasilasi pada molekul gula
(Jettanapornsumran, 2009). Keberadaan gugus asil dalam jumlah dan posisi
tertentu dapat meningkatkan kestabilan antosianin terutama terhadap cahaya dan
pH (Rein, 2005). Keberadaan dua grup asil, yaitu grup asil yang terletak di atas
dan di bawah cincin pirilium dibutuhkan untuk retensi warna maksimum.
Antosianin merupakan senyawa yang bersifat amfoter, yaitu memiliki
kemampuan untuk bereaksi baik dengan asam maupun basa. Antosianin akan
berwarna merah dalam media asam, berwarna ungu di lingkungan netral, dan
berwarna biru di lingkungan basa. Perubahan warna ini terjadi karena adanya
perubahan lingkungan dan tergantung dari gugus yang terikat pada struktur dasar
dari posisi ikatannya (Santoso dan Teti, 2014). Beberapa gugus pengganti yang
terikat pada struktur dasar antosianin membentuk stuktur antosianidin dan
memiliki peranan penting dalam bahan pangan (Gambar 3), yaitu pelargonidin
(orange), sianidin (orange-merah), peonidin (orange-merah), delphinidin
(biru-merah), petunidin (biru-merah) dan malvidin (biru-merah) (Fernando dan
11
Gambar 3. Bentuk-bentuk struktur antosianidin (Brouillard, 1982)
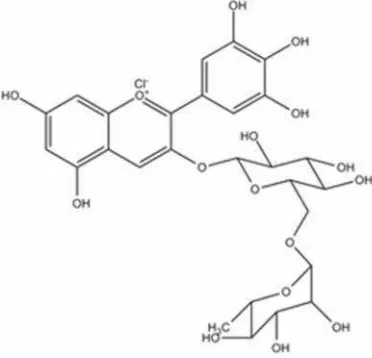
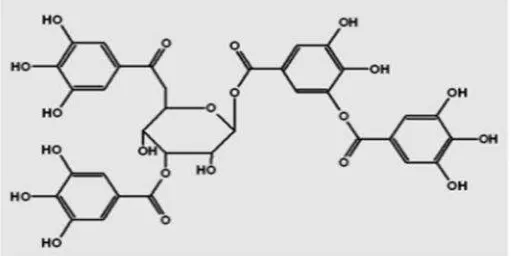
Antosianin terung Belanda (Chypomandra betaceaeSendtn) memiliki struktur
kimia delphinidin-3-rutinosida (Listeret al., 2005) ditunjukkan pada Gambar 4.
Gambar 4. Struktur delphinidin-3-rutinosida
2.3 Stabilitas antosianin
Antosianin memiliki struktur berbentuk kation flavilium, yang terikat pada gugus
hidroksi, metoksi, atau o-glikosil (Catrien, 2009). Antosianin memiliki stabilitas
yang rendah, sehingga mudah mengalami kerusakan selama proses pengolahan
12
karena adanya reaksi-reaksi yang terjadi akibat kekurangan elektron yang
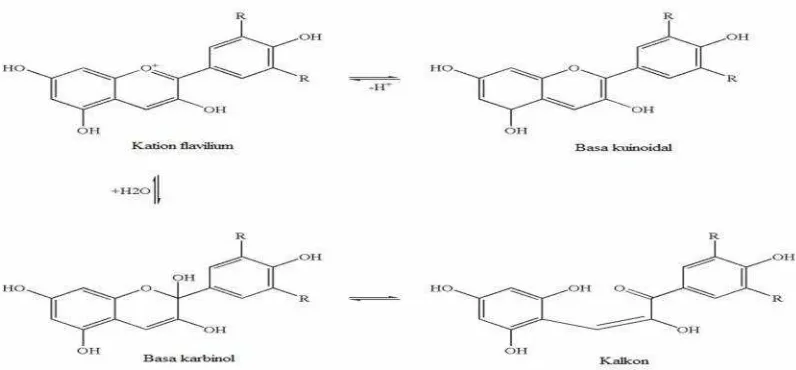
menyebabkan kation flavilium menjadi sangat reaktif. Degradasi warna dari
pigmen antosianin disebabkan oleh berubahnya kation flavilium yang berwarna
merah menjadi bentuk kesetimbangan yaitu basa karbinol dan kalkon yang tidak
berwarna (Mateus dan Freitas, 2009). Rein (2005) menyatakan bahwa reaksi
degradasi pada antosianin mengikuti laju reaksi ordo pertama. Laju degradasi
warna antosianin dipercepat dengan adanya asam askorbat, asam amino, fenol,
dan gula. Senyawa-senyawa tersebut dapat berkondensasi dengan molekul
antosianin melalui suatu reaksi yang kompleks (Del pozo-insfran, 2006).
Sifat dan warna antosianin dalam jaringan tanaman dipengaruhi oleh beberapa
faktor, antara lain jumlah pigmen, letak dan jumlah gugus hidroksi dan metoksi
(Santoso dan Teti, 2014). Konsentrasi pigmen yang tinggi di dalam jaringan akan
menyebabkan warna merah hingga gelap, sedangkan konsentrasi pigmen yang
sedang akan menyebabkan warna ungu, dan konsentrasi pigmen yang rendah akan
menyebabkan warna biru (Rein, 2005). Penambahan gugus glikosida atau
peningkatan jumlah gugus hidroksi bebas pada rantai karbon nomor 5 (cincin A)
yang dominan menyebabkan warna cenderung biru dan relatif tidak stabil,
sedangkan metilasi atau penambahan jumlah gugus metoksi akan menyebabkan
warna cenderung merah dan relatif stabil (Jettanapornsumran, 2009).
Kestabilan antosianin dipengaruhi oleh beberapa faktor antara lain pH,
temperatur, cahaya, oksigen, dan enzim (Niendyah, 2004; Rein, 2005;
Jettanapornsumran, 2009; Jianteng xu, 2013). Antosianin sangat sensitif dan tidak
13
pada larutan asam dibanding larutan basa. Struktur kation flavilium (merah) akan
dominan pada pH rendah yaitu < 2, sedangkan pada pH 3-6, struktur kation
flavilium mengalami serangan nukleofilik oleh molekul air, menghasilkan struktur
basa karbinol/hemiasetal (tidak berwarna). Pada pH yang lebih tinggi (pH 6-8)
terjadi reaksi deprotonisasi menghasilkan struktur basa quinonoidal (ungu)
(Jettanapornsumran, 2009). Semakin meningkatnya pH maka akan semakin
banyak terbentuk senyawa basa karbinol dan kalkon yang menyebabkan tidak
berwarna (Rein, 2005). Struktur antosianin pada kondisi pH yang berbeda
ditunjukkan pada Gambar 5.
Gambar 5. Struktur antosianin pada kondisi pH yang berbeda (Giusti dan Wrolstad, 2001)
Kopjar dan Pilizota (2009) juga menyatakan bahwa suhu mempunyai pengaruh
nyata terhadap degradasi antosianin. Pemanasan pada suhu tinggi selama waktu
tertentu dapat menggeser kesetimbangan antosianin menuju bentuk yang tidak
berwarna, yaitu bentuk basa karbinol dan kalkon (Mateus dan Freitas, 2009).
14
Gambar 6. Berbagai bentuk kesetimbangan antosianin (Mateus dan Freitas, 2009)
Rein dan Heinonen (2004) menyatakan bahwa stabilitas warna antosianin sebagai
fungsi suhu dan lama pemanasan dinyatakan sebagai persen retensi warna
antosianin. Penurunan nilai retensi warna selama perlakuan pemanasan terjadi
karena terbentuknya senyawa seperti karbinol dan turunannya yang tidak
berwarna. Selain pemanasan, suhu penyimpanan juga berperan penting dalam
pembentukan kalkon (Rein, 2005). Amr dan Al-Tamimi (2007) melaporkan
bahwa antosianin dalam model minuman berkarbonasi yang disimpan selama 180
hari pada suhu ruang dan 4°C masing-masing mengalami degradasi warna sebesar
90% dan 30%. Menurut Kopjar dan Pilizota (2009), suhu juga mempengaruhi
stabilitas warna antosianinred currant juicesehingga pengendalian pada suhu
penyimpanan merupakan salah satu faktor penting untuk menjaga stabilitas
15
Gambar 7. Degradasi antosianin monoglukosida pada pH 3,7 oleh panas (Rein, 2005)
Cahaya menjadi salah satu faktor yang menentukan kestabilan antosianin.
Menurut Rein (2005), cahaya mempengaruhi antosianin dalam dua cara yang
berbeda, yaitu berperan penting dalam biosintesis antosianin dan mempercepat
degradasi. Antosianin dalam kondisi netral atau basa bahkan asam akan
mengalami perubahan warna jika terkena paparan cahaya, sehingga larutan perlu
disimpan di tempat gelap (Jawiet al., 2007). Stabilitas antosianin juga
dipengaruhi oleh oksigen. Adanya oksigen disertai suhu tinggi merupakan faktor
yang dapat yang menyebabkan kerusakan pada berbagai jus berry dan isolasi
antosianin (Rein, 2005). Proses rusaknya antosianin karena pengaruh oksigen
dapat terjadi melalui mekanisme oksidasi langsung dan/atau melalui oksidasi
tidak langsung, di mana komponen yang teroksidasi dari bahan bereaksi dengan
antosianin menghasilkan produk tidak berwarna atau coklat (Rein, 2005). Talcott
et al. (2003) melaporkan bahwa kehadiran enzim antosianase atau polifenol
oksidase juga mempengaruhi kestabilan antosianin karena bersifat merusak
16
2.4 Kopigmentasi
2.4.1 Mekanisme reaksi kopigmentasi
Kopigmentasi merupakan salah satu cara untuk menstabilkan dan memperkuat
warna antosianin. Fenomena kopigmentasi pertama kali teramati pada tahun 1916
oleh Willstatter dan Zollinger yang mengamati warna pigmen anggur, oenin
(malvidin 3-glukosida) dengan penambahan tanin dan asam galat mengalami
perubahan warna dari merah menjadi merah kebiruan (Rein, 2005). Pada anggur,
ketidakstabilan dan reaktivitas antosianin bersama-sama dengan reaksi
kopigmentasi diperkirakan bertanggung jawab terhadap perubahan warna pada
proses pemeraman anggur. Kopigmentasi juga berperan dalam mempertajam dan
menstabilkan warna jus,buah dan produk berry,puree,jam, dan sirup sehingga
mampu meningkatkan penerimaan konsumen dan memperpanjang umur simpan
produk (Rein dan Heinonen, 2004). Kopigmentasi merupakan interaksi antara
struktur antosianin dengan molekul lain seperti logam (Al3+, Fe3+,Sn2+, Cu2+) dan
molekul organik lain seperti senyawa falvonoid (flavon, flavonon, dan flavonol),
senyawa alkaloid (kafein), dan sebagainya (Rein, 2005), sehingga terbentuk ikatan
antara molekul antosianin dengan kopigmen yang berperan dalam memperlambat
proses degradasi dan cenderung meningkatkan dan menstabilkan antosianin
selama penyimpanan (Tallcotet al., 2003).
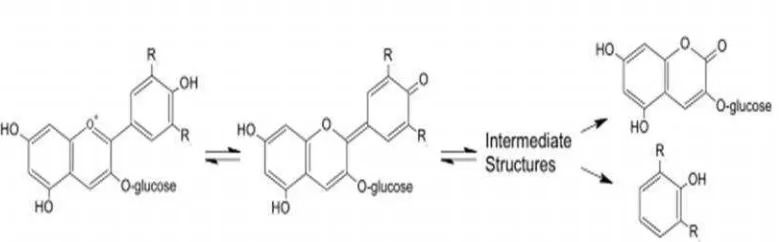
Kopigmentasi dapat terjadi melalui beberapa interaksi (Gambar 8) yaitu
kopigmentasi intermolekul (intermolecular copigmentation),kopigmentasi
intramolekul (intramolecular copigmentation), kopigmentasi pembentukan
17
sejenis (self association). Beberapa interaksi kopigmentasi ditunjukkan oleh
Gambar 8.
Gambar 8. Mekanisme reaksi kopigmentasi pada antosianin (Rein, 2005)
Kopigmentasiself associationmerupakan interaksi antara antosianin dengan
antosianin lain yang berperan sebagai senyawa kopigmen dengan bantuan gugus
gula sebagai pengikat (Rein dan Heinonen, 2004). Pada mekanisme kopigmentasi
intramolekul,interaksi terjadi antara antosianin dengan bagian dari molekul
antosianin itu sendiri, misalnya dengan gugus asil melalui reaksi kimia atau
dengan bantuan perlakuan fisik yang proses pengikatannya dapat terjadi dengan
bantuan gugus gula. Berdasarkan penyusunannya, interaksi intramolekul terbagi
atas 2 yaitu mono-asilasi pigmen dan di-asilasi pigmen. Kopigmentasi
pembentukan kompleks dengan logam merupakan interaksi pembentukan
kompleks antara antosianin dengan logam sebagai senyawa kopigmen. Namun,
kopigmentasi logam kurang menarik dalam bidang pangan karena pada umumnya
kontaminasi produk oleh logam sangat dihindari.
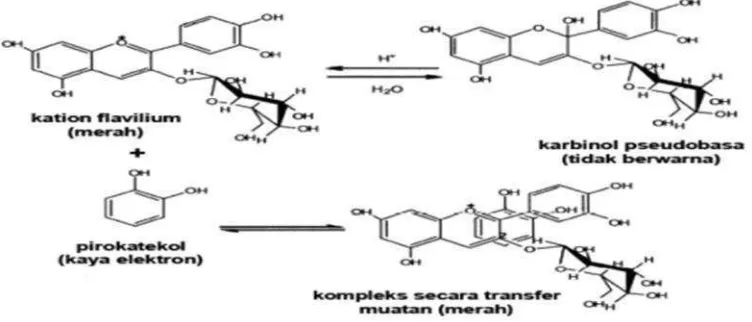
Reaksi kopigmentasi dalam penelitian ini termasuk ke dalam kopigmentasi
18
karena adanya interaksi antara antosianin dengan senyawa kopigmen seperti
flavonoid atau fenolik melalui ikatan lemah (hidrofobik atau ikatan hidrogen)
yang ditunjukkan oleh Gambar 9.
Antosianin B Kopigmen
A
Gambar 9. Interaksi intermolekul melalui ikatan hidrogen (A) dan hidrofobik (B) antara antosianin dan kopigmen
Menurut Castenada-Ovandoet al.(2009) secara garis besar, mekanisme
kopigmentasi dapat terjadi ketika kation flavilium yang bermuatan positif
(kekurangan elektron), menerima elektron dari senyawa kopigmen yang memiliki
elektron bebas, sehingga terjadi kesetimbangan elektron. Mekanisme
kopigmentasi intermolekuler antara antosianin dengan senyawa kopigmen yang
bukan berasal dari molekul antosianin itu sendiri dapat dilihat pada Gambar 10.
19
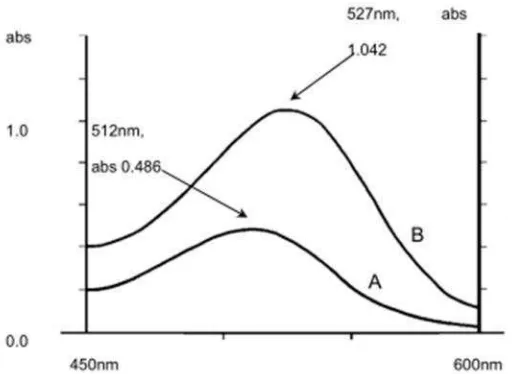
Fenomena kopigmentasi teramati sebagai pergeseran panjang gelombang
maksimum yang dikenal dengan nama efek batokromik atau efek hiperkromik.
Efek batokromik(Δ λmax)yaitu pergeseran absorpsi panjang gelombang
maksimum(λmax), contohnya terjadi perubahan warna pada antosianin dari
merah menjadi merah kebiruan (bluing effect) karena kopigmentasi (Rein, 2005).
Efek hiperkromik (Δ A) merupakan peningkatan intensitas warna antosianin
setelah kopigmentasi (Rein, 2005). Perubahan penyerapan panjang gelombang
maksimum (pergeseran batokromik) dan peningkatan intensitas warna (efek
hiperkromik) untuk sianidin 3 -glucosideterkopigmentasi dengan asam
rosmarinat ditunjukkan pada Gambar 11.
Gambar 11. Efek hiperkromik dan batokromik dari proses kopigmentasi A) Sianidin-3-glukosida, B) Sianidin-3-glukosida + asam rosmarinat
2.4.2 Faktor yang mempengaruhi kopigmentasi
Seperti halnya antosianin, reaksi kopigmentasi juga dipengaruhi oleh beberapa
faktor seperti pH, suhu, dan konsentrasi (Bakowskaet al., 2003). Kopigmentasi
20
terdapat kesetimbangan dengan bentuk quinoidalnya (Jettanopornsumran, 2009).
Menurut Yuwono dan Choirunnisa (2009), peningkatan pH dapat menyebabkan
penurunan monomer dan absorbansi antosianin. Peningkatan suhu dapat
menyebabkan kopigmentasi yang terjadi tidak stabil. Hal ini terjadi karena
kerusakan parsial pada ikatan hidrogen. Konsentrasi kopigmen yang ditambahkan
juga mempengaruhi kopigmentasi. Efek kopigmentasi akan lebih efisien jika
konsentrasi kopigmen lebih besar dibandingkan konsentrasi antosianin.
Konsentrasi antosianin sebelum reaksi kopigmentasi harus di atas 3,5 x 10-5M
agar kopigmentasi efektif (Rein, 2005).
Rein (2005) menyatakan bahwa penggunaan rasio molar kopigmen terhadap
antosianin yang terlalu rendah akan menyebabkan kopigmentasi tidak efektif, dan
rasio terlalu tinggi menyebabkan tidak efisien terhadap penggunaan kopigmen.
Menurut Boulton (2001), rasio yang terlalu rendah K=1 menghasilkan
pembentukan ikatan yang lemah, pada penggunaan rasio yang lebih tinggi yaitu
K=10 sampai K=100 menghasilkan pembentukan ikatan kopigmen terhadap
antosianin yang kuat sehingga dapat menstabilkan antosianin. Kopigmentasi
senyawa tanin dengan ekstrak antosianin kulit terung Belanda (Chypomandra
betaceaeSendtn) pada perlakuan rasio molar 100:1 dilaporkan dapat
meningkatkan kestabilan warna ekstrak antosianin sampai 40 hari penyimpanan
(Wahyuni, 2014).
2.4.3 Kopigmen
Kopigmen adalah senyawa yang digunakan dalam proses kopigmentasi yaitu
21
berwarna kekuningan yang terdapat secara alami dalam sel tanaman. Kopigmen
dilaporkan mampu meningkatkan warna antosianin yang ditandai dengan
pergeseran batokromik dan peningkatan penyerapan warna pada panjang
gelombang penyerapan warna maksimum. Senyawa ini juga memiliki
kemampuan menstabilkan selama proses dan penyimpanan. Senyawa yang umum
menjadi kopigmen adalah senyawa dari golongan flavonoid, polifenol, alkaloid,
asam amino, dan asam organik (Rein, 2005).
Banyak kopigmen yang telah diteliti dan menunjukkan hasil yang efektif dalam
proses kopigmentasi. Markovicet al. (2000) menyatakan bahwa asam ferulat
yang berasal dari golongan asam fenolik merupakan salah satu jenis kopigmen
yang tergolong efisien. Rutin dan quercetin dari jenis flavonol merupakan jenis
kopigmen yang menghasilkan efek kopigmentasi yang paling efisien dan kuat
(Bakowskaet al., 2003). Rein dan Heinonen (2004) menggunakan asam ferulat,
asam sinapat, dan asam rosmarinat untuk memperbaiki kualitasberry juice.
Selain itu, katekin dan asam galat (Kopjar dan Pilizota, 2009) serta tanin
(Wahyuni, 2014) juga dapat digunakan sebagai kopigmen. Kopigmen yang
digunakan dalam penelitian ini adalah tanin dan asam galat.
Tanin atau lebih dikenal dengan asam tanat merupakan salah satu jenis senyawa
dengan rumus molekul C76H52O46yang termasuk ke dalam golongan polifenol
yang larut dalam air dengan berat molekul 1701 mg/mMol (Ismarani, 2012) dan
mempunyai gugus hidroksil dan gugus lainnya (karboksil) sehingga dapat
membentuk kompleks dengan protein (Rahimet al.,2007 ). Senyawa tanin
22
batang, daun dan buah–buahan (Danartoet al., 2011). Beberapa jenis tumbuh–
tumbuhan atau tanaman yang dapat menghasilkan tanin, antara lain : tanaman
pinang, tanaman akasia, gabus, bakau, pinus dan gambir. Tanin juga banyak
ditemukan pada teh.
Tanin memiliki struktur kimia yang kompleks (Gambar 12). Berdasarkan
strukturnya, tanin dapat diklasifikasikan dalam dua kelas yaitu condensed tannin
(tanin yang dapat terkondensasi dan tidak dapat dihidrolisis kecuali dalam suasana
asam, contoh: katekin, proantocyanidin) danhidrolisable tannin(tanin yang
terhidrolisis dalam air, contoh: galotanin, caffetanin) (Danartoet al., 2011). Tanin
secara alami umumnya ada yang tidak berwarna tetapi ada juga yang berwarna
kuning sampai coklat terang. Dalam industri pangan, tanin sering dimanfaatkan
sebagai zat pewarna dan bahan pengawet minuman (Hagerman, 2002).
Gambar 12. Struktur dasar tanin (Hagerman, 2002)
Asam galat merupakan salah satu jenis kopigmen yang merupakan senyawa
fenolik C6-C1dengan rumus molekul C7H6O5. Struktur asam galat ditunjukkan
oleh Gambar 13. Asam galat memiliki karakteristik yaitu berwarna putih
23
biasanya digunakan untuk menentukan fenol dan memiliki aktivitas sebagai
antioksidan. Asam galat dapat ditemukan pada anggur (Belinda, 2011).
III. BAHAN DAN METODE
3.1 Tempat dan Waktu Penelitian
Penelitian ini dilaksanakan di Laboratorium Analisis Hasil Pertanian (Ruang
Analisis Pati dan Karbohidrat), Laboratorium Pengolahan Hasil Pertanian, Jurusan
Teknologi Hasil Pertanian Fakultas Pertanian dan Laboratorium Biomassa Jurusan
Kimia Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Lampung.
Penelitian ini dilaksanakan pada Bulan April sampai dengan Juni 2015.
3.2 Alat dan Bahan
Alat-alat yang digunakan pada penelitian ini adalah spektrofotometer Varian tipe
cary 50 probe, sentrifius merk Hitachi tipe CF16RX II,shaker, pH meter,
timbangan, botol gelap, mikropipet, pipet tip, baskom,juice extractormerk
Cosmos, dan alat-alat gelas.
Bahan baku yang digunakan adalah terung Belanda (Cyphomandra betacea
Sendtn) sebagai bahan baku jus, asam galat, dan tanin. Bahan-bahan kimia yang
diperlukan untuk keperluan analisis seperti larutanbufferHCl-KCl pH 1, larutan
buffersitrat pH 3,5 dan 4,5, air suling, serta bahan pembantu seperti kain saring,
25
3.3 Metode Penelitian
Percobaan pada penelitian ini dilakukan dengan menggunakan Rancangan Acak
Lengkap (RAL) yang disusun secara faktorial (2 x 4) dengan 3 ulangan. Faktor
pertama adalah jenis kopigmen (K) yaitu tanin (K1) dan asam galat (K2). Faktor
kedua adalah rasio molar kopigmen terhadap antosianin (R), yaitu Kontrol (R0),
50 (R1), 100 (R2) dan 150 (R3).
Data yang diperoleh diuji kemenambahan datanya dengan menggunakan uji
Tuckey dan kesamaan ragam data diuji dengan menggunakan uji Bartlet. Data
dianalisis dengan analisis ragam untuk mendapatkan penduga ragam galat dan
mengetahui ada tidaknya perbedaan antar perlakuan, kemudian untuk mengetahui
perlakuan terbaik pengujian dilanjutkan dengan BNT pada taraf uji 5% (Steel dan
Torrie, 1991).
3.4 Pelaksanaan Penelitian
3.4.1 Pembuatan larutanbufferpH 1, pH 3,5 dan pH 4,5
PembuatanbufferpH 1, pH 3,5 dan pH 4,5 menggunakan metode Sudarmadjiet
al. (1997). BufferHCl-KCl pH 1 dibuat dengan cara mencampurkan 50 mL
larutan HCl 0,2 M dengan 97 mL larutan KCl 0,2 M, kemudian diencerkan
dengan menambahkan air suling hingga volume 200 mL. Buffersitrat pH 3,5
dibuat dengan cara mencampurkan 40 mL larutan asam sitrat 0,1 M dengan 11
mL larutan natrium sitrat 0,1 M, kemudian ditambahkan air suling hingga volume
26
asam sitrat 0,1 M dengan 23 mL larutan natrium sitrat 0,1 M, dan kemudian
ditambahkan air suling hingga volume 100 mL.
3.4.2 Pembuatan jus terung Belanda
Jus terung Belanda dibuat dengan cara mengambil sebanyak 3 kg terung Belanda
dicuci, dipotong delapan, kemudian diambil sarinya dengan menggunakanjuice
extractor. Sari buah yang di dapat kemudian di saring dengan menggunakan kain
saring, lalu disentrifius dengan kecepatan 10.000 rpm pada suhu 5oC selama 10
menit. Jus kemudian diambil cuplikannya untuk mengukur pH dan konsentrasi
awal antosianin yang ditentukan secara spektrofotometri. Jus yang diperoleh
kemudian dimasukkan ke dalam botol dan di simpan dalam refrigerator untuk
perlakuan selanjutnya.
3.4.3 Kopigmentasi antosianin jus terung Belanda
Kopigmentasi dilakukan dengan mengambil sebanyak 18 mL jus, kemudian
dimasukkan ke dalam botol gelap, lalu ditambahkan kopigmen yaitu tanin dan
asam galat. Jumlah kopigmen tanin dan asam galat yang akan ditambahkan
dihitung sesuai dengan masing-masing perlakuan rasio molar kopigmen terhadap
antosianin (50, 100, dan 150) dengan perhitungan sebagai berikut :
Jumlah kopigmen = C x BM x V/1000 x R
Keterangan :
C = Konsentrasi antosianin awal (mMol)
BM = Berat molekul (BM tanin = 1701 mg/mMol dan BM asam galat = 170 mg/mMol)
V = Volume sampel
27
Botol sampel berisi jus yang telah ditambahkan tanin (315,11 mg, 630,21 mg,
945,32 mg) dan asam galat (31,49 mg, 62,98 mg, 94,47 mg) untuk masing-masing
rasio (50, 100, dan 150) ditutup dan homogenkan dengan menggunakanshaker
dengan kecepatan 100 rpm selama 10 menit hingga tanin dan asam galat
bercampur dengan jus. Masing-masing sampel disimpan di refrigerator selama ±7
hari, waktu yang diperkirakan cukup untuk berlangsungnya kopigmentasi.
3.5 Pengamatan
Pengamatan dilakukan untuk melihat efek batokromik dan hiperkromik dengan
spektrofotometri, konsentrasi antosianin, retensi warna dan kinetika reaksi.
3.5.1 Pengamatan efek batokromik dan hiperkromik
Sampel antosianin yang tidak dikopigmentasi dan antosianin terkopigmentasi
masing-masing sebanyak 1 mL dimasukkan ke dalam 3 mL larutanbufferpH 3,5.
Absorban sampel diukur dengan spektrofotometer pada berbagai panjang
gelombang 450 nm–600 nm (scanning) sampai diperoleh Absorban tertinggi
(Aλmax) (Rein, 2005). Analisisscanningdilakukan pada hari ke–7
(diperkirakan sudah terjadi kopigmentasi) untuk mengamati peningkatan
absorbansi maks (hiperkromik) dan pergeseran λ maks(batokromik).
3.5.2 Analisis konsentrasi antosianin
Penentuan kadar antosianin yang dinyatakan sebagai delphinidin-3-rutinosida
dilakukan dengan metode perbedaan pH pada spektrofotometer (Giusti dan
28
terkopigmentasi dimasukkan ke dalam 2 buah tabung reaksi yang berisi larutan
bufferpH 1 dan 4,5 masing-masing 3 mL. Masing-masing sampel diukur dengan
menggunakan spektrofotometer pada λ 525 nm dan 700 nmmenggunakan air
suling sebagai blanko. Konsentrasi antosianin dihitung menggunakan persamaan
berikut :
Absorban sampel (A) = (Aλmax–A700)pH1–(Aλmax–A700)pH4,5
Total antosianin (mMol) = (A x DF x 1000) / (ε x 1)
Total antosianin (mg/L) = (A x MW x DF x 1000) / (ε x 1)
Keterangan :
Aλmax= Absorban pada panjang gelombang maksimal MW Delphinidin-3-rutinosida = 647,0 g/mol
DF = Faktor pengenceran
Konstanta absortivitas molar = ε =26.900 L mol-1cm-1
3.5.3 Retensi warna
Perubahan warna antosianin jus terung Belanda tidak dikopigmentasi maupun
terkopigmentasi dilakukan dengan pengukuran absorbansi pada larutanbuffer
sitrat pH 3,5 dan λ 525 nm. Retensi warna dihitung dengan rumus :
Retensi Warna (%) = (At/A0) x 100%
Keterangan :
A0: absorban pada hari ke-0
29
3.5.4 Kinetika reaksi antosianin
Pengujian kinetika degradasi antosianin dilakukan pada suhu 60oC dengan
melarutkan 1 mL jus terung Belanda ke dalam 3 mL larutanbufferuntuk
masing-masing pH (1 dan 4,5) kemudian dipanaskan menggunakanwaterbathpada suhu
60oC selama 8 jam dengan interval waktu 2 jam, selanjutnya larutan diukur
absorbansinya pada panjang gelombang 525 nm (Shiet al., 1992). Konstanta laju
reaksi ordo pertama (k) ditentukan dari kemiringan garis, sedangkan waktu paruh
(t1/2) dihitung dengan menggunakan persamaan laju reaksi ordo satu sebagai
berikut :
C0adalah konsentrasi awal antosianin
Ctadalah konsentrasi antosianin setelah pemanasan waktu t
V. KESIMPULAN DAN SARAN
5.1 Kesimpulan
Berdasarkan hasil penelitian, dapat disimpulkan bahwa:
1. Jus terung Belanda terkopigmentasi tanin dan asam galat menunjukkan tidak
ada efek batokromik tetapi terjadi hiperkromik pada rasio molar yang berbeda.
2. Kopigmentasi dengan tanin dan asam galat mampu mempertahankan stabilitas
antosianin jus yang ditunjukkan oleh konsentrasi dan retensi warna antosianin
jus terkopigmentasi lebih tinggi (65,70%) dibandingkan jus tidak
dikopigmentasi (kontrol).
3. Uji kinetika reaksi pada suhu 60oC menunjukkan kopigmen asam galat pada
rasio molar 100 lebih efektif mempertahankan warna jus ditunjukkan oleh
konstanta kinetik yang lebih rendah (0,055 mM/jam) dan waktu paruh yang
lebih panjang 12,60 jam.
5.2 Saran
Berdasarkan hasil penelitian ini disarankan untuk dilakukan penelitian lanjutan
untuk mengetahui pengaruh penambahan kopigmen asam galat terhadap stabilitas
DAFTAR PUSTAKA
Amr, A. dan E. Al-Tamimi. 2007. Stability of the Crude Extracts of Ranunculus Asiaticus Anthocyanins and Their Use as Food Colourants.International Journal of Food Science & Technology. 42(8):985–991.
Asen, S., R.N. Stewart, dan K.H. Norris. 1972. Copigmentation of Anthocyanins in Plant Tissues and its Effect on Color.Phytochemistry. 11:1139-1145.
Bakowska, A., A.Z. Kucharska, dan J. Oszmiansk. 2003. The Effects of Heating, UV Irradiation, and Storage on Stability of the Anthocyanin-Polyphenol Copigment Complex.J. Food Chemistry. 81(3):349-355.
Belinda, P. 2011. Studi Reaksi Esterifikasi antara Asam Galat dan Gliserol dengan Menggunakan Gelombang Mikro. (Skripsi). Universitas Indonesia. Depok. 71 hlm.
Boulton, R. 2001. The Copigmentation of Anthocyanins and Its Role in the Color of Red Wine: A Critical Review.J. Enol Vitic. 52(2):67-87.
Brouillard, R. 1982. Chemical Structure of Anthocyanin. In: Anthocyanins as Food Colors. P. Markakis (Ed). Academic Press. New York. Pp 1-38.
Castaneda-Ovando, A., M.L. Pacheo-Hernandez, M.E. Paez-Hernandez, J.A Rodriguez, dan C.A. Galan-Vidal. 2009. Chemical Studies of Anthocyanins: A Review.J. Food Chemistry. 113(4):859–871.
Catrien. 2009. Pengaruh Kopigmentasi Pewarna Alami Antosianin dari Rosela (Hibiscus sabdariffa L.) dengan Rosmarinic Acid terhadap Stabilitas Warna pada Model Minuman Ringan. (Skripsi). Institut Pertanian Bogor. Bogor. 48 hlm.
Chang, L., Yen, Wen-Jhe, S. C. Huang, Duh, dan Pir-Der. 2002. Antioxidant Activity of Sesame.Food Chemistry. 78:347-354.
43
Danarto, YC., S.A. Prihananto, dan Z.A. Pamungkas. 2011. PemanfaatanTanin dari Kulit Kayu Bakau sebagai Pengganti Gugus Fenol pada Resin Fenol Formaldehid.Pengembangan Teknologi Kimia untuk Pengolahan Sumber Daya Alam Indonesia.5 hlm.
Del pozo-insfran, D. 2006. Emerging Technologies and Strategies to Enhance Anthocyanin Stability. (Dissertation). University of Florida. Gainesville.Pp 144.
Diniyah, N., T. Susanto, dan F. Choirunnisa. 2010. Uji Stabilitas Antosianin pada Kulit Terung.Jurnal Agrotechno. 1:9.
Fernando, J.M.R.C. dan G.K.R. Senadeera. 2008. Natural Anthocyanins as Photosensitizers for Dye-sensitized Solar Devices.Current Science. 95(5):663-666.
Giusti, M.M. dan R. E. Wrolstad. 2001. Characterization and Measurement of Anthocyanins by UV-Visible Spectroscopy in Current Protocols. In:Food Analytical Chemistry. Leon, B (ed). John Wiley and Sons, Inc. New York. Pp 241-259.
Hagerman, A.E. 2002. Tannin Chemistry. Journal of Range Management. 45:57-62.
Hanum, T. 2000. Ekstraksi dan Stabilitas Zat Pewarna Alami dari Katul Beras Ketan Hitam (Oryza sativa glutinosa).Buletin Teknologi dan Industri Pangan. 11:17-23.
He, F., N. Liang., L.Mu., Q. Pan., J. Wang., M.J. Reeves. dan C.Q Duan. 2012. Anthocyanins and Their Variation in Red Wines I. Monomeric
Anthocyanins and Their Color Expression: Review.Molecules. 17:1571-1601.
Herani dan M. Rahardjo. 2005.Tanaman Berkhasiat Antioksidan. Penebar Swadaya. Jakarta. 99 hlm.
Ismarani. 2012. Potensi Senyawa Tannin dalam Menunjang Produksi Ramah Lingkungan.Jurnal Agribisnis dan Pengembangan Wilayah.3:46-55.
Jettanapornsumran, M. 2009. Copigmentation Reaction of Boysenberry Juice. (Thesis). Massey University. Albani, New Zealand. Pp 208.
44
Jianteng xu. 2013. Identification and Stability of Acylated Anthocyanins in Purple-Fleshed Sweetpotato p40. (Thesis). Kansas State University. Manhattan, Kansas. Pp 42.
Kopjar, M., V. Pilizota, D. Subaric., dan J. Babic. 2009. Prevention of Thermal Degradation of Red Currant Juice Anthocyanins by Phenolic Compounds Addition.Journal of Food Science Technology. 1(1):24-30.
Kopjar, M. dan V. Pilizota. 2009. Copigmentation Effect of Phenolic Componds on Red Currant Juice Anthocyanins During Storage.Journal of Food Science Technology. 1(2):16-20.
Kumalaningsih, S. dan Suprayogi. 2006. Antioksidan Alami Terong Belanda (Tamarillo).Trubus Agrisarana. Surabaya. 4-11 hlm.
Lister, CE., S.C Morrison, N.S. Kerkhofs, dan K.M. Wright. 2005.The
Nutritional Composition and Health Benefits of New Zealand Tamarillos. New Zealand Institute for Crop & Food Research Limited. Christchurch, New Zealand. Pp 28.
Markovic, J.M.D., N.A. Petranovic, dan J.M Baranac. 2000. A
Spectrophotometric Study of the Copigmentation of Malvin with Caffeic and Ferulic Acids.J Agric Food Chem. 48:5530-5536.
Mateus, N. dan V. de Freitas. 2009. Anthocyanins as Food Colorants. In:
Anthocyanins. Biosynthesis, Functions, and Applications. Gould, K., K. Davies, C. Winefield (eds). Springer. New York. Pp 345.
Niendyah, H. 2004. Efektifitas Jenis Pelarut dan Bentuk Pigmen Antosianin Bunga Kana (Canna coccinea mill.) serta Aplikasinya pada Produk Pangan. Universitas Brawijaya Malang.http://digilib.ti.itb.ac.id/go.php?id=jiptumm gdl-s1-2004-niendyaha1533. Diakses pada tanggal 20 Oktober 2014.
Rahim, A.A., E. Rocca, J. Steinmetz, M.J. Kassim, R. Adnan, dan M.S. Ibrahim. 2007. Mangrove Tannins and Their Flavanoid Monomers as Alternative Steel Corrosion Inhibitors in Acidic Medium.Corrosion Science. 49:402–
417.
Rein, M. dan M. Heinonen. 2004. Stability and Enhancement of Berry Juice Color.Journal of Agricultural and Food Chemistry. 52(25):3106-3114.
Rein, M. 2005. Copigmentation Reaction and Color Stability of Berry Anthocyanin. (Dissertation). EKT series 1331. Department of Applied Chemistry and Microbiology, University of Helsinki. Finland. Pp 86.
45
Stabilitasnya terhadap Pemanasan: Jurnal Review.Jurnal Pangan dan Agroindustri.2:121-127.
Satyatama, D.I. 2008. Pengaruh Kopigmentasi terhadap Stabilitas Warna Antosianin Buah Duwet (Syzygium cumini). (Tesis). Fakultas Pertanian. Institut Pertanian Bogor. Bogor. 52 hlm.
Schwarz, M., J.J. Picazo-Bacete, P. Winterhalter, I. Hermosín-Gutiérrez. 2005. Effect of Copigments and Grape Cultivar on the Color of Red Wines Fermented after the Addition of Copigments.J. Agric. Food Chem. 53:8372–8381.
Sembiring, L.R. 2013. Pemanfaatan Ekstrak Terong Belanda (Cyphomandra BetaceaSendtn) sebagai Pewarna Alami Es Krim.
http://e-journal.uajy.ac.id/id/eprint.4373. Diakses pada tanggal 20 Oktober 2014.
Shi, Z., F.J. Francis, dan H. Daun. 1992. Quantitative Comparison of the Stability of Anthocyanins fromBrassica oleraceaandTradescantia pallidain Non-Sugar Drink Model and Protein Model System.J. Food Science. 57:768-770.
Smith M, K., D. Marley, K. Seigler, Singletary, dan B. Meline. 2000. Bioactive Properties of Wild Blueberry Fruits.Journal of Food Science. 65:352–356.
Steel, R.G.D. dan J.H. Torrie. 1991.Prinsip dan Prosedur Statistika. PT. Gramedia. Jakarta. 772 hlm.
Sudarmadji, S., B. Haryono, dan Suhardi. 1997.Prosedur Analisa untuk Bahan Makanan dan Pertanian. Penerbit Liberty. Yogyakarta. 54-56 hlm.
Syariah, W.A., Usmar, dan R. Syukur. 2011. Pengaruh Jus Buah Terung Belanda (Chypomandra betacea) terhadap Kadar Kolesterol Total Tikus Putih (Rattus norvegicus) Jantan.Majalah Farmasi dan Farmakologi. 15(2):95-98.
Talcott S.T., C.H. Brenes, D.M. Pires, dan D. Del Pozo-Insfran. 2003.
Phytochemical Stability and Color Retention of Copigmented and Processed Muscadine Grape Juice.J Agric Food Chem.51: 957-963.
Wahyuni, H. 2014. Pengaruh Kopigmentasi terhadap Stabilitas Warna Antosianin Ekstrak Kulit Terung Belanda (Cyphomandra betaceaSendtn). (Tesis). Universitas Lampung. Bandar Lampung. 50 hlm.
46
Yuwono, S.S. dan F. Choirunnisa. 2009. Stabilisasi Warna Antosianin Rosella (Hibiscus Sabdariffa L.) selama Penyimpanan dengan Metode