LAPORAN RESMI
PRAKTIKUM DASAR TEKNIK KIMIA I
Materi : ACIDI ALKALI
Oleh: KELOMPOK : 2 / SELASA SIANG
ANGGOTA : RIDHA CINDRA OKTIAN 21030113130110
PRAKTIKUM DASAR TEKNIK KIMIA I TEKNIK KIMIA FAKULTAS TEKNIK
UNIVERSITAS DIPONEGORO SEMARANG
Laboratorium Dasar Teknik Kimia I
i HALAMAN PENGESAHANMateri : Acidi Alkalimetri Kelompok : 2 Rabu Pagi Anggota :
1. Ridha Cindra Oktian NIM: 21030113130110 2. Andika Eko Mahendro NIM: 21030113140179 3. Erdita Aprilia Yuga P. NIM: 21030113120018
Telah disetujui dan disahkan oleh Asisten Pembimbing pada: Hari : Kamis
Tanggal : 19 Desember 2013
Semarang, 19 Desember 2013 Asisten Pembimbing,
Laboratorium Dasar Teknik Kimia I
ii PRAKATAPuji syukur kehadirat Tuhan Yang Maha Esa yang telah melimpahkan berkat dan rahmat-Nya sehingga Laporan Resmi Praktikum Dasar Teknik Kimia I ini dapat terselesaikan dengan baik.
Penyusunan laporan ini ditujukan sebagai salah satu syarat untuk melengkapi mata kuliah Praktikum Dasar Teknik Kimia I sekaligus mempelajari materi Acidi Alkalimetri yang telah diberikan di bangku kuliah.
Selesainya penyusunan laporan ini berkat bantuan dari berbagai pihak, oleh karena itu pada kesempatan ini terima kasih disampaikan kepada:
1. Allah Yang Maha Esa
2. Dr.Widayat, ST, MT selaku dosen penanggung jawab Laboratorium Dasar Teknik Kimia I Jurusan Teknik Kimia Fakultas Teknik Universitas Diponegoro;
3. Dani Puji Utomo selaku asisten pembimbing laporan resmi praktikum acidi alkalimetri dan semua asisten yang telah membimbing selama praktikum sehingga laporan resmi ini dapat terselesaikan;
4. Semua pihak yang telah membantu tersusunnya laporan ini.
Laporan resmi ini masih terdapat kekurangan, oleh karena itu diharapkan kritik dan saran yang membangun. Semoga laporan resmi Praktikum Dasar Teknik Kimia I materi Acidi Alkalimetri ini bermanfaat bagi semua pihak.
Semarang, 20 Desember 2013
Laboratorium Dasar Teknik Kimia I
iii DAFTAR ISIHALAMAN PENGESAHAN ... i
PRAKATA ... ii
DAFTAR ISI ... iii
DAFTAR TABEL ... v
DAFTAR GAMBAR ... vi
INTISARI ... vii
SUMMARY ... ix
BAB I PENDAHULUAN I.1 latar belakang ... 1
I.2 tujuan percobaan ... 1
I.3 manfaat percobaan ... 1
BAB II TINJAUAN PUSTAKA ... 2
BAB III METODE PERCOBAAN III.1 bahan dan alat yang digunakan ... 11
III.2 gambar alat ... 12
III.3 keterangan alat ... 13
III.4 cara kerja ... 14
BAB IV HASIL PERCOBAAN DAN PEMBAHASAN IV.1 hasil percobaan ... 16
IV.2 pembahasan ... 16
BAB V PENUTUP V.1 kesimpulan ... 24
V.2 saran ... 24
DAFTAR PUSTAKA ... 25 LAMPIRAN
Laboratorium Dasar Teknik Kimia I
v DAFTAR TABELLaboratorium Dasar Teknik Kimia I
vi DAFTAR GAMBARGambar 3.1 Statif ... 12
Gambar 3.2 Klem ... 12
Gambar 3.3 Buret ... 12
Gambar 3.4 Erlenmeyer ... 12
Gambar 3.5 Corong ... 12
Gambar 3.6 Pipet volum ... 12
Gambar 3.7 Pipet ukur ... 12
Gambar 3.8 Pengaduk ... 12
Gambar 3.9 Beaker glass ... 12
Gambar 3.10 Pipet tetes ... 13
Gambar 3.11 Labu takar ... 13
Gambar 3.12 Gelas ukur ... 13
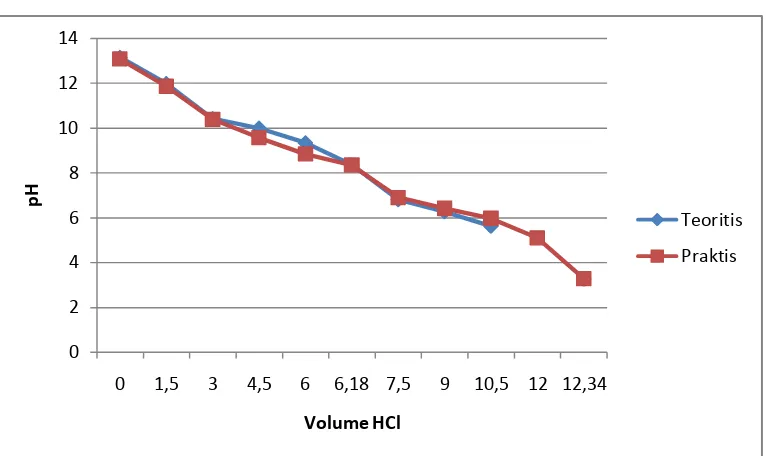
Gambar 4.1 Grafik Hubungan Volume HCl vs pH Sampel 1 ... 19
Laboratorium Dasar Teknik Kimia I
vii IntisariAsam basa merupakan parameter lingkungan yang vital dalam kehidupan sehari-hari. Air, tanah, limbah maupun zat makanan seperti buah dan sayur dapat mengandung zat asam maupun basa. Zat – zat tersebut dapat dinyatakan dalam derajat keasaman (pH) atau derajat kebasaannya (pOH). Hal ini dapat kita analisa dengan titrasi secara crosscheck. Tujuan percobaan ini adalah menganalisa kadar/konsentrasi asam atau basa suatu sampel.
Titrasi adalah penentuan kadar suatu zat secara volumetri menggunakan larutan lain yang telah diketahui kadarnya. Acidi alkalimetri merupakan salah satu bentuk titrasi berdasarkan reaksi netralisai antara zat titran dengan zat yang akan dititrasi. Acidimetri adalah penentuan kadar basa dalam suatu larutan menggunakan larutan asam yang telah diketahui konsentrasinya sebagai titran. Sedangkan alkalimetri adalah penentuan kadar asam dalam suatu larutan menggunakan larutan basa yang telah diketahui konsentrasinya sebagai tiran.
Dalam percobaan ini dilakukan standarisasi HCl dengan boraks 0,1 N, standarisasi NaOH dengan HCl yang telah distandarisasi, menentukan kadar Na2CO3 dan NaHCO3 dalam sampel I dan II, menentukan kadar asam asetat dalam cuka, asam sitrat dalam citrun zuur, dan asam askorbat dalam jeruk nipis.
Percobaan dimulai dengan menstandarisasi HCl dengan boraks 0,1 N dengan menggunakan indikator MO sampai warna berubah menjadi merah orange. Lalu menstandarisasi NaOH dengan HCl yang telah distandarisasi dengan indikator yang sama. Setelah itu mencari kadar Na2CO3 dan atau NaHCO3 dengan indikator PP sampai warna merah hampir hilang lalu ditambah MO dan dititrasi sampai warna merah menjadi orange. Kemudian mencari kadar asam sampel yaitu sari jeruk baby, sari jambu biji, dan asam cuka dengan menambah indikator Pp lalu dititrasi dengan NaOH sampai warna menjadi merah muda.
Setelah percobaan kami mendapatkan hasil data bahwa normalitas HCl yang distandarisasi dengan boraks 0,1 N adalah 0,2 N. Normalitas NaOH yang dengan persen eror 37,5 %.
Laboratorium Dasar Teknik Kimia I
viii SummaryAcid-base is the vital parameters of the environment in daily life. Analysis of the content or the concentration of acid-base can be determined with a cross check titration. Acid-base titration is called as acidi alkalimetry. The purpose of this experiment is to analyze the concentration of acid or alkaline in a sample.
Titration is the determination of substance’s concentration using other known solution in volumetric. The basic of acidi alkalimetry is neutralization reaction between the titrant with the substance that will be titrated. Acidimetry is the determination of base concentration in a solution using an acid solution as a titrant which concentration is known. Alkalimetry is the determination of the acid in a solution using an alkaline solution as a titrant which concentration is known.
In this experiment, things that should be done are HCl standardization with 0.1N of borax, NaOH standardization with standardized HCl, determination of Na2CO3 and NaHCO3 concentration in the sample I and II, determination of acetic acid’s concetration in vinegar, citric acid in water melon, and ascorbic acid in baby orange. The results of the experiment are practical concentration of Na2CO3 in the sample I and II are 10,176 ppm and 11,024 ppm. Theoretical concentration of concentration of HCl is easily changes so it affects the first equivalent point and the second equivalent point. Citric acid is a chemical substance that is used to give sour taste to foods and beverages. From the experimental results, concentration of citric acid in the citrun zuur is 8.918 %. Basically, vinegar is a solution of acetic acid in water. The concentration of acetic acid in the vinegar is 18.102 %. Ascorbic acid is another name for vitamin C. From the experiments, the concentration of ascorbic acid in the lime is 14.678%.
BAB I PENDAHULUAN
I.1 Latar Belakang Masalah
Asam basa merupakan parameter lingkungan yang sangat vital dalam kehidupan sehari-hari kita. Air, tanah, limbah, maupun zat makan seperti buah dan sayur dapat mengandung zat asam maupun basa. Zat-zat tersebut dapat dinyatakan dalam derajat keasaman (pH) atau derajat kebasaannya (pOH). Analisis mengenai kandungan atau yang lazim disebut konsentrasi asam maupun basa dalam kimia analisa dapat dilakukan dengan titrasi secara cross check. Zat asam dapat diketahui kadarnya dengan menggunakan zat basa sebagai titrannya maupun sebaliknya zat basa dapat dinilai menggunakan zat asam sebagai titran. Hal ini dapat dipelajari dalam materi acidi-alkalimetri atau kesetimbangan asam basa.
I.2 Tujuan Percobaan
a. Menganalisa kadar/konsentrasi suatu sampel (% berat, % volume, % R/V, % M, % N)
b. Menganalisa kadar aciditas, alkalinity dari suatu sampel I.3 Manfaat Percobaan
BAB II
TINJAUAN PUSTAKA
II.1 Pengertian
Titrasi adalah penentuan kadar suatu zat secara volumetrik menggunakan larutan lain yang telah diketahui kadarnya. Reaksi yang terjadi antara asam dan basa
HЀ + OH¯ H2O
Acidi alkalimetri merupakan salah satu bentuk titrasi berdasarkan reaksi netralisasi antara zat titran dan zat yang akan dititrasi.
Acidimetri: penentuan kadar basa dalam sutau larutan dengan menggunakan larutan asam yang telah diketahui konsentrasinya sebagai titran.
Natrium hidroksida lazim tercemar dengan natrium karbonat. Hal ini disebabkan NaOH dapat menyerap CO2 yang terdapat dalam udara dan bereaksi sebagai berikut :
CO2 + 2 OHЁ CO3²Ё + H2O
Seringkali natrium karbonat dan natrium bikarbonat terdapat bersama-sama. Dimungkinkan untuk menganalisis campuran senyawa ini dengan titrasi dengan asam standart.
II.2 Titrasi Karbonat
Ion karbonat dititrasi dengan asam kuat sebagai titran, reaksi yang terjadi CO3 2- + H3O+ HCO3¯ + H2O ... (1)
HCO3¯ + H3O+ H2CO3 + H2O ... (2) Ka1 = 4,6.10Ё7 pKa = 6,34
Ka2 = 4,4.10Ё11 pKa = 10,36
PP digunakan sebagai indikator untuk reaksi pertama (TAT pertama) dan MO digunakan sebagai indikator pada reaksi yang kedua (TAT kedua).
II.3 Hubungan Volume dalam Titrasi Karbonat
Dalam suatu larutan zat NaOH, Na2CO3, maupun NaHCO3 keberadaannya dapat sebagai zat tunggal. Namun sering kali terdapat bersama-sama misalnya, NaOH tercampur dengan Na2CO3 atau NaHCO3 dan Na2CO3 terdapat bersama-sama. Hal ini dapat teridentifikasi setelah senyawa tersebut dititrasi dengan HCl.
Zat Hubungan u/ identifikasi kualitatif Milimol zat yg ada
NaOH y = 0 M × x
Na2CO3 x = y M × x
NaHCO3 x = 0 M × y
NaOH + Na2CO3 x > y M × (x−y)
NaHCO3 + Na2CO3 x < y M × (y−x)
Keterangan : M = molaritas
x = volume yang dibutuhkan untuk mencapai TAT I menggunakan indikator PP y = volume yang dibutuhkan untuk mencapai TAT II menggunakan indikator MO Diagram titrasi Na2CO3 dan NaHCO3
Na2CO3……….. PP ditambahkan x ml x ml HCl
NaHCO3……….. PP berubah warna, MO ditambahkan x ml HCl
y ml NaCl NaHCO3 y-x ml HCl
NaCl ..………. MO berubah warna Keterangan
: dititrasi
: jumlah volume titran
Alkalimetri : penentuan kadar asam dalam sutau larutan dengan menggunakan larutan basa yang telah diketahui konsentrasinya sebagai titran.
Vitamin C merupakan nama lain dari ascorbic acid yang tidak lain adalah sejenis asam. Vitamin C larut dalam air dan dapat ditemukan buah jeruk, tomat, dan sayuran hijau dengan konsentrasi tinggi. Vitamin C merupakan vitamin yang tidak stabil karena mudah teroksidasi dan dapat hilang selama proses memasak. Peran utama vitamin C dalam tubuh adalah sebagai penghasil kolagen, sejenis protein penting daalm jaringan alat gerak. Vitamin C juga berperan penting dalam sintesa hemoglobin dan metabolisme asam amino. Selain itu, vitamin C juga mampu menangkal nitrit penyebab kanker. Hipoaskorbemia (defisiensi asam askorbat) bisa berakibat seriawan, baik di mulut maupun perut, kulit kasar, gusi tidak sehat sehingga gigi mudah goyah dan lepas, perdarahan di bawah kulit (sekitar mata dan gusi), cepat lelah, otot lemah dan depresi.
Jeruk nipis (Citrus aurantifolia Swingle) merupakan buah yang mengandung banyak air dan vitamin C yang cukup tinggi. Daun, buah, dan bunganya mengandung minyak terbang. Jeruk nipis mengandung asam sitrat, asam amino (triptofan, lisin), minyak atsiri (sitral, limonen, felandren, lemon kamfer, kadinen, gerani-lasetat, linali-lasetat, aktilaldehid, nildehid) damar, glikosida, asam sitrun, lemak, kalsium, fosfor, besi, belerang, vitamin B1 danC.
Dari kandungan berbagai minyak dan zat di dalamnya, jeruk nipis dimanfaatkan untuk mengatasi disentri, sembelit, ambeien, haid tak teratur, difteri, jerawat, kepala pusing atau vertigo, suara serak, batuk, bau badan, menambah nafsu makan, mencegah rambut rontok, ketombe, flu, demam, terlalu gemuk, amandel, penyakit anyang-anyangan (kencing terasa sakit), mimisan, dan radang hidung.
Dari beberapa penelitian terakhir menunjukkan, jeruk nipis juga mempunyai manfaat mencegah kekambuhan batu ginjal, khususnya batu ginjal kalsium idiopatik. Menurut laporan tersebut, mengonsumsi jeruk nipis bisa mencegah timbulnya batu ginjal.
Pada suatu penelitian diketahui bahwa jeruk nipis mengandung sitrat yang tinggi. Dinyatakan bahwa kandungan sitrat jeruk nipis lokal (Citrus aurantifolia Swingle yang bulat) 10 kali lebih besar dibanding kandungan sitrat pada jeruk keprok, atau enam kali jeruk manis. Kandungan sitratnya mencapai 55,6 gram per kilogram.
Indikator merupakan suatu zat yang digunakan untuk menentukan kapan titik akhir titrasi (TAT) tercapai dengan indikasi perubahan warna.
Pada saat TAT tercapai maka jumlah mol equivalen zat dititrasi sama dengan jumlah mol equivalen zat titran.
Indikator yang akan digunakan dalam titrasi acidi alkaimetri adalah : a. PP (phenolphthalein)
Asam dipotrik tidak berwarna, dengan trayek pH 8-9.6 b. MO (Methyl Orange)
Suatu basa berwarna kuning dalam bentuk molekulnya, dengan trayek pH 3,1-4,4
II.5 Kurva Titrasi
Titrasi asam basa dapat dinyatakan dalam bentuk kurva titrasi antara pH (pOH) versus mililiter titran. Kurva semacam ini membantu mempertimbangkan kelayakan suatu titrasi dalam memilih indikator yang tepat. Akan diperiksa dua kasus, titrasi asam kuat dengan basa kuat dan titrasi asam lemah dengan basa kuat.
a. Titrasi Asam Kuat dan Basa kuat
Asam kuat dan basa kuat terhidrolisa dengan lengkap dalam larutan air. Jadi pH sama di berbagai titik selama titrasi. Dapat dihitung langsung dari kuantitas stokiometri asam dan basa yang telah dibiarkan bereaksi. Pada titik kesetaraan, pH ditetapkan oleh jauhnya air terdisiosiasi pada 250 C, pH air murni adalah 7.00
b. Titrasi Asam Lemah dan Basa kuat
Pada kurva titrasi ini, kurva untuk suatu asam lemah mulai meningkat dengan cepat, ketika mula-mula ditambahkan basa. Laju pertambahan mengecil dengan bertambahnya konsentrasi B-. Larutan ini disebut terbuffer dalam daerah dimana peningkatan pH tersebut lambat.
Perhatikan bahwa bila asam itu dinetralkan [HB¯] ≈ [B¯] � = � −log[HB ¯]
¯ ≈ �
Setelah titik separuh jalan, pH naik lagi dengan lambat sampai terjadi perubahan besar pada titik kesetaraan.
II.6 Fisis dan Chemist Reagen
a. Fisis
BM : 60.05 g/mol
Densitas dan fase : 1.049 g cm−3, cairan: 1.266 g cm−3, padatan
TL = 16.5°C TD = 118.1°C
Penampilan = cairan tak berwarna atau kristal
Keasaman pKa = 4.76 pada 25°C
b. Chemist
Asam asetat bersifat korosif terhadap banyak logam seperti besi, magnesium, dan seng membentuk gas hidrogen dan garam-garam asetat (disebut logam asetat). Aluminium merupakan logam yang tahan terhadap korosi karena dapat membentuk lapisan aluminium oksida yang melindungi permukaannya. Karena itu, biasanya asam asetat diangkut dengan tangki-tangki aluminium.
2. HCl a. Fisis:
BM = 36,47 gr/mol BJ = 1,268 gr/cc TD = 85°C
TL = -110°C
Kelarutan dalam 100 bagian air 0°C = 82,3
Kelarutan dalam 100 bagian air 100°C = 56,3
b. Chemist:
Bereaksi dengan Hg2+ membentuk endapan putih Hg2Cl2 yang tidak larut
dalam air panas dan asam encer tetapi larut dalam amoniak encer, larutan KCN serta thiosulfat.
2 HCl + Hg2+ 2 H+ + Hg2Cl2
Hg2Cl2 + 2 NH3 Hg(NH4)Cl + Hg + NH4Cl
Bereaksi dengan Pb2+ membentuk endapan putih PbCl2
2 HCl + Pb2+ PbCl2 + 2 H+
Mudah menguap apalagi bila dipanaskan
Konsentrasi tidak mudah berubah karena udara/cahaya
Merupakan asam kuat karena derajat disosiasinya tinggi
a. Fisis:
BM = 40 gr/mol BJ= 2,13 gr/cc
TD= 1390°C
TL= 318,4°C
Kelarutan dalam 100 bagian air 0°C = 82,3
Kelarutan dalam 100 bagian air 100°C = 56,3
b. Chemist:
Dengan Pb(NO3) membentuk endapan Pb(OH)2 yang larut dalam reagen
exess
Pb(NO)3 + NaOH Pb(OH)2 + NaNO3 Pb(OH)2 + 2 NaOH Na2PbO2 + 2 H2O
Dengan Hg2(NO3)2 membentuk endapan hitam Hg2O yang larut dalam reagen
exess
Merupakan basa yang cukup kuat
Mudah larut dalam air dan higroskopis
Mudah menyerap CO2 sehingga membentuk karbonat
4. Na2B4O7. 10H2O (Boraks) a. Fisis:
BM= 381,43 gr/mol
BJ= 1,73 gr/ml TD= 200°C TL= 75°C
Kelarutan dalam 100 bagian air dingin ( 0,5°C ) = 1,3
b. Chemist:
Jika ditambah H2SO4 menjadi asam boraks
Na2B4O7 + H2SO4 + 5 H2O 4 H3BO3 + Na2NO3
Jika ditambah AgNO3 menjadi endapan putih perak mutu boraks
Na2B4O7 + AgNO3 + 3H2O AgBO2 + H3BO3 +NaNO3
Jika ditambahkan BaCl2 menjadi endapan putih Ba mutu boraks
5. H2SO4 a. Fisis:
BM= 98,08 gr/mol
TD= 3400C
TL= 10,440C
Kelarutan dalam 100 bagian air dingin = 80
Kelarutan dalam 100 bagian air panas = 59
b. Chemist:
Merupakan asam kuat
Jika ditambah basa membentuk garam dan air
Dengan Pb2+ membentuk PbSO4
Pb2+ + SO42- PbSO4
Dengan Ba2+ membentuk BaSO4
Ba2+ + SO42- BaSO4
6. Phenolphtalein (C20H16O4) a. Fisis:
BM= 318,31 gr/mol
BJ= 1,299 gr/cc
TD= 261°C
pH 8,0 – 9,6
Kelarutan dalam 100 bagian air = 8,22
b. Chemist:
Merupakan asam diprotik dan tidak berwarna
Mula-mula berdisiosiasi menjadi bentuk tidak berwarna kemudian kehilangan
H+ menjadi ion dengan sistem terkonjugasi maka dihasilkan warna merah. II.7 Satuan Konsentrasi
1. Molaritas (M)
Molaritas suatu larutan menyatakan jumlah mol suatu zat per liter larutan.
M = �
�
2. Molalitas (m)
Molalitas (m) = � 3. Normalitas (N)
Normalitas menyatakan jumlah ekivalen zat terlarut dalam tiap liter larutan, ekivalen zat dalam larutan bergantung pada jenis reaksi yang dialami zat itu, karena satuan ini dipakai dalam penyetara zat dalam reaksi.
Normalitas (N) = � �
�
Normalitas (N) = Molaritas x valensi 4. Fraksi Mol (X)
Bilangan yang menyatakan rasio jumlah mol zat terlarut dan pelarut dalam sebuah larutan. Secara umum jika terdapat larutan AB dimana A mol zat terlarut dan B mol zat pelarut, maka fraksi mol A (XA) adalah
XA =
+
Fraksi mol zat B (XB) adalah
XB =
+
BAB III
METODE PERCOBAAN
III.1 Alat dan Bahan Bahan
1. Boraks 4. Larutan Jeruk / Juice Jeruk
2. NaOH 5. HCl
3. Asam Asetat / Asam Cuka 6. Phenolptalein
Alat
1. Buret, statif, klem 6. Pengaduk
2. Erlenmeyer 7. Beaker Glass
3. Corong 8. Pipet Tetes
4. Pipet volum 9. Labu Takar
5. Pipet Ukur 10. Gelas Ukur
III.2 Gambar Alat
gambar 3.1 Statif gambar 3.2 Klem gambar 3.3 Buret gambar 3.4 Erlenmeyer
Gambar 3.7 Pipet Ukur Gambar 3.8 Pengaduk
Gambar 3.9 Beaker Glass
Gambar 3.10 Pipet Tetes Gambar 3.11 Labu Takar
Gambar 3.12 Gelas Ukur
III.3 Keterangan Alat
1. Buret : Sebagai tempat untuk titran
2. Klem : Penghubung antara statif dan buret 3. Statif : Penyangga buret
4. Corong : Untuk memindahkan larutan 5. Erlenmeyer : Tempat untuk analit
6. Pipet volume : Untuk mengukur volume larutan dengan ukuran tertentu 7. Pipet ukur : Untuk mengukur volume larutan dengan ukuran tertentu 8. Pengaduk : Untuk mengaduk analit
9. Beaker glass : Tempat untuk analit
11. Labu takar : Tempat untuk menghomogenkan/mencampur larutan 12. Gelas ukur : Untuk mengukur volume larutan
III.4 Cara Kerja
III.4.1 Standarisasi HCl dengan Borak 0,1 N
1. Ambil 10 ml borak 0,1 N dan masukkan ke dalam erlenmeyer 2. Tambahkan beberapa tetes indikator MO
3. Titrasi dengan HCl 0,1 N sampai warna berubah menjadi merah orange 4. Catat kebutuhan titran
NHCl = ��
��
III.4.2 Standarisasi NaOH dengan HCl yang Telah Distandarisasi 1. Ambil 10 ml NaOH, masukkan ke dalam erlenmeyer
2. Tambahkan beberapa tetes indikator MO
3. Titrasi dengan HCl sampai warna menjadi merah orange 4. Catat volume HCl
NNaOH = �� �
� �
III.4.3 Mencari Kadar Na2CO3 dan atau NaHCO3
1. Ambil sampel 10 ml larutan sampel, masukkan ke dalam erlenmeyer 2. Tambahkan beberapa tetes indikator PP
3. Titrasi dengan HCl sampai warna merah hampir hilang 4. Catat kebutuhan HCl pada TAT I = x ml
5. Tambahkan beberapa tetes indikator MO
6. Titrasi dengan HCl sampai warna menjadi merah orange 7. Catat kebutuhan HCl untuk Na2CO3 = y ml
III.4.4 Mencari Kadar Asam Asetat dan Jeruk Nipis 1. Ambil 5 ml cuka, encerkan sampai 100 ml aquadest
2. Ambil 10 ml larutan sampel tersebut, masukkan ke dalam erlenmeyer. 3. Tambahkan indikator PP beberapa tetes (± 3 tetes)
5. Catat kebutuhan NaOH
6. Menghitung normalitas asam sampel
Nasam = �� �
� ×
7. Ulangi langkah 1-6 tetapi menggunakan 20 ml jeruk nipis III.4.5 Mencari Kadar Asam Sitrat pada Citrun Zuur
1. Ambil 4 gram citrun zuur, encerkan sampai 100 ml aquadest 2. Ambil 10 ml larutan tersebut, encerkan sampai 100 ml aquadest 3. Ambil 10 ml larutan sampel tersebut, masukkan ke dalam erlenmeyer 4. Tambahkan indikator PP beberapa tetes (± 3 tetes)
5. Titrasi dengan NaOH sampai warrna merah hampir hilang 6. Catat kebutuhan NaOH
7. Menghitung normalitas asam sampel
BAB IV Praktis (ppm) Teoritis (ppm)
I 12.643,04 15.000 15,71
II 13.420,45 16.250 17,41
Tabel 4.1.2 Kadar NaHCO3 pada Sampel I dan II
Sampel
Kadar NaHCO3
% Error (%) Praktis (ppm) Teoritis (ppm)
I 9.986,59 12.000 16,78
II 10.456,74 13.000 19,56
Tabel 4.1.3 Kadar Asam Asetat dalam Cuka
Sampel
Kadar Asam Asetat Praktis Teoritis
Cuka 18,12 25%
Tabel 4.1.4 Kadar Asam Sitrat dalam Citrun Zuur
Sampel
Kadar Asam Sitrat Praktis Teoritis Citrun Zuur 8,98% 99,5-100%
Tabel 4.1.5 Kadar Asam Askorbat dalam Jeruk Nipis
Sampel
Kadar Asam Askorbat Praktis Teoritis
Jeruk Nipis 7,2952% 0,049%
IV.2.1 Kadar Na2CO3 dan NaHCO3
Kadar praktis Na2CO3 dan NaHCO3 lebih kecil dibandingkan dengan kadar teoritis disebabkan oleh:
1. Kristal NaOH bersifat higroskopis, yaitu mudah bereaksi dengan CO2 di udara sesuai dengan reaksi: (Michelle Wiyanty Setiawan, 2011)
2 NaOH(s) + CO2 Na2CO3(aq) + H2O(l) (Anonim, 2013)
Kristal NaOH yang dibutuhkan dalam percobaan ini adalah 1,5 gram. Berat 1,5 gram yang diperoleh saat penimbangan tidak tepat mengandung 1,5 gram murni kristal NaOH karena kristal tersebut mengalami kontak langsung dengan udara. 2. Na2CO3 berasal dari natrium hidroksida yang bereaksi dengan CO2 di udara. Natrium hidroksida selalu terkontaminasi oleh sejumlah kecil pengotor yang paling serius di antaranya adalah natrium karbonat. Ketika CO2 diserap oleh larutan NaOH, terjadi reaksi berikut:
CO2 + 2OH- CO3 2- + H2O
Ion karbonat adalah basa, tetapi bereaksi dengan ion hidrogen dalam 2 tahap: CO3 2- + H3O+ HCO3- + H2O
HCO3- + H3O+ H2CO3 + H2O
Hal ini terjadi karena Na2CO3 dititrasi dengan HCl maka TAT dengan menggunakan indikator PP lebih kecil daripada indikator MO. Hal tersebut dapat terjadi karena pertama Na2CO3 hanya mengambil ion H+ untuk setiap molekul karbonat, sedangkan untuk titrasi kedua diperlukan 2 ion H+. Selisih antara kedua titik akhir titrasi semakin kecil pula. Akibatnya apabila larutan baku basa telah bereaksi dengan CO2 di udara maka normalitasnya lebih rendah saat menggunakan indikator PP.
(Underwood 154 dan 157) 3. Konsentrasi HCl mudah berubah karena HCl merupakan senyawa yang mudah bereaksi dengan senyawa lain di udara. Hal ini mempengaruhi pada TAT 1 dan TAT 2 dari sampel yang diberikan, baik sampel 1 maupun sampel 2 sesuai dengan reaksi:
Na2CO3 + HCl NaHCO3 + NaCl
Untuk menentukan kadar NaOH diperlukan larutan HCl, sehingga kadar NaOH yang didapat juga akan berbeda dengan kadar teoritis. Hal ini menyebabkan kadar dari sampel yang membutuhkan NaOH dan HCl sebagai titran terdapat perbedaan dengan kadar teoritis.
IV.2.2 Uji Asam Sitrat Metode Acidi Alkalimetri
Asam sitrun atau citrun zuur merupakan zat kimia yang digunakan untuk memberi rasa asam atau mengatur keasaman makanan dan minuman. Asam sitrun adalah nama lain dari asam sitrat dengan rumus kimia C6H8O7 atau CH2(COOH)-COH(COOH)-CH2(COOH). Struktur asam ini tercermin pada nama IUPAC-nya yaitu asam 2-hidroksi-1,2,3-propanatrikarboksilat. Keasaman asam sitrat didapatkan dari tiga gugus karboksil COOH yang dapat melepas proton dalam larutan. (Anonim, 2013)
Untuk mengetahui kadar dari asam sitrat, dilakukan pengujian dengan metode alkalimetri. Langkah-langkah dalam percobaan yaitu:
1. Menyiapkan 4 gram citrun zuur dan melarutkan dengan aquadest hingga 100 ml larutan.
2. Mengambil 10 ml larutan citrun zuur yang telah diencerkan dan memasukkan ke dalam erlenmeyer.
3. Menambahkan indikator PP beberapa tetes (± 3 tetes)
4. Menitrasi dengan NaOH hingga warna berubah menjadi merah hampir hilang. 5. Mencatat kebutuhan NaOH dan menghitung normalitas asam sitrat dalam
larutan citrun zuur.
Nasam = �� � � ×
Reaksi yang terjadi adalah C6H8O7 + 3 NaOH Na3(C6H5O7) + 3 H2O.
(Anonim, 2011) Dalam percobaan, kadar asam sitrat yang didapatkan adalah 8,98%. Kadar yang ditemukan lebih kecil dibandingkan kadar teoritis yaitu berkisar 99,5-100,5% dalam kondisi anhidrat (Anonim, 1995)
IV.2.3 Uji Asam Asetat dalam Cuka Metode Acidi Alkalimetri
dalam cuka. Sebuah titrasi melibatkan larutan yang sudah diketahui konsentrasinya (titran) dan larutan yang konsentrasinya belum diketahui (analit). Dalam percobaan ini titran adalah NaOH 0,13356 N dan analit adalah cuka yang telah diencerkan dengan faktor pengenceran 20x.
Ketika titrasi, terjadi netralisasi antara NaOH dengan CH3COOH dalam cuka menurut reaksi:
NaOH + CH3COOH NaCH3COO + H2O
Natrium hidroksida secara bertahap ditambahkan ke dalam cuka hingga semua asam asetat dalam cuka tepat habis. Pada titik ini reaksi selesai dan tidak ada lagi NaOH yang diperlukan. Titik ini disebut kesetaran titik reaksi.
Untuk mengetahui kapan titik ekivalen tercapai, ditambahkan larutan indikator yaitu phenolpthalein pada awal titrasi. Pada titik ekivalen titrasi, penambahan hanya satu tetes NaOH menyebabkan seluruh larutan dalam labu erlenmeyer berubah warna dari merah muda menjadi merah merah hampir hilang. Dari hasil percobaan, kadar asam asetat dalam cuka adalah 18,51%. Kadar yang didapat lebih kecil dari kadar teoritisnya yaitu 25%.
(Anonim, 2012) IV.2.3 Uji Asam Askorbat dengan Metode Acidi Alkalimetri
Asam askorbat adalah nama lain dari vitamin C. Vitamin C merupakan vitamin yang larut dalam air dan ditemukan dalam banyak makanan. Asam askorbat dalam konsentrasi tinggi ditemukan dalam buah jeruk, tomat, dan sayuran hijau. Vitamin C adalah vitamin yang tidak stabil karena mudah teroksidasi dan hilang dalam proses memasak.
Dalam larutan, asam askorbat akan bereaksi dengan NaOH menghasilkan garam natrium askorbat dan air menurut reaksi:
HC6H7O6 + NaOH NaC6H7O6 + H2O
0 2 4 6 8 10 12 14
0 1,5 3 4,5 6 6,18 7,5 9 10,5 12 12,34
pH
Volume HCl
Teoritis
Praktis
Dalam percobaan ini kadar asama askorbat dalam sampel adalah 7,2952% sedangkan kadar teoritisnya adalah 0,049%.
IV.2.4 Grafik Hubungan Volume HCl vs pH
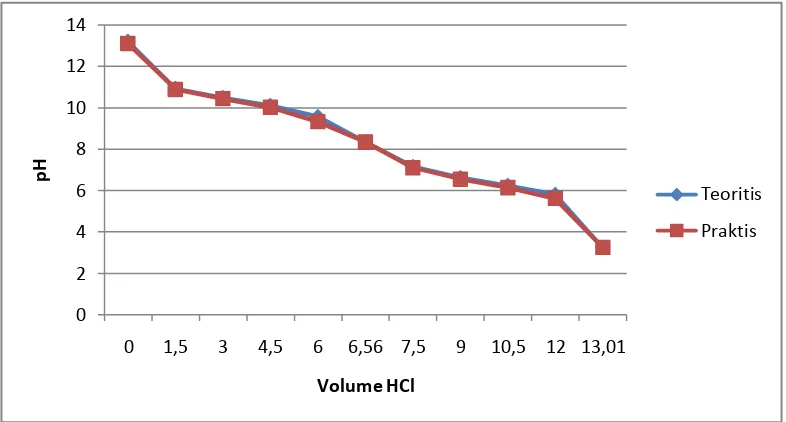
Grafik 4.2 Hubungan Volume HCl vs pH sampel 2
0 2 4 6 8 10 12 14
0 1,5 3 4,5 6 6,56 7,5 9 10,5 12 13,01
pH
Volume HCl
Teoritis
BAB V PENUTUP
V.1 Kesimpulan
1. Kadar praktis Na2CO3 dalam sampel I dan II adalah 12.643,04 ppm dan 13.420,45 ppm. Kadar teoritis Na2CO3 dalam sampel I dan II adalah 15.000 ppm dan 16.250 ppm.
2. Kadar praktis NaHCO3 dalam sampel I dan II adalah 9.986,59 ppm dan 13.420,45 ppm. Kadar teoritis NaHCO3 dalam sampel I dan II adalah 12.000 ppm dan 13.000 ppm.
3. Kadar praktis asam sitrat dalam citrun zuur adalah 8,98% sedangkan kadar teoritisnya sebesar 99,5-100,5%.
4. Kadar praktis asam asetat dalam cuka adalah 18,12% sedangkan kadar teoritisnya sebesar 25%.
5. Kadar praktis asam askorbat dalam jeruk nipis adalah 7,2952% sedangkan kadar teoritisnya sebesar 0,049%.
6. Kadar praktis Na2CO3 dan NaHCO3 dalam sampel I dan II lebih kecil dari kadar teoritisnya disebabkan oleh kristal NaOH bersifat higroskopis dan konsentrasi HCl yang mudah berubah mempengaruhi TAT 1 dan TAT 2. V.2 Saran
1. Memastikan semua alat yang akan digunakan dalam keadaan bersih. 2. Mencuci buret setiap pergantian titran.
3. Mencuci erlenmeyer setiap pergantian larutan atau zat yang akan dititrasi. 4. Segera melarutkan kristal NaOH setelah penimbangan untuk meminimalkan
reaksi dengan CO2 di udara.
DAFTAR PUSTAKA
A. L, Kemppainen. 2002. Determining Ascorbic Acid ini Vitamin C. Finlandia University, Wadsworth Group.
Analysis of Vitamin C. General Chemistry Laboratories University of Alberta. Anonim. 1995. Farmakope Indonesia edisi 4. Jakarta: Departemen Kesehatan RI. Anonim. 2005. Buku Petunjuk Praktikum Teknik Kimia I. Laboratorium Teknologi
Proses, Jurusan Teknik Kimia Fakultas Teknik Universitas Diponegoro Semarang.
Anonim. 2010. Titration of Vinegar. Dikutip dari
www.smc.edu/projects/28/chemistry_10_experiments/chio_titration.pdf/ pada 16 Oktober 2013 pukul 6.57 WIB.
Anonim. 2011. Asam Sitrat. Dikutip dari
www.lab.tekim.undip.ac.id/mikrobiologi/category/kelompok_dan_materi/ pada 16 Oktober 2013 pukul 22.44 WIB.
Anonim. 2012. Asidi Alkalimetri. Dikutip dari
www.grciez_pharmacy.blogspot.com/2012/11/asidi_alkalimetry.html/ pada 14 Oktober 2013 pukul 10.28 WIB.
Anonim. 2013. Dikutip dari
http://repository.usu.ac.id/bitstream/123456789/4/Chapter%20II.pdf/ pada 9 Oktober 2013 pukul 16.08 WIB.
Anonim. 2013. Dikutip dari http://web.pdx.edu/~atkinsdb/tech/321/NAOH.htm pada 3 November 2013 pukul 22.04 WIB.
Day, R.A and Underwood A.L. 1986. Analisa Kimia Kuantitatif edisi 5. Jakarta: Erlangga.
Hamilton and Simpson. 1960. Calculations of Analytical Chemistry 6th edition. McGraw Hill Book Company.
LEMBAR PERHITUNGAN REAGEN
NaOH
NaOH 0,15 N = NaOH 0,15 M Mol NaOH = MNaOH x Volume
= 0,15 x 0,25 = 0,0375 mol
Massa NaOH = Mol NaOH x BM NaOH = 0,0375 x 40
= 1,5 gram
HCl
�� = 1,19 3
Kadar HCl = 37%
Massa HCl = ×�× �
� × 100%
=0,22 × 0,25 × 36,461
37% × 100%
= 5,4199 gram
Volume HCl =
� =
5,4199
Lembar Perhitungan 1. Standarisasi HCl dengan boraks 0,1 N
v HCl = 5ml NHCl = �� ��
NHCl = 10 � 1
5 = 0,2 N
2. Standarisasi NaOH dengan HCl yang telah distandarisasi
v HCl = �� �
� � =
2,5 � 0,2
10 = 0,05 N 3. Mencari kadar Na2CO3 dan atau NaHCO3
Sampel 1: kadar Na2CO3 = 2� × � ×( 2 3
5. Kadar asam asetat, asam sari jambu biji, dan asam sari jeruk baby a. asam asetat
v NaOH = 0,8ml
c. asam sari jeruk baby v NaOH = 0,5ml
6. Kadar asli asam asetat, asam sari jambu biji, dan asam sari jeruk baby a. asam asetat
N asam asetat = (v cuka praktis x N cuka praktis ) 10
= (16 x 0,8)
10 = 1,28 N b. asam sari jambu biji
N asam sari jambu biji = × 1000 × �
c. asam sari jeruk baby
N asam sari jeruk baby = × 1000 × �
10. Persen eror kadar NaHCO3 rata – rata pada sampel 2: (2,25+5,3+8,3)
3 %= 5,28 % 11. Persen eror asam cuka
(1,28−0,8)
1,28 x 100 % = 37,5 %
12. Persen eror asam sari jambu biji (0,049−0,040 )
13. Persen eror asam sari jeruk baby (0,028−0,025 )
pH = 6,34 + log 0,6832 0,8668
= 6,237
Penambahan 12 ml
[NaHCO3] = (0,155 x 10) - (0,22 x 5,44) = 0,3532
pH = 6,34 + log 0,3532 1,968
= 5,810
Penambahan 13,01 ml
HCO3¯ = (13,01 – 6,56) x 0,22 = 1,419
H2CO3 = 1
2 x 1,419 = 0,7095 H = 4,6. 10−7× 0,7095 = 5,713.10-4
Laboratorium Dasar Teknik Kimia I
D-1LAPORAN SEMENTARA
PRAKTIKUM DASAR TEKNIK KIMIA I
Materi:
ACIDI ALKALIMETRI
NAMA : Ridha Cindra Oktian NIM: 21030113130110
GROUP : 1. Andika Eko Mahendro 2. Erdita Aprilia Yuga Pamujo
LABORATORIUM DASAR TEKNIK KIMIA TEKNIK KIMIA FAKULTAS TEKNIK
UNIVERSITAS DIPONEGORO SEMARANG
Laboratorium Dasar Teknik Kimia I
D-2I. TUJUAN PERCOBAAN
a. Menganalisa kadar/konsentrasi suatu sampel (% berat, % volume, % R/V, % M, % N)
b. Menganalisa kadar aciditas, alkalinity dari suatu sampel
II. PERCOBAAN
2.1 Bahan yang Digunakan
1. Boraks 4. Sari Jeruk Baby, Sari Jeruk
2. NaOH 5. HCl
3. Asam Asetat / Asam Cuka 6. Phenolptalein
2.2 Alat yang Dipakai
1. Buret, statif, klem 6. Pengaduk
2. Erlenmeyer 7. Beaker Glass
3. Corong 8. Pipet Tetes
4. Pipet volum 9. Labu Takar
5. Pipet Ukur 10. Gelas Ukur
2.3 Cara Kerja
2.3.1 Standarisasi HCl dengan Boraks 0,1 N
1.Ambil 10 ml boraks 0,1 N, masukkan ke dalam erlenmeyer. 2.Tambahkan beberapa tetes indikator MO.
3.Titrasi dengan HCl 0,1 N sampai warna berubah menjadi merah orange. 4.Catat kebutuhan titran
NHCl = ��
��
2.3.2 Standarisasi NaOH dengan HCl yang Telah Distandarisasi 1. Ambil 10 ml NaOH, masukkan ke dalam erlenmeyer.
2. Tambahkan beberapa tetes indikator MO.
3. Titrasi dengan HCl sampai warna menjadi merah orange. 4. Catat volume HCl
NNaOH = �� �
Laboratorium Dasar Teknik Kimia I
D-3 2.3.3 Mencari Kadar Na2CO3 dan atau NaHCO31. Ambil sampel 10 ml larutan sampel, masukkan ke dalam erlenmeyer. 2. Tambahkan beberapa tetes indikator PP.
3. Titrasi dengan HCl sampai warna merah hampir hilang. 4. Catat kebutuhan HCl pada TAT I = x ml.
5. Tambahkan beberapa tetes indikator MO.
6. Titrasi dengan HCl sampai warna menjadi merah orange. 7. Catat kebutuhan HCl untuk Na2CO3 = y ml.
Kadar Na2CO3 = 2� × � × ( 2 3
2.3.4 Mencari Kadar Asam Asetat dan Jeruk Nipis 1. Ambil 5 ml cuka, encerkan sampai 100 ml aquadest
2. Ambil 10 ml larutan sampel tersebut, masukkan ke dalam erlenmeyer. 3. Tambahkan indikator PP beberapa tetes (± 3 tetes)
4. Titrasi dengan NaOH sampai warna merah hampir hilang. 5. Catat kebutuhan NaOH
6. Menghitung normalitas asam sampel
Nasam = �� � � ×
7. Ulangi langkah 1-6 tetapi menggunakan 20 ml jeruk nipis
2.3.5 Mencari Kadar Asam Sitrat pada Citrun Zuur
1. Ambil 4 gram citrun zuur, encerkan sampai 100 ml aquadest 2. Ambil 10 ml larutan tersebut, encerkan sampai 100 ml aquadest 3. Ambil 10 ml larutan sampel tersebut, masukkan ke dalam erlenmeyer 4. Tambahkan indikator PP beberapa tetes (± 3 tetes)
5. Titrasi dengan NaOH sampai warrna merah hampir hilang 6. Catat kebutuhan NaOH
Laboratorium Dasar Teknik Kimia I
D-4 %asam = �� � �6�8 7
3
×
× 100%
2.4 Hasil Percobaan
2.4.1 Standarisasi HCl dengan Boraks 0,1 N NHCl = 10 � 0,1
5 = 0,2
2.4.2 Standarisasi NaOH dengan HCl yang Telah Distandarisasi NNaOH =
2.4.5 Kadar Asam Sari Jeruk Baby
Nasam = 0,5 � 0,2
10 × 10 = 0,1
2.4.6 Kadar Asam Sari Jambu Biji Nasam = 0,8 � 0,2
Laboratorium Dasar Teknik Kimia I
D-5 MENGETAHUIPRAKTIKAN ASISTEN
Laboratorium Dasar Teknik Kimia I
E-1 LEMBAR KUANTITAS REAGENMateri : Acidi Alkalimetri Hari/Tanggal : Rabu, 2 Oktober 2013 Kelompok : 2 Selasa siang
Nama : 1. Ridha Cindra Oktian 2. Andika Eko Mahendro 3. Erdita Aprilia Yugo Pamujo Asisten : Sella Kurnia Putri
KUANTITAS REAGEN
No Jenis Reagen Kuantitas
1. NaOH 0,2 N 250 ml
2. HCl 37 % 0,2 N 250 ml
3. Asam cuka rumah 20 ml
4. Sari jambu biji 20 ml
5. Sari jeruk baby 20 ml
TUGAS TAMBAHAN:
CATATAN:
Semarang, 2 Oktober 2013 Asisten,
Sella Kurnia Putri Kadar asam cuka, asam sari jambu biji, dan asam jeruk baby
Laboratorium Dasar Teknik Kimia I
F-1 REFERENSIMengapa kadar HCl bias lebuh besar dari kadar sebenarnya?
Karena, kadar NaOH setelah dititrasi pada percobaan kami 0,19 M dan kadar NaOH yang telah dititrasi dengan asam oksalat digunakan untuk menetukan kadar HCl setelah dititrasi. Berdasarkan teori, Lonjakan pH terjadi disebabkan terjadinya titik akhir titrasi dimana ion hidrogen (H+) dari HCl telah habis bereaksi dengan ion hidronium (OH-) dari NaOH.
Sebelum titrasi dilakukan, larutan titrat bersifat asam yang mengandung banyak ion hidrogen dalam larutan tersebut. Namun setelah titrasi dilakukan, jumlah ion hidrogen perlahan-lahan berkurang karena telah bereaksi dengan ion hidronium membentuk air, dan saat terjadi lonjakan pH secara drastis tersebut ion hidrogen (H+) dari HCl telah habis bereaksi dengan ion hidronium (OH-) dari NaOH. Dengan demikian, tidak terdapat lagi ion hidrogen dalam bentuk bebas dalam larutan titrat. Penambahan larutan titrat setelah titik akhir titrasi terjadi menyebabkan jumlah ion hidronium akan semakin meningkat dan menyebabkan naiknya pH larutan (pH larutan basa). Tidak adanya ion hidrogen di dalam elektrode gelas secara tiba-tiba akan membuat arus yang dihasilkan oleh elektrode gelas menjadi meningkat secara tiba-tiba dan kemudian turun secara tiba-tiba pula. Hal inilah yang memberi sinyal pada pH meter mengenai adanya peningkatan harga pH secara tiba-tiba dari larutan HCl yang dititrasi oleh pentiter (larutan NaOH 0,1N).
Kenapa digunakan asam oksalat? Bias diganti tidak?
Karena, Untuk menentukan konsentrasi suatu larutan asam atau basa diperlukan suatu larutan baku yaitu suatu larutan yang diketahui konsentrasinya dan biasanya berupa larutan asam basa yang mantap (konsentrasinya tidak berubah), sebagai larutan baku primer dapat dipakai larutan asam oksalat.
(http://apapunaku.blogspot.com/2012/03/abstrak.tujuan percobaan.adalah.html)
IN KIMIA ANALISIS, TITRASI / BY S HAMDANI /
“Larutan baku adalah larutan yang konsentrasinya sudah diketahui dengan pasti”
Larutan baku dapat dibuat dengan cara penimbangan zatnya lalu dilarutkan dalam
sejumlah pelarut(air). Larutan baku ini sangat bergantung pada jenis zat yang
Laboratorium Dasar Teknik Kimia I
F-1Larutan yang dibuat dari zat yang memenuhi syarat-syarat tertentu disebut larutan
baku primer. Syarat agar suatu zat menjadi larutan baku primer adalah:
Mudah diperoleh, dimurnikan, dikeringkan (jika mungkin pada suhu 110-1200C)
dan disimpan dalam keadaan murni.
Tidak bersifat higroskopis dan tidak berubah berat dalam penimbangan di udara.
Zat tersebut dapat diuji kadar pengotornya dengan uji kualitatif dan kepekaan
tertentu.
Sedapat mungkin mempunyai massa relatif dan massa ekivalen yang besar,
sehingga kesalahan karena penimbangan dapat diabaikan.
Zat tersebut harus mudah larut dalam pelarut yang dipilih
Reaksi yang berlangsung dengan pereaksi tersebut harus bersifat stoikiometrik dan
langsung. kesalahan titrasi harus dapat diabaikan atau dapat ditentukan secara tepat dan
mudah.
Larutan baku primer biasanya dibuat hanya sedikit, penimbangan yang
dilakukanpun harus teliti, dan dilarutkan dengan volume yang akurat. Pembuatan larutan
baku primer ini biasanya dilakukan dalam labu ukur yang volumenya tertentu. Zat yang
dapat dibuat sebagai larutan baku primer adalah asam oksalat, Boraks, asam
benzoat(C6H5COOH), K2Cr2O7, AS2O3, NaCl.
Konsentrasi larutan baku yang digunakan dapat berupa molaritas(jumlah mol zat
terlarut dalam satu liter larutan) dan normalitas(jumlah ekivalen zat terlarut dalam satu liter
larutan). Satuan molaritas merupakan satuan dasar yang digunakan secara internasional,
sedangkan satuan normalitas biasa juga dilakukan dalam analisis karena dapat memudahkan
perhitungan.
Laboratorium Dasar Teknik Kimia I
F-1Dari beberapa jenis jeruk, yang paling nikmat menjadi bahan jus adalah jeruk baby. Dinamakan jeruk baby karena rasanya manis, tidak asam sehingga aman untuk dikonsumsi bayi. Meski bernama baby yang identik dengan mungil, jeruk ini memiliki ukuran mirip jeruk kebanyakan. Penentuan kualitas ini berdasarkan berat dan bentuk jeruk. Jeruk kualitas A memiliki berat 150 gram (gr) hingga 200 gr dan Kulit buah mulus tanpa cacat.
Manfaat Jeruk
1. Sumber vitamin. C Satu jeruk memiliki pasokan 116,2 persen dari nilai harian untuk asupan vitamin C. Vitamin C bermanfaat untuk menurunkan risiko kanker usus besar karena bisa membantu mengusir radikal bebas yang menyebabkan kerusakan pada DNA. Vitamin C, juga penting sebagai sistem kekebalan tubuh, baik untuk menangkal flu dan mencegah infeksi telinga berulang.
2. Antioksidan untuk kesehatan kulit. Antioksidan dalam jeruk membantu
melindungi kulit dari kerusakan akibat radikal bebas yang bisa menimbulkan tanda-tanda penuaan. Satu buah jeruk sehari dapat membantu Anda mempertahankan keremajaan kulit meski usia sudah beranjak 50 tahun.
3. Kaya Vitamin B6. Vitamin ini membantu mendukung produksi hemoglobin dan juga membantu menjaga tekanan darah tetap normal karena adanya magnesium. Menurut sebuah studi oleh peneliti AS dan Kanada, senyawa yang ditemukan dalam kulit buah jeruk yang disebut Polymethoxylated flavon (PMFs) juga memiliki potensi untuk menurunkan kolesterol lebih efektif dan tanpa efek samping daripada beberapa resep obat lainnya.
4. Serat jeruk untuk cegah diabetes. Serat dalam jeruk membantu menjaga kadar gula darah tetap stabil. Karena itulah, jeruk aman dijadikan makanan selingan sehat bagi penderita diabetes. Gula buah alami dalam jeruk, fruktosa, dapat membantu menjaga kadar gula darah tetap normal.
5. Kaya beta-cryptoxanthin. Mengkonsumsi makanan yang kaya akan
beta-cryptoxanthin, sebuah karotenoid dalam buah dan sayuran berwarna oranye-merah yang banyak ditemukan pada jeruk, jagung dan labu bisa menurunkan risiko serangan kanker paru-paru.
Nilai Gizi
Laboratorium Dasar Teknik Kimia I
F-1Kalori Energi 81
1 Mangkok Jeruk 165 g
%angka kecukupan gizi
Potasium 274
mg 9%
Karbohidrat 21 g 7%
Serat Pangan 4 g 15%
Gula 14 g -
Protein 2 g -
Total Lemak 0 g -
Vitamin A - 8%
Vitamin B6 - 7%
Vitamin C - 163%
Vitamin K - 3%
Magnesium - 5%
Tembaga - 9%
Riboflavin - 5%
Tiamin - 7%
Folat - 14%
Kalsium - 7%
Bagaimana Cara Mengkonsumsi Jeruk?
1. Dimakan langsung setelah dicuci bersih dan dibuka dari kulitnya 2. Dibuat sebagai jus jeruk
3. Dimasukan kedalam salad hijau/buah
4. Dibuat menjadi bahan dasar membuat tart/kue/muffin/cupcakes 5. Ditambahkan diatas yoghurt/tart sbg topping
Laboratorium Dasar Teknik Kimia I
F-1 Kandungan dan Manfaat Buah Jambu BijiJambu biji memiliki nama latin Psidium guajava dan termasuk dalam keluarga
Myrtaceae. Di beberapa daerah di Indonesia, jambu biji dikenal dengan nama jambu siki atau jambu klutuk. Nama jambu klutuk diberikan karena ketika dimakan, bijinya keras
berbunyi klutuk klutuk.
Buah jambu biji memiliki rasa yang manis meski ada juga yang rasanya sangat asam. Daging
buahnya berwarna merah muda ada juga yang putih. Bijinya keras, sangat banyak dan
kecil-kecil. Akan tetapi, sekarang ada varietas unggul dimana rasanya sangat manis dan hampir
tanpa biji.
Kandungan Nutrisi Jambu Biji
Jambu biji sangat kaya vitamin C, lebih tinggi dari buah jeruk, dan jauh lebih tinggi daripada
kiwi yang disebut-sebut sebagai rajanya vitamin C. Di samping serat, terutama pektin yang
merupakan serat larut, jambu biji juga mengandung mineral seperti mangan dan magnesium,
serta asam amino esensial seperti tryptophan. Juga fitokimia berkhasiat seperti asam elagat,
asam linoleat, dan asam korbigen.
Kandungan Gizi dalam 100 gram buah jambu biji.
Energi 49 kal
Protein 0,9 g
Lemak (0,3) g
Karbohidrat 12,2 g
Serat 5,6 g
Kalsium 14 mg
Fosfor 28 mg
Zat Besi 1,1 mg
Vitamin A 25 IU
Vitamin B1 0,02 mg
Laboratorium Dasar Teknik Kimia I
F-1 Air 86 g
Sumber: Intisari Online
Manfaat dan Khasiat Buah Jambu Biji
Selain rasanya manis dan menyegarkan, ternyata buah jambu biji juga bermanfaat bagi
kesehatan. Berikut ini beberapa khasiat dari jambu biji untuk kesehatan:
Menyembuhkan Infeksi
Berkat kandungan vitamin C-nya yang tinggi, buah ini dapat meningkatkan sistem kekebalan
tubuh. Bila dikonsumsi saat menderita radang tenggorok atau flu, akan mempercepat
penyembuhan akibat infeksi.
Mencegah Kanker
Kandungan vitamin C yang tinggi serta senyawa flavonoid membuat jambu biji memiliki
sifat antioksidan yang kuat yang mampu menghambat produksi nitrosamin, zat pemicu
kanker. Vitamin C yang cukup dalam darah juga mendorong kerja selenium dalam
menghambat sel kanker, terutama kanker paru-paru, prostat, payudara, dan usus besar.
Likopen dalam jambu merah mampu menghambat oksidasi lemak sehingga mencegah
kanker.
Mengatasi Penyakit Jantung Koroner
Kadar kalium pada jambu biji membantu jantung berdetak lebih teratur. Kandungan asam
elagat, asam linoleat, asam korbigen, dan juga serat mampu mengikat lemak sehingga
menghindari terbentuknya plak, penyebab jantung koroner.
Mengatasi Diabetes
Serat pektinnya mampu berperan menurunkan kadar glukosa darah sehingga cocok
Laboratorium Dasar Teknik Kimia I
F-1Menurunkan Tekanan Darah Tinggi
Jambu biji juga dapat menurunkan tekanan darah tinggi karena kadar kaliumnya, juga
seratnya yang mengikat lemak.
Antiradang dan Antivirus
Vitamin C-nya berperan membentuk kolagen yang bermanfaat untuk penyembuhan luka.
Senyawa flavonoidnya memiliki kemampuan sebagai antiradang, antialergi, dan antivirus.
Khasiat Lainnya
Menurut penelitian, daun jambu klutuk dapat membantu menaikkan kadar trombosit pada
penderita demam berdarah. Sedangkan buahnya yang kerap dijus lalu diberikan pada
penderita demam berdarah tidak berkhasiat menaikkan kadar trombosit tetapi lebih sebagai
suplai cairan yang banyak hilang akibat penurunan trombosit.
http://manfaatnyasehat.blogspot.com/2013/07/kandungan-dan-manfaat-buah-jambu-biji.html
Asam asetat
Dari Wikipedia bahasa Indonesia, ensiklopedia bebas
Asam asetat
Laboratorium Dasar Teknik Kimia I
F-1Asetil hidroksida (AcOH)
Hidrogen asetat (HAc)
Asam asetat, asam etanoat atau asam cuka[2] adalah senyawa kimia asam organik yang dikenal sebagai pemberi rasa asam dan aroma dalam makanan. Asam cuka memiliki rumus empiris C2H4O2. Rumus ini seringkali ditulis dalam bentuk CH3-COOH, CH3COOH, atau
CH3CO2H. Asam asetat murni (disebut asam asetat glasial) adalah cairan higroskopis tak
berwarna, dan memiliki titik beku 16.7°C.
Asam asetat merupakan salah satu asam karboksilat paling sederhana, setelah asam format. Larutan asam asetat dalam air merupakan sebuah asam lemah, artinya hanya terdisosiasi sebagian menjadi ion H+ dan CH3COO-. Asam asetat merupakan pereaksi kimia dan bahan
baku industri yang penting. Asam asetat digunakan dalam produksi polimer seperti
polietilena tereftalat, selulosa asetat, dan polivinil asetat, maupun berbagai macam serat dan kain. Dalam industri makanan, asam asetat digunakan sebagai pengatur keasaman. Di rumah tangga, asam asetat encer juga sering digunakan sebagai pelunak air. Dalam setahun,
Laboratorium Dasar Teknik Kimia I
F-1 Sifat-sifat kimiaKeasaman
Atom hidrogen (H) pada gugus karboksil (−COOH) dalam asam karboksilat seperti asam asetat dapat dilepaskan sebagai ion H+ (proton), sehingga memberikan sifat asam. Asam asetat adalah asam lemah monoprotik dengan nilai pKa=4.8. Basa konjugasinya adalah asetat
(CH3COO−). Sebuah larutan 1.0 M asam asetat (kira-kira sama dengan konsentrasi pada cuka
rumah) memiliki pH sekitar 2.4.
Dimer siklis
Dimer siklis dari asam asetat, garis putus-putus melambangkan ikatan hidrogen.
Struktur kristal asam asetat menunjukkan bahwa molekul-molekul asam asetat berpasangan membentuk dimer yang dihubungkan oleh ikatan hidrogen.[3] Dimer juga dapat dideteksi pada uap bersuhu 120 °C. Dimer juga terjadi pada larutan encer di dalam pelarut tak-berikatan-hidrogen, dan kadang-kadang pada cairan asam asetat murni.[4] Dimer dirusak dengan adanya pelarut berikatan hidrogen (misalnya air). Entalpi disosiasi dimer tersebut diperkirakan 65.0–66.0 kJ/mol, entropi disosiasi sekitar 154–157 J mol–1 K–1.[5] Sifat dimerisasi ini juga dimiliki oleh asam karboksilat sederhana lainnya.
Sebagai Pelarut
Asam asetat cair adalah pelarut protik hidrofilik (polar), mirip seperti air dan etanol. Asam asetat memiliki konstanta dielektrik yang sedang yaitu 6.2, sehingga ia bisa melarutkan baik senyawa polar seperi garam anorganik dan gula maupun senyawa non-polar seperti minyak dan unsur-unsur seperti sulfur dan iodin. Asam asetat bercambur dengan mudah dengan pelarut polar atau nonpolar lainnya seperti air, kloroform dan heksana. Sifat kelarutan dan kemudahan bercampur dari asam asetat ini membuatnya digunakan secara luas dalam industri kimia.
Reaksi-reaksi kimia
Laboratorium Dasar Teknik Kimia I
F-1garam asetat larut dengan baik dalam air. Salah satu pengecualian adalah kromium (II) asetat. Contoh reaksi pembentukan garam asetat:
Mg(s) + 2 CH3COOH(aq) (CH3COO)2Mg(aq) + H2(g)
NaHCO3(s) + CH3COOH(aq) CH3COONa(aq) + CO2(g) + H2O(l)
Aluminium merupakan logam yang tahan terhadap korosi karena dapat membentuk lapisan aluminium oksida yang melindungi permukaannya. Karena itu, biasanya asam asetat diangkut dengan tangki-tangki aluminium.
Dua reaksi organik tipikal dari asam asetat
Asam asetat mengalami reaksi-reaksi asam karboksilat, misalnya menghasilkan garam asetat bila bereaksi dengan alkali, menghasilkan logam etanoat bila bereaksi dengan logam, dan menghasilkan logam etanoat, air dan karbondioksida bila bereaksi dengan garam karbonat atau bikarbonat. Reaksi organik yang paling terkenal dari asam asetat adalah pembentukan etanol melalui reduksi, pembentukan turunan asam karboksilat seperti asetil klorida atau anhidrida asetat melalui substitusi nukleofilik. Anhidrida asetat dibentuk melalui kondensasi dua molekul asam asetat. Ester dari asam asetat dapat diperoleh melalui reaksi esterifikasi Fischer, dan juga pembentukan amida. Pada suhu 440 °C, asam asetat terurai menjadi metana dan karbon dioksida, atau ketena dan air.
Deteksi
Asam asetat dapat dikenali dengan baunya yang khas. Selain itu, garam-garam dari asam asetat bereaksi dengan larutan besi(III) klorida, yang menghasilkan warna merah pekat yang hilang bila larutan diasamkan. Garam-garam asetat bila dipanaskan dengan arsenik trioksida (AsO3) membentuk kakodil oksida ((CH3)2As-O-As(CH3)2), yang mudah dikenali dengan
baunya yang tidak menyenangkan.
Penggunaan
Botol berisi 2,5 liter asam asetat di laboratorium
Asam asetat digunakan sebagai pereaksi kimia untuk menghasilkan berbagai senyawa kimia. Sebagian besar (40-45%) dari asam asetat dunia digunakan sebagai bahan untuk
Laboratorium Dasar Teknik Kimia I
F-1DIPERIKSA
KETERANGAN TANDA TANGAN
NO TANGGAL
13.12.2013
18.12.2013
Perbaiki summary
Perbaikibab III, IV, V, dandapus
Halamanpadalampiranmisalperhitungangrafik
C-1, halamanberikutnya C-2, C-3
danseterusnya.
Selanjutnyakalaubisadijadiin 1 yafilenya,
pakai page break untukmengaturhalamannya.
Perbaiki cover
Perbaiki format, intisari, summary
Pebaiki bab IV