LAPORAN RESMI
PRAKTIKUM DASAR TEKNIK KIMIA I
MATERI : POTENSIOMETRI
OLEH :
NAMA : PRANA MAHISA NIM : 21030113120008 KELOMPOK : III / RABU PAGI
Laboratorium Dasar Teknik Kimia I Jurusan Teknik Kimia Fakultas Teknik
Universitas Diponegoro Semarang
Laboratorium Dasar Teknik Kimia I
LAPORAN RESMI
PRAKTIKUM DASAR TEKNIK KIMIA I
MATERI : POTENSIOMETRI
OLEH :
NAMA : PRANA MAHISA NIM : 21030113120008 KELOMPOK : III / RABU PAGI
Laboratorium Dasar Teknik Kimia I Jurusan Teknik Kimia Fakultas Teknik
Universitas Diponegoro Semarang
Laboratorium Dasar Teknik Kimia I
ii
HALAMAN PENGESAHAN
Judul Praktikum : POTENSIOMETRI
Anggota
1. Nama Lengkap : Bernadeth Ivannia
NIM : 21030113140119
Jurusan : Teknik Kimia
Universitas/Institut/Politeknik : Universitas Diponegoro
2. Nama Lengkap : Noor Hanifah Angga
NIM : 21030113130162
Jurusan : Teknik Kimia
Universitas/Institut/Politeknik : Universitas Diponegoro
3. Nama Lengkap : Prana Mahisa
NIM : 21030113120008
Jurusan : Teknik Kimia
Universitas/Institut/Politeknik : Universitas Diponegoro
Telah disahkan pada : Tempat : Semarang
Tanggal : 20 Desember 2013
Asisten Laboratorium PDTK 1
Laboratorium Dasar Teknik Kimia I
iii
PRAKATA
Puji dan syukur kami panjatkan kepada Allah SWT karena berkat rahmat dan karunianya, kami dapat menyelesaikan laporan resmi Praktikum Dasar Teknik Kimia 1 dengan lancar dan sesuai dengan harapan kami.
Ucapan terima kasih juga kami ucapkan kepada koordinator asisten laboratorium PDTK 1 Puji Lestari, asisten Prafitra Asih R.S.P sebagai asisten laporan praktikum potensiometri kami, dan semua asisten yang telah membimbing sehingga tugas laporan resmi ini dapat kami selesaikan. Kami juga mengucapkan terima kasih kepada teman-teman yang telah membantu kami, baik dalam segi waktu maupun motivasi.
Laporan resmi praktikum dasar tekinik kimia 1 ini berisi materi tentang potensiometri. Potensiometri merupakan metode penetapan kadar suatu zat dengan mengukur beda potensialnya. Tujuan dari percobaan ini adalah menentukan kadar NaOH dan HCL dalam larutan dengan metode potensiometri, untuk mendapatkan titik ekivalen pada titrasi asam basa.
Laporan resmi ini merupakan laporan resmi yang bisa kami ajukan, namun kami menyadari pasti ada kekurangan yang perlu kami perbaiki. Maka dari itu kritik dan saran yang sifatnya membangun sangat kami harapkan.
Semarang, 20 Desember 2013
Laboratorium Dasar Teknik Kimia I
iv
DAFTAR ISI
HALAMAN PENGESAHAN ... ii
PRAKATA ... iii
DAFTAR TABEL ... vi
DAFTAR GAMBAR ... vii
INTISARI ... viii
SUMMARY ... ix
BAB I. PENDAHULUAN 1.1. Latar Belakang ... 1
1.2. Rumusan Masalah ... 1
1.3. Tujuan Percobaan ... 1
BAB II. TINJAUAN PUSTAKA 2.1.. Landasan Teori ... 2
2.2. Pengertian dan Prinsip Metode Potensiometrik ... 2
2.3. Potensiometri Langsung ... 3
2.4. Titrasi Potensiometrik ... 3
2.5. Fisis dan Chemist Reagen ... 3
2.6. Aplikasi Potensiometri di Bidang Industri ... 4
BAB III. METODOLOGI PERCOBAAN 3.1. Alat dan Bahan ... 6
3.2. Gambar Alat Utama ... 7
3.3. Keterangan Gambar Alat Utama ... 7
3.4. Cara Kerja ... 7
BAB IV. HASIL PERCOBAAN DAN PEMBAHASAN 4.1. Hasil Percobaan ... 9
4.2 . Pembahasan ... 10
4.2.1. Penemuan Kadar HCl yang Lebih Kecil ... 10
4.2.2. Aplikasi Potensiometri ... 11
4.2.3. Macam – Macam Larutan Standar ... 12
Laboratorium Dasar Teknik Kimia I
v
BAB V. PENUTUP
5.1. Kesimpulan ... 15 5.2. Saran ... 15 DAFTAR PUSTAKA ... 16 LAMPIRAN
Laboratorium Dasar Teknik Kimia I
vii
DAFTAR TABEL
Laboratorium Dasar Teknik Kimia I
vii
DAFTAR GAMBAR
Gambar 3.1 Buret, Statif, Klem ... 6
Gambar 3.2. Magnetic Stirrer... 6
Gambar 3.3. Beaker Glass ... 6
Gambar 3.4. Gelas Ukur... 6
Gambar 3.5. Labu Ukur ... 6
Gambar 3.6. pH meter ... 6
Gambar 3.7. Gambar Alat Utama ... 7
Grafik 4.1. Penambahan Asam Oksalat terhadap pH ... 13
Grafik 4.2. Penambahan NaOH terhadap pH ... 13
Laboratorium Dasar Teknik Kimia I
viii
INTISARI
Pengukuran kadar asam maupun basa dapat dilakukan dengan beberapa cara baik secara manual menggunakan titrasi volumetrik ( aicdi alkalimetri ) maupun cara pembacaan langsung menggunakan alat potensiometri terutama pH meter. Pada potensiometri tidak menggunakan indikator yang menyebabkan perubahan warna tapi menggunakan elektroda untuk mengukur perubahan potensial. Tujuan percobaan ini yaitu menentukan kadar NaOH dan HCl dalam larutan dengan metode potensiometri untuk mendapatkan titik ekivalen pada titrasi asam basa.
Potensiometri adalah metode penetapan kadar zat dengan mengukur beda potensialnya. Prinsipnya berdasarkan persamaan Nerst. Titrasi potensiometrik melibatkan pengukuran potensial antara elektroda indikator dan elektroda pembanding, selisih potensialnya diukur dengan pH meter. Potensiometri digunakan dalam bidang industry seperti analisis klorida dalam pulp atau kertas, di bidang control bahan makanan seperti analisis NO3, F, Br, Ca, dalam minuman, susu, daging, atau jus buah.
Alat yang digunakan yaitu pH meter, magnetic stirrer, buret, statif, klem, labu ukur, erlenmeyer, gelas kimia, pipet tetes, gelas ukur, botol semprot, dan tissue. Bahan yang diperlukan yaitu asam oksalat 0,1 N ; NaOH 0,1 N; HCl ; dan aquadest. Langkah yang pertama yaitu standarisasi larutan NaOH dan langkah kedua yaitu menghitung kadar NaOH.
Kadar HCl yang kami temukan dalam percobaan 0,013 N sedangkan kadar aslinya yaitu 0,096 N. Persen errornya yaiu sebesar 86,46 %. Kadar HCl yang kami temukan lebih kecil karena factor basa dan galat karbonat, temperature saat titran yang tidak sesuai standar, dan keterbatasan elektroda kaca. Potensiometri dapat digunakan dalam penentuan kandungan organik total tanah. Larutan standar dibagi menjadi dua yaitu larutan standar primer dan larutan standar sekunder.
Faktor penyebab kadar HCl yang kami temukan lebih kecil yaitu basa dan galat karbonat, temperatur saat titrasi yang tidak sesuai standar, dan keterbatasan elektroda kaca. Aplikasi potensiometri yaitu menentukan kandungan karbon organic tanah menggunakan elektroda selektif CO2. Ada dua macam larutan standar yaitu
Laboratorium Dasar Teknik Kimia I
ix
SUMMARY
Measurement of acidity or alkalinity can be done in several ways, either manually using volumetric titration (acidi-alkalimetry) and also by direct reading using potentiometric instrument especially pH meter. In potentiometry we do not use indicators which undergo discoloration but we use electrodes to measure potential changes. The purpose of this experiment is to determine the levels of NaOH and HCl in solution with potentiometric method to obtain the equivalence point in acid-base titration.
Potentiometry is a method to determine the concentration of a solution by measuring the potential difference. The principle is based on the Nerst equation. Potentiometric titration involves mea suring the potential between the standard electrode and the indicator electrode, the difference in potential is measured with a pH meter. Potentiometry used in industrial fields for the analysis of chloride in pulp or paper, in the field of foodstuffs control such as analysis of NO3-,
F-, Br-, Ca2+ , in beverage, dairy, meat, or fruit juice.
The apparatus which are used are pH meter, magnetic stirrer, buret, stative, clamps, measuring flask, erlenmeyer, beaker, pipette, measuring glass, spray bottle, and tissue. Materials which are required are 0.1 N oxalic acid; 0.1 N NaOH; HCl, and distilled water. The first step is the standardization of NaOH solution and the second step is to calculate the concentration of NaOH.
HCl levels which is found in the experiment is 0.013 N while the actual concentration is 0.096 N. While the experimental error is 86.46%. HCl levels which we found is smaller, it’s because it errors due to base and alkaline carbonate, titration temperature is not standard, and the errors due to the limitations of the glass electrode. Potentiometric can be used to determine of total organic content of the soil. Standard solution can be classified into two, which are primary standard solution and secondary standard solution.
Factors causing the HCl concentration that we found to be smaller than the original levels are errors due to base and alkaline carbonate, titration temperature is not standard, and the errors due to the limitations of the glass electrode. Potentiometric applications can be used to determine soil organic carbon content using a CO2 selective electrode. Standard solution can be classified into two,
Laboratorium Dasar Teknik Kimia I
1
BAB I PENDUHULUAN
I.1. Latar Belakang
Pengukuran kadar asam maupun basa dapat dilakukan dengan beberapa cara baik secara manual menggunakan titrasi volumetrik (acidi alkalimetri) maupun cara pembacaan langsung menggunakan alat potensiometri terutama pH meter. Alat ini digunakan berdasarkan prinsip perubahan pH/potensial elektroda yang cukup besar antara suatu elektroda indikator dengan elektroda pembanding dalam suatu titrasi.
Perbedaan dari metode acidi alkalimetri dan potensiometri adalah pada acidi alkalimetri menggunakan indicator untuk mengetahui kapan terjadinya TAT (Titik Akhir Titrasi). Karena acidi alkalimetri dilakukan secara manual dengan cara menghitung berapa volume titran yang ditambahkan untuk mencapai TE (Titik Ekivalen).
Berbeda dengan metode potensiometri, metode ini merupakan cabang ilmu kimia yang mempelajari pengukuran perubahan potensial dari elektroda untuk mengetahui konsentrasi dari suatu larutan. Jadi pada potensiometri tidak menggunakan indikator yang menyebabkan perubahan warna, tetapi menggunakan elektroda untuk mengukur perubahan potensial dari suatu larutan, ketika terjadi lonjakan perubahan potensial yang tinggi, maka saat itulah terjadi TE (Titik Ekivalen).
I.2. Rumusan Masalah
a. Menentukan kadar NaOH dan HCl dengan potensiometri, serta dapat menentukan titik ekivalen pada titrasi asam basa.
I.3. Tujuan Percobaan
Laboratorium Dasar Teknik Kimia I
2
BAB II
TINJAUAN PUSTAKA
II.1. Landasan Teori
Potensiometri adalah metode penetapan kadar suatu zat dengan mengukur beda potensialnya. Prinsipnya yaitu berdasarkan persamaan “Nerst”.
�= 0+ ��
� ln���
+
Dimana: 0 = Potensial elektroda standar yang konstan dengan logam P = Tetapan gas
T = Temperatut mutlak
F = Tetapan Faraday
n = valensi ion
���+= aktivitas ion dengan larutan Persamaan diatas disederhanakan menjadi :
�= 0 + 0,0001983� ln���+ Untuk temperature 250C (298 K) :
�= 0+ 0,0591� ln���+
���+ diasumsikan sebagai ���+ (konsentrasi ion dengan molar)
II.2. Pengertian dan Prinsip Metode Potensiometrik
Laboratorium Dasar Teknik Kimia I
3
II.3. Potensiometri Langsung
Salah satu metode potensiometri adalah dengan melakukan pengukuran ion spesifik untuk mengukur konsentrasi ion hidrogen atau suatu ion lain dalam larutan dengan menggunakan pH meter.
II.4. Titrasi Potensiometrik
Titrasi potensiometrik melibatkan pengukuran potensial antara suatu elektroda indikator dan elektroda pembanding selama titrasi. Selisih potensialnya diukur dengan alat pH meter agar lebih akurat hasilnya. Suatu potensiometer biasa tidak dapat digunakan bersama suatu elektroda kaca karena tinggi resistansinya, 1-100 megaohm, dari elketrodanya. pH meter adalah suatu alat pengukur voltase yang dirancang untuk digunakan dengan sel-sel beresistensi tinggi sehingga arusnya akan rendah, juga dapat membaca pengukuran berbanding lurus dengan pH.
II.5. Fisis dan Chemist Reagen a. Asam Oksalat
Rumus Molekul : C2H2O4
Massa Molar : 90,03 g/mol (anhidrat) 126,07 g/mol (dihidrat)
Wujud : Kristal Putih
Densitas : 1,9 g/cm3 (anhidrat) 1,653 g/cm3 (dihidrat)
Kelarutan : 14,3 g/100 ml (250 C) pada air
23,7 g/100 ml (150 C) pada etanol 1,49 g/100 ml (150 C) pada dietel eter
Keasaman (pKa) : 1,25 ; 4,14
Titik nyala : 1660 C
Laboratorium Dasar Teknik Kimia I
4
b. HCl
Rumus Molekul : HCl
Massa Molar : 36,46 g/mol
Wujud : Cairan tak berwarna sampai dengan kuning pucat
Densitas : 1,18 g/cm3
Titik Lebur : −27,320C larutan 38%
Titik didih : 1100C larutan 20,2% 480C larutan 38%
Kelarutan : Bercampur penuh dengan air
Keasaman (pKa) : -8,0
Viskositas : 1,9 mPas pada 250C larutan 31,5%
c. NaOH
Rumus Molekul : NaOH
Massa Molar : 39,9971 g/mol
Wujud : Zat padat putih
Densitas : 2,1 g/cm3
Titik Lebur : 3180C
Titik didih : 13900C
Kelarutan : 111 g/100 mol (200C) pada air
Kebasaan (pKb) : -2,93
II.6. Aplikasi Potensiometri di Bidang Industri
Laboratorium Dasar Teknik Kimia I
5
Laboratorium Dasar Teknik Kimia I
6
BAB III
METODOLOGI PERCOBAAN
III.1. Alat dan Bahan III.1.1 Bahan
1. Asam oksalat 2. NaOH
3. HCl 4. Aquadest III.2.2 Alat
1 4
Gambar 3.1. Buret, Statif,Klem Gambar 3.4. Gelas Ukur
2 5
Gambar 3.2. Magnetic Stirrer Gambar 3.5. Labu Ukur
3 6
Laboratorium Dasar Teknik Kimia I
7
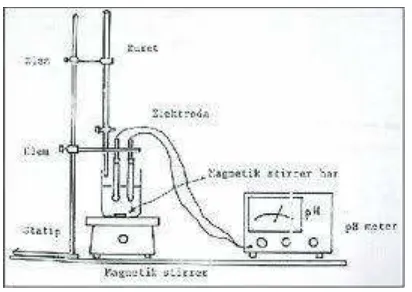
III.2. Gambar Alat Utama
Gambar 3.7. Gambar Alat Utama
III.3. Keterangan Gambar Alat Utama
1. Statif : Untuk menyangga buret
2. Klem : Penghubung antara statif dan buret 3. Buret : Sebagai tempat untuk titran
4. Gelas Kimia : Sebagai tempat untuk analit 5. Magnetic Bar : Sebagai pengaduk magnetic stirrer 6. Magnetic Stirrer : Sebagai pengaduk analit
7. Elektroda : Tempat elektroda pembanding dan elektroda referensi 8. Penyangga : Untuk memgatur elektroda agar berada di analit 9. pH meter : Memunculkan harga pH dari elektroda
III.4. Cara Kerja
III.4.1. Standarisasi Larutan NaOH
1. Kalibrasi pH meter dengan menggunakan larutan buffer standar pada dua harga pH atau tiga harga pH.
2. Masukkan 70 ml NaOH ke dalam gelas kimia dan masukkan magnetic bar ke dalamnya, tempatkan gelas kimia tersebut di atas magnetic stirer atur kecepatannya pada sekitar skala 6.
3. Masukkan asam oksalat ke dalam buret, tempatkan ujung karet pada mulut gelas kimia yang berisi NaOH.
Laboratorium Dasar Teknik Kimia I
8
5. (selalu lakukan pembilasan dan pengeringan setiap kali elektroda dimasukkan ke dalam cairan yang baru).
6. Catat pH yang terbaca oleh pH meter.
7. Alirkan asam oksalat 2 ml, catat perubahan pH yang terjadi, lakukan penambahan setiap 2 ml dan cata pH setiap penambahan (sampai pH menunjukan harga asam yang stabil).
8. Ulangi proses diatas (nomor 2-6) dengan larutan NaOH yang baru tetapi pencatatan pH dilakukan setiap penambahan PH 0,1 ml pada daerah yang mengalami lonjakan pH sedangkan pada daerah lain tetap 2 ml
9. Buat kurva titrasi antara pH vs volume asam oksalat dan tentukan titik ekivalennya.
10. Hitung kadar NaOH.
III.4.1. Penetapan kadar HCl
Laboratorium Dasar Teknik Kimia I
9
BAB IV
HASIL PERCOBAAN DAN PEMBAHASAN
1V.1. Hasil Percobaan
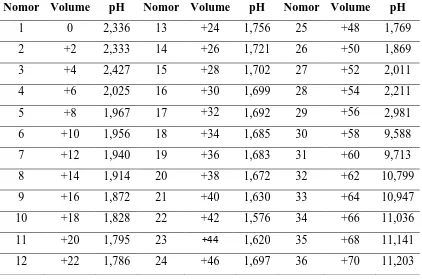
Tabel IV.1.1. Tabel Percobaan Asam Oksalat + NaOH
Tabel IV.1.2. Tabel Percobaan NaOH + HCl
Nomor Volume pH Nomor Volume pH
1 0 10,356 7 +12 5,049
2 +2 10,323 8 +14 5,334
3 +4 10,497 9 +16 4,936
4 +6 10,470 10 +18 4,519
5 +8 10,239 11 +20 4,166
6 +10 9,166 12 +22 3,833
Nomor Volume pH Nomor Volume pH Nomor Volume pH
1 0 2,336 13 +24 1,756 25 +48 1,769
2 +2 2,333 14 +26 1,721 26 +50 1,869
3 +4 2,427 15 +28 1,702 27 +52 2,011
4 +6 2,025 16 +30 1,699 28 +54 2,211
5 +8 1,967 17 +32 1,692 29 +56 2,981
6 +10 1,956 18 +34 1,685 30 +58 9,588
7 +12 1,940 19 +36 1,683 31 +60 9,713
8 +14 1,914 20 +38 1,672 32 +62 10,799
9 +16 1,872 21 +40 1,630 33 +64 10,947
10 +18 1,828 22 +42 1,576 34 +66 11,036
11 +20 1,795 23 +44 1,620 35 +68 11,141
Laboratorium Dasar Teknik Kimia I
10
As. Oksalat = NaOH NaOH = HCl V1N1 = V2N2 V1N1 = V2N2
11.0,1 = 70.N2 57.0,016 = 70.N2
N2 = 0,016 N N2 = 0,013 N
Kadar sebenarnya = 0,096 N Persen error = (0,096−0,013)
0,096 = 86,46 %
IV.2. Pembahasan
IV.2.1. Penemuan Kadar HCl yang Lebih Kecil
Normalitas HCl praktis yaitu 0,013 N lebih kecil dari normalitas sebenarnya yaitu 0,096 N dengan persen kesalahan sebesar 86,46 %. Hal ini disebabkan oleh beberapa faktor yaitu :
a. Basa dan Galat Karbonat
Galat adalah perbedaan numerik antara nilai sebenarnya dari suatu senyawa. Sumber umum galat bermacam-macam. Pada percobaan selalu digunakan NaOH yang terkontaminasi oleh sejumlah kecil pengotor,yaitu natrium karbonat.karena NaOH mudah menyerap CO2,maka terjadi reaksi antara NaOH dengan CO2, sebagai berikut:
CO2 + 2OH- CO32- + H2O
Ion karbonat adalah basa tapi ion ini dapat bergabung dengan ion hidrogen 2 tahap :
CO32- + H3O+ HCO3- + H2O HCO3- + H3O+ H2CO3 + H2O
Dihasilkan H2CO3 yang merupakan asam yang dapat menaikkan pH lebih cepat.
(Underwood 154) b. Temperatur Saat Titrasi yang Tidak Sesuai Standar
Laboratorium Dasar Teknik Kimia I
11
semakin aktif bergerak karena energinya bertambah. Sehingga terjadi tumbukan yang menghasilkan laju reaksi bertambah. Pada umumnya untuk setiap kenaikan suhu sebesar 100 C, laju reaksi akan naik menjadi 2 hingga 3 kali lipat lebih cepat dari semula, keadaan suhu saat titrasi di laboratorium tidak dipastikan secara tepat sehingga reaksi penetralan dapat berlangsung semakin cepat. Hal ini yang menyebabkan konsentrasi HCl yang kami temukan lebih kecil.
(kimia.upi.edu/staf/nurul/web/2012/0905762/isi_materi_3.html) c. Keterbatasan Elektroda Kaca
Pada larutan dengan pH yang sangat tinggi, spesifitas untuk H+ hilang. Ketergantungan tegangan terhadap pH berkurang, dan potensial menjadi terganrung pada aNa+. Batas atas pH bergantung
pada kation lainnya (misal Na+ atau K+) dan tipe dari kaca. Dengan demikian, akan berpengaruh pada kurva titrasi yang terbentuk.
(Underwood, 315 dan 316) HCl mudah menguap karena senyawa ini termasuk senyawa volatil. Titik didih HCl 530 C sehingga pada suhu ruangan akan membentuk fume.
IV.2.2. Aplikasi Potensiometri
Metode potensiometri banyak digunakan untuk menentukan kandungan ion-ion tertentu di dalam suatu larutan, salah satunya yaitu penerapan metode potensiometri pada penentuan kandungan karbon organic total tanah menggunakan elektroda selektif CO2
sebagai elektroda petunjuk. Prinsip penentuan kandungan karbon menjadi CO2 yang dihasilkan diukur konsentrasinya berdasarkan
perubahan potensial elektroda yang ditunjukkan oleh elektroda selektif CO2. Konsentrasi CO2 yang didapat sebanding dengan
konsentrasi karbon organik.
Laboratorium Dasar Teknik Kimia I
12
IV.2.3. Macam-Macam Larutan Standar
Larutan standar adalah larutan yang konsentrsinya sudah diketahui dan biasanya berfungsi sebagai titran dan alat ukur volume larutan beku. Larutan standar ada dua macam yaitu : 1. Larutan Standar Primer
Larutan yang mengandung zat padat murni yang konsentrasi larutannya diketahui secara tepat melalui metode gravimetri, dapat digunakan untuk menetapkan konsentrasi larutan lain yang belum diketahui. Contoh K2CrO7, As2O3, NaCl, asam
oksalat, dan asam benzoat. Syarat-syaratnya yaitu :
a. Zat harus mudah diperoleh, dimurnikan, dikeringkan, dan disimpan dalam keadaan murni
b. Tidak berubah berat dalam penimbangan di udara
c. Dapat diuji kadar pengotornya dengan uji-uji kuantitatif dan kepekaan tertentu
d. Mempunyai massa relatif dan massa ekivalen yang besar e. Mudah larut
f. Bersifat langsung 2. Larutan Standar Sekunder
Larutan suatu zat yang konsentrasinya tidak dapat diketahui dengan tepat karena berasal dari zat yang tidak pernah murni. Contoh: AgNO3, KMnO4, Fe(SO4)2. Syarat-syaratnya yaitu :
a. Derajat kemurnian lebih rendah daripada larutan baku primer
b. Mempunyai berat ekivalen yang tinggi c. Stabil dalam penyimpanan
Laboratorium Dasar Teknik Kimia I
13
IV.2.4. Gambar Grafik
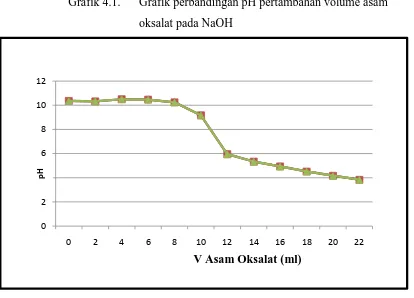
Grafik 4.1. Grafik perbandingan pH pertambahan volume asam oksalat pada NaOH
Grafik 4.2. Grafik perbandingan pH pertambahan volume NaOH pada HCl
0 2 4 6 8 10 12
0 2 4 6 8 10 12 14 16 18 20 22
0 2 4 6 8 10 12
0 2 4 6 8 10121416182022242628303234363840424446485052545658606264666870
V Asam Oksalat (ml)
p
H
p
H
Laboratorium Dasar Teknik Kimia I
14
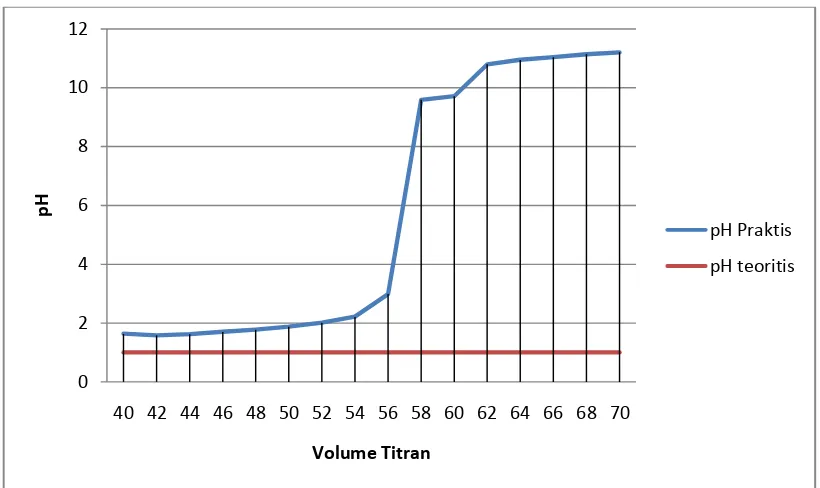
Grafik 4.3. Grafik perbandingan pH titrasi 70 ml HCl dengan NaOH 0,1 N antara teoritis dan praktis tiap 2ml
0 2 4 6 8 10 12
40 42 44 46 48 50 52 54 56 58 60 62 64 66 68 70
p
H
Volume Titran
pH Praktis
Laboratorium Dasar Teknik Kimia I
15
BAB V PENUTUP
V.1. Kesimpulan
1. Kadar HCl yang ditemukan lebih kecil disebabkan oleh faktor basa dan galat karbonat, temperatur saat titrasi yang tidak sesuai standar, dan keterbatasan elektroda kaca.
2. Potensiometri dapat diaplikasikan dalam bidang industri yaitu menentukan kandungan organik total tanah menggunakan elektroda selektif CO2
sebagai elektroda-elektroda penunjuk.
3. Larutan standar dibagi menjadi dua yaitu larutan standar primer dan larutan standar sekunder.
V.2. Saran
1. Mencuci bersih alat setelah dan sebelum digunakan .
2. Melakukan kalibrasi pH dengan menggunakan aquadest di awal praktikum.
3. Memasukkan titran sedikit demi sedikit ke dalam sampel agar tidak terlewat saat mencatat pH.
4. Sebelum memasukkan titran, menunggu pH meter sampai menunjukkan pH yang stabil.
Laboratorium Dasar Teknik Kimia I
16
DAFTAR PUSTAKA
Anonim.http://www.ut.ac.id/html/suplemen/peki/B10/penentuan-pH.htm. Diakses 11 November 2013.17:37
Anonim.http://jurnal.unej.ac.id/index.php/JAGT/article/download/37/16. Diakses 11 November 2013.17:49
Anonim.kimia.upi.edu/staf/nurul/web2012/0905762/isi-materi3.html. Diakses 11 November 2013.17:32
Day and Underwood,A.I.Analisa Kimia Kuantitatif edisi ke 4.Erlangga.Jakarta.1986 Metter,Julia.2005.”Cloud Formation”.Diakses 7 Desember 2013.12:03
Perry,R.H,and Green.Perry’s Chemical Engineering Hand Book 6th edition.Mc Graw Hill Book Co.Singapore.1984
Vogel,A.I.A Text Book Of Quantitative Anorganic Analysis. 5th edition.Longman Co.London.1988
Laboratorium Dasar Teknik Kimia I
A - 1
LEMBAR PERHITUNGAN REAGEN
Perhitungan kadar NaOH dengan mentitrasinya dengan asam oksalat dapat dilakukan dalam fase larutan. Pembuatan NaOH dengan konsentrasi dan kuantitas yang diingikan dilakukan dengan melarutkan padatan NaOH kedalam aquadest. Hal ini dibutuhkan 0,1 N NaOH 250 ml untuk dititrasi dengan asam oksalat. Maka garam padatan NaOH yang dibutuhkan dapat diketahui dengan cara :
M =
Karena N = M . valensi dan valensi NaOH = 1, maka yang dibutuhkan 0,1 N
0,1 =
Laboratorium Dasar Teknik Kimia I
B - 1
LEMBAR PERHITUNGAN KADAR
Kadar HCl Praktis
As. Oksalat = NaOH V1N1 = V2N2
11.0,1 = 70. N2
N2 = 0,016 N
NaOH = HCl
V1N1 = V2N2
57.0,016 = 70. N2
N2 = 0,013 N
Kadar HCl Teoritis
Konsentrasi HCl adalah 0,096 N Persen Kesalahan
(0,096-0,013)
Laboratorium Dasar Teknik Kimia I
C - 1
LEMBAR PERHITUNGAN GRAFIK
1. Mol HCl = N HCl . V HCl = 0.096.70 = 6,72 mmol 2. Penambahan 40 ml NaOH
Mol NaoH = N . V [H+] = N
V
= 0,0157 . 40 = 6,09
(70+40)= 0,055 N
= 0,63 mmol
NaOH + HCl → NaCl + H2O
m 0,63 6,72 0 pH = - log [H+] r 0,63 0,63 0,63 = - log 0,055 s - 6,09 0,63 = 1,26 3. Penambahan 42 ml NaOH
Mol NaoH = N . V [H+] = N
V
= 0,0157 . 42 = 6,06
(70+42)= 0,054 N
= 0,66 mmol
NaOH + HCl → NaCl + H2O
m 0,66 6,72 0 pH = - log [H+] r 0,66 0,66 0,66 = - log 0,054 s - 6,06 0,66 = 1,27 4. Penambahan 44 ml NaOH
Mol NaoH = N . V [H+] = N
V
= 0,0157 . 44 = 6,00
(70+44)= 0,053 N
= 0,69 mmol
NaOH + HCl → NaCl + H2O
Laboratorium Dasar Teknik Kimia I
C - 2
5. Penambahan 46 ml NaOH
Mol NaoH = N . V [H+] = N
V
= 0,0157 . 46 = 6,00
(70+46)= 0,052 N
= 0,72 mmol
NaOH + HCl → NaCl + H2O
m 0,72 6,72 0 pH = - log [H+] r 0,72 0,72 0,72 = - log 0,05 s - 6,00 0,72 = 1,28 6. Penambahan 48 ml NaOH
Mol NaoH = N . V [H+] = N
V
= 0,0157 . 48 = 5,97
(70+48)= 0,051 N
= 0,75 mmol
NaOH + HCl → NaCl + H2O
m 0,75 6,72 0 pH = - log [H+] r 0,75 0,75 0,75 = - log 0,051 s - 5,97 0,75 = 1,29 7. Penambahan 50 ml NaOH
Mol NaoH = N . V [H+] = N
V
= 0,0157 . 50 = 5,93
(70+50)= 0,049 N
= 0,79 mmol
NaOH + HCl → NaCl + H2O
m 0,79 6,72 0 pH = - log [H+] r 0,79 0,79 0,79 = - log 0,049 s - 5,93 0,79 = 1,31 8. Penambahan 52 ml NaOH
Mol NaoH = N . V [H+] = N
V
= 0,0157 . 52 = 5,90
(70+52)= 0,048 N
Laboratorium Dasar Teknik Kimia I
C - 3
NaOH + HCl → NaCl + H2O
m 0,82 6,72 0 pH = - log [H+] r 0,82 0,82 0,82 = - log 0,048 s - 5,90 0,82 = 1,32 9. Penambahan 54 ml NaOH
Mol NaoH = N . V [H+] = N
V
= 0,0157 . 54 = 5,89
(70+54)= 0,048 N
= 0,83 mmol
NaOH + HCl → NaCl + H2O
m 0,83 6,72 0 pH = - log [H+]
r 0,83 0,83 0,83 = - log 0,048 s - 5,89 0,83 = 1,32 10. Penambahan 56 ml NaOH
Mol NaoH = N . V [H+] = N
V
= 0,0157 . 56 = 5,84
(70+56)= 0,046 N
= 0,88 mmol
NaOH + HCl → NaCl + H2O
m 0,88 6,72 0 pH = - log [H+] r 0,88 0,88 0,88 = - log 0,046 s - 5,84 0,88 = 1,33 11. Penambahan 58 ml NaOH
Mol NaoH = N . V [H+] = N
V
= 0,0157 . 58 = 5,81
(70+58)= 0,045 N
= 0,91 mmol
NaOH + HCl → NaCl + H2O
Laboratorium Dasar Teknik Kimia I
C - 4
12. Penambahan 60 ml NaOH
Mol NaoH = N . V [H+] = N
V
= 0,0157 . 60 = 5,78
(70+60)= 0,044 N
= 0,94 mmol
NaOH + HCl → NaCl + H2O
m 0,94 6,72 0 pH = - log [H+] r 0,94 0,94 0,94 = - log 0,044 s - 5,78 0,94 = 1,35 13. Penambahan 62 ml NaOH
Mol NaoH = N . V [H+] = N
V
= 0,0157 . 62 = 5,75
(70+62)= 0,044 N
= 0,97 mmol
NaOH + HCl → NaCl + H2O
m 0,97 6,72 0 pH = - log [H+] r 0,97 0,97 0,97 = - log 0,044 s - 5,75 0,97 = 1,35 14. Penambahan 64 ml NaOH
Mol NaoH = N . V [H+] = N
V
= 0,0157 . 64 = 5,72
(70+62)= 0,043 N
= 1,00 mmol
NaOH + HCl → NaCl + H2O
m 1,00 6,72 0 pH = - log [H+] r 1,00 1,00 1,00 = - log 0,043 s - 5,72 1,00 = 1,37 15. Penambahan 66 ml NaOH
Mol NaoH = N . V [H+] = N
V
= 0,0157 . 66 = 5,68
(70+66)= 0,042 N
Labooratorium Dasar Teknik Kimia I
C - 5
NaOH + HCl → NaCl + H2O
m 1,04 6,72 0 pH = - log [H+] r 1,04 1,04 1,04 = - log 0,042 s - 5,68 1,04 = 1,38 16. Penambahan 68 ml NaOH
Mol NaoH = N . V [H+] = N
V
= 0,0157 . 68 = 5,65
(70+68)= 0,041 N
= 1,07 mmol
NaOH + HCl → NaCl + H2O
m 1,07 6,72 0 pH = - log [H+] r 1,07 1,07 1,07 = - log 0,041 s - 5,65 1,07 = 1,39 17. Penambahan 70 ml NaOH
Mol NaoH = N . V [H+] = N
V
= 0,0157 . 70 = 5,63
(70+70)= 0,040 N
= 1,09 mmol
NaOH + HCl → NaCl + H2O
Laboratorium Dasar Teknik Kimia I
D - 1
LAPORAN SEMENTARA
PRAKTIKUM DASAR TEKNIK KIMIA 1
Materi : POTENSIOMETRI
NAMA : PRANA MAHISA NIM : 21030113120008
GRUP : III / RABU PAGI
REKAN KERJA : 1. BERNADETH IVANNIA
2. NOOR HANIFAH ANGGA PUTRA
LABORATORIUM DASAR TEKNIK KIMIA TEKNIK KIMIA FAKULTAS TEKNIK
Laboratorium Dasar Teknik Kimia I
D - 2
I. TUJUAN PERCOBAAN
Menentukan kadar NaOH dan HCL dalam larutan dengan metode potensiometri, untuk mendapatkan titik ekivalen pada titrasi asam basa.
II. PERCOBAAN
2.1Bahan Yang Digunakan 1. Asam Oksalat 2. NaOH 0,1 N 3. HCL
4. Aquadest 2.2 Alat Yang Dipakai
1. pH meter 6. Gelas Kimia
2. Magnetic Stirer 7. Pipet tetes
3. Buret, Statif, Klem 8. Gelas Ukur
4. Labu Ukur 9. Botol Semprot
5. Erlenmeyer 10. Kertas Tissue
III. CARA KERJA
1. Kalibrasi pH meter dengan menggunakan larutan buffer standar pada dua harga pH atau tiga harga pH.
2. Masukkan 70 ml NaOH ke dalam gelas kimia dan masukkan magnetic bar ke dalamnya, tempatkan gelas kimia tersebut di atas magnetic stirer atur kecepatannya pada sekitar skala 6.
3. Masukkan asam oksalat ke dalam buret, tempatkan ujung karet pada mulut gelas kimia yang berisi NaOH.
4. Pasangkan elektroda pH sampai tercelup pada cairan dalam gelas kimia (selalu lakukan pembilasan dan pengeringan setiap kali elektroda dimasukkan ke dalam cairan yang baru).
5. Catat pH yang terbaca oleh pH meter.
Laboratorium Dasar Teknik Kimia I
D - 3
Catat pada jurnal dengan format sebagai berikut 7. Buat kurva titrasi antara pH Vs volume.
8. Hitung kadar NaOH.
IV. HASIL PENGAMATAN
Penambahan asam oksalat terhadap pH
As. Oksalat = NaOH V1N1 = V2N2
11 . N = 70. 0,1
N = 0,6364 N
Volume as.
Ph oksalat
(ml)
0 10,356
2 10,323
4 10,497
6 10,470
8 10,239
10 9,166
12 5,949
14 5,334
16 4,936
18 4,519
20 4,166
Laboratorium Dasar Teknik Kimia I D - 4
Penambahan NaOH terhadap pH
Volume pH Volume pH
0 2,336 36 1,683
2 2,333 38 1,672
4 2,427 40 1,630
6 2,025 42 1,576
8 1,967 44 1,620
10 1,956 46 1,697
12 1,940 48 1,769
14 1,914 50 1,869
16 1,872 52 2,011
18 1,828 54 2,211
20 1,795 56 2,981
22 1,786 58 9,588
24 1,756 60 9,713
26 1,721 62 10,799
28 1,702 64 10,947
30 1,699 66 11,036
32 1,692 68 11,141
34 1,685 70 11,203
NaOH = HCl
V1N1 = V2N2
57 . 0,6364 = 70. N2
N = 0,5182 N
SEMARANG, 09 OKTOBER 2013
PRAKTIKAN MENGETAHUI ASISTEN
Laboratorium Dasar Teknik Kimia I E - 1
LEMBAR KUANTITAS REAGEN
MATERI : POTENSIOMETRI
HARI/TANGGAL : 07 OKTOBER 2013 KELOMPOK : 3 / RABU PAGI
NAMA : 1. BERNADETH IVANNIA
2. PRANA MAHISA
3. NOOR HANIFAH ANGGA PUTRA
ASISTEN : PRAFITRA ASIH R.S.P
KUANTITAS REAGEN
NO JENIS REAGEN KUANTITAS
1 HCl 70 ml
2 NaOH 0,1 N 250 ml
3 Asam Oksalat 0,1 N 70 ml
TUGAS TAMBAHAN
Reff Aplikasi Potensiometri di Industri Reff Macam-Macam Larutan Standar
CATATAN SEMARANG, 07 OKTOBER 2013
ASISTEN
Bawa tissue
Bawa millimeter blok Titrasi tiap 2 ml
Laboratorium Dasar Teknik Kimia I
F - 1
REFERENSI
Basa dan Galat Karbonat
Natrium hidroksida merupakan basa yang paling lazim digunakan. Kalium hidroksida tidak menawarkan kelebihan atas natrium hidroksida dan lebih mahal. Natrium hidroksida selalu terkontaminasi oleh sejumlah kecil pengotor, yang paling serius di antaranya adalah natrium karbonat. Ketika CO2 diserap oleh
larutan NaOH, reaksi berikut ini terjadi :
CO2 + 2OH− → CO32− + H2O
Ion karbonat adalah basa, tetapi ion ini bergabung dengan ion hydrogen dalam dua tahap :
CO32− + H3O+ → HCO3− + H2O
( 1 )
HCO3− + H3O+ → H2CO3 + H2O
( 2 )
(Vogel, 154) Faktor – Faktor yang Mempengaruhi Laju Reaksi
b. Konsentrasi
Jika konsentrasi suatu larutan makin besar, larutan akan mengandung jumlah partikel semakin banyak sehingga partikel-partikel tersebut akan tersusun lebih rapat dibandingkan larutan yang konsentrasinya lebih rendah. Susunan partikel yang lebih rapat memungkinkan terjadinya tumbukan semakin banyak dan kemungkinan terjadi reaksi lebih besar. Makin besar konsentrasi zat, makin cepat laju reaksinya.
c. Suhu
Laboratorium Dasar Teknik Kimia I
F - 2
semakin besarnya energi potensial zat, maka semakin besar terjadinya tumbukan yang efektif, sehingga laju reaksi semakin cepat.
(http://kimia.upi.edu/staf/nurul/web2012/0905762/isi-materi3.html) Elektroda membran
a. Elektorda membran kaca
Kualitas paling bagus yang dijual dipasaran untuk elektroda membran kaca terbuat dari Corning 015, sebuah kaca yang terdiri dari 22% Na20, 6% CaO,dan
72% SiO. Ketika dicelupkan ke dalam larutan berair, maka pada bagian luar dari membran akan terhidrat sampai 10nm sampai beberapa jam. Hasil hidrasi dari membran menghasilkan muatan negatif, hal ini merupakan bagian dari fungsi kerja membran silika. Ion natrium, yang mampu bergerak
menembus lapisan hidrat berfungsi sebagai ion penghitung. Ion hidrogen dari larutan berdifusi kedalam membran dan membentuk ikatan yang lebih kuat dengan membran sehingga mampu menggeser keberadaan ion Na+ yang mengakibatkan konsentrasiion H+ meningkat pada membran .
Elektroda membran kaca sering dijual dalam bentuk kombinasi antara indikator dan elektroda pembanding. Penggunaan satu elektroda sangat bermanfaat untuk pengukuran pH.
Kelebihan elektroda kaca :
· Larutan uji tidak terkontaminasi
· Zat-zat yang tidak mudah teroksidasi & tereduksi tidak berinteferensi · Elektroda ini bisa dibuat cukup kecil untuk disisipkan dalam volume larutan yang sangat kecil.
· Tidak ada permukaan katalitis yang kehilangan aktivitasnya oleh kontaminasi seperti platina pada elektroda hidrogen.
Kelemahan elektroda kaca yaitu Pada kondisi pH yang sangat tinggi (misal NaOH 0,1M dengan pH = 13) berakibat :
Spesifisitas untuk H+ hilang
Ketergatungan tegangan pH berkurang
Potensial menjadi tergantung pada aNa+
Laboratorium Dasar Teknik Kimia I
F - 3
b. Keterbatasan Elektroda Kaca
Tidak ada alat-alat yang sempurnda atau pun bisa dipakai pada semua kondisi. Pada larutan denga pH yang sangat tinggi (misalnya, 0,1 M NaOH , pH ~ 13,dimana [H]+ sekitar 10−13 M dan [Na]+ sekitar 0,1 M), spesifisitas untuk H+ hilang; ketergantungan tegangan terhadap pH berkurang, dan potensial menjadi tergantung pada aNa+. Batas atas pH tergantung pada kation lainnya
(misalnya, Na+ atau K+) dan tipe dari kaca.
(Vogel, 315 dan 316) Larutan Baku
Larutan adalah campuran homogen. Disebut campuran karena susunannya dapat diubah-ubah, dan disebut homogen karena komponen-komponen penyusunnya telah kehilangan sifat fisiknya dan susunannya sangat seragam sehinnga tidak dapat diamati bagian-bagian penyusunnya dengan mikroskop sekalipun. Didalam suatu campuran terdapat molekul-molekul, atom-atom atau ion-ion dari dua zat atau lebih. (Benny karyadi 1994).
Larutan baku ( Larutan standar ) adalah larutan yang konsentrasinya sudah diketahui. Larutan baku biasanya berfungsi sebagai titran sehingga ditempatkan dalam buret, yang sekaligus berfungsi sebagai alat ukur volume larutan baku. Adapun larutan baku dibagi menjadi :
1. Larutan Baku Primer
Larutan yang mengandung zat padat murni yang konsentrasinya diketahui secara cepat melalui metode Gravimetri ( Perhitungan Massa). Dapat digunakan untuk menetapkan konsentrasi larutan lain yang belum diketahui. Nilai konsentrasi dihitung melalui perumusan sederhana, setelah dilakukan dalam volume tertentu.
Syarat-syarat larutan baku primer :
Zat harus mudah diperoleh, dimurnikan, dikeringkan ( jika mungkin pada suhu 110-120 ̊ C ) dan disimpan dalam keadaan murni.
5Laboratorium Dasar Teknik Kimia I
F - 4
Zat tersebut dapat diuji pengotornya dengan uji-uji kualitatif dan kepekaan tertentu.
Zat tersebut sedapat mungkin mempunyai massa relatif dan massa ekuivalen yang besar.
Zat tersebut harus mudah larut dalam pelarut yang dipilih.
Reaksi yang berlangsung dengan pereaksi harus bersifat stoikiometrik dan langsung.
2. Larutan Baku Sekunder
Larutan suatu zat yang konsentrasinya tidak dapat diketahui dengan tepat karena berasal dari zat yang tidak pernah murni. Konsentrasi larutan ini ditentukan dengan pembakuan menggunakan larutan baku primer, biasanya melalui metode titrimetri.
Syarat-syarat larutan baku sekunder :
Derajat kemurnian lebih rendah darpiada larutan baku primer.
Mempunyai berat ekivalen yang tinggi untuk memperkecil kesalahan penimbangan.
Larutannya relatif stabil dalam penyimpanan.
(http://jurnal.unej.ac.id/index/php/JAGT/acticle/donwload/37/16) Studi Aplikasi Metode Potensiometri Pada Penentuan Kandungan Karbon
Organik Total Tanah
Metode potensiometri merupakan salah satu metode yang banyak digunakan untuk menentukan kandungan ion-ion tertentu di dalam suatu larutan, namun belum banyak diterapkan untuk analisa sampel tanah. Dalam penelitian ini telah diteliti penerapan metode potensiometri pada penentuan kandungan karbon organik total tanah menggunakan elektroda selektif CO2 sebagai elektroda
penunjuk. Prinsip penentuan kandungan karbon organik total tanah adalah mengubah karbon organik total menjadi CO2 yang selanjutnya CO2 yang
dihasilkan diukur konsentrasinya berdasarkan perubahan potensial elektroda yang ditunjukkan oleh elektroda selektif CO2. Konsentrasi CO2 yang didapatkan
Laboratorium Dasar Teknik Kimia I
F - 5
CO2 mempunyai waktu respon 2,5 menit dengan tenggang waktu stabil 40 detik,
daerah konsentrasi pengukuran 9,09 x 10-4 M hingga 3,83 x 10 -1M dengan faktor Nernst 53 mV/dekade dan limit deteksi 4,5 x 10-4 M, pH optimum 4,8. Adanya CH3COO- atau H2PO4- dengan konsentrasi 10-2 M mengganggu pengukuran potensial CO2 dengan koefisien selektifitas (Kij) masing-masing 0,36
dan 0,133. Untuk mengoreksi kelayakan hasil pengukuran karbon organik total tanah dengan metode potensiometri, maka digunakan metode titrimetri sebagai pembandingnya. Hasil pengukuran dari kedua metode tersebut menunjukkan bahwa metode potensiometri dapat digunakan untuk menentukan kandungan karbon organik total tanah dengan hasil yang diperkirakan lebih akurat dibandingkan dengan metode titrimetri biasa.
(http://journal.fmipa.itb.ac.id/jms/article/view/52/46) Macroscopic lev
Five Senses:
Both chemicals, HCl and NH4OH, are clear liquids and volatile. They move from the liquid phase to the vapour phase easily. In the case of the NH4OH it releases molecular NH3. They both have a very strong pungent odour that makes your nose burn and eyes irritated. The concentrated HCl releases a white cloud of smoke immediately upon being released into the air. When you blow into the apparatus, a white cloud is formed at the opening of the two L-tubes. The cloud is only formed when the L-tube are close to one another. In the glass tube, the cloud is created closer to the end with the HCl. When the glass tube is opened, the smoke that has collected in the tube escapes from both ends and rises up into the air.
Lembar Asistensi
DIPERIKSA
KETERANGAN TANDA
TANGAN NO TANGGAL
1. 16-12-2013 1. Format acidi ada beberapa yang miss
2. Tab di daftar isi
3. Jarak antar subbab, gambar, table
4. Letak potensiometri di header
5. Summary ketemu aku ya
Semangat :D
2. 18-12-2013 1. Perbaiki summary
3. 19-12-2013
2. Judul grafik diatas grafik
1. Daftar isi dirapikan
2. Grafik jangan melewati batas header atau
footer
3. Format cover diperbaiki
4. Halaman pengesahan diperbaiki
4. 19-12-2013 ACC