LAPORAN RESMI PRAKTIKUM
KIMIA DASAR
Disusun Oleh:
Nama : Muhammad Irfan Khodil
NIM : 15/17825/ THP
Kelas : STPK-A
Jurusan : Teknologi Hasil Pertanian
Kelompok : II
Acara : Standarisasi Larutan 0,1 NnaOH dan Penggunaannya Dalam Penentuan Kadar Asam Cuka
Co.Ass : Iim Dewi Retnowati
FAKULTAS TEKNOLOGI PERTANIAN
INSTITUT PERTANIAN STIPER
I. ACARA II :
II. TANGGAL : 16 Oktober 2015
III. TUJUAN :
IV. DASAR TEORI
Asidi dan alkalimetri termasuk reaksi netralisasi yakni reaksi antara ion hidrogen yang berasal dari asam dengan ion hidroksida yang berasal dari basa untuk menghasilkan air yang bersifat netral.
Pada asidimetri digunakan asam sebagai larutan standart. Analisis di
V. ALAT DAN BAHAN A. Alat
1. Labu Ukur : 1 buah
2. Buret : 1 buah
3. Erlenmeyer : 3 buah 4. Pipet Tetes : 1 buah 5. Pipet Gondok : 1 buah
6. Corong : 1 buah
7. Gelas Beker : 1 buah B. Bahan
1. Kristal asam oksalat : 0,63 gram 2. Air suling : 100 ml 3. Larutan asam oksalat :.100 ml 4. Larutan NaOH : 15 ml 5. Indikator PP : 12 tetes
VI. CARA KERJA
2. Buret disiapkan dan di cuci, di isi larutan NaOh yang sudah di siapkan
3. Di tuangkan 15 ml larutan asam oksalat kedalam erlenmeyer, dan di tambahkan 2-3 tetes indikator PP, lalu di titrasi dengan larutan NaOH hingga berubah warna menjadi merah jambu
4. Lakukan titrasi sebnyak 3 kali B.Penentuan kadar asam cuka
1. Diambil 10 ml larutan cuka perdagangan dengan pipet gondok/ukur kemudian dimasukan ke dalam labu ukur kapasitas 1000 ml dan di encerkan hingga volume menjadi 1000 ml
2. Diambil 10 ml larutan encer dan dan dimasukan kedalam erlenmeyer dab di tambah 2-3 tetes indikator PP
3. Larutan ini dititrasi dengan larutan NaOH standart hingga berubah warna menjadi warna merah jambu/pink
VII. HASIL PENGAMATAN
1.Tabel Kegiatan N
o
Gambar Kegiatan Ketrangan
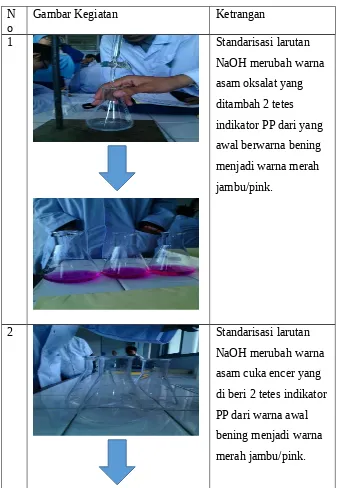
1 Standarisasi larutan
NaOH merubah warna asam oksalat yang ditambah 2 tetes indikator PP dari yang awal berwarna bening menjadi warna merah jambu/pink.
2 Standarisasi larutan
N NaOH II = V asam Oksalat X N asam oksalatV NaOH II
= 1519,5x0,1
= 0,07692
N NaOH III = V asam Oksalat X N asam oksalat V NaOH III
= 15x0,1 13,3 = 0,11278
Normalitas NaOH = N1+N32+N3
= 0,08108+0,07692+0,11278 3
= 0,09026 b.Penentuan kadar asam cuka
Volume rata-rata = V1+V32+v3
= 24,8+23,2+3 25
= 24,33
Normalitas asam cuka = Va x Na = Vb x Nb = 10 ml x Na = 17,1 x 0,09026 = Na= 0,15435 (untuk 1 ml) = untuk 10 ml
Devisiasi standard(s) =
√
∑
|Xn−X|2 n−1=
√
1,9467 2 =√
0,97335 = 0,986585019Devisiasi standard rata-rata(A) = Xa x100
= 0,75677 24,33 x100 = 3,11%
Devisiasi standard relative(S) = Xs x100
= 0,98658501924,33 x100
= 4,055%
Hasil pengukuran = X + a = 24,33 + 0,75667 = 25,08
= X – a = 24,33 – 0,75667 = 23,57
VIII. PEMBAHASAN
Pada percobaan kali ini kita melakukan analisis kuantitatif untuk menentukan kadar asam asetat dalam asam cuka komersial, yang beredar di pasaran. Di mana pada percobaan ini digunakan asam cuka. Analisis yang dilakukan adalah analisis tirimetri karena kadar komposisi ditetapkan berdasarkan volum pereaksi (konsentrasi diketahui). Penggunaan analisi tirimetri ini menggunakan larutan NaOH 0,1 N sebagai larutan standarnya. Karena NaOH merupakan larutan standar sekunder, maka sebelum digunakan terlebih dahulu larutan NaOH tersebut distandarisasi dengan larutan asam oksalat yang merupakan suatu standar primer.
larutan asam oksalat.Pada penentuan konsentrasi asam asetat terjadi reaksi antara asam lemah (CH3COOH) dengan basa kuat (NaOH).
Sebelum dititrasi, asam asetat telah diencerkan terlebih dahulu. Karena asam asetat adalah asam monoproptik, maka n asam asetat sebesar 1 ek/mol.
Berdasarkan praktikum yang telah dilakukan hasil normalitas NaOH yaitu 0,09026N dan kadar asam cuka setelah diuji yaitu18,522%. Kadar asam cuka antara kelompok yang satu dengan kelompok yang lain berbeda karena perbedaan banyaknya jumlah titran yang diteteskan ke dalam zat yang dititrasi.
Setelah pengamatan selesai dilakukan, praktikan melakukan perhitungan ralat. Dari perhitungan ralat standarisasi NaOH, diperoleh deviasi rata-rata relative (a) 2,53, deviasi standard (s) 3,32, deviasi standard rata-rata (A) 14,795%, deviasi standard relative (S) 19,415%dan tingkat ketelitian 85,205%.
elektron valensi menentukan sifat kimia dari unsur dan menentukan apakah atom unsur tersebut mampu berikatan dengan unsur lain atau tidak. Contoh nya golongan logam alkali yang mempunyai elektron terluar 1 sehingga menempati golongan IA dalam table periodik, elektron valensi dapat di gunakan sebagai acuan untuk menentukan golongan suatu unsur.
IX. KESIMPULAN
Adapun kesimpulan yang dapat diambil praktikan setelah melakukan kegiatan praktikum standardisasi larutan 0,1 NaOH dan penggunaannya dalam penentuan kadar asam cuka antara lain :
1. Standarisasi larutan bertujuan untuk menetukan konsentrasi dari larutan standard
2. Pada titrasi larutan asam cuka dengan larutan NaOH akan menghasilkan
garam yang berasal dari asam lemah dan basa kuat.
3. Untuk menenetukan titik akhir titrasi dapat dilakukan atau dilihat ketika
perubahan warna permanen pada indikator yang menunjukkan titik ekuivalen reaksi antara zat yang dianalisis dan larutan standar. 4. Pada proses standardisasi NaOH terbentuk perubahan warna dari
5. Pada proses kadar asam cuka terbentuk perubahan warna dari bening menjadi warna merah jambu dengan kadar asam cuka sebesar 18,522%
6. Dari perhitungan ralat standardisasi NaOH, diperoleh deviasi rata-rata relative (a) 2,53, deviasi standard (s) 3,32, deviasi standard rata-rata (A) 14,795%deviasi standard relative (S) 19,415%dan tingkat ketelitian 85,205%. Dari perhitungan ralat kadar asam cuka, diperoleh deviasi rata-rata relative (a) 0,75667, deviasi standard (s) 0,986585019, deviasi standard rata-rata (A) 3,11%, deviasi standard relative (S) 4,055%dan tingkat ketelitian 96,89%. 7. Elektron valensi adalah elektron yang berperan dalam
pembentukam ikatan kimia antar atom. Pada logam transisi ,elektron valensi berada pada orbital dalam. Adanya elektron valensi menentukan sifat kimia dari unsur tersebut.
DAFTAR PUSTAKA
Anonim,2015a. “Buku Petunjuk Praktikum Kimia Dasar”.Yogyakarta
Anonim,2015b. “Kimia Dasar”,http://blody-moghlycat.blogspot.com/
Akses 23 September 2015,19.00 WIB
Keenan, Charles W. dkk. 1991. Ilmu Kimia Untuk Universitas. Jakarta, Erlangga
Yogyakarta,17 Oktober 2015 Mengetahui
Co.Ass Praktikan