MODUL PRAKTIKUM
KIMIA DASAR
LABORATORIUM KIMIA DASAR
JURUSAN KIMIA
FAKULTASMATEMATIKA DAN ILMU PENGETAHUAN ALAM
TAHUN
2017/2018
UNIVERSITAS JEMBER
Disusun Oleh:
ii
KATA PENGANTAR
Praktikum Kimia Dasar merupakan sarana untuk meningkatkan keterampilan dasar yang harus dikuasai di laboratorium Kimia disamping sebagai ilustrasi dari teori ilmu kimia yang diperoleh saat mengikuti kuliah Kimia Dasar. Mengingat banyaknya bahan-bahan kimia dan peralatan gelas yang akan digunakan, tentu kesadaran mahasiswa akan keamanan serta keselamatan selama praktikum sangat diharapkan. Karena itu, mahasiswa diharapkan dapat lebih menghayati pelaksanaan praktikum dan bukan hanya mencampur satu cairan dengan cairan lain tanpa tahu mengapa harus dilakukan langkah tersebut.
Sebagai bagian dari kegiatan praktikum, mahasiswa harus membuat laporan praktikum. Setiap laporan praktikum harus dilengkapi lembar pengamatan yang ditandatangani oleh pembimbing praktikum setelah selesai melaksanakan praktikum. Lembar pengamatan sekaligus merupakan halaman depan laporan. Laporan harus diserahkan kepada teknisi yang ditunjuk seminggu setelah pelaksanaan praktikum. Mahasiswa yang menyerahkan laporan melebihi batas waktu yang ditentukan dianggap tidak melakukan praktikum.
Jember, 29 Agustus 2017 Tim Perumus
iii
KEAMANAN DAN KESELAMATAN KERJA DI LABORATORIUM KIMIA
Praktikum kimia organik ini dilakukan dengan tujuan untuk lebih memahami dan meyakini segala sesuatu yang telah dipelajari dalam teori kimia organik. Disamping itu juga untuk mengembangkan sikap ilmiah dan melatih ketrampilan bekerja di laboratorium kimia. Dalam praktikum kimia organik ini juga dipelajari cara kerja yang efisien dan menjaga keselamatan kerja di laboratorium.
1.1. Keselamatan kerja di laboratorium
Telah disadari bahwa laboratorium kimia merupakan tempat yang penuh akan bahaya, sebab laboratorium kimia berisi zat-zat kimia mudah terbakar, beracun, mudah meledak, serta banyak alat-alat dari kaca yang mudah pecah. Namun bagi orang laboratorium kimia organik yang tahu akan keselamatan kerja dan patuh akan peraturan dan petunjuk-petunjuk kerja, maka laboratorium akan menjadi tempat yang menyenangkan. Oleh karena itu sebelum bekerja di laboratorium kimia, marilah kita pelajari bahaya apa saja yang mungkin bisa terjadi serta mempelajari petunjuk-petunjuk keselamatan kerja, bagaimana cara mencegah terjadinya kecelakaan dan pertolongan pertama yang harus diberikan.
Jenis bahaya yang mungkin bisa terjadi di laboratorium kimia organik dapat digolongkan dalam tiga kategori yaitu :
1. Bahaya kebakaran dan ledakan
2. Bahaya terkena dan keracunan zat kimia 3. Bahaya yang disebabkan oleh pecahan kaca
1.2. Mencegah terjadinya kecelakaan
1.2.1. Mencegah terjadinya kebakaran dan ledakan
a. Kalau memang tidak diperlukan, hindari pemakaian nyala api.
b. Apabila harus memanaskan zat kimia yang mudah terbakar, jangan sekali-kali menggunakan wadah terbuka. Gunakanlah sebuah labu yang dilengkapi dengan pendingin dan alirkan uap yang timbul ke udara bebas jauh dari api. Sedapat mungkin pemanasan dilakukan dengan penangas air, pasir, listrik, atau lainnya. Periksa sambungan alat yang digunakan, jangan sampai ada
iv
sambungan yang bocor. Jangan menuangkan zat cair yang mudah terbakar didekat nyala api.
c. Jangan sekali-kali memanaskan zat cair dalam wadah yang tertutup rapat, kenaikan temperatur akan menyebabkan kenaikan tekanan dalam wadah yang tertutup rapat, sehingga akan menimbulkan ledakan.
d. Saat melakukan reaksi yang eksoterm (melepas panas), sediakan air dingin atau air es untuk menurunkan panas yang timbul.
1.2.2. Mencegah bahaya terkena dan keracunan zat kimia
Usahakan jangan sampai zat kimia mengenai anggota badan. Gunakan spatula atau sendok pada waktu mengambil zat kimia padat, gunakan pipet atau tuangkan dengan hati-hati bila mengambil zat cair. Jangan sekali-kali mencicipi atau mencium kimia secara langsung dan jika ada uap yang timbul jauhkan dari muka sediri atau muka teman kerja.
1.2.3. Mencegah bahaya terkena pecahan kaca
Tempatkan alat-alat kaca ditempat yang aman. Segera cuci alat-alat kaca yang telah selesai digunakan dengan larutan detergent atau pelarut lain yang sesuai untuk kotoran yang ada. Bila ingin memasukkan termometer atau pipa kaca kedalam gabus atau sumbat karet maupun pipa karet, basahi terlebih dahulu gabus, sumbat karet, atau pipa karet dengan air atau gliserin. Peganglah termometer atau pipa kaca dekat ujung yang akan dimasukkan dan kerjakan dengan hati-hati. Bila ternyata susah untuk memasukkannya perbesar lubang gabus atau sumbat tersebut.
1.3. Pertolongan pertama terhadap kecelakaan di laboratorium 1.3.1. Bahaya kebakaran atau ledakan
Jauhkan diri saudara dari api kebakaran atau ledakan yang terjadi. Untuk mencegah menjalarnya api, singkirkan semua botol yang berisi bahan mudah terbakar, matikan semua alat pembakar yang sedang digunakan dan tutup semua aliran gas. Api kebakaran dimatikan dengan cara mengerahkan mulut pipa pemadam kebakaran langsung pada dasar/nyala api. Bila baju kerja saudara terkena nyala api, jangan berlari sebab akan memperbesar nyala api, bergulinglah pada lantai dan usahakan supaya nyala api tidak menjalar ke kepala atau bagian lain dari badan. Bagi peserta yang lain berikan pertolongan dengan jalan menutupi
v
pakaian teman dengan selimut atau baju laboratorium yang telah dibasahi dengan air, supaya api segara mati. Yang terpenting jangan gugup, bertindaklah dengan tenang dang cekatan. Jika ada luka bakar yang kecil dapat diolesi dengan minyak ikan, sedangkan luka bakar serius mintalah pertolongan dokter.
1.3.2. Menolong terkena atau keracunan zat kimia
Siramlah kulit yang terkena zat kimia dengan air sebanyak-banyaknya. Kulit yang terkena air brom, setelah disiram dan dicuci dengan air sabun, rendamlah dengan larutan tiosulfat 10 % selama 3 jam kemudian olesi dengan minyak ikan dan dibalut dengan kain yang bersih. Mata yang terkena zat/uap kimia segera dicuci dengan air bersih yang mengalir dan jangan sampai mata kena sentuh. Segeralah minta pertolongan dokter mata. Bila terisap atau terminum zat kimia, minumlah air bersih atau susu sebanyak-banyaknya, kemudian sebaiknya minta pertolongan dokter.
1.3.3. Menolong terkena pecahan kaca
Bila saudara terkena pecahan kaca, bersihkan sisa-sisa kaca yang tertinggal pada luka saudara. Usahakan jangan terlalu banyak darah yang keluar dengan cara mengikat bagian dekat luka antara luka dengan letak jantung. Segeralah minta pertolongan dokter.
vi
DAFTAR ISI
COVER ... i
KATA PENGANTAR ... ii
KEAMANAN DAN KESELAMATAN KERJA DI LABORATORIUM KIMIA ... iii
DAFTAR ISI ... vi
PERCOBAAN 1. Pengetahuan Pokok dan Teknik Laboratorium ... 1
PERCOBAAN 2. Perubahan Materi dan Pemisahan Campuran ... 9
PERCOBAAN 3. Ikatan Kimia ... 15
PERCOBAAN 4. Stoikiometri ... 20
1
Percobaan
1
PENGETAHUAN POKOK DAN TEKNIK
LABORATORIUM
1. PENDAHULUAN
Pembelajaran, Penemuan-penemuan, pemahaman materi secara visual dapat diperoleh di laboratorium kimia. Tetapi bisa juga menjadi tempat berbahaya, jika kita tidak mengenal teknik-teknik laboratorium dan petunjuk-petunjuk keselamatan laboratorium.
Percobaan ini merupakan percobaan pendahuluan yang akan mengenalkan kepada saudara beberapa pengetahuan pokok dan teknik-teknik laboratorium. Percobaan ini mendasari semua materi percobaan selanjutnya. Selain itu dengan memahami secara praktis materi percobaan ini dapat mencegah timbulnya bahaya yang ditimbulkan oleh bahan-bahan kimia maupun kesalahan penggunaan peralatan.
Kimia adalah pengetahuan yang dikembangkan berdasarkan eksperimen. Berbagai teori atau model dalam kimia muncul dari hasil eksperimen yang valid. Validitas eksperimen ditentukan oleh hasil pengukuran dan pengamatan. Dengan demikian, pengukuran adalah bagian penting dalam pembelajaran kimia. Dalam materi pengukuran akan dikenalkan satuan pengukuran dan turunan-turunannya. Contoh, panjang adalah satuan dasar yang biasa dinyatakan dengan meter (m), sedangkan volume adalah satuan turunan dari panjang yang dinyatakan dalam kubik (m3).
Setiap pengukuran selalu mengandung ketidakpastian (uncertainity). Untuk mengetahui ketidak pastian dalam pengukuran, digunakan analisis kesalahan (error). Melalui analisis ini, dapat diketahui keakuratan dan kepresisian suatu pengukuran. Akurat dalam pengukuran berarti hasil pengukuran mempunyai nilai yang hampir mendekati dengan nilai sebenarnya, sedangkan presisi adalah hasil pengukuran dalam beberapa kali pengukuran mempunyai nilai yang sama. Hasil pengukuran yang baik memiliki keakuratan dan kepresisian yang tinggi. Untuk memahami kedua istilah ini, perlu dikenalkan nilai rata-rata
2
pengukuran dan standar deviasi. Kedua nilai tersebut dapat diperoleh dari rumus sebagai berikut: 1 rata-rata n i j x x
(1) (2) 2. TUJUAN PERCOBAAN- Mengenalkan beberapa peralatan dasar laboratorium kimia dan penggunaannya.
- Mengenalkan teknik-teknik laboratorium dan petunjuk-petunjuk keselamatan laboratorium.
- Mengenalkan metode pengukuran dalam laboratorium
3. PERALATAN DASAR LABORATORIUM KIMIA
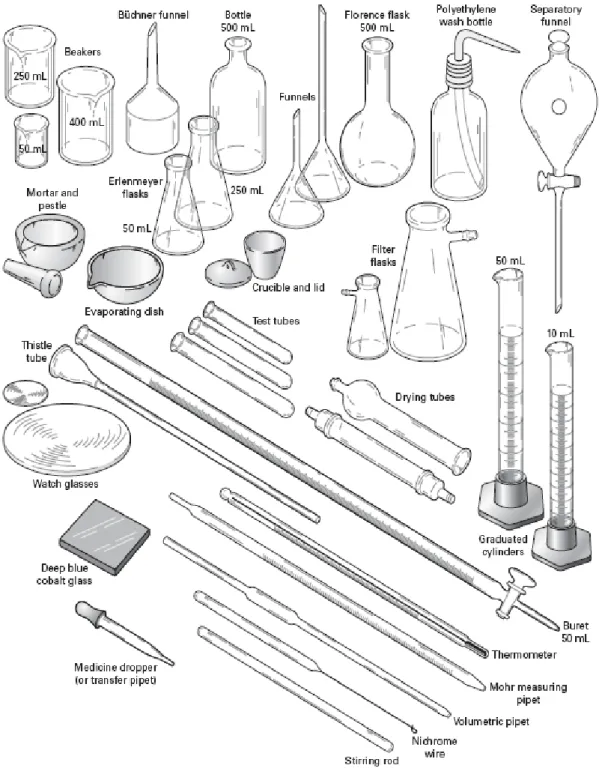
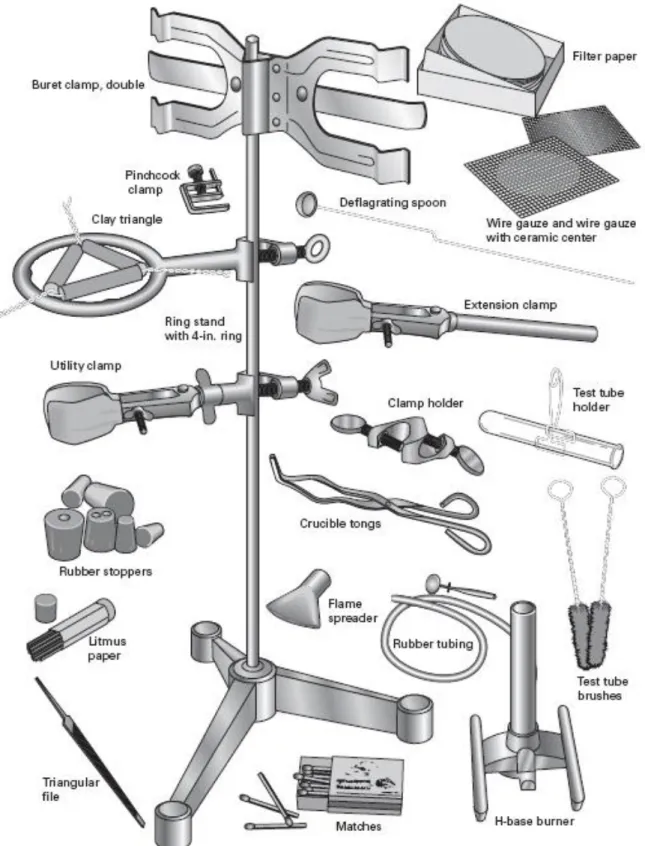
Beberapa peralatan gelas laboratorium yang digunakan dalam percobaan dapat dilihat pada Gambar 1 dan Gambar 2.
4. PROSEDUR PERCOBAAN a. TEKNIK LABORATORIUM
- Mengencerkan Asam Pekat
Tuangkan asam pekat ke dalam air sambil diaduk-aduk. Anda dapat merugikan orang lain atau setidak-tidaknya diri sendiri jika menuangkan air kedalam asam pekat.
- Memanaskan Tabung Reaksi.
Hadapkan mulut tabung ke tempat yang aman, anda tak suka terkena percikan benda panas dan juga berbahaya bukan? Orang lain pun tidak !!!
2 1 ( ) standar deviasi 1 n i j x x s n
3
- Teknik Penanganan Reaksi dan Bahan yang Menimbulkan Gas
Percobaan yang menimbulkan gas (yang sangat) berbahaya bagi kesehatan dilakukan dalam lemari asam atau diluar laboratorium.
- Teknik Pemasangan Termometer
Jika memasukkan termometer atau pipa gelas kedalam lubang gabus atau karet, basahi alat gelas tersebut dengan air, pegang dekat bagian yang akan dimasukkan menggunakan sepotong kain basah. Masukkan alat gelas tersebut dengan gerak ulir.
- Teknik Penanganan Kebocoran Buret
Buret yang bocor sangat sering terjadi bahwa buret yang akan dipakai ternyata bocor. Jangan mudah putus asa, perkaranya sangat sederhana. Tuangkan cairan dalam buret ke wadah lain. Bukalah keran buret, kemudian lap dengan kertas saring seluruh bagian keran. Saluran cairan tidak boleh tersumbat oleh benda-benda yang tidak semestinya. Balurlah / lumuri bagian yang diarsir. Pasang lagi kekeran putar-putar agar vaselin benar-benar telah merata. Hanya itu.
- Mengambil Cairan dengan Pipet Menggunakan Pipet Seukuran
Ujung pipet harus betul-betul tercelup kedalam cairan. Hisap sampai sedikit melewati batas. Keringkan bagian luar ujung pipet yang terkena cairan dengan kertas saring. Atur agar pipet tegak atau vertikal dan cairan tepat pada batas. Pindahkan cairan dalam wadah.
Perhatikan: cairan yang beracun dan mudah menguap tidak boleh dipipet
dengan cara menghisap menggunakan mulut. - Menimbang
Zat yang ditimbang tidak boleh langsung diletakkan diatas neraca. Gunakan gelas kimia, botol timbang, kaca arloji, kertas saring, atau wadah lain yang sesuai (?).
4
5
6
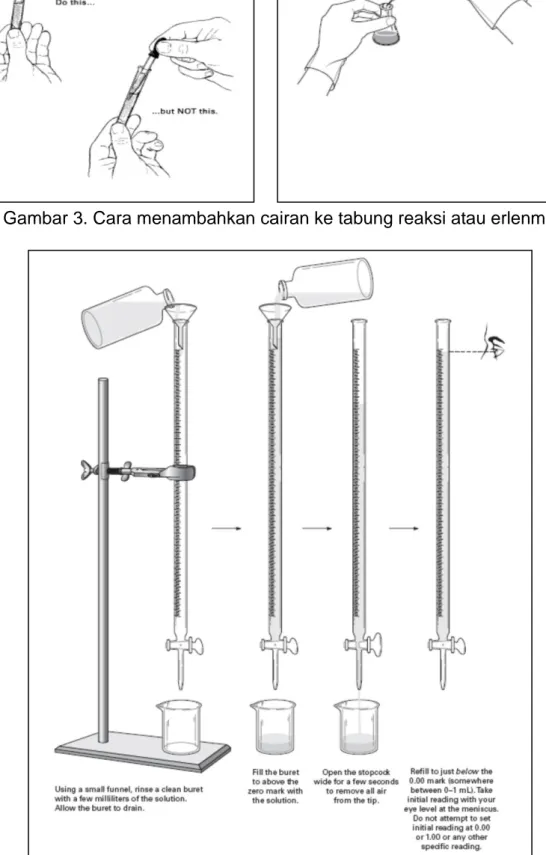
Gambar 3. Cara menambahkan cairan ke tabung reaksi atau erlenmeyer
7
Gambar 5.b. Cara menambahkan grease (vaselin) (A), memasang stopcock (B),
mengeluarkan sisa cairan (C).
2. PENGUKURAN DI LABORATORIUM a. Pengukuran volume
- Ambil gelas ukur volume 100 mL
- Isi dengan akuades dengan volume 5 mL - Tunjukkan mana yang disebut meniscus
- Gambarkan dalam lembar pengamatan untuk menunjukkan meniscus - Lakukan perlakuan yang sama untuk erlenmeyer 50 mL dan pada buret 25
mL
Gambar 5.a. Cara yang benar membaca meniscus
8
b. Pengukuran massa
- Timbang suatu lempengan logam dengan timbangan triple beam - Lakukan tiga kali ulangan untuk lempengan yang sama
- Lakukan dengan logam yang sama namun dengan jenis timbangan yang berbeda.
c. Penentuan Massa jenis cairan dan padatan menggunakan gelas ukur
- Ambil 100 mL aquades menggunakan gelas kimia - Siapkan gelas ukur 10 mL dalam kondisi kering
- Timbang gelas ukur 10 mL menggunakan timbangan manual (top-loading), tuliskan angka pentingnya.
- Menggunakan pipet tetes plastic, isikan 10 mL aquades ke dalam gelas ukur pada suhu kamar, amati sampai tanda batas. Tanda batas diamati pada posisi meniscus.
- Timbang gelas ukur yang telah terisi aquades 10 mL menggunakan timbangan manual.
- Kosongkan gelas ukur, kemudian isi lagi dengan akuades 10 mL, timbang lagi beratnya.
- Menggunakan termometer, catat suhu sampel saat pengukuran
d. Penentuan Massa jenis cairan dan padatan menggunakan buret
- Isikan akuades 80 mL pada gelas kimia 100 mL
- Timbang botol plastik dan tutupnya pada timbangan manual (top-loading). - Isi buret 50 mL dengan akuades, perhatikan cara mengisi dan cara
menghindari adanya gelembung di dalam buret. Tinggi cairan dimulai dari antara 0-5 mL.
- Baca volume awal buret dan catat pembacaannya sesuai angka pentingnya.
- Dari buret, tambahkan 5 mL ke botol plastik.
- Catat pembacaan akhir buret dan tentukan volume yang ditambahkan - Timbang tutup botol pada timbangan manual (top-loading)
- Ulangi tahap 5-7 dengan volume yang berbeda (misalnya 6, 8 atau 10 mL). botol tidak perlu dikosongkan selama penambahan volume
9
Percobaan
2
PERUBAHAN MATERI DAN PEMISAHAN
CAMPURAN
1. PENDAHULUAN
Sangat sedikit materi yang ditemukan dalam keadaan murni. Beberapa material merupakan campuran lebih dari dua zat yang tidak tercampur secara kimia. Isolasi zat murni dari suatu campuran memerlukan proses pemisahan satu komponen dengan yang lainnya. Ahli kimia telah mengembangkan beberapa teknik/metode pemisahan. Metode pemisahan tersebut biasanya berdasarkan perbedaan sifat fisik masing-masing komponen. Berikut ini beberapa metode pemisahan yang lazim digunakan adalah :
a. Sublimasi
Metode ini melibatkan panas, dimana suatu padatan dipanaskan sampai melewatkan berubah secara langsung dari padat menjadi gas. Kebalikan dari proses ini disebut kondensasi atau deposisi. Beberapa padatan yang dapat menyblim diantaranya iodin, cafein, dan para-diklorobenzena.(mothballs).
b. Ekstraksi
Metode ini menggunakan suatu pelarut yang dapat melarutkan suatu komponen dari campuran secara selektif. Melaui metode ini, suatu padatan dilarutkan kemudian dipisahkan dari padatn yang tidak larut.
c. Dekantasi
Merupakan proses pemisahan suatu cairan dari padatan yang mengendap dengan cara menuangkan cairannya secara hati-hati tanpa mengganggu padatannya.
d. Filtrasi
Suatu padatan dipisahkan dari cairannya dengan menggunakan suatu material berpori sebagai filter. Kertas saring, arang (charcoal), atau pasir dapat digunakan sebagai filter. Material ini akan melewatkan fase cairnya, tetapi tidak padatannya.
10
e. Evaporasi
Suatu campuran dipisahkan dengan cara pemanasan. Cairannya akan menguap sementara padatannya akan tersisa dalam wadah.
f. Distilasi
Distilasi adalah salah satu metode pemurnian cairan yang paling umum. Metode ini sangat sederhana, zat cair dipanaskan hingga mendidih, uapnya dialirkan ke penampung, kemudian dikondensasi sehingga cairan terbentuk kembali. Setiap orang memiliki pengalaman dalam memanaskan air. Panas yang diberikan akan meningkatkan energi kinetic molekul air sehingga energi yang dimilikinya cukup mengubah molekul air dari fase cair menjadi fase gas. Tekanan uap diatas cairan yang ditimbulkan disebut tekanan uap. Tekanan ini akan semakin besar bila jumlah molekul air yang berubah menjadi fase gas bertambah. Ada kalanya tekanan uap cairan sebanding dengan tekanan uap eksternal dari cairan yang biasa disebut tekanan atmosfir. Bila kondisi ini terjadi, maka cairan akan mendidih, dan temperatur saat cairan mulai mendidih disebut dengan titik didih.
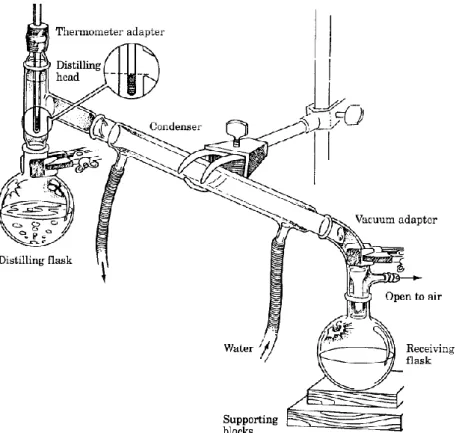
Pada distilasi yang berlangsung dalam system tertutup seperti pada Gambar 2.1. Zat cair dipanaskan sampai mendidih, uapnya dialirkan melewati pipa pendingin sehingga akan mengembun kembali. Jika campuran yang didistiasi mengandung beberapa komponen yang memiliki titik didih berbeda, maka komponen yang titik didihnya rendah akan terdistilasi pertama kali, dan yang titik didihnya lebih tinggi akan terdisilasi berikutnya. Molekul (zat) yang tidak menguap (nonvolatile) tidak akan terdistilasi.
11
Gambar 2.1. Sistem Distilasi
2. TUJUAN PERCOBAAN
- mendemontrasikan pemisahan suatu campuran.
- menguji beberapa teknik pemisahan berdasarkan sifat fisik masing-masing komponen.
- menggunakan distilasi untuk memisahkan campuran.
- untuk mengetahui bahwa distilasi dapat memurnikan suatu cairan.
3. BAHAN DAN ALAT
- Campuran pasir-naphtalene-garam
- Timbangan - Evaporating dish - Batu didih - Kaki tiga - Jaring kawat - Kertas saring - Beaker - Spatula
- Vaselin - Batang pengaduk - Pembakar spiritus - Campuran garam (NaCl) – air - Corong - Clamps
12
4. PROSEDUR PERCOBAAN a. Pemisahan Campuran
- Kedalam satu beaker 150-mL yang kosong, bersih, dan kering, diisi sebanyak 1,5 gram sampel campuran pasir-garam-naphtalele. Timbang berat total sampel dan beaker.
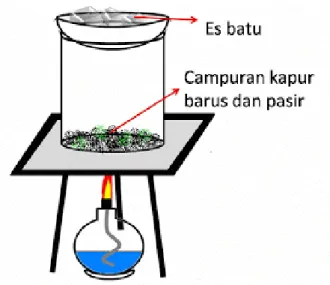
- Siapkan satu evaporating dish diatas beaker yang berisi campuran. Tempatkan beaker dan dish diatas jaring kawat dan kaki tiga. Tambahkan beberapa pecahan es diatas evaporating dish. Hati-hati jangan sampai ada tetesan air dibawah dish atau didalam beaker.
Gambar 3.1 Pemisahan Campuran
- Panaskan beaker dengan pembakar spritus atau Bunsen sampai terbentuk uap didalam beaker dan padatan mulai menempel dibawah dish. Setelah 10 menit, pindahkan pembakar spiritus dan kumpulkan padatan dibawah evaporating dish kedalam wadah menggunakan spatula. Aduklah campuran dalam beaker dengan batang pengaduk. Tutup beaker dengan evaporating dish, kemudian panaskan beaker kembali sampai tidak terbentuk padatan dibawah evaporating dish. Timbang padatan (padatan hasil sublimasi) yang menempel dibawah evaporating dish.
- Dinginkan beaker pada temperature ruang. Timbanglah beaker yang berisi padatan tersisa. Hitunglah berat hasil sublimasi ditambah dengan
13
berat padatan tersisa. Bandingkan hasil perhitungannya dengan berat awal total campuran dalam beaker.
- Tambahkan 25 mL aquades kedalam sisa padatan dalam beaker. Lakukan pengadukan selama 5 menit.
- Siapkan kertas saring yang sudah diketahui beratnya untuk proses penyaringan.
- Saringlah campuran dan tampung filtratnya dengan beaker lain. Bilas padatan pada kertas saring dengan 10 mL aquades.
- Kertas saring yang berisi padatan dikeringkan dalam oven suhu 105 oC selama 10 menit, lalu ditentukan berapa berat padatan hasil penyaringan. - Cairan (filtrat) yang terisisa digunakan sebagai sampel percobaan
distilasi. b. Distilasi
- Pasang set alat distilasi sesuai dengan instruksi dari instruktur. Ingat setiap sambungan alat gelas diolesi vaselin.
- Gunakan labu alas bulat 100 mL untuk labu distilasi dan labu penampung. Isi labu distilasi dengan sisa filtrat percobaan sebelumnya (a). Masukkan 2 butir batu didih. Pasangkan kedua labu tersebut pada set alat distilasi, dan mulailah memanaskan menggunakan pembakar spiritus.
- Catat temperatur saat distilat yang tertampung volumenya sekitar 1 mL. Distilasi dilanjutkan hingga setengah volume air pada labu distilasi pindah ke labu penampung distilat. Matikan pembakar spiritus dan dinginkan labu distilat.
- Masukan masing-masing sebanyak 2 mL cairan sisa pada labu distilasi dan cairan pada labu penampung distilat, pada dua tabung reaksi terpisah. Teteskan sebanyak 5 tetes larutan AgNO3 0,01 M pada
masing-masing tabung reaksi. Amati dan catat perubahan yang terjadi.
c. Filtrasi versus Dekantasi
- Masukkan 2-3 sendok makan bubuk kapur kedalam gelas kimia 50 ml. Tambahkan (25-30) ml air, aduk sampai rata. Selanjutnya ambil ± 5 ml
14
larutan kedalam tabung sentrifugal. Pisahkan sentrat dan endapan dengan cara dekantasi.
- Sisa larutan dalam gelas kimia disaring , filtratnya ditampung.
- Bandingkan sentrat dari proses dekantasi dengan filtrat dari proses penyaringan
d. Rekristalisasi
- Ambil ± satu sendok teh garam dapur kotor, larutkan dalam gelas kimia 50 ml dengan air secukupnya.
- Saring dan tampung filtratnya, kemudian uapkan dalam cawan porselin diatas nyala pembakar spirtus sampai air habis menguap.
- Bandingkan keadaan fisik garam dapur sebelum dan sesudah proses
e. Pemisahan ion
- Tuangkan hati-hati 5 ml larutan NaCl kedalam kolom resin penukar ion, elusi dengan air 30 ml.
- Tampung 30 ml larutan dengan membuka kran agar kecepatan 1 tetes tiap detik (1ml/20 detik), jaga jangan sampai kolom kering.
- Bandingkan apa yang terjadi antara larutan NaCl sebelum dilewatkan kolom dengan setelah dilewatkan kolom dengan ditetesi indikator PP dan dites dengan lakmus.
-
Tugas Sebelum Praktikum
1. Terangkan istilah-istilah berikut :
a. Dekantasi. e. Ekstrak. b. Filtrat. f. Bumping. c. Sentrat. g. Batu didih. d. Sentrifugasi
2. Gambarkan struktur molekul naphtalene dan tuliskan pula data sifat-sifat fisiknya.
15
Percobaan
3
IKATAN KIMIA
1. PENDAHULUAN
a. Reaksi Kimia ( Ikatan Ion dan Ikatan Kovalen )
Penggabungan atom-atom dalam molekul terjadi karena ikatan kimia. Berdasarkan cara terbentuknya ikatan atom-atom tersebut dikenal dua macam ikatan kimia yaitu ikatan ion dan ikatan kovalen. Ikatan ion terjadi karena pelepasan dan penangkapan elektron sehingga yang berikatan adalah ion-ion positif dan negatif.
Didalam larutan ion-ion tersebut dapat diikat oleh ion-ion lain yang muatannya berlawanan sehingga membentuk senyawa baru yang mudah dikenal (misalnya berbentuk endapan). Contoh senyawa yang terbentuk dari ikatan ion ialah NaCl dan AgNO3. Bila NaCl dan AgNO3 direaksikan maka akan
terjadi reaksi pertukaran ion :
AgCl + AgNO3 AgCl + NaNO3
Ikatan kovalen tidak terjadi karena pelepasan dan penangkapan elektron, tetapi karena pemakaian bersama pasangan elektron valensi, karena atom-atom yang berikatan sukar diganti oleh atom lain. Sebagai contoh adalah CCl4. CCl4 bila direaksikan dengan AgNO3 tidak akan menghasilkan senyawa
lain.
CCl4 + AgNO3
Selain itu sifat seperti titik leleh, titik didih, kelarutan, konduktivitas listrik, warna, dan bau dapat membantu membedakan senyawa ionik dari senyawa kovalen. Seperti di banyak bidang kimia, perbedaan tidak selalu jelas dan juga tidak berlaku untuk semua senyawa.
Garam dan gula sama-sama larut dalam air, tetapi larutan yang terbetuk memiliki perbedaan yang penting. Salah satu jenis kristal putih merupakan senyawa ionik, dan ketika larut membentuk ion. Ion-ion bebas bergerak dalam larutan, oleh karena itu larutan tersebut menghantarkan listrik. Jika larutan mengandung lebih banyak ion, maka larutan akan menghantarkan
16
listrik lebih baik dan disebut sebagai elektrolit kuat. Sebaliknya jika larutan tidak mengandung ion maka tidak menghantarkan listrik dan disebut larutan non elektrolit.
Ikatan kovalen antara suatu atom dengan atom lain di dalam molekul dapat diubah menjadi ikatan ion dengan cara mengganti salah satu atom. Misalnya CCl4 yang berikatan melalui ikatan kovalen dengan atom C dapat
diubah menjadi ikatan ion dengan cara mengamati atom C dengan atom Ca. Untuk itu CCl4 direaksikan dengan CaO.
CCl4 + 3CaO CaCO3 + 2CaCl2
Terbentuknya CaCl2 yang berikatan ion dapat dibuktikan dari reaksinya dengan
AgNO3 menurut persamaan reaksi :
CaCl2 + 2 AgNO3 Ca(NO3)2 + 2AgCl
b. Pembakaran Senyawa Organik
Pembakaran terhadap senyawa organik akan menghasilkan CO2 dan
H2O bila pembakaran berlangsung secara sempurna. Sedangkan bila
pembakaran berjalan tidak sempurna maka akan juga dihasilkan CO dan seringkali juga C. Sebagai contoh pembakaran sempurna etanol :
C2H5OH + 3O2 2CO2 + 3H2O
2. TUJUAN PERCOBAAN
a. Membandingkan ikatan kovalen dengan ikatan ion dalam dua senyawa yang berbeda.
b. Mengamati perubahan ikatan kimia unsur klor dari ikatan kovalen menjadi ikatan ion.
17
3. ALAT DAN BAHAN
Bahan: Alat:
- Aquades - Asam benzoate - Pembakar spiritus
- NaCl - KI - Cawan porselin
- CHCl3 - MgCl2 - Korek api
- AgNO3 - Petroleum eter - Pipet tetes
- Serbuk CaO - Na2SO4 - Tabung reaksi
- HNO3 - NaOH 2M - Pipet mohr
- Benzena - Kloroform - Kaki tiga
- Spiritus - Aseton - Termometer
- Asam oksalat - HCl 2M - Spot plate - Gula tebu - NH4Cl 2 M - Tusuk gigi
- Etanol - FeCl2 0,1M - Konduktivitas tester
- Paku
4. PROSEDUR PERCOBAAN
a. Membandingkan ikatan kovalen dengan ikatan ion dalam dua senyawa yang berbeda.
- Ambil 2 buah tabung reaksi (beri tanda I dan II).
- Tabung reaksi I diisi dengan 1 ml aquadest dan 5 tetes larutan NaCl. - Tabung reaksi II diisi dengan 5 tetes CHCl3.
- Masing-masing ditambah dengan satu tetes AgNO3.
- Amati yang terjadi.
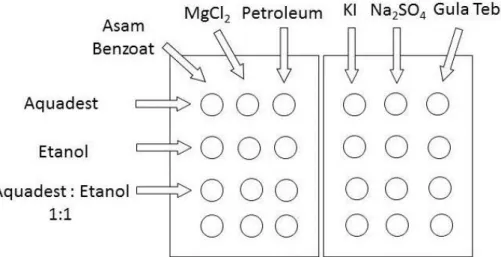
b. Mengamati perdedaan kelarutan dan konduktivitas senyawa ionik dan kovalen - Bersihkan 2 spot plate dengan sabun dan air. Keringkan seluruhnya
- Tempatkan satu ujung spatula asam benzoat pada kolom pertama sebanyak 3 baris (seperti pada gambar 1).
- Ulangi langkah kedua untuk sampel MgCl2 pada kolom kedua dan 5 tetes
petroleum eter pada kolom ketiga
- Untuk baris pertama, tambahkan ke masing-masing sampel sebanyak 5 tetes akuades. Aduk dengan tusuk gigi dan amati kelarutan relatif dari masing-masing sampel. Catat pengamatan Anda
18
- Untuk baris kedua, tambahkan ke masing-masing sampel 5 tetes etanol. Aduk dengan tusuk gigi dan mengamati kelarutan relatif dari masing-masing sampel. Catat pengamatan Anda
- Untuk baris ketiga, tambahkan ke masing-masing sampel 5 tetes campuran etanol dan aquades. Aduk dengan tusuk gigi. Uji semua larutan dengan tester konduktivitas (Volt-meter). Catat pengamatan Anda
- Lakukan hal yang sama untuk sampel KI, natrium sulfat dan gula tebu pada spot plate yang satunya.
Gambar 1. Spot plate
c. Perubahan ikatan kimia unsur dari ikatan kovalen menjadi ikatan ion. - Ambil tabung reaksi yang kering dan bersih.
- Masukkan 1 sendok (spatel) CaO.
- Panaskan mula-mula dengan api yang kecil kemudian dengan api yang membentuk inti berwarna biru ditengah. (jangan lupa menggoyang-goyang tabung reaksi pada waktu pemanasan). Lakukan pemanasan selama 15 menit
- Pindahkan tabung menjauhi api, kemudian teteskan (dalam keadaan tegak) 2 tetes CHCl3.
- Panaskan lagi, tabung reaksi dan teteskan 1 tetes CHCl3, panaskan lagi.
- Dinginkan, setelah dingin tambahkan 1 ml HNO3 pekat.
- Panaskan tabung reaksi kimia hingga endapan larut dan gas-gas yang terbentuk hilang.
19
- Dinginkan, setelah dingin tambahkan 3 tetes AgNO3 1%. Amati yang
terjadi.
d. Reaksi Pembakaran Senyawa Organik.
Percobaan harus dilakukan dilemari asam.
- Sediakan cawan porselin, teteskan 2 tetes benzena. - Bakarlah dengan korek api.
- Perhatikan, apakah terjadi perubahan.
- Ulangi pekerjaan diatas berturut-turut dengan, etanol, aseton dan kloroform.
e. Reaksi Pemanasan Senyawa organik. - Siapkan cawan porselin.
- Isilah cawan tersebut dengan sedikit kristal asam oksalat.
- Letakkan diatas kaki tiga dan panaskan (lakukan dilemari asam).
- Catat perubahan yang terjadi (bau, pembentukan kristal dan sebagainya). - Ulangi percobaan 1-4 dengan mengamati asam oksalat dengan gula tebu. - Perhatian : Setelah pemanasan dengan gula segera bersihkan gula yang
di Cawan Porcelin selagi masih panas karena kalau dingin akan lengket.
Tugas Pendahuluan
1. Jelaskan perbedaan antara ikatan kovalen dengan ikatan ion !
2. Minyak dan alkohol merupakan senyawa organik, jelaskan mengapa minyak tidak larut dalam air sedangkan alkohol larut dalam air !
3. Jelaskan perbedaan antara pemanasan dan pembakaran !
4. Jelaskan mengapa gula larut dalam air padahal bukan larutan elektrolit ! 5. Jelaskan mengapa senyawa ion lebih mudah larut dalam air !
20
Percobaan
4
STOIKIOMETRI
A. PENDAHULUAN
Dasar percobaan ini adalah metode JOB atau metode variasi kontinu. Dalam metode ini dilakukan sederetan pengamatan yang kuantitas molarnya sama, tetapi masing-masing kuantitas mol pereaksinya berubah-ubah (bervariasi). Salah satu sifat fisik tertentu dipilih untuk diperiksa, seperti massa, volum, suhu atau daya serap. Oleh karena kuantitas pereaksinya berlainan, maka perubahan harga sifat fisik dan sistem ini dapat digunakan untuk meramalkan stoikiometri sistem. Bila digambarkan grafik aluran sifat fisik yang diamati (diukur) terhadap kuantitas pereaksinya, maka akan diperoleh suatu titik maksimum atau minimum yang sesuai dengan titik stoikimetri sistem, yaitu yang menyatakan perbandingan pereaksi-pereaksi senyawa.
B. TUJUAN PERCOBAAN
Mempelajari stoikiometri beberapa reaksi
C. ALAT DAN BAHAN
1. Bahan 2. Alat
- CuSO4 1 M - Pipet Mohr
- NaOH 2 M - Tabung reaksi - HCl 2 M - Termometer - H2SO4 2 M - Ball pipet
- Ca(OH)2 2 M
D. PROSEDUR PERCOBAAN
1. Stoikiometri sistem CuSO4-NaOH
a. Masukan 1 mL larutan CuSO4 1 M kedalam satu tabung reaksi,
sementara ditabung reaksi lain, dimasukan 4 mL NaOH 2 M. Ukur temperatur masing-masing larutan dalam tabung reaksi tersebut.
21
b. Larutan CuSO4 1 M dituang kedalam tabung reaksi yang berisi NaOH 2 M, aduk dan ukur temperatur campurannya.
c. Ulangi percobaan diatas dengan menggunakan 2 mL NaOH 2 M dan 3 mL CuSO4 1 M, sekali lagi menggunakan 1 mL NaOH 2 M dan 4 mL CuSO4 1 M dan akhirnya menggunakan 3 mL NaOH 2 M dan 2 mL larutan CuSO4 1 M.
2. Stoikiometri Asam Basa
a. kedalam 5 tabung reaksi masukkan berturut-turut 2, 4, 6, 8 dan 10 mL larutan NaOH 2 M dan kedalam 5 buah tabung reaksi yang lain dimasukkan berturut-turut 2, 4, 6, 8 dan 10 mL larutan HCl 2 M.
b. Temperatur dari tiap-tiap larutan diukur, dicatat kemudian diambil harga rata-ratanya (ini adalah temperatur mula-mula Tm).
c. Setelah itu kedua macam larutan ini dicampurkan sedemikian rupa sehingga volum campuran larutan asam basa selau tetap yaitu 12 mL. d. Perubahan temperatur yang terjadi selama pencampuran ini diamati dan
dicatat sebagai temperatur akhir Ta. T = Ta - Tm
Dengan demikian diperoleh harga T untuk setiap kali pencampuran larutan asam dan basa.
e. Selanjutnya buat grafik antara T (sumbu Y) dan volume asam-basa (sumbu X).
f. Lakukan percobaan yang sama terhadap campuran NaOH 2 M dengan H2SO4 2 M, dan Ca(OH)2 2 M dengan HCl 2 M.. Perbedaan apakah yang
mungkin terdapat jika dibandingkan terhadap percobaan sebelumnya?
E. TUGAS PENDAHULUAN
1. Apa yang dimaksud stoikimetri reaksi? 2. Apa yang dimaksud metode variasi kontinu?
3. Jelaskan hukum-hukum yang mendasari pembahasan tentang stoikimetri reaksi.
22
Percobaan
5
TERMOKIMIA
A. PENDAHULUAN
Setiap perubahan kimia selalu disertai dengan perubahan kimia disebut panas reaksi. Reaksi kimia disebut panas reaksi. Reaksi kimia yang disertai dengan penyerapan panas disertai dengan penyerapan panas disebut reaksi endotermik dan yang menghasilkan panas disebut reaksi eksotermik. Panas reaksi yang menyertai reaksi yang berlangsung pada tekanan tetap sering disebut dengan perubahan entalpi reaksi, H. Perubahan entalpi reaksi sering dinamakan sesuai dengan jenis reaksi yang terjadi, misalnya entalpi pembentukan, entalpi pembakaran, entalpi netralisasi, dll. Menurut hukum Hess, perubahan entalpi reaksi tidak bergantung pada jalannya reaksi dan cara bagaimana reaksi itu dilakukan, namun hanya bergantung pada keadaan dan keadaan akhir reaksi.
Dalam percobaan ini akan dilakukan pengukuran perubahan entalpi yang menyertai reaksi netralisasi antara NaOH kristal dengan larutan HCl yang terjadi secara bertahap dan yang terjadi secara langsung (satu tahap) menggunakan kalorimeter sederhana. Percobaan akan diawali dengan penentuan kalor jenis kalorimeter yang digunakan.
Reaksi secara langsung yaitu reaksi antara NaOH padat dengan larutan HCl NaOH (s) + HCl (aq) NaCl (aq) + H2O (l) H3
Reaksi yang terjadi secara bertahap: 1. tahap pelarutan:
NaOH (s) NaOH (aq) H1
2. Tahap netralisasi
23
Jika reaksi tahap 1 dan tahap 2 dijumlahkan, maka didapat reaksi total: NaOH (s) NaOH (aq) H1
NaOH (aq) + HCl (aq) NaCl (aq) + H2O (l) H2
NaOH (s) + HCl (aq) NaCl (aq) + H2O (l) H3 = H1+H2
B. TUJUAN PERCOBAAN
- Menentukan kalor jenis kalorimeter sederhana,
- menentukan perubahan entalpi reaksi H1, H2 dan H3,
- mempelajari penjumlahan perubahan entalpi reaksi yang berlangsung bertahap.
C. BAHAN DAN ALAT
1. Bahan: 2. Alat:
- Aquades - Kalorimeter sederhana - NaOH padat - Termometer (0 – 100 oC) - Larutan HCl 2 M - Gelas kimia 200 mL - Larutan NaOH 2 M
D. PROSEDUR PERCOBAAN
1. Penentuan Tetapan Kalorimeter
a. isilah kalorimeter dengan 20 mL aquades, diamkan beberapa detik dan catat suhunya, t1 dengan tepat,
b. panaskan 20 mL aquades dalam gelas kimia 200 mL sampai suhu sekitar 65 oC dan catat suhu tepatnya, t2 dan segera tuangkan ke dalam
kalorimeter aduk dengan baik dan catat suhu tertingginya, t3,
c. Hitunglah Kalor Jenis Kalorimeter. 2. Kalor Pelarutan NaOH
a. isilah kalorimeter dengan 100 mL aquades, diamkan beberapa saat dan catat suhu dengan tepat, t1
b. timbanglah dengan tepat sekitar 2 g NaOH padat dan catat berat tepatnya (tutuplah botol tempat NaOH sesegera mungkin)
24
c. masukkan NaOH ke dalam kalorimeter, aduklah dengan cepat sehingga semua NaOH larut. Perhatikan perubahan suhunya dan catat suhu tertingginya.
3. Kalor reaksi antara larutan HCl dengan larutan NaOH
a. masukkan 20 mL larutan HCl 2 M ke dalam kalorimeter, diamkan beberapa saat dan catat suhunya dengan tepat.
b. Ukurlah 20 mL larutan NaOH 2 M, pindahkan ke gelas kimia diamkan beberapa saat dan ukur dan catat suhunya dengan tepat.
c. Tuangkan 20 mL NaOH tersebut ke dalam kalorimeter, aduklah dengan cepat, perhatikan perubahan suhunya dan catatlah suhu tertingginya.
Keterangan:
Untuk semua perhitungan pakailah data berikut: Massa jenis larutan = massa jenis air = 1 g/mL Kalor jenis larutan = kalor jenis air = 4,2 J/g. oC
E. TUGAS PENDAHULUAN
1. Apakah yang dimaksud dengan : a. kalor jenis dan kalor spesifik
b. reaksi eksotermik dan reaksi endotermik c. entalpi netralisasi
d. entalpi pembentukan e. entalpi pembakaran