PENETAPAN KADAR AKRILAMIDA DALAM KENTANG GORENG PADA RESTORAN CEPAT SAJI DI KOTA MEDAN SECARA
KROMATOGRAFI CAIR KINERJA TINGGI
SKRIPSI
OLEH: PUTRI SARI DEWI
NIM 060804011
FAKULTAS FARMASI
UNIVERSITAS SEMATERA UTARA MEDAN
PENETAPAN KADAR AKRILAMIDA DALAM KENTANG GORENG PADA RESTORAN CEPAT SAJI DI KOTA MEDAN SECARA
KROMATOGRAFI CAIR KINERJA TINGGI
SKRIPSI
Diajukan untuk melengkapi salah satu syarat untuk memperoleh gelar Sarjana Farmasi pada Fakultas Farmasi
Universitas Sumatera Utara
OLEH: PUTRI SARI DEWI
NIM 060804011
FAKULTAS FARMASI
UNIVERSITAS SEMATERA UTARA MEDAN
PENGESAHAN SKRIPSI
PENETAPAN KADAR AKRILAMIDA DALAM KENTANG GORENG PADA RESTORAN CEPAT SAJI DI KOTA MEDAN SECARA
KROMATOGRAFI CAIR KINERJA TINGGI OLEH :
PUTRI SARI DEWI NIM 060804011
Dipertahankan di hadapan Panitia Penguji Fakultas Farmasi
Universitas Sumatera Utara Pada Tanggal : Oktober 2010
Pembimbing I, Panitia Penguji,
Drs. Fathur Rahman Harun, M.Si., Apt. Prof. Dr. Jansen Silalahi, M.AppSc., Apt. NIP: 195201041980031002 NIP: 195311281983031002
Pembimbing II,
Drs. Fathur Rahman Harun, M.Si., Apt. NIP: 195201041980031002
Prof. Dr. Siti Morin Sinaga, M.Sc., Apt. NIP: 195008281976032002
Dra. Salbiah, M.Si., Apt. NIP: 194810031987012001
Drs. Syafruddin, MS, Apt. NIP: 194811111976031003
Medan, Oktober 2010 Fakultas Farmasi Universitas Sumatera Utara
Dekan,
KATA PENGANTAR
Puji syukur ke hadirat Allah SWT yang telah melimpahkan rahmat dan karunia-Nya, sehingga penulis dapat menyelesaikan skripsi dengan judul “Penetapan Kadar Akrilamida dalam Kentang Goreng pada Restoran Cepat Saji di Kota Medan secara Kromatografi Cair Kinerja Tinggi”. Skripsi ini diajukan sebagai salah satu syarat guna memperoleh gelar Sarjana Farmasi dari Fakultas Farmasi Universitas Sumatera Utara.
Penemuan senyawa karsinogen dalam makanan berkarbohidrat tinggi yang dimasak pada suhu tinggi (diatas 1200C) yakni akrilamida telah menimbulkan kekhawatiran akan dampak kesehatan yang kemungkinan timbul. Kentang goreng merupakan salah satu makanan yang mengandung akrilamida tinggi, sehingga diperlukan upaya untuk mengurangi kadarnya selama penggorengan berlangsung. Oleh karena itu, tujuan penelitian ini adalah untuk mengetahui kadar akrilamida dalam kentang goreng pada restoran cepat saji di kota medan secara KCKT. Hasil penelitian diharapkan dapat menjadi masukan bagi masyarakat untuk mengurangi konsumsi kentang goreng sehingga dapat meminimalkan toksisitas akrilamida yang terjadi.
Penulis menyampaikan rasa hormat dan terima kasih yang sebesarbesarnya kepada bapak Drs. Fathur Rahman Harun, M.Si., Apt. dan ibu Prof.Dr.Siti Morin Sinaga,M.Sc.,Apt. yang telah banyak memberikan bimbingan dan bantuan yang tak ternilai harganya selama penelitian dan penulisan skripsi ini berlangsung. Ucapan terima kasih juga penulis haturkan kepada bapak Prof. Dr. Sumadio Hadisahputra, Apt. selaku Dekan Fakultas Farmasi Universitas Sumatera Utara yang telah memberikan bantuan fasilitas dan banyak masukan selama masa pendidikan dan penelitian.
Dalam kesempatan ini, penulis juga hendak menyampaikan penghargaan tertinggi kepada kedua orang tua dan adik penulis, juga terima kasih setulusnya kepada pak Basri, bang Surya, Ludvika, Wina, Niki, Irma, Ririn, Bayu dan teman-teman stambuk Farmasi 2006 serta para asisten Laboratorium Penelitian dan Sintesa Bahan Obat yang tak dapat disebutkan namanya satu per satu, atas segala dorongan motivasi dan bantuannya kepada penulis sehingga skripsi ini dapat selesai tepat waktu.
Medan, Oktober 2010
Penetapan Kadar Akrilamida Dalam Kentang Goreng Pada Restoran Cepat Saji di Kota Medan Secara Kromatografi Cair Kinerja Tinggi
Abstrak
Akrilamida merupakan suatu senyawa toksik yang ditemukan dalam beragam jenis makanan terutama pada kentang goreng. Tujuan penelitian ini adalah untuk mengetahui kadar akrilamida pada kentang goreng yang terdapat di restoran cepat saji di kota Medan dengan metode kromatografi cair kinerja tinggi (KCKT).
Pada awal penelitian digunakan kolom C18 (250 X 4,6 mm), detektor UV pada panjang gelombang 230 nm, laju alir 1,0 ml/menit, dan fase gerak asetronitril:aquabidest:asam fosfat dengan perbandingan (5:94:1) ternyata memberikan hasil pemisahan kromatogram yang kurang baik. Untuk mengatasi hal tersebut dilakukan perubahan komposisi fase gerak menjadi asetonitril:larutan asam fosfat 11,45 mM dengan perbandingan (5:95) sehingga diperoleh pemisahan kromatogram yang baik. Metode ini memberikan akurasi dengan persen recovery 94,07 % (RSD 1,69 %), batas deteksi 0,5810 µg/ml dan batas kuantitasi 1,9368 µg/ml.
Dari hasil penelitian terhadap kadar akrilamida pada kentang goreng di restoran cepat saji yang berada di kota Medan diperoleh kadar pada rentang 0,4-11 mg/kg.
Determination of Acrylamide in French Fries at Fast Food Restaurants in Medan by High Performance Liquid Chromatography
Abstract
Acrylamide is a toxic substance found in various foods especially in french fries. The purpose of this research is to determine level of acrylamide in french fries at fast food restaurants located in Medan analized by high performance liquid chromatography (HPLC).
In the early of this research were used C18 column (250 X 4.6 mm), UV detector at 230 nm, flow rate of 1.0 ml/minute, and mobile phase mixture applied was acetonitrile: aquabidest: phosphoric acid (5:94:1) simply gives unfavourable result of chromatographic separation. To overcome this problem then the mobile phase composition was changed to acetonitrile: phosphoric acid solution 11,45 mM (5:95) in order to obtain a good chromatographic separation. This method gives the accuracy with percent recovery 94.07% (RSD 1.69 %), limit of detection 0.5810 μg/ml and limit of quantitation 1.9368 μg/ml.
Based on the result of this research to the level of acrylamide in french fries in fast food restaurants located in Medan city are in the range of 0,4-11 mg/kg.
DAFTAR ISI
Halaman
JUDUL ... i
HALAMAN JUDUL ... ii
HALAMAN PENGESAHAN ... iii
ABSTRAK ... iv
ABSTRACT ... v
DAFTAR ISI ... vi
DAFTAR TABEL ... ix
DAFTAR GAMBAR ... x
DAFTAR LAMPIRAN ... xi
BAB I PENDAHULUAN ... 1
1.1 Latar Belakang ... 1
1.2 Perumusan Masalah ... 2
1.3 Hipotesis ... 3
1.4 Tujuan ... 3
BAB II TINJAUAN PUSTAKA ... 4
2.1 Akrilamida ... 4
2.1.1 Sifat Fisikokimia ... 4
2.1.2 Kegunaan Umum ... 4
2.1.3 Farmakokinetika ... 4
2.1.4 Toksikologi ... 5
2.1.5 Kadar Akrilamida dalam Berbagai Makanan ... 5
2.2 Teori Kromatografi Cair Kinerja Tinggi ... 7
2.2.1 Sejarah Kromatografi ... 7
2.2.2 Pembagian Kromatografi ... 7
2.2.3 Kromatografi Cair Kinerja Tinggi... 8
2.2.4 Cara Kerja KCKT ... 9
2.2.5 Migrasi Retensi dan Solut ... 9
2.2.6 Instrumen KCKT ... 10
2.2.6.1 Wadah Fase Gerak ... 10
2.2.6.2 Pompa ... 11
2.2.6.3 Injektor ... 11
2.2.6.4 Kolom ... 12
2.2.6.5 Detektor ... 12
2.2.6.6 Perekam ... 13
2.2.7 Parameter Penting dalam KCKT ... 13
2.2.7.1 Tinggi dan Luas Puncak ... 13
2.2.7.2 Waktu Tambat ... 14
2.2.7.3 Faktor Kapasitas ... 14
2.2.7.4 Selektifitas ... 15
2.2.7.5 Efisiensi Kolom ... 16
2.2.7.6 Resolusi ... 16
2.2.7.7 Faktor Asimetri ... 17
2.3 Validasi Metode ... 17
2.3.1 Akurasi ... 18
2.3.3 Spesifitas ... 19
2.3.4 Batas Deteksi dan Batas Kuantitasi ... 20
2.3.5 Linearitas ... 20
2.3.6 Rentang ... 21
2.3.7 Kekuatan ... 21
BAB III METODOLOGI PENELITIAN... 22
3.1 Alat- alat ... 22
3.2 Bahan-bahan ... 22
3.3 Sampel ... 23
3.4 Rancangan Penelitian ... 23
3.4.1 Penyiapan Bahan ... 23
3.4.1.1 Pembuatan Fase Gerak ... 23
3.4.1.2 Pembuatan Pelarut ... 23
3.4.1.3 Pembuatan Larutan Induk Baku Pembanding Akrilamida .... 24
3.4.1.3.1 Pembuatan Larutan Induk Baku Pertama (1000 ppm) 24 3.4.1.3.2 Pembuatan Larutan Induk Baku Kedua (100 ppm) ... 24
3.4.1.3.3 Pembuatan Larutan Induk Baku Ketiga (10 ppm) ... 24
3.4.1.4 Pembuatan Larutan Sampel ... 24
3.4.2 Prosedur Analisis ... 25
3.4.2.1 Penyiapan Alat KCKT ... 25
3.4.2.2 Analisis Kualitatif ... 25
3.4.2.3 Analisis Kuantitatif ... 26
3.4.2.3.2 Penetapan Kadar Akrilamida dalam Sampel ... 26
3.4.2.4 Analisis Data Penetapan Kadar Secara Statistik ... 27
3.4.3 Validasi Metode ... 28
3.4.3.1 Akurasi ... 28
3.4.3.2 Presisi ... 29
3.4.3.3 Penentuan Batas Deteksi dan Batas Kuantitasi ... 29
BAB IV HASIL DAN PEMBAHASAN ... 30
4.1 Penentuan Kondisi Kromatografi untuk Mendapatkan Hasil Analisis yang Optimum ... 30
4.2 Analisis Kualitatif ... 37
4.3 Analisis Kuantitatif ... 40
4.4 Perolehan Kadar Akrilamida dalam Sampel Kentang Goreng ... 41
4.5 Validasi Metode ... 42
BAB V KESIMPULAN DAN SARAN ... 44
5.1 Kesimpulan ... 44
5.2 Saran ... 44
DAFTAR PUSTAKA ... 45
LAMPIRAN ... 47
DAFTAR TABEL
Tabel 1. Kadar Akrilamida dalam Berbagai Jenis Makanan ... 6 Tabel 2. Perbandingan Kromatogram Baku dengan Komposisi Fase Gerak
yang Dioptimasi ... 31 Tabel 3. Perbandingan Kromatogram Sampel dengan Komposisi Fase Gerak
yang Dioptimasi ... 34 Tabel 4. Rerata Kadar Akrilamida dalam Sampel Kentang Goreng ... 41 Tabel 5. Data Hasil Pengujian Perolehan Kembali Akrilamida Pada Kentang
DAFTAR GAMBAR
Halaman
Gambar 1. Rumus Bangun Senyawa Akrilamida ... 4 Gambar 2. Instrumen Dasar KCKT ... 10 Gambar 3. Kurva Serapan Akrilamida Baku 0,5 ppm secara spektrofotometri
UV ... 30 Gambar 4. Kromatogram hasil penyuntikan baku akrilamida dengan komposisi
fase gerak asetonitril:aquabidest:asam fosfat 10% (5:94:1) ... 32 Gambar 5. Kromatogram hasil penyuntikan baku akrilamida dengan komposisi
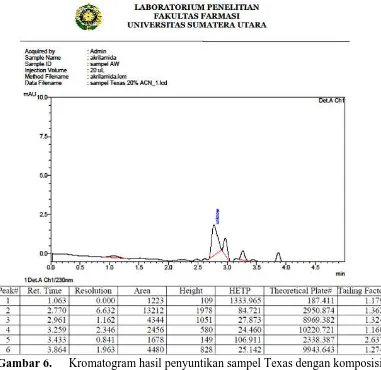
fase gerak asetonitril:aquabidest:asam fosfat 10% (20:79:1) ... 33 Gambar 6. Kromatogram hasil penyuntikan sampel Texas dengan komposisi
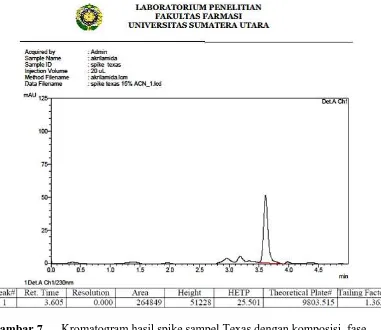
fase gerak asetonitril:aquabidest:asam fosfat 10% (20:79:1) ... 35 Gambar 7. Kromatogram hasil spike sampel Texas dengan komposisi fase
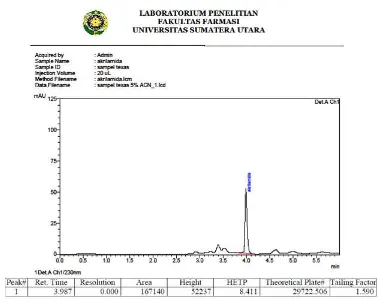
gerak asetonitril:aquabidest:asam fosfat 10% (20:79:1) ... 36 Gambar 8. Kromatogram hasil penyuntikan sampel Texas dengan komposisi
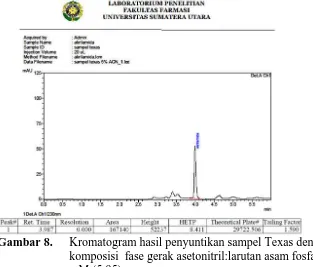
fase gerak asetonitril:larutan asam fosfat 11,45 mM (5:95) ... 37 Gambar 9. Kromatogram hasil penyuntikan sampel Texas dengan komposisi
fase gerak asetonitril:larutan asam fosfat 11,45 µm (5:95) ... 38 Gambar 10. Kromatogram hasil penyuntikan baku akrilamida 10 ppm dengan
kondisi fase gerak asetonitril:larutan asam fosfat 11,45 mM (5:95) .. 39 Gambar 11. Kromatogram hasil penyuntikan larutan sampel yang telah di-spike
DAFTAR LAMPIRAN
Halaman
Lampiran 1. Kromatogram Penyuntikan Akrilamida Baku untuk Mencari Komposisi Fase Gerak yang Optimum untuk Analisis ... 47 Lampiran 2. Kromatogram Penyuntikan Sampel untuk Orientasi... 48 Lampiran 3. Kromatogram Hasil Penyuntikan Larutan Akrilamida Baku pada
Pembuatan Kurva Kalibrasi ... 49 Lampiran 4. Perhitungan Persamaan Regresi dari Kurva Kalibrasi Akrilamida
Baku yang Diperoleh dengan KCKT pada Panjang Gelombang 230 nm ... 54 Lampiran 5. Kromatogram Hasil Penyuntikan Larutan Sampel I ... 56 Lampiran 6. Analisis Data secara Statistik dari Hasil Penyuntikan Larutan
Sampel I ... 58 Lampiran 7. Kromatogram Hasil Penyuntikan Larutan Sampel II ... 60 Lampiran 8. Analisis Data secara Statistik dari Hasil Penyuntikan Larutan
Sampel II ... 62 Lampiran 9. Kromatogram Hasil Penyuntikan Larutan Sampel III ... 65 Lampiran 10. Analisis Data secara Statistik dari Hasil Penyuntikan Larutan
Sampel III ... 67 Lampiran 11. Kromatogram Hasil Penyuntikan Larutan Sampel IV ... 70 Lampiran 12. Analisis Data secara Statistik dari Hasil Penyuntikan Larutan
Lampiran 14. Analisis data secara statistik dari hasil penyuntikan larutan
sampel V ... 76
Lampiran 15. Kromatogram Hasil Penyuntikan Larutan Sampel VI ... 79
Lampiran 16. Analisis Data secara Statistik dari Hasil Penyuntikan Larutan Sampel VI ... 81
Lampiran 17. Contoh Perhitungan untuk Mencari Kadar Akrilamida dalam Sampel ... 84
Lampiran 18. Kromatogram Hasil Perolehan Kembali Akrilamida Baku yang Ditambahkan pada Sampel II (Metode Penambahan Baku) ... 85
Lampiran 19. Data Perolehan Kembali Akrilamida Baku yang Ditambahkanpada Sampel II (Metode Penambahan Baku) ... 89
Lampiran 20. Perhitungan Molaritas Fase Gerak Asam Fosfat yang Ditambahkan kedalam Aquabidest ... 90
Lampiran 21. Contoh Perhitungan Persen Perolehan Kembali ... 92
Lampiran 22. Perhitungan Penetapan Batas Deteksi dan Batas Kuantitasi ... 93
Lampiran 23. Sertifikat Analisis Akrilamida Baku ... 94
Lampiran 24. Gambar Instrumen KCKT dan Syringe 100µl ... 95
Penetapan Kadar Akrilamida Dalam Kentang Goreng Pada Restoran Cepat Saji di Kota Medan Secara Kromatografi Cair Kinerja Tinggi
Abstrak
Akrilamida merupakan suatu senyawa toksik yang ditemukan dalam beragam jenis makanan terutama pada kentang goreng. Tujuan penelitian ini adalah untuk mengetahui kadar akrilamida pada kentang goreng yang terdapat di restoran cepat saji di kota Medan dengan metode kromatografi cair kinerja tinggi (KCKT).
Pada awal penelitian digunakan kolom C18 (250 X 4,6 mm), detektor UV pada panjang gelombang 230 nm, laju alir 1,0 ml/menit, dan fase gerak asetronitril:aquabidest:asam fosfat dengan perbandingan (5:94:1) ternyata memberikan hasil pemisahan kromatogram yang kurang baik. Untuk mengatasi hal tersebut dilakukan perubahan komposisi fase gerak menjadi asetonitril:larutan asam fosfat 11,45 mM dengan perbandingan (5:95) sehingga diperoleh pemisahan kromatogram yang baik. Metode ini memberikan akurasi dengan persen recovery 94,07 % (RSD 1,69 %), batas deteksi 0,5810 µg/ml dan batas kuantitasi 1,9368 µg/ml.
Dari hasil penelitian terhadap kadar akrilamida pada kentang goreng di restoran cepat saji yang berada di kota Medan diperoleh kadar pada rentang 0,4-11 mg/kg.
Determination of Acrylamide in French Fries at Fast Food Restaurants in Medan by High Performance Liquid Chromatography
Abstract
Acrylamide is a toxic substance found in various foods especially in french fries. The purpose of this research is to determine level of acrylamide in french fries at fast food restaurants located in Medan analized by high performance liquid chromatography (HPLC).
In the early of this research were used C18 column (250 X 4.6 mm), UV detector at 230 nm, flow rate of 1.0 ml/minute, and mobile phase mixture applied was acetonitrile: aquabidest: phosphoric acid (5:94:1) simply gives unfavourable result of chromatographic separation. To overcome this problem then the mobile phase composition was changed to acetonitrile: phosphoric acid solution 11,45 mM (5:95) in order to obtain a good chromatographic separation. This method gives the accuracy with percent recovery 94.07% (RSD 1.69 %), limit of detection 0.5810 μg/ml and limit of quantitation 1.9368 μg/ml.
Based on the result of this research to the level of acrylamide in french fries in fast food restaurants located in Medan city are in the range of 0,4-11 mg/kg.
BAB I
PENDAHULUAN 1.1Latar Belakang
Akrilamida merupakan suatu senyawa yang umumnya digunakan sebagai bahan baku dalam sintesis poliakrilamida, pemurnian air dan produksi kertas. Akrilamida memiliki efek neurotoksik, genotoksik dan karsinogenik (Ötles, 2004).
Akrilamida terdapat dalam makanan kaya karbohidrat, misalnya roti, beberapa produk kentang, biskuit, jagung, sereal dan lain-lain. Dari hasil penelitian terhadap beragam jenis makanan kandungan akrilamida yang terbesar terdapat pada makanan berkarbohidrat tinggi yang dimasak pada suhu diatas 1200C (Friedman, 2003).
Kentang merupakan kelompok makanan yang mengandung konsentrasi akrilamida tertinggi yaitu keripik kentang sebesar 0,17-3,7 mg/kg dan kentang goreng sebesar 0,2-12 mg/kg (Friedman, 2003), adapun dosis letal akrilamida ialah 50-500 mg/kg setiap harinya pada manusia dengan berat badan kira-kira 76 kg (BPOM, 2002). Dari pernyataan di atas, dapat disimpulkan bahwa kentang goreng berbahaya bila dikonsumsi berlebihan. Hal ini mengkhawatirkan karena penggemar kentang goreng cukup banyak di masyarakat, terutama kalangan remaja dan anak-anak.
demikian, belum ada fakta yang teruji untuk membuktikan bahwa akrilamida dalam makanan berpotensi menyebabkan kanker pada manusia, karena pemberian makanan yang mengandung akrilamida dengan dosis tinggi pada hewan tikus tidak dapat diterapkan pada manusia secara langsung (Harahap, 2006).
Analisis akrilamida dalam makanan dapat menggunakan berbagai metode seperti kromatografi gas spektrometri massa, kromatografi cair–spektrometri massa tandem dan kromatografi cair kinerja tinggi (Harahap, 2006; Ötles, 2004; Tanseri, 2009).
Uraian di atas menjadi alasan penelitian ini dilakukan, yaitu untuk mengetahui kadar akrilamida pada kentang goreng yang terdapat di restoran cepat saji di kota medan dengan metode KCKT menggunakan kolom C18 (4,6 x 250 mm), detektor UV pada panjang gelombang 230 nm dengan fase gerak asetronitril:aquabidest:asam fosfat (5:94:1) dan laju alir 1,0 ml/menit. Metode KCKT dipilih karena lebih sederhana dibanding dengan metode kromatografi gas spektrometri massa dan kromatografi cair–spektrometri massa tandem (Harahap, 2006).
1.2 Perumusan Masalah
1. Apakah kadar akrilamida pada kentang goreng yang terdapat pada restoran cepat saji masih berada pada batas dosis letal yaitu 50-500 mg/kg?
1.3 Hipotesis
1. Kadar akrilamida pada kentang goreng yang terdapat pada restoran cepat saji masih berada pada batas dosis letal yaitu 50-500 mg/kg.
2. Metode KCKT dengan kolom C18 (4,6 x 250 mm), perbandingan fase gerak asetonitril:aquabidest:asam fosfat (5:94:1), laju alir 1,0 ml/menit, dan detektor UV pada panjang gelombang 230 nm dapat diterapkan dalam penetapan kadar akrilamida pada kentang goreng.
1.4 Tujuan Penelitian
1. Menentukan kadar akrilamida dalam kentang goreng yang berasal dari beberapa restoran cepat saji di kota Medan dan membandingkannya dengan dosis letal yaitu 50-500 mg/kg.
BAB II
TINJAUAN PUSTAKA 2.1 Akrilamida
2.1.1 Sifat Fisikokimia
Akrilamida (sinonim: 2-propenamida, etilen karboksi amida, akrilik amida, vinil amida) merupakan senyawa kristalin bening hingga putih dengan bobot molekul 71,09; tidak berbau; larut dalam air, metanol, etanol, dimetil eter dan aseton, serta tidak larut dalam benzen dan heptan. Akrilamida akan meleleh pada suhu 87,5oC dan mendidih pada suhu 125oC (Ötles, 2004).
Akrilamida memiliki rumus molekul C3H5NO dan rumus bangun seperti yang ditunjukkan pada Gambar 1.
2.1.2 Kegunaan Umum
Akrilamida digunakan pada proses pengolahan plastik, pengemasan makanan, produksi karet sintesis, dan sebagai pemurni air. Gel akrilamida berperan pada proses elektroforesis sedangkan kopolimer akrilamida berfungsi juga sebagai bahan flokulasi dan pengental (Ötles, 2004).
2.1.3 Farmakokinetika
Akrilamida dapat diabsorpsi secara oral, melalui membran mukosa saluran nafas (inhalasi), dan rute dermal melewati kulit. Berdasarkan data bioavailabilitas
absorbsi akrilamida tercepat diperoleh melalui rute oral, di dalam tubuh akrilamida didistribusi melalui cairan tubuh dan dimetabolisme oleh enzim sitokrom P450 lalu dieksresikan melalui urin dan empedu.Waktu paruh eliminasi akrilamida pada tikus sekitar 2 jam, sedangkan pada manusia belum diketahui secara jelas waktu eliminasi yang dibutuhkan (FAO dan WHO, 2002; Friedman, 2003).
2.1.4 Toksikologi
Akrilamida merupakan senyawa toksik dalam bentuk monomer sedangkan poliakrilamida yang merupakan polimernya tidak lagi bersifat toksik. Akrilamida telah diklasifikasikan sebagai senyawa yang mungkin menyebabkan kanker atau berpotensi sebagai karsinogen pada manusia (Friedman, 2003).
Akrilamida dapat menyebabkan tumor pada saraf pusat, kelenjar susu, kelenjar tiroid, uterus, dengan dosis letal 50-500 mg/kg setiap harinya. Akrilamida berpotensi menyebabkan neurotoksik yang berakibat kepada sistem saraf pusat dan perifer, toksisitas akut menyebabkan gangguan emosional, halusinasi, turunnya tingkat kesadaran, dan hipotensi, sedangkan toksisitas kronik menyebabkan iritasi pada kulit, pengeluaran keringat yang berlebihan, kelelahan, dan turunnya berat badan (Friedman, 2003; Info POM, 2002).
2.1.5 Kadar Akrilamida dalam Berbagai Makanan
Tabel 1. Kadar Akrilamida Dalam Berbagai Jenis Makanan
(Friedman, 2003) 2.1.6 Metode Analisis
2.2 Teori Kromatografi Cair Kinerja Tinggi 2.2.1 Sejarah Kromatografi
Kromatografi adalah suatu istilah umum yang digunakan untuk bermacam-macam teknik pemisahan yang didasarkan atas partisi atau absorbsi sampel diantara suatu fase gerak yang bisa berupa gas ataupun cair dan dan fase diam yang juga bisa cairan atau suatu padatan. Penemu Kromatografi adalah Tswett yang pada tahun 1903 mencoba memisahkan pigmen-pigmen dari daun dengan menggunakan suatu kolom yang berisi kapur (CaSO4). Istilah kromatografi diciptakan oleh Tswett untuk melukiskan daerah-daerah yang berwarna yang bergerak ke bawah kolom. Pada waktu yang hampir bersamaan, D.T. Day juga menggunakan kromatografi untuk memisahan fraksi-fraksi petroleum, namun Tswett adalah yang pertama diakui sebagai penemu dan yang menjelaskan tentang proses kromatografi (Johnson, 1991).
2.2.2 Pembagian Kromatografi
Kromatografi dapat dibedakan atas berbagai macam, tergantung pada pengelompokannya. Berdasarkan pada mekanisme pemisahannya, kromatografi dibedakan menjadi : (a) kromatografi adsorbsi; (b) kromatografi partisi; (c) kromatografi pasangan ion; (d) kromatografi penukar ion (e) kromatografi eksklusi ukuran dan (f) kromatografi afinitas (Johnson, 1991; Rohman, 2007).
2.2.3 Kromatografi Cair Kinerja Tinggi
Kromatografi cair kinerja tinggi (KCKT) merupakan sistem pemisahan dengan kecepatan dan efisiensi yang tinggi karena didukung oleh kemajuan dalam teknologi kolom, sistem pompa tekanan tinggi dan detektor yang sangat sensitifdan beragam sehingga mampu menganalisis berbagai analit secara kualitatif maupun kuantitatif, baik dalam komponen tunggal maupun campuran (Depkes, 1995).
Kromatografi cair kinerja tinggi dikembangkan pada akhir tahun 1960-an, saat ini KCKT merupakan teknik pemisahan yang diterima secara luas untuk analisis dan pemurnian senyawa tertentu dalam suatu sampel pada sejumlah bidang. KCKT merupakan metode yang tidak destruktif dan dapat digunakan baik untuk analisis kuantitatif maupun kualitatif (Rohman, 2007).
Kegunaan umum KCKT adalah untuk pemisahan sejumlah senyawa organik, anorganik, maupun senyawa biologis, analisis ketidakmurnian (impurities) dan analisis senyawa-senyawa yang tidak mudah menguap (nonvolatile). KCKT sering digunakan untuk menetapkan kadar senyawa-senyawa tertentu seperti asam-asam amino, asam-asam nukleat dan protein-protein dalam cairan fisiologis, menentukan kadar senyawa-senyawa aktif obat dan lain-lain (Rohman, 2007).
2.2.3.1 Jenis-jenis KCKT
Pada KCKT fase normal (fase diam lebih polar daripada fase gerak), kemampuan elusi meningkat dengan meningkatnya polaritas pelarut. Fase gerak biasanya non polar, seperti dietil eter, benzen, hidrokarbon lurus seperti pentana, heksana, heptana maupun iso-oktana. Halida alifatis seperti diklorometana, dikloroetana, butilklorida dan kloroform juga digunakan. Umumnya gas terlarut tidak menimbulkan masalah pada fase normal.
Pada KCKT fase terbalik paling sering digunakan fase diam berupa oktadesilsilan (ODS atau C18) dan fase gerak campuran methanol atau asetonitril dengan air atau dengan larutan buffer. Untuk solut yang bersifat asam lemah ,peranan pH sangat krusial karena bila pH fase gerak tidak diatur maka solute akan mengalami ionisasi atau protonisasi. Terbentuknya spesies yang terionisasi ini menyebabkan ikatannya dengan fase diam menjadi lebih lemah dibanding jika solute dalam bentuk spesies yang tidak terionisasi akan terelusi lebih cepat (Rohman, 2007).
2.2.4 Cara Kerja KCKT
Secara teori, pemisahan kromatografi yang paling baik akan diperoleh jika fase diam mempunyai luas permukaan sebesar-besarnya sehingga memastikan kesetimbangan yang baik antara fase dan bila fase gerak bergerak dengan cepat sehingga difusi sekecil-kecilnya (Gritter, 1991).
baik, diperlukan penggabungan secara tepat dari kondisi operasional seperti jenis kolom, fase gerak, panjang dan diameter kolom, kecepatan alir fase gerak, suhu kolom dan ukuran sampel (Rohman, 2007).
Komponen yang telah terpisah akan dibawa oleh fase gerak menuju detektor dan sinyal yang terekam oleh detektor disebut sebagai puncak, sedangkan keseluruhan puncak yang direkam oleh detektor selama analisis dinamakan kromatogram. Puncak yang diperoleh dalam analisis memiliki dua informasi penting yakni informasi kualitatif dan kuantitatif (Meyer, 2004).
2.2.5 Migrasi dan Retensi Solut
Kecepatan migrasi solut melalui fase diam ditentukan oleh perbandingan distribusinya (D) dan besarnya D ditentukan oleh afinitas relatif solut pada kedua fase (fase diam dan fase bergerak). Dalam konteks kromatografi, nilai D didefinisikan sebagai perbandingan konsentrasi solut dalam fase diam (Cs) dan dalam fase gerak (Cm).
Jadi semakin besar nilai D maka migrasi solut semakin lambat; dan semakin kecil nilai D migrasi solut semakin cepat. Solut akan terelusi menurut perbandingan distribusinya. Jika perbedaan perbandingan distribusi solut cukup besar maka campuran-campuran solut akan mudah dan cepat dipisahkan (Rohman, 2007).
2.2.6 Instrumen KCKT
Instrument KCKT tersusun atas 6 bagian dasar, yaitu wadah fase gerak (reservoir), pompa (pump), tempat injeksi sampel (injector), kolom (column), detector (detector) dan perekam (recorder). Ilustrasi instrument dasar KCKT dapat dilihat pada gambar
Gambar 2 . Instrumen Dasar KCKT
2.2.6.1 Wadah Fase Gerak
Wadah fase gerak harus bersih dan inert. Wadah pelarut kosong ataupun labu dapat digunakan sebagai wadah fase gerak dan biasanya dapat menampung fase gerak antara 1 sampai 2 liter pelarut. Fase gerak sebelum digunakan harus dilakukan degassing (penghilangan gas) yang ada pada fase gerak, sebab adanya gas akan berkumpul dengan komponen lain terutama dipompa dan detektor sehingga akan mengacaukan analisis (Rohman, 2007).
2.2.6.2 Pompa
terhadap fase gerak. Bahan yang umum dipakai untuk pompa adalah gelas, baja tahan karat, Teflon, dan batu nilam. Pompa yang dgunakan sebaiknya mampu memberikan tekanan sampai 5000 psi dan mampu mengalirkan fase gerak dengan kecepatan alir 3 ml/ menit (Rohman, 2007).
Ada dua jenis utama pompa yang digunakan: tekanan-tetap. Pompa pendesakan tetap dapat dibagi lagi menjadi pompa torak dan pompa semprit. Pompa torak menghasilkan aliran yang berdenyut, jadi memerlukan peredam denyut atau peredam elektronik untuk menghasilakan garis alais detektor yang stabil jika detektor peka terhadap aliran. Kelebihan utamanya ialah tandonnya tidak terbatas. Pompa semprit menghasilkan aliran yang tak berdenyut, tetapi tandonnya terbatas (Johnson, 1991).
2.2.6.3 Injektor
Sampel-sampel cair dan larutan disuntikkan secara langsung ke dalam fase gerak yang mengalir dibawah tekanan menuju kolom menggunakan alat penyuntik yang terbuat dari tembaga tahan karat dan katup Teflon yang dilengkapi dengan keluk sampel (sample loop) (Rohman,2007).
2.2.6.4 Kolom
Kolom dapat dibagi menjadi dua kelompok:
b. Kolom preparatif: umumnya bergaris tengah 6 mm atau lebih besar dari panjang 25-100 cm.
Kolom hampir selalu terbuat dari baja nirkarat. Kolom biasanya dipakai pada suhu kamar, tetapi pada suhu yang lebih tinggi dapat juga dipakai (Johnson, 1991).
2.2.6.5 Detektor
Suatu detektor dibutuhkan untuk mendeteksi adanya komponen cuplikan dalam aliran yang keluar dari kolom. Detektor-detektor yang baik memiliki sensitifitas yang tinggi, gangguan (noise) yang rendah, kisar respons linier yang luas, dan memberi tanggapan/respon untuk semua tipe senyawa. Suatu kepekaan yang rendah terhadap aliran dan fluktuasi temperatur sangat diinginkan, tetapi tidak selalu dapat diperoleh.
Detektor yang paling banyak digunakan dalam kromatografi cair modern kecepatan tinggi adalah detektor spektrofotometer UV 254 nm. Bermacam-macam detektor dengan variasi panjang gelombang UV-Vis sekarang menjadi populer karena mereka dapat digunakan untuk mendeteksi senyawa-senyawa dalam rentang yang luas. Detektor indeks refraksi juga secara luas digunakan, terutama dalam kromatografi eksklusi, tetapi umumnya kurang sensitif dari pada detektor spektrofotometer UV. Detektor lainnya, antara lain: detektor fluometer, detektor ionisasi nyala, detektor elektrokimia dan lain-lain juga telah digunakan.
jenis senyawa. Detektor yang merupakan tulang punggung kromatografi cair kecepatan tinggi modern (KCKT) ialah detektor UV 254 nm (Jonshon, 1991).
2.2.6.6 Perekam
Alat pengumpul data seperti komputer, integrator, rekorder dihubungkan dengan detektor. Alat ini akan mengukur sinyal elektronik yang dihasilkan oleh detektor lalu mem-plotkannya sebagai suatu kromatogram yang selanjutnya dapat dievaluasi oleh seorang analis (Rohman, 2007).
2.2.7 Parameter Penting dalam KCKT 2.2.7.1 Tinggi dan Luas Puncak
2.2.7.2 Waktu Tambat
Periode waktu antara penyuntikan sampel dan puncak maksimum yang terekam oleh detektor disebut sebagai waktu tambat. Waktu tambat dari suatu komponen yang tidak ditahan oleh fase diam disebut sebagai waktu hampa/void time (t0). Waktu tambat merupakan fungsi dari laju alir fase gerak dan panjang
kolom. Jika fase gerak mengalir lebih lambat atau kolom semakin panjang, waktu hampa dan waktu tambat akan semakin besar, dan sebaliknya bila fase gerak mengalir lebih cepat atau kolom semakin pendek, maka waktu hampa dan waktu tambat akan semakin kecil (Meyer, 2004).
2.2.7.3 Faktor Kapasitas
Waktu tambat dipengaruhi oleh laju alir, ukuran kolom dan parameter yang lain. Oleh karena itu, diperlukan suatu ukuran derajat tambatan dari analit yang lebih independen yakni faktor kapasitas (k’). Faktor kapasitas dihitung dengan membagi waktu tambat bersih (t’R) dengan waktu hampa (t0) (Ornaf dan Dong, 2005).
Dalam beberapa literatur lain, faktor kapasitas juga disebut sebagai factor tambat (k) dalam beberapa literatur yang lain. Idealnya, analit yang sama jika diukur pada dua instrumen berbeda dengan ukuran kolom yang berbeda namun memiliki fase diam dan fase gerak yang sama, maka faktor tambat dari analit pada kedua sistem KCKT tersebut secara teoritis adalah sama (Kazakevich dan LoBrutto, 2007).
tidak terjadi interaksi dengan fase diam dan oleh karena itu tidak akan muncul dalam kromatogram. Sebaliknya, nilai k yang terlalu besar mengindikasikan waktu analisis akan panjang (Meyer, 2004). Nilai k’ dari analit yang lebih besar dari 20 akan menjadi masalah dalam analisis KCKT karena waktu analisis yang terlalu panjang dan sensitifitas yang buruk sebagai akibat dari pelebaran puncak yang berlebihan (Ornaf dan Dong, 2005).
2.2.7.4 Selektifitas
Proses pemisahan antara dua komponen dalam KCKT hanya memungkinkan bila kedua komponen memiliki kecepatan yang berbeda dalam melewati kolom (Ornaf dan Dong, 2005). Kemampuan sistem kromatografi dalam
memisahkan/membedakan analit yang berbeda dikenal sebagai selektifitas (α).
Selektifitas umumnya tergantung pada sifat analit itu sendiri, interaksinya dengan permukaan fase diam serta jenis fase gerak yang digunakan (Kazakevich dan LoBrutto, 2007). Nilai selektifitas yang didapatkan dalam sistem KCKT harus lebih besar dari 1 (Ornaf dan Dong, 2005). Selektifitas disebut juga sebagai faktor pemisahan atau tambatan relatif (Meyer, 2004).
2.2.7.5 Efisiensi Kolom
menghasilkan satu lempeng teoritis. Kolom yang baik akan mempunyai bilangan lempeng yang tinggi dan nilai H yang rendah, untuk mencapai hal ini ada beberapa faktor yang mendukung yaitu kolom yang dikemas dengan baik, kolom yang lebih panjang, partikel fase diam yang lebih kecil, viskositas fase gerak yang lebih rendah dan suhu yang lebih tinggi, molekul-molekul sampel yang lebih kecil, dan pengaruh di luar kolom yang minimal (Rohman, 2007).
2.2.7.6 Resolusi
Tingkat pemisahan komponen dalam suatu campuran dengan metode kromatografi direfleksikan dalam kromatogram yang dihasilkan, untuk hasil pemisahan yang baik puncak-puncak dalam kromatogram harus terpisah secara sempurna dari puncak lainnya. Resolusi adalah perbedaan waktu retensi 2 puncak yang saling berdekatan, dibagi dengan rata-rata lebar puncak, dengan rumus sbb:
Ket:
t = waktu retensi puncak W = lebar puncak
Nilai Rs mendekati atau lebih dari 1,5 akan memberikan pemisahan yang baik (Rohman, 2007).
) (
2 2 1 W W
t
Rs R
+ ∆ =
1 2 R R
R t t
t = −
2.2.7.7 Faktor Asimetri
Adanya puncak, yang asimetris dapat disebabkan oleh hal –hal berikut: • Ukuran sampel yang dianalisis terlalu besar. Jika sampel terlalu besar maka fase gerak tidak mampu membawa solut dengan sempurna karenanya terjadi pengekoran atau tailing.
• Interaksi yang kuat antara solut dengan fase diam dapat menyebabkan solut
sukar terelusi sehingga dapat menyebabkan terbentuknya puncak yang mengekor. • Adanya kontaminan dalam sampel yang dapat muncul terlebih dahulu sehingga menimbulkan puncak mendahului (fronting).
(Rohman, 2007).
2.3 Validasi Metode
Validasi metoda analisis adalah suatu tindakan penilaian terhadap
parameter tertentu, berdasarkan percobaan laboratorium, untuk membuktikan
bahwa parameter tersebut memenuhi persyaratan untuk penggunaannya (Harmita,
2004). Berikut delapan karakterisitik utama yang digunakan dalam validasi metode analitik menurut USP:
Karakteristik Pengertian
Akurasi Kedekatan antara nilai hasil uji yang diperoleh lewat metode analitik dengan nilai sebenarnya.
Spesifisitas Kemampuan untuk mengukur analit yang dituju secara tepat dan spesifik dengan adanya komponen lain dalam matriks sampel seperti ketidakmurnian, produk degradatif dan komponen matriks.
Batas deteksi Konsentrasi analit terendah dalam sampel yang masih dapat dideteksi, meskipun tidak selalu dapat dikuantifikasi.
Batas kuantitasi Konsentrasi analit terendah dalam sampel yang dapat ditentukan dengan presisi dan akurasi yang dapat diterima pada kondisi operasional metode yang digunakan.
Linieritas
Rentang
Kemampuan suatu metode untuk memperoleh hasil uji yang secara langsung proposional dengan konsentrasi analit pada kisaran yang diberikan.
Konsentrasi terendah dan tertinggi yang mana suatu metode analitik menunjukkan akurasi, presisi dan linieritas yang cukup. Kekasaran Tingkat reprodusibilitas hasil yang diperoleh dibawah berbagai
kondisi yang diekspresikan sebagai % RSD.
Ketahanan Kapasitas metode untuk tidak terpengaruh oleh adanya variasi parameter yang kecil.
(Rohman, 2007)
2.3.1 Akurasi
Akurasi/kecermatan dapat ditentukan dengan dua metode, yakni spiked placebo recovery dan standard addition method. Pada spiked placebo recovery
atau metode simulasi, analit murni ditambahkan (spiked) ke dalam campuran bahan pembawa sediaan farmasi, lalu campuran tersebut dianalisis dan jumlah analit hasil analisis dibandingkan dengan jumlah analit teoritis yang diharapkan.
Jika plasebo tidak memungkinkan untuk disiapkan, maka sejumlah analit yang telah diketahui konsentrasinya dapat ditambahkan langsung ke dalam sediaan farmasi otentik. Metode ini dinamakan metode standard addition method atau metode penambahan baku.
tersebut, ditambah dengan jumlah analit yg di-spiked ke dalam sediaan. Akurasi kemudian dinyatakan dalam persen perolehan kembali (%Recovery).
Persen perolehan kembali ditentukan sebagai rasio antara hasil yang diperoleh dari analisis dengan hasil sebenarnya yang dihitung secara teoritis. Hal yang penting untuk diperhatikan adalah metode kuantitasi yang digunakan dalam penentuan akurasi harus sama dengan metode kuantitasi yang digunakan untuk menganalisis sampel dalam penelitian (Harmita, 2004; Ermer, 2005).
2.3.2 Presisi
Presisi diekspresikan dengan standar deviasi atau standar deviasi relatif (RSD) dari serangkaian data. Data untuk menguji presisi seringkali dikumpulkan sebagai bagian dari kajian-kajian lain yang berkaitan dengan presisi seperti linearitas atau akurasi. Biasnya replikasi 6-15 dilakukan pada sampel tunggal untuk tiap-tiap konsentrasi.
Pada pengujian dengan KCKT, nilai RSD antara 1-2% biasanya dipersyaratkan untuk senyawa-senyawa aktif dalam jumlah yang banyak sedangkan untuk senyawa-senyawa dengan kadar sekelumit RSD berkisar antara 5-15% (Rohman, 2007).
2.3.3 Spesifitas
menggunakan detektor selektif terutama untuk senyawa-senyawa yang terelusi secara bersama-sama sebagai contoh detektor elektrokimia hanya akan mendeteksi senyawa tertentu, sementara senyawa yang lainnya tidak terdeteksi. Penggunaan detektor UV pada panjang gelombang yang spesifik juga merupakan cara yang efektif untuk melakukan pengukuran selektifitas (Rohman, 2007).
2.3.4 Batas Deteksi dan Batas Kuantitasi
Batas deteksi dan batas kuantitasi dapat ditentukan dengan 2 metode yakni metode non instrumental visual dan metode perhitungan. Metode non instrumental visual digunakan pada teknik kromatografi lapis tipis dan metode titrimetri. Metode perhitungan didasarkan pada simpangan baku respon (SD) dan derajat kemiringan/slope (b) dengan rumus perhitungan batas deteksi yakni 3,3 (SD/b) sedangkan batas kuantitasi dihitung dengan rumus 10(SD/b). Simpangan baku respon dapat ditentukan berdasarkan simpangan baku blanko, simpangan baku residual dari garis regresi atau simpangan baku intersep y pada garis regresi (Rohman, 2007).
2.3.5 Linearitas
kuadrat terkecil, untuk selanjutnya dapat ditentukan nilai kemiringan (slope), intersep, dan koefisien korelasinya (Rohman, 2007).
2.3.6 Rentang
Rentang atau kisaran suatu metode didefinisikan sebagai konsentrasi terendah dan tertinggi yang mana suatu metode analisis menunjukkan akurasi, presisi, dan linearitas yang mencukupi. Kisaran-kisaran konsentrasi yang diuji tergantung pada jenis metode dan kegunaannya (Rohman, 2007).
2.3.7 Kekuatan
BAB III
METODOLOGI
Penelitian ini merupakan penelitian eksperimental yang dilakukan di laboratorium Penelitian, Fakultas Farmasi, Universitas Sumatera Utara, Medan pada bulan Mei hingga Juni 2010.
3.1 Alat
Alat yang digunakan dalam penelitian ini meliputi seperangkat instrumen KCKT (Shimadzu Prominence series), kolom Shim-Pack VP-ODS (4,6 x 250
mm), injektor (Rheodyne 7225i) dan detektor UV/Vis (SPD 20 A); syringe 100 μl
(SGE); sonifikator (Branson 1510); pompa vakum (Gast DOA-P604-BN); penyaring membran Whatman Cellulose Nitrate 0,45 μm dan PTFE 0,5 μm dengan diameter 47 mm, penyaring membran Whatman Cellulose Nitrate 0,2 μm dengan diameter 13 mm; neraca analitik (Boeco BBL31); spektrofotometer UV (Shimadzu 1800); laboratory shaker (Julabo SW 22); hot plate (Fisons); sentrifugator (Janetzki T5); alat destilasi serta peralatan gelas yang umumnya digunakan dalam laboratorium analitik (Gambar alat dapat dilihat pada Lampiran 24 dan 25).
3.2 Bahan
3.3 Sampel
Sampel yang diperiksa dalam penelitian ini merupakan kentang goreng yang berasal dari 6 restoran cepat saji yang berada di kota Medan, yaitu AW, CFC, KFC, Mc Donald, Popeye, dan Texas.
3.4 Rancangan Penelitian 3.4.1 Penyiapan Bahan
3.4.1.1 Pembuatan Fase Gerak
Fase gerak terdiri dari larutan asam fosfat 11,45 mM dan asetonitril secara terpisah. Larutan asam fosfat 11,45 mM dibuat dari asam fosfat 85% b/v, diambil 12 ml lalu ditambahkan aquabidest hingga garis tanda pada labu tentukur 100 ml (asam fosfat 10%), setelah itu diambil 11 ml larutan asam fosfat 10% dan ditambahkan aquabidest hingga garis tanda pada labu tentukur 1000 ml. Sebelum digunakan, larutan asam fosfat 11,45 mM dan asetonitril disaring masing-masing melalui penyaring membran Whatman Cellulose Nitrate 0,45 μm dan PTFE 0,5
μm, kemudian diawaudarakan selama ± 20 menit menggunakan sonifikator.
3.4.1.2 Pembuatan Pelarut
3.4.1.3 Pembuatan Larutan Induk Baku Pembanding Akrilamida 3.4.1.3.1 Pembuatan Larutan Induk Baku I (1000 ppm)
Ditimbang seksama sebanyak 50,0 mg akrilamida baku, dimasukkan ke dalam labu tentukur 50 ml, dilarutkan dengan sedikit pelarut, kemudian dikocok dan diencerkan dengan pelarut sampai garis tanda sehingga diperoleh larutan dengan konsentrasi 1000 ppm.
3.4.1.3.2 Pembuatan Larutan Induk Baku II (100 ppm)
Dipipet 5 ml larutan induk baku I, dimasukkan ke dalam labu tentukur 50 ml, diencerkan dengan pelarut sampai garis tanda lalu dikocok sampai homogen sehingga diperoleh larutan dengan konsentrasi 100 ppm.
3.4.1.3.3 Pembuatan Larutan Induk Baku III (10 ppm)
Dipipet 5 ml larutan induk baku II, dimasukkan ke dalam labu tentukur 50 ml, diencerkan dengan pelarut sampai garis tanda dan dikocok sampai homogen sehingga diperoleh larutan dengan konsentrasi 10 ppm.
3.4.1.4 Pembuatan Larutan Sampel
terekstraksi, larutan destilat kemudian disentrifugasi selama 30 menit (Levitta, J., 2006). Setelah itu, larutan dibekukan dalam freezer lemari pendingin selama 3 jam. Minyak yang sudah memadat dipisahkan secara fisik dari fase air beku. Larutan ini kemudian disebut sebagai larutan sampel.
3.4.2 Prosedur Analisis
3.4.2.1 Penyiapan Alat KCKT
Kolom yang digunakan adalah Shim-Pack VP-ODS (4,6 x 250 mm). KCKT menggunakan detektor UV dengan sensitifitas 1,000 AUFS. Pompa menggunakan mode aliran tetap dengan low-pressure gradient system untuk memperoleh komposisi fase gerak yang konstan selama analisis (sistem elusi isokratik).
Setelah alat KCKT dihidupkan, maka pompa dijalankan dan fase gerak dibiarkan mengalir selama ± 30 menit sampai diperoleh garis alas yang datar pertanda sistem kromatografi telah stabil.
3.4.2.2 Analisis Kualitatif
spiking dengan kromatogram larutan sampel sebelum spiking. Sampel dinyatakan
mengandung akrilamida jika terjadi peningkatan tinggi dan luas puncak pada kromatogram hasil spiking dengan waktu tambat yang sama seperti pada kromatogram penyuntikan larutan baku pembanding.
3.4.2.3 Analisis Kuantitatif
3.4.2.3.1 Penentuan Linieritas Kurva Kalibrasi Baku Pembanding Akrilamida
Larutan induk baku III (10 ppm) dipipet 6 ml; 8 ml; 10 ml; 12 ml; dan 13 ml masing-masing dimasukkan ke dalam labu tentukur 25 ml, diencerkan dengan pelarut sampai garis tanda. Lalu dikocok sampai homogen sehingga diperoleh larutan dengan konsentrasi 2,4 ppm; 3,2 ppm; 4 ppm; 4,8 ppm; dan 5,2 ppm. Masing-masing larutan tersebut disaring melalui penyaring membran Cellulose Nitrate 0,2 μm dan diawaudarakan selama ± 20 menit. Setelah itu, filtrat larutan baku pembanding disuntikkan sebanyak 100 μl ke dalam sistem KCKT melalui injektor dengan loop 20 μl. Direkam kromatogram dan dibuat kurva kalibrasi antara luas puncak dengan konsentrasi, lalu dihitung persamaan regresi dan koefisien korelasi (kromatogram dan data perhitungan dapat dilihat pada lampiran 3 dan 4)..
3.4.2.3.2 Penetapan Kadar Akrilamida dalam Sampel
fase gerak larutan asam fosfat 11,45 mM dan asetonitril dimana perbandingan komposisi dan laju alir sesuai dengan hasil optimasi. Deteksi menggunakan detektor UV pada panjang gelombang hasil optimasi. Direkam kromatogram dan dicatat luas puncak, kromatogram dapat dilihat pada lampiran 5, 7, 9, 11, 13, dan15.
Kadar akrilamida yang terdapat dalam larutan sampel (X) dihitung dengan mensubstitusikan luas puncak ke dalam persamaan regresi yang diperoleh dari kurva kalibrasi sebagai Y. Hasilnya lalu dikali volume larutan sampel (25 ml), kemudian dibagi dengan berat penimbangan sampel kentang goreng sehingga diperoleh kadar akrilamida dengan satuan mcg/g sampel.
Rumus perhitungan kadar akrilamida dalam sampel dituliskan sebagai berikut. Kadar akrilamida =
Contoh perhitungan untuk mencari kadar dapat dilihat pada Lampiran 18. 3.4.2.4 Analisis Data Penetapan Kadar Secara Statistik
Data perhitungan kadar akrilamida dianalisis secara statistik menggunakan uji t. Rumus yang digunakan untuk menghitung simpangan baku adalah:
Untuk mengetahui apakah data diterima atau ditolak digunakan rumus seperti di bawah ini :
t hitung =
n SD X X / −
Dasar penolakan data jika thitung ≥ ttabel dan thitung≤ -ttabel.
Untuk mencari kadar akrilamida sebenarnya dengan taraf kepercayaan 95% dengan derajat kebebasan dk = n-1 dan α = 0,05, digunakan rumus :
µ = X± t(1-1/2α)dk x
n
SD
Keterangan : µ = interval kepercayaan X = kadar rata-rata sampel X = kadar sampel
t = harga t tabel sesuai dengan dk = n-1
α = tingkat kepercayaaan dk = derajat kebebasan SD = standard deviation n = jumlah perlakuan
Data perhitungan penetapan kadar secara statistik dapat dilihat pada lampiran 6, 8, 10, 12, 14, dan 16.
3.4.3 Validasi Metode 3.4.3.1 Akurasi
Akurasi ditentukan dengan menggunakan metode penambahan baku (the method of standard additives), yakni ke dalam sampel kentang goreng
ditambahkan akrilamida baku sebanyak 50%, 100%, 150% dari rerata kadar akrilamida yang terdapat pada sampel, kemudian dianalisis dengan prosedur yang sama seperti pada sampel. Hasil dinyatakan dalam persen perolehan kembali (% recovery). Persen perolehan kembali dihitung dengan menggunakan rumus sbb :
% Perolehan Kembali
Keterangan : A = konsentrasi sampel yang diperoleh setelah penambahan baku B = konsentrasi sampel sebelum penambahan bahan baku
C = konsentrasi baku yang ditambahkan
Contoh perhitungan persen perolehan kembali dapat dilihat pada Lampiran 20. %
100 x C
3.4.3.2 Presisi
Uji presisi (keseksamaan) ditentukan dengan parameter RSD (Relatif Standard Deviasi) dengan rumus :
RSD = Keterangan :
RSD = Relative Standard Deviation SD = Standard Deviation
X = Kadar Rerata Akrilamida dalam Sampel 3.4.3.3 Penentuan Batas Deteksi dan Batas Kuantitasi
Batas deteksi (Limit Of Detection/LOD) dan batas kuantitasi (Limit Of Quantitation/LOQ) dihitung dari persamaan regresi kurva kalibrasi baku
pembanding. Batas deteksi dan batas kuantitasi dapat dihitung dengan menggunakan rumus sebagai berikut :
Keterangan : SB = Simpangan Baku
LOD = Limit of Detection (Batas Deteksi) LOQ = Limit of Quantitation (Batas Kuantitasi)
Data perhitungan penetapan batas deteksi dan batas kuantitasi dapat dilihat pada Lampiran 21.
% 100 x X SD
2 )
( 2
− − =
∑
n Yi Y SB
Slope SB x LOD=3
BAB IV
HASIL DAN PEMBAHASAN
4.1 Penentuan Kondisi Kromatografi untuk Mendapatkan Hasil Analisis yang Optimum
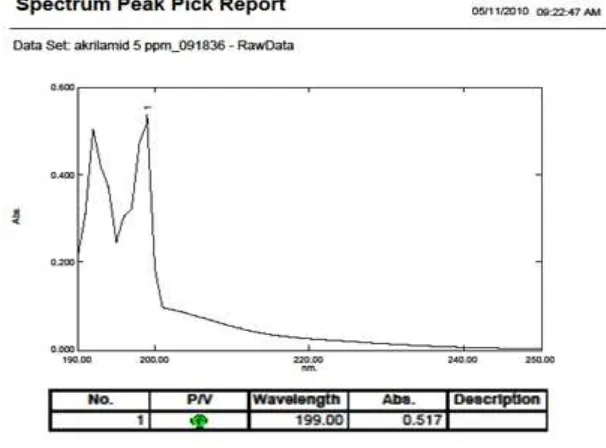
[image:47.595.176.479.394.618.2]Sebelum dilakukan penentuan kadar akrilamida pada sampel terlebih dahulu dilakukan optimasi meliputi panjang gelombang analisis, komposisi fase gerak dan laju alir. Panjang gelombang analisis ditentukan dengan membuat kurva serapan akrilamida baku menggunakan spektrofotometer UV. Spektrum hasil pengukuran akrilamida baku dapat dilihat pada Gambar 3.
maksimum akrilamida pada 199 nm dengan serapan 0,517 seperti terlihat pada gambar 4 Adanya perbedaan panjang gelombang ini masih dalam batas-batas yang diterima yaitu ± 2 nm (Moffat, 2004).
Penggunaan panjang gelombang analisis pada 199 nm memberikan banyak gangguan dikarenakan pelarut sampel yaitu asetonitril memiliki serapan pada panjang gelombang 210 nm. Berdasarkan hal tersebut maka analisis akrilamida dalam penelitian ini dilakukan pada panjang gelombang 230 nm dimana panjang gelombang ini telah digunakan oleh Harahap (2006) untuk menganalisis akrilamida dalam kentang goreng secara KCKT dengan menggunakan fase gerak asetonitril:aquabidest:asam fosfat 10% (5:94:1) dan laju alir 1,0 ml/menit.
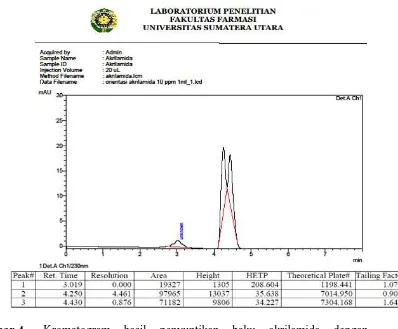
Gambar 4. Kromatogram hasil penyuntikan baku akrilamida dengan komposisi fase gerak asetonitril:aquabidest:asam fosfat 10% (5:94:1)
Tabel 2. Perbandingan Kromatogram Baku dengan Komposisi Fase Gerak yang Dioptimasi
Komposisi Fase Gerak Tailing Factor
Theoritical Plate
HETP asetonitril:aquabidest:asam fosfat
10% (5:94:1)
Terdapat 2 Puncak kromatogram
asetonitril:aquabidest:asam fosfat 10%
(10:89:1)
Terdapat 2 Puncak kromatogram
asetonitril:aquabidest:asam fosfat 10%
(15:84:1)
0,820 1643,125 152,149
asetonitril:aquabidest:asam fosfat 10%
(20:79:1)
1,023 2795,068 89,443
Gambar 5. Kromatogram hasil penyuntikan baku akrilamida dengan komposisi fase gerak asetonitril:aquabidest:asam fosfat 10% (20:79:1)
Gambar 6. Kromatogram hasil penyuntikan sampel Texas dengan komposisi fase gerak asetonitril:aquabidest:asam fosfat 10% (20:79:1)
Gambar 7. Kromatogram hasil spike sampel Texas dengan komposisi fase gerak asetonitril:aquabidest:asam fosfat 10% (20:79:1)
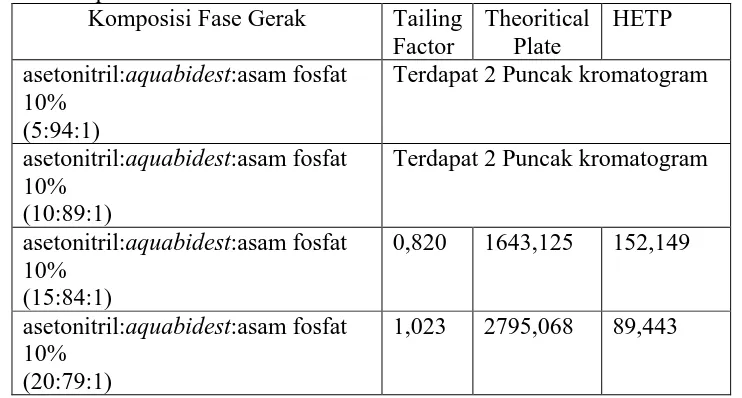
Tabel 3. Perbandingan Kromatogram Sampel dengan Komposisi Fase Gerak yang Dioptimasi
Komposisi Fase Gerak Tailing Factor
Theoritical Plate
HETP asetonitril: Larutan asam fosfat 11,45mM
(20:80)
2,637 2338,387 106,911 asetonitril: Larutan asam fosfat 11,45mM
(15:85)
1,641 16720,590 14,952 asetonitril: Larutan asam fosfat 11,45mM
(10:90)
1,497 21922,067 11,404 asetonitril: Larutan asam fosfat 11,45mM
(5:95)
1,590 29722,506 8,411
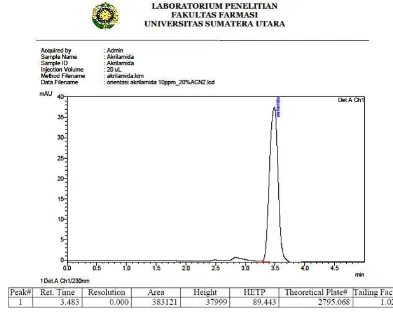
Dari tabel diatas dapat dilihat bahwa komposisi fase gerak sampel yang terbaik diperoleh pada perbandingan asetonitril:larutan asam fosfat 11,45 mM (5:95) karena menunjukkan nilai pelat teori yang tertinggi, HETP yang terendah, faktor ikutan 1,590 (≤ 2) dan puncak yang simetris seperti terlihat pada gambar 8 sedangkan kromatogram perbandingan fase gerak lainnya dapat dilihat pada lampiran 2.
[image:54.595.152.465.447.714.2]4.2 Analisis Kualitatif
[image:55.595.121.501.242.541.2]Hasil identifikasi sampel kentang goreng yang berasal dari 6 restoran cepat saji menunjukkan adanya akrilamida, hal ini didukung oleh waktu retensi sampel terhadap baku akrilamida yang hampir sama (≤ 5%) . Salah satu contoh kromatogram sampel dan baku akrilamida hasil analisis KCKT ini dapat dilihat pada gambar 9 dan 10.
Gambar 10. Kromatogram hasil penyuntikan baku akrilamida 10 ppm dengan kondisi fase gerak asetonitril:larutan asam fosfat 11,45 mM (5:95)
Gambar 11. Kromatogram hasil penyuntikan larutan sampel yang telah di-spike dengan larutan baku pembanding akrilamida dengan kondisi KCKT yang sama untuk uji kualitatif.
4.3 Analisis Kuantitatif
[image:57.595.121.506.82.408.2]Gambar 12. Kurva kalibrasi akrilamida baku.
Dari kurva kalibrasi diperoleh hubungan yang linier antara luas puncak dan konsentrasi dengan koefisien korelasi, r = 0,9978. Koefisien korelasi ini telah memenuhi persyaratan lebih besar dari 0,9950 (Moffat, 2004).
4.4 Perolehan Kadar Akrilamida dalam Sampel Kentang Goreng
Hasil penentuan rerata kadar akrilamida dalam sampel kentang goreng dari 6 restoran cepat saji di kota Medan terdapat dalam tabel berikut:
Tabel 4. Rerata kadar akrilamida dalam sampel kentang goreng No Sampel Rerata Kadar Akrilamida (mg/kg sampel)
1 AW 3,1925
2 CFC 1,8286
3 KFC 0,4525
4 Mc Donald 5,1069
5 Popeye 1,7603
6 Texas 11,3501
Ket: rerata kadar akrilamida diperoleh dari 6 kali replikasi
Adapun alasan pemilihan 6 restoran diatas karena merupakan restoran-restoran cepat saji terkenal dan memiliki banyak pengunjung sehingga
0 60000 120000 180000 240000 300000 360000
0 1 2 3 4 5 6
lu
as
ar
ea
[image:58.595.139.487.498.650.2]pengambilan sampel akan mewakili sampel kentang goreng yang dikonsumsi oleh penduduk di kota Medan.
Pengamatan secara visual dari keenam sampel tidak bisa menggambarkan kadar akrilamida yang terkandung didalamnya karena keenam sampel tersebut memiliki ciri visual yang mirip terkecuali sampel Popeye yang warnanya lebih kecoklatan dibanding yang lainnya tetapi setelah dianalisis kadarnya jauh lebih kecil daripada sampel Texas yang warnanya lebih kekuningan. Kadar keenam sampel tersebut masih berada pada batas dosis letal yaitu 50-500 mg/kg.
4.5 Validasi Metode
Pada penelitian ini dilakukan uji validasi dengan metode penambahan bahan baku (standard addition method) terhadap salah satu sampel dari 6 sampel kentang goreng yang ada. Uji validasi yang dilakukan meliputi uji akurasi dengan parameter persen perolehan kembali (% recovery), uji presisi dengan parameter RSD (Relatif Standar Deviasi), batas deteksi (LOD) dan batas kuantitasi (LOQ).
Tabel 5. Data hasil pengujian perolehan kembali akrilamida pada kentang goreng dengan penambahan baku standar (standard addition method)
Rentang Spesifik %
Konsentrasi (mcg/g)
PerolehanKembali (%)
50
2,7509 92,13
2,7486 91,89
2,7632 93,36
100
3,5319 94,62
3,5143 93,64
3,5245 94,21
150
4,3905 94,88
4,4038 95,38
4,4337 96,49
Rata-rata (% recovery) 94,07
Standar Deviasi (SD) 1,59
Relative Standar Deviasi (RSD) (%) 1,69
Dari data di atas diperoleh kadar rata-rata persen recovery, yaitu 94,07 % dengan standar deviasi (SD) sebesar 1,59 %. Hasil persen perolehan kembali ini memenuhi persyaratan uji akurasi dimana rentang rata-rata hasil perolehan kembali adalah 80-120 %. Sedangkan dari hasil uji presisi dengan parameter Relatif Standar Deviasi (RSD) adalah 1,59 %. Hasil Relatif Standard Deviasi (RSD) ini memenuhi persyaratan presisi, dimana nilai RSD yang diizinkan adalah
≤ 2 %.
BAB V
KESIMPULAN DAN SARAN 5.1 Kesimpulan
Dari hasil penelitian menunjukkan kadar akrilamida pada kentang goreng di restoran cepat saji berada pada rentang 0,4-11 mg/kg dimana kadar tersebut masih berada pada batas dosis letal yaitu 50-500 mg/kg.
Metode KCKT menggunakan kolom C18 (4,6 X 250 mm), dengan perbandingan fase gerak asetonitril:aquabidest:asam fosfat (5:94:1), laju alir 1,0 ml/menit, dan detektor UV pada panjang gelombang 230 nm tidak dapat diterapkan dalam penetapan kadar akrilamid pada kentang goreng karena memberikan hasil pemisahan kromatogram yang kurang baik, tetapi dengan merubah komposisi fase gerak menjadi asetonitril:larutan asam fosfat 11,45 mM (5:95) dihasilkan pemisahan kromatogram yang baik dan metode ini memberikan akurasi dengan persen recovery 94,07 %, relatif standar deviasi 1,69 %, batas deteksi 0,5810 mcg/ml dan batas kuantitasi 1,9368 mcg/ml.
5.2 Saran
DAFTAR PUSTAKA
BPOM. (2002). Akrilamida dalam Makanan. Info POM. Vol 3(8): 2.
Brown, L., Rhead, M.M., dan K.C.C. Bancroft. (1982). Rapid Screening Technique Utilising High-Performance Liquid Chromatography for Assessing Acrylamide Contamination in Effluents. Analyst 107: 749-754. Castle, L. (2006). Analysis for Acrylamide in Foods. Dalam: Skog, K., dan
J.Alexander, editors. Acrylamide and Other Hazardous Compounds in Heat-Treated Foods. Cambridge: Woodhead Publishing, Ltd.: 121.
Depkes RI. (1995). Farmakope Indonesia. Edisi IV. Departemen Kesehatan RI. Jakarta. Hal:1002.
FAO dan WHO. (2002). Health Implications of Acrylamide in Food: Report of a Joint FAO/WHO Consultation; 2002: Jun 25-27; Geneva, Switzerland.WHO Headquarters: 12-13.
Friedman, M. (2003). Chemistry, Biochemistry and Safety of Acrylamide: a Review. Journal of Agricultural and Food Chemistry 51: 4509,4517.
Gökmen, V., dan H.Z. Senyuva. (2008). Acrylamide in Heated Foods. Dalam:Gilbert, J., dan H.Z. Senyuva, editors. Bioactive Compounds in Foods.Chichester: Blackwell Publishing: 254, 257-259, 273.
Gritter, R.J, Bobbit, J.M, dan Schwarting, A.E. (1985). Introduction of Chromatography. Penerjemah Kosasih Padmawinata. Pengantar Kromatografi. Edisi Ketiga. Penerbit ITB. Bandung. Hal. 186 - 239.
Harmita. (2004). Petunjuk Pelaksanaan Validasi Metode dan Cara Perhitungannya. Review Artikel. Majalah Ilmu Kefarmasian. Vol 1(3):
117-135.
Johnson, E.L., dan R. Stevenson. (1991). Basic Liquid Chromatography. Penerjemah Kosasih Padmawinata. Dasar Kromatografi Cair. Penerbit ITB. Bandung. Hal. 1–6,278-279.
Leung, R.W.M., Pandey, R.N., dan B.S. Das. (1987). Determination of Polyacrylamides in Coal Washery Effluents by Ultrafiltration/Size-Exclusion Chromatography-Ultraviolet Detection Techniques. Environmental Science Technology 21(5): 476-481.
Moffat, A.C., dkk. (2004). Clarke‘s Analysis Of Drug And Poisons. Thirth edition London: Pharmaceutical Press. Electronic version.
Ötles et al. (2004). Acrylamide in Food. Electronic Journal of Enviromental, Agricultural and Food Chemistry: 723-726.
Rohman, A. (2007). Kimia Farmasi Analisis. Cetakan Pertama. Yogyakarta.Pustaka Pelajar: 323,378-382,393-397, 465-470.
Levita, J. (2006). Study Of The Formation Of Acrylamide in Fried Cassava with Coconut Oil, Palm Oil and Corn Oil As Cooking Media. Universitas Padjajaran. Bandung: 3.
Lampiran 1. Kromatogram Penyuntikan Akrilamida Baku untuk Mencari Komposisi Fase Gerak yang Optimum pada Analisis
Komposisi fase gerak asetonitril:aquabidest:asam fosfat 10% (10:89:1)
Lampiran 2. Kromatogram Penyuntikan Sampel untuk orientasi
Sampel dengan komposisi fase gerak asetonitril:asam fosfat 11,45 mM (15:85)
Lampiran 3. Kromatogram Hasil Penyuntikan Larutan Akrilamida Baku pada Pembuatan Kurva Kalibrasi
A.
B.
Lampiran 3. (lanjutan)
D.
E.
Lampiran 3. (lanjutan)
G.
H.
Lampiran 3. (lanjutan)
J.
K.
Lampiran 3. (lanjutan)
M.
N.
Lampiran 4. Perhitungan Persamaan Regresi dari Kurva Kalibrasi Akrilamida Baku yang Diperoleh dengan KCKT pada Panjang Gelombang 230 nm
Data Hasil Penyuntikan Larutan Akrilamida Baku yang Diperoleh dengan KCKT No. Konsentrasi
(µg/ml))
Luas Area
1 2,4 99377,6667
2 3,2 120089,0000
3 4,0 145568,3333
4 4,8 179312,3333
[image:71.595.203.421.167.272.2]5 5,2 189953,6667
Tabel Konsentrasi (X) vs Luas Area (Y) untuk Akrilamida Baku
No. X Y XY X2 Y2
1 0 0 0 0 0,0000
2 2,4 99377,6667 238506,4001 5,7600 9875920638,7363 3 3,2 120089,0000 384284,8000 10,2400 14421367921,0000 4 4,0 145568,3333 582273,3332 16,0000 21190139659,7399 5 4,8 179312,3333 860699,1998 23,0400 32152912873,4903 6 5,2 189953,6667 987759,0668 27,0400 36082395492,7747
Lampiran 4. (lanjutan) a =
∑
∑
∑
∑
∑ ∑
− − 2 2 2 ) ( ) ( ) )( ( ) )( ( x x n xy x x y= 2
) 6 , 19 ( ) 08 , 82 ( 6 ) 8 , 3053522 )( 6 , 19 ( ) 08 , 82 )( 734301 ( 6 − − = 3694,7710 b =
∑
∑
∑
∑ ∑
− − 2 2 ) ( ) ( ) )( ( ) ( x x n y x xy n= 2
) 6 , 19 ( ) 08 , 82 ( 6 ) 734301 )( 6 , 19 ( ) 8 , 3050522 ( 6 − − = 36270,6536
Sehingga diperoleh persamaan garis regeresi Y = 36270,6536X + 3694,7710 Untuk mencari hubungan linier antara konsentrasi (X) dengan luas area (Y) maka dihitung koefisien korelasi (r) sebagai berikut
r =
∑
∑
∑
∑
−∑
∑ ∑
− − ] ) ( ) ( [ ] ) ( ) ( [ ) )( ( ) ( 2 2 2 2 y y n x x x n y x xy n = 2 2 ) 7343011 ( ) 7410 , 85 1137227365 ( 6 [ ] ) 6 , 19 ( ) 08 , 82 ( 6 [ ) 734301 )( 6 , 19 ( ) 8 , 3053522 ( 6 − − − xLampiran 5. Kromatogram Hasil Penyuntikan Larutan Sampel AW A.
B.
C.
Lampiran 5. (lanjutan) D.
E.
Lampiran 6. Analisis Data secara Statistik dari Hasil Penyuntikan Larutan Sampel AW
No Luas Area (Y)
Kadar (mcg/g)
(X- ) (X- )2
1 49881 3,1946 0,0021 0,000005
2 50036 3,1925 0,0000 0,000000
3 50052 3,2160 0,0235 0,000552
4 50087 3,1882 -0,0043 0,000018
5 50323 3,1818 -0,0107 0,000114
6 50813 3,1819 -0,0106 0,000113
= 3,1925 ∑
= 0,000802 SD = 1 ) ( 2 − −
∑
n X X 5 000802 , 0= = 0,0127
Pada interval kepercayaan 95% dengan nilai α/2 = 0,0025,dk = 5 diperoleh
nilai ttabel = 2,57. Data diterima bila –ttabel ≤ thitung ≤ ttabel.
thitung = n SD X X / −
thitung data 1 = 0,0021 x
0127
,
0
4495
,
2
= 0,4050thitung data 2 = 0,0000 x
0127
,
0
4495
,
2
= 0,0000thitung data 3 = 0,0235 x
0127
,
0
4495
,
2
= 4,5325(ditolak)thitung data 4 = -0,0043 x
0127
,
0
4495
,
2
= -0,8294thitung data 5 = -0,0107 x
0127
,
0
4495
,
2
= -2,0638thitung data 6 = -0,0106 x
Lampiran 6. (lanjutan)
No Kadar
(mcg/g) (X- ) (X- )
2
1 3,1818 -0,0060 0,0000360
2 3,1819 -0,0059 0,0000352
3 3,1882 0,0004 0,0000002
4 3,1925 0,0047 0,0000220
5 3,1946 0,0068 0,0000466
=3,1878 ∑ =0,000140
SD = 1 ) ( 2 − −
∑
n X X 4 000140 , 0= = 0,0059
Pada interval kepercayaan 95% dengan nilai α/2 = 0,0025,dk = 4 diperoleh
nilai ttabel = 2,78. Data diterima bila –ttabel ≤ thitung ≤ ttabel.
thitung = n SD X X / −
thitung data 1 = -0,0060 x
0059
,
0
2361
,
2
= -2,2740thitung data 2 = -0,0059 x
0059
,
0
2361
,
2
= -2,2361thitung data 3 = 0,0004 x
0059
,
0
2361
,
2
= 0,1516thitung data 4 = 0,0047 x
0059
,
0
2361
,
2
= 1,7813thitung data 5 = 0,0068 x
0059
,
0
2361
,
2
= 2,5572Karena –ttabel ≤ thitung ≤ ttabel maka data diterima, maka kadar sebenarnya terletak antara :
Kadar Akrilamida (µ) =
X
± t(1-1/2α)dk x n SD
= 3,1878 ± 0,0073
Lampiran 7. Kromatogram Hasil Penyuntikan Larutan Sampel CFC A.
B.
. Lampiran 7. (lanjutan)
A.
B.
Lampiran 8. Analisis Data secara Statistik dari Hasil Penyuntikan Larutan Sampel CFC
No Luas Area (Y)
Kadar (mcg/g)
(X- ) (X- )2 1 29992 1,8119 -0,0167 0,000279
2 30283 1,8355 0,0069 0,000047
3 30295 1,8310 0,0024 0,000006
4 30322 1,8343 0,0057 0,000033
5 30463 1,8347 0,0061 0,000037
6 30580 1,8242 -0,0044 0,000020
= 1,8286 ∑ = 0,000421
SD = 1 ) ( 2 − −
∑
n X X 5 0004 , 0= = 0,0092
Pada interval kepercayaan 95% dengan nilai α/2 = 0,0025,dk = 5 diperoleh
nilai ttabel = 2,57. Data diterima bila –ttabel ≤ thitung ≤ ttabel.
thitung =
n SD X X / −
thitung data 1 = -0,0167 x
0092
,
0
4495
,
2
= -4,4464 (ditolak)
thitung data 2 = -0,0069 x
0092
,
0
4495
,
2
= -1,8371thitung data 3 = 0,0024 x
thitung data 4 = 0,0057 x
0092
,
0
4495
,
2
= 1,5176thitung data 5 = 0,0061 x
0092
,
0
4495
,
2
= 1,6241thitung data 6 = -0,0044 x
0092
,
0
4495
,
2
= -1,1715Lampiran 8. (lanjutan)
No
Kadar (mcg/g)
(X- ) (X- )2
1 1,8242 -0,0078 0,000060
2 1,8310 -0,0009 0,000001
3 1,8343 0,0024 0,000006
4 1,8347 0,0027 0,000008
5 1,8355 0,0035 0,000012
= 1,8319 ∑ = 0,000087
SD = 1 ) ( 2 − −
∑
n X X 4 00009 , 0= = 0,0046
Pada interval kepercayaan 95% dengan nilai α/2 = 0,0025, dk = 4
diperoleh nilai ttabel = 2,78. Data diterima bila –ttabel ≤ thitung ≤ ttabel.
thitung = n SD X X / −
thitung data 1 = -0,0078 x
0046
,
0
2361
,
2
= -3,7916 (ditolak)
thitung data 2 = -0,0009 x
0046
,
0
2361
,
2
= -0,4375thitung data 3 = 0,0024 x
thitung data 4 = 0,0027 x
0046
,
0
2361
,
2
= 1,3124thitung data 5 = 0,0035 x
0046
,
0
2361
,
2
= 1,7014Lampiran 8. (lanjutan) No
Kadar (mcg/g) (X- ) (X- ) 2
1 1,8310 -0,0028 0,0000081
2 1,8343 0,0004 0,0000002
3 1,8347 0,0008 0,0000006
4 1,8355 0,0016 0,0000025
= 1,8339 ∑ = 0,000011
SD = 1 ) ( 2 − −
∑
n X X 3 000011 , 0= = 0,0019
Pada interval kepercayaan 95%