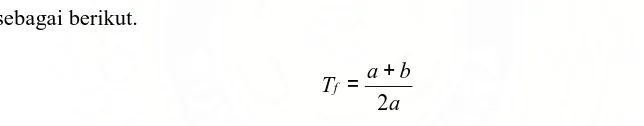PENGARUH SUHU TERHADAP KADAR
AKRILAMIDA DALAM KENTANG GORENG
SIMULASI SECARA KROMATOGRAFI CAIR
KINERJA TINGGI FASE BALIK
SKRIPSI
OLEH:
LIMIYANTO TANSERI
NIM 060804024
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA
MEDAN
PENGARUH SUHU TERHADAP KADAR
AKRILAMIDA DALAM KENTANG GORENG
SIMULASI SECARA KROMATOGRAFI CAIR
KINERJA TINGGI FASE BALIK
SKRIPSI
Diajukan untuk melengkapi salah satu syarat untuk memperoleh gelar Sarjana Farmasi pada Fakultas Farmasi
Universitas Sumatera Utara
OLEH:
LIMIYANTO TANSERI
NIM 060804024
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA
MEDAN
PENGESAHAN SKRIPSI
L
PENGARUH SUHU TERHADAP KADAR
AKRILAMIDA DALAM KENTANG GORENG
SIMULASI SECARA KROMATOGRAFI CAIR
KINERJA TINGGI FASE BALIK
OLEH:
LIMIYANTO TANSERI
NIM 060804024
Dipertahankan di hadapan Panitia Penguji Fakultas Farmasi
Universitas Sumatera Utara Pada tanggal: 14 Januari 2010
Pembimbing I, Panitia Penguji,
Drs. Fathur Rahman Harun, M.Si., Apt. Prof. Dr. Jansen Silalahi, M.App.Sc., Apt.
NIP 19520104198003 1 002 NIP 19531128198303 1 002 Pembimbing II,
Drs. Fathur Rahman Harun, M.Si., Apt.
Drs. Muchlisyam, M.Si., Apt. NIP 19520104198003 1 002
NIP 19500622198002 1 001
Drs. Nahitma Ginting, M.Si., Apt.
NIP 19540628198303 1 002
Dra. Salbiah, M.Si., Apt.
NIP 19481003198701 2 001
Medan, 14 Januari 2010 Fakultas Farmasi Universitas Sumatera Utara
Dekan,
Prof. Dr. Sumadio Hadisahputra, Apt.
KATA PENGANTAR
Puji syukur ke hadirat Tuhan Yang Maha Kuasa yang telah melimpahkan rahmat dan karunia-Nya, sehingga penulis dapat menyelesaikan skripsi dengan judul “Pengaruh Suhu terhadap Kadar Akrilamida dalam Kentang Goreng Simulasi secara Kromatografi Cair Kinerja Tinggi Fase Balik”. Skripsi ini diajukan sebagai salah satu syarat guna memperoleh gelar Sarjana Farmasi dari Fakultas Farmasi Universitas Sumatera Utara.
Penemuan senyawa karsinogen dalam berbagai gorengan yakni akrilamida telah menimbulkan kekhawatiran akan dampak kesehatan yang kemungkinan timbul. Kentang goreng merupakan salah satu makanan yang digemari oleh masyarakat luas ternyata mengandung akrilamida tinggi, sehingga diperlukan upaya untuk mengurangi kadarnya selama penggorengan berlangsung. Salah satu faktor yang diduga berpengaruh terhadap pembentukan akrilamida adalah suhu penggorengan. Oleh karena itu, tujuan penelitian ini adalah untuk mengamati pengaruh suhu terhadap pembentukan akrilamida dalam kentang goreng. Hasil penelitian diharapkan dapat menjadi masukan bagi masyarakat untuk menggoreng kentang pada suhu yang tepat sehingga dapat meminimalkan akrilamida yang terbentuk.
Penulis menyampaikan rasa hormat dan terima kasih yang sebesar-besarnya kepada bapak Drs. Fathur Rahman Harun, M.Si., Apt. dan bapak Drs. Muchlisyam, M.Si., Apt. yang telah banyak memberikan bimbingan dan bantuan yang tak ternilai harganya selama penelitian dan penulisan skripsi ini berlangsung. Ucapan terima kasih juga penulis haturkan kepada bapak Prof. Dr. Sumadio Hadisahputra, Apt. selaku Dekan Fakultas Farmasi Universitas Sumatera Utara yang telah memberikan bantuan fasilitas dan banyak masukan selama masa pendidikan dan penelitian.
Dalam kesempatan ini, penulis juga hendak menyampaikan penghargaan tertinggi kepada kedua orang tua dan kakak penulis, juga terima kasih setulusnya kepada pak Basri, Alfan, Lisa, teman-teman stambuk Farmasi 2006 serta para asisten Laboratorium Kimia Kuantitatif dan Sintesa Bahan Obat yang tak dapat disebutkan satu per satu, atas segala dorongan motivasi dan bantuannya kepada penulis sehingga skripsi ini dapat selesai tepat waktu.
Medan, Januari 2010
Penulis,
PENGARUH SUHU TERHADAP KADAR AKRILAMIDA DALAM KENTANG GORENG SIMULASI SECARA KROMATOGRAFI
CAIR KINERJA TINGGI FASE BALIK
Abstrak
Akrilamida terbentuk dalam beragam jenis makanan yang mengandung karbohidrat bila dipanaskan pada suhu yang tinggi dan waktu yang lama. Kentang goreng merupakan salah satu makanan yang banyak digemari masyarakat ternyata mengandung kadar akrilamida tinggi. Akrilamida merupakan suatu senyawa karsinogenik, genotoksik dan neurotoksik, sehingga dapat membahayakan kesehatan. Upaya yang dapat dilakukan untuk meminimalkan dampak kesehatan yang timbul adalah dengan mempelajari faktor-faktor yang mempengaruhi pembentukan akrilamida. Salah satu faktor yang diperkirakan berperan besar dalam proses pembentukan akrilamida adalah suhu sewaktu penggorengan berlangsung (suhu penggorengan).
Untuk mengkaji hal ini, sampel kentang digoreng pada berbagai suhu dengan metode penggorengan rendam (immersion frying atau deep-fat frying) kemudian akrilamida yang terbentuk dalam kentang goreng dianalisis dengan Kromatografi Cair Kinerja Tinggi (KCKT) fase balik menggunakan kolom Shim-Pack VP-ODS (4,6 x 250 mm), perbandingan fase gerak metanol dan larutan asam fosfat 3,5 mM (10:90), laju alir 1,5 ml/menit, detektor UV pada panjang gelombang 210 nm dan sensitifitas 1,000 AUFS.
Validasi metode menunjukkan bahwa prosedur yang dikerjakan dalam penelitian ini memiliki akurasi dan presisi yang baik yakni dengan persen perolehan kembali 92,0799% dan simpangan baku relatif 0,8013%. Sedangkan batas deteksi dan batas kuantitasi berturut-turut adalah 0,1313 g/ml dan 0,3979
g/ml.
Dari hasil penelitian, diperoleh kadar akrilamida dalam kentang yang digoreng pada suhu 110°C, 130°C, 150°C, 170°C dan 190°C berturut-turut adalah 0,1175±0,0374 g/g, 0,3574±0,0074 g/g, 0,3813±0,0116 g/g, 1,0299±0,1617
g/g dan 1,9773±0,0533 g/g sampel. Dari hasil ini, terlihat bahwa semakin tinggi
dapat disimpulkan bahwa suhu ternyata mempengaruhi kadar akrilamida dalam kentang goreng.
Kata kunci: akrilamida, kentang goreng, penggorengan rendam, KCKT fase
THE INFLUENCE OF TEMPERATURE TO ACRYLAMIDE LEVELS IN SIMULATED FRIED POTATOES BY REVERSED PHASE
HIGH PERFORMANCE LIQUID CHROMATOGRAPHY
Abstract
Acrylamide is formed in various carbohydrate-rich foods which are cooked at hight temperature and long durations. Fried potatoes which is generally one of the most favourite foods, actually contain high level of acrylamide. Acrylamide is considered as carcinogenic, genotoxic and neurotoxic compounds, so that it may endanger human health. Studying influence factors of acrylamide formation is the effort that can be carried out to minimize its potentially health effects. One of the primary factor predicted to acrylamide formation process is frying temperature.
In order to study this factor, potatoes was deep-fried at various temperature (immersion frying or deep-fat frying), then acrylamide level in fried potatoes was analized by reversed phase High Performance Liquid Chromatography (HPLC) using Shim-Pack VP-ODS column (4,6 x 250 mm), methanol–3,5 mM phosphoric acid solution mixture (10:90) applied as mobile phase at the flow rate of 1,5 ml/minute, as well as UV detector at 210 nm and 1,000 AUFS sensitivity.
Method validation has performed that research procedure have good accuracy and precision with percent recovery 92,0799% and relative standard deviation 0,8013%. Limit of detection and limit of quantitation are 0,1313 g/ml and 0,3979 g/ml, respectively.
Based on this research, the levels of acrylamide in potatoes fried at 110°C, 130°C, 150°C, 170°C and 190°C are 0,1175±0,0374 g/g, 0,3574±0,0074 g/g,
0,3813±0,0116 g/g, 1,0299±0,1617 g/g and 1,9773±0,0533 g/g sample,
respectively. This data have shown that higher frying temperature will result to higher acrylamide formation, so that it can be summarized that temperature appears to influence acrylamide levels in fried potatoes.
Keyword: acrylamide, fried potatoes, deep-fat frying, reversed phase HPLC,
DAFTAR ISI
Halaman
JUDUL ... i
HALAMAN JUDUL ... ii
LEMBAR PENGESAHAN ... iii
KATA PENGANTAR ... iv
ABSTRAK ... v
ABSTRACT ... vii
DAFTAR ISI ... viii
DAFTAR TABEL ... xi
DAFTAR GAMBAR ... xii
DAFTAR LAMPIRAN ... xiv
BAB I PENDAHULUAN ... 1
1.1 Latar Belakang ... 1
1.2 Perumusan Masalah ... 3
1.3 Hipotesis ... 4
1.4 Tujuan Penelitian ... 4
1.5 Manfaat Penelitian ... 4
BAB II TINJAUAN PUSTAKA ... 5
2.1 Akrilamida ... 5
2.1.1 Sifat Fisikokimia ... 5
2.1.2 Kegunaan Umum ... 5
2.1.3 Farmakokinetika ... 6
2.1.4 Toksikologi ... 6
2.1.5 Metode Analisis ... 8
2.2 Proses Penggorengan ... 9
2.2.1 Perubahan Fisikokimia pada Bahan Makanan yang Digoreng Rendam ... 9
2.2.2 Mekanisme Terbentuknya Akrilamida dalam Makanan yang Digoreng ... 10
2.3.1 Jenis Kromatografi Cair ... 14
2.3.2 Proses Pemisahan dalam Kolom Kromatografi Cair ... 14
2.3.3 Konsep Umum Kromatografi Cair ... 16
2.3.3.1 Waktu Tambat ... 16
2.3.3.2 Faktor Kapasitas (k’) atau Faktor Tambat (k) ... 17
2.3.3.3 Selektifitas atau Faktor Pemisahan (α) ... 18
2.3.3.4 Efisiensi Kolom ... 18
2.3.3.5 Resolusi ... 19
2.3.3.6 Faktor Tailing dan Faktor Asimetri ... 19
2.3.4 Instrumen KCKT ... 21
2.3.4.1 Wadah Fase Gerak (Reservoir) ... 22
2.3.4.2 Pompa (Pump) ... 22
2.3.4.3 Tempat Injeksi Sampel (Injector) ... 23
2.3.4.4 Kolom (Column) ... 24
3.4.1.3 Pembuatan Fase Gerak ... 33
3.4.1.4 Pembuatan Pelarut ... 33
3.4.1.5 Pembuatan Larutan Induk Baku Pembanding Akrilamida ... 33
3.4.1.5.1 Pembuatan Larutan Induk Baku Pertama (1000 ppm) ... 33
3.4.1.5.2 Pembuatan Larutan Induk Baku Kedua (100 ppm) ... 33
3.4.1.5.3 Pembuatan Larutan Induk Baku Ketiga (10 ppm) ... 34
3.4.1.6 Pembuatan Larutan Sampel... 34
3.4.2 Prosedur Analisis ... 34
3.4.2.1 Penyiapan Alat KCKT ... 34
3.4.2.2 Penentuan Kondisi Kromatografi untuk Mendapatkan Hasil Analisis yang Optimum ... 35
3.4.2.3 Analisis Kualitatif ... 35
3.4.2.4 Analisis Kuantitatif ... 36
3.4.2.4.1 Penentuan Lineritas Kurva Kalibrasi Baku Pembanding Akrilamida ... 36
3.4.2.4.2 Penetapan Kadar Akrilamida dalam Sampel ... 36
3.4.2.5 Analisis Data Penetapan Kadar Secara Statistik . 37 3.4.3 Validasi Metode ... 38
3.4.3.1 Akurasi (Kecermatan) ... 38
3.4.3.2 Presisi (Keseksamaan) ... 39
3.4.3.3 Batas Deteksi dan Batas Kuantitasi ... 40
DAFTAR TABEL
Halaman
Tabel 1. Delapan Karakteristik Utama yang Digunakan dalam Validasi
Metode Analitik ... 25
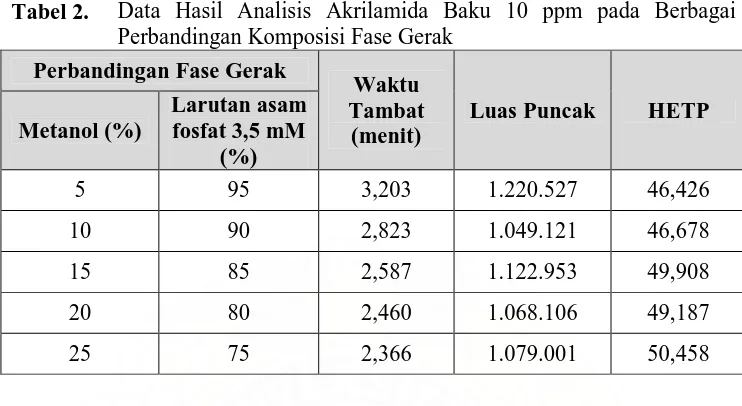
Tabel 2. Data Hasil Analisis Akrilamida Baku 10 ppm pada
Berbagai Perbandingan Komposisi Fase Gerak ... 45
Tabel 3. Data Hasil Analisis Akrilamida Baku 4 ppm dengan Laju Alir
yang Divariasikan ... 47
Tabel 4. Tailing Factor dan Asymmetry Factor dari Puncak Akrilamida
pada Pembuatan Kurva Kalibrasi ... 55
Tabel 5. Hasil Pengolahan Data Penyuntikan Larutan Sampel Kentang
Goreng Menggunakan KCKT ... 58
Tabel 6. Hasil Penetapan Kadar Akrilamida dalam Sampel Kentang
Goreng secara Statistik ... 59
DAFTAR GAMBAR
Halaman
Gambar 1. Rumus bangun senyawa akrilamida ... 5
Gambar 2. Skema pembentukan akrilamida lewat reaksi Maillard... 12
Gambar 3. Ilustrasi proses pemisahan yang terjadi di dalam kolom KCKT 15
Gambar 4. Sebuah kromatogram yang diperoleh dari analisis KCKT ... 17
Gambar 5. Tiga jenis bentuk puncak ... 20
Gambar 6. Pengukuran derajat asimetris puncak ... 21
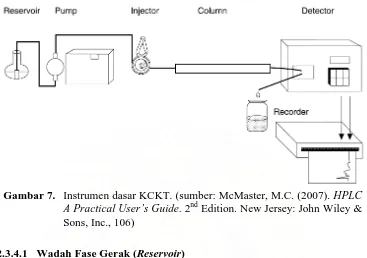
Gambar 7. Instrumen dasar KCKT ... 22
Gambar 8. Kurva serapan akrilamida baku 5 ppm secara spektrofotometri UV ... 41
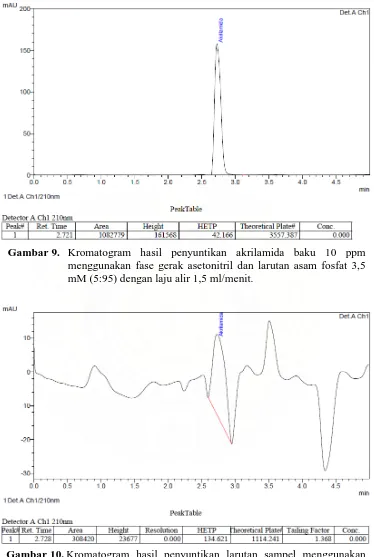
Gambar 9. Kromatogram hasil penyuntikan akrilamida baku 10 ppm menggunakan fase gerak asetonitril dan larutan asam fosfat 3,5 mM (5:95) dengan laju alir 1,5 ml/menit ... 43
Gambar 10. Kromatogram hasil penyuntikan larutan sampel menggunakan fase gerak metanol dan larutan asam fosfat 3,5 mM (5:95) dengan laju alir 1,5 ml/menit ... 43
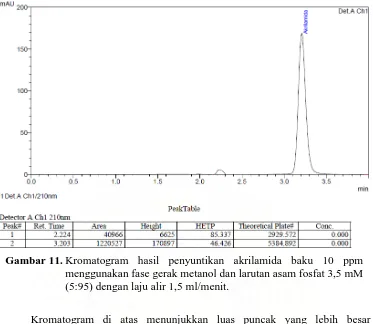
Gambar 11. Kromatogram hasil penyuntikan akrilamida baku 10 ppm menggunakan fase gerak metanol dan larutan asam fosfat 3,5 mM (5:95) dengan laju alir 1,5 ml/menit ... 45
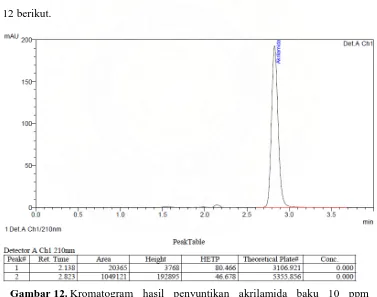
Gambar 12. Kromatogram hasil penyuntikan akrilamida baku 10 ppm menggunakan fase gerak metanol dan larutan asam fosfat 3,5 mM (10:90) dengan laju alir 1,5 ml/menit ... 47
Gambar 13. Larutan destilat yang dibekukan di dalam lemari pendingin ... 50
Gambar 14. Kromatogram hasil penyuntikan akrilamida baku 4 ppm untuk uji kualitatif ... 51
Gambar 15. Kromatogram hasil penyuntikan larutan sampel kentang goreng dengan kondisi KCKT yang sama untuk uji kualitatif ... 52
Gambar 16. Kromatogram setelah larutan sampel di-spike dengan
yang sama untuk uji kualitatif ... 53
Gambar 17. Kurva kalibrasi akrilamida baku ... 54
Gambar 18. Kromatogram hasil penyuntikan larutan akrilamida baku
4 ppm pada pembuatan kurva kalibrasi ... 55
Gambar 19. Kromatogram hasil penyuntikan larutan sampel kentang
goreng yang diintegrasi secara valley method ... 57
Gambar 20. Kromatogram hasil penyuntikan larutan sampel kentang
goreng yang diintegrasi secara perpendicular drop method ... 58
Gambar 21. Kurva hubungan antara kadar akrilamida dengan suhu
DAFTAR LAMPIRAN
Halaman
Lampiran 1. Gambar Instrumen KCKT dan Syringe 100 l... 72
Lampiran 2. Gambar Perangkat Pendukung Penelitian Lainnya ... 73
Lampiran 3. Kromatogram Penyuntikan Akrilamida Baku untuk Mencari Perbandingan Fase Gerak Larutan Asam Fosfat
3,5 mM dan Metanol yang Optimum untuk Analisis ... 76
Lampiran 4. Kromatogram Penyuntikan Akrilamida Baku dalam
Upaya Mencari Laju Alir yang Optimum untuk Analisis ... 81
Lampiran 5. Kromatogram Hasil Penyuntikan Larutan Akrilamida
Baku pada Pembuatan Kurva Kalibrasi ... 85
Lampiran 6. Perhitungan Persamaan Regresi dari Kurva Kalibrasi Akrilamida Baku yang Diperoleh dengan KCKT pada
Panjang Gelombang 210 nm ... 89
Lampiran 7. Kromatogram Hasil Penyuntikan Larutan Sampel Kentang yang Digoreng pada Suhu 110±5°C selama 3 menit ... 91
Lampiran 8. Analisis Data secara Statistik dari Hasil Penyuntikan Larutan Sampel Kentang yang Digoreng pada Suhu
110±5°C selama 3 menit ... 93
Lampiran 9. Kromatogram Hasil Penyuntikan Larutan Sampel Kentang yang Digoreng pada Suhu 130±5°C selama 3 menit ... 94
Lampiran 10. Analisis Data secara Statistik dari Hasil Penyuntikan
Larutan Sampel Kentang yang Digoreng pada Suhu
130±5°C selama 3 menit ... 96
Lampiran 11. Kromatogram Hasil Penyuntikan Larutan Sampel Kentang
yang Digoreng pada Suhu 150±5°C selama 3 menit ... 97
Lampiran 12. Analisis Data secara Statistik dari Hasil Penyuntikan
Larutan Sampel Kentang yang Digoreng pada Suhu
150±5°C selama 3 menit ... 99
Lampiran 13. Kromatogram Hasil Penyuntikan Larutan Sampel Kentang
Lampiran 14. Analisis Data secara Statistik dari Hasil Penyuntikan
Larutan Sampel Kentang yang Digoreng pada Suhu
170±5°C selama 3 menit ... 102
Lampiran 15. Kromatogram Hasil Penyuntikan Larutan Sampel Kentang
yang Digoreng pada Suhu 190±5oC selama 3 menit ... 103
Lampiran 16. Analisis Data secara Statistik dari Hasil Penyuntikan
Larutan Sampel Kentang yang Digoreng pada Suhu
190±5°C selama 3 menit ... 105
Lampiran 17. Kromatogram Hasil Perolehan Kembali Akrilamida Baku
yang Ditambahkan pada Sampel Kentang yang Digoreng pada Suhu 190±5°C selama 3 menit (Metode Penambahan
Baku) ... 106
Lampiran 18. Data Perolehan Kembali Akrilamida Baku yang
Ditambahkan pada Sampel Kentang yang Digoreng pada
Suhu 190±5°C selama 3 menit (Metode Penambahan Baku) 108
Lampiran 19. Contoh Perhitungan Persen Perolehan Kembali... 109
Lampiran 20. Analisis Data secara Statistik dari Hasil Perolehan Kembali
Akrilamida Baku yang Ditambahkan pada Sampel Kentang yang Digoreng pada Suhu 190°C selama 3 menit
(Metode Penambahan Baku) ... 110
Lampiran 21. Perhitungan Penetapan Batas Deteksi dan Batas Kuantitasi .. 111
Lampiran 22. Contoh Perhitungan untuk Mencari Kadar Akrilamida
dalam Sampel ... 112
Lampiran 23. Sertifikat Analisis Akrilamida Baku ... 113
BAB I
PENDAHULUAN
1.1 Latar Belakang
Pada tahun 2002, Swedish National Food Administration (Sw NFA) dan peneliti lainnya dari Universitas Stockholm mengemukakan suatu penemuan bahwa akrilamida terbentuk dalam beragam jenis makanan yang diolah pada suhu tinggi (FAO dan WHO, 2002).
Akrilamida merupakan suatu senyawa yang reaktif secara kimia dan umumnya digunakan sebagai bahan baku monomer dalam sintesis poliakrilamida, sejenis polimer yang digunakan dalam pemurnian air dan produksi kertas (Gökmen dan Şenyuva, 2008). Akrilamida diketahui memiliki efek neurotoksik, genotoksik dan karsinogenik (Kotsonis dan Burdock, 2008; LoPachin, et.al., 2007; Park, et.al., 2002).
Menurut Friedman (2003), akrilamida banyak ditemukan dalam makanan sehari-hari seperti roti, biskuit, bubuk kopi, mentega, dan lain-lain. Dalam suatu studi terhadap beragam jenis makanan, kandungan akrilamida terbesar ditemukan dalam makanan kaya karbohidrat yang dimasak pada suhu tinggi dan jangka waktu yang lama. Studi ini menemukan bahwa akrilamida tidak terbentuk pada makanan yang dimasak pada suhu di bawah 120°C (CERHR, 2004). Dalam studi lain dilaporkan bahwa akrilamida akan meningkat secara drastis ketika suhu penggorengan mencapai lebih dari 180°C (Haase, 2006; Matthäus, 2009).
mengandung konsentrasi akrilamida tertinggi (Gökmen dan Şenyuva, 2008) dan bahkan diperkirakan sebagai penyumbang 20% asupan harian akrilamida oleh masyarakat (Dybing dan Sanner, 2003). Dari pernyataan di atas, dapat disimpulkan bahwa kentang goreng berpotensi bahaya bila dikonsumsi berlebihan. Hal ini mengkhawatirkan karena penggemar kentang goreng cukup banyak di masyarakat, terutama kalangan remaja dan anak-anak.
Analisis akrilamida dalam makanan dipublikasikan dalam banyak jurnal penelitian dengan menggunakan berbagai metode seperti kromatografi gas– spektrometri massa (gas chromatography–mass spectrometry atau GC-MS), kromatografi cair–spektrometri massa tandem (liquid chromatography–tandem
mass spectrometry atau LC-MS/MS) dan kromatografi cair kinerja tinggi (Liu,
et.al., 2008). Di antara metode tersebut, Kromatografi Cair Kinerja Tinggi
(KCKT) merupakan metode yang lebih mudah dikerjakan dan membutuhkan waktu yang relatif singkat.
metanol dalam fase gerak perlu diubah untuk mendapatkan kekuatan elusi yang setara seperti saat asetonitril digunakan. Oleh karena itu, diperlukan optimasi komposisi fase gerak dalam analisis akrilamida secara KCKT fase balik.
Uraian di atas menjadi alasan penelitian ini untuk mengetahui pengaruh suhu terhadap kadar akrilamida dalam kentang goreng secara KCKT fase balik menggunakan metanol dan larutan asam fosfat 3,5 mM sebagai fase gerak dengan komposisi dan laju alir yang dioptimasi terlebih dahulu. Di dalam penelitian ini, sampel yang digunakan adalah kentang goreng yang disiapkan sendiri (kentang goreng simulasi) dengan metode penggorengan rendam (immersion frying atau
deep-fat frying) pada suhu penggorengan yang divariasikan dan lama
penggorengan yang seragam. Suhu dan waktu penggorengan yang umum dilakukan berdasarkan pengamatan adalah pada suhu sekitar 150°C selama ± 3
menit. Maka dari itu, kentang digoreng selama 3 menit di sekitar suhu penggorengan yang umum yaitu 110°C, 130°C, 150°C, 170°C dan 190°C dengan koreksi suhu ± 5°C.
1.2 Perumusan Masalah
− Apakah metanol–larutan asam fosfat 3,5 mM dapat digunakan sebagai
fase gerak untuk analisis akrilamida dalam kentang goreng secara KCKT fase balik?
− Apakah metode KCKT fase balik yang telah dioptimasi memenuhi
persyaratan uji validasi?
− Apakah suhu penggorengan mempengaruhi kadar akrilamida yang
1.3 Hipotesis
− Metanol–larutan asam fosfat 3,5 mM dapat digunakan sebagai fase
gerak untuk analisis akrilamida dalam kentang goreng secara KCKT fase balik.
− Metode KCKT fase balik yang telah dioptimasi memenuhi persyaratan
uji validasi.
− Suhu penggorengan yang semakin tinggi akan meningkatkan kadar
akrilamida yang terbentuk dalam kentang goreng.
1.4 Tujuan Penelitian
− Untuk menggunakan metanol–larutan asam fosfat 3,5 mM sebagai fase
gerak guna analisis akrilamida dalam kentang goreng secara KCKT fase balik.
− Untuk mendapatkan suatu metode analisis akrilamida yang memenuhi
persyaratan uji validasi.
− Untuk mengetahui pengaruh suhu penggorengan terhadap kadar
akrilamida dalam kentang goreng.
1.5 Manfaat Penelitian
BAB II
TINJAUAN PUSTAKA
2.1 Akrilamida
2.1.1 Sifat Fisikokimia
Akrilamida (sinonim: 2-propenamida, etilen karboksi amida, akrilik amida, asam propeonik amida, vinil amida) merupakan suatu senyawa kristalin bening hingga putih dengan bobot molekul 71,08; tidak berbau; larut dalam air, metanol, etanol, dimetil eter dan aseton, serta tidak larut dalam benzene dan heptan. Akrilamida akan meleleh pada suhu 84-85°C dan mendidih pada suhu 125°C (Report on Carcinogens Review Committee, 2005; Gökmen dan Şenyuva, 2008; Harahap, 2006). Akrilamida memiliki rumus molekul C3H5NO dan rumus bangun
seperti yang ditunjukkan pada Gambar 1.
2.1.2 Kegunaan Umum
Sejak pertengahan tahun 1950-an, akrilamida dikenal sebagai senyawa antara dalam pembuatan poliakrilamida, suatu polimer akrilamida, yang digunakan sebagai flokulan dan koagulan dalam proses pengolahan air minum dan limbah, pengatur viskositas pada pemrosesan minyak mentah, bahan pengikat pada pabrik kertas, produksi perekat, tape serta gel pada kosmetik (Matthäus, 2009). Kegunaan lainnya yang cukup penting yakni sebagai pupuk dan grouting
agent untuk memperbaiki saluran air (Karol, 2003; Stadler dan Goldmann, 2008).
2.1.3 Farmakokinetika
Akrilamida dapat diabsorpsi dari semua rute pajanan. Absorpsinya diperkirakan cepat dan sempurna lewat rute oral (FAO dan WHO, 2002). Akrilamida juga berpotensi diabsorpsi lewat membran mukosa saluran nafas (rute inhalasi) dan lewat kontak dengan kulit utuh (rute dermal) (CERHR, 2004; Merck KGaA, 2004). Kelarutan akrilamida yang tinggi dalam air menjadi salah satu alasan bagi distribusinya yang cepat ke seluruh tubuh setelah pajanan terjadi (Matthäus, 2009). Di dalam tubuh, akrilamida akan dimetabolisme oleh enzim sitokrom P450 2E1 menjadi glisidamida. Kedua zat ini akan dikonjugasi menjadi glutation, lalu sebagian besar akan dieliminasi dari tubuh sebagai konjugat asam merkapturat (Alexander, 2006; Kotsonis dan Burdock, 2008). Waktu paruh eliminasi akrilamida dan glisidamida pada tikus diketahui sekitar 2 jam, sedangkan waktu paruh eliminasinya pada manusia belum diketahui secara jelas (FAO dan WHO, 2002).
2.1.4 Toksikologi
Akrilamida merupakan senyawa toksik sedangkan poliakrilamida tidak lagi toksik seperti monomernya (Kotsonis dan Burdock, 2008). Pada tahun 1991, akrilamida dimasukkan ke dalam daftar senyawa karsinogenik oleh departemen kesehatan Amerika Serikat (Report on Carcinogens Review Committee, 2005).
International Agency for Research on Cancer (IARC), U.S. Environmental
Protection Agency (EPA), Food and Drug Administration (FDA), serta The
National Toxicology Program-Center for The Evaluation of Risks to Human
Reproduction (NTP-CERHR) telah mengklasifikasikan akrilamida sebagai
pada manusia (“probably carcinogenic to humans” atau grup 2A) (CERHR, 2004; Harahap, 2006; Stadler dan Goldmann, 2008). Senyawa ini juga diketahui memiliki efek neurotoksik dan genotoksik (LoPachin, et.al., 2007; Park, et.al., 2002). Dari serangkaian penelitian terhadap hewan percobaan, akrilamida juga terbukti toksis terhadap pertumbuhan dan reproduksi, serta bersifat fetotoksis (Alexander, 2006; Field, et.al., 1990).
Akrilamida akan mengakibatkan perubahan morfologis saraf perifer pada pajanan dosis 1 mg/kg BB/hari dan kerusakan otak pada dosis 21 mg/kg BB/hari selama 40 hari (Kotsonis dan Burdock, 2008). Hal ini dikarenakan akrilamida, suatu elektrofil lemah, dapat membentuk ikatan dengan gugus sulfhidril (SH-), yang nukleofil lemah, pada protein sehingga menghasilkan efek neurotoksik (Gökmen dan Şenyuva, 2008; LoPachin, et.al., 2007).
Akrilamida menunjukkan aktifitas sebagai pemicu tumor pada tikus dan mencit. Dalam berbagai penelitian, pajanan kronis akrilamida dinyatakan dapat mengakibatkan mesotelioma testikular, tumor tiroid, tumor kelenjar susu, tumor saraf pusat, kanker kulit dan paru. Hal ini disebabkan sifat reaktif akrilamida yang dapat mengganggu jalur hantaran sinyal intrasel sehingga menginduksi perubahan fungsi sel. Akrilamida juga diketahui akan dimetabolisme di dalam tubuh oleh enzim sitokrom P450 2E1 menjadi glisidamida, suatu senyawa epoksi yang reaktif pada DNA, sehingga mengakibatkan pertukaran antar kromatid anak (Sister
Chromatid Exchange/SCE) dan penyimpangan kromosom. Mekanisme ini diduga
bertanggungjawab atas efek genotoksik akrilamida (Ghanayem, et.al., 2005; Park,
2.1.5 Metode Analisis
Akrilamida memiliki kelarutan yang tinggi dalam air yakni 215 g/L air pada suhu 25°C (Stadler dan Goldmann, 2008). Oleh karena itu, dapat dikatakan bahwa akrilamida merupakan suatu senyawa dengan kepolaran yang tinggi. Ditinjau dari struktur molekulnya, akrilamida memiliki ikatan rangkap terkonjugasi (CH2=CH–CO–NH2), suatu gugus kromofor yang dapat menyerap
sinar UV (Castle, 2006). Hal ini mendasari penggunaan KCKT fase balik (reversed phase high performance liquid chromatography) dengan detektor UV untuk analisis akrilamida dalam sampel.
Metode lain yang juga dipakai adalah kromatografi gas–spektrometri massa (gas chromatography–mass spectrometry atau GC-MS) dan kromatografi cair–spektrometri massa tandem (liquid chromatography–tandem mass spectrometry atau LC-MS/MS). Kebanyakan metode GC menggunakan prinsip
derivatisasi molekul akrilamida dengan brominasi. Pendekatan ini bermanfaat untuk meningkatkan volatilitas, mendapatkan berat molekul yang lebih besar dan ion yang lebih selektif untuk analisis spektrometri massa (Stadler dan Goldmann, 2008). Detektor ionisasi nyala (flame-ionisation detector) atau detektor penangkap ion (ion capture detector) dapat digunakan sebagai detektor dalam analisis menggunakan GC (Castle, 2006).
atmosfer (atmospheric pressure chemical ionization/APCI) (Stadler dan Goldmann, 2008).
2.2 Proses Penggorengan
Penggorengan merupakan salah satu metode paling tua yang dikenal umat manusia untuk menyiapkan makanan. Gorengan merupakan makanan kesukaan di antara orang-orang seluruh dunia (Dunford, 2003). Menggoreng merupakan suatu proses memasak menggunakan lemak atau minyak sebagai medium penghantar panas. Proses menggoreng ada 3 jenis yakni penggorengan rendam (deep frying), penggorengan dangkal/pengtumisan (shallow frying) dan pemanggangan (roasting) (Quaglia dan Bucarelli, 2001).
2.2.1 Perubahan Fisikokimia pada Bahan Makanan yang Digoreng Rendam
Penggorengan rendam merupakan suatu proses di mana makanan dimasak dengan cara direndam dalam minyak panas (Moreira, et.al., 1999). Penggorengan rendam dilakukan pada suhu di atas titik didih air, biasanya pada suhu 150-200°C selama periode waktu spesifik tertentu (Mittal, 2009). Sifat fisika dan kimia makanan akan berubah setelah mengalami penggorengan rendam.
fisika dari gorengan adalah kandungan minyak dan air dari bahan makanan, serta kondisi proses penggorengan itu sendiri (Mittal, 2009).
Perubahan kimia selama proses penggorengan akan menghasilkan rasa dan aroma makanan yang khas, hal ini dipengaruhi oleh proses hidrolisis, polimerisasi dan oksidasi termal (Warner, 2009). Pemanasan makanan pada suhu tinggi (termasuk penggorengan) akan memicu suatu reaksi kimia yang disebut dengan reaksi maillard. Reaksi maillard telah dikenal selama hampir 100 tahun yang lalu sebagai rute utama penyebab terbentuknya senyawa-senyawa yang berperan atas perubahan warna (browning) dan pembentukan aroma serta rasa yang khas pada makanan yang diproses pada suhu tinggi (Kawamura, 1983). Reaksi maillard juga disebut sebagai browning reaction (Yasuhara, et.al., 2003). Beberapa hasil reaksi maillard antara lain senyawa-senyawa volatil (piridin, pirazin, pirol, imidazol, tiazol), senyawa berwarna seperti melanoidin, akrolein, propionaldehida, propananitril, propioamida dan metilglioksal (Nursten, 2005; Yasuhara, et.al., 2003). Adapun senyawa kimia lain yang meningkat kadarnya ketika terjadi proses penggorengan adalah peroksida, asam lemak bebas, sejumlah materi polar dan senyawa polimer (Warner, 2009).
Sebagai tambahan, perubahan biokimia dalam makanan juga terjadi selama proses penggorengan. Gelatinisasi zat tepung, denaturasi protein, inaktivasi enzim dan dekstruksi mikroorganisme dapat diamati dalam produk makanan yang digoreng (Sahin dan Sumnu, 2009).
2.2.2 Mekanisme Terbentuknya Akrilamida dalam Makanan yang Digoreng
ini ada yang tidak bermanfaat atau bahkan bersifat toksik bila dikonsumsi. Salah satu hasil reaksi maillard yang toksik adalah akrilamida.
Reaksi maillard, dalam berbagai penelitian, disimpulkan sebagai jalur utama bagi pembentukan akrilamida (Becalski, et.al., 2003; Ciesarová, et.al., 2006; Rydberg, et.al., 2003; Zyzak, et.al., 2003). Reaksi maillard merupakan suatu reaksi kompleks yang terjadi antara senyawa karbonil (umumnya gula pereduksi) dengan suatu amina (biasanya berupa suatu asam amino, peptida atau pun protein) (Nursten, 2005). Reaksi ini pertama sekali dikemukakan oleh Louis-Camille Maillard pada tahun 1912 (Kawamura, 1983).
2.3 Kromatografi Cair Kinerja Tinggi (KCKT)
Kromatografi merupakan serangkaian teknik yang digunakan untuk memisahkan beberapa komponen yang terdapat dalam sampel, didasarkan pada afinitas relatif masing-masing komponen antara fase diam dan fase gerak (Sadek, 2004). Jenis kromatografi umumnya dinamai berdasarkan jenis fase gerak yang digunakan. Sebagai contohnya, kromatografi cair menggunakan fase gerak berupa zat cair dan kromatografi gas memanfaatkan gas sebagai fase gerak (Hamilton dan Sewell, 1977).
Gambar 2. Skema pembentukan akrilamida lewat reaksi Maillard. (sumber:
Berdasarkan jenis fase diamnya, kromatografi cair dapat dibagi menjadi 3 kelompok yakni kromatografi lapis tipis, kromatografi kertas dan kromatografi kolom cair. Kromatografi kolom cair atau secara umum seringkali disebut kromatografi cair, memiliki 2 sistem kolom yakni sistem terbuka dan sistem tertutup. Sistem kolom terbuka terdiri dari sebuah kolom gelas yang dikemas dengan partikel fase diam berukuran besar (≈ 30 m atau lebih) lalu fase gerak dituang ke atasnya. Karena ukuran partikelnya cukup besar, fase gerak dapat turun melewati kolom hanya dengan gravitasi dan terkadang dibantu penyedotan dengan pompa vakum. Selanjutnya untuk meningkatkan efisiensi pemisahan, laju alir tinggi dan ukuran partikel fase diam yang kecil (≤ 10 m) mutlak diperlukan. Akan tetapi, hal ini akan menyebabkan peningkatan tekanan balik (back pressure) sehingga sebuah pompa berkinerja tinggi diperlukan untuk mengatasi tekanan balik ini dan kemudian akan memaksa fase gerak melewati kolom. Sistem ini disebut sebagai sistem kolom tertutup dan instrumen yang dikembangkan untuk sistem ini dikenal sebagai kromatografi cair kinerja tinggi (Lembke, 2001).
Sejak kemunculannya pada tahun 1975, Kromatografi Cair Kinerja Tinggi (KCKT) atau HPLC berkembang menjadi begitu populer hingga sekarang ini (Siouffi, 2000). HPLC merupakan singkatan dari High Pressure Liquid
Chromatography atau High Performance Liquid Chromatography, di mana jenis
kromatografi ini menggunakan suatu padatan, cairan, resin penukar ion (ion
exchange resin) atau polimer berpori (porous polymer) sebagai fase diamnya,
2.3.1 Jenis Kromatografi Cair
Berdasarkan mekanisme pemisahannya, kromatografi cair dapat dibagi menjadi beberapa metode, yakni: kromatografi adsorpsi (adsorption
chromatography) atau disebut juga kromatografi fase normal (normal phase
chromatography), kromatografi fase balik (reversed-phase chromatography),
kromatografi fase terikat (chemically bonded-phase chromatography),
kromatografi penukar ion (ion-exchange chromatography), kromatografi pasangan ion (ion-pair chromatography), kromatografi ion (ion chromatography), kromatografi eksklusi ukuran (size-exclusion chromatography) dan kromatografi afinitas (affinity chromatography) (Meyer, 2004).
Kromatografi fase balik merupakan contoh khusus dari kromatografi fase terikat. Kromatografi ini menggunakan fase diam dari silika yang dimodifikasi secara kimiawi. Fase diam yang paling populer digunakan adalah oktadesilsilan (ODS atau C18) yang relatif non polar sedangkan fase geraknya relatif lebih polar
daripada fase diam. Kondisi kepolaran kedua fase ini merupakan kebalikan dari kromatografi fase normal sehingga disebut kromatografi fase balik (Meyer, 2004; Rohman, 2007). Kromatografi fase balik merupakan metode pemisahan yang paling populer dalam kromatografi cair modern (Poole, 2003).
2.3.2 Proses Pemisahan dalam Kolom Kromatografi Cair
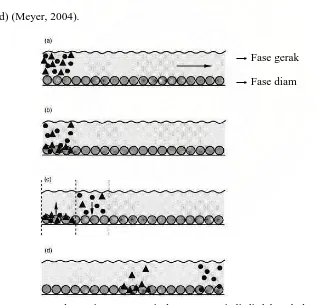
Pemisahan dalam kromatografi cair disebabkan oleh distribusi kesetimbangan dari senyawa-senyawa yang berbeda antara partikel fase diam dan larutan fase gerak (Snyder dan Kirkland, 1979). Contohnya, campuran dua komponen dimasukkan ke dalam sistem kromatografi (partikel ● dan ▲) (Gambar
lebih cenderung di dalam fase gerak (Gambar 3b). Masuknya eluen (fase gerak) yang baru ke dalam kolom akan menimbulkan kesetimbangan baru: molekul sampel dalam fase gerak diadsorpsi sebagian oleh permukaan fase diam berdasarkan pada koefisien distribusinya, sedangkan molekul yang sebelumnya diadsorpsi akan muncul kembali di fase gerak (Gambar 3c). Setelah proses ini terjadi berulang kali, kedua komponen akan terpisah. Komponen ● yang lebih
suka dengan fase gerak akan berpindah lebih cepat daripada komponen ▲ yang
cenderung menetap di fase diam, sehingga komponen ● akan muncul terlebih
dahulu dalam kromatogram, kemudian baru diikuti oleh komponen ▲ (Gambar
3d) (Meyer, 2004).
→ Fase gerak → Fase diam
Gambar 3. Ilustrasi proses pemisahan yang terjadi di dalam kolom KCKT.
(sumber: Meyer, V.R. (2004). Practical High-Performance
2.3.3 Konsep Umum Kromatografi Cair
Komponen yang telah terpisah akan dibawa oleh fase gerak menuju detektor dan sinyal yang terekam oleh detektor disebut sebagai puncak, sedangkan keseluruhan puncak yang direkam oleh detektor selama analisis dinamakan kromatogram. Puncak yang diperoleh selama analisis memiliki dua informasi penting yakni informasi kualitatif dan kuantitatif (Meyer, 2004). Terdapat beberapa parameter yang penting untuk diketahui selama analisis menggunakan KCKT, parameter tersebut akan dijelaskan secara singkat sebagai berikut.
2.3.3.1 Waktu Tambat
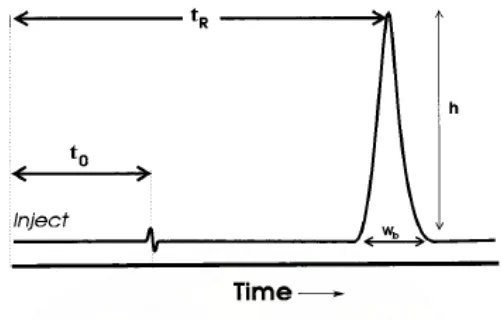
Periode waktu antara penyuntikan sampel dan puncak maksimum yang terekam oleh detektor disebut sebagai waktu tambat/retention time (tR). Waktu
tambat dari suatu komponen yang tidak ditahan/ditambat oleh fase gerak disebut sebagai waktu hampa/void time (t0). Waktu tambat merupakan fungsi dari laju alir
fase gerak dan panjang kolom. Jika fase gerak mengalir lebih lambat atau pun kolom semakin panjang, waktu hampa dan waktu tambat akan semakin besar, dan sebaliknya bila fase gerak mengalir lebih cepat atau pun kolom semakin pendek, maka waktu hampa dan waktu tambat akan semakin kecil (Meyer, 2004).
Sebuah puncak memiliki tinggi (h) dan lebar puncak (Wb). Lebar puncak
yang diukur biasanya merupakan lebar pada 5% tinggi puncak (W0,05). Tinggi dan
(Ornaf dan Dong, 2005). Gambaran sebuah kromatogram KCKT dapat dilihat pada Gambar 4.
2.3.3.2 Faktor Kapasitas (k’) atau Faktor Tambat (k)
Waktu tambat dipengaruhi oleh laju alir, ukuran kolom dan parameter yang lain. Oleh karena itu, diperlukan suatu ukuran derajat tambatan dari analit yang lebih independen yakni faktor kapasitas (k’). Faktor kapasitas dihitung dengan membagi waktu tambat bersih (t’R) dengan waktu hampa (t0) seperti yang
dapat dilihat pada rumus berikut ini.
0 0
0 '
t t t t t
k = R = R−
(Ornaf dan Dong, 2005). Faktor kapasitas ini juga disebut sebagai faktor tambat (k) dalam beberapa literatur yang lain. Idealnya, analit yang sama jika diukur pada dua instrumen berbeda dengan ukuran kolom yang berbeda namun memiliki fase diam dan fase gerak yang sama, maka faktor tambat dari analit pada kedua sistem KCKT tersebut secara teoritis adalah sama (Kazakevich dan LoBrutto, 2007).
Gambar 4. Sebuah kromatogram yang diperoleh dari analisis KCKT.
Faktor tambat yang disukai berada di antara nilai 1 hingga 10. Jika nilai k terlalu kecil menunjukkan bahwa analit terlalu cepat melewati kolom sehingga tidak terjadi interaksi dengan fase diam dan oleh karena itu, tidak akan muncul dalam kromatogram. Sebaliknya, nilai k yang terlalu besar mengindikasikan waktu analisis akan panjang (Meyer, 2004). Nilai k’ dari analit yang lebih besar dari 20 akan menjadi masalah dalam analisis KCKT (Ornaf dan Dong, 2005).
2.3.3.3 Selektifitas atau Faktor Pemisahan (αααα)
Proses pemisahan antara dua komponen dalam KCKT hanya memungkinkan bila kedua komponen memiliki kecepatan yang berbeda dalam melewati kolom (Ornaf dan Dong, 2005). Kemampuan sistem kromatografi dalam memisahkan/membedakan analit yang berbeda dikenal sebagai selektifitas. Selektifitas umumnya tergantung pada sifat analit itu sendiri serta interaksinya dengan permukaan fase diam. Jenis fase gerak seperti metanol dan asetonitril juga diketahui dapat mempengaruhi selektifitas (Kazakevich dan LoBrutto, 2007).
Selektifitas ditentukan sebagai rasio perbandingan dua faktor kapasitas dari analit yang berbeda (Ornaf dan Dong, 2005). Selektifitas ditentukan dengan
(Kazakevich dan LoBrutto, 2007). Nilai selektifitas yang didapatkan dalam sistem KCKT harus lebih besar dari 1 (Ornaf dan Dong, 2005). Selektifitas disebut juga sebagai faktor pemisahan atau tambatan relatif (Meyer, 2004).
2.3.3.4 Efisiensi Kolom
Ukuran kuantitatif dari efisiensi kolom disebut sebagai nilai lempeng/plate
mampu menghasilkan pita sempit dan memisahkan analit dengan baik. Nilai lempeng akan semakin tinggi jika ukuran kolom semakin panjang, hal ini berarti proses pemisahan yang terjadi semakin baik. Hubungan proporsionalitas antara nilai lempeng dengan panjang kolom disebut sebagai nilai HETP/High Equivalent
of a Theoretical Plate. Tujuan utama dari praktik HPLC adalah mendapatkan
nilai HETP yang kecil untuk nilai N yang maksimum dan efisiensi kolom yang tertinggi (Snyder dan Kirkland, 1979).
2.3.3.5 Resolusi
Resolusi merupakan derajat pemisahan dari dua puncak analit yang bersebelahan (Ornaf dan Dong, 2005). Resolusi dinyatakan sebagai rasio jarak antara dua puncak analit, dengan rumus sebagai berikut.
2 memiliki resolusi 1. Pada analisis kuantitatif, resolusi yang ditunjukkan harus lebih besar dari 1,5. Sementara itu, bila kedua puncak yang berdekatan memiliki perbedaan ukuran yang signifikan, maka diperlukan nilai resolusi yang lebih besar (Meyer, 2004).
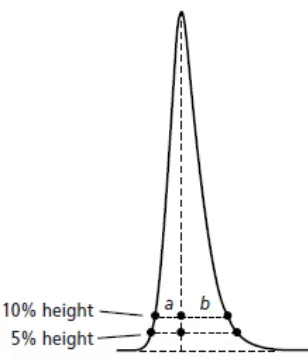
2.3.3.6 Faktor Tailing dan Faktor Asimetri
memperlihatkan tailing dalam derajat tertentu (Dolan, 2003). Pada Gambar 5 ditunjukkan tiga jenis bentuk puncak.
Ada dua cara yang digunakan untuk pengukuran derajat asimetris puncak, yakni faktor tailing dan faktor asimetris. Faktor tailing/tailing factor (Tf) seperti
yang diterangkan dalam Farmakope Amerika Serikat (USP) dihitung dengan menggunakan lebar puncak pada ketinggian 5% (W0,05), rumusnya dituliskan
sebagai berikut.
a b a Tf
2
+ =
Dengan nilai a dan b merupakan setengah lebar puncak pada ketinggian 5% seperti yang ditunjukkan di Gambar 6.
Gambar 5. Tiga jenis bentuk puncak. (sumber: Meyer, V.R. (2004).
Practical High-Performance Liquid Chromatography. 4th
Sementara itu, faktor asimetri/asymmetry factor (As) dihitung dengan
rumus sebagai berikut.
a b As=
Namun, nilai a dan b dalam perhitungan faktor asimetri merupakan setengah lebar puncak pada ketinggian 10% seperti yang ditunjukkan di Gambar 6. Jika nilai a sama dengan b, maka faktor tailing dan asimetri bernilai 1. Kondisi ini menunjukkan bentuk puncak yang simetris sempurna (Dolan, 2003). Bila puncak berbentuk tailing, maka kedua faktor ini akan bernilai lebih besar dari 1 dan sebaliknya bila puncak berbentuk fronting, maka faktor tailing dan asimetri akan bernilai lebih kecil dari 1 (Hinshaw, 2004).
2.3.4 Instrumen KCKT
Instrumen KCKT tersusun atas 6 bagian dasar, yakni wadah fase gerak (reservoir), pompa (pump), tempat injeksi sampel (injector), kolom (column),
Gambar 6. Pengukuran derajat asimetris puncak. (sumber: Dolan, J.W.
detektor (detector) dan perekam (recorder). Ilustrasi instrumen dasar KCKT dapat dilihat pada Gambar 7 (McMaster, 2007).
2.3.4.1 Wadah Fase Gerak (Reservoir)
Wadah fase gerak haruslah bersih dan inert, seperti botol pereaksi kosong, labu gelas atau pun wadah komersial lainnya. Adalah hal yang penting untuk
men-degass fase gerak sebelum digunakan karena gelembung gas kecil dalam fase
gerak dapat terkumpul di pump head atau pun detektor sehingga akan mengganggu hasil analisis. Fase gerak juga sebaiknya disaring terlebih dahulu sebelum digunakan untuk menghilangkan partikulat pengotor (Brown dan DeAntonis, 1997).
2.3.4.2 Pompa (Pump)
Pompa yang digunakan pada KCKT haruslah merupakan instrumen yang kokoh untuk menghasilkan tekanan tinggi hingga 350 bar atau bahkan 500 bar serta dapat memenuhi kebutuhan analis akan akurasi dan presisi aliran pada berbagai tingkat laju alir. Tipe pompa yang umum digunakan adalah pompa piston
Gambar 7. Instrumen dasar KCKT. (sumber: McMaster, M.C. (2007). HPLC
bersilinder pendek (short-stroke piston pump). Laju alir dapat bervariasi dari 0,1 hingga 5 atau 10 mL/menit. Pompa terdiri dari motor, piring putar (rotating disk /
cam), piston dan check valve. Piston dapat terbuat dari safir atau pun keramik,
sedangkan bola yang terdapat di check valve terbuat dari rubi dan seat-nya dari safir. Kebanyakan pompa saat ini telah memiliki saluran pembilas di mana larutan yang biasanya air dapat bersirkulasi. Larutan ini berfungsi untuk membilas piston agar bersih dari garam bufer atau materi abrasif dari pengunci piston/piston seal (Meyer, 2004). Jenis pompa yang lain adalah positive-displacement pump dan
pneumatic amplifier pump (Snyder dan Kirkland, 1979).
2.3.4.3 Tempat Injeksi Sampel (Injector)
Ada 3 jenis macam injektor, yakni syringe injector, sampling valve dan
automatic injector. Syringe injector merupakan bentuk injektor yang paling
sederhana, terdapat dalam dua jenis antara lain stop-flow injection dan
septumless-syringe injector (Snyder dan Kirkland, 1979). Sampling valve atau manual
injector mengandung 6 katup saluran dilengkapi dengan rotor, sample loop dan
saluran jarum suntik (needle port). Larutan sampel akan disuntikkan ke dalam
sampel loop dengan jarum suntik gauge 22 pada posisi “load” dan larutan sampel
yang ada di sample loop kemudian akan dialirkan ke kolom dengan memutar rotor ke posisi “inject”. Ukuran sample loop eksternal bervariasi antara 6 L hingga 2 mL (Dong, 2005). Automatic injector atau disebut juga autosampler memiliki prinsip yang mirip, hanya saja sistem penyuntikannya bekerja secara otomatis, terbagi menjadi 3 tipe prinsip penyuntikan, yakni pull-loop injection, push-loop
2.3.4.4 Kolom (Column)
Kolom merupakan jantung dari instrumen HPLC karena proses pemisahan terjadi di sini. Kolom umumnya terbuat dari 316-grade stainless steel yang relatif tahan karat dan dikemas dengan fase diam tertentu. Ukuran kolom untuk tujuan analitik berkisar antara panjang 10 hingga 25 cm dan diameter dalam 3 hingga 9 mm (Brown dan DeAntonis, 1997).
2.3.4.5 Detektor (Detector)
Detektor dapat dibagi ke dalam dua kategori yakni bulk property detector (detektor universal) dan solute property detector (detektor spesifik). Jika detektor mampu mengukur sifat baik dari solut maupun fase gerak, detektor demikian merupakan bulk property detector. Sedangkan detektor yang hanya mampu mengukur sifat solut dinamakan solute property detector (Brown dan DeAntonis, 1997). Karakteristik detektor yang baik adalah sensitif, batas deteksi rendah, respon yang linier, mampu mendeteksi solut secara universal, tidak destruktif, mudah dioperasikan, memiliki dead volume yang kecil dan tidak sensitif terhadap perubahan suhu serta kecepatan fase gerak (Hamilton dan Sewell, 1977). Beberapa detektor yang paling sering digunakan dalam KCKT adalah detektor spektrofotometri UV-Vis, photodiode-array (PDA), fluoresensi, indeks bias dan detektor elektrokimia (Rohman, 2007).
2.3.4.6 Perekam (Recorder)
2.4 Validasi Metode
Organisasi standarisasi internasional (ISO/The International Organization
for Standarization) mendefinisikan validasi sebagai suatu perngesahan dengan
cara pemeriksaan dan penetapan bukti-bukti objektif bahwa persyaratan tertentu untuk tujuan spesifik yang diinginkan telah dipenuhi (MacNeil, et.al., 2000). FDA (Food and Drugs Administration) dalam publikasinya yang terbaru, Guidance for
Industry on Analytical Procedures and Methods Validation, menyatakan bahwa
validasi metode adalah suatu proses yang menunjukkan bahwa prosedur analitik telah sesuai dengan penggunaan yang dikehendaki. Proses validasi metode untuk prosedur analitik dimulai dengan pengumpulan data validasi oleh pelaksana guna mendukung prosedur analitiknya (Bliesner, 2006).
Tabel 1. Delapan Karakterisitk Utama yang Digunakan dalam Validasi Metode
Analitik
Karakteristik Pengertian
Akurasi/Kecermatan Kedekatan antara nilai hasil uji yang diperoleh lewat metode analitik dengan nilai sebenarnya.
Presisi/Keseksamaan Ukuran keterulangan metode analitik, termasuk di antaranya kemampuan instrumen dalam memberikan hasil analitik yang reprodusibel.
Spesifisitas Kemampuan untuk mengukur analit yang dituju secara tepat dan spesifik dengan adanya komponen lain dalam matriks sampel seperti ketidakmurnian, produk degradatif dan komponen matriks.
Batas deteksi Konsentrasi analit terendah dalam sampel yang masih dapat dideteksi, meskipun tidak selalu dapat dikuantifikasi.
Batas kuantitasi Konsentrasi analit terendah dalam sampel yang dapat ditentukan dengan presisi dan akurasi yang dapat diterima pada kondisi operasional metode yang digunakan.
Linieritas Kemampuan suatu metode untuk memperoleh hasil uji yang secara langsung proposional dengan konsentrasi analit pada kisaran yang diberikan.
Rentang/Kisaran Konsentrasi terendah dan tertinggi yang mana suatu metode analitik menunjukkan akurasi, presisi dan linieritas yang cukup.
Kekuatan/Ketahanan Kapasitas metode untuk tetap tidak terpengaruh oleh adanya variasi parameter metode yang kecil.
2.4.1 Akurasi/Kecermatan
Akurasi dapat ditentukan dengan dua metode, yakni spiked-placebo
metode simulasi, analit murni ditambahkan (spiked) ke dalam campuran bahan pembawa sediaan farmasi, lalu campuran tersebut dianalisis dan jumlah analit hasil analisis dibandingkan dengan jumlah analit teoritis yang diharapkan. Jika plasebo tidak memungkinkan untuk disiapkan, maka sejumlah analit yang telah diketahui konsentrasinya dapat ditambahkan langsung ke dalam sediaan farmasi otentik. Metode ini dinamakan metode standard addition method atau metode penambahan baku. Jumlah keseluruhan analit kemudian diukur dan dibandingkan dengan jumlah teoritis, yaitu jumlah analit yang murni berasal dari sediaan farmasi otentik tersebut, ditambah dengan jumlah analit yg di-spiked ke dalam sediaan. Akurasi kemudian dinyatakan dalam persen perolehan kembail (%Recovery). %Recovery ditentukan sebagai rasio antara hasil yang diperoleh dari analisis dengan hasil sebenarnya yang dihitung secara teoritis. Hal yang penting untuk diperhatikan adalah metode kuantitasi yang digunakan dalam penentuan akurasi harus sama dengan metode kuantitasi yang digunakan untuk menganalisis sampel dalam penelitian (Ermer, 2005; Harmita, 2004; Vanderwielen dan Hardwidge, 1982).
2.4.2 Presisi/Keseksamaan
waktu singkat. Presisi antara dikerjakan oleh analis yang berbeda. Sedangkan reprodusibilitas dikerjakan oleh analis yang berbeda dan di laboratorium yang berbeda (Épshtein, 2004).
2.4.3 Spesifisitas
Dalam prosedur analitik yang spesifik, pengukuran yang digunakan untuk penentuan suatu senyawa tidak dipengaruhi oleh adanya material lain (Vanderwielen dan Hardwidge, 1982). Secara umum, spesifisitas dapat ditunjukkan oleh pendekatan secara langsung maupun tidak langsung. Pendekatan langsung dapat ditunjukkan oleh minimalnya gangguan oleh senyawa lain terhadap hasil analisis misalnya mendapatkan hasil yang sama dengan atau tanpa senyawa pengganggu, resolusi kromatografik yang bagus dan kemurnian puncak (peak purity). Pendekatan tidak langsung adalah lewat pengamatan karakteristik akurasi dari metode tersebut. Bila akurasi metode telah dapat diterima (acceptable) dan valid, maka metode tersebut otomatis telah masuk kriteria sebagai metode yang spesifik (Ermer, 2005).
2.4.4 Batas Deteksi dan Batas Kuantitasi
2.4.5 Linieritas
Linieritas dapat ditentukan secara langsung dengan pengukuran analit atau sampel yang di-spiked pada konsentrasi sekurang-kurangnya lima titik konsentrasi yang mencakup seluruh rentang konsentrasi kerja (Ermer, 2005). Berdasarkan rekomendasi ICH, linieritas dalam prakteknya diperkirakan pertama kali secara visual dari penampilan kurva plot luas area/tinggi puncak dengan konsentrasi. Bila terlihat linier, maka hubungan plot tersebut dipelajari lagi dengan metode analisis regresi. Untuk prosedur analitik penentuan kadar senyawa induk, CDER (Center
for Drug Evaluation and Research, US FDA) merekomendasikan bahwa kriteria
linieritasnya pada tingkat koefisien korelasi tidak lebih kecil dari 0,999 (Épshtein, 2004).
2.4.6 Rentang
2.4.7 Kekuatan/Ketahanan
BAB III
METODOLOGI
Penelitian ini merupakan penelitian eksperimental yang dilakukan di laboratorium Analisis Fisikokimia, Fakultas Farmasi, Universitas Sumatera Utara, Medan; pada bulan Juni 2009 hingga Juli 2009.
3.1 Alat
Alat yang digunakan dalam penelitian ini meliputi seperangkat instrumen Kromatografi Cair Kinerja Tinggi (KCKT) lengkap (Shimadzu Prominence series) dengan injektor (Rheodyne 7225i), kolom Shim-Pack VP-ODS (4,6 x 250 mm) dan detektor UV/Vis (SPD 20 A); syringe 100 l (SGE); sonifikator (Branson 1510); pompa vakum (Gast DOA-P604-BN); alat penyaring fase gerak dan sampel dilengkapi dengan penyaring membran Whatman Cellulose Nitrate 0,45 m dan PTFE 0,5 m dengan diameter 47 mm serta Cellulose Nitrate 0,2 m dengan diameter 13 mm; neraca analitik (Boeco BBL31); spektrofotometer UV-Vis (Shimadzu Mini 1240); laboratory shaker (Julabo SW 22); hot plate (Fisons); sentrifugator (Janetzki T5); alat destilasi serta peralatan gelas yang umumnya digunakan dalam laboratorium analitik. (Gambar alat dapat dilihat pada Lampiran 1 dan 2)
3.2 Bahan
85%, metanol, akrilamida for synthesis (sertifikat analisis dapat dilihat pada Lampiran 23) dan aquabidest (PT. Ikapharmindo Putramas).
3.3 Sampel
Sampel yang diperiksa dalam penelitian ini merupakan kentang (Solanum
tuberosum L.) varietas granola yang berasal dari tanah karo Berastagi dan dibeli di
Pasar Sore, Padang Bulan, Medan.
3.4 Rancangan Penelitian
3.4.1 Penyiapan Bahan
3.4.1.1 Pembuatan Sampel
Kentang yang telah disiapkan, dicuci bersih dan dikupas kulit luarnya, kemudian dipotong dengan ukuran yang seragam dan digoreng dengan metode penggorengan rendam (deep-fat frying) menggunakan hot plate pada berbagai suhu penggorengan yakni 110°C, 130°C, 150°C, 170°C dan 190°C. Suhu penggorengan dikontrol menggunakan termometer dengan koreksi suhu ±5°C.
3.4.1.2 Pembuatan Larutan Asam Fosfat 0,1% v/v
3.4.1.3 Pembuatan Fase Gerak
Fase gerak terdiri dari larutan asam fosfat 3,5 mM dan metanol disiapkan secara terpisah. Larutan asam fosfat 3,5 mM dibuat dari 0,036 ml larutan asam fosfat 0,1% v/v (setara dengan 3,5 mM asam fosfat), lalu ditambahkan aquabidest hingga garis tanda pada labu tentukur 1000 ml. Sebelum digunakan, larutan asam fosfat 3,5 mM dan metanol disaring masing-masing melalui penyaring membran Whatman Cellulose Nitrate 0,45 m dan PTFE 0,5 m, kemudian diawaudarakan selama ±20 menit menggunakan sonifikator.
3.4.1.4 Pembuatan Pelarut
Pelarut dibuat secara kuantitatif dari larutan asam fosfat 3,5 mM dan metanol dengan perbandingan yang sama seperti perbandingan fase gerak hasil optimasi. Pelarut lalu disaring dengan penyaring membran Cellulose Nitrate 0,45
m dan diawaudarakan selama ±20 menit menggunakan sonifikator.
3.4.1.5 Pembuatan Larutan Induk Baku Pembanding Akrilamida
3.4.1.5.1 Pembuatan Larutan Induk Baku Pertama (1000 ppm)
Ditimbang sebanyak 50 mg akrilamida, lalu dimasukkan ke dalam labu tentukur 50 ml. Kemudian ditambahkan dengan sedikit pelarut, kocok hingga larut. Setelah larut, diencerkan lagi dengan pelarut sampai garis tanda.
3.4.1.5.2 Pembuatan Larutan Induk Baku Kedua (100 ppm)
3.4.1.5.3 Pembuatan Larutan Induk Baku Ketiga (10 ppm)
Dipipet 5 ml larutan induk baku kedua, lalu dimasukkan ke dalam labu tentukur 50 ml. Setelah itu, ditambahkan pelarut sampai garis tanda.
3.4.1.6 Pembuatan Larutan Sampel
Sampel ditimbang sebanyak 10 g kemudian ditambahkan 60 ml diklorometan dan 3 ml etanol. Akrilamida lalu diekstraksi dari sampel dengan bantuan alat laboratory shaker pada kecepatan 150 rpm selama 120 menit. Hasil ekstraksi disaring kemudian dibilas dengan 5 ml diklorometan sebanyak dua kali. Filtrat selanjutnya ditambahkan 25 ml pelarut (pembuatannya dapat dilihat pada bagian 3.4.1.4) dan didestilasi hingga diklorometan habis. Untuk memisahkan minyak yang ikut terekstraksi, larutan destilat kemudian disentrifugasi selama 60 menit lalu dibekukan dalam freezer lemari pendingin selama 3 jam. Minyak yang sudah memadat dipisahkan secara fisik dari fase air beku. Fase air yang membeku kemudian dibiarkan mencair dan dipindahkan ke dalam labu tentukur 25 ml. Setelah itu, volumenya dicukupkan hingga 25 ml dengan pelarut. Larutan ini kemudian disebut sebagai larutan sampel.
3.4.2 Prosedur Analisis
3.4.2.1 Penyiapan Alat KCKT
tetap dengan low-pressure gradient system untuk memperoleh komposisi fase gerak yang konstan selama analisis (sistem elusi isokratik).
Setelah alat KCKT dihidupkan, maka pompa dijalankan dan fase gerak dibiarkan mengalir selama ± 30 menit sampai diperoleh garis alas yang datar
pertanda sistem kromatografi telah stabil.
3.4.2.2 Penentuan Kondisi Kromatografi untuk Mendapatkan Hasil Analisis yang Optimum
Panjang gelombang analisis ditentukan dengan cara membuat spektrum serapan dari akrilamida baku menggunakan spektrofotometer UV. Kondisi kromatografi lainnya yang divariasikan untuk mendapatkan hasil analisis optimum adalah komposisi fase gerak dan laju alir. Perbandingan fase gerak yakni metanol dan larutan asam fosfat 3,5 mM divariasikan 5:95, 10:90, 15:85, 20:80, 25:75 dan 30:70, sedangkan laju alir divariasikan mulai dari 1,2 hingga 1,8 ml/menit. Kondisi kromatografi yang memberi hasil analisis yang optimum lalu ditentukan berdasarkan analisis hasil yang diperoleh. (Data hasil optimasi dapat dilihat pada Lampiran 3 dan 4)
3.4.2.3 Analisis Kualitatif
tambat yang sama diamati kembali dan dibandingkan antara kromatogram hasil
spiking dengan kromatogram larutan sampel sebelum spiking. Sampel dinyatakan
mengandung akrilamida jika terjadi peningkatan tinggi dan luas puncak pada kromatogram hasil spiking dengan waktu tambat yang sama seperti pada kromatogram penyuntikan larutan baku pembanding.
3.4.2.4 Analisis Kuantitatif
3.4.2.4.1 Penentuan Linieritas Kurva Kalibrasi Baku Pembanding Akrilamida
Larutan induk baku pembanding ketiga dipipet 1 ml, 2 ml, 2,5 ml, 5 ml, 7,5 ml dan 10 ml; masing-masing dimasukkan ke dalam labu tentukur 25 ml, lalu diencerkan dengan pelarut sampai garis tanda. Konsentrasi masing-masing larutan adalah 0,4 ppm, 0,8 ppm, 1 ppm, 2 ppm, 3 ppm dan 4 ppm. Masing-masing larutan disaring melalui penyaring membran Cellulose Nitrate 0,2 m dan diawaudarakan selama ±20 menit. Setelah itu, filtrat larutan baku pembanding
disuntikkan sebanyak 100 l ke dalam sistem KCKT melalui injektor dengan loop 20 l. Direkam kromatogram dan dibuat kurva kalibrasi, lalu dihitung persamaan regresi dan koefisien korelasi. (Kromatogram dan data perhitungan dapat dilihat pada Lampiran 5 dan 6)
3.4.2.4.2 Penetapan Kadar Akrilamida dalam Sampel
Larutan sampel yang telah disiapkan seperti pada bagian 3.4.1.6, dimasukkan ke dalam labu tentukur 25 ml dan ditambahkan dengan pelarut sampai garis tanda. Larutan lalu disaring melalui penyaring membran Cellulose
sebanyak 100 l ke dalam sistem KCKT melalui injektor dengan loop 20 l, menggunakan sistem elusi isokratik dengan fase gerak larutan asam fosfat 3,5 mM dan metanol di mana perbandingan komposisi dan laju alir sesuai dengan hasil optimasi. Deteksi menggunakan detektor UV pada panjang gelombang hasil optimasi. Direkam kromatogram dan dicatat luas puncak. (Kromatogram dapat dilihat pada Lampiran 7, 9, 11, 13 dan 15)
Kadar akrilamida yang terdapat dalam larutan sampel (X) dihitung dengan mensubstitusikan luas puncak ke dalam persamaan regresi yang diperoleh dari kurva kalibrasi pada bagian 3.4.2.4.1 sebagai Y. Hasilnya lalu dikali volume larutan sampel (25 ml), kemudian dibagi dengan berat penimbangan sampel kentang goreng sehingga diperoleh kadar akrilamida dengan satuan µg/g sampel. Rumus perhitungan kadar akrilamida dalam sampel dituliskan sebagai berikut.
sampel
(Contoh perhitungan untuk mencari kadar dapat dilihat pada Lampiran 22)
3.4.2.5 Analisis Data Penetapan Kadar Secara Statistik
Data perhitungan kadar akrilamida pada bagian 3.4.2.4.2 dianalisis secara statistik menggunakan uji t.
Rumus yang digunakan untuk menghitung simpangan baku adalah:
1
Sedangkan untuk mendapatkan thitung digunakan rumus:
Data diterima jika –ttabel < thitung < ttabel pada interval kepercayaan 95%
dengan nilai α = 0,05. Keterangan:
SD = standard deviation/simpangan baku
X = kadar akrilamida
X
= kadar rerata akrilamidan = jumlah perlakuan
Untuk menghitung kadar akrilamida dalam sampel secara statistik digunakan rumus:
) n SD (t X ) ( Akrilamida
Kadar µ = ± ×
Keterangan:
= kadar akrilamida
t = harga ttabel sesuai dengan derajat kepercayaan
(Data perhitungan penetapan kadar secara statistik dapat dilihat pada Lampiran 8, 10, 12, 14 dan 16)
3.4.3 Validasi Metode
3.4.3.1 Akurasi (Kecermatan)
Akurasi ditentukan dengan menggunakan metode penambahan baku (the method of standard additives), yakni ke dalam sampel kentang goreng
recovery). Persen perolehan kembali dapat dihitung dengan menggunakan rumus
CF = kadar analit yang diperoleh setelah penambahan akrilamida
baku
CA = kadar analit sebelum penambahan akrilamida baku
A *
C = kadar akrilamida baku yang ditambahkan
(Contoh perhitungan persen perolehan kembali dapat dilihat pada Lampiran 19) (Data perolehan kembali dan analisisnya secara statistik dapat dilihat pada Lampiran 18 dan 20)
3.4.3.2 Presisi (Keseksamaan)
Presisi metode penelitian dinyatakan oleh simpangan baku relatif (Relative Standard Deviation/RSD) dari serangkaian data. RSD dapat dirumuskan sebagai
berikut.
SD = standard deviation/simpangan baku
3.4.3.3 Batas Deteksi dan Batas Kuantitasi
Batas deteksi (Limit Of Detection/LOD) dan batas kuantitasi (Limit Of Quantitation/LOQ) dihitung dari persamaan regresi kurva kalibrasi baku
pembanding. Batas deteksi dan batas kuantitasi dapat dihitung dengan menggunakan rumus sebagai berikut.
2 -n
Yi) -Y ( S
2 y/x
∑
=
S S 3,3 LOD= × y/x
S S 10 LOQ= × y/x
Keterangan:
Sy/x = residual standard deviation/simpangan baku residual
S = slope atau derajat kemiringan
(Épshtein, 2004)
BAB IV
HASIL DAN PEMBAHASAN
Kadar akrilamida dalam kentang goreng akan dianalisis menggunakan KCKT fase balik. Maka untuk dapat memberikan hasil analisis yang baik, terlebih dahulu dicari kondisi optimal KCKT yang mencakup panjang gelombang analisis, komposisi fase gerak dan laju alir.
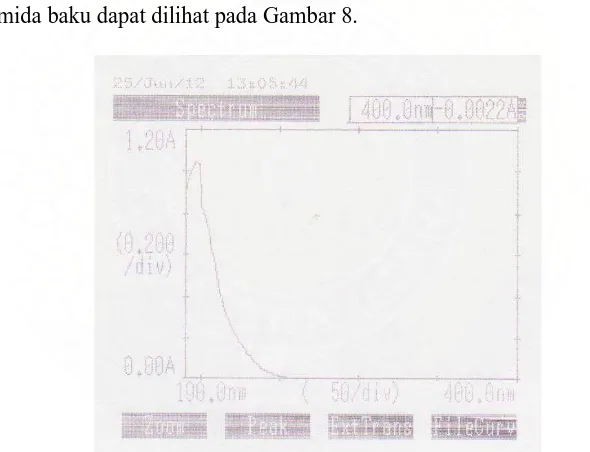
Panjang gelombang analisis ditentukan dengan membuat kurva serapan akrilamida baku menggunakan spektrofotometer UV. Spektrum hasil pengukuran akrilamida baku dapat dilihat pada Gambar 8.
Dari kurva serapan ini, diperoleh kesimpulan bahwa akrilamida memberi serapan maksimum pada panjang gelombang 198 nm. Hasil yang diperoleh sesuai dengan pernyataan dari Brown, et.al. (1982) bahwa akrilamida memiliki serapan maksimum pada panjang gelombang sekitar 196-198 nm, namun karena sampel yang akan dianalisis merupakan matriks biologik dengan kandungan yang
Gambar 8. Kurva serapan akrilamida baku 5 ppm secara
kompleks, dikhawatirkan penggunaan panjang gelombang analisis pada rentang 196-198 nm akan memberikan banyak gangguan dari senyawa lain yang ikut terekstraksi (co-extractives), dikarenakan semua senyawa ini memiliki serapan pada rentang panjang gelombang 195-205 nm (Gökmen and Şenyuva, 2008). Menurut Leung, et.al. (1987), analisis yang dilakukan pada panjang gelombang 190 nm akan menghasilkan noise yang tinggi dan garis alas yang tidak stabil. Dan menurut Brown, et.al. (1982) sisa ion anorganik yang terelusi cepat sebelum akrilamida, akan terdeteksi lebih kuat pada panjang gelombang 197 nm. Berdasarkan hal tersebut maka analisis akrilamida dalam penelitian ini dilakukan pada panjang gelombang 210 nm. Panjang gelombang ini juga digunakan dalam beberapa penelitian sebelumnya (Li, et.al., 2008; Liu, et.al., 2008).
Gambar 9. Kromatogram hasil penyuntikan akrilamida baku 10 ppm
menggunakan fase gerak asetonitril dan larutan asam fosfat 3,5 mM (5:95) dengan laju alir 1,5 ml/menit.
Gambar 10. Kromatogram hasil penyuntikan larutan sampel menggunakan
Penggunaan asetonitril sebagai komponen fase gerak memperlihatkan banyaknya puncak yang memiliki serapan negatif (negative peak) pada kromatogram Gambar 10. Integrator secara normal tidak bisa mengukur negative
peak karena derajat kemiringan/slope yang positif diperlukan dalam deteksi
Kromatogram di atas menunjukkan luas puncak yang lebih besar dibandingkan kromatogram pada Gambar 9, sedangkan HETP yang dihasilkan keduanya tidak berbeda jauh. Meskipun waktu tambat yang dihasilkan lebih lama daripada waktu tambat ketika analisis menggunakan fase gerak asetonitril dan larutan asam fosfat 3,5 mM (5:95), namun waktu tambat ini dapat dipercepat dengan cara meningkatkan konsentrasi metanol dalam fase gerak atau mempercepat laju alir, sehingga penggunaan fase gerak metanol dan larutan asam fosfat 3,5 mM dapat memberikan hasil optimal untuk analisis akrilamida dengan menggunakan KCKT.
Setelah menentukan fase gerak yang akan digunakan dalam analisis, kemudian dicari kondisi kromatografi yang lebih baik dengan memvariasikan komposisi fase gerak metanol dan larutan asam fosfat 3,5 mM dengan laju alir
Gambar 11. Kromatogram hasil penyuntikan akrilamida baku 10 ppm