PENETAPAN KADAR AKRILAMIDA PADA KERIPIK SINGKONG YANG BERASAL DARI PASAR SWALAYAN DAN PASAR TRADISIONAL DI KOTA MEDAN SECARA KROMATOGRAFI CAIR
KINERJA TINGGI (KCKT)
SKRIPSI
OLEH : WINA HALIM NIM 060804018
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA MEDAN
PENETAPAN KADAR AKRILAMIDA PADA KERIPIK SINGKONG YANG BERASAL DARI PASAR SWALAYAN DAN PASAR TRADISIONAL DI KOTA MEDAN SECARA KROMATOGRAFI CAIR
KINERJA TINGGI (KCKT)
SKRIPSI
Diajukan untuk melengkapi salah satu syarat untuk memperoleh Gelar Sarjana Farmasi pada Fakultas Farmasi
Universitas Sumatera Utara
OLEH : WINA HALIM NIM 060804018
FAKULTAS FARMASI
PENGESAHAN SKRIPSI
PENETAPAN KADAR AKRILAMIDA PADA KERIPIK SINGKONG YANG BERASAL DARI PASAR SWALAYAN DAN PASAR TRADISIONAL DI KOTA MEDAN SECARA KROMATOGRAFI CAIR
KINERJA TINGGI (KCKT) OLEH :
WINA HALIM NIM 060804018
Dipertahankan di Hadapan Panitia Penguji Fakultas Farmasi
Universitas Sumatera Utara Pada Tanggal: ... 2010
Pembimbing I, Panitia Penguji,
Dra. Salbiah, M.Si., Apt. Drs. Fathur Rahman Harun, M.Si., Apt. NIP 194810031987012001 NIP 195201041980031002
Pembimbing II, Dra. Salbiah, M.Si., Apt.
NIP 194810031987012001
Prof. Dr. rer .nat. Effendy De Lux Putra, SU., Apt. Drs. Muchlisyam, M.Si., Apt. NIP 195306191983031001 NIP 195006221980021001
Dra. Nurmadjuzita,M.Si., Apt. NIP 194809041974122001 Medan, November 2010
Fakultas Farmasi Universitas Sumatera Utara
Dekan,
KATA PENGANTAR
Puji dan syukur kepada Tuhan Yang Maha Kuasa yang telah melimpahkan rahmat dan anugerah-Nya sehingga penulis dapat menyelesaikan penelitian dan penyusunan skripsi ini yang berjudul “Penetapan Kadar Akrilamida pada Keripik Singkong yang Berasal dari Pasar Swalayan dan Pasar Tradisional di Kota Medan secara Kromatografi Cair Kinerja Tinggi (KCKT)”. Skripsi ini diajukan sebagai salah satu syarat untuk memperoleh gelar Sarjana Farmasi pada Fakultas Farmasi Universitas Sumatera Utara.
Ucapan terima kasih dan penghargaan yang tulus tiada terhingga kepada kedua orang tua tercinta, juga kepada kakak dan adik-adik penulis atas doa, kasih sayang, dorongan dan semangat baik moril maupun materil kepada penulis selama masa perkuliahan hingga selesainya penyusunan skripsi ini.
Pada kesempatan ini penulis ingin menyampaikan terima kasih yang sebesar-besarnya kepada Ibu Dra. Salbiah, M.Si., Apt. dan Bapak Prof. Dr. rer.nat. Effendy De Lux Putra, SU., Apt. yang telah membimbing penulis dengan penuh kesabaran, tulus dan ikhlas selama penelitian hingga selesainya penulisan skripsi ini.
Penulis juga menyampaikan ucapan terima kasih yang sebesar-besarnya kepada :
1. Bapak Prof. Dr. Sumadio Hadisahputra, Apt., sebagai Dekan Fakultas Farmasi yang telah memberikan bantuan dan fasilitas selama masa pendidikan.
2. Ibu Dra. Fat Aminah, M.Sc., Apt., selaku penasehat akademik serta seluruh Staf Pengajar Fakultas Farmasi USU yang telah banyak membimbing dan mendidik penulis selama masa perkuliahan hingga selesai.
3. Bapak Drs. Fathur Rahman Harun, M.Si., Apt., Bapak Drs. Muchlisyam, M.Si., Apt., Ibu Dra. Nurmadjuzita, M.Si., Apt., selaku dosen penguji yang telah memberikan saran, arahan, kritik, dan masukan kepada penulis dalam penyelesaian skripsi ini.
Putra, SU., Apt., selaku Kepala Laboratorium Penelitian yang telah memberikan fasilitas dan bantuan selama penelitian.
5. Sahabat-sahabat terbaikku, Steffi, Jeny, Ie, Niki, Irma, Ririn, dan Uul, terima kasih atas segala perhatian dan kebersamaannya selama ini.
6. Teman-teman seperjuangan, Deni, Ibeth, Dina, Gokman, Roni, Jon, Jandri, Mery, Cyanita, Siti, Hendra, Azhar dan teman-teman Farmasi 2006, kakak dan abang senior Farmasi, adik-adik junior Farmasi serta semua pihak yang tidak dapat disebutkan satu persatu yang telah banyak membantu selama masa perkuliahan hingga selesainya penulisan skripsi ini.
Penulis menyadari sepenuhnya bahwa penulisan skripsi ini masih memiliki banyak kekurangan, oleh karena itu sangat diharapkan kritikan dan saran yang dapat menyempurnakan skripsi ini.
Medan, November 2010 Penulis,
Penetapan Kadar Akrilamida pada Keripik Singkong yang berasal dari Pasar Swalayan dan Pasar Tradisional di Kota Medan secara Kromatografi
Cair Kinerja Tinggi (KCKT)
Abstrak
Akrilamida merupakan suatu senyawa toksik yang ditemukan dalam beragam jenis makanan yang kaya karbohidrat yang dimasak pada suhu yang tinggi dan waktu yang lama. Salah satu jenis makanan ringan yang mengandung karbohidrat dan banyak digemari oleh masyarakat di Indonesia adalah keripik singkong. Oleh karena itu, tujuan penelitian ini adalah untuk mengetahui kadar akrilamida dalam keripik singkong yang terdapat di kota Medan.
Untuk mengkaji hal ini, maka dilakukan penelitian dengan mengambil beberapa sampel keripik singkong yang berasal dari pasar swalayan dan pasar tradisional untuk mewakili keripik singkong yang berada di kota Medan. Kadar akrilamida dianalisa dengan Kromatografi Cair Kinerja Tinggi (KCKT) fase balik menggunakan kolom Shim-Pack VP_ODS (4,6 x 250 nm), perbandingan fase gerak asetonitril dan asam fosfat 21,7 mM (5:95), laju alir 1 ml/menit dan detektor uv pada panjang gelombang 230 nm.
Validasi metode menunjukkan bahwa prosedur penelitian yang dilakukan memiliki akurasi dan presisi yang baik yakni dengan persen perolehan kembali 115,78% (RSD = 1,41%). Sedangkan batas deteksi dan batas kuantitasi berturut-turut adalah 0,21 mcg/ml dan 0,69 mcg/ml.
Dari hasil penelitian, disimpulkan bahwa kadar akrilamida dalam keripik singkong yang berasal dari pasar tradisional yaitu sebesar 1900-5500 mcg/kg sampel dan jauh lebih besar dari kadar akrilamida dalam keripik singkong yang berasal dari pasar swalayan yaitu sebesar 850-1300 mcg/kg sampel.
Determination of Acrylamide Concentration on Cassava Chips from Supermarkets and Traditional Markets by High Perfomance Liquid
Chromatography (HPLC)
Abstract
Acrylamide was a toxic compound found in various types of foods rich of carbohydrates which were cooked at high temperatures and long periods. Cassava chips are one of the snacks containing high concentration carbohydrates which Indonesian people liked. Therefore, the purpose of this research was to determine the acrylamide content of cassava chips existed in Medan.
To examine this, a research was done by taking several samples of cassava chips from supermarkets and traditional markets to represent all cassava chips in the city of Medan. Level of Acrylamide was then analyzed by High Performance Liquid Chromatography (HPLC) reversed phase column, Shim-Pack VP_ODS (4.6 x 250 nm), the ratio of mobile phase acetonitrile and 21.7 mM phosphoric acid (5:95), flow rate 1 ml/min and UV detector at 230 nm.
Method of validation showed that the research procedure had a good accuracy and precision, which gave percent recovery of 115.78% (RSD = 1.41%). The limit of detection and limit of quantitation frequently were 0.21 mcg/ml and 0.69 mcg/ml, respectively.
Based on this research, it was concluded that the level of acrylamide in cassava chips derived from the traditional market equal to 1900-5500 mcg/kg sample and was significantly higher than the level of acrylamide in cassava chips from the supermarket 850-1300 for mcg/kg sample.
DAFTAR ISI
Halaman
JUDUL ... i
HALAMAN JUDUL ... ii
LEMBAR PENGESAHAN ... iii
KATA PENGANTAR ... iv
ABSTRAK ... vi
ABSTRACT ... vii
DAFTAR ISI ... viii
DAFTAR TABEL ... xi
DAFTAR GAMBAR ... xii
DAFTAR LAMPIRAN ... xiv
BAB I PENDAHULUAN ... 1
1.1 Latar Belakang ... 1
1.2 Perumusan Masalah ... 3
1.3 Hipotesis ... 3
1.4 Tujuan ... 4
BAB II TINJAUAN PUSTAKA... ... 5
2.1 Akrilamida... 5
2.1.1 Sifat Fisikokimia ... 5
2.1.2 Kegunaan Umum ... 5
2.1.3 Farmakokinetika ... 6
2.1.4 Toksikologi ... 6
2.1.5 Metode Analisis ... 7
2.2 Mekanisme Terbentuknya Akrilmida dalam Makanan yang Digoreng... 7
2.3 Teori Kromagrafi ... 8
2.3.1 Sejarah ... 8
2.3.2 Kromatografi Cair Kinerja Tinggi (KCKT) ... 9
2.3.3 Jenis Kromatografi Cair Kinerja Tinggi... 9
2.3.4 Komponen Kromatografi Cair Kinerja Tinggi ... 10
2.3.4.1 Wadah Fase Gerak ... 11
2.3.4.2 Pompa ... 11
2.3.4.3 Injektor... 12
2.3.4.5 Detektor ... 13
2.3.4.6 Perekam ... 13
2.3.5 Parameter Kromatografi ... 14
2.4 Validasi ... 16
BAB III METODOLOGI PENELITIAN... 19
3.1 Alat- alat ... 19
3.2 Bahan-bahan ... 19
3.3 Sampel ... 20
3.4 Rancangan Penelitian... 20
3.4.1 Penyiapan Bahan ... 20
3.4.1.1 Pembuatan Fase Gerak ... 20
3.4.1.2 Pembuatan Pelarut ... 20
3.4.1.3 Pembuatan Larutan Induk Baku Pembanding Akrilamida ... 21
3.4.1.3.1 Pembuatan Larutan Induk Baku Pertama (1000 mcg/ml) ... 21
3.4.1.3.2 Pembuatan Larutan Induk Baku Kedua (100 mcg/ml) ... 21
3.4.1.3.3 Pembuatan Larutan Induk Baku Ketiga (10 mcg/ml) ... 21
3.4.1.4 Pembuatan Larutan Sampel ... 21
3.4.2 Prosedur Analisis ... 22
3.4.2.1 Penyiapan Alat KCKT ... 22
3.4.2.2 Penentuan Komposisi Fase Gerak ... 22
3.4.2.3 Analisis Kualitatif ... 22
3.4.2.4 Analisis Kuantitatif ... 23
3.4.2.4.1 Penentuan Linieritas Kurva Kalibrasi Baku Pembanding Akrilamida ... 23
3.4.2.4.2 Penetapan Kadar Akrilamida dalam Sampel ... 24
3.4.2.5 Analisis Data Penetapan Kadar Secara Statistik ... 24
3.4.3 Validasi Metode... 26
3.4.3.1 Akurasi ... 26
3.4.3.2 Presisi ... 26
3.4.3.3 Batas Deteksi dan Batas Kuantitasi ... 27
BAB IV HASIL DAN PEMBAHASAN ... 28
4.1 Penentuan Kondisi Kromatografi untuk Mendapatkan Hasil Analisis yang Optimum ... 28
4.2 Penyiapan Larutan Sampel ... 34
4.3 Analisis Kualitatif ... 36
4.4 Analisis Kuantitatif ... 38
4.5 Perolehan Kadar Akrilamida dalam Sampel Keripik Singkong ... 39
4.6 Validasi Metode... 41
BAB V KESIMPULAN DAN SARAN... 43
DAFTAR TABEL
Halaman
Tabel 1. Data Hasil Analisis Akrilamida Baku 10 mcg/ml pada Berbagai Perbandingan Komposisi Fase Gerak dengan Laju Alir 1,0 ml/menit ... 30 Tabel 2. Hasil Pengukuran Kurva Kalibrasi Akrilamida Baku ... 39 Tabel 3. Hasil Penetapan Kadar Akrilamida dalam Sampel Keripik
Singkong secara Statistik ... 40 Tabel 4. Data Hasil Pengujian Perolehan Kembali Akrilamida pada
DAFTAR GAMBAR
Halaman
Gambar 1. Rumus Bangun Senyawa Akrilamida ... 5 Gambar 2. Skema Pembentukan Akrilamida Lewat Reaksi Mailard ... 8 Gambar 3. Instrumen Dasar KCKT ... 11 Gambar 4. Kurva Serapan Akrilamida Baku 0,5 mcg/ml secara
Spektrofotometri UV ... 28
Gambar 5. Kromatogram Hasil Penyuntikan Baku Akrilamida dengan Komposisi Fase Gerak Asetonitril : Aquabidest : Asam Fosfat 10% (5:94:1) dengan Laju Alir 1,0 ml/menit ... 30 Gambar 6. Kromatogram Hasil Penyuntikan Baku Akrilamida dengan
Komposisi Fase Gerak Asetonitril : Aquabidest : Asam Fosfat 10% (20:79:1) dengan Laju Alir 1,0 ml/menit ... 31 Gambar 7. Kromatogram Hasil Penyuntikan Sampel Keripik Singkong
yang Berasal dari Kampung Lalang dengan Komposisi Fase Gerak Asetonitril : Aquabidest : Asam Fosfat 10% (20:79:1) dengan Laju Alir 1,0 ml/menit ... 32 Gambar 8. Kromatogram Hasil Spike Keripik Singkong yang Berasal
dari Kampung Lalang dengan Baku Akrilamida10 mcg/ml dan Komposisi Fase Gerak Asetonitril : Aquabidest : Asam Fosfat 10% (20:79:1) dengan Laju Alir 1,0 ml/menit ... 33 Gambar 9. Kromatogram Hasil Penyuntikan Sampel Keripik Singkong
yang Berasal dari Kampung Lalang dengan Komposisi Asetonitril : Larutan Asam Fosfat 21,7 mM (5:95) dan Laju Alir 1,0 ml/menit ... 34 Gambar 10. Kromatogram Hasil Penyuntikan Sampel Keripik Singkong
yang Berasal dari Kampung Lalang dengan Komposisi Asetonitril : Larutan Asam Fosfat 21,7 mM (5:95) dan Laju Alir 1,0 ml/menit ... 36 Gambar 11. Kromatogram Hasil Penyuntikan Baku Akrilamida 10
mcg/ml ... 37 Gambar 12. Kromatogram Hasil Penyuntikan Larutan Sampel yang
DAFTAR LAMPIRAN
Halaman
Lampiran 1. Kromatogram Penyuntikan Akrilamida Baku untuk Mencari Komposisi Fase Gerak yang Optimum untuk
Analisis ... 47 Lampiran 2. Kromatogram Penyuntikan Sampel untuk Orientasi ... 51
Lampiran 3. Kromatogram Hasil Penyuntikan Larutan Akrilamida
Baku pada Pembuatan Kurva Kalibrasi... 54
Lampiran 4. Perhitungan Persamaan Regresi dari Kurva Kalibrasi Akrilamida Baku yang Diperoleh dengan KCKT pada
Panjang Gelombang 230 nm ... 61
Lampiran 5. Kromatogram Hasil Penyuntikan Larutan Sampel Qtela ... 63 Lampiran 6. Analisis Data secara Statistik dari Hasil Penyuntikan
Larutan Sampel Qtela ... 66
Lampiran 7. Kromatogram Hasil Penyuntikan Larutan Sampel Kusuka... 68 Lampiran 8. Analisis Data secara Statistik dari Hasil Penyuntikan
Larutan Sampel Kusuka ... 71
Lampiran 9. Kromatogram Hasil Penyuntikan Larutan Sampel
Kingkong ... 73
Lampiran 10.Analisis Data secara Statistik dari Hasil Penyuntikan
Larutan Sampel Kingkong ... 76
Lampiran 11.Kromatogram Hasil Penyuntikan Larutan Sampel
Kampung Lalang ... 77
Lampiran 12.Analisis Data secara Statistik dari Hasil Penyuntikan Larutan Sampel Keripik Singkong yang Berasal dari
Kampung Lalang ... 80
Lampiran 13.Kromatogram Hasil Penyuntikan Larutan Sampel Keripik
Singkong yang Berasal dari Kampung Baru ... 82
Lampiran 14.Analisis Data secara Statistik dari Hasil Penyuntikan Larutan Sampel Keripik Singkong yang Berasal dari
Lampiran 15.Kromatogram Hasil Penyuntikan Larutan Sampel Keripik
Singkong yang Berasal dari Krakatau ... 86
Lampiran 16.Analisis Data secara Statistik dari Hasil Penyuntikan Larutan Sampel Keripik Singkong yang Berasal dari Krakatau ... 89
Lampiran 17.Hasil Pengolahan Data Penyuntikan Larutan Sampel Keripik Singkong Menggunakan KCKT ... 91
Lampiran 18.Contoh Perhitungan untuk Mencari Kadar Akrilamida dalam Sampel ... 92
Lampiran 19.Kromatogram Hasil Perolehan Kembali Akrilamida Baku yang Ditambahkan pada Sampel Keripik Singkong Qtela (Metode Penambahan Baku)... 93
Lampiran 20.Data Perolehan Kembali Akrilamida Baku yang Ditambahkan pada Sampel Keripik Singkong Qtela (Metode Penambahan Baku) ... 95
Lampiran 21.Contoh Perhitungan Persen Perolehan Kembali ... 96
Lampiran 22.Perhitungan Penetapan Batas Deteksi dan Batas Kuantitasi ... 97
Lampiran 23.Sertifikat Analisis Akrilamida Baku ... 98
Lampiran 24.Daftar Nilai Distribusi t ... 99
Lampiran 25. Gambar Instrumen KCKT dan Syringe 100µl ... 100
Penetapan Kadar Akrilamida pada Keripik Singkong yang berasal dari Pasar Swalayan dan Pasar Tradisional di Kota Medan secara Kromatografi
Cair Kinerja Tinggi (KCKT)
Abstrak
Akrilamida merupakan suatu senyawa toksik yang ditemukan dalam beragam jenis makanan yang kaya karbohidrat yang dimasak pada suhu yang tinggi dan waktu yang lama. Salah satu jenis makanan ringan yang mengandung karbohidrat dan banyak digemari oleh masyarakat di Indonesia adalah keripik singkong. Oleh karena itu, tujuan penelitian ini adalah untuk mengetahui kadar akrilamida dalam keripik singkong yang terdapat di kota Medan.
Untuk mengkaji hal ini, maka dilakukan penelitian dengan mengambil beberapa sampel keripik singkong yang berasal dari pasar swalayan dan pasar tradisional untuk mewakili keripik singkong yang berada di kota Medan. Kadar akrilamida dianalisa dengan Kromatografi Cair Kinerja Tinggi (KCKT) fase balik menggunakan kolom Shim-Pack VP_ODS (4,6 x 250 nm), perbandingan fase gerak asetonitril dan asam fosfat 21,7 mM (5:95), laju alir 1 ml/menit dan detektor uv pada panjang gelombang 230 nm.
Validasi metode menunjukkan bahwa prosedur penelitian yang dilakukan memiliki akurasi dan presisi yang baik yakni dengan persen perolehan kembali 115,78% (RSD = 1,41%). Sedangkan batas deteksi dan batas kuantitasi berturut-turut adalah 0,21 mcg/ml dan 0,69 mcg/ml.
Dari hasil penelitian, disimpulkan bahwa kadar akrilamida dalam keripik singkong yang berasal dari pasar tradisional yaitu sebesar 1900-5500 mcg/kg sampel dan jauh lebih besar dari kadar akrilamida dalam keripik singkong yang berasal dari pasar swalayan yaitu sebesar 850-1300 mcg/kg sampel.
Determination of Acrylamide Concentration on Cassava Chips from Supermarkets and Traditional Markets by High Perfomance Liquid
Chromatography (HPLC)
Abstract
Acrylamide was a toxic compound found in various types of foods rich of carbohydrates which were cooked at high temperatures and long periods. Cassava chips are one of the snacks containing high concentration carbohydrates which Indonesian people liked. Therefore, the purpose of this research was to determine the acrylamide content of cassava chips existed in Medan.
To examine this, a research was done by taking several samples of cassava chips from supermarkets and traditional markets to represent all cassava chips in the city of Medan. Level of Acrylamide was then analyzed by High Performance Liquid Chromatography (HPLC) reversed phase column, Shim-Pack VP_ODS (4.6 x 250 nm), the ratio of mobile phase acetonitrile and 21.7 mM phosphoric acid (5:95), flow rate 1 ml/min and UV detector at 230 nm.
Method of validation showed that the research procedure had a good accuracy and precision, which gave percent recovery of 115.78% (RSD = 1.41%). The limit of detection and limit of quantitation frequently were 0.21 mcg/ml and 0.69 mcg/ml, respectively.
Based on this research, it was concluded that the level of acrylamide in cassava chips derived from the traditional market equal to 1900-5500 mcg/kg sample and was significantly higher than the level of acrylamide in cassava chips from the supermarket 850-1300 for mcg/kg sample.
BAB I PENDAHULUAN 1.1Latar Belakang
Pada tahun 2002, University of Stockholm dan National Food
Administration mengumumkan bahwa terdapat pembentukan akrilamida pada makanan yang dipanggang, dibakar dan digoreng, khususnya makanan yang mengandung karbohidrat yang tinggi. Suatu penemuan menunjukkan bahwa akrilamida terbentuk dalam beragam jenis makanan yang diolah pada suhu tinggi, seperti keripik kentang, popcorn, biskuit dan lain sebagainya (Ötles et al., 2004).
Akrilamida merupakan suatu senyawa yang reaktif secara kimia dan umumnya digunakan sebagai bahan baku monomer dalam sintesis poliakrilamida, juga dalam pemurnian air dan produksi kertas. Akrilamida diketahui memiliki efek neurotoksik, genotoksik dan karsinogenik (Ötles et al., 2004). Akrilamida juga dapat menyebabkan tumor pada saraf pusat, kelenjar susu, kelenjar tiroid dan uterus (Info POM, 2002). Food and Agriculture Organization of the United
Nations (FAO) dan World Health Organization (WHO) menetapkan batas aman akrilamida adalah 0,5 mg/kg BB/hari terkait dengan neuropati.
FAO dan WHO menyatakan bahwa akrilamida diketahui berpotensi menyebabkan kerusakan sel-sel saraf dan gangguan reproduksi pada hewan tikus tersebut dan pemberian dalam jangka panjang dapat menyebabkan tumor. Namun demikian, belum ada fakta yang teruji untuk membuktikan bahwa akrilamida dalam makanan berpotensi menyebabkan kanker pada manusia, karena pemberian makanan yang mengandung akrilamida dengan dosis tinggi pada hewan tikus tidak dapat diekstrapolasikan pada manusia secara langsung. Dari pernyataan di atas, dapat disimpulkan bahwa keripik singkong berbahaya bila dikonsumsi berlebihan.
Pada penelitian-penelitian terdahulu, analisis akrilamida dalam makanan banyak menggunakan sampel kentang dimana kadar akrilamida dalam sampel keripik kentang sebesar 170-3700 mcg/kg dan kentang goreng 200-12000 mcg/kg (Friedman, 2003), sedangkan keripik singkong belum pernah digunakan sebagai sampel dalam penelitian.
Analisis akrilamida dalam makanan juga dipublikasikan dalam banyak jurnal penelitian dengan menggunakan berbagai metode seperti kromatografi gas-spektrometri massa (gas chromatography–mass spectrometry atau GC-MS), kromatografi cair–spektrometri massa tandem (liquid chromatography–tandem
Berbagai fase gerak yang digunakan dalam analisis akrilamida yaitu metanol dan larutan asam fosfat 3,5 mM (10:90) (Tanseri, 2010) dan asetonitril, aquabidest dan asam fosfat (5:94:1) (Harahap, 2006). Dari fase gerak tersebut, dipilih fase gerak asetonitril, aquabidest dan asam fosfat. Penggunaan asetonitril dinilai lebih baik daripada metanol dikarenakan asetonitril mempunyai viskositas lebih rendah dan lebih mudah bercampur dengan linarut non polar (Johnson dan Stevenson, 1991).
Uraian di atas menjadi alasan penelitian ini dilakukan, yaitu untuk menetapkan kadar akrilamida pada keripik singkong yang terdapat pada pasar swalayan dan pasar trasidional di kota Medan secara KCKT. Untuk menguji keabsahan metode yang dikerjakan, maka pada akhir penelitian ini dilakukan validasi. Parameter validasi yang akan dilakukan meliputi akurasi (kecermatan), presisi (keseksamaan), batas deteksi dan batas kuantitasi.
1.2 Perumusan Masalah
1. Apakah metode KCKT dengan kolom C18 (4,6 X 250 mm), perbandingan
fase gerak asetonitril : aquabidest : asam fosfat 10% (5:94:1), laju alir 1,2 ml/menit, dan detektor UV pada panjang gelombang 230 nm dapat diterapkan dalam penetapan kadar akrilamida pada keripik singkong yang berasal dari pasar swalayan dan pasar tradisional di kota Medan?
2. Apakah terdapat perbedaaan kadar akrilamida pada keripik singkong yang berasal dari pasar swalayan dan pasar tradisional di kota Medan?
1.3 Hipotesis
1. Metode KCKT dengan kolom C18 (4,6 X 250 mm), perbandingan fase
ml/menit, dan detektor UV pada panjang gelombang 230 nm dapat diterapkan dalam penetapan kadar akrilamida pada keripik singkong yang berasal dari pasar swalayan dan pasar tradisional di kota Medan.
2. Terdapat perbedaan kadar akrilamida pada keripik singkong yang berasal dari pasar swalayan dan pasar tradisional di kota Medan.
1.4 Tujuan Penelitian
1. Menerapkan metode KCKT dengan kolom C18 (4,6 x 250 nm),
perbandingan fase gerak asetonitril : aquabidest : asam fosfat (5:94:1), laju alir 1,2 ml/menit, dan detektor UV pada panjang gelombang 230 nm dalam penetapan kadar akrilamida pada keripik singkong yang berasal dari pasar swalayan dan pasar tradisional di kota Medan.
BAB II
TINJAUAN PUSTAKA
2.1 Akrilamida
2.1.1 Sifat Fisikokimia
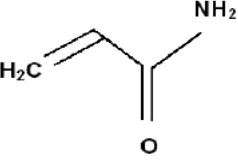
Akrilamida (sinonim: 2-propenamida, etilen karboksiamida, akrilikamida, asam propeonik amida, vinilamida) merupakan suatu senyawa kimia kristalin bening hingga putih dengan bobot molekul 71,08 dan tidak berbau. Senyawa ini sangat mudah larut dalam air, larut dalam aseton, etanol, metanol dan dimetil eter. Titik leleh akrilamida pada suhu 840-850C dan mendidih pada suhu 1250C (Friedman, 2003; Harahap, 2006).
Gambar 1. Rumus Bangun Senyawa Akrilamida 2.1.2 Kegunaan Umum
2.1.3 Farmakokinetika
Akrilamida dapat diabsorpsi secara oral, melalui membran mukosa saluran nafas (inhalasi), dan lewat kontak dengan kulit utuh (rute dermal). Menurut FAO dan WHO, absorpsinya diperkirakan cepat lewat rute oral. Kelarutan akrilamida yang tinggi dalam air menjadi salah satu alasan bagi distribusinya yang cepat ke seluruh tubuh. Di dalam tubuh akrilamida didistribusi melalui cairan tubuh dan dimetabolisme oleh enzim sitokrom P450 lalu dieksresikan melalui urin dan empedu.Waktu paruh eliminasi akrilamida pada tikus sekitar 2 jam, sedangkan waktu paruh eliminasinya pada manusia belum diketahui secara jelas (FAO dan WHO, 2002; Friedman, 2003).
2.1.4 Toksikologi
Akrilamida merupakan senyawa toksik sedangkan poliakrilamida yang merupakan polimernya tidak lagi bersifat toksik. Akrilamida telah diklasifikasikan sebagai senyawa yang mungkin menyebabkan kanker atau berpotensi sebagai karsinogen pada manusia (Friedman, 2003).
2.1.5 Metode Analisis
Metode yang dapat digunakan untuk menganalisis kadar akrilamida dalam sampel makanan, antara lain kromatografi gas spektrometri massa (Rothweiler, 2004), kromatografi cair–spektrometri massa tandem (Takatsuki, 2002) dan kromatografi cair kinerja tinggi (Harahap, 2006; Tanseri, 2009).
Akrilamida memiliki berat molekul 71,08 dengan kelarutan yakni 215 g/L air pada suhu 25°C. Oleh karena itu, dapat dikatakan bahwa akrilamida merupakan suatu senyawa dengan kepolaran yang tinggi dan bila diitinjau dari struktur molekulnya, akrilamida memiliki ikatan rangkap terkonjugasi (CH2=CH– CO–NH2) dan gugus kromofor yang dapat menyerap sinar UV (Castle, 2006). Hal ini mendasari penggunaan KCKT fase balik (reversed phase high
performance liquid chromatography) dengan detektor UV untuk analisis akrilamida dalam sampel.
Gambar 2. Skema Pembentukan Akrilamida Lewat Reaksi Mailard (sumber: Wedzicha et al., 2005 dan Zyzak et al., 2003)
2.3 Teori Kromatografi 2.3.1 Sejarah
Kromatografi Cair Kinerja Tinggi atau KCKT atau biasa juga disebut dengan HPLC (High Perfomance Liquid Chromatography) dikembangkan pada akhir tahun 1960-an dan awal tahun 1970-an. Saat ini, KCKT merupakan teknik pemisahan yang diterima secara luas untuk analisis dan pemurnian senyawa tertentu dalam suatu sampel pada sejumlah bidang, antara lain: farmasi, lingkungan, bioteknologi, polimer, dan analisis senyawa-senyawa kiral (Rohman, 2007).
2.3.2 Kromatografi Cair Kinerja Tinggi (KCKT)
Kromatografi cair kinerja tinggi merupakan metode pemisahan dengan kecepatan dan efisiensi tinggi yang dapat mengidentifikasi serta menetapkan secara kuantitatif bahan dalam jumlah yang sangat kecil. KCKT mempunyai kemajuan dalam teknologi kolom, sistem pompa tekanan tinggi, dan detektor yang sensitif. Dengan teknologi ini, kromatografi cair dapat menghasilkan pemisahan yang cepat dalam banyak hal, dengan keunggulan zat-zat yang tidak menguap atau tidak tahan panas dapat dikromatografi tanpa peruraian atau tanpa perlu membuat derivat yang dapat menguap (Ditjen POM, 1995).
protein-protein dalam cairan fisiologis, menentukan kadar senyawa-senyawa aktif obat dan lain-lain (Rohman, 2007).
2.3.3 Jenis Kromatografi Cair Kinerja Tinggi
Pemisahan dengan KCKT dapat dilakukan dengan fase normal (jika fase diamnya lebih polar dibanding dengan fase geraknya) atau fase terbalik (jika fase diamnya lebih non polar dibanding dengan fase geraknya). Berdasarkan pada kedua pemisahan ini, sering kali KCKT dikelompokkan menjadi KCKT fase normal dan KCKT fase terbalik.
Selain klasifikasi di atas, KCKT juga dapat dikelompokkan berdasarkan pada sifat fase diam, yaitu: kromatografi adsorpsi, kromatografi terikat, kromatografi penukar ion, kromatografi pasangan ion, kromatografi eksklusi ukuran, dan kromatografi afinitas.
Kromatografi fase terikat menggunakan fase diam dari silika yang dimodifikasi secara kimiawi atau fase terikat. Sejauh ini yang digunakan untuk memodifikasi silikia adalah hidrokarbon-hidrokarbon non-polar seperti dengan oktadesilsilana, oktasilana, atau dengan fenil. Fase diam yang paling populer digunakan adalah oktadesilsilan (ODS atauC18) dan kebanyakan pemisahannya
adalah fase terbalik (Rohman, 2009).
2.3.4 Komponen Kromatografi Cair Kinerja Tinggi
Gambar 3. Instrumen Dasar KCKT 2.3.4.1 Wadah Fase Gerak
Wadah fase gerak harus bersih dan inert, seperti wadah pelarut kosong ataupun labu labolatorium. Wadah ini biasanya dapat menampung fase gerak antara 1 sampai 2 liter pelarut. Fase gerak sebelum digunakan harus disaring terlebih dahulu untuk menghindari partikel-partikel kecil. Selain itu, adanya gas dalam fase gerak juga harus dihilangkan, sebab adanya gas akan berkumpul dengan komponen lain terutama di pompa dan detektor sehingga akan mengacaukan analisis.
2.3.4.2 Pompa
Ada 2 jenis pompa dalam KCKT yaitu pompa dengan aliran fase gerak yang tetap dan pompa dengan tekanan konstan.
2.3.4.3 Injektor
Sampel-sampel cair dan larutan disuntikkan secara langsung ke dalam fase gerak yang mengalir dibawah tekanan menuju kolom menggunakan alat penyuntik yang terbuat dari tembaga tahan karat dan katup teflon.
Ada tiga jenis dasar injektor, yaitu:
a. Hentikan aliran/stop flow : aliran dihentikan, injeksi dilakukan pada kinerja atmosfir, sistem tertutup, dan aliran dilanjutkan lagi. Teknik ini bisa digunakan karena difusi di dalam aliran kecil dan resolusi tidak dipengaruhi.
b. Septum : injektor-injektor langsung ke aliran fase gerak umumnya sama dengan yang digunakan pada kromatografi gas. Injektor ini dapat digunakan pada kinerja sampai 60-70 atmosfir. Tetapi septum ini tidak tahan dengan semua pelarut-pelarut kromatografi cair. Selain itu, partikel kecil dari septum yang terkoyak (akibat jarum injektor) dapat menyebabkan penyumbatan.
c. Katup putaran (loop valve) : tipe injektor ini umumnya digunakan untuk menginjeksi volume lebih besar dari pada 10 μl dan sekarang digunakan
2.3.4.4 Kolom
Kolom merupakan jantung kromatografi. Keberhasilan atau kegagalan analisis bergantung pada pilihan kolom dan kondisi kerja yang tepat. Kolom dapat dibagi menjadi dua kelompok :
a. Kolom analitik : diameter dalam 2-6 mm. Panjang bergantung pada jenis kemasan, untuk kemasan pelikel biasanya panjang kolom 50-100 cm, untuk kemasan mikropartikel berpori biasanya 10-30 cm;
b. Kolom preparatif : umumnya bergaris tengah 6 mm atau lebih besar dan panjang 25-100 cm
Kolom umumnya terbuat dari stainless steel. Kolom biasanya dipakai pada suhu kamar, tetapi suhu yang yang lebih tinggi juga dipakai, terutama dalam kromatografi pertukaran ion dan kromatografi eksklusi.
2.3.4.5 Detektor
Detektor pada KCKT dikelompokkan menjadi 2 golongan yaitu :
1. Detektor universal : mampu mendeteksi zat secara umum, tidak bersifat spesifik, dan tidak bersifat selektif, seperti detektor indeks bis dan detektor spektrometri massa.
2. Detektor spesifik : hanya mendeteksi analit secara spesifik dan selektif, seperti detektor UV-Vis, detektor fluoresensi dan elektrokimia.
2.3.4.6Perekam
2.3.5 Parameter Kromatografi
Ada beberapa parameter kromatografi yang digunakan secara umum, yaitu:
1. Waktu Tambat / Waktu Retensi
Jarak antara puncak maksimal dari titik injeksi yang dinyatakan dalam unit waktu disebut waktu retensi. Waktu retensi berfungsi sebagai pengidentifikasi analit pada sistem partikuler.
Waktu retensi merupakan deskriptor yang paling luas digunakan untuk analit, dan parameter yang paling mudah diukur. Walaupun mudah diukur, waktu retensi merupakam parameter universal yang paling akhir.
Waktu retensi analit tergantung pada laju alir fase gerak dan stabilitas laju alir. Semakin cepatlaju alir, semakin singkat waktu retensi (Dong, 2006).
2. Resolusi
Tujuan sederhana dan bahkan sangat penting dalam KCKT adalah mendapatkan pemisahan campuran sampel yang baik. Untuk mencapai tujuan inikita perlu menghitung ukuran kunatitatif dari pemisahan relatif atau resolusi. Resolusi, Rs, dari dua puncak berdekatan didefinisikan sebagai perbandingan jarak antara dua puncak, dibagi dengan rata-rata lebar puncak. Rumusnya :
Rs =
2 1 1 2 ) ( 2 w w t t t t + −
Dimana : t1 dan t2 = waktu retensi puncak 1 dan 2
tw1 dan tw2 = lebar puncak 1 dan 2
3. Efisiensi Kolom
Salah satu karakteristik sistem kromatografi yang paling penting adalah efisiensi atau jumlah lempeng teoritis. Bilangan lempeng (N) yang tinggi disyaratkan untuk pemisahan yang baik yang nilainya semakin kecilnya nilai H. Istilah H merupakan tinggi ekivalen lempeng teoritis atau HETP (high equivalent
theoretical plate) yang mana merupakan panjang kolom yang dibutuhkan untuk menghasilkan satu lempeng teoritis. Kolom yang baik akan mempunyai bilangan lempeng yang tinggi dan nilai H yang rendah, untuk mencapai hal ini ada beberapa faktor yang mendukung yaitu kolom yang dikemas dengan baik, kolom yang lebih panjang, partikel fase diam yang lebih kecil, viskositas fase gerak yang lebih rendah dan suhu yang lebih tinggi, molekul-molekul sampel yang lebih kecil, dan pengaruh di luar kolom yang minimal (Rohman, 2007).
4. Faktor Asimetri
Hal-hal yang menyebabkan terjadinya puncak yang asimetris, yaitu :
a. Ukuran sampel yang dianalisis terlalu besar. Jika sampel terlalu besar maka fase gerak tidak mampu membawa solut dengan sempurna karenanya terjadi pengekoran atau tailing.
b. Interaksi yang kuat antara solut dengan fase diam dapat menyebabkan solut sukar terelusi sehingga dapat menyebabkan terbentuknya puncak yang mengekor.
2.4 Validasi
Validasi adalah suatu tindakan terhadap parameter tertentu pada prosedur penetapan yang dipakai untuk membuktikan bahwa parameter tersebut memenuhi persyaratan untuk penggunaannya. Validasi dilakukan untuk menjamin bahwa metode analisis yang dilakukan akurat, spesifik, reprodusibel, dan tahan pada kisaran analit yang akan dianalisis (WHO, 1992; Rohman, 2007).
Parameter analisis yang ditentukan pada validasi adalah akurasi, presisi, spesifikasi, limit deteksi, limit kuantitasi, linieritas dan rentang kadar.
Akurasi (kecermatan) adalah ukuran yang menunjukkan derajat kedekatan hasil analisis dengan kadar analit sebenarnya. Akurasi dinyatakan sebagai persen perolehan kembali (% recovery) analit yang ditambahkan dan dapat ditentukan melalui dua cara, yaitu metode simulasi (spiked placebo recovery) dan metode penambahan bahan baku (standard addition method). Dalam kedua metode tersebut, persen perolehan kembali dinyatakan sebagai rasio antara hasil yang diperoleh dengan hasil yang sebenarnya.
% Perolehan Kembali = x100% C
B A−
Keterangan : A = konsentrasi sampel yang diperoleh setelah penambahan baku B = konsentrasi sampel sebelum penambahan baku
C = konsentrasi baku yang ditambahkan
diartikan pula sebagai derajat reprodusibilitas atau keterulangan dari prosedur analisis. Ada 4 macam ukuran ketepatan, yaitu :
a. Kisaran (range) kadar merupakan selisih hasil penetapan yang paling besar dengan yang paling kecil. Semakin kecil selisihnya berarti hasilnya semakin tepat.
b. Deviasi rata-rata (mean deviation) merupakan deviasi masing-masing hasil penetapan terhadap rata-rata, dengan tidak memperhatikan tanda deviasinya (positif atau negatif) dan dirumuskan sebagai berikut :
d =
c. Standar deviasi (SD) merupakan akar jumlah kuadrat deviasi masing-masing hasil penetapan terhadap mean dibagi dengan derajat kebebasannya yang dinyatakan dalam rumus berikut :
Keterangan :
X = nilai dari masing-masing pengukuran
X = rata-rata (mean) dari pengukuran N = frekuensi penetapan
N-1 = derajat kebebasan
d. Standar deviasi relatif (relative standard deviation, RSD) merupakan ukuran ketepatan relatif dan umumnya dinyatakan dalam persen. RSD dirumuskan dengan persamaan :
Keterangan :RSD = Relative Standard Deviation (%) SD = Standard Deviation
X = rata-rata
Kespesifikan dari suatu metode analisis adalah kemampuannya untuk mengukur kadar analit secara khusus dengan akurat, disamping komponen lain yang terdapat dalam matriks sampel.
Batas deteksi (limit of detection) didefinisikan sebagai konsentrasi analit terendah dalam sampel yang masih dapat terdeteksi. Batas deteksi dapat dihitung dengan rumus sebagai berikut:
Batas deteksi = Slope
xSB
3
Batas kuantitasi (limit of quantitation) didefinisikan sebagai konsentrasi analit terendah dalam sampel yang dapat ditentukan dengan presisi dan akurasi yang dapat diterima pada kondisi operasional metode yang digunakan.
Batas Kuantitasi = Slope
xSB
10
BAB III METODOLOGI
Penelitian ini merupakan penelitian deskriptif yang dilakukan di Laboratorium Penelitian, Fakultas Farmasi, Universitas Sumatera Utara, Medan, pada bulan Mei hingga Juni 2010.
3.1 Alat
Alat yang digunakan dalam penelitian ini meliputi seperangkat instrumen Kromatografi Cair Kinerja Tinggi (KCKT) (Shimadzu Prominence series) dengan injektor (Rheodyne 7225i), kolom Shim-Pack VP-ODS (4,6 x 250 mm) dan detektor UV/Vis (SPD 20 A); syringe 100 μl (SGE); sonifikator (Branson 1510);
pompa vakum (Gast DOA-P604-BN); alat penyaring fase gerak dan sampel dilengkapi dengan penyaring membran Whatman Cellulose Nitrate 0,45 μm dan PTFE 0,5 μm dengan diameter 47 mm serta Cellulose Nitrate 0,2 μm dengan
diameter 13 mm; neraca analitik (Boeco BBL31); spektrofotometer UV-Vis (Shimadzu 1800); laboratory shaker (Julabo SW 22); hot plate (Fisons); sentrifugator (Janetzki T5); alat destilasi serta peralatan gelas yang umumnya digunakan dalam laboratorium analitik (Gambar alat dapat dilihat pada Lampiran 25 dan 26).
3.2 Bahan
3.3 Sampel
Pengambilan sampel untuk keripik singkong yang berasal dari pasar swalayan dilakukan secara purposif yaitu tanpa membandingkan antara satu sampel dengan yang lain karena sampel dianggap homogen. Sampel yang diperiksa dalam penelitian ini yaitu Qtela, Kingkong, Kusuka.
Pengambilan sampel untuk keripik singkong yang berasal dari pasar tradisional dilakukan secara random. Sampel yang diperiksa dalam penelitian yaitu keripik singkong yang terdapat di Kampung Lalang, Krakatau, dan Kampung Baru.
3.4 Rancangan Penelitian 3.4.1 Penyiapan Bahan
3.4.1.1 Pembuatan Fase Gerak
Fase gerak terdiri dari asetonitril dan larutan asam fosfat 21,7 mM disiapkan secara terpisah. Larutan asam fosfat 21,7 mM dibuat dari asam fosfat 85%, diambil 12 ml lalu ditambahkan aquabidest hingga garis tanda pada labu tentukur 100 ml (asam fosfat 10%), setelah itu diambil 10,5 ml larutan asam fosfat 10% dan ditambahkan aquabidest hingga garis tanda pada labu tentukur 1000 ml. Sebelum digunakan, larutan asam fosfat 21,7 mM dan asetonitril disaring masing-masing melalui penyaring membran Whatman Cellulose Nitrate 0,45 μm dan PTFE 0,5 μm, kemudian diawaudarakan selama ±20 menit menggunakan
sonifikator.
3.4.1.2 Pembuatan Pelarut
yang didapat pada optimasi. Pelarut lalu disaring dengan penyaring membran
Cellulose Nitrate 0,45 μm, kemudian diawaudarakan selama ±20 menit menggunakan sonifikator.
3.4.1.3 Pembuatan Larutan Induk Baku Pembanding Akrilamida 3.4.1.3.1 Pembuatan Larutan Induk Baku Pertama (1000 mcg/ml)
Ditimbang seksama sebanyak 50,0 mg akrilamida, lalu dimasukkan ke dalam labu tentukur 50 ml. Kemudian ditambahkan dengan sedikit pelarut, kocok hingga larut. Setelah larut, diencerkan lagi dengan pelarut sampai garis tanda.
3.4.1.3.2 Pembuatan Larutan Induk Baku Kedua (100 mcg/ml)
Dipipet 5 ml larutan induk baku pertama, lalu dimasukkan ke dalam labu tentukur 50 ml. Setelah itu, ditambahkan pelarut sampai garis tanda.
3.4.1.3.3 Pembuatan Larutan Induk Baku Ketiga (10 mcg/ml)
Dipipet 5 ml larutan induk baku kedua, lalu dimasukkan ke dalam labu tentukur 50 ml. Setelah itu, ditambahkan pelarut sampai garis tanda.
3.4.1.4 Pembuatan Larutan Sampel
fisik dari fase air beku. Fase air yang membeku kemudian dibiarkan mencair. Larutan ini kemudian disebut sebagai larutan sampel (Levita, et.al., 2006).
3.4.2 Prosedur Analisis
3.4.2.1 Penyiapan Alat KCKT
Kolom yang digunakan adalah Shim-Pack VP-ODS (4,6 x 250 mm). KCKT menggunakan detektor UV. Pompa menggunakan mode aliran tetap dengan low-pressure gradient system untuk memperoleh komposisi fase gerak yang konstan selama analisis (sistem elusi isokratik).
Setelah alat KCKT dihidupkan, maka pompa dijalankan dan fase gerak dibiarkan mengalir selama ±30 menit sampai diperoleh garis alas yang datar pertanda sistem kromatografi telah stabil.
3.4.2.2 Penentuan Komposisi Fase Gerak
Kondisi kromatografi divariasikan untuk mendapatkan hasil analisis yang optimum. Kondisi kromatografi yang divariasikan adalah perbandingan fase gerak yaitu asetonitril, aquabidest dan asam fosfat 10% divariasikan 5:94:1, 10:89:1, 15:84:1 dan 20:79:1; asetonitril dengan larutan asam fosfat 21,7 mM dengan perbandingan 5:95, 10:90 dan 15:85.
3.4.2.3 Analisis Kualitatif
tambat yang sama diamati kembali dan dibandingkan antara kromatogram hasil
spiking dengan kromatogram larutan sampel sebelum spiking. Sampel dinyatakan mengandung akrilamida jika terjadi peningkatan tinggi dan luas puncak pada kromatogram hasil spiking dengan waktu tambat yang sama seperti pada kromatogram penyuntikan larutan baku pembanding (Rohman, 2007).
3.4.2.4 Analisis Kuantitatif
3.4.2.4.1 Penentuan Linieritas Kurva Kalibrasi Baku Pembanding Akrilamida
Konsentrasi yang digunakan pada pembuatan kurva kalibrasi baku pembanding akrilamida adalah 0,1; 1,6; 2,4; 3,2; 4,8; dan 5,2 mcg/ml. Larutan dengan konsentrasi 0,1 mcg/ml dibuat dengan cara memipet larutan induk baku pembanding ketiga (konsentrasi 10 mcg/ml) sebanyak 1 ml dimasukkan ke dalam labu tentukur 100 ml, lalu diencerkan dengan pelarut sampai garis tanda, sedangkan untuk konsentrasi 1,6; 2,4; 3,2; 4,8 dan 5,2 mcg/ml dipipet larutan induk baku pembanding ketiga (konsentrasi 10 mcg/ml) 4, 6, 8, 12 dan 13 ml; dimasukkan ke dalam labu tentukur 25 ml, kemudian diencerkan dengan pelarut sampai garis tanda.
Masing-masing larutan disaring melalui penyaring membran Cellulose
3.4.2.4.2 Penetapan Kadar Akrilamida dalam Sampel
Larutan sampel yang telah disiapkan seperti pada bagian 2.4.1.4 disaring dengan menggunakan penyaring membran Cellulose Nitrate 0,2 μm dan diawaudarakan selama ±20 menit. Kemudian disuntikkan sebanyak 20 μl ke dalam sistem KCKT melalui injektor dengan loop 20 μl, menggunakan sistem elusi isokratik dengan fase gerak asetonitril dan larutan asam fosfat 21,7 mM di mana perbandingan komposisi dan laju alir sesuai dengan hasil optimasi. Deteksi menggunakan detektor UV pada panjang gelombang hasil optimasi. Direkam kromatogram dan dicatat luas puncak. (Kromatogram dapat dilihat pada Lampiran 5, 7, 9, 11, 13 dan 15).
Kadar akrilamida yang terdapat dalam larutan sampel (X) dihitung dengan mensubstitusikan luas puncak ke dalam persamaan regresi yang diperoleh dari kurva kalibrasi pada bagian 2.4.2.3.1 sebagai Y. Hasilnya lalu dikali volume larutan sampel (25 ml), kemudian dibagi dengan berat penimbangan sampel keripik singkong sehingga diperoleh kadar akrilamida dengan satuan mcg/g sampel.
Rumus perhitungan kadar akrilamida dalam sampel dituliskan sebagai berikut:
Kadar Akrilamida (mcg/g sampel) =
) ( sampel(ml) larutan Volume x mcg/ml) ( g sampel n penimbanga berat X
(Contoh perhitungan untuk mencari kadar dapat dilihat pada Lampiran 18) 3.4.2.5 Analisis Data Penetapan Kadar Secara Statistik
Data perhitungan kadar akrilamida pada bagian 2.4.2.3.2 dianalisis secara statistik menggunakan uji t.
SD =
(
)
1 2 − −∑
n X XSedangkan untuk mendapatkan thitung digunakan rumus:
thitung =
n SD X X / −
Data diterima jika –ttabel < thitung < ttabel pada interval kepercayaan 95%
dengan derajat kebebasan dk = n-1 dan nilai α = 0,05. Keterangan:
SD = standard deviation/simpangan baku X = kadar akrilamida
= kadar rerata akrilamida
n = jumlah perlakuan
Untuk menghitung kadar akrilamida dalam sampel secara statistik digunakan rumus:
Kadar Akrilamida (µ) = X ± t(1-1/2α)dk x
n SD
Keterangan:
μ = kadar akrilamida
t = harga ttabel sesuai dengan derajat kepercayaan
α = tingkat kepercayaaan
dk = derajat kebebasan
3.4.3 Validasi Metode 3.4.3.1 Akurasi
Akurasi ditentukan dengan menggunakan metode penambahan baku (the
method of standard additives), yakni ke dalam sampel keripik singkong ditambahkan akrilamida baku sebanyak 150% dari kadar akrilamida yang diketahui terdapat dalam sampel, kemudian dianalisis dengan prosedur yang sama seperti pada sampel. Hasil dinyatakan dalam persen perolehan kembali (%
recovery). Persen perolehan kembali dapat dihitung dengan menggunakan rumus sebagai berikut:
% perolehan kembali = C
B A−
x 100%
Keterangan:
A = konsentrasi sampel yang diperoleh setelah penambahan akrilamida baku B = konsentrasi sampel sebelum penambahan akrilamida baku
C = konsentrasi baku yang ditambahkan
(Contoh perhitungan persen perolehan kembali dapat dilihat pada Lampiran 21) (Data perolehan kembali dapat dilihat pada Lampiran 20)
3.4.3.2 Presisi
Presisi metode penelitian dinyatakan oleh simpangan baku relatif (Relative
Standard Deviation/RSD) dari serangkaian data. RSD dapat dirumuskan sebagai berikut.
RSD = X SD
Keterangan:
SD = standard deviation/simpangan baku = kadar rerata akrilamida dalam satu sampel
3.4.3.3 Batas Deteksi dan Batas Kuantitasi
Menurut Harmita (2004), batas deteksi (Limit Of Detection/LOD) dan batas kuantitasi (Limit Of Quantitation/LOQ) dihitung dari persamaan regresi kurva kalibrasi baku pembanding. Batas deteksi dari batas kuantitasi dapat dihitung dengan menggunakan rumus sebagai berikut :
SB =
(
)
2 2 − −
∑
n Yi Y LOD = Slope SB x 3 LOQ = Slope SB x 10 Keterangan :SB = residual standard deviation/simpangan baku residual S = slope atau derajat kemiringan
BAB IV
HASIL DAN PEMBAHASAN
4.1 Penentuan Kondisi Kromatografi untuk Mendapatkan Hasil Analisis yang Optimum
Kadar akrilamida dalam keripik singkong ditentukan dengan KCKT fase balik. Maka untuk dapat memberikan hasil yang baik, terlebih dahulu dicari kondisi optimal KCKT yang mencakup panjang gelombang analisis, komposisi fase gerak dan laju alir.
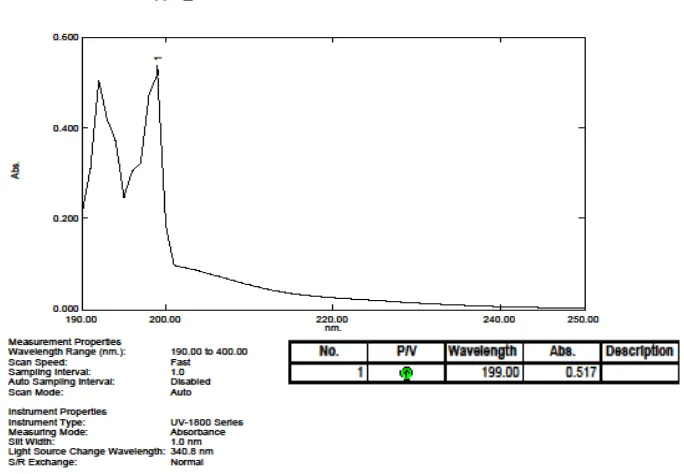
[image:46.595.142.484.422.659.2]Panjang gelombang analisis ditentukan dengan membuat kurva serapan akrilamida baku menggunakan spektrofotometer UV. Spektrum hasil pengukuran akrilamida baku dapat dilihat pada Gambar 4.
Dari hasil penentuan panjang gelombang dengan konsentrasi pengukuran 0,5 mcg/ml diperoleh panjang gelombang maksimum akrilamida pada 199 nm dengan serapan 0,517 seperti terlihat pada Gambar 4.
Menurut Brown, et.al. (1982) akrilamida memiliki serapan maksimum pada panjang gelombang sekitar 196-198 nm. Dimana adanya perbedaan panjang gelombang ini masih dalam batas-batas yang diterima menurut Farmakope Indonesia edisi IV, yaitu ±2 nm.
Pada penelitian ini tidak digunakan panjang gelombang 199 nm tetapi digunakan panjang gelombang 230 nm. Dimana penggunaan panjang gelombang 230 nm akan memberikan kondisi analisis yang baik. Menurut Leung, et.al. (1987), analisis yang dilakukan pada panjang gelombang 190 nm akan menghasilkan noise yang tinggi dan garis alas yang tidak stabil. Dan menurut Brown, et.al. (1982) sisa ion anorganik yang terelusi cepat sebelum akrilamida, akan terdeteksi lebih kuat pada panjang gelombang 197 nm. Berdasarkan hal tersebut maka analisis akrilamida dalam penelitian ini dilakukan pada panjang gelombang 230 nm dimana panjang gelombang ini telah digunakan oleh Harahap (2006) untuk menganalisis akrilamida dalam keripik kentang secara KCKT fase balik dengan menggunakan fase gerak asetonitril : aquabidest : asam fosfat 10% (5:94:1).
larutan akrilamida baku 10 mcg/ml, tetapi diperoleh kromatogram yang kurang baik, seperti yang terlihat pada Gambar 5.
Gambar 5. Kromatogram Hasil Penyuntikan Baku Akrilamida dengan Komposisi Fase Gerak Asetonitril : Aquabidest : Asam Fosfat 10% (5:94:1) dengan Laju Alir 1,0 ml/menit
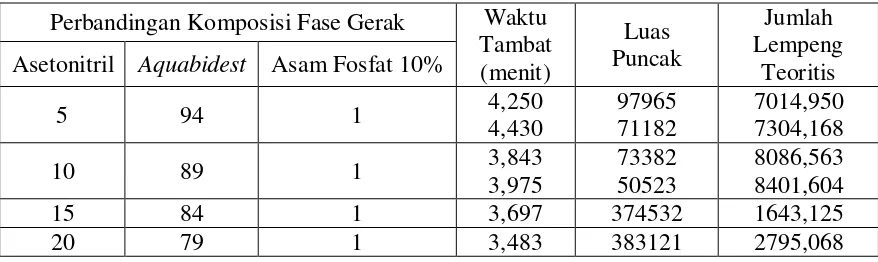
Kemudian peneliti mencoba untuk memvariasikan komposisi fase gerak dengan laju alir 1 ml/menit yang akan memberikan kondisi kromatografi yang lebih baik dari yang sebelumnya. Dimana laju alir tidak divariasikan, hal ini disebabkan pada laju alir 1 ml/menit telah memberikan waktu tambat yang singkat. Data analisis KCKT dengan berbagai perbandingan komposisi fase gerak pada laju alir 1,0 ml/menit dapat dilihat pada Tabel 1.
Tabel 1. Data Hasil Analisis Akrilamida Baku 10 mcg/ml pada Berbagai Perbandingan Komposisi Fase Gerak dengan Laju Alir 1,0 ml/menit Perbandingan Komposisi Fase Gerak Waktu
Tambat (menit)
Luas Puncak
Jumlah Lempeng
Teoritis Asetonitril Aquabidest Asam Fosfat 10%
5 94 1 4,250 4,430 97965 71182 7014,950 7304,168 10 89 1 3,843 3,975 73382 50523 8086,563 8401,604
[image:48.595.92.531.622.753.2]Tabel 1 menunjukkan bahwa semakin besar konsentrasi asetonitril dalam fase gerak, maka waktu tambat akrilamida semakin singkat. Hal ini dikarenakan kekuatan pelarut (solvent strength), di mana pada kromatografi fase terbalik, konsentrasi asetonitril yang lebih besar akan mengakibatkan fase gerak semakin kuat sehingga proses elusi terjadi lebih cepat dan nilai faktor kapasitas (k’) menjadi semakin kecil, oleh karena itu waktu tambat analit menjadi singkat. Dari pengamatan selama analisis, diketahui bahwa konsentrasi asetonitril yang semakin rendah dalam fase gerak akan mengakibatkan pecahnya peak (doubling peaks). Hal ini kemudian menjadi dasar peneliti memilih menggunakan fase gerak asetonitril : aquabidest : asam fosfat 10% dengan perbandingan 20:79:1. Kromatogram dapat dilihat pada Gambar 6.
Gambar 6. Kromatogram Hasil Penyuntikan Baku Akrilamida dengan Komposisi Fase Gerak Asetonitril : Aquabidest : Asam Fosfat 10% (20:79:1) dengan Laju Alir 1,0 ml/menit
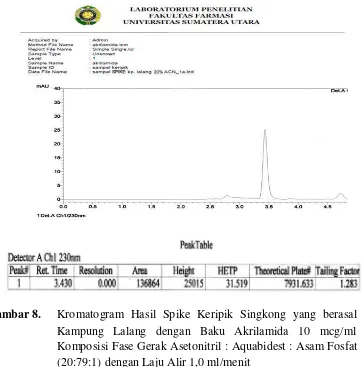
[image:49.595.116.497.394.706.2]senyawa-senyawa ikutan lainnya. Pada awalnya sampel dianalisis menggunakan kondisi KCKT sesuai optimasi dengan komposisi fase gerak asetonitril :
aquabidest : asam fosfat 10% (20:79:1) dan diperoleh hasil kromatogram yang kurang baik yaitu tidak terlihat puncak akrilamida yang terdapat dalam sampel seperti terlihat pada Gambar 7. Puncak akrilamida pada sampel Kampung Lalang dapat dilihat setelah ditambahkan sedikit larutan baku 10 mcg/ml (spiking) ke dalam larutan sampel Kampung Lalang seperti terlihat pada Gambar 8.
[image:50.595.127.496.276.608.2]Gambar 8. Kromatogram Hasil Spike Keripik Singkong yang berasal dari Kampung Lalang dengan Baku Akrilamida 10 mcg/ml dan Komposisi Fase Gerak Asetonitril : Aquabidest : Asam Fosfat 10% (20:79:1) dengan Laju Alir 1,0 ml/menit
Gambar 9. Kromatogram Hasil Penyuntikan Sampel Keripik Singkong yang berasal dari Kampung Lalang dengan Komposisi Fase Gerak Asetonitril : Larutan Asam Fosfat 21,7 mM (5:95) dan Laju Alir 1,0 ml/menit
4.2 Penyiapan Larutan Sampel
Setelah diperoleh kondisi kromatogram yang optimal maka disusunlah prosedur penyiapan larutan sampel. Prosedur diambil dari jurnal penelitian oleh Levita (2006) yakni dimulai dari ekstraksi akrilamida dari sampel keripik singkong menggunakan campuran 60 ml diklorometan dan 3 ml etanol.
selesai, filtrat ditambahkan pelarut yaitu asetonitril, aquabidest dan asam fosfat dengan perbandingan 20:79:1 dimana sebagian besar komposisi pelarutnya adalah air. Hal ini dimaksudkan agar akrilamida dapat tertarik ke dalam fase air tanpa terbawanya senyawa organik lain yang tidak larut dalam air.
Adanya kemungkinan bahwa tidak seluruh akrilamida tertarik ke dalam fase air, maka fase diklorometan harus diuapkan hingga habis sehingga sisa akrilamida yang tertinggal akan larut ke dalam fase air (Castle, 2006). Diklorometan bersifat relatif toksik dan berpotensi mencemari lingkungan bila dilakukan penguapan secara langsung, sehingga penguapan dilakukan dalam sistem tertutup menggunakan proses destilasi. Proses destilasi memungkinkan untuk dikerjakan karena titik didih diklorometan yang relatif jauh dari air yakni 40°C. Selain itu, pengamatan titik akhir destilasi juga mudah dilakukan karena fase air tidak bercampur dengan fase diklorometan.
4.3 Analisis Kualitatif
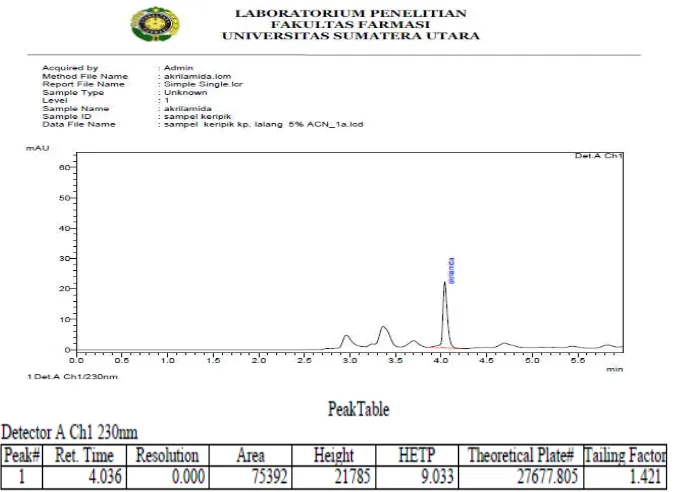
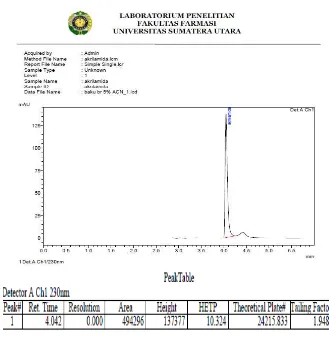
[image:54.595.145.483.432.678.2]Larutan sampel yang telah diperoleh kemudian diidentifikasi dan ternyata uji kualitatif menunjukkan bahwa akrilamida terdapat dalam sampel keripik singkong. Dari hasil penyuntikkan sampel keripik singkong diperoleh waktu tambat (misalnya, sampel penyuntikan I keripik singkong yang berasal dari kampung lalang) yaitu 4,036 menit. Waktu tambat ini berdekatan dengan waktu tambat akrilamida baku yang dianalisis pada kondisi KCKT yang sama yakni 4,042 menit. Meskipun waktu tambat yang ditunjukkan tidak sama persis, namun puncak yang diamati dalam kromatogram sampel dapat diterima sebagai puncak akrilamida karena waktu tambat 4,036 menit, masih berada di dalam rentang waktu tambat yang dapat diterima yaitu ±5% dari waktu tambat puncak akrilamida baku, 4,042 menit (Brown, 1997). Kedua kromatogram hasil analisis KCKT ini dapat dilihat pada Gambar 10 dan 11.
Gambar 12. Kromatogram Hasil Penyuntikan Larutan Sampel yang telah Di-Spike dengan Larutan Baku Pembanding Akrilamida dengan Kondisi KCKT yang Sama untuk Uji Kualitatif.
4.4 Analisis Kuantitatif
Tabel 2. Hasil Pengukuran Kurva Kalibrasi Akrilamida Baku
No. Konsentrasi (mcg/ml) (X)
Luas Area (Y)
1 0,1 17.223,6670
2 1,6 73.037,0000
3 2,4 99.377,6667
4 3,2 124.227,3333
5 4,8 179.312,3333
6 5,2 189.953,6667
Dari hasil pengukuran kurva kalibarasi didapat gambar kurva kalibrasi akrilamida baku yang dapat dilihat pada Gambar 13.
Gambar 13. Kurva Kalibrasi Akrilamida Baku.
Dari kurva kalibrasi diperoleh hubungan yang linier antara luas puncak dan konsentrasi dengan koefisien korelasi, r = 0,9995. Koefisien korelasi ini sudah sangat bagus yaitu lebih besar dari 0,99 (Christian, 1994). Dari hasil perhitungan, diperoleh persamaan garis regresi Y = 33747,1305X + 16551,0515.
4.5 Perolehan Kadar Akrilamida dalam Sampel Keripik Singkong
[image:57.595.168.466.381.507.2]laju alir 1,0 ml/menit, detektor UV pada panjang gelombang 230 nm dapat dilihat pada Lampiran 17. Data kemudian diolah secara statistik sehingga diperoleh rerata kadar akrilamida dalam sampel keripik singkong yang berasal dari pasar swalayan dan pasar tradisional di kota Medan dengan 6 kali perlakuan. Hasilnya dapat dilihat pada tabel 3.
Tabel 3. Hasil Penetapan Kadar Akrilamida dalam Sampel Keripik Singkong secara Statistik
No Nama Sampel Kadar Akrilamida (mcg/g sampel) Pasar
Swalayan
1 Qtela 0,8546
2 Kusuka 0,8964
3 Kingkong 1,2709
Pasar Tradisional
1 Kampung Lalang 4,4747
2 Kampung Baru 5,4505
3 Krakatau 1,9873
Adapun diambil 6 sampel keripik singkong di atas dikarenakan keripik singkong banyak digemari masyarakat sebagai makanan ringan maka dipilih sampel tersebut dengan asumsi akan mewakili sampel keripik singkong yang dikonsumsi oleh penduduk di kota Medan.
Kadar akrilamida keripik singkong yang berasal dari pasar tradisional yaitu 1900-5500 mcg/kg jauh lebih tinggi dari keripik singkong yang berasal dari pasar swalayan yaitu 850-1300 mcg/kg. Hal ini disebabkan oleh perbedaan cara pengolahan dan jenis minyak yang digunakan, tetapi bila dibandingkan dengan keripik kentang (170-3700 mcg/kg), kadar akrilamida dalam keripik singkong yang berasal dari pasar swalayan lebih kecil dan yang berasal dari pasar tradisional lebih besar.
menetapkan bahwa 0,2 mcg/hari akrilamida tidak bersifat sebagai agen pencetus kanker. Dapat disimpulkan bahwa konsumsi keripik singkong yang berlebihan sangat berbahaya.
4.6 Validasi Metode
Pada penelitian ini dilakukan uji validasi dengan metode penambahan bahan baku (standard addition method) terhadap salah satu sampel dari 6 sampel keripik singkong yang ada. Uji validasi yang dilakukan meliputi uji akurasi dengan parameter persen perolehan kembali (% recovery), uji presisi dengan parameter RSD (Relatif Standar Deviasi), batas deteksi (LOD) dan batas kuantitasi (LOQ).
[image:59.595.134.490.509.739.2]Hasil dinyatakan dalam persen perolehan kembali (% recovery). Kromatogram hasil perolehan kembali dapat dilihat pada Lampiran 19 sedangkan data hasil pengujian akurasi dapat dilihat pada Tabel 4.
Tabel 4. Data Hasil Pengujian Perolehan Kembali Akrilamida pada Keripik Singkong dengan Penambahan Baku Standar (Standard Addition Method)
NO Rentang Spesifik
% Luas Puncak
Perolehan Kembali (℅)
1 150 49444 114,3383
2 150 48425 113,3819
3 150 51146 117,1889
4 150 51061 117,4124
5 150 51011 116,6612
6 150 50756 115,6907
Rerata perolehan kembali 115,7789
Simpangan baku (SD) 1,6287
BAB V
KESIMPULAN DAN SARAN 5.1 Kesimpulan
Penetapan kadar baku akrilamida 10 mcg/kg secara KCKT dengan kolom C18 (4,6 X 250 mm), perbandingan fase gerak asetonitril : aquabidest : asam fosfat
10% (5:94:1), dan detektor UV pada panjang gelombang 230 nm tidak dapat diterapkan dalam penetapan kadar akrilamida pada sampel, tetapi bila fase geraknya diubah menjadi asetonitril : larutan asam fosfat 21,7 mM dengan perbandingan 5:94 maka metode ini dapat diterapkan karena memberikan uji validasi dengan parameter akurasi dan presisi yang memenuhi syarat dengan batas deteksi (LOD) sebesar 0,21 mcg/ml dan batas kuantitasi (LOQ) sebesar 0,69 mcg/ml.
Dari hasil penelitian menunjukkan kadar akrilamida pada keripik singkong yang berasal dari pasar swalayan yaitu sebesar 850-1300 mcg/kg lebih kecil dari kadar akrilamida dalam keripik kentang yaitu 170-3700 mcg/kg dan kadar akrilamida pada keripik singkong yang berasal dari pasar tradisional yaitu 1900-5500 mcg/kg lebih besar dari kadar akrilamida dalam keripik kentang yaitu 170-3700 mcg/kg.
5.2 Saran
DAFTAR PUSTAKA
BPOM. (2002). Akrilamida dalam Makanan. Info POM. Vol 3(8): 2.
Brown, P., dan K. DeAntonis. (1997). High-Performance Liquid Chromatography. Dalam: Settle, F.A., editor. Handbook of Instrumental Techniques for Analytical Chemistry. New Jersey: Prentice-Hall, Inc. Halaman 149-154.
Castle, L. (2006). Analysis for Acrylamide in Foods. Dalam: Skog, K., dan J.Alexander, editors. Acrylamide and Other Hazardous Compounds in Heat-Treated Foods. Cambridge: Woodhead Publishing, Ltd.: 121.
Christian, G. D., (1994). Analytical Chemistry. 5th Edition. John Wiley & Sons. Page 52.
De Lux Putra, E., (2004). Kromatografi Cair Kinerja Tinggi dalam Bidang Farmasi. Medan: USU Digital Library. Hal 5-8.
Ditjen POM. (1995). Farmakope Indonesia. Edisi Keempat. Jakarta: Departemen Kesehatan RI. Hal 1009-1011.
Dong, M. W. (2006). Modern HPLC for practicing scientists. New York: John Wiley and Sons: 26
FAO dan WHO. (2002). Health Implications of Acrylamide in Food: Report of a Joint FAO/WHO Consultation; 2002: Jun 25-27; Geneva, Switzerland.WHO Headquarters: 12-13.
Friedman, M. (2003). Chemistry, Biochemistry and Safety of Acrylamide: a Review. Journal of Agricultural and Food Chemistry 51: 4505, 4507, 4509-4510.
Gökmen, V., dan H.Z. Senyuva. (2008). Acrylamide in Heated Foods. Dalam:Gilbert, J., dan H.Z. Senyuva, editors. Bioactive Compounds in Foods. Chichester: Blackwell Publishing: 254, 257-259, 273.
Harahap, Y. (2006). Pembentukan Akrilamida dalam Makanan dan Analisisnya. Majalah Ilmu Kefarmasian III(3): 107-116.
Harmita. (2004). Petunjuk Pelaksanaan Validasi Metode dan Cara Perhitunganya. Review Artikel. Majalah Ilmu Kefarmasian. Vol 1(3): 117-135.
Leung, R.W.M., Pandey, R.N., dan B.S. Das. (1987). Determination of Polyacrylamides in Coal Washery Effluents by Ultrafiltration/Size-Exclusion Chromatography-Ultraviolet Detection Techniques. Environmental Science Technology 21(5): 476-481.
Levita, J., Indriyati, W. dan Muchtaridi. (2006). Study of The Formation of Acrylamide in Fried Cassava with Coconut Oil, Palm Oil and Corn Oil as Cooking Media: 2, 3.
Liu, P.Y., Zhang, L., dan L. Liu. (2008). Determination of Acrylamide in Potato Chips by High-Performance Liquid Chromatography Coupled to Diode Array Detection. Chemical Journal on Internet 10(2): 9.
http://www.chemistrymag.org/cji/2008/102009pe.htm [9 April 2008]
Meyer, V.R. (2004). Practical High-Perfomance Liquid Chromatography. Chichester: John Wiley and Sons Inc. Page 4.
Mottram, D.S., Low, M.Y., dan J.S. Elmore. (2009). The Maillard Reaction and Its Role in The Formation of Acrylamide and Other Potentially Hazardous Compounds in Foods. Dalam: Sahin, S., dan S.G. Sumnu, editors. Advances in Deep-Fat Frying of Foods. Boca Raton: CRC Press. Halaman 7-9.
Ötles et al. (2004). Acrylamide in Food. Electronic Journal of Enviromental, Agricultural and Food Chemistry: 723, 724, 725,726.
Rohman, A. (2007). Kimia Farmasi Analisis. Cetakan Pertama. Yogyakarta. Pustaka Pelajar: 378-384, 386-397, 465-469.
Rohman, A. (2009). Kromatografi untuk Analisis Obat. Edisi I. Yogyakarta. Pustaka Pelajar: 117-120.
Rothweiler, B., et al. (2004). Gas Chromatography/Mass Spectrometry Approaches to the Analysis of Acrylamide in Foods. Germany: Waldbronn.
Takatsuki, S., et al. (2002). Determination of Acrylamide in Processed Foods by LC/MS Using Column Switching. Japan: J. Food Hyg Soc.
Tanseri, L. (2010). Pengaruh Suhu Terhadap Kadar Akrilamida Dalam Kentang Goreng Simulasi: 34, 35.
Lampiran 1. Kromatogram Penyuntikan Akrilamida Baku untuk Mencari Komposisi Fase Gerak yang Optimum pada Analisis
Komposisi fase gerak asetonitril : aquabidest : asam fosfat 10% (5:94:1)
Lampiran 1. (lanjutan)
Komposisi fase gerak asetonitril : aquabidest : asam fosfat 10% (15:84:1)
Lampiran 1. (lanjutan)
Komposisi fase gerak asetonitril : asam fosfat 21,7 mM (15:85)
Lampiran 1. (lanjutan)
Lampiran 2. Kromatogram Penyuntikan Sampel untuk Orientasi
Sampel dengan komposisi fase gerak asetonitril : aquabidest : asam fosfat 10% (20:79:1)
Lampiran 2. (lanjutan)
Sampel dengan komposisi fase gerak asetonitril : asam fosfat 21,7 mM (15:85)
Lampiran 2. (lanjutan)
Sampel dengan komposisi fase gerak asetonitril : asam fosfat 21,7 mM (5:95)
Lampiran 3. Kromatogram Hasil Penyuntikan Larutan Akrilamida Baku pada Pembuatan Kurva Kalibrasi
A.
B.
Lampiran 3. (lanjutan) D.
E.
Lampiran 3. (lanjutan) G.
H.
Lampiran 3. (lanjutan) J.
K.
Lampiran 3. (lanjutan) M.
N.
Lampiran 3. (lanjutan) P.
Q.
Lampiran 3. (lanjutan)
Lampiran 4. Perhitungan Persamaan Regresi dari Kurva Kalibrasi Akrilamida Baku yang Diperoleh dengan KCKT pada Panjang Gelombang 230 nm
Data Hasil Penyuntikan Larutan Akrilamida Baku yang Diperoleh dengan KCKT
No. Konsentrasi (mcg/ml) Luas Area
1 0,1 17.223,667
2 1,6 73.037,0000
3 2,4 99.377,6667
4 3,2 124.227,3333
5 4,8 179.312,3333
[image:80.595.106.518.416.623.2]5 5,2 189.953,6667
Tabel Konsentrasi (X) vs Luas Area (Y) untuk Akrilamida Baku
No. X Y XY X2 Y2
1 0,1 17.223,6667 1.722,3667 0,01 296.654.694,5927 2 1,6 73.037,000 116.859,2000 2,56 5.334.403.369,000 3 2,4 99.377,6667 238.506,4001 5,76 9.875.920.638,7363 4 3,2 124.227,3333 397.527,4666 10,24 15.432.430.338,8293 5 4,8 179.312,3333 860.699,1998 23,04 32.152.912.873,4903 6 5,2 189.953,6667 987.759,0668 27,04 36.082.395.492,7747 ∑ 17,3 683.131,6667 2.603.073,7000 68,65 99.174.717.407,4232
Lampiran 4. (lanjutan) a =
(
X)
(
X)
nn Y X XY / / . 2 2
∑
∑
∑
∑
∑
− − = 6 / ) 3 , 17 ( 65 , 68 6 / 6667 , 683131 . 3 , 17 7 , 2603073 2 − − = 7683 , 18 3944 , 633377 = 33747,1305= a + b
b = - a
= 113855,2778 – 33747,1305 . 2,8833 = 16551,0515
Sehingga diperoleh persamaan garis regeresi
Y= 33747,1305X + 16551,0515
Untuk mencari hubungan linier antara konsentrasi (X) dengan luas area (Y) maka dihitung koefisien korelasi (r) sebagai berikut
r =
( )
(
)
[
X X n]
[
( )
Y( )
Y n]
n Y X XY / . / / . 2 2 2 2
∑
∑
∑
∑
∑
∑
∑
− − − =( )
Lampiran 5. Kromatogram Hasil Penyuntikan Larutan Sampel Qtela A.
B.
Lampiran 5. (lanjutan) D.
E.
Lampiran 5. (lanjutan)
Lampiran 6. Analisis Data secara Statistik dari Hasil Penyuntikan Larutan Sampel Qtela
SD =
(
)
1 2 − −
∑
n X X = 1 6 2664 , 0− = 0,23082
Pada interval kepercayaan 95% dengan nilai α = 0,05, dk = 5 diperoleh nilai ttabel
= 2,57. Data diterima bila –ttabel < thitung < ttabel.
thitung =
n SD X X / −
thitung 1 : -0,1829/0,09423 = -1,9410
thitung 2 : 0,0791/0,09423 = 0,8394
thitung3 : 0,0701/0,09423 = 0,7439
thitung4 : 0,3916/0,09423 = 4,1558 (ditolak)
thitung 5 : -0,2254/0,09423 = -2,3920
thitung 6 : -0,1327/0,09423 = -1,4082
N0 Kadar (mcg/g) Luas Puncak (X- ) (X- )2
X y
1 0,7501 26573 -0,1829 0,0334
2 1,0121 30819 0,0791 0,0063
3 1,0031 29460 0,0701 0,0049
4 1,3246 34545 0,3916 0,1534
5 0,7076 25617 -0,2254 0,0508
6 0,8003 27615 -0,1327 0,0176
= 5,5978
Lampiran 6. (lanjutan)
SD =
(
)
1 2 − −
∑
n X X = 1 5 082336 , 0− = 0,1435
Pada interval kepercayaan 95% dengan nilai α = 0,05, dk = 4 diperoleh nilai ttabel
= 2,78. Data diterima bila –ttabel < thitung < ttabel.
thitung =
n SD X X / −
thitung 1 :-0,1045/0,06418 = -1,6282
thitung2 : 0,1575/0,06418 = 2,454
thitung3 : 0,1485/0,06418 = 2,3138
thitung4 : -0,1470/0,06418 = -2,2904
thitung5 : -0,0543/0,06418 = -0,8461
(semua data diterima)
Kadar akrilamida (µ) = ± (ttabel x SD/ )
= 0,8546 ± (2,78 x 0,1435/2,2361) = 0,8546 ± 0,1784
N0 Ka