PENGEMBANGAN PADI GOGO INDICA TOLERAN
KEKERINGAN MELALUI TRANSFORMASI
GENETIK GEN REGULATOR HD-ZIP OSHOX6 DAN
SELEKSI POPULASI PADI MENGANDUNG MARKA
GENETIK QTL 12.1.
ENUNG SRI MULYANINGSIH
SEKOLAH PASCA SARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI DISERTASI DAN
SUMBER INFORMASI
Dengan ini saya menyatakan bahwa disertasi Pengembangan Padi Gogo
Indica Toleran Kekeringan melalui Transformasi Genetik Gen Regulator HD-Zip
Oshox6 dan Seleksi Populasi Padi yang Mengandung Marka Genetik QTL 12.1 adalah karya saya dengan arahan dari komisi pembimbing dan belum diajukan
dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang
berasal atau dikutip dari karya yang diterbitkan dari penulis lain telah disebutkan
dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir disertasi ini.
Bogor, Januari 2011
Enung Sri Mulyaningsih
ABSTRACT
ENUNG SRI MULYANINGSIH. Development of Drought Tolerance Upland Indica Rice by Genetic Transformation of HD-Zip oshox6 Regulator Gene and Through Selection on Rice Population Harboring Genetic Marker QTL 12.1. Under direction of HAJRIAL ASWIDINNOOR, DIDY SOPANDIE, INEZ H. SLAMET-LOEDIN, and PIETER B.F. OUWERKERK
Drought is the main factor affecting rice productivity in sub-optimal dryland. Therefore, a drought tolerance upland rice cultivar is needed for extensification purposes. Two approaches to generate drought tolerance rice plants have been carried out in this research. First is a genetic transformation and the second is selection for drought tolerance on rice population harboring genetic marker qtl 12.1 in the field. In the first approach, a regulator gene of HD-Zip Oshox6 under a drought inducible OsLEA promotor, has been transformed into Batutegi and Kasalath cultivars. A number of 12 independent lines of each cultivar having one to four copy numbers have been produced. The inserted gene has been observed to follow Mendelian segregation (3:1). Based on the evaluation results of drought stress in the greenhouse, transpiration rate of Batutegi and Kasalath cultivars began to drop in FTSW value of 0.2 and 0.3 respectively, which indicates severe stress. Integration of oshox-6 gene in Batutegi cultivar had no significant effects on the Ψd, RWC and praline content between transgenic and non-transgenic plants. Effects of oshox-6 gene integration are more evident in the Kasalath cultivar at the end of drought period. Character selection to obtain tolerance lines of transgenic plants were: scoring of leaves performance under drought, NTR, Ψd, and RWC, while the proline content was excluded. The transgenic lines of Batutegi (tolerant) and Kasalath (moderate) have self-defense responses most probably through avoidance. Yield of transgenic plants after drought in a pot test is an early indication of plants normality. Futher evaluation needs to be done in the rain-free screen house facility or field. Results of selection in the field in 2008 from F7 rice population harboring genetic marker qtl 12.1 and without marker qtl. 12.1, 21 lines have been selected (13 lines with qtl and 8 lines without qtl). In 2009, 12 moderate genotypes and one tolerant genotype from severe stress were obtained. These lines have high adaptability to the environment. Selection of drought tolerant genotype based on qtl 12.1 marker was not effective. The presence or absence of qtl 12.1 was not restricted with drought tolerance in the lines selected. The reference genotypes, Qtl 71(+) and Qtl 98(+), that were tested in the greenhouse had a defense response most probably through avoidance (by keeping the Ψd and RWC). The FTSW drought test method could differentiate different level of drought stress and drought tolerance of plants. There was drought tolerance correlation in the field and in the greenhouse based on data from selected genotypes of Qtl 71(+) and Qtl 98(+). The FTSW drought evaluation method in the greenhouse can represent the real drought stress condition in the field.
RINGKASAN
ENUNG SRI MULYANINGSIH. Pengembangan Padi Gogo Indica Toleran Kekeringan melalui Transformasi Genetik Gen Regulator HD-Zip Oshox6 dan Seleksi Populasi Padi yang Mengandung Marka Genetik QTL 12.1. Dibimbing oleh HAJRIAL ASWIDINNOOR, DIDY SOPANDIE, INEZ H. SLAMET-LOEDIN, dan PIETER B.F. OUWERKERK.
Pada tahun 2009, konsumsi beras Indonesia mencapai 139 kg per orang per tahun melebihi rata-rata dunia (60 kg per orang per tahun). Dengan laju pertumbuhan penduduk rata-rata 1,4% per tahun, kebutuhan beras Indonesia pada tahun 2030 mencapai 44 juta ton. Kebutuhan yang demikian besar tanpa diimbangi oleh produksi dikhawatirkan akan menyebabkan kerawanan pangan. Tuntutan produksi yang besar tidak terlepas dari berbagai permasalahan yang menyebabkan produktivitas padi menurun. Permasalahan tersebut antara lain penyempitan areal lahan sawah, sumber air berkurang, dan perubahan iklim ekstrim akibat pemanasan global. Fenomena perubahan iklim ekstrim antara lain kemarau panjang yang menyebabkan cekaman kekeringan.
Disisi lain Indonesia memiliki lahan kering yang mencapai 51 juta ha dan belum dimanfaatkan maksimal. Oleh karena itu, ekstensifikasi ke lahan kering merupakan pilihan potensial sebagai upaya memenuhi kebutuhan beras. Kultivar padi yang tepat diaplikasikan pada lahan tersebut ialah padi gogo. Namun demikian, cekaman kekeringan menjadi salah satu kendala di lahan padi gogo. Anomali iklim yang lebih sering terjadi dan tidak dapat diprediksi menyebabkan periode kekeringan lebih lama. Oleh karena itu perlu dikembangkan kultivar padi gogo toleran kekeringan untuk mengantisipasi perubahan iklim agar bisa dimanfaatkan maksimal di lahan gogo. Selain itu, galur yang dihasilkan juga dapat digunakan untuk bahan persilangan dengan padi sawah guna mengantisipasi cekaman kekeringan yang terjadi di lahan sawah atau lahan tadah hujan.
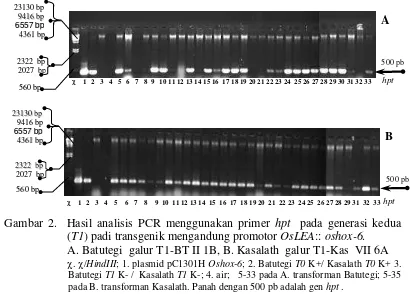
Padi toleran kekeringan dapat diperoleh melalui persilangan dengan seleksi menggunakan marka molekuler dan transformasi genetik. Transformasi gen regulator faktor transkripsi (FT) berpeluang untuk mendapatkan tanaman padi toleran kekeringan. FT akan meregulasi sejumlah gen lain yang bertanggung jawab terhadap toleransi kekeringan. Gen FT yang digunakan dalam penelitian ini ialah HD-Zip Oshox6 (Homeodomain leucine zipper Oryza sativa homeobox). Gen ini responsif terhadap cekaman kekeringan. Gen ini dikendalikan oleh promotor terinduksi kekeringan (OsLEA/ late embryogenesis abundant). Promotor OsLEA::Oshox6 berada dalam plasmid pC1301H oshox-6 dan ditransformasikan ke dalam genom tanaman padi cv. Batutegi dan Kasalath. Diperoleh masing-masing 12 galur independen dari cv. Batutegi dan Kasalath, dengan jumlah salinan gen sisipan antara 1-4. Gen sisipan yang terintegrasi diwariskan secara Mendel (3:1) berdasarkan hasil PCR dan ekpresi gen hpt pada daun tanaman transgenik cv. Batutegi dan Kasalath.
transpirasi cv. Batutegi mulai turun pada nilai FTSW 0,2 dan pada cv. Kasalath 0,3. Kedua nilai FTSW menunjukkan tingkat cekaman berat.
Berdasarkan tingkat skoring kekeringan daun dan nilai NTR serta FTSW diperoleh 3 galur Batutegi transgenik toleran dan satu galur moderat toleran. Integrasi gen oshox-6 pada cv. Batutegi secara statistik tidak berbeda nyata untuk karakter Ψd, RWC dan kandungan prolin diantara transgenik dengan kontrol (WT). kenaikan nilai pengamatan ke arah karakter toleransi kecil antara BT-WT dengan transgenik. Diduga karena cv. Batutegi adalah kultivar unggul dan moderat toleran terhadap cekaman kekeringan sehingga pengaruh gen sisipan kecil. Pada cv. Kasalath diperoleh 5 galur toleran kekeringan dan satu moderat toleran. Pengaruh gen oshox6 terhadap toleransi kekeringan nyata pada cv. Kasalath di akhir periode kekeringan (30 hsk) di bandingkan pada cv. Batutegi.
Karakter pengamatan yang bisa dijadikan karakter seleksi pada galur-galur transgenik (cv. Batutegi dan cv. Kasalath) untuk mendapatkan galur toleran ialah skoring kekeringan daun, nilai NTR, Ψd dan RWC, sementara kandungan prolin tidak dapat dijadikan karakter seleksi. Galur-galur yang dianggap toleran dan moderat cenderung tidak menunjukkan peningkatan prolin di akhir periode kekeringan. Berdasarkan percobaan ini, galur-galur transgenik Batutegi dan Kasalath toleran dan moderat cenderung memiliki respon pertahanan diri melalui mekanisme penghindaran, dan untuk mekanisme pertahanan lainnya perlu dievalusi lebih lanjut.
Nilai produksi tanaman transgenik setelah uji kekeringan dalam pot merupakan indikasi awal normalitas tanaman. Percobaan pot lebih ditujukan untuk melihat parameter fisiologis. Seleksi galur unggul perlu dilakukan di fasilitas rumah kasa bebas hujan atau lapang. Berdasarkan pengamatan terhadap karakter agronomi, terjadi kenaikan bobot gabah per rumpun, biomassa kering dan jumlah gabah bernas per malai ketika terjadi kekeringan pada galur T1-BT II.1A, T1-BT II.2A, T1-BT III.1A, dan T1-Kas. IV.1A, galur-galur ini merupakan galur potensial unggul.
Galur toleran kekeringan dalam penelitian diperoleh juga melalui seleksi terhadap populasi hasil persilangan cv. Vandana x Way rarem. Pada generasi F3 diketahui bahwa segregan persilangan ada yang mengandung marka qtl 12.1 (quantitatif trait loci) dan ada yang tidak mengandung marka. Marka ini mampu mempertahankan hasil ketika terjadi cekaman kekeringan berat pada fase reproduktif menjelang berbunga. Sebanyak 100 genotipe F7 diuji kekeringan pada MK 2008 terpilih 21 genotipe untuk di uji kembali pada MK 2009.
Hasil seleksi menunjukkan bahwa karakter jumlah anakan produktif sulit dijadikan karakter seleksi karena perlakuan cekaman kekeringan dilakukan ketika jumlah anakan maksimum (menjelang fase generatif). Karakter jumlah anakan produktif sulit dijadikan karakter seleksi pada populasi hasil persilangan Vandana x Way rarem. Sementara bobot gabah per umpun, tinggi tanaman, jumlah gabah bernas per malai, bobot gabah per petak (plot), waktu berbunga, indeks panen, indeks sensitivitas kekeringan dapat menjadi karakter seleksi dalam memilih galur-galur potensial toleran dan produktivitas tinggi.
tersebut memiliki daya adaptasi tinggi terhadap lingkungan, artinya jika ditanam pada lokasi tanpa cekaman maka produktivitas tinggi, dan ketika dalam lingkungan kekeringan, produktivitas tanaman masih cukup tinggi. Galur dengan daya adaptasi tinggi terhadap lingkungan akan bermanfaat jika ditanam di berbagai lokasi lahan kering dan dapat mengantisipasi kemungkinan kekeringan yang tidak dapat diprediksi.
Berdasarkan MK I dan MK II, seleksi genotipe potensial dan toleran kekeringan cukup berdasarkan data dari lingkungan normal dan cekaman berat berat, karena hasil pengamatan lingkungan normal tidak berbeda nyata dengan lingkungan cekaman sedang. Seleksi genotipe toleran kekeringan kurang efektif bila hanya berdasarkan kerberadaan marka qtl 12.1, karena genotipe unggul diperoleh pula dari genotipe yang tidak mengandung marka tersebut. Berdasarkan karakter-karakter seleksi yang digunakan dalam penelitian ini, sulit membedakan antara tanaman toleran dari genotipe yang memiliki marka qtl 12.1 dengan genotipe toleran yang tidak memiliki marka qtl 12.1.
Genotipe-genotipe pembanding QTL 71 (+) dan QTL 98(+) yang diuji kekeringan bersama dengan tanaman transgenik cenderung memiliki respon pertahanan diri penghindaran yaitu dengan mempertahankan Ψd dan RWC. Sementara karakter kandungan prolin tidak dapat dijadikan karakter seleksi. Genotipe-genotipe toleran kekeringan dari lapang diduga memiliki daya adaptasi luas, sehingga bisa ditanam diberbagai kondisi dan dapat mengantisipasi cekaman kekeringan yang tidak dapat diduga kejadiannya.
Hasil uji kekeringan di rumah kaca dengan tujuan memvalidasi metode uji kekeringan menunjukkan bahwa metode FTSW dapat membedakan tingkat cekaman dan tingkat toleransi tanaman yang terjadi selama percobaan. Semakin rendah nilai FTSW semakin berat cekaman yang terjadi. Nilai FTSW yang rendah mempengaruhi nilai normalisasi transpirasi (NTR), sehingga transpirasi semakin rendah. Hasil percobaan menujukkan bahwa tingkat cekaman yang terjadi bersifat berat yang terjadi pada fase reproduktif. Hasil skoring kekeringan daun dalam menentukan klasifikasi toleransi galur-galur tanaman selaras dengan nilai NTR dan FTSW.
Ada keselarasan tingkat toleransi kekeringan di lapangan dan di rumah kaca berdasarkan data dari genotipe terpilih Qtl 71 (+) dan Qtl 98(+) menunjukkan bahwa metode uji kekeringan FTSW di rumah kaca dapat representatif menggambarkan kondisi cekaman yang terjadi di lapangan.
C Hak Cipta milik IPB, tahun 2011
Hak Cipta dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB.
PENGEMBANGAN PADI GOGO INDICA TOLERAN
KEKERINGAN MELALUI TRANSFORMASI
GENETIK GEN REGULATOR HD-ZIP OSHOX6 DAN
SELEKSI POPULASI PADI YANG MENGANDUNG
MARKA GENETIK QTL 12.1.
ENUNG SRI MULYANINGSIH
Disertasi
sebagai salah satu syarat untuk memperoleh gelar Doktor pada
Program Studi Agronomi
SEKOLAH PASCA SARJANA
INSTITUT PERTANIAN BOGOR
Penguji pada Ujian Tertutup : Dr. Trikoesoemaningtyas Dr. Sobir
Judul Disertasi : Pengembangan Padi Gogo Indica Toleran Kekeringan melalui Transformasi Genetik Gen Regulator HD-Zip Oshox6 dan Seleksi Populasi Padi yang Mengandung Marka Genetik QTL 12.1.
Nama : Enung Sri Mulyaningsih NIM : A.161060061
Disetujui,
Komisi pembimbing
Dr. Ir. Hajrial Aswidinnoor, MSc Prof. Dr. Ir. Didy Sopandie, M.Agr
Ketua Anggota
Dr. Ir. Inez H. Slamet-Loedin Pieter B.F. Ouwerkerk. Ph.D
Anggota Anggota
Mengetahui,
Ketua Program Studi Dekan Sekolah Pasca Sarjana Agronomi,
Dr. Ir. Munif Ghulamahdi MS Prof. Dr. Ir. Khairil A. Notodiputro, MSc
PRAKATA
Puji syukur penulis panjatkan ke khadirat Allah SWT, atas segala rahmat dan karuniaNya hingga penulis dapat menyelesaikan disertasi ini. Penelitian dilaksanakan mulai Oktober 2007-Mei 2010, di Pusat Penelitian Bioteknologi LIPI, Puslit Biologi LIPI dan Kebun Percobaan Balai Penelitian Kacang dan Umbi, Probolinggo. Judul disertasi ialah Pengembangan Padi Gogo Indica Toleran Kekeringan melalui Transformasi Genetik Gen Regulator HD-Zip Oshox6 dan Seleksi Populasi Padi yang Mengandung Marka Genetik QTL 12.1.
Ucapan terima kasih dan penghargaan setinggi-tingginya kepada Dr. Ir. Hajrial Aswidinnoor, MSc, Prof. Dr. Ir. Didy Sopandie, M.Agr, Dr. Ir. Inez H. Slamet-Loedin dan Pieter B.F. Ouwerkerk. Ph.D selaku pembimbing atas segala saran, bimbingan, kritik dan nasehatnya selama penelitian dan penulisan disertasi. Terima kasih kepada Bapak Prof. Dr. Bambang Prasetya (Kepala Pusat Penelitian Bioteknologi-LIPI), atas kesempatan yang diberikan untuk menempuh pendidikan dan kepada Lembaga Ilmu Pengetahuan Indonesia (LIPI) atas beasiswa yang penulis terima.
Ucapan terimakasih disampaikan kepada Dr. Satya Nugroho dan Dr. Amy Estiati (Puslit Bioteknologi LIPI) atas bantuan bahan kimia, dan diskusi. Terimakasih kepada Dr. Paul Naiola dan Dr Nuril Hidayati (Puslit. Biologi LIPI) atas diskusi dan perkenannya menggunakan lab. Fisiologi cekaman.Terimakasih kepada Ir. Imam Sutrisno selaku Kepala KP-Balitkabi Probolinggo beserta staf (Bapak Robert dan Bapak Rohmin) atas segala bantuan selama penelitian lapang berlangsung. Terima kasih kepada Dr. Wien Kusharyoto (Puslit. Bioteknologi LIPI), Imam Sanjaya (Mahasiswa Statistik IPB) atas bantuan analisis grafik dan data. Terima kasih sebesar-besarnya kepada Oktri Yurika, Bapak Adang dan Bapak Tohar yang telah membantu penelitian di Lab. dan rumah kaca.
Terimakasih kepada semua teman di kelti padi atas dukungan dan pengertiannya. Terimakasih kepada teman-teman Agronomi, Biologi dan HPT IPB 2006 atas persahabatannya. Terimakasih untuk temanku Syamsidah Rahmawati dan Sri Hartati, serta semua rekan di Puslit. Bioteknologi LIPI yang tidak dapat penulis sebutkan satu persatu.
Dengan penuh rasa hormat, penulis mengucapkan terima kasih yang tulus kepada Bapak (Alm), Ibu (Alm), Bapak Mertua (Alm), Mamah mertua, kakak-kakak, adik-adik dan keponakan-keponakan di Bogor dan Jakarta atas doa, dorongan dan pengertiannya.
Dengan segenap kasih sayang, penulis mengucapkan terima kasih kepada suamiku dan sahabat hatiku Dr. Asrul Muhamad Fuad, MSc, atas doa, kasih sayang, semangat, kesabaran, kesetiaan, diskusi, dan sarannya. Untuk anak-anakku tersayang Kaka Akbar dan Dede Rizky, keberhasilan, canda tawa kalian akan selalu menjadi semangat Ibu….
Semoga Allah SWT melimpahkan balasan kepada semua pihak yang telah membantu penelitian dan penulisan disertasi ini. Semoga karya ilmiah ini bermanfaat untuk dunia ilmu pengetahuan.
RIWAYAT HIDUP
Penulis dilahirkan di Bogor pada tanggal 20 Agustus 1969 sebagai anak ke lima dari tujuh bersaudara dari pasangan Soekandi dan Mamah. Penulis menikah dengan Asrul Muhamad Fuad pada tahun 1997 dan dikaruniai dua orang putra yaitu Muhamad Akbar Fuad dan Muhamad Rizky Fuad.
Penulis menyelesaikan Diploma III Perbenihan IPB pada tahun 1991 dan tahun 1996 mendapatkan gelar Sarjana Pertanian dari Universitas Djuanda Bogor. Pada tahun 1999, penulis diterima di Program Studi Bioteknologi, Sekolah Pascasarjana IPB dan lulus pada tahun 2001 melalui program karyasiswa LIPI. Melalui program karyasiswa LIPI pula pada tahun 2006, penulis menempuh pendidikan S3 di program studi Agronomi IPB.
Penulis bekerja di Pusat Penelitian Bioteknologi LIPI sejak tahun 1992 dengan jenjang fungsional Peneliti Madya. Beberapa karya ilmiah yang merupakan bagian dari disertasi telah diterbitkan pada beberapa jurnal ilmiah nasional. Makalah tersebut ialah:
1. Perbandingan Tiga Metode Transformasi Agrobacterium untuk Pencarian Gen-gen Terkait Toleransi Kekeringan Menggunakan Transposon Ac/Ds pada padi cv. Batutegi di Jurnal Biologi Indonesia. Vol 6(3): 376-382.
2. Transformasi Padi Indica Kultivar Batutegi dan Kasalath dengan Gen Regulator HD-Zip untuk Perakitan Toleran Kekeringan diterbitkan pada Jurnal Agronomi Indonesia. Vol 38(1): 1-7.
DAFTAR ISI
DAFTAR TABEL ……… xiii
DAFTAR GAMBAR ……… xvi
DAFTAR SINGKATAN ……… xviii
PENDAHULUAN Latar Belakang ……… 1
Tujuan Penelitian ………. 5
Manfaat Penelitian ………. 5
Ruang Lingkup Penelitian ………. 6
TINJAUAN PUSTAKA Pengelompokkan Tanaman Padi ... 7
Lahan Marginal dan Cekaman Kekeringan pada Tanaman ... 8
Gen Regulator Faktor Transkripsi untuk Sifat Toleransi Kekeringan ... 10
Transformasi Genetik ... 12
Resistensi Tanaman terhadap Cekaman Kekeringan... 15
Lokus Sifat Kuantitatif (QTL) Cekaman Kekeringan ... 16
Uji Kekeringan ... 17
JUDUL 1. Pengujian Tiga Metode Transformasi Agrobacterium untuk Padi Gogo Indica cv. Batutegi dan Kasalath Abstrak ... 21
Abstract ………. 22
Pendahuluan ………... 22
Bahan dan Metode ………. 24
Hasil dan Pembahasan ……… 30
JUDUL 2. Transformasi Padi Indica Kultivar Batutegi dan Kasalath dengan Gen Regulator HD-Zip oshox6 untuk Perakitan padi Toleran Kekeringan
Abstrak ………. 36
Abstract ……… 37
Pendahuluan ………. 37
Bahan dan Metode ……… 38
Hasil dan Pembahasan ……….. 41
Kesimpulan ……… 45
JUDUL 3. Pewarisan gen penanda hpt (hygromycine phosphotransferase ) berdasarkan analisis PCR dan ekspresinya pada populasi padi transforman Mengandung gen HD Zip Oshox-6 Abstrak ………. 46
Abstract ……… 46
Pendahuluan ……….. 47
Bahan dan Metode ……… 50
Hasil dan Pembahasan ……….. 52
Kesimpulan ……….. 55
JUDUL 4. Penapisan Genotipe Padi Gogo Toleran Kekeringan dari Populasi Mengandung Marka qtl 12.1. Abstrak ……… 56
Abstract ……….. 57
Pendahuluan ……… 57
Bahan dan Metode ……….. 59
Hasil dan Pembahasan ……… 63
JUDUL 5. Uji kekeringan galur transgenik cv. Batutegi dan Kasalath mengandung gen regulator HD Zip Oshox-6 dan galur toleran kekeringan hasil seleksi di lapang
Abstrak ……… 75
Abstract ……… 76
Pendahuluan ……… 76
Bahan dan Metode ………. 78
Hasil dan Pembahasan ……… 84
Kesimpulan ………. 110
PEMBAHASAN UMUM ……….. 111
KESIMPULAN DAN SARAN ……….. 117
DAFTAR PUSTAKA ……… 120
DAFTAR TABEL
Halaman
1. Perbedaan dalam tiga teknik transformasi yang digunakan 28
2. Transformasi menggunakan metode B (Toki et al., 2006) 30 3. Efisiensi transformasi menggunakan metode C dengan
plasmid pNU400 (Hiei dan Komari, 2006)
31
4. Efisiensi transformasi menggunakan metode C dengan plasmid pUR224 (Hiei dan Komari, 2006)
31
5. Hasil analisis integrasi gen hpt dan gusA pada cv. Batutegi dan Kasalath
33
6. Hasil analisis Southern blot cv. Batutegi dan Kasalath menggunakan DNA pelacak hpt
34
7. Transformasi pC1301H oshox-6 pada cv. Batutegi dan Kasalath 42
8. Integrasi gen sisipan (PLEA + oshox6) pada generasi pertama (T0) padi cv. Batutegi dan Kasalath menggunakan primer dan pelacak hpt
45
9. Analisis pewarisan untuk karakter keberadaan gen hpt dalam genom dan ekspresi hpt pada populasi tanaman transgenik cv. Batutegi dan Kasalath generasi kedua (T1).
54
10. Genotipe terpilih berdasarkan percobaan MK 2008 dan digunakan dalam percobaan MK 2009.
62
11. Rangkuman analisis keragaman perlakuan genotipe, perlakuan kekeringan dan interaksinya pada karakter jumlah anakan produktif, bobot gabah per plot dan jumlah gabah bernas per malai genotipe terpilih, Muneng, MK 2008.
63
12. Hasil uji lanjut faktor lingkungan terhadap karakter anakan produktif, bobot gabah per plot dan jumlah gabah bernas/ malai genotipe terpilih, Muneng, MK 2008.
64
13. Hasil genotipe terpilih dan kultivar pembanding untuk karakter jumlah anakan produktif, jumlah gabah bernas per malai, bobot gabah per plot, berdasarkan uji Tukey, Muneng, MK 2008.
14. Rangkuman nilai analisis keragaman perlakuan genotipe, perlakuan kekeringan dan interaksinya pada semua karakter pengamatan dari genotipe terpilih, Muneng, MK 2009.
66
15. Hasil uji lanjut faktor lingkungan terhadap semua karakter dari genotipe terpilih, Muneng, MK 2009.
67
16. Hasil uji lanjut faktor genotipe untuk karakter bobot gabah per rumpun, tinggi tanaman, waktu berbunga 50%, jumlah anakan produktif dan jumlah gabah bernas per malai, genotipe terpilih, Muneng MK 2009.
68
17. Uji lanjut interaksi bobot gabah per petak genotipe terpilih, Muneng MK 2009.
71
18. Rata-rata hasil gabah, nilai indeks kepekaan genotipe, peringkat hasil dan indeks panen pada kondisi normal dan tercekam dari genotipe terpilih, Muneng, MK 2009.
73
19. Nilai skoring kekeringan daun pada galur-galur transgenik dan kultivar pembanding
85
20. Nilai NTR dan FTSW pada galur-galur transgenik Batutegi dan Kasalath terhadap kultivar-kultivar pembanding
86
21. Rangkuman nilai analisis keragaman perlakuan genotipe, lingkungan dan interkasinya pada semua peubah fisiologis cv. Batutegi.
92
22. Nilai potensial air daun (Ψd) 7 hsk, kandungan air relatif
(RWC) 7 hsk dan 45 hsk pada cv. Batutegi.
93
23. Rerata Potensial air daun (Ψd), kandungan air relatif (RWC), dan kandungan prolin pada galur transgenik cv. Batutegi dan tanaman pembanding.
95
24. Rangkuman nilai analisis keragaman perlakuan genotipe, lingkungan dan interkasinya pada semua peubah fisiologis cv. Kasalath
97
25. Uji lanjut faktor lingkungan untuk karakter pengamatan kandungan air relatif (RWC) 7 hsk cv. Kasalath
97
26. Nilai potensial air daun (Ψd), kandungan air relatif (RWC), dan kandungan prolin pada beberapa galur transgenik cv. Kasalath dan tanaman pembanding
27. Rangkuman nilai analisis keragaman perlakuan genotipe, lingkungan dan interaksinya pada peubah agronomi cv. Batutegi
100
28. Hasil uji lanjut faktor genotipe, galur transgenik cv. Batutegi dan genotipe pembanding untuk karakter bobot gabah per rumpun, jumlah anakan produktif, jumlah gabah bernas per malai, waktu berbunga, biomasa kering tanaman dan tinggi tanaman berdasarkan uji Tukey.
101
29. Rangkuman nilai analisis keragaman perlakuan genotipe, lingkungan dan interaksinya pada peubah agronomi cv. Kasalath transforman
104
30. Hasil uji lanjut faktor genotipe, galur transgenik cv. Kasalath dan genotipe pembanding untuk karakter bobot gabah per rumpun, jumlah anakan produktif, jumlah gabah bernas per malai, biomasa kering tanaman dan tinggi tanaman berdasarkan uji Tukey.
105
31 Hasil Hasil uji lanjut faktor lingkungan, galur transgenik cv. Kasalath dan genotipe pembanding untuk karakter waktu berbunga dan panjang akar
DAFTAR GAMBAR
Halaman
1. Struktur gen regulator HD-Zip. 11
2. Tipe kurva respon tanaman kacang tanah JL24 terhadap cekaman kekeringan dengan metode uji kekeringan FTSW
20
3. Daerah T-DNA dalam vektor transformasi pNU400 dan pUR224.
25
4. Ekspresi GFP dari transforman plasmid pNU400 pada cv. Kasalath dan Batutegi
32
5. Hasil analisis PCR menggunakan primer hpt dan gusA pada padi cv. Batutegi dan kasalath
33
6. Hasil analisis Southern pada cv. Batutegi (A) dan Kasalath (B) denganDNA pelacak hpt.
35
7. Skema daerah T-DNA dalam vektor transformasi pC1301H Oshox-6.
39
8. Kegiatan transformasi dan regenerasi kultivar Batutegi dan Kasalath
42
9. Hasil analisis PCR menggunakan primer hpt pada populasi Batutegi dan Kasalath hasil transformasi menggunakan pC1301H oshox-6.
44
10. Hasil analisis Southern blot menggunakan pelacak hpt pada populasi Batutegi (a) dan Kasalath (b) hasil transformasi menggunakan pC1301H oshox-6.
45
11. Skema daerah T-DNA dalam vektor transformasi pC1301H Oshox-6.
50
12. Hasil analisis PCR menggunakan primer hpt pada generasi kedua (T1) tanaman padi transgenik mengandung pC1301H oshox-6 pada cv. Batutegi galur T1-BT II 1B (A) dan Kasalath galur T1-Kas VII 6A (B)
52
13. Hasil Uji higromisin pada daun tanaman. 54
14. Hubungan transpirasi harian (NTR) terhadap waktu perlakuan kekeringan.
15. Hubungan fraksi transpirasi air tanah (FTSW) terhadap waktu perlakuan kekeringan
89
16. Kurva hubungan antara nilai laju transpirasi harian (NTR) terhadap laju penurunan fraksi traspirasi air tanah (FTSW).
91
17. Galur-galur transgenik Batutegi dan Kasalath yang merupakan kandidat galur unggul.
PENDAHULUAN
Latar Belakang
Padi ialah pangan utama yang dikonsumsi sebagain besar penduduk di
dunia terutama Asia. Konsumsi beras Indonesia mencapai 139 kg per orang per
tahun (teringgi dunia) jauh di atas rata-rata konsumsi beras dunia sebesar 60 kg
per orang per tahun (FAO 2009). Dengan laju pertumbuhan penduduk rata-rata
1,4% per tahun (BPS 2006), maka kebutuhan beras Indonesia pada tahun 2030
mencapai 44 juta ton. Pada tingkat dunia diperlukan peningkatan produksi padi
sebesar 40% dalam 25 tahun mendatang (Bernier et al. 2008). Kebutuhan yang demikian besar tanpa diimbangi oleh produksi dikhawatirkan akan menyebabkan
kerawanan pangan.
Tuntutan produksi yang besar tidak lepas dari berbagai permasalahan yang
seringkali menyebabkan turunnya produktivitas padi secara nasional maupun
dunia. Permasalahan tersebut antara lain penyempitan areal lahan sawah akibat
konversi fungsi lahan, berkurangnya sumber air, dan perubahan iklim ekstrim
akibat pemanasan global. Fenomena perubahan iklim ekstrim antara lain kemarau
panjang, sehingga Burke et al. (2006) memprediksi luas lahan kering akan terus meningkat di masa mendatang dan persentase lahan kering dunia meningkat dua
kali pada periode 1970 hingga awal tahun 2000.
Di Pulau Jawa dan Bali pada periode 1979-2004 menunjukkan penundaan
musim tanam hingga 30 hari akibat gejala alam El Nino, dan penurunan hasil
mencapai 11% (~540 ribu ton). Analisis model iklim memproyeksikan
keterlambatan hujan akan semakin sering terjadi di Jawa dan Bali (Naylor et al. 2007). Kejadian El Nino tahun 1997/1998 menyebabkan volume impor beras
Indonesia mencapai 5,8 juta ton yang setara dengan 20% dari total perdagangan
beras dunia. Musim kemarau panjang tahun 2006 juga menyebabkan sebagian
besar lahan pertanaman padi gagal panen dan membuka kembali impor beras.
Kedaan ini bukan saja melanda Indonesia, yang secara geografis dipengaruhui
oleh iklim makro di sekitar wilayahnya tetapi juga dirasakan secara global.
Disisi lain Indonesia memiliki lahan-lahan sub optimal potensial, salah
satunya lahan kering. Luas lahan kering Indonesia mencapai 51 juta ha (Ar-Riza
lahan kering merupakan pilihan potensial sebagai upaya memenuhi kebutuhan
beras. Kultivar padi yang tepat diaplikasikan pada lahan tersebut ialah padi gogo.
Meskipun secara umum produktivitas padi gogo masih rendah dibandingkan padi
sawah, namun keberadaannya bisa menjadi solusi guna mengoptimalkan lahan
kering sebagai substitusi lahan sawah yang terkonversi. Namun demikian,
cekaman kekeringan menjadi salah satu kendala di lahan padi gogo. Anomali
iklim yang lebih sering terjadi dan tidak dapat diprediksi menyebabkan periode
kekeringan lebih lama. Oleh karena itu perlu dikembangkan kultivar padi gogo
toleran kekeringan untuk mengantisipasi perubahan iklim agar bisa dimanfaatkan
maksimal di lahan gogo. Selain itu, tingkat pendapatan petani lahan gogo
umumnya lebih rendah dari petani lahan sawah sehingga secara sosial sangat
rentan terhadap kemungkinan gagal panen akibat kekeringan. Galur padi gogo
toleran yang dihasilkan juga dapat digunakan untuk bahan persilangan dengan
padi sawah guna mengantisipasi cekaman kekeringan yang terjadi di lahan sawah
atau lahan tadah hujan.
Padi toleran kekeringan dapat diperoleh melalui persilangan biasa,
persilangan dengan seleksi menggunakan marka molekuler, dan transformasi
genetik. Hal yang penting dalam pengembangan ini ialah memahami mekanisme
toleransi kekeringan karena sifat ini disandikan oleh banyak gen. Shinozaki dan
Yamaguchi (2007) mengelompokkan gen-gen ini dalam dua grup. Pertama ialah
gen-gen terkait dengan perlindungan sel selama kekeringan (menjaga tekanan
osmotik, perbaikan sel, detoksifikasi dan adaptasi struktural) dan kedua terkait
dengan mekanisme regulasi respon terhadap kekeringan (protein kinase,
enzim-enzim terkait metabolisme phosphoinositide, dan faktor transkripsi (FT)).
Gen-gen tersebut ada yang ekspresinya tergantung ABA (asam absisik) dan ada yang
tidak (Yamaguchi-Shinozaki dan Shinozaki 2005).
Transformasi genetik pada level FT berpeluang untuk mendapatkan
tanaman padi toleran kekeringan, karena FT berperan dalam meregulasi sejumlah
gen lain yang bertanggung jawab terhadap sifat kekeringan. Beberapa gen
AP39 (Oh et al 2009), PeSCL7 (Ma et al. 2010) dan HD-Zip (Homeodomain leucine zipper) (Meijer et al. 1997; Meijer et al. 2000). Peningkatan ekspresi gen-gen regulator ini pada berbagai tanaman dapat meningkatkan toleransi cekaman
kekeringan (Scarpella et al. 2005; Hu et al. 2006).
Beberapa bukti menunjukkan bahwa HD-Zip terkait dengan adaptasi
perkembangan tanaman terhadap cekaman lingkungan. Gen HD-Zip oshox (Oryza sativa homeobox) tanaman padi terdiri dari 33 gen, dikelompokkan dalam famili I, II, III yang posisinya tersebar dalam 12 kromosom. Dari jumlah tersebut baru
dua gen oshox yang telah diidentifikasi yaitu oshox1 (HD-Zip II) dan oshox4 (HD-Zip I) (Agalou et al. 2008). Gen oshox6 termasuk HD-Zip I yang responsif kekeringan, regulasinya meningkat ketika ada cekaman kekeringan, namun
karakterisasi fungsi gen ini belum dipelajari (Agalou et al. 2008).
Perakitan tanaman transgenik dengan menggunakan gen regulator FT
untuk cekaman kekeringan umumnya menggunakan promotor konstitutif seperti
35S CaMV (Cauliflower Mosaic Virus). Penggunaan promotor tersebut sering menyebabkan tanaman menjadi kerdil, steril dan berbunga lambat (Jaglo-Ottosen
et al. 1998; Kasuga et al. 1999; Purwantomo 2007, Pino et al. 2007). Penggunaan promotor terinduksi kekeringan menjadi dasar pertimbangan karena promotor ini
akan bekerja mengekspresi gen targetnya hanya jika ada induser. Beberapa
promotor terinduksi kekeringan yang telah digunakan antara lain: HVA22, RD29A, dan OsLEA (Xiao et al. 2009; Kasuga et al. 2004; Xiao et al. 2007). Dalam penelitian digunakan promotor terinduksi cekaman kekeringan OsLEA (late embryogenesis abundant) yang memiliki ekspresi kuat pada kondisi kekeringan dan rendah pada saat kondisi normal (Xiao et al. 2007). Gen Oshox6 dikendalikan promotor OsLEA dalam plasmid yang dinamankan pC1301H oshox-6. Pada daerah T-DNA plasmid tersebut terdapat gen penyeleksi hpt (hygromycin phosphotransferase) dan penanda gusA yang keduanya dikendalikan promotor 35S CaMV.
Gen sisipan hasil transfornasi pada tanaman generasi pertama akan
terintegrasi di salah satu pasangan kromosom sehingga tetua bersifat hemizygous.
bersifat dominan dan terintegrasi pada satu lokus maka pola segregasi akan
mengikuti hukum Mendel dengan rasio 3:1.
Padi indica banyak dibudidayakan di Asia termasuk Indonesia, namun
keberhasilan transformasi genetiknya masih terbatas. Kebanyakan kultivar Indica
digolongkan pada indica grup I, yang sebagian besar merupakan kultivar
rekalsitran untuk kegiatan kultur jaringan dan transformasi (Zhang et al. 1998; Wunn et al. 1996). Pada padi Indica sering dijumpai kondisi transformasi dan regenerasi yang optimum untuk suatu genotipe tidak optimum untuk genotipe
lain. Oleh karena itu, sistem transformasi dan regenerasi tanaman yang efisien dan
dapat diulang sangat diperlukan untuk menghasilkan tanaman transgenik.
Kegiatan persilangan tanaman padi telah lama dilakukan dan memberikan
sumbangan besar bagi terciptanya kultivar unggul. Kegiatan persilangan dengan
seleksi menggunakan marka molekuler dapat membantu seleksi lebih akurat.
Salah satu marka terkait sifat toleran kekeringan ialah marka qtl 12.1 (quantitative trait locus). International Rice Research Institute (IRRI) membuat persilangan padi gogo kultivar Vandana asal India dan Way rarem asal Indonesia. Pada
generasi F3 dilakukan seleksi menggunakan marka molekuler qtl 12.1. Keberadaan marka qtl 12.1 mampu mempertahankan hasil ketika terjadi cekaman kekeringan berat pada fase reproduktif menjelang berbunga. Pada
kondisi tanpa cekaman, qtl 12.1 tidak berdampak nyata pada sejumlah respon pengamatan (Bernier et al. 2007). Lokasi qtl 12.1 berada pada kromosom 12 antara marka SSR RM28048 dan RM 511 (Mc Couch et al. 2002). Seleksi galur-galur unggul di lapangan dilakukan terhadap generasi silangan Vandana x Way
rarem dengan perlakuan kekeringan menjelang berbunga.
Di Indonesia, tanaman transgenik yang diperoleh tidak dapat diuji langsung
di lapangan. Sesuai Peraturan Pemerintah no. 21 tahun 2005 tentang keamanan
hayati produk rekayasa genetika, maka setiap tanaman transgenik harus diuji pada
setiap tahapnya. Terkait dengan hal tersebut maka pengujian tanaman transgenik
untuk toleransi kekeringan di tahap awal hanya mungkin dilakukan di rumah kaca.
Disadari bahwa kondisi lingkungan kekeringan dipengaruhi oleh banyak
faktor. Uji kekeringan di rumah kaca selayaknya dapat mewakili kondisi
pemilihan metode uji kekeringan, hal lain yang mungkin dilakukan adalah
menggunakan tanaman pembanding toleran kekeringan yang teruji dilapangan.
Galur toleran yang digunakan dalam penelitian ini merupakan generasi
persilangan cv. Vandana dan Way rarem yang memiliki marka qtl 12.1 yang telah terseleksi di lapangan. Dengan menggunakan pembanding tersebut diharapkan
hasil pengujian di rumah kaca dan lapang dapat selaras.
Tanaman toleran kekeringan hasil transformasi genetik dan hasil seleksi
lapangan dapat dimanfaatkan untuk tujuan ekstensifikasi ke lahan marginal
kering. Lahan-lahan yang demikian sebagian besar berada di luar Pulau Jawa.
Tanaman toleran yang diperoleh juga bermanfaat untuk mengantisipasi terjadinya
musim kering yang tidak dapat diprediksi.
Tujuan Penelitian
1. Mendapatkan padi gogo transgenik cv. Batutegi dan Kasalath yang
mengandung gen toleran kekeringan Oshox6 dikendalikan promotor terinduksi kekeringan OsLEA dan teruji toleran kekeringan.
2. Mendapatkan genotipe toleran kekeringan hasil persilangan cv. Vandana dan
Way rarem mengandung marka qtl 12.1 dan tidak mengandung marka qtl 12.1.
3. Mendapatkan informasi validasi metode uji kekeringan FTSW (fraction transpiration saol water) untuk seleksi galur toleran kekeringan di tingkat rumah kaca yang menginterpolasi cekaman kekeringan di lapang.
Manfaat Penelitian
Diperolehnya galur-galur unggul dan toleran kekeringan dari hasil
transformasi genetik menggunakan gen regulator oshox-6 dan seleksi populasi yang mengandung marka qtl 12.1 dapat bermanfaat untuk :
1. Menunjang program ekstensifikasi padi di lahan sub-optimal kering
2. Memperbaiki kultivar yang sudah dilepas (Batutegi dan Way rarem) sehingga
diharapkan meningkatkan sifat unggul dari kultivar tersebut.
3. Meningkatkan sumbangan produksi beras dari lahan marginal kering.
Ruang Lingkup Penelitian
1. Transformasi genetik dengan gen penanda (hpt, gusA dan gfp) pada padi indica cv. Batutegi dan Kasalath.
2. Transformasi gen HD-Zip oshox6 yang dikendalikan promotor terinduksi kekeringan (OsLEA) pada cv. Batutegi dan Kasalath.
3. Analisis integrasi dan pewarisan gen sisipan dalam genom generasi kedua.
4. Melakukan seleksi genotipe pada populasi hasil persilangan cv. Vandana x
Way rarem yang mengandung dan tidak mengandung marka qtl 12.1 di lapangan (MK-1 dan MK-2).
5. Uji kekeringan galur-galur transgenik cv. Batutegi dan Kasalath mengandung
TINJAUAN PUSTAKA
Pengelompokan Tanaman Padi
Padi merupakan tanaman pangan utama yang dikonsumsi sebagian besar
penduduk dunia. Tanaman pertanian kuno ini berasal dari benua Asia dan Afrika
Barat-Tropis hingga Subtropis. Bukti sejarah secara arkeologi menunjukkan
bahwa padi telah ada pada 8000 tahun sebelum masehi (SM), meskipun waktu
budidayanya masih menjadi perdebatan. Terdapat dua spesies padi yang
dibudibayakan yaitu Oryza sativa di wilayah Asia dan O. glaberrima di Afrika kedua jenis ini memiliki sejarah budidaya yang unik (Sweeney & McCouch
2007).
Genus Oryza memiliki 21 kelompok padi liar yang dibudidayakan
(Vaughan et al. 2003). Genus ini dibagi kedalam empat kelompok species yaitu O. sativa, O. officinalis, O. ridelyi dan O. granulata. Semua anggota genus Oryza memiliki jumlah n = 12 kromosom. Persilangan diantara keempat kelompok ini
memungkinkan terjadi (Vaughan et al. 2003). Kelompok O. sativa memilki dua species yang dibudidayakan yaitu O. sativa dan O. glaberrima dan enam species liar yaitu O. rufipogon, O. nivara, O. barthii, O. longistaminata, O. meridionalis dan O. glumaepatula yang semuanya diploid. O. rufipogon sebagai species tanaman tahunan dan O. nivara sebagai tanaman semusim atau dugaan keduanya sebagai leluhur dari O. sativa hingga saat ini masih menjadi perdebatan (Sweeney & McCouch 2007). Secara botani tanaman padi diklasifikasikan menjadi: Divisi:
Spermatophyta, Sub Divisi: Angiospermae; Kelas: Monokotiledonae; Ordo:
Gramineales, Famili: Graminiae (Poaceae), Genus: Oryza, Species: Oryza sativa. Berdasarkan ekologinya Oryza sativa mengalami evolusi yang membentuk 3 ras yaitu (a) indica, (b) japonica/sinica dan (c) javanica dengan sebaran area di
wilayah Selatan, Tenggara dan Timur Asia (Gupta & O’toole 1986). Adapun
ciri-ciri ke-3 ras tersebut menurut Chang dan Bardenas (1976) sebagai berikut:
Japonica/Sinica : daun berukuran sempit-lebar, berwarna hijau muda, gabah
panjang-pendek, berbentuk bulat panjang dan agak pendek, umumnya gabah tidak
batang sedang-tinggi, jaringan lunak, kepekaan terhadap panjang hari bervariasi,
kandungan amilosa 23-31% dan suhu membukanya lema dan palea bervariasi.
Indica : daun berukuran sempit berwarna hijau tua, gabah pendek dan agak bulat
panjang, gabah tidak berekor kalaupun ada berbentuk panjang, bulu sekam lebat
dan panjang, gabah sedikit rontok, anakan sedang, batang sedang-pendek,
jaringan keras, tidak peka terhadap panjang hari atau agak peka, kandungan
amilosa 10-24% dan suhu membukanya lema dan palea rendah.
Javanica : daun berukuran lebar, kaku dan berwarna hijau muda, gabah panjang
lebar dan tebal, berbentuk bulat panjang dan agak pendek, gabah berekor panjang
atau tidak ada, bulu sekam panjang, gabah sedikit rontok, anakan sedikit, batang
tinggi, jaringan keras, agak peka terhadap panjang hari, kandungan amilosa
20-25% dan suhu membukanya lema dan palea rendah.
Berdasarkan habitatnya padi dikelompokkan menjadi padi gogo, padi
sawah dan padi kumbang (rawa). Padi gogo tumbuh di lahan kering, padi sawah
di lahan tergenang, dan padi rawa di daerah rawa yang dalam. Hampir semua padi
unggul yang ditanam di Indonesia tergolong padi cere (indica) (Harahap et al. 1977). Budidaya padi sawah di Indonesia lebih populer dari padi gogo, jumlah
kultivar padi sawah lebih banyak dari padi gogo, begitu pula produktivitas padi
sawah lebih tinggi dari padi gogo. Produktivitas padi secara nasional hingga saat
ini masih didominasi padi sawah.
Lahan Marginal dan Cekaman Kekeringan pada Tanaman
Salah satu upaya peningkatan produktivitas pangan di Indonesia adalah
dengan ekstensifikasi pada lahan sub-optimal seperti lahan kering. Luas lahan
kering potensial mencapai 51 juta ha, 48 juta ha diantaranya berada di luar Jawa
(Ar-Riza 2002) dan baru 10,3% yang telah dimanfaatkan (BPS 2006).
Ekstensifikasi di lahan marginal tidak terlepas dari cekaman kekeringan terlebih
dengan sering terjadinya perubahan iklim yang tidak dapat diprediksi.
Lahan kering adalah hamparan lahan yang didayagunakan tanpa
penggenangan air, baik secara permanen maupun musiman dengan sumber air
berupa hujan atau air irigasi (Suwardji 2003). Topologi lahan ini dapat dijumpai
pengertian diatas, maka jenis penggunaan lahan yang termasuk dalam kelompok
lahan kering mencakup: lahan tadah hujan, tegalan, kebun campuran, perkebunan,
hutan, semak, padang rumput, dan padang alang-alang (As-syakur 2007).
Menurut Sopandie (2006) peningkatan produksi di lahan marginal dapat
dicapai melalui berbagai perbaikan yaitu: (1) perbaikan potensi hasil dari
galur-galur beradaptasi luas (2) memperbaiki tingkat adaptasi tanaman terhadap
cekaman abiotik dan resistensi terhadap cekaman biotik, dengan membuat
genotipe tanaman yang lebih sesuai dengan lingkungan tumbuh (3) perbaikan
teknik budidaya yang berbasis pengetahuan fisiologis dan ekofisiologis tanaman.
Faktor-faktor tersebut harus sinergis agar peningkatan hasil dapat tercapai.
Cekaman kekeringan merupakan istilah untuk menyatakan bahwa tanaman
mengalami kekurangan air akibat keterbatasan air dari lingkungan tumbuhnya
yaitu media tanam. Menurut Levitt (1980) cekaman kekeringan (drought stress) pada tanaman dapat disebabkan oleh dua hal yaitu (1) kekurangan air di daerah
perakaran dan (2) permintaan air yang berlebihan oleh daun akibat laju
evapotranspirasi melebihi laju absorpsi air walaupun keadaan air tanah tersedia
cukup. Pada lahan kering, cekaman kekeringan pada tanaman terjadi karena
suplai air yang tidak mencukupi.
Air ialah komponen utama bagi pertumbuhan dan perkembangan tanaman.
Ketiadaan atau kekurangan air bagi tanaman dapat menyebabkan terhambatnya
perkembangan tanaman dan menurunkan produktivitas. Cekaman kekeringan
adalah salah satu penyebab rendahnya produktivitas tanaman di lahan kering,
akibat pertumbuhan terhambat dan tingginya sterilitas gabah. Penurunan hasil
akibat kekeringan sangat ditentukan oleh derajat kekeringan, periode kekurangan
air dan fase pertumbuhan tanaman (Jongdee et al. 2002). Kekeringan pada fase vegetatif seringkali tidak berakibat menurunkan hasil secara nyata (Boonjung &
Fukai 1996; Jongdee et al. 2006). Kekeringan yang terjadi ketika pertumbuhan anakan maksimum hingga periode pembungaan dapat menurunkan hasil secara
nyata. Kekeringan yang terjadi selama pembungaan berakibat pada rendahnya
Gen Regulator Faktor Transkripsi untuk Toleransi Kekeringan
Sifat toleran kekeringan merupakan sifat yang kompleks dan dikontrol oleh
banyak gen. Gen-gen ini terbagi dalam dua grup, pertama ialah gen-gen terkait
dengan perlindungan sel selama kekeringan dan kedua gen-gen yang terkait
mekanisme regulasi untuk respon terhadap kekeringan (Shinozaki &
Yamaguchi-Shinozaki. 2007). Grup pertama termasuk gen-gen yang menyandikan protein
untuk menjaga tekanan osmotik, perlindungan sel terhadap kerusakan, perbaikan
sel dan adaptasi struktural. Kelompok gen yang kedua merupakan protein signal
transduksi seperti protein kinase dan faktor transkripsi (FT).
Faktor transkripsi ialah urutan khusus asam amino yang mampu berikatan
dengan DNA untuk mengontrol proses penempelan RNA polimerase sehingga
transkripsi terjadi (de Sauza et al. 2003). Identifikasi FT didasarkan pada domain khusus dan daerah yang berperan pada DNA binding atau oligomerisasi (Liu et al. 1999). Rekayasa genetika pada level faktor transkripsi berpeluang untuk
mendapatkan tanaman padi toleran kekeringan, karena faktor transkripsi berperan
dalam meregulasi ekspresi sejumlah gen lain yang terkait toleransi kekeringan.
Beberapa kelas faktor transkripsi yang termasuk dalam respon tanaman
terhadap cekaman ialah MYC, MYB, bZIP, AP2, zinc finger protein dan
homeodomain-leucin zipper protein (HD-Zip). HD-Zip mempunyai fungsi luas
yang terkait dalam perkembangan dan adaptasi tanaman terhadap cekaman. Gen
HD-Zip termasuk dalam grup homeobox (HB), hanya dijumpai pada tanaman dan
tidak ditemukan pada eukariot lain (Agalou et al. 2008). Kelompok lain homeobox (HB) antara lain: knox (kotted1 like homeobox), HD-Bell, PHD-finger (plant homeodomain-finger), PALE (penta aminoacid loop extension) dan Ndx (Postma-Haarsma 2002). Masing-masing gen HB dikodekan oleh 61 sekuen asam amino
terkonservasi yang dinamakan homeodomain (HD). Homeodomain mengandung protein faktor transkripasi dan berperan dalam pengikatan DNA spesifik.
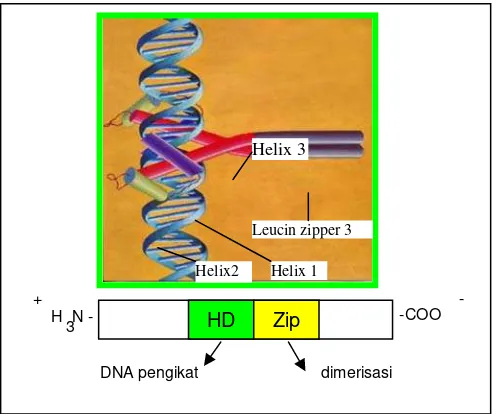
HD-Zip dalam tanaman bersifat spesifik dan dikarakterisasi berdasarkan
keberadaan suatu motif leucin zipper (zip) pada ujung C dari HD. Motif leucin zipper berfungsi dalam pembentukan dimerisasi membentuk homo dan
(Agalou et al. 2008). Kelompok HD pada genom padi merupakan kelompok HD-Zip I, II dan III. Perbedaan dalam kelompok tersebut diketahui sebagai represor (menekan ekspresi gen) atau aktivator (mengaktifkan ekspresi gen) melalui transkripsi gen.
Gen HD-Zip terkait dengan adaptasi perkembangan tanaman terhadap
cekaman lingkungan. Gen HD-Zip Athb2 (Arabidopsis thaliana homeobox) dari Arabidopsis berfungsi untuk pertahanan tanaman terhadap naungan. Gen ini terinduksi cahaya merah dan overekpresinya mendorong terjadi pemanjangan sel
(Steindler et al. 1999). Gen-gen HD-Zip Athb6, Athb7 dan Athb12 pada Arabidopsis ekspresinya terinduksi saat cekaman kekeringan (Lee et al. 2001; Soedarman et al. 1999). Sebanyak 7 gen HD-Zip asal tanaman Craterostigma plantagenium diidentifikasi responsif terhadap kekeringan melalui mekanisme up dan downregulation (Frank et al. 1998; Deng et al. 2002) dan HD-Zip hahb-4 (Helianthus anuus homeobox) dari bunga matahari berpotensi untuk pertahanan diri terhadap kekurangan air.
Helix 3
Helix 1 Leucin zipper 3 Helix2
H N - +
3 HD Zip -COO
-
[image:31.595.212.460.407.614.2]DNA pengikat dimerisasi
Gambar 1. Struktur gen regulator HD-Zip.
Motif HD berperan sebagai DNA pengikat pada ujung N, dan leucin zipper pada ujung C untuk dimerisasi
Meijer et al. (1997; 2000), mengidentifikasi tujuh gen HD-Zip dalam tanaman padi yang dinamakan oshox1-7 (Oryza sativa homeobox). Sekuen gen-gen tersebut kemudian digunakan untuk menganalisis gen-gen-gen-gen HD-Zip lain (I, II
genomik. Hasil analisis menunjukkan bahwa terdapat 33 gen HD-Zip pada
tanaman padi japonica yang diklasifikasikan menjadi kelompok I (14 gen), II (14
gene) dan III (5 gen) dengan lokasi tersebar pada 12 kromosom padi (Agalou et al. 2008).
Kelompok gen HD-Zip I dan II dari padi (oshox 4, 6, 11, 19, 20, 22, -24, dan -27) diketahui responsif terhadap cekaman kekeringan. Eskpresinya dapat meningkat (ekpresi gen semakin kuat) maupun menurun (ekpresi gen semakin
lemah) ketika cekaman kekeringan. Gen oshox6 (HD-Zip I) diketahui pola regulasinya meningkat ketika ada cekaman kekeringan pada cv. Zhenshan (padi
sawah indica, sensitif) dan IRAT 109 (padi gogo) setelah tiga hari perlakuan
cekaman kekeringan. Pada kultivar IRAT 112, Cabacu, Cisadane, Nipponbare dan
T-309 ekspresi gen oshox6 menurun setelah diberi perlakuan kekeringan 48 jam dan gen ini diinduksi ABA pada bagian akar, sehingga jalur transduksi sinyal
melalui ABA (Purwantomo 2007; Agalou et al. 2008). Dari sejumlah gen oshox yang ada, baru dua gen yang telah dikarakterisasi yaitu oshox1 (HD-Zip II) dan oshox4 (HD-Zip I) yang diregulasi oleh cekaman kekeringan (Agalou et al. 2008). Karakterisasi oshox1 (HD-Zip II) berfungsi dalam perkembangan tanaman tepatnya di jaringan pembuluh (Scarpella et al. 2000). Karakterisasi gen oshox4 melalui pendekatan overekspresi menunjukkan bahwa gen oshox4 mampu menekan jumlah dan ukuran sel serta memperpanjang fase vegetatif. Oshox4 terekpresi kuat pada jaringan pembuluh akar, batang, dan daun tapi
memperlihatkan lokasi khusus pada jaringan floem batang. Kemampuan
menunda penuaan dan kontrol terhadap jumlah dan ukuran sel menjadi faktor
penting untuk potensi aplikasi gen oshox4 dalam pengembangan padi toleran kekeringan (Purwantomo 2007).
Transformasi Genetik
Teknik transformasi genetik menungkinkan diperoleh tanaman dengan sifat
agronomis tertentu. Melalui teknik ini introduksi gen dari organisme lain dapat
dilakukan. Potongan gen (DNA) asing dari organisme lain tersebut akan menyatu
ke dalam genom tanaman. Pengembangan teknik ini dilakukan setelah ditemukan
DNA pada tempat spesifik, dan enzim ligase (enzim penyambung) yang
menyatukan fragmen–fragmen DNA. Berbagai metode transfomasi genetik
tanaman telah dikembangkan, pemilihan metode sangat tergantung pada
kemampuan jaringan atau sel tanaman untuk beregenerasi. Salah satu teknik
transformasi ialah menggunakan Agrobacterium tumefaciens. A. tumefaciens merupakan bakteri aerob obligat gram negatif yang hidup alami dalam tanah dan
dapat menyebabkan penyakit crown gall pada tanaman dikotil (Sheng & Citovsky 1996). Beberapa keuntungan transformasi menggunakan A. tumefaciens antara lain: dapat diulang (reproducible), relatif lebih murah, jumlah salinan gen sedikit (antara 1-3), efisiensi transformasi serupa dengan tanaman dikotil, ekspresi dan
pewarisan gen stabil, transfer segmen DNA relatif besar dan morfologi tanaman
normal dengan fertilitas tinggi (Hiei et al. 1994; Slamet-Loedin 1994).
Pada awalnya transformasi dengan Agrobacterium hanya dapat dilakukan pada tanaman dikotil, namun sekarang berhasil digunakan pada monokotil. Hal
ini terkait dengan penggunaan senyawa fenolik yang ditambahkan saat
transformasi tanaman monokotil. Senyawa fenolik secara alami dihasilkan
tanaman dikotil sebagai respon pelukaan. Senyawa ini diperlukan bakteri untuk
menginduksi gen-gen vir (Sheng & Citovsky 1996). Senyawa fenolik asetosiringone yang ditambahkan ke dalam media ko-kultivasi saat transformasi telah memungkinkan diperoleh tanaman padi transgenik (Hiei et al. 1994).
Transformasi genetik padi yang dikemukakan pada pertengahan tahun 1980
bertujuan untuk memodifikasi genetik kultivar-kultivar penting. Kultivar tersebut
diharapkan memiliki ketahanan terhadap cekaman biotik dan abiotik, dengan padi
japonica sebagai model. Transformasi genetik pada padi indica belum sebanyak
padi japonica, meskipun tanaman indica adalah mayoritas yang dibudidayakan di
Asia. Kebanyakan kultivar indica termasuk grup I, yang dinamakan ’true Indica rice’ (Zhang et al. 1998) yang sebagian besar diantaranya merupakan varietas rekalsitran untuk kegiatan kultur jaringan dan transformasi (Wunn et al. 1996).
Transformasi genetik sangat terkait dengan sistem regenerasi tanaman. Studi
regenerasi melalui kultur jaringan bertujuan untuk melihat respon suatu genotipe
terhadap kondisi kultur jaringan. Pada padi indica sering dijumpai bahwa kondisi
untuk genotipe lain atau optimum hanya pada spektrum sempit. Menurut Ge et al. (2006) potensi induksi kalus dan regenerasi kultur jaringan padi sangat tergantung
pada beberapa faktor seperti genotipe tanaman, tipe dan status fisiologi eksplan,
komposisi dan konsentrasi garam, komponen organik dan hormon pertumbuhan
dalam media. Ge et al. (2006) mengembangkan sistem kultur jaringan untuk peningkatan efisiensi regenerasi terhadap suatu seri near isogenic line dari kultivar IR 24 (4 genotipe) dan tiga kultivar indica lainnya. Genotipe padi yang
digunakan ini mewakili keragaman plasma nutfah padi indica. Modifikasi yang
dilakukan ialah pada media induksi kalus, media subkultur dan media regenerasi.
Percobaan modifikasi media subkultur dan regenerasi pada empat kultivar indica
berhasil meningkatkan laju pertumbuhan tanaman, kualitas, diferensiasi kalus dan
efisiensi transformasi (Lin & Zhang 2005).
Padi indica pertama kali berhasil ditransformasi melalui penembakan DNA
(Christou et al. 1991). Transformasi genetik yang berhasil dilakukan melalui A. tumefaciens antara lain terhadap: cv. TSC10 dan IR72 (Aldemita et al. 1996), Tiga kultivar indica Basmati (Rashid et al. 1996), cv. Minghui 63, Zhensan 97, W9864S dan Zhong 419 (Lin & Zhang 2005), cv. Pusa Basmati I (Zhang et al. 1997), IR 64 (Khanna & Raina 2002). Efisiensi transformasi tertinggi (>50%)
diperoleh pada sepuluh kultivar indica grup I dengan eksplan berupa embrio
zigotik belum masak (Hiei & Komari 2006).
Beberapa faktor penting lain untuk keberhasilan transformasi genetik antara
lain: tipe dan umur jaringan, genotipe dan berbagai kondisi kultur jaringan yang
digunakan, jenis vektor, ukuran vektor, strain Agrobacteruim, konsentrasi dan jenis antibiotik (Hiei et al. 1997). Efisiensi transformasi yang rendah pada indica diduga terkait pula dengan antibiotik yang digunakan, karena antibiotik dapat
meracuni kalus (Khanna & Raina. 1999; Rashid et al. 1996).
Pemilihan jaringan sebagai material awal yang akan digunakan adalah
faktor penting yang menentukan keberhasilan transformasi. Inisiasi kalus dari
skutelum padi japonica yang akan transformasi lebih baik dibanding penggunaan
material lain seperti tunas dan immature embrio (Hiei et al. 1994). Percobaan menggunakan jaringan muda dan segar dari tanaman sehat yang berupa embrio
keberhasilan transformasi indica (Hiei et al. 2006). Ketepatan pemilihan jaringan dan waktu transformasi dapat mempengaruhi waktu yang diperlukan untuk
mendapatkan tanaman transgenik. Penggunaan kalus dari bagian skutelum benih
padi japonica memerlukan waktu 3 bulan untuk mendapatkan tanaman
transgenik. Pendekatan lain (Toki et al. 2006), waktu pra kultur yang singkat (1-5 hari) yang kemudian ditransformasi dapat menghemat waktu dua bulan
dibandingan menggunakan kalus embriogenik.Teknik ini berhasil dilakukan pada
padi japonica seperti Nipponbare, Koshihikari, Dontokoi dan indica Basmati 370,
meskipun nilai efisiensi transformasi tidak dikemukakan.
Resistensi Tanaman terhadap Cekaman Kekeringan
Respon tanaman terhadap cekaman kekeringan terjadi melalui proses
transduksi sinyal. Proses tersebut melibatkan reseptor sebagai penerima signal,
phosphoprotein cascade sebagai penghantar signal, dan trans acting factor sebagai pengaktif gen-gen yang mengendalikan respon. Pada gen tertentu ABA
berperan sebagai reseptor sekunder yang menghubungkan reseptor utama di
membran dengan phosphoprotein cascade, namun pada gen lain respon tanaman tidak tergantung ABA (Mundree et al. 2002; Yamaguchi-Shinozaki & Shinozaki 2005).
Mekanisme resistensi tanaman terhadap cekaman kekeringan dapat
dikelompokkan menjadi beberapa kategori. Tanaman padi toleran kekeringan
menggunakan mekanisme avoidance dan tolerance. Drought avoidance adalah kemampuan tanaman untuk menyerap air atau untuk menekan hilangnya air
sehingga dapat menjaga kecukupan air dalam sel atau jaringan. Drought tolerance ialah kemampuan sel untuk hidup dan melakukan fungsi metabolisme meskipun jaringan mengalami kekeringan (Tajima 1995).
Fukai dan Cooper (1995) membagi mekanisme adaptasi tanaman terhadap
kekeringan di lahan tadah hujan menjadi empat yaitu: drought escape, avoidance, tolerance, dan drought recovery. Sementara Gupta & O’Toole (1986) membagi mekanisme ketahanan kekeringan menjadi lima yaitu: (1) Tahan kekeringan
hidup dengan kecukupan air yang terbatas. (2) Escape kekeringan (drought escape) ialah kemampuan tanaman untuk masak sebelum cekaman kekeringan terjadi yang merupakan faktor pembatas yang serius. Pemasakan awal dan
panjang hari adalah terkait dengan mekanisme escape terhadap kekeringan. (3)
Penghindaran kekeringan (Drought avoidance) ialah kemampuan tanaman untuk menjaga status kecukupan air selama kekeringan. Bagian tanaman yang berupa
akar dan tajuk adalah yang terkait dengan mekanisme penghindaran. (4) Toleran
kekeringan (drought tolerance) ialah kemampuan tanaman untuk bertahan pada saat kekurangan air yang diukur melalui derajat dan lamanya potensial air yang
rendah dalam tanaman. Toleransi kekeringan mengakibatkan perubahan fisiologi
tanaman. (5) Mekanisme penyembuhan (Drought recovery) ialah kemampuan tanaman tumbuh kembali dan menghasilkan setelah terkena cekaman kekeringan.
Lokus Sifat Kuantitatif (QTL) Cekaman Kekeringan
Teknologi marka molekuler yang terus berkembang sekarang ini telah
memungkinkan dipelajari alel-alel terkait yang mengendalikan suatu sifat
komplek. Analisis QTL (quantitative trait locus) dapat menyediakan informasi relevan untuk mempelajari sifat-sifat agronomis melalui marka molekuler dengan
identifikasi daerah spesifik dalam genom yang mempengaruhi pengukuran suatu
sifat (Suh et al. 2005). Dengan menggunakan peta keterpautan molekuler dan analisis QTL, jumlah lokus yang mengendalikan variasi genetik dalam suatu
populasi bersegregasi dapat diduga dan diketahui posisinya dalam genom, aksi
gen, pengaruh fenotipik, pengaruh pleotropik dan interaksi epistasis dengan QTL
lain (Cho et al. 2006).
Keberhasilan penggunaan marka molekuler untuk sifat tolelan kekeringan
telah dilaporkan. Beberapa karakter yang diamati yaitu: hasil (Lanceras et al. 2004), panjang akar, ketebalan akar, daun menggulung dan sensitivitas stomata
(Price et al. 2002; Courtois et al. 2003), osmotic adjusment (Lilley et al. 1996). Seleksi galur toleran kekeringan dan produktivitas tinggi dilakukan dengan
menguji galur-galur potensial tersebut pada kondisi tercekam. Seleksi langsung
terhadap hasil pada kondisi lapangan cukup air dan kondisi tercekam sangat
pada periode anthesis telah dilakukan dengan karakter pengamatan komponen
hasil dan komponen agronomi lainnya (Babu et al. 2003; Lanceras et al. 2004). Seleksi galur unggul juga dilakukan terhadap generasi silangan Vandana (India) x
Way Rarem (Indonesia) dengan perlakuan kekeringan menjelang berbunga. Hasil
percobaan menunjukkan bahwa keberadaan marka qtl 12.1 mampu mempertahankan hasil meskipun cekaman berat (Bernier et al. 2007). Marka qtl 12.1 diwariskan dari kultivar Way Rarem, yang merupakan kultivar tidak toleran kekeringan namun produktivitas tinggi. Sementara Vandana ialah kultivar toleran
kekeringan namun produktivitas rendah. Marka qtl 12.1 adalah yang pertama dilaporkan mampu mempertahankan hasil saat kekeringan pada fase reproduksi.
Peningkatan hasil mencapai 47% pada cekaman kekeringan berat (Bernier et al. 2007). Lokasi marka qtl 12.1 berada pada daerah 10.2 cM di antara marka RM 28048 dan RM 511 (Mc Couch et al. 2002).
Uji Kekeringan
Kondisi cekaman kekeringan dipengaruhi oleh banyak faktor. Sifat toleran
kekeringan juga dikendalikan oleh banyak gen. Tanaman tahan cekaman
kekeringan sangat ditentukan oleh respon tanaman terhadap cekaman tersebut.
Oleh karena itu diperlukan suatu metode uji kekeringan yang dapat melihat
mekanisme pertahanan tanaman. Karakter pengamatan untuk tanaman dengan
respon escape, akan berbeda dengan respon tanaman avoidance begitu pula dengan respon kemampuan penyembuhan setelah terkena kekeringan. Oleh karena
itu diperlukan banyak karakter pengamatan agar mekanisme pertahanan tanaman
dapat diamati. Dengan kata lain, tidak cukup hanya satu karakter pengamatan
untuk menseleksi tingkat toleransi kekeringan dari suatu populasi genetik yang
beragam (Price et al. 2002).
Populasi hasil silangan kultivar Bala x Azucena yang diuji pada lingkungan
berbeda memberikan hasil skoring ketahanan berbeda untuk karakter yang sama.
Pengujian kekeringan di lapangan perlu dilakukan pada saat musim kering ketika
dijamin bahwa air dalam jumlah terbatas dan dikombinasi dengan penggunaan
irigasi. Kondisi yang demikian sangat berat bagi tanaman dan kemungkinan tidak
Hal-hal penting lain saat pengujian dilakukan pada lahan demikian ialah
kemungkinan irigasi membasahi seluruh tanah hingga kedalaman tertentu
sehingga tanah bagian bawah basah, cahaya matahari penuh, iklim yang panas
dan kering yang mungkin menyebabkan stres fisiologis pada pucuk tanaman
(Price et al. 2002). Uji Kekeringan pada fase generatif lebih berpengaruh terhadap hasil dibandingkan pengujian pada fase vegetatif. Dengan demikian
pengujian pada fase ini dianggap penting dilakukan agar diperoleh gambaran
tingkat ketahanan suatu genotipe tanaman terhadap cekamam kekeringan.
Seleksi langsung terhadap hasil pada kondisi lapangan cukup air dan kondisi
tercekam sangat umum dilakukan untuk mendapatkan tanaman terpilih.
Beberapa penelitian lapang untuk populasi tanaman mengandung marka QTL
toleran kekeringan antar lain: populasi dauble haploid (DH), generasi hasil
persilangan padi gogo japonica dengan indica, generasi hasil silangan Vandana x
Way Rarem dengan target fase reproduktif (Babu et al. 2003; Lanceras et al. 2004; Bernier et al. 2007).
Tanaman transgenik yang telah diperoleh, sebelum diuji di lapangan harus
melewati pengujian di rumah kaca. Disadari bahwa kondisi lingkungan
kekeringan dipengaruhi oleh banyak faktor yang komplek. Oleh karena,
pemilihan metode pengujian di rumah kaca hendaknya dapat menginterpolasi
kondisi kekeringan di lapang. Penggunaan kultivar atau galur pembanding yang
teruji dilapang merupakan hal lain yang perlu dicermati.
Uji kekeringan di lapangan dan rumah kaca telah dilakukan terhadap padi
transgenik yang mengandung gen SNAC1 (Stress–responsive NAC1) yang bersifat responsif terhadap kekeringan. Percobaan di lapang dilakukan pada fase
generatif sedangkan percobaan di rumah kaca dilakukan pada fase vegetatif. Pada
percobaan di rumah kaca, setelah pengairan dihentikan semua daun tanaman
kontrol menggulung dan sedikit pada transgenik. Sebanyak 50% tanaman
transgenik dan 10% tanaman kontrol pulih setelah seminggu pengairan
dinormalkan. Karakter yang diamati meliputi karakter fisiologi seperti: tekanan
Evaluasi tanaman toleran kekeringan umumnya dilakukan dengan tingkat
cekaman yang sangat berat. Kondisi demikian sangat berbeda dengan kondisi
cekaman yang terjadi di alam (Bharnagar-Mathur et al. 2008), seperti yang dilakukan pada percobaan Pellegrineschi et al. (2004). Selain sistem yang digunakan untuk menguji penampakan tanaman tersebut, pengamatan dapat
dilakukan setidaknya terhadap akumulasi biomasa yang terjadi selama percobaan
kekeringan (Bharnagar-Mathur et al. 2008). Karakter lain yang dapat diamati ialah tingkat efisiensi penggunaan air (water use eficiency= WUE) (Sivamani et al. 2000), bobot segar tanaman (Sun et al. 2000), laju pertumbuhan dan pemanjangan batang (Pilon-Smith et al. 1995) serta daya hidup tanaman (Pardo et al. 1998).
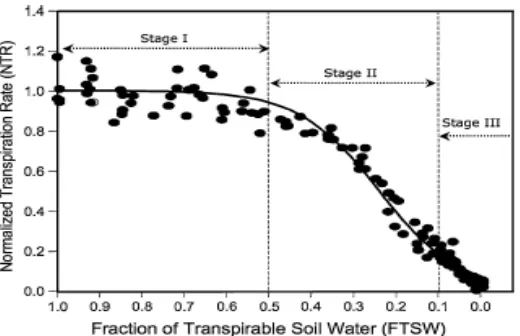
Menurut Sinclair dan Ludlow (1986), respon tanaman terhadap kekeringan
dibagi dalam tiga level (Gambar 2). Kekeringan level pertama ialah: air masih
cukup banyak, tanaman dapat mengambil air untuk transpirasi dan stomata
terbuka penuh. Kekeringan level kedua, akar tanaman tidak mampu lagi
menunjang suplai air yang cukup ke bagian atas tanaman (daun) dan stomata
secara bertahap menutup menyesuaikan dengan kehilangan air agar turgor daun
dapat dipertahankan. Kekeringan level ketiga, ketika akar tanaman sudah tidak
bisa lagi mencukupi air untuk transpirasi, stomata menutup dan semua proses
fisiologis yang terlibat dalam pertumbuhan termasuk fotosintesis terhambat.
Penelitian ini dijadikan dasar uji kekeringan yang kejadiannya berlangsung secara
bertahap. Respon tanaman terhadap kekeringan dianggap sebagai fungsi dari
fraksi air tanah yang tersedia bagi tanaman (fraction of transpirable soil water, FTSW) dan bukan sebagai fungsi dari periode kekeringan (hari) setelah cekaman
kekeringan dilakukan (Bhratnagar-Mathur et al. 2008). Aplikasi pengujian kekeringan ini telah digunakan pada tanaman kedelai dan jagung (Ray & Sinclair
Pengujian Tiga Metode Transformasi
Agrobacterium
untuk
Padi Gogo Indica cv. Batutegi dan Kasalath
Examination of Three Methods of Agrobacterium-mediated Transformation for Batutegi and Kasalath Upland Rice Indica Cultivars
E.S.Mulyaningsih1,3, H.Aswidinnoor2, D.Sopandie2, I.H. Slamet- Loedin3, P.B.F.Ouwerkerk4
1,3
Mahasiswa Pasca Sarjana Departemen Agronomi dan Hortikultura Institut Pertanian Bogor dan Staf Pusat Penelitian Bioteknologi LIPI, 2Departemen Agronomi dan
Hortikultura Institut Pertanian Bogor, 3Pusat Penelitian Bioteknologi LIPI,
4
Institute of Biology IBL Leiden University Netherlands
ABSTRAK
Transformasi genetik dengan Agrobacterium pada padi japonica sudah banyak dilaporkan dan memiliki efisiensi transformasi tinggi. Akan tetapi informasi keberhasilan pada padi indica sangat terbatas. Optimasi dan evaluasi suatu kultivar indica dapat dilakukan dengan menggunakan gen penanda atau gen pelapor. Penelitian ini bertujuan untuk mengetahui metode transformasi Agrobacterium terbaik untuk padi gogo cv. Batutegi dengan membandingkan tiga metode transformasi sebelumnya. Dua plasmid yang dinamakan pNU400 dan pUR224 digunakan untuk mendapatkan tanaman transforman padi indica cv. Batutegi (padi gogo Indonesia) dan Kasalath (padi gogo Thailand). Plasmid pNU400 mengandung GFP (green flourescens protein) sebagai gen pelapor, plasmid pUR224 mengandung gen penyeleksi hpt (hygromycin phosphotransferase) dan gusA (glucoronidase) sebagai gen pelapor. Masing-masing plasmid ditransformasikan ke dalam genom tanaman padi kultivar Batutegi dan Kasalath dengan A.tumefaciens menggunakan tiga metode transformasi. Transformasi dengan metode C (Hiei dan Komari 2006) adalah yang terbaik untuk menghasilkan tanaman transgenik kedua kultivar dengan menggunakan kedua plasmid. Pembentukan kalus embriogenik Batutegi lebih sulit dari Kasalath, namun regenerasi Batutegi lebih baik dibandingkan Kasalath. Integrasi gen hpt dilakukan dengan PCR dan Southern blot sedangkan gen gfp analisis ekspresi berdasarkan pendaran protein GFP dalam jaringan tanaman. Hasil Southern blot diperoleh 3 galur tanaman independen pada cv Batutegi dan 7 galur pada cv. Kasalath. Hasil penelitian ini membuktikan bahwa cv. Batutegi dapat ditransformasi dan dapat dijadikan sebagai tanaman target untuk transformasi padi indica.
ABSTRACT
Highly efficiency Agrobacterium mediated transformation on rice has already been reported. However, information on successefully transformation of indica rice varieties is still