KAJIAN IMUNOHISTOKIMIA PERKEMBANGAN
NEURON KATEKOLAMINERGIK PADA AREA
POSTREMA MONYET EKOR PANJANG
(
Macaca fascicularis
)
TRI WAHYU PANGESTININGSIH
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI DISERTASI DAN SUMBER INFORMASI
Dengan ini saya menyatakan bahwa disertasi berjudul “Kajian Imunohistokimia Perkembangan Neuron Katekolaminergik pada Area Postrema Monyet Ekor Panjang (Macaca fascicularis)” ini adalah karya saya sendiri dengan arahan komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir disertasi ini.
Bogor, Februari 2006
KAJIAN IMUNOHISTOKIMIA PERKEMBANGAN
NEURON KATEKOLAMINERGIK PADA AREA
POSTREMA MONYET EKOR PANJANG
(
Macaca fascicularis
)
TRI WAHYU PANGESTININGSIH
Disertasi
sebagai salah satu syarat untuk memperoleh
gelar Doktor
pada Program Studi Primatologi
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Judul Disertasi : Kajian Imunohistokimia Perkembangan Neuron
Katekolaminergik pada Area Postrema Monyet
Ekor Panjang
(Macaca fascicularis)
Nama
: Tri Wahyu Pangestiningsih
NRP
: P 30600003
Program Studi
: Primatologi
Disetujui
Komisi Pembimbing
Prof. Dr. drh. Koeswinarning Sigit, MS.
Ketua
Prof. drh. Dondin Sajuthi, MST., Ph.D.
Anggota
Dr.drh. Nurhidayat, MS.
Anggota
Prof. Douglas McHose Bowden, MD.
Anggota
Diketahui
Ketua Program Studi Primatologi
Dr. Ir. Sri Supraptini Mansjoer
Dekan Sekolah Pascasarjana
Prof. Dr. Ir. Syafrida Manuwoto, M.Sc.
KAJIAN IMUNOHISTOKIMIA PERKEMBANGAN NEURON
KATEKOLAMINERGIK PADA AREA POSTREMA
MONYET EKOR PANJANG
(Macaca fascicularis)
Tri Wahyu Pangestiningsih1,3), Koeswinarning Sigit2), Dondin Sajuthi2,3), Nurhidayat2), Douglas McHose Bowden4)
ABSTRAK
Telah dilakukan penelitian secara imunohistokimia tentang perkembangan neuron katekolaminergik (KA) pada area postrema (AP) monyet ekor panjang /MEP (Macaca fascicularis), mulai umur kebuntingan 40 hari (F 40) sampai anak umur 105 hari (P 105) menggunakan pelabelan tunggal tirosin hidroksilase (TH), dan pada F 55, F 70, F 145 dengan pelabelan ganda TH dan dopamin ß-hidroksilase (DBH).
Hasil pengamatan menunjukkan bahwa neuron KA dalam bentuk kelompok imunoreaktif TH (ir-TH) dapat diamati mulai F 55 pada daerah yang sejajar dengan bagian kaudal medula oblongata, dan pada umur tersebut neuron KA bermigrasi ke ventrolateral menjadi bakal Grup A2 dan A1.
Neuron ir-TH pada AP fetus terletak di dekat lapisan ependimal serta di bagian internal, berbentuk bulat dengan prosesus sitoplasma kecil pada F 55, kemudian berkembang menjadi neuron bipolar dengan prosesus sitoplasma yang pendek pada F 100, dan berkembang lebih lanjut menjadi neuron bipolar dengan prosesus sitoplasma yang panjang pada P 105. Sejumlah kecil badan sel yang imunoreaktif-DBH (ir-DBH) ditemukan pada F 55, dan jumlahnya semakin bertambah pada F 70 dan F 145.
Jalur katekolamin pada medula oblongata pertama kali ditemukan pada F 120, yang menghubungkan antara neuron KA di Grup A2 dengan A1, dari dorsomedial medula oblongata menuju area ventrolateral. Keberadaan jalur katekolaminergik ini menandakan bahwa neuron KA dalam medula oblongata telah berdiferensiasi membentuk jalur akson yang saling tersambung satu dengan yang lain, dan merupakan tanda bahwa sistem katekolaminergik sudah berada dalam tahap siap berfungsi.
Penelitian juga menemukan bahwa neuron KA di AP pada MEP dipertahankan keberadaannya sampai postnatal, yang pada spesies mamalia lain belum diketahui karena belum ada informasinya. Ditemukan juga bahwa pada periode fetus, neuron KA di AP pada MEP didominasi oleh neuron dopaminergik dengan sedikit neuron noradrenergik. Dapat disimpulkan bahwa neuron KA di AP pada MEP merupakan sel bakalan yang membentuk sel-sel Grup A2 dan A1.
Kata kunci: monyet ekor panjang, area postrema, tirosin hidroksilase, dopamin ß-hidroksilase, neuron katekolaminergik, neuron dopaminergik, neuron noradrenergik, perkembangan fetus, sel bakalan.
________
1)
Bagian dari disertasi penulis pertama,Program Studi Primatologi, Sekolah Pascasarjana-IPB; Fak. Kedokteran Hewan UGM, Tel: 0274-7480307, email: wahyuwijayanto@yahoo.com
2)
Program Studi Primatologi, Sekolah Pascasarjana-IPB, Tel: 0251-353386; Fak. Kedokteran Hewan IPB, Kampus IPB Darmaga, Bogor, Tel: 0251-421865
3)
Pusat Studi Satwa Primata, LPPM-IPB, Jl. Lodaya II/5 Bogor, 16151, Tel: 0251-313637.
4)
DEVELOPMENT OF CATECHOLAMINERGIC NEURONS IN THE AREA
POSTREMA OF THE LONG-TAILED MACAQUE (
Macaca fascicularis
):
AN IMMUNOHISTOCHEMICAL STUDY
Tri Wahyu Pangestiningsih1,3), Koeswinarning Sigit2), Dondin Sajuthi2,3), Nurhidayat2), Douglas McHose Bowden4)
ABSTRACT
The development of catecholaminergic (CA) neurons in the area postrema (AP) of the long-tailed macaque from fetal day (F) 40 to postnatal day (P) 105 was studied immunohistochemically. Single label for tyrosine hydroxylase (TH) was applied for F40 up to P105, while double labeling for TH and dopamine ß-hydroxylase (DBH) was used for specimens F 55, F 70 and F 145. (Average duration of pregnancy is about 165 days.).
CA neurons first appeared at F 55 as a cluster of TH immunoreactive (TH-ir) neurons predominantly in the anlage of AP in the posterolateral wall of the fourth ventricle. Labeled neurons, round with very short cytoplasmic processes were distributed most densely just deep to the ependymal layer with scattered cells further from the ventricular surface. At F 55 a very small number of THir cells was seen in dorsomedial and ventrolateral areas corresponding to the subsequent location of CA groups A1 and A2 in the caudal medulla. At F 100 TH-ir cells were more bipolar in shape with short cytoplasmic processes that were longer in the P 105 specimen. Double labeling revealed that most of the CA cells in AP were immunoreactive for TH. A very few were reactive for DBH at F 55, and a few more at F 70 and F 145. The first evidence of CA pathway development appeared in the F 120 specimen. TH labeled fibers were seen in coronal section between labeled cells in A1, A2 and AP.
From these results we propose that in the long-tailed macaque: 1) the area postrema is the source of stem cells for CA neurons that migrate to areas A1 and A2; 2) by the end of the fetal period and during early infancy A1 and A2 are already predominantly noradrenergic, whereas cells in area postrema remain largely dopaminergic.
Keywords: long-tailed macaque, area postrema, tyrosine hydroxylase, dopamine ß-hydroxylase, catecholaminergic neurons, dopaminergic neurons, noradrenergic neurons, fetal development, stem cells.
________
1)Part of the dissertation of the first author.Program Studi Primatologi, Sekolah Pascasarjana-IPB; Fak. Kedokteran Hewan UGM, Tel: 0274-7480307, email: wahyuwijayanto@yahoo.com
2)
Program Studi Primatologi, Sekolah Pascasarjana-IPB Tel: 0251-353386; Fak. Kedokteran Hewan IPB, Kampus IPB Darmaga, Bogor, Tel: 0251-421865
3) Pusat Studi Satwa Primata, LPPM-IPB, Jl. Lodaya II/5 Bogor, 16151, Tel: 0251-313637. 4)
PRAKATA
Syukur ke hadlirat Tuhan Yang Maha Esa atas segala berkah dan hidayah-Nya, sehingga disertasi yang membahas mengenai perkembangan sel syaraf (neuron) dengan judul ”Kajian Imunohistokimia Perkembangan Neuron Katekolaminergik pada Area Postrema Monyet Ekor Panjang (Macaca fascicularis)” ini dapat diselesaikan. Penelitian ini dilaksanakan selama tiga tahun, sejak Agustus 2002 sampai dengan September 2005 di Pusat Studi Satwa Primata-LPPM, IPB dan University of Washington, Seattle, Amerika Serikat, yang merupakan projek kerjasama penelitian antara ke-dua institusi tersebut di atas.
Pada kesempatan ini penghargaan dan terima kasih setinggi-tingginya Penulis ucapkan kepada:
Prof. Dr. drh. Koeswinarning Sigit, MS., Prof. drh. Dondin Sajuthi, MST., Ph.D., Dr. drh. Nurhidayat, MS., dan Prof. Douglas M Bowden, MD. selaku Dewan Komisi Pembimbing atas segala waktu, nasehat, kesabaran, ketelitian, dan pengorbanan yang dicurahkan selama pembimbingan hingga selesainya penulisan disertasi ini.
Ucapan terima kasih juga Penulis sampaikan kepada Rektor dan Dekan Fakultas Kedokteran Hewan, Universitas Gadjah Mada yang telah memberikan ijin tugas belajar, serta Dekan Sekolah Pascasarjana IPB atas kesempatan belajar yang diberikan.
Terima kasih juga Penulis sampaikan kepada BPPS-DIKTI dan APPERI sebagai Lembaga Pemberi Beasiswa selama Penulis menjalankan tugas belajar.
Penghargaan dan terima kasih juga disampaikan kepada Dr. Nastiti Kusumorini, Prof. drh. Soesanto Mangkoewidjojo, MSc., PhD., dan Dr. drh. Arief Boediono selaku penguji luar komisi dalam ujian tertutup dan terbuka atas segala saran dan masukannya untuk penyempurnaan disertasi ini.
Penulis juga menyampaikan rasa terima kasih yang tak terhingga kepada Dr. drh. Diah Iskandriati, Dr. drh. Erni Sulistiawati, Dr. Drh. Chairun Nisa MS, drh. Diah Pawitri, dr. Irma A Suparto MS, Ir. Entang Iskandar MSi, Ir. Itasia A Lelana, Dr. Mark Dubah, Andra Erickson, Erik McArthur, Hidayat Djajadi, Rahayu Sulistina, Artati Sri Redjeki SH, Ir. Linda, para staf di Laboratorium Patologi dan Lipida serta di Laboratorium Mikrobiologi dan Imunologi PSSP LPPM-IPB, Bagian Anatomi FKH IPB dan UGM, dan semua rekan di PSSP LPPM-IPB dan PRM yang telah membantu selama Penulis menjalani studi.
Segala ujian dan tantangan selama tugas belajar tak akan dapat Penulis lalui tanpa dorongan dari seluruh keluarga. Untuk itu, Penulis sangat berterima kasih kepada suami tercinta Mas Hery, serta anak-anakku Dian, Andi, Dhanik atas kesabaran, pengertian, dan pengorbanan yang diberikan selama Penulis menjalani studi. Kepada ayahnda Ignatius Jahoedi Priohamidjojo, Mas Tiwid, Mbak Ninuk, Heni, dan Dhini beserta keluarga serta keluarga besar Supadi terima kasih atas bantuan, dorongan semangat, dan doa yang tiada henti.
Akhir kata, semoga Allah Yang Maha Kuasa selalu melimpahkan rahmat dan hidayah kepada Penulis untuk mengamalkan ilmu yang diperoleh demi kemajuan bangsa dan negara, serta dapat dimanfaatkan bagi peningkatan kesejahteraan manusia.
Bogor, Februari 2006 Penulis
RIWAYAT HIDUP
Penulis dilahirkan di Pacitan, Jawa Timur pada tanggal 6 November 1962, sebagai anak ketiga dari Ayah Ignatius Jahoedi Priohamidjojo dan Ibu Maria Elizabeth Soepartijani (Almh).
Pendidikan dasar sampai menengah pertama Penulis selesaikan di Pacitan tahun 1978, sedang pendidikan menengah atas di SMA Negeri I Madiun lulus tahun 1981. Pada tahun yang sama Penulis diterima sebagai mahasiswa di Fakultas Kedokteran Hewan UGM hingga mendapatkan gelar Dokter Hewan pada tahun 1987, dan diterima menjadi staf edukatif pada fakultas yang sama pada tahun 1989. Gelar Magister Ilmu-Ilmu Pertanian (MP) Penulis peroleh dari Program Studi Sain Veteriner, Program Pascasarjana UGM tahun 1994.
Untuk mengembangkan diri dalam IImu Anatomi Veteriner khususnya, hingga kini Penulis menjadi anggota Perhimpunan Dokter Hewan Indonesia sejak tahun 1987 dan Perhimpunan Ahli Anatomi Indonesia sejak tahun 1989.
Untuk memperkuat pemahaman tentang neuroscience, Penulis berkesempatan menjadi peneliti tamu pada Biostructure Technology Laboratory,
National Primate Research Center, University of Washington, Amerika Serikat pada bulan Januari-Juni 2002 dan Juni-Agustus 2005. Pada kesempatan pertama sebagai peneliti tamu di Institusi di atas, Penulis berhasil menyelesaikan penambahan istilah neuroanatomi dalam Bahasa Indonesia pada website neuro science dengan alamat situs http://braininfo.rprc.washington.edu melengkapi istilah dalam bahasa Inggris, Rusia, Spanyol, Italia, dan Belanda yang sudah ada sebelumnya.
DAFTAR ISI
Hal
DAFTAR ISI ...
DAFTAR GAMBAR ...
DAFTAR SINGKATAN ...
PENDAHULUAN ... Latar belakang ... Tujuan penelitian ... Manfaat penelitian ...
TINJAUAN PUSTAKA ... Biologi Macaca fascicularis....
Anatomi dan fungsi otak ... Perkembangan otak ... Neurotransmiter ... Katekolamin ... ... Identifikasi katekolamin ... Neuron katekolaminergik ... Area postrema ...
MATERI DAN METODE ... Tempat dan waktu penelitian ... Materi penelitian ... Metode... Pengambilan fetus... Perfusi jaringan otak ...
Proses blok parafin dan sayatan preparat untuk pewarnaan
imunohistokimia label tunggal ... Pewarnaan cresyl eacht violet dan HE ...
Pewarnaan imunohistokimia secara label tunggal ... Pewarnaan imunohistokimia secara label ganda ... Pengamatan hasil penelitian... Interpretasi hasil pewarnaan imunohistokimia... Analisis hasil ...
HASIL DAN PEMBAHASAN ... Hasil ...
Terbentuknya jalur akson katekolamin di medulla oblongata ... Intensitas pewarnaan neuron KA di AP ... Pembuluh darah pada AP ... Pembahasan ...
Anatomi area postrema ... Perkembangan morfologi neuron KA di AP ... Migrasi neuron KA pada medula oblongata dan distribusinya ... Diferensiasi neuron KA di AP menjadi neuron DA atau NA ... Terbentuknya jalur akson katekolamin di medula oblongata ... Intensitas pewarnaan neuron KA di AP ... Pembuluh darah pada AP ...
KESIMPULAN DAN SARAN ... Kesimpulan ... Saran ...
DAFTAR PUSTAKA ... 52 52 52 56 56 56 58 59 61 62 63
64 64 64
DAFTAR GAMBAR
Hal
Gambar 1. Gambar 2. Gambar 3. Gambar 4. Gambar 5. Gambar 6. Gambar 7. Gambar 8. Gambar 9. Gambar 10. Gambar 11. Gambar 12. Gambar 13. Gambar 14. Gambar 15.
Potongan di bidang median otak manusia...
Perkembangan sistem syaraf manusia pada bulan pertama kebuntingan...
Skema perkembangan neuron dan neuroglia di buluh neural dan krista neural ...
Skema perkembangan otak. ………..
Klasifikasi neurotransmiter...
Sintesis berbagai jenis katekolamin yang ditemukan pada jaringan syaraf serta enzim yang terlibat dalam seri
perubahannya ...
Metabolisme katekolamin oleh enzim
catechol-O-méthyltransferase (COMT) dan mono-aminoxidase (MAO) ..
Potongan batang otak pada bidang frontal (kiri) dan bidang sagital (kanan) pada monyet Rhesus...
Potongan koronal AP tikus dengan pewarnaan
imunositokimia terhadap TH ...
Skema tahap-tahap penelitian mulai dari seleksi induk, preparasi sampel sampai ke pewarnaan imunohistokimia ....
Sayatan koronal medula oblongata pada P 105 dengan perwarnaan imunohistokimia terhadap TH...
Gambaran mikroskopis area postrema pada P 10 dengan pewarnaan HE ...
Sayatan koronal bakal medula oblongata pada F 40 dengan pewarnaan imunohistokimia terhadap TH ...
Sayatan koronal daerah bakal AP di medula oblongata pada F 55 dengan pewarnaan imunohistokimia terhadap TH ...
Perkembangan bentuk neuron katekolaminergik di AP mulai F 40 sampai P 105 ...
Gambar 16.
Gambar 17.
Gambar 18.
Gambar 19.
Gambar 20.
Gambar 21.
Gambar 22.
Gambar 23.
Gambar 24.
Gambaran skematis perkembangan bentuk neuron KA di AP mulai F 40 sampai P105. ...
Sayatan koronal daerah medula oblongata pada F 55
dengan pewarnaan imunohistokimia terhadap TH...
Sayatan koronal daerah medula oblongata pada F 70
dengan pewarnaan imunohistokimia terhadap TH ...
Sayatan sagital AP pada F 55 dengan pewarnaan
imunofloresen label ganda terhadap TH dan DBH ...
Sayatan sagital AP pada F 70 dengan pewarnaan
imunofloresen label ganda terhadap TH dan DBH ...
Sayatan sagital AP pad F 145 dengan pewarnaan
imunofloresen label ganda terhadap TH dan DBH ...
Jalur akson katekolamin ventral ascenden catecholamine pathway (acpv) di medula oblongata pada F 120 dengan pewarnaan imunohistokimia terhadap TH ...
Sayatan koronal area postrema pada F 100 dengan
pewarnaan imunohistokimia terhadap TH ...
Sayatan koronal area postrema dengan pewarnaan
imunohistokimia terhadap TH pada P 10 ...
45
46
47
49
50
51
53
54
DAFTAR SINGKATAN
A AADC acpv AP COMT CTZ CVO DA DAB DBH DVC FITC ir-DBH ir-TH KA MAO MEP MN NA NGF NHS NMN PB PBS PNMT SIDS THVMA
= = = = = = = = = = = = = = = = = = = = = = = = = = = = adrenergikaromatic amino acid DOPA decarboxylase
ventralascending catecholamine pathway
area postrema
catechol O-methyl transferase
chemoreceptor trigger zone
circumventricular organ dopaminergik
3,3-diamino benzidine tetrahydrochloride dopamine ß-hydroxylase
dorsal vagal complex
fluorocein-iso-thiocyanate
imunoreaktif DBH imunoreaktif TH katekolaminergik
monoamine oxidase monyet ekor panjang
metanephrine noradrenergik
neuronal growth factors
normal horse serum
normetanephrine
phosphate buffered
phosphate buffered saline
phenylethanolamine N-methyl transferase
sudden infant death syndrome
tyrosine hydroxylase
PENDAHULUAN
Latar belakang
Suatu individu sering berada dalam lingkungan yang tidak sesuai dengan kondisi yang diharapkan, sehingga diperlukan sistem yang peka terhadap perubahan lingkungan agar homeostasis tubuh tetap terjaga. Salah satunya adalah sistem syaraf, yang merupakan pengatur sistem-sistem tubuh untuk memelihara homeostasis, karena kemampuannya menerima rangsangan, baik eksternal maupun internal, mengolah serta mengintegrasikan rangsangan tersebut untuk diteruskan ke organ target agar mendapat tanggapan. Sistem syaraf terdiri dari sistem syaraf pusat yakni otak dan medula spinalis, serta sistem syaraf perifer yaitu serabut-serabut syaraf dan ganglion (Carola et al. 1990). Untuk menjalankan fungsinya, sistem syaraf mempunyai neuron sebagai unit anatomis dan fungsional terkecil, serta neuroglia sebagai sel penunjang. Neuron tersusun atas badan sel atau perikarion, serta dua jenis prosesus sitoplasma, yakni tempat masuknya impuls (dendrit) dan tempat keluarnya impuls (akson), sedangkan daerah antar sel yang merupakan tempat akson dan dendrit saling bersinapsis disebut neurofil (Shepherd 1983). Kumpulan badan sel syaraf pada sistem syaraf pusat dinamakan nukleus, sedang yang berada pada sistem syaraf perifer disebut ganglion (Banks 1993).
Komponen terbesar sistem syaraf pusat adalah otak, yang secara embrional berkembang dari lempeng neural (neural plate), yaitu suatu penebalan lapis ektodermal di bagian dorsal embrio. Di sisi lempeng neural terdapat sepasang penonjolan jaringan yang kemudian bergabung membentuk buluh neural (neural tube) dengan rongga di tengahnya yang disebut canalis neuralis.
Tepi ektodermal yang berbatasan dengan buluh neural selanjutnya berkembang membentuk krista neural, yang kemudian berkembang menjadi ganglion, sel kromafin di medula adrenal, neuron bipolar pada alat pendengaran, dan selaput pembungkus otak.
sinaps, baik secara elektrik maupun kimiawi. Penghantaran impuls secara elektrik terjadi karena adanya perbedaan aksi potensial pada akson, sehingga sinyal berjalan dari pangkal akson menuju ke ujung dan diteruskan ke organ target oleh gap junction, sedang penghantaran sinyal secara kimiawi memerlukan bahan kimia perantara yang disebut dengan neurotransmiter. Neurotransmiter ini dilepaskan dari ujung akson menuju ke daerah synaptic gap,
yang kemudian ditangkap oleh reseptor pada organ target untuk menghasilkan reaksi.
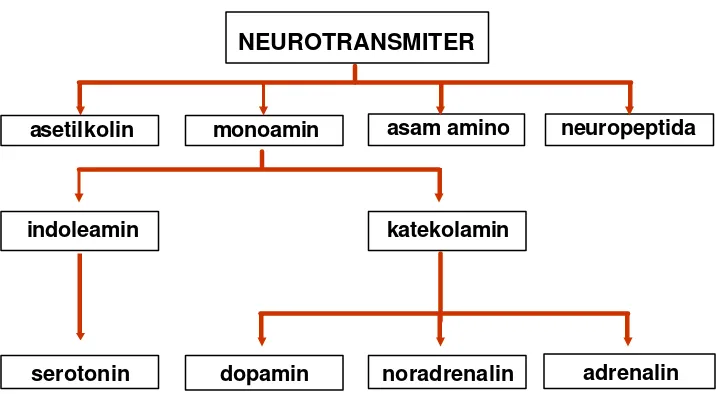
Di otak, terdapat kurang lebih 50 macam neurotransmiter, yang pada garis besarnya digolongkan menjadi golongan asetilkolin, monoamin, asam amino, dan peptida. Golongan monoamin terdiri atas kelompok katekolamin (contohnya dopamin, noradrenalin, dan adrenalin), serta kelompok indoleamin (contohnya adalah serotonin). Neuron yang mensintesa katekolamin disebut neuron katekolaminergik (KA).
Katekolamin disintesa dari asam amino tirosin sebagai prekursor, yang kemudian diubah menjadi catecholamine dihydroxyphenylalanine (disebut juga DOPA) dengan penambahan sebuah gugus hidroksil pada cincin katekol oleh enzim tyrosine hydroxylase (TH). Selanjutnya DOPA mengalami dekarboksilasi pada kelompok amin menjadi dopamin oleh enzim DOPA decarboxylase. Karena enzim DOPA decarboxylase juga bekerja pada substrat asam amino aromatik lain, maka enzim ini sering disebut juga dengan aromatic amino acid DOPA decarboxylase (AADC).
Keberadaan katekolamin di dalam jaringan dapat diidentifikasi dengan beberapa cara, antara lain dengan mendeteksi katekolamin itu sendiri, enzim yang mensintesis maupun memetabolisir, ataupun kompleks uptake yang terbentuk setelah degradasi katekolamin. Salah satu metode anatomis yang biasa digunakan untuk mengidentifikasi katekolamin tersebut adalah teknik imunohistokimia. Teknik imunohistokimia yang dipakai untuk mengidentifikasi keberadaan neuron dopaminergik (DA), noradrenergik (NA), dan adrenergik (A), dikerjakan dengan menggunakan antibodi terhadap TH, yang merupakan enzim pertama dalam jalur sintesa katekolamin, sedang untuk mendeteksi neuron NA digunakan antibodi terhadap DBH. Dengan metode yang sama sering juga dilakukan identifikasi terhadap keberadaan neuron A, dengan memanfaatkan antibodi terhadap PNMT.
Pada manusia dewasa, neuron KA berfungsi untuk mengontrol perasaan (mood), aktivitas psikomotorik, mengatasi gangguan emosional (affective disorder) dan kegelisahan (Carlsson 1987), semangat (drives), penghargaan (reward), nafsu makan, minum dan reproduksi (Fellous 1999), serta mengatur fungsi endokrin dan sistem syaraf otonom (Tillet 1994). Pada masa prenatal, katekolamin penting bagi perkembangan fetus, sedangkan pada masa postnatal berperan dalam mempertahankan daya hidup (Zhou et al. 1995; Thomas et al. 1995). Organisasi neuron KA yang memiliki peran besar dalam sistem homeostasis tubuh salah satunya adalah area postrema (AP).
dopamin dan noradrenalin, serta enkefalin dan serotonin. Selain itu, AP juga mendapat input katekolamin dalam bentuk adrenalin dan serotonin, asetilkolin, L-glutamat, substansi P, dan beberapa peptida seperti arginine vasopressin,
angiotensin, dan sitokin. Mekanisme DA dan A di AP ini diduga kuat berperan dalam proses muntah.
Di otak terdapat beberapa CVO, yaitu organ yang letaknya berdekatan dengan ventrikel, pembuluh darahnya memiliki fenestra, dan tidak dibatasi oleh
blood brain barrier. Struktur ini membuatCVO peka terhadap perubahan humoral maupun neuronal. Bagian dari otak yang termasuk CVO adalah organ vaskulosum lamina terminalis, eminensia mediana, neurohipofisis, organ subfornikal, dan AP. Secara umum, CVO merupakan tempat bersirkulasinya beberapa hormon seperti peptida hipotalamus, steroid, sitokin, dan angiotensin II yang berfungsi sebagai neuroendokrin, sehingga sangat erat kaitannya dengan berbagai fungsi homeostasis tubuh.
Muntah tidak selalu berhubungan dengan penyakit, tetapi merupakan reaksi tubuh untuk mengeluarkan bahan berbahaya. Dalam pemberian kemoterapi untuk menghentikan mitosis sel kanker, biasanya diikuti dengan efek samping mual dan muntah. Kondisi ini apabila tidak dikendalikan dapat menyebabkan komplikasi fisik maupun psikis yang sering mendorong pasien menghentikan proses pengobatannya karena tidak tahan terhadap rasa mual dan muntah tersebut. Untuk mengatasi itu, para peneliti sedang mempelajari cara mempengaruhi fungsi AP agar rasa mual dan muntah dapat dihilangkan pada saat kemoterapi, sehingga pasien merasa lebih nyaman (Kufe et al. 2003). Pada proses muntah yang disebabkan oleh kemoterapi dan bahan kimia lainnya, AP berfungsi sebagai chemoreceptor trigger zone (CTZ) (Klara dan Brizzee 1975; Brizzee et al. 1978; Miller dan Leslie 1994), meskipun mekanisme pastinya belum diketahui.
tahun 2000 sampai 2005). Lebih dari separuh (60%-70%) kematian tersebut berkaitan dengan abnormalitas kronis yang terjadi sebelum kelahiran. Oleh karena itu, hasil dari penelitian intensif mengenai perkembangan AP yang diduga terkait erat dengan peristiwa SIDS ini diyakini dapat membantu menurunkan angka kematian dan menyelamatkan lebih banyak bayi. Hal ini penting, terutama pada ibu yang pernah melahirkan bayi yang mengalami SIDS, bayi yang lahir berikutnya memiliki predisposisi yang tinggi untuk mengalami hal sama (The American SIDS Institute 2005). Penyebab pasti terjadinya SIDS sampai saat ini belum diketahui, tetapi diduga kuat akibat adanya gangguan perkembangan AP dan sirkuitnya pada bayi, meskipun tidak menutup kemungkinan karena adanya infeksi serta gangguan sistem respirasi dan kardiovaskuler. Dalam kondisi normal, AP bertugas merespon adanya hiperkapnia (peningkatan kadar CO2 dalam darah), yang dimungkinkan karena adanya peran neuron KA dalam mengontrol sistem respirasi dan kardiovaskuler.
Gangguan perkembangan AP pada janin dapat disebabkan oleh karena adanya stres lingkungan, antara lain disebabkan oleh asap rokok yang mengandung nikotin dan inhalasi carbon monoksida, yang keduanya diketahui berpengaruh secara signifikan terhadap perkembangan AP dan menganggu proses maturasi neuron serta pembentukan sirkuitnya (Gozal dan Gaultier 2001). Pemeriksaan terhadap pasien yang meninggal karena SIDS ditemukan adanya penurunan secara signifikan imunoreaktivitas TH pada neuron di medula oblongata, yaitu di AP, nukleus traktus solitarius, nukleus retikular sentralis, nukleus motor dorsalis dari nervus vagus, dan area ventrolateralis.
pada manusia dewasa. Neuron KA di AP pada hewan dewasa ditemukan pada beberapa spesies, antara lain tikus, kucing, kelinci, anjing, dan marmut. Keberadaan neuron KA pada monyet dewasa di AP masih perlu diteliti lagi karena adanya kontroversi publikasi, seperti antara laporan Felten dan Sladek (1983) yang menyatakan bahwa neuron KA tidak ditemukan pada monyet Rhesus squirrel monkey dewasa, dan monyet Jepang (Kitahama et al. 1994), namun menurut Schreihofer et al. (1997), neuron KA masih ditemukan pada monyet ekor panjang (MEP) dan monyet Rhesus dewasa.
Sebagai organ yang terletak di bagian medial buluh neural, neuron di AP juga berkontribusi dalam membentuk medula oblongata. Mengingat besarnya peran neuron KA di AP dalam mengontrol sistem respirasi dan kardiovaskular, proses muntah, dan keterkaitannya dengan kejadian SIDS, serta belum lengkapnya informasi anatomis tentang perkembangan neuron tersebut pada masa prenatal dan postnatal, merupakan alasan kuat dilakukannya penelitian mengenai perkembangan neuron KA di AP ini.
Tujuan penelitian
Penelitian ini bertujuan mempelajari tahap kesiapan sistem respirasi, kardiovaskular, dan refleks muntah pada janin dan anak MEP, melalui pengamatan tahap perkembangan bentuk, pola migrasi, distribusi, diferensiasi, dan proses maturasi neuron KA di AP dan area di sekitarnya yang terkait.
Manfaat penelitian
TINJAUAN PUSTAKA
Biologi Macaca fascicularis
Macaca fascicularis disebut juga Long-tailed macaque atau dalam Bahasa Indonesia monyet ekor panjang (MEP). Sinonim lain dari Macaca fascicularis adalah monyet cynomolgus,Macaca irus, monyet pemakan kepiting (crab eating monkey), dan monyet jawa (Soehartono dan Mardiastuti 2002). Hewan ini memiliki warna rambut yang bervariasi, mulai dari abu-abu sampai coklat kemerahan, dengan warna pada tubuh bagian bawah lebih muda, dan rambut di daerah mahkota tumbuh ke belakang seperti krista atau jambul. Pada individu jantan terdapat jambang dan kumis, sedangkan betinanya berjenggot. Bayi yang baru lahir memiliki rambut hitam yang kemudian berubah menjadi keabu-abuan ketika dewasa. Panjang tubuh betina dewasa mencapai 385-503 mm, sedangkan pada jantan dewasanya dapat mencapai 412-648 mm. Panjang ekor betina dewasa bervariasi antara 400-550 mm, sementara pada jantan dewasa antara 435-655 mm (Rowe 1996).
Monyet ekor panjang memiliki bobot tubuh pada individu betina dewasa berkisar 2,5-7 kg, sedang jantan dewasa antara 4,7-8,3 kg, dengan berat otak hewan dewasanya kurang-lebih 69,2 g. Periode bayi berlangsung antara umur 6-12 bulan, masa sapih antara umur 6-12-24 bulan, dan masa puber berlangsung pada umur 42-54 bulan. Dewasa kelamin untuk betina dicapai pada umur 51,6 bulan, sedangkan pada jantan umur 50,4 bulan. Hewan ini memiliki panjang siklus estrus 28 hari, dengan lama kebunt ingan antara 160-170 hari. Interval dari bunting ke-bunting berikutnya berkisar antara 12-24 bulan, tetapi rata-rata berlangsung selama 13 bulan (Rowe 1996).
Taksonomi MEP menurut Whitney et al. (1995) adalah sebagai berikut: Filum Kelas Ordo Sub ordo Infra ordo Super famili Famili Subfamili Genus Species : : : : : : : : : Chordata Mammalia Primata Anthropoidea Catarrhini Cercopithecoidea Cercopithecidae Cercopithecinae Macaca
Macaca fascic ularis
Satwa primata merupakan salah satu sumber daya alam yang mempunyai peranan penting dalam kehidupan manusia, khususnya sebagai hewan model dalam penelitian biomedis, karena secara anatomis dan fisiologis memiliki banyak kemiripan dengan manusia dibandingkan dengan hewan model lainnya. Nilai ilmiah satwa primata untuk penelitian biomedis diperoleh dari kemiripan anatomis dan fisiologisnya dengan manusia karena adanya kedekatan filogenetik (Vandeberg 1995). Menurut Soehartono dan Mardiastuti (2002), sampai saat ini spesies primata non manusia yang paling banyak digunakan untuk hewan riset adalah monyet Rhesus (Macaca mullata), MEP (Macaca fascicularis), babun savana (Papio cynocephalus), dan monyet vervet (Cercopithecus aethiops).
Anatomi dan fungsi otak
neuron, yang merupakan unit anatomis dan fungsional terkecil, dengan didukung oleh neuroglia sebagai sel penunjang. Secara anatomis, neuron terdiri atas satu badan sel, satu akson, serta satu atau beberapa dendrit (Carola et al. 1990; Banks 1993). Dendrit merupakan prosesus sitoplasma yang berfungsi menerima impuls masuk ke badan sel, sedangkan akson berfungsi untuk meneruskan impuls menuju organ target atau neuron lain (Shepherd 1983). Akson dan dendrit saling bersinapsis di daerah antar sel yang disebut dengan
neurofil. Badan sel sendiri berfungsi sebagai tempat untuk mengolah, menyeleksi, dan mengintegrasikan impuls, tersusun atas inti sel beserta sitoplasma di sekitar inti. Kumpulan badan-badan sel tersebut yang terdapat pada sistem syaraf pusat disebut dengan nukleus, sedangkan pada sistem syaraf perifer disebut ganglion (Carola et al. 1990).
Neuron memiliki tiga zona fungsional, yaitu zona dendritik, aksonik, dan telodendritik. Zona dendritik adalah zona yang peka terhadap stimulus, baik yang bersifat eksitatorik maupun inhibitorik, terdiri dari dendrit, badan sel, dan segmen awal akson, sedang zona aksonik terdiri dari akson yang dimulai dari segmen awal sampai di dekat terminal akson, berfungsi untuk meneruskan atau menghambat impuls. Zona telondendritik merupakan daerah terminal akson yang sudah mengalami modifikasi untuk mentransfer informasi ke elemen selanjutnya. Terminal akson berhubungan dengan neuron lain atau sel efektor di daerah transmisi elektrokimiawi yang disebut dengan sinaps (Banks 1993).
Interneuron yang sering disebut juga dengan istilah neuron asosiasi, neuron konektor atau neuron internusial, mempunyai fungsi untuk membawa impuls dari neuron sensoris ke neuron motoris (Carola et al. 1990). Ujung dendrit pada neuron sensoris sangat peka terhadap stimulasi baik dari eksternal maupun internal, karena memiliki reseptor, atau berhubungan dengan reseptor sensoris (Banks 1993).
Berdasarkan jumlah prosesus sitoplasmanya, neuron pada sistem syaraf dapat dibagi menjadi neuron multipolar, bipolar, unipolar, unipolar semu dan neuron an-aksonik. Sebagian besar neuron di otak dan medula spinalis adalah neuron multipolar, yakni neuron yang memiliki beberapa dendrit. Neuron bipolar memiliki satu dendrit yang letaknya berlawanan arah dengan akson. Neuron berbentuk bipolar ini lebih banyak dijumpai pada masa perkembangan karena merupakan bentuk perantara sebelum menjadi neuron dewasa. Seperti halnya neuron bipolar, neuron unipolar yang hanya memiliki sebuah akson hanya ditemukan selama periode perkembangan saja. Neuron unipolar semu adalah neuron yang memiliki sebuah akson serta sebuah dendrit dan kedua prosesus sitoplasma tersebut seperti bergabung namun sebenarnya saling terpisah. Neuron unipolar semu sebagian besar merupakan penyusun neuron sensoris pada sistem syaraf perifer. Kelompok terakhir adalah neuron an-aksonik, yaitu neuron yang tidak memiliki akson yang merupakan kelompok terkecil pada sistem syaraf, seperti neuron amakrin pada retina mata (Carola et al. 1990; Banks 1993).
Oligodendrosit berukuran lebih kecil dengan prosesus sitoplasma yang lebih sedikit dibanding astrosit, memiliki fungsi untuk menghasilkan mielin. Mikroglia dari segi ukuran juga kecil, berbentuk oval dengan sedikit prosesus sitoplasma, dapat bergerak dan merupakan komponen pertahanan di otak karena kemampuannya memfagositosis zat asing. Sel ependima memiliki bentuk pipih sampai kuboid dan merupakan sel pelapis permukaan otak yang berbatasan dengan ventrikel (Jenkins 1978).
Otak sebagai komponen terbesar sistem syaraf dilindungi oleh tulang tengkorak serta tiga lapisan selaput pembungkus yang kuat. Dari luar ke dalam, lapisan pembungkus otak meliputi duramater, arakhnoidea dan piamater. Duramater tersusun atas jaringan ikat kolagen padat, sedang arahnoidea terdiri atas jaringan ikat kolagen yang tersusun membentuk rongga-rongga seperti jala dan terisi cairan serebrospinal, sehingga otak selalu diliputi oleh cairan tersebut. Selain itu, arahnoidea juga merupakan area perlintasan pembuluh darah di otak. Piamater letaknya paling dalam, merupakan lapisan jaringan ikat longgar yang tipis dan langsung berbatasan dengan otak. Arakhnoidea kaya akan kapiler yang bertugas memberi suplai darah pada otak (Banks 1993).
Sebagai komponen terbesar sistem syaraf, otak dibagi menjadi forebrain
(otak depan), midbrain (otak tengah), dan hindbrain (otak belakang) (Gambar 1). Otak depan terdiri dari telensefalon dan diensefalon, otak tengah dibentuk oleh mesensefalon, dan otak belakang terdiri atas metensefalon dan mielensefalon (Carola et al. 1990).
hipotalamus berfungsi untuk mengatur aktivitas syaraf otonom dan sekresi hormon oleh kelenjar pituitari (Carola et al. 1990).
Mesensefalon terdiri atas korpora kuadrigemina yang penting sebagai tempat melintasnya jalur pendengaran dan penglihatan. Lebih dari itu, mesensefalon juga berperan dalam mengendalikan gerakan mata dan otot skelet. Di kaudal mesensefalon dijumpai metensefalon yang terbentuk dari pons di bagian ventral dan serebelum di bagian dorsal. Serebelum berfungsi untuk menerima input somatosensorik dari medula spinalis, menerima informasi motoris dari korteks serebri dan informasi keseimbangan dari organ vestibular di telinga bagian dalam, serta menyatukan informasi dan mengkoordinasikan rencana, waktu, dan pola kontraksi otot selama individu bergerak. Pons bersama dengan medula oblongata (mielensefalon) berfungsi mengontrol tekanan darah dan respirasi, serta berperan dalam pengaturan proses muntah, batuk, dan menelan (Carola et al. 1990).
Perkembangan otak
Pada embrio mamalia yang sedang berkembang, lapisan ektodermal di bb tahap selanjutnya, sel-sel di zona ventrikularis ini berkembang menjadi dua macam sel, yaitu sel prekursor neuron dan sel prekursor glia, sehingga zona ventrikularis ini sering disebut juga zona germinalis. Sel prekursor neuron (neuroblas) pada proses neurogenesis kemudian bermigrasi menuju tempat
perkembangan akhir untuk berdiferensiasi menjadi sel yang memiliki struktur, fungsi, dan penjuluran spesifik, serta mengalami mielinasi (Shepherd 1983; Insel 2000; Morilak et al. 2000). Menurut Velle dan La Velle 1970 (disitasi dari Lorke et al. 2003), dalam sitodiferensiasi secara umum terjadi tiga tahap perkembangan morfologi neuron, yaitu tahap perkembangan awal, neuron bersifat apolar, berbentuk bulat tanpa prosesus sitoplasma. Pada tahap perkembangan menengah, neuron berbentuk bipolar, memiliki satu atau dua prosesus sitoplasma yang masih pendek. Tahap perkembangan akhir ditandai dengan bentuk neuron yang telah mencapai bentuk definitifnya, yaitu bentuk neuron multipolar yang memiliki beberapa dendrit, dan bentuk neuron bipolar yang hanya memiliki sebuah dendrit, dengan prosesus sitoplasma yang sudah mencapai tempat inervasinya.
Daerah di antara buluh neural dengan lapisan epidermis selanjutnya berkembang menjadi krista neural. Neuroblas di krista neural kemudian
krista neural
sistem syaraf otonom, neuron bipolar pada alat pendengaran, dan sel kromafin di medula kelenjar adrenal. Krista neural tersebut, bersama dengan buluh neural selanjutnya membentuk selaput arakhnoidea dan piamater yang membungkus otak, serta neuroglia yang lain seperti mikroglia dan sel Schwann (Shepherd 1983). Gambar 3 menunjukkan gambaran skematis perkembangan sel prekursor sistem syaraf, mulai dari buluh neural, pembentukan neuron, neuroglia, serta jaringan pembungkus otak dan medula spinalis.
Otak yang berasal dari bagian rostral buluh neural kemudian berdilatasi, dari anterior ke posterior berturut-turut dinamai prosensefalon atau otak bagian depan, mesensefalon atau otak bagian tengah, dan rombensefalon atau otak bagian belakang. Prosensefalon berdiferensiasi menjadi telensefalon dan diensefalon. Mesensefalon tidak berdilatasi tetapi mengalami pelangsingan di bagian belakangnya, sedang rombensefalon tumbuh menjadi dua bagian yaitu metensefalon di bagian depan dan mielensefalon di bagian belakang (Jenkins 1978; Carola et al. 1990; UNAM 2003). Secara umum buluh neural terdiri atas
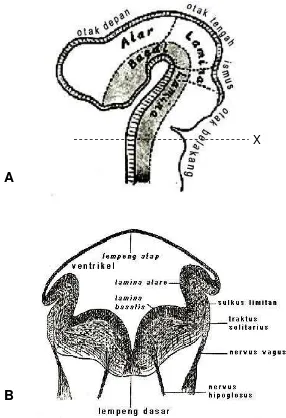
lamina alaris yang terletak di bagian dorsal dan lamina basalis yang terletak di bagian ventral rombensefalon. Selama masa perkembangan kanalis neuralis, bagian dorsal rombensefalon mengalami perluasan ke samping membentuk ventrikel IV, sehingga lamina alaris menjadi terletak di sebelah dorsolateral
lamina basalis seperti (Gambar 4). Dalam perkembangan selanjutnya, lamina alaris akan menjadi neuron yang bersifat sensorik, sedang lamina basalis
menjadi neuron yang bersifat motorik. Kedua lamina tersebut dipisahkan oleh celah yang disebut sulkus limitan (Jenkins 1978).
Untuk merunut asal-usul neuron dapat dilakukan dengan cara melabel DNA-nya menggunakan isotop H3
Gambar 3. Skema perkembangan neuron dan neuroglia di buluh neural dan krista neural (Sumber: Shepherd 1983).
yang bersangkutan diamati pada usia menjelang dewasa. Pada pengamatan tersebut akan teramati distribusi neuron yang terjadi pada umur ketika hewan diberi perlakuan H3 thymidine, sekaligus waktu mitosis terakhir yang terjadi (Levitt dan Rakic 1982; Insel 2000; Morilak et al. 2000). Neuron-neuron yang berukuran besar umumnya diproduksi lebih awal dibanding neuron yang berukuran kecil, sehingga neuron motorik akan terbentuk mendahului neuron sensorik (Insel 2000).
Proses pergerakan migrasi neuron di medula oblongata terjadi secara amuboid, yang dimungkinkan dengan adanya prosesus yang ujungnya memiliki
growth cone (Shepherd 1983). Dalam bermigrasi, neuroblas akan menggantung pada sel glia radial agar sampai ke tempat akhir. Sel-sel glia radial biasanya hanya terdapat pada periode tertentu dalam masa perkembangan, yang berperan memandu neuron untuk bermigrasi menuju tempat akhir. Sebelum mulai bermigrasi, neuron di zona intermedia akan bergerak menyesuaikan orientasinya menuju ke arah tujuan migrasi (Shepherd 1983; Insel 2000; Morilak
et al. 2000).
Secara umum proses diferensiasi sel, yang diartikan sebagai keseluruhan proses pembentukan neuroblas sampai ke bentuk akhir neuron (Shepherd 1983), dapat berlangsung sebelum, pada saat, maupun sesudah sel bermigrasi (Morilak 2000). Setelah neuron mencapai tempat tujuan akhir, mereka akan mengalami proses diferensiasi untuk membentuk konektivitas. Diduga kuat, arah perkembangan akson yang dimulai dari ujung pertumbuhan akson (axonal growth cone) menuju ke sel target berlangsung karena adanya sekresi neuronal growth factors (NGF) oleh sel target yang akan diinervasinya (Shepherd 1983; Insel 2000; Morilak et al. 2000). Beberapa NGF yang sudah diketahui selama ini adalah brain-derived neurothrophic factors, neurotrophin-3, 4 dan 5. Substansi tersebut menyebar di daerah target kemudian diambil oleh terminal akson melalui reseptor yang ada pada bagian tersebut dan dibawa secara retrograde
Gambar 4. Skema perkembangan otak.
A. Sayatan memanjang bakal otak yang membentuk tiga vesikel: otak depan, otak tengah, dan otak belakang. Sayatan koronal AP ditunjukkan oleh garis X.
B. Sayatan melintang (Sumber: Barleby.com 2000).
A
B
berdekatan saling bergabung membentuk untaian jalur akson. Terbentuknya untaian jalur akson itu sendiri terjadi karena akson mengeluarkan molekul protein adesi di permukaan serabut akson, sehingga memungkinkan permukaan serabut akson tersebut saling berikatan satu sama lain (Morilak et al. 2000).
Setelah diferensiasi, proses akan berlanjut ke tahap akhir maturasi neuron, yang merupakan saat perkembangan lanjutan prosesus sitoplasma, yang ditandai dengan adanya konektivitas serabut yang sempurna dan membentuk sinaps. Pada tipe neuron bermielin, maturasi neuron ditandai dengan terbentuknya mielin (Shepherd 1983; Morilak et al. 2000).
Neurotransmiter
Komunikasi antar bagian otak, maupun otak dengan organ target umumnya terjadi melalui penghantaran stimuli melalui sinaps, baik secara elektrik maupun kimia. Penghantaran stimuli secara kimia dapat berlangsung karena adanya zat pembawa yang disebut neurotransmiter, yaitu molekul kecil yang dilepaskan oleh bagian pres inaptik neuron ke dalam celah sinaptik, sehingga menimbulkan perubahan potensial pada membran post-sinaptik neuron atau organ target. Neurotransmiter tersebut disintesa di badan sel, dibungkus dalam vesikel, untuk kemudian dibawa menuju daerah synaptic buttons di terminal akson yang berdekatan dengan daerah sinaps (Carola et al. 1990; Erlandsen 2002).
Neurotransmiter adalah bahan kimia yang disintesa oleh sel syaraf dan disimpan di dalam kantong sekresi. Pada saat ion kalsium yang berasal dari celah sinaptik membanjiri kantong sekresi, menyebabkan bergeraknya kantong sekresi tersebut menuju ke membran presinaptik. Bergabungnya kantong sekresi dengan membran presinaptik menyebabkan terbukanya membran presinaptik, sehingga neurotransmiter yang disimpan dalam kantung sekresi dilepaskan ke celah sinaptik menuju ke membran postsinaptik. Adanya neurotransmiter pada membran postsinaptik menyebabkan respon perangsangan ataupun penghambatan. Respon ini merupakan kemampuan reseptor yang dipicu oleh neurotransmiter. Sebagai contoh adalah neurotransmiter asetilkolin yang menyebabkan respon perangsangan pada
Neurotransmiter pada garis besarnya digolongkan menjadi golongan asetilkolin, monoamin, asam amino, dan peptida (Gambar 5). Golongan monoamin dibagi menjadi kelompok katekolamin dan indoleamin. Kelompok katekolamin meliputi tiga macam neurotransmiter yaitu dopamin, noradrenalin, dan adrenalin, sedang kelompok indoleamin adalah serotonin. Neuron yang mensintesa katekolamin disebut neuron katekolaminergik (neuron KA) (Reiner 1994 ; Smeets dan Reiner 1994).
Katekolamin
[image:33.596.130.490.125.322.2]Katekolamin merupakan neurotransmiter yang tersusun atas sebuah cincin benzena dengan dua gugus hidroksil yang berdekatan dan sebuah rantai amin yang letaknya berlawanan. Dua gugus hidroksil tersebut merupakan bagian katekol pada katekolamin (Angevine dan Cotman 1981; Reiner 1994). Katekolamin disintesis dengan perubahan secara serial dari satu katekolamin ke katekolamin lain (Gambar 6) dimulai dari asam amino tirosin sebagai prekursor, yang selanjutnya diubah menjadi catecholamine dihydroxyphenylalanine (L-DOPA) dengan penambahan sebuah gugus hidroksil pada cincin katekol oleh enzim TH (Reiner 1994; Erlandsen 2002). Gambar 5. Klasifikasi neurotransmiter (Sumber: Carola et al. 1990).
asam amino NEUROTRANSMITER
asetilkolin monoamin
indoleamin katekolamin
Enzim pertama pada sintesis katekolamin adalah TH, yang merubah tirosin menjadi L-DOPA. Melalui proses dekarboksilasi pada kelompok amin, L-DOPA kemudian diubah menjadi dopamin oleh enzim DOPA decarboxylase. Karena enzim DOPA decarboxylase juga bekerja pada substrat asam amino aromatik lain, maka enzim ini disebut juga AADC. Dopamin merupakan salah satu produk pada sintesis katekolamin yang selain aktif secara biologis, berperan juga sebagai prekursor untuk sintesis noradrenalin dengan menambahkan gugus hidroksil ke kelompok karbon yang berada di dekat cincin katekol oleh enzimDBH. Di tempat tertentu pada sistem syaraf pusat dan sistem syaraf perifer, noradrenalin diubah menjadi adrenalin dengan cara metilasi kelompok amin terakhir oleh enzim PNMT (Reiner 1994; Erlandsen 2002).
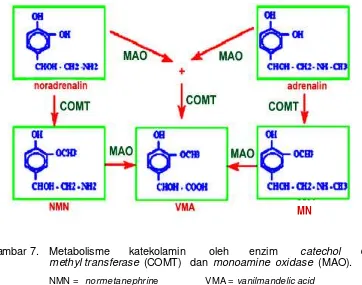
Gambar 7 menunjukkan proses metabolisme KA oleh enzim catechol O-methyl transferase (COMT), yang mengubah katekolamin menjadi dua kelompok metoksiamin yaitu normetanephrine (NMN) dan metanephrine (MN). Gambar 6. Sintesis berbagai jenis katekolamin yang ditemukan pada
[image:34.596.119.499.123.348.2]Katekolamin juga dimetabolisir oleh enzim monoamine oxidase (MAO), yang bekerja dengan menghilangkan gugus amin pada katekolamin dan metoksiamin, menjadi vanilmandelic acid (VMA) (Reiner 1994; Erlandsen 2002).
Identifikasi katekolamin
Ada beberapa cara untuk mengidentifikasi katekolamin di jaringan, antara lain dengan mendeteksi katekolamin itu sendiri, enzim yang mensintesis maupun memetabolisir, ataupun pada kompleks uptake. Salah satu cara identifikasi yang baik adalah dengan teknik imunohistokimia. Teknik ini bekerja dengan cara mendeteksi neuron yang mengandung enzim katekolamin khusus menggunakan antisera terhadap enzim tersebut. Dengan teknik imunohistokimia, neuron DA akan memberikan reaksi positif terhadap TH dan AADC tetapi tidak terhadap DBH dan PNMT, atau terlabel dopamin tetapi tidak terlabel noradrenalin dan adrenalin, sedang neuron NA akan memberikan reaksi positif terhadap TH, AADC dan DBH. Dengan teknik imunohistokimia akan diperoleh hasil yang baik Gambar 7. Metabolisme katekolamin oleh enzim catechol
O-methyl transferase (COMT) dan monoamine oxidase (MAO).
NMN = normetanephrine VMA = vanilmandelic acid
MN = metanephrine (Sumber: Erlandsen 2002).
[image:35.596.131.493.197.482.2]untuk pendekatan anatomis. Selain jelas dan mudah terbaca, hasilnya juga lebih pasti karena reaksi yang muncul merupakan ikatan antara antigen-antibodi (Reiner 1994; Smeets dan Reiner 1994). Dengan identifikasi imunohistokimia di atas tampak bahwa TH merupakan penanda spesifik untuk neuron KA, karena memberikan reaksi positif baik pada DA maupun NA (Sawaguchi et al. 2003; Verney 2003).
Neuron katekolaminergik
Neuron yang mengandung katekolamin disebut neuron KA. Distribusi neuron KA pada mamalia pertama kali diteliti pada otak tikus oleh Dahlström dan Fuxe (1964), dan dinamai secara alfabet numerik untuk mengidentifikasi kelompok neuron KA pada lokasi yang berbeda. Penamaan kelompok neuron tersebut dimulai dari kaudal ke rostral berturut-turut adalah A1, A2, dan seterusnya sampai A12. Pada perkembangannya, penamaan ini kemudian diterapkan juga pada mamalia lain termasuk manusia (Pearson et al. 1983; Kitahama et al. 1994; Smeets dan Reiner 1994).
Berdasarkan lokasinya, neuron KA di otak mamalia dibagi menjadi enam kelompok utama yaitu: 1) kelompok neuron KA yang terdistribusi pada kaudal rombensefalon, terdiri dari neuron noradrenergik Grup A1, A2, A3, serta neuron adrenergik yaitu Grup C1, C2, C3; 2) kelompok neuron di rostral rombensefalon, terdiri dari neuron noradrenergik Grup A4, A5, A6, A7; 3) kelompok neuron di mesensefalon bagian ventral, yaitu neuron dopaminergik yang termasuk dalam Grup A8, A9, A10 ; 4) Kelompok neuron pada diensefalon, yakni neuron dopaminergik Grup A11, A12, A13, A14, A15 ; 5) kelompok neuron dopaminergik pada bulbus olfaktorius yaitu Grup A16 ; dan 6) kelompok neuron pada retina, terdiri dari neuron dopaminergik Grup A17 (Smeets dan Reiner 1994; Kitahama et al. 1994; Tillet 1994). Hingga kini telah diketahui adanya neuron dopaminergik pada telensefalon manusia dan satwa primata, tetapi tidak dijumpai pada tikus, kecuali pada masa perkembangan (Dubach 1994).
rombensefalon yang berdekatan dengan AP, sedang kelompok A3 hanya ditemukan pada tikus (Dahlström dan Fuxe (1964). Pada monyet, neuron KA Grup A1 memiliki diameter 15-30 µm, dengan sebagian besar sel berbentuk multipolar dan hanya sebagian kecil yang berbentuk bipolar. Neuron ini ditemukan terutama di bagian lateral, dorsal, dan dorsomedial nukleus retikular lateral, memanjang ke arah kaudal mulai dari decusatio pyramidum menuju ke rostral sampai ke daerah yang setara letaknya dengan nukleus olivarius kaudalis. Neuron kelompok A2 berdiameter 20-30 µm, merupakan neuron bipolar, dengan badan sel berbentuk oval dan terdistribusi di bagian sentral nukleus motor dorsalis dari nervus vagus, di bagian medial dan ventromedial nukleus traktus solitarius dorsal, serta di bagian dorsal nukleus hipoglosus. Sebagian kecil neuron Grup A2, yang terdistribusi di bagian lateral, berbentuk multipolar (Felten dan Sladek 1983). Selain Grup A1 dan A2, di medula oblongata juga dijumpai adanya neuron adrenergik Grup C1 di area retikularis lateralis, ventral nukleus ambigus, dan Grup C2 yang terdistribusi di subtansia gelatinosa nukleus traktus solitarius (Kitahama et al. 1994).
Akson katekolamin pada medula oblongata pada perkembangannya kemudian membentuk jalur akson yang disebut dengan ventral ascending catecholamine pathway (acpv) (Felten dan Sladek 1983), yang oleh Angevine dan Cotman (1981) disebut dengan sistem tegmental lateral. Jalur akson tersebut menuju ke hipotalamus, trunkus ensefalikus, dan bagian basal telensefalon.
katekolamin sangat penting bagi perkembangan fetus, sedangkan pada periode postnatal berperan besar dalam mempertahankan daya hidup (Zhou et al. 1995; Thomas et al. 1995).
Pada monyet Rhesus, neuron kelompok monoaminergik (katekolamin dan indoleamin) muncul pertama kali di batang otak pada embrio umur 27–36 hari, dan mencapai puncaknya di daerah medula oblongata ketika embrio berumur 38-40 hari, dengan gradien perkembangan rostrokaudal (Levitt dan Rakic 1982). Pada manusia, neuron KA dapat dijumpai di prosomer, mesomer, dan rombomer saat embrio berumur 4,5 minggu (Verney 2003), sedang pada mencit pertama kali dapat diamati di otak pada umur kebuntingan 10 hari (Zhou
et al. 1995). Banyaknya neuron pada embrio muda ini diduga terjadi karena neuron katekolaminergik mengekspresikan TH, segera setelah meninggalkan zona ventrikularis yang merupakan tempat pembentukan neuron tersebut. Neuron yang sedang berkembang ini didistribusikan dengan pola dorsoventral pada laminabasalis dan laminaalar is. Menurut Verney (2003), calon neuron KA di kaudal rombensefalon terdistribusi pada rombomer ke-6 dan -7 di bagian basal plate (Grup A1 dan C1) dan bagian alar plate (Grup A2 dan C2).
Ketika embrio manusia berumur enam minggu, neuron katekolaminergik (Grup A1 dan C1) semakin banyak tersebar di nukleus ambigus dan sekitarnya, serta di nuklues motor dorsalis dari nervus vagus dan sekitarnya (Grup A2 dan C2), hingga mencapai rombomer ke-7 dan -8. Pada embrio yang berumur empat bulan, neuron noradrenergik dan adrenergik sudah memiliki dendrit, dan di area postrema mulai dapat diamati adanya neuron noradrenergik dan adrenergik berukuran kecil (Verney 1999).
Area postrema
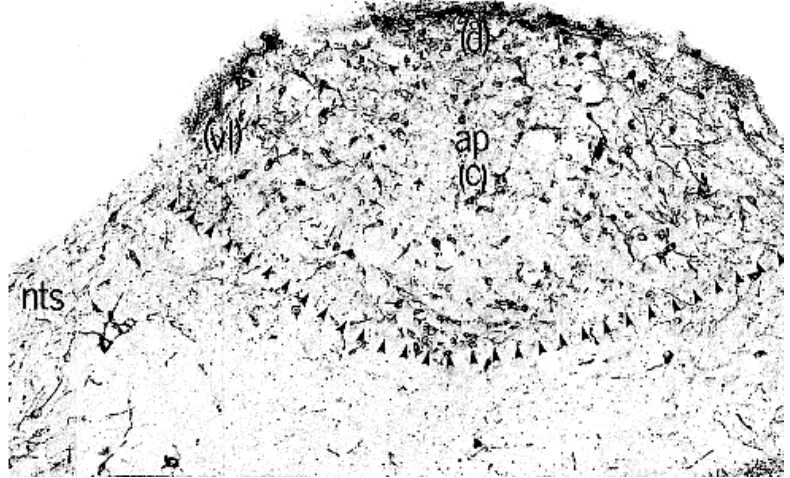
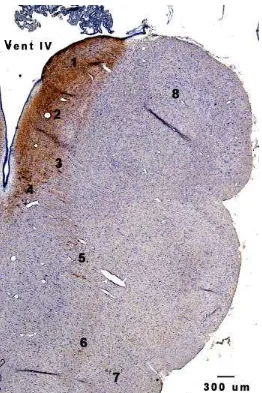
Area postrema (AP) merupakan penonjolan bagian dorsal medula oblongata ke arah ventrikel IV, dan berbentuk agak bulat (Miller dan Leslie, 1994), terletak di sebelah rostral nukleus grasilis dan dorsal terhadap nukleus traktus solitarius (Oertel 1969). Gambar 8 memperlihatkan lokasi AP di medula oblongata monyet Rhesus. Armstrong et al. (1982) membagi AP tersebut menjadi daerah dorsal, sentral, dan ventrolateral (Gambar 9). Bagian dorsal AP berbatasan dengan ventrikel IV, sedangkan bagian ventrolateral berbatasan dengan nukleus traktus solitarius. Permukaan vetrikuler AP yang disebut dengan lapisan ependima dilapisi oleh sel-sel ependima yang bentuknya bervariasi dari kolumner sampai pipih.
Gambar 8. Potongan batang otak pada bidang frontal (kiri) dan bidang sagital (kanan) pada monyet Rhesus .
Area postrema (warna merah) terletak di sebelah dorsal nukleus traktus solitarius (warna hijau tua). Nukleus hipoglosus (warna biru), nukleus motor dorsalis nervus vagus (warna coklat), formasio retikularis sentralis (warna kuning), nukleus ambigus (warna hijau muda), nukleus retikularis lateralis (warna ungu) ( Sumber: Oertel 1969).
[image:39.596.135.470.342.516.2](Armstrong et al. 1982). Pada kelinci, kucing, dan monyet, neuron KA lebih banyak didistribusikan di bawah lapisan ependima, sementara pada marmut lebih dominan di bagian tengah (Fuxe dan Owman 1965). Neuroglia yang ditemukan pada AP sebagian besar adalah astrosit protoplasmik (Klara dan Brizzee 1975).
[image:40.596.110.505.254.493.2]Area postrema merupakan salah satu CVO, yaitu organ-organ yang letaknya berbatasan dengan ventrikel III dan IV, berukuran kecil, tidak dibatasi oleh blood brain barrier, dan pembuluh darahnya berfenestrasi sehingga memiliki permeabilitas tinggi terhadap darah (Ganong 2000; Buller 2001). Selain AP, yang termasuk dalam CVO adalah organ vaskulosum lamina terminalis, Gambar 9. Potongan koronal AP tikus dengan pewarnaan imunositokimia
terhadap TH.
eminensia mediana, neurohipofisis, dan organ subfornikal (Ganong 2000; Lechan 2004). Dengan satu sisi AP menghadap ventrikel IV dan sisi yang lain menghadap parenkim otak, memungkinkan AP dapat mendeteksi bahan kimia emetik, baik yang ada di dalam darah maupun cairan serebrospinal (Miller dan Leslie 1994), sehingga memiliki fungsi sebagai CTZ dalam proses muntah, meskipun mekanisme pastinya belum diketahui (Rosen 2002). Proses muntah diduga terjadi karena reseptor dopamin D2 yang ada di area postrema peka terhadap bahan kimia emetik (Lang dan Marvig 1989, Takeda et al. 2001). Pada AP terdapat neurotransmiter katekolamin (Armstrong et al. 1982; Miceli et al. 1987; Hermann et al. 2005) yaitu dopamin (Kalia et al. 1985; Maqbool et al. 1993) dan noradrenalin (Armstrong et al. 1981; Beleslin et al. 1989), serta neurotransmiter yang lain, yaitu enkefalin (Armstrong et al. 1981) dan serotonin (Miceli et al. 1987, Hay 2000). Area postrema juga mendapat input adrenalin (Armstrong et al. 1981), serta serotonin (Pickel dan Armstrong 1984; Hay 2001; Farber et al. 2004), asetilkolin (Beleslin et al. 1989), L-glutamat (Hay 2001), substansi P (Armstrong et al. 1981) dan beberapa peptida seperti arginine vasopressin (AVP), angiotensin (Ang II), dan sitokin (Buller 2001).
Area postrema bersama dengan Grup A2, A5, A1, dan A6 merupakan sumber input katekolaminergik untuk nukleus traktus solitarius (Hermann et al.
2005). Di AP ini neuron-neuron memproyeksikan aksonnya ke nukleus traktus solitarius, nukleus motor dorsalis dari nervus vagus, dan nukleus parabrakhialis, yang berperan dalam mengendalikan sistem kardiovaskuler (Hay 2001). Akson dari neuron katekolaminergik di area postrema kemudian bersinaps di nukleus traktus solitarius, dan diduga berkaitan dengan pengaturan refleks gastrium dan kardiovaskuler yang berhubungan dengan respon peptida di sirkulasi (Kachidian dan Pickel 1993).
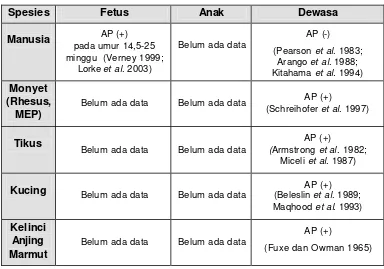
Pada AP mamalia dewasa seperti tikus (Armstrong et al. 1982; Kalia et al. 1985; Miceli et al. 1987), kucing (Beleslin et al. 1989; Ma qbool et al. 1993), anjing, kelinci, marmut (Fuxe dan Owman 1965), monyet Rhesus dan MEP (Schreihofer et al. 1997) dijumpai adanya neuron katekolaminergik (Tabel 1). Tetapi pada manusia, neuron KA di AP hanya ditemukan selama masa prenatal (Lorke et al. 2003), karena tidak ada pada individu dewasa (Pearson et al. 1983; Arango et al. 1988; Kitahama et al. 1994). Neuron KA pada area postrema tikus terdiri dari neuron DA (Kalia et al. 1985) dan neuron NA (Armstrong et al. 1981), sedangkan pada kucing hanya neuron DA saja (Maqbool et al. 1993).
Penelitian pada anak babi menunjukkan bahwa AP merupakan kemoreseptor yang memberikan respon terhadap cekaman hiperkapnia. Adanya gangguan perkembangan neuron KA di AP tersebut dapat mengakibatkan hilangnya kontrol fungsi refleks sistem kardiopulmonaris, yang diduga menjadi penyebab terjadinya SIDS (Ruggiero et al. 1999). Namun
Spesies Fetus Anak Dewasa
Manusia AP (+) pada umur 14,5-25 minggu (Verney 1999;
Lorke et al. 2003)
Belum ada data
AP (-) (Pearson et al. 1983;
Arango et al. 1988; Kitahama et al. 1994) Monyet
(Rhesus, MEP)
Belum ada data Belum ada data AP (+)
(Schreihofer et al. 1997)
Tikus
Belum ada data Belum ada data
AP (+)
(Armstrong et al. 1982; Miceli et al. 1987)
Kucing Belum ada data Belum ada data (Beleslin AP (+) et al. 1989; Maqhood et al. 1993) Kelinci
Anjing Marmut
Belum ada data Belum ada data
AP (+)
[image:42.596.116.500.157.426.2](Fuxe dan Owman 1965)
MATERI DAN METODE
Tempat dan Waktu Penelitian
Penelitian ini dilaksanakan mulai bulan Agustus 2002 sampai September 2005. Persiapan hewan coba meliputi perfusi jaringan yang dilakukan di Karantina Hewan, Pusat Studi Satwa Primata, Lembaga Penelitian dan Pemberdayaan Masyarakat-Institut Pertanian Bogor (PSSP-LPPM IPB). Pewarnaan jaringan otak dan pengamatan hasil penelitian yang dilakukan di Laboratorium Biologi dan Laboratorium Patologi dan Lipid, PSSP-LPPM IPB; Bagian Anatomi, Fakultas Kedokteran Hewan-Institut Pertanian Bogor dan Fakultas Kedokteran Hewan-Universitas Gadjah Mada, Yogyakarta; serta di
Biostructure Technology Laboratory, Regional Primate Research
Center-University of Washington, Seattle.
Materi
Penelitian ini mempergunakan dua belas ekor MEP yang terdiri dari 10 fetus dan 2 ekor anak. Untuk keperluan pewarnaan imunohistokimia dengan teknik label tunggal dipergunakan batang otak sebelah kiri yang berasal dari fetus umur kebuntingan 40 hari (F 40), 55 hari (F 55), 70 hari (F 70), 85 hari (F 85), 100 hari (F 100), 120 hari (F 120) dan 150 hari (F 150), serta anak umur 10 hari (P 10) dan 105 hari (P 105) masing-masing satu ekor. Hewan tersebut diperoleh dari PSSP-LPPM IPB. Untuk pewarnaan imunohistokimia dengan teknik label ganda digunakan batang otak MEP sebanyak tiga ekor, yaitu fetus umur 55 hari (F 55), 70 hari (F 70), dan 145 hari (F 145) masing-masing satu ekor, yang diperoleh atas kebaikan Dr. Anita Hendrickson dari Regional Primate Research Center-University of Washington, Seattle, USA.
terpilih kemudian dipindah ke kandang kawin. Masa subur induk betina ditandai dengan lendir vagina yang encer dan bening, biasanya muncul pada hari ke-11 siklus menstruasi. Ketika betina memasuki masa subur, pejantan dimasukkan ke kandang kawin selama 3 hari. Hari ke dua pencampuran antara induk jantan dan betina ditentukan sebagai hari ke nol kebuntingan dengan simpangan baku satu hari.
Metode Pengambilan fetus
Fetus dikoleksi melalui laparotomi medianus, kemudian dibius secara intraumbilikal dengan pentobarbital (0,1 ml/kg bobot badan), sedangkan untuk P 10 dan P 105 dibius dengan anastetikum yang sama, tetapi secara intraperitoneal.
Perfusi jaringan otak
Sampel yang didapat kemudian dikorbankan dengan cara mengeluarkan darah secara intrakardial dengan teknik perfusi dalam keadaan terbius. Perfusi dilakukan dengan menggunakan 0,2% paraformaldehid dalam phosphate buffered (PB) 0,1M, pH 7,4 pada suhu 37oC, dengan kecepatan antara 15-20 ml/menit sebagai pre-rinse, dilanjutkan dengan larutan fiksatif 2% paraformaldehid dalam PB 0,1M, pH 7,4 dengan suhu 4oC selama 20 menit pada kecepatan yang sama.
Perfusi intrakardial dilakukan dengan cara membuka rongga dada, aorta torakalis dijepit dengan penjepit arteri, kemudian jarum kupu yang telah dihubungkan dengan pompa perfusi dimasukkan ke dalam ventrikel kiri. Setelah jantung membesar karena terisi larutan pre-rinse, atrium kanan kemudian disayat agar darah dan larutan perfusi dapat keluar dari tubuh. Apabila larutan perfusi
Untuk keperluan pewarnaan label tunggal, medula oblongata dipotong secara longitudinal pada garis median menjadi dua bagian. Belahan kiri dipotong secara koronal dengan ketebalan 5 mm, tegak lurus terhadap garis bayangan yang ditarik dari bagian tengah commissura anterior dan commissura posterior. Masing-masing sayatan kemudian diblok dalam parafin, sedang belahan kanan medula oblongata disimpan di larutan fiksatif paraformaldehid 2% dalam PB 0,1M, pH 7,4 pada suhu 4o
[image:46.596.117.507.127.498.2]C untuk bahan penelitian lanjutan.
Gambar 10. Skema tahap-tahap penelitian mulai dari seleksi induk, preparasi sampel sampai ke pewarnaan imunohistokimia.
pengamatan siklus estrus induk betina
perkawinan dengan metode time mating
fetus (F) umur 40, 55, 70, 85, 100, 120, dan 150 ; anak (P)
umur 10 dan 105 hari
fetus (F) umur 55, 70, dan 145 hari
perfusi
preparasi otak
Proses blok parafin dan sayatan preparat untuk pewarnaan imunohistokimia label tunggal
Sayatan koronal medula oblongata dengan ketebalan 5 mm dimasukkan ke dalam tissue casset, kemudian didehidrasi dalam larutan etanol bertingkat berturut-turut 50, 70, 80, dan 95%, diakhiri dengan tiga kali larutan etanol 100%, masing-masing selama 90 menit. Semua proses dehidrasi dilakukan pada suhu kamar. Setelah dehidrasi dilanjutkan proses penjernihan (clearing) dalam larutan campuran silol dan etanol 100%, dan dua kali silol masing-masing selama 45 menit pada suhu kamar. Setelah proses clearing, dilakukan proses infiltrasi dalam larutan campuran silol dan parafin, kemudian diteruskan dengan tiga kali larutan parafin, masing-masing 45 menit, dengan suhu 60o
C. Terakhir jaringan diletakkan dalam cetakan blok kemudian disiram parafin cair, dan didinginkan pada suhu kamar sampai parafin membeku menjadi blok. Sayatan koronal ini dilakukan agar didapatkan area postrema dan neuron Grup A1/C1 dan A2/C2 dalam satu bidang pandang.
Blok parafin jaringan otak disayat secara serial setebal 12 µm menggunakan rotary microtome, dengan interval dari satu sayatan ke sayatan berikutnya mulai sampel tertua (P 105) ke sampel termuda (F 40) berturut-turut 460, 403, 444, 387, 274, 242, 169, 137, dan 55 µm. Dari setiap interval tersebut diambil tiga serial sayatan, kemudian diletakkan di permukaan air hangat dengan suhu 45oC sebelum ditempelkan pada superfrost slide dan dikeringkan secara vertikal pada suhu kamar. Setelah kering, sediaan diinkubasi pada suhu 37oC dengan posisi horisontal selama satu malam, selanjutnya disimpan pada suhu 4 oC sampai saatnya diwarnai.
Pewarnaan cresyl echt violet dan HE
Sayatan organ dari blok parafin yang akan diwarnai dengan cresyl echt violet dijajarkan dalam rak untuk diinkubasi pada suhu 60oC selama 90 menit. Setelah inkubasi sediaan dibiarkan pada suhu ruang sampai dingin. Slide yang telah dingin selanjutnya dideparafinis asi dan direhidrasi sesuai prosedur standar.
Setelah proses rehidrasi, jaringan diwarnai dengan laturan cresyl echt violet (Chroma, No.1A 396) selama 30 menit, diteruskan proses dehidrasi, rehidrasi, dehidrasi ulang, dan diakhiri dengan proses penjernihan dalam silol sebelum ditutup dengan kaca penutup menggunakan media Entelan (Merck, Cat. 107961).
Tahap-tahap pewarnaan HE sama seperti pewarnaan cresyl echt violet,
kecuali, setelah proses rehidrasi jaringan diwarnai dengan larutan hematoksilin selama 3 menit, kemudian dicuci dalam air mengalir selama 10 menit. Dari air mengalir, jaringan dicuci dalam akuades selama 10 celupan kemudian diwarnai dalam larutan eosin selama 5 menit. Setelah diwarnai menggunakan larutan eosin, jaringan dicuci sebanyak 10 celupan dalam akuades.
Pewarnaan imunohistokimia secara label tunggal
Untuk pewarnaan imunohistokimia terhadap TH, proses deparafinisasi dan rehidrasi seperti pada pewarnaan cresyl echt violet, kemudian jaringan dibilas dua kali di dalam larutan phosphate buffered saline (PBS) pada suhu ruang masing-masing selama 10 menit. Peroksidase endogen pada jaringan diblok dengan cara merendam sediaan pada 3% H2O2 dalam akuades selama 30 menit, kemudian dibilas tiga kali dalam PBS masing-masing selama 10 menit. Permukaan sediaan di sekitar jaringan dikeringkan menggunakan kertas tisu dengan tetap menjaga jaringan untuk tidak kering, kemudian dibuat lingkaran pembatas di sekitar jaringan dengan menggunakan hydrophobic marker.
Sediaan selanjutnya dijajarkan secara mendatar dalam kotak yang lembab. Jaringan pada slide yang telah dibatasi dengan hydrophobic marker,
PBS, masing-masing selama 10 menit. Permeabilitas jaringan tetap dijaga dengan pemberian larutan 3% TritonX100 dalam PBS selama 30 menit pada suhu ruang. Untuk memblok latar belakang (background) jaringan, dipergunakan larutan 10% normal horse serum (NHS) dalam 3% TritonX100 pada PBS selama 60 menit dengan suhu ruang.
Antibodi primer rat anti-TH mouse serum (ImmunoStar, cat no. 22941) yang diencerkan 2500 kali, diteteskan pada jaringan. Jaringan kontrol (jaringan dengan sel yang mengandung TH) tidak diberi antibodi primer atau hanya diberi IgG mouse. Sediaan diletakkan secara horisontal pada kotak yang lembab dan ditutup rapat selama empat malam pada suhu 4 oC.
Setelah diinkubasi dalam antibodi primer, jaringan dibilas menggunakan PBS sebanyak empat kali masing-masing selama 15 menit, kemudian ditetesi antibodi sekunder yaitu biotinylated anti-mouse IgG (H+L) horse serum (Vector, Cat. No: BA-2000) yang diencerkan 100 kali, dengan inkubasi selama 60 menit.
Setelah diberi antibodi sekunder, jaringan dibilas empat kali menggunakan PBS masing-masing selama 15 menit. Setelah dibilas, permukaan sediaan di sekitar jaringan dikeringkan, kemudian jaringan ditetesi dengan larutan kompleks avidin biotin conjugated (Elite Vecta StainR
, Vector laboratories, Cat.no: PK-6100) yang diinkubasikan selama 60 menit. Selanjutnya jaringan dibilas lagi dengan menggunakan PB sebanyak tiga kali masing-masing 15 menit. Pada pencucian ke tiga, larutan 3,3-diaminobenzidine tetrahydrochloride (DAB, Sigma, Cat. No: D-5905) dan larutan 3% H2O2 dalam DAB disiapkan.
Pewarnaan imunohistokimia dengan label ganda
Teknik perfusi sampai fiksasi pewarnaan imunohistokimia label ganda sama seperti pewarnaan secara label tunggal, namun setelah proses fiksasi di dalam larutan 2% paraformaldehid otak kemudian disimpan dalam larutan 30% sukrosa. Untuk pewarnaan label ganda ini sampel disayat dalam kondisi beku secara sagital.
Pada prinsipnya proses pewarnaan imunohistokimia label ganda sama dengan label tunggal dengan sedikit perbedaan. Untuk memblok background
digunakan 10% ChemiBLOCKER (Chemicon, Cat. No: 2170-S) yang dilarutkan dalam PBS 0,01M yang mengandung 0,5% tritonX100 dan 0,05% sodium azide. Untuk antibodi primer langsung digunakan dua macam antibodi yaitu rat anti-TH mouse serum (ImmunoStar, cat no. 22941) 2500 kali pengenceran dan bovine anti-DBH rabbit serum (ImmunoStar, Cat. no: 22806) 1500 kali pengenceran dengan masa inkubasi satu malam, pada suhu ruang. Antibodi sekunder, yaitu
Alexa488 goat anti-rabbit IgG yang mengandung fluorocein-iso-thiocyanate
(FITC) dengan pengenceran 500 kali dan Alexa597 goat anti-mouse IgG yang mengandung rodamin (Moleculer Probes, Eugene OR) pada pengenceran 500 kali, diberikan selama satu jam, pada suhu ruang. Setelah sediaan dicuci tiga kali dalam PBS 0,01M masing-masing selama 10 menit, sediaan kemudian ditutup dengan kaca penutup menggunakan media Fluoromount-G (Microscopy Science, Cat. No: 17984-25).
Pengamatan hasil penelitian
Hasil pewarnaan label tunggal diamati dengan mikroskop yang dilengkapi dengan kamera digital. Untuk pengamatan hasil pewarnaan secara label ganda digunakan mikroskop Nikon Optiphot yang dilengkapi dengan filter fluoresen Omega dan dipotret dengan menggunakan film Kodak Extrachrom 200. Gambar yang dihasilkan diolah dengan perangkat lunak grafis Adobe Photoshop CS edition.
Ciri neuron yang sedang bermigrasi diamati terutama pada daerah intermedia medula oblongata yaitu pada nukleus retikularis sentralis.
Perbedaan intensitas pew arnaan terhadap antiserum TH diamati dengan melihat perbedaan warna dalam satu bidang pandang antara daerah dorsal dengan daerah sentral di area postrema, sedang terbentuknya jalur