PENERAPAN BIOFILTER UNTUK PENGHILANGAN
NH
3DAN H
2S DENGAN MENGGUNAKAN BAKTERI
Nitrosomonas sp DAN Thiobacillus sp
DI PABRIK LATEKS PEKAT
Oleh :
HAIMAN SAPUTRA F34102124
FAKULTAS TEKNOLOGI PERTANIAN
INSTITUT PERTANIAN BOGOR
Haiman Saputra (F34102124). Penerapan Biofilter Untuk Penghilangan NH3 dan
H2S Dengan Menggunakan Bakteri Nitrosomonas sp dan Thiobacillus sp di Pabrik
Lateks Pekat. Di bawah bimbingan Mohamad Yani.
RINGKASAN
Karet merupakan salah satu komoditi hasil pertanian yang sangat besar. Jumlah produksi karet Indonesia pada tahun 2004 mencapai 1.851 juta ton yang terdiri dari perkebunan rakyat dan perkebunan besar. Karena jumlah produksi karet yang sangat besar, maka industri karet di Indonesia mengalami perkembangan seperti industri RSS (Ribbed smoked sheet), karet remah dan lateks pekat. Berkembangnya industri ini menghasilkan masalah baru yaitu pencemaran lingkungan. Salah satunya adalah pencemaran udara yang dihasilkan dari parik lateks pekat dimana lateks pekat ini membutuhkan amoniak yang cukup banyak dalam proses produksinya dan menghasilkan gas H2S dari limbah cair dan lump.
Tujuan utama penelitian ini adalah untuk mengetahui kemampuan teknik biofilter dalam mengatasi permasalahan emisi gas yang dikeluarkan dari pabrik lateks pekat. Tujuan khususnya adalah menentukan kapasitas penyerapan emisi gas pada masing-masing biofilter dan menentukan campuran bahan pengisi tambahan terhadap kinerja biofilter berdasarkan kemampuan menghilangkan emisi gas amoniak dan hidrogen sulfida.
Penelitian dilakukan pada biofilter skala pilot dengan bahan pengisinya campuran dari kompos, tanah dan bahan pengisi tambahan (4:2:1) yang terdiri dari sekam, potongan daun karet dan potongan kulit kayu karet, serta penambahan sludge yang merupakan variable perlakuan dalam penelitian ini. Perlakuan sebagai berikut : biofilter satu, ditambah sekam dan sludge; biofilter dua ditambah sekam; biofilter tiga ditambah serasah daun karet dan sludge; biofilter empat ditambah serasah daun karet; biofilter lima ditambah kulit kayu karet dan sludge; dan biofilter enam ditambah kulit kayu karet. Parameter yang diukur adalah inlet dan outlet gas amoniak (NH3) dan hidrogen sulfida (H2S) pada biofilter, setiap hari selama 30 hari. Kondisi
media yang diukur setiap minggu adalah pH, kadar air, total N, S, C, ion nitrat, ion amonium dan populasi bakteri.
Karakteristik bahan pengisi awal memiliki kadar air yang baik untuk pertumbuhan mikroorganisme yaitu berkisar antara 47 - 62%. Nilai pH sangat baik yaitu berkisar 7 untuk semua biofilter. Sedangkan jumlah karbon dan nitrogen juga sangat cukup bagi mikroorganisme. Jumlah karbon dari berkisar antara 21 - 32%. Jumlah nitrogen berkisar antara 0.43 - 0.57%. Porositas pada masing-masing biofilter sangat baik yaitu diatas 80%.
2, 3, 4, 5 dan 6 berturut-turut berkisar nilai logaritma antara 4 – 9.85; 0 – 9.68; 5 – 9.68; 5 – 7.7; 5.3 – 8.15 dan 5 – 10.08 sel/g-contoh. Populasi bakteri Nitrosomonas sp dan heterotrof relatif baik karena selalu ada di setiap biofilter, sedangkan bakteri Thiobacillus sp kurang baik karena setiap biofilter pernah tidak terdeteksi pertumbuhannya.
Kinerja efisiensi penghilangan gas NH3 semua biofilter sangat baik yaitu diatas
98%. Efisiensi penghilangan H2S yang lebih baik yaitu pada biofilter 3 dan 6 yaitu
rata-rata diatas 97%. Emisi pabrik lateks pekat untuk amoniak dan hidrogen sulfida adalah berkisar antara 1 – 600 ppm dan 0.3 - 80 ppm. Kapasitas penghilangan gas amoniak berkisar antara 57.99 – 68.53 g-N/kg bahan/hari, kemudian kapasitas penghilangan hidrogen sulfida berkisar antara 19.86 – 21.82 g-S/kg bahan/hari. Campuran bahan pengisi dari setiap biofilter baik untuk penghilangan amoniak, sedangkan campuran bahan pengisi untuk penghilangan hirogen sulfida yang terbaik adalah kompos, tanah, sludge dan serasah daun karet.
PENERAPAN BIOFILTER UNTUK PENGHILANGAN
NH
3DAN H
2S DENGAN MENGGUNAKAN BAKTERI
Nitrosomonas sp DAN Thiobacillus sp
DI PABRIK LATEKS PEKAT
SKRIPSI
Sebagai salah satu syarat untuk memperoleh gelar
SARJANA TEKNOLOGI PERTANIAN
Pada Departemen Teknologi Industri Pertanian,
Fakultas Teknologi Pertanian,
Institut Pertanian Bogor
Oleh :
HAIMAN SAPUTRA F34102124
FAKULTAS TEKNOLOGI PERTANIAN
INSTITUT PERTANIAN BOGOR
INSTITUT PERTANIAN BOGOR FAKULTAS TEKNOLOGI PERTANIAN
PENERAPAN BIOFILTER UNTUK PENGHILANGAN
NH
3DAN H
2S DENGAN MENGGUNAKAN BAKTERI
Nitrosomonas sp DAN Thiobacillus sp
DI PABRIK LATEKS PEKAT
SKRIPSI
Sebagai salah satu syarat untuk memperoleh gelar
SARJANA TEKNOLOGI PERTANIAN
Pada Departemen Teknologi Industri Pertanian,
Fakultas Teknologi Pertanian,
Institut Pertanian Bogor
Oleh :
HAIMAN SAPUTRA F341021324
Dilahirkan pada tanggal 22 November 1983
di Jakarta
Tanggal lulus : 12 Juni 2006
Menyetujui,
Bogor, 13 Juni 2006
BIODATA PENULIS
Haiman Saputra dilahirkan di Jakarta pada tanggal 22 November 1983
dari bapak Muhamad Hairullah dan ibu Mursida Dahlan. Putra kedua dari tiga
bersaudara ini menyelesaikan pendidikan dasar di Sekolah Dasar Negeri 1 Pagi
Bintaro tahun 1989-1995, Sekolah Lanjutan Tingkat Pertama di SLTP 19 Jakarta
tahun 1995-1998 dan Sekolah Menengah Umum di SMU Negeri 6 Jakarta tahun
1998-2001.
Pada tahun 2001, penulis diterima di Institut Pertanian Bogor melalui
jalur Seleksi Penerimaan Mahasiswa Baru (SPMB) pada Departemen Teknologi
Industri Pertanian, Fakultas Teknologi Pertanian IPB. Pada bulan Juni 2006,
penulis dinyatakan lulus dari perguruan tinggi tersebut setelah menyelesaikan
tugas akhir yang berjudul “Penerapan Biofilter Untuk Penghilangan NH3 dan H2S
Dengan Menggunakan Bakteri Nitrosomonas sp dan Thiobacillus sp di Pabrik
Lateks Pekat”.
Selama kuliah, penulis mengikuti organisasi yang terdapat pada
Fakultas Teknologi Pertanian yaitu Forum Bina Islami Fateta (FBI-F). Penulis
diberikan kesempatan untuk melakukan praktikum lapang di PTP Nusantara VIII
Wangunreja, Subang tahun 2005.
KATA PENGANTAR
Puji serta syukur selalu terpanjat kepada Allah SWT yang telah
memberikan berbagai nikmatnya sehingga saya dapat menulis Skripsi ini. Skripsi
yang berjudul “Penerapan Biofilter Untuk Penghilangan NH3 dan H2S Dengan
Menggunakan Bakteri Nitrosomonas sp dan Thiobacillus sp di Pabrik Lateks
Pekat” dibuat berdasarkan penelitian yang dilakukan di PTPN VIII Wangunreja
Subang dan di Laboratorium Bioindustri, Departemen Teknologi Industri
Pertanian, Fateta, IPB.
Melalui skripsi ini penulis menyampaikan ucapan terima kasih yang
sebesar-besarnya kepada :
1. Dr. Ir. Mohamad Yani, M.Eng, sebagai dosen pembimbing yang telah
banyak memberikan bimbingan selama ini.
2. Dr. Ir. Mulyorini Rahayuningsih, Msi dan Dr. Ono Suparno, STP. MT,
selaku dosen penguji yang telah memberikan masukkan dan kritik kepada
penulis.
3. Papa, ibu, abang Yaya serta adikku Nia yang selalu memberikan motivasi
dan doa.
4. Seluruh staf dan karyawan Departemen Teknologi Industri Pertanian atas
semua bantuannya selama ini.
5. Puji Rahmawati N yang telah memberikan bantuan dan dorongannya
selama penelitian.
6. Rekan-rekan TIN ’39 dan Gibol yang telah memberikan semangat serta
bantuan sehingga penulis dapat menyelesaikan skripsi ini.
Semoga skripsi ini dapat memberikan manfaat yang seluasnya di
kemudian hari dan mendapatkan ridho Allah SWT.
Bogor, Juni 2006
iv
DAFTAR ISI
Halaman
KATA PENGANTAR... iii
DAFTAR GAMBAR... vi
DAFTAR TABEL... vii
DAFTAR LAMPIRAN... viii
I.PENDAHULUAN... 1
A. Latar Belakang... 1
B. Tujuan... 2
II.TINJAUAN PUSTAKA... 3
A. Lateks pekat... 3
B. Biofilter... 4
C. Bahan Pengisi... 6
D. Amoniak(NH3)... 8
E. Bakteri Pengoksidasi Amoniak (NH3)... 10
F. Hidrogen Sulfida(H2S)... 11
G. Bakteri Pengoksidasi Hidrogen Sulfida (H2S)... 13
H. Bakteri Heterotrof... 14
III.METODE PENELITIAN... 16
A. Bahan dan Alat... 16
B. Reaktor Biofilter... 16
C. Bahan Pengisi... 17
D. Penelitian Utama... 18
E. Analisa Data... 19
IV.HASIL DAN PEMBAHASAN... 20
A. Gas Pencemar dan Karakteristik Bahan Pengisi... 20
B. Bioflter 1... 22
D. Bioflter 3... 36
E. Bioflter 4... 41
F. Bioflter 5... 47
G. Bioflter 6... 52
H. Kapasitas Penghilangan N dan S oleh Biofilter... 58
I. Total Penghilangan N dan S oleh Biofilter... 62
V.KESIMPULAN DAN SARAN... 65
A. Kesimpulan... 65
B. Saran... 65
DAFTAR PUSTAKA... 67
vi
DAFTAR GAMBAR
Halaman
Gambar 1. Proses pengolahan lateks pekat... . 4
Gambar 2. Transformasi nitrogen yang terjadi dalam biofilter... 9
Gambar 3. Nitrosomonas sp... 11
Gambar 4. Siklus sulfur secara biologi... 12
Gambar 5. Penyebaran bakteri nitrifikan pada biofilm... 15
Gambar 6. Model kolom biofilter... 17
Gambar 7. Kondisi dan kinerja penghilangan NH3 biofilter satu... 23
Gambar 8. Kinerja penghilangan H2Sbiofilter satu... 26
Gambar 9. Kandungan beberapa unsur dalam biofilter satu... 27
Gambar 10. Kondisi dan kinerja penghilangan NH3 biofilter dua... 30
Gambar 11. Kinerja penghilangan H2Sbiofilter dua... 33
Gambar 12. Kandungan beberapa unsur dalam biofilter dua... 35
Gambar 13. Kondisi dan kinerja penghilangan NH3 biofilter tiga... 37
Gambar 14. Kinerja penghilangan H2Sbiofilter satu tiga... 39
Gambar 15. Kandungan beberapa unsur dalam biofilter tiga... 41
Gambar 16. Kondisi dan kinerja penghilangan NH3 biofilter empat... 43
Gambar 17. Kinerja penghilangan H2Sbiofilter empat... 44
Gambar 18. Kandungan beberapa unsur dalam biofilter empat... 45
Gambar 19. Kondisi dan kinerja penghilangan NH3 biofilter lima... 48
Gambar 20. Kinerja penghilangan H2Sbiofilter lima... 50
Gambar 21. Kandungan beberapa unsur dalam biofilter lima... 51
Gambar 22. Kondisi dan kinerja penghilangan NH3 biofilter enam... 54
Gambar 23. Kinerja penghilangan H2Sbiofilter enam... 55
Gambar 24 Kandungan beberapa unsur dalam biofilter enam... 57
Gambar 25. Kapasitas penghilangan N terhadap beban yangmasuk ke dalam ke enam biofilter... 59
DAFTAR TABEL
Halaman
Tabel 1. Nilai ekspor karet Indonesia... 3
Tabel 2. Karakteristik bahan pengisi biofilter... 6
Tabel 3. Dampak amoniak... 8
Tabel 4. Bakteri-bakteri pengoksidasi amoniak dan nitrit... 10
Tabel 5. Dampak menghirup H2S... 14
Tabel 6. Bakteri pengoksidasi senyawa sulfur... 15
Tabel 7. Emisi yang terdapat pada pabrik karet... 20
Tabel 8. Karakteristik bahan yang digunakan... 21
Tabel 9. Total penghilangan H2S dan NH3... 62
Tabel 10. Kapasitas penyerapan beberapa polutan gas pada beberapa jenis bahan pengisi biofilter... 63
viii
DAFTAR LAMPIRAN
Halaman
Lampiran 1a. Kurva Standar NH3... 71
Lampiran 1b. Hasil pengamatan NH3 inlet, outlet, beban dan
efisiensi pada biofilter 1... 72
Lampiran 1c. Hasil pengamatan NH3 inlet, outlet, beban dan
efisiensi pada biofilter 2... 74
Lampiran 1d. Hasil pengamatan NH3 inlet, outlet, beban dan
efisiensi pada biofilter 3... 76
Lampiran 1e. Hasil pengamatan NH3 inlet, outlet, beban dan
efisiensi pada biofilter 4... 78
Lampiran 1f. Hasil pengamatan NH3 inlet, outlet, beban dan
efisiensi pada biofilter 5... 80
Lampiran 1g. Hasil pengamatan NH3 inlet, outlet, beban dan
efisiensi pada biofilter 6... 82
Lampiran 2a. Kurva standar H2S... 84
Lampiran 2b. Hasil pengamatan H2S inlet, outlet, beban dan
efisiensi pada biofilter 1... 85
Lampiran 2c. Hasil pengamatan H2S inlet, outlet, beban dan
efisiensi pada biofilter 2... 87
Lampiran 2d. Hasil pengamatan H2S inlet, outlet, beban dan
efisiensi pada biofilter 3... 89
Lampiran 2e. Hasil pengamatan H2S inlet, outlet, beban dan
efisiensi pada biofilter 4... 91
Lampiran 2f. Hasil pengamatan H2S inlet, outlet, beban dan
efisiensi pada biofilter 5... 93
Lampiran 2g. Hasil pengamatan H2S inlet, outlet, beban dan
efisiensi pada biofilter 6... 95
Lampiran 3. Metode analisa penelitian... 97
I. PENDAHULUAN
A. LATAR BELAKANG
Tanaman karet masuk ke Indonesia pada abad ke-20 melalui Sumatra
dari Malaysia, kemudian ke Pulau Jawa dan Kalimantan. Tanaman karet
diusahakan baik oleh rakyat maupun oleh pihak perkebunan seperti PT
Perkebunan Nusantara (PTPN) VIII Wangunreja (Sadjad,1983). Meskipun
Indonesia memiliki wilayah cukup luas untuk tanaman karet, tetapi
produktivitasnya masih berada di bawah Thailand. Luas areal perkebunan
karet di Indonesia mencapai sekitar 3.3 juta hektar, 2.6 juta hektar di
antaranya lahan milik petani (80%) (SWO, 2005). Dengan luas lahan seperti
di atas, Indonesia memiliki nilai ekspor karet sebesar 1.369 juta ton (946 juta
dolar AS) untuk ekspor lateks segar dan 117.713 ton (250.446 juta dolar AS)
ton untuk ekspor lateks olahan. Meskipun Indonesia mampu mengekspor
karet, Indonesia juga mengimpor karet dalam jumlah kecil yaitu 330 ton (522
ribu dolar AS) untuk impor lateks segar dan 176 ton (607 ribu dolar AS) untuk
impor lateks olahan (Data dan Statistik Agribisnis, 2005).
Nilai ekspor Indonesia yang cukup besar menunjukkan bahwa industri
karet telah berkembang termasuk industri lateks pekat. Seiring kemajuan
industri karet mentah dan lateks pekat ini timbul permasalahan limbah dan
emisi gas yang dihasilkan dari pabrik. Dalam industri beberapa macam
pencemaran diantaranya limbah cair, padat, dan emisi gas berbau. Emisi Gas
pencemar (polutan) udara antara lain yaitu CO, CO2, SO2, N2O, NOx, H2S,
Hidrokarbon, dan lainnya (Manik, 2003). Emisi gas dihasilkan dari industri
lateks yang paling dominan adalah hidrogen sulfida dan amoniak.
Sumber emisi gas dari industri karet ini dapat dihasilkan dari berbagai
sumber dan kegiatan antara lain penyimpanan lump (gumpalan lateks yang
sudah membeku), proses oksidasi anaerob limbah cair, pemberian amoniak
cair dan gas pada pembuatan lateks pekat. Penyimpanan lump selama
berhari-hari akan menimbulkan bau yang tidak enak. Bau dari lump ini tercium
sepanjang hari pada pabrik karet. Sedangkan bau amoniak tercium pada saat
2 pelepasan atau kebocoran pada tabung gas amoniak atau pada tangki
penyimpanan lateks pekat. Penghilangan emisi dengan biofilter pada gudang
lump telah dilakukan melalui oleh Indriasari (2005), sedangkan penghilangan
emisi di pabrik lateks pekat akan dilakukan dalam penelitian ini. Pada kedua
tempat ini memiliki emisi yang masih dibahwah baku mutu.
Berbagai cara telah diusahakan untuk mengurangi emisi pada pabrik
diantaranya dengan menyemprotkan cairan penghilang bau pada tumpukan
lump. Sedangkan pada lateks pekat untuk mengurangi emisi digunakan blower
(Saputra, 2005). Pengendalian pencemaran udara (bau) dapat menggunakan
proses biologi yaitu biofilter yang memiliki biaya relatif lebih murah
(Raghuvanshi dan Babu, 2004). Biofilter telah banyak digunakan (populer) di
negara-negara maju (Belanda, Jerman, Amerika, dan Jepang) karena efektif
untuk mengolah gas-gas buangan industri dengan volume yang besar namun
konsentrasi polutan yang rendah. Selain itu, dibandingkan dengan metode
fisik-kimia, biaya investasi dan operasionalnya rendah, stabil pada
penggunaan dalam waktu yang relatif lama dan memiliki daya penguraian
atau pengolahan yang tinggi (Andrew and Noah, 1995).
B. TUJUAN
Tujuan utama penelitian ini adalah untuk mengetahui kemampuan
teknik biofilter dalam mengatasi permasalahan emisi gas yang di keluarkan
dari pabrik lateks pekat
Tujuan khusus dari penelitian ini adalah :
1. Menentukan kapasitas penyerapan emisi gas pada masing-masing biofilter
pada pabrik lateks pekat
2. Menentukan campuran bahan pengisi tambahan terhadap kinerja biofilter
berdasarkan kemampuan menghilangkan emisi gas dari pabrik lateks
II. TINJAUAN PUSTAKA
A. LATEKS PEKAT
Karet merupakan salah satu hasil perkebunan yang cukup besar di
Indonesia. Pada tahun 2003 produksi karet alam Indonesia mencapai 1.6 juta
ton, dan merupakan produsen karet alam terbesar kedua di dunia setelah
Thailand yang produksi karet alamnya mencapai 2.3 juta ton (Pusat Peneliti
Karet, 2003), sedangkan jumlah produksi lateks cukup besar seperti pada
PTPN II sebesar 2 224 ton/hari. Jumlah produksi karet Indonesia tahun
2000–2004 dari perkebunan besar dan perkebunan rakyat diperlihatkan pada
Tabel 1.
Tabel 1. Jumlah produksi karet Indonesia
Penghasil Jumlah produksi (1000 ton)
2000 2001 2002 2003 2004
Perkebunan Besar 375.7 397.7 403.4 405.4 409.5
Perkebunan Rakyat 1125.2 1723.3 1226.6 1386.6 1441.5 Sumber : BPS (2005)
Salah satu komoditas karet adalah lateks pekat yang biasa
digunakan untuk pembuatan produk karet busa, sarung tangan, kondom dan
lainnya. Untuk menghasilkan lateks pekat yang bermutu tinggi maka
diperlukan lateks segar yang baik. Lateks segar perlu diawetkan dengan cara
penambahan bahan pengawet (anti koagulan). Bahan pengawet yang sering
digunakan adalah amoniak (Goutara et al., 1985). Menurut Saputra (2005),
apabila kadar amoniak dari setiap tangki penerima lebih rendah dari yang
ditetapkan, penambahan amoniak perlu dilakukan secepatnya sampai kadar
yang dikehendaki 70%. Proses pengolahan lateks pekat diperlihatkan pada
4
Tidak harus dilakukan
Bagian proses produksi
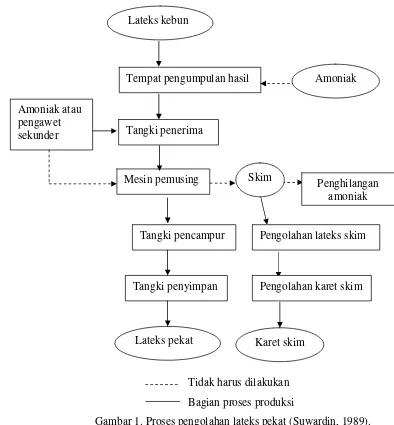
Gambar 1. Proses pengolahan lateks pekat (Suwardin, 1989).
B. BIOFILTER
Penghilangan gas secara fisik-kimia memiliki keterbatasan bila bahan
penyerap gas (adsorban) jenuh maka harus diganti. Zat penyerap yang telah
jenuh sering kali sulit untuk diregenerasikan, sehingga tidak dapat digunakan
lagi. Kelemahan ini dapat diatasi dengan aktivitas mikroba. Menurut
Ottenggraf (1986), metode biologi dapat dibedakan menjadi tiga yaitu
bioscrubber, biotrickling filter, dan biofilter. Tempat pengumpulan hasil
Tangki penerima
Mesin pemusing Amoniak atau
pengawet sekunder
Pengolahan lateks skim
Tangki penyimpan Tangki pencampur
Pengolahan karet skim Lateks kebun
Amoniak
Lateks pekat Karet skim
Skim
Biofilter adalah teknologi yang relatif baru digunakan dalam
menangani gas terkontaminasi dengan degradasi senyawa secara biologi
(Hodge, 1993). Teknologi biofilter memanfaatkan mikroorganisme untuk
mendegradasi secara biologi senyawa organik yang mudah menguap (VOC)
dan gas pencemar (Raghuvanshi dan Babu, 2004). Desain biofilter didasarkan
pada tingkat aliran volume, spesifikasi zat pencemar dan konsentrasi,
karakteristik media, ukuran biofilter, pengendalian kelembaban, perawatan,
dan biaya (Schmidt et al., 2004)
Menurut Devinny et al. (1999), terdapat keuntungan dan kerugian dari
penggunaan biofilter ini. Keuntungan biofilter :
Biaya operasional dan modal yang sedikit. Penghilangan efektif untuk senyawa. Pressure drop rendah.
Tidak ada produk limbah lebih lanjut.
Kerugian biofilter :
Keadaan medium yang mungkin memburuk. Kurang cocok untuk konsentrasi tinggi. pH dan kelembaban sulit untuk di kontrol. Partikel mungkin bisa menyumbat medium.
Elemen kunci dalam penghilangan kontaminan gas adalah biofilm
(Devinny et al., 1999). Mekanisme pembentukan biofilm menurut Schmidt et
al. (2004), yaitu udara berbau disedot oleh kipas dari bangunan dan
didistribusikan secara menyeluruh ke media biofilter. Mikroorganisme
melekat pada media organik membentuk biofilm. Di dalam biofilm,
mikroorganisme mengoksidasi gas yang dapat dibiodegradasi menjadi CO2,
H2O, garam mineral, dan biomassa.
Secara umum biofilter konvensional menangani kontaminan pada
konsentrasi antara 10-3 sampai 10 g per m3. Pada kisaran konsentrasi ini memungkinkan biofilm mendegradasi secara efisien (Devinny et al., 1999).
Sedangkan menurut Vanotti (1999), dibutuhkan penyesuaian selama enam
minggu untuk mengembangkan fungsi biofilm nitrifikasi di permukaan media
6
C. BAHAN PENGISI
Dalam memilih media biofilter ada beberapa kriteria yang harus
dipenuhi diantaranya kandungan nutrien anorganik, kandungan organik, kimia
dan aditif, kadar air, pH, porositas, karakteristik penyerapan, tambahan
bakteri, peralatan mekanik, bau dari bahan pengepak, biaya pengepakan dan
umur hidup, pembuangan pengepak (Devinny et al., 1999). Sedangkan
menurut Hirai et al. (2001), syarat-syarat yang harus dipenuhi dalam
pemilihan bahan pengisi untuk biofilter antara lain mempunyai kapasitas
penyangga air yang tinggi, mempunyai tingkat porositas yang tinggi,
mempunyai daya memadat yang rendah, tidak mengalami penurunan kinerja
walaupun kadar air menurun, tidak berubah dalam jangka panjang, ringan,
murah, mampu menyerap gas penyebab bau, dan mempunyai kapasitas
penyangga tinggi terhadap produk akhir yang bersifat asam.
Berbagai material digunakan sebagai bahan pengisi biofilter dengan
berbagai tingkatan efektifitas, antara lain kompos, potongan kayu, kulit kayu,
gambut, tanah dan campuran pasir, carbon aktif, batu lahar, dan organik
sintetik (Boswell, 2004). Menurut Schmidt et al. (2004) untuk
mengoperasikan biofilter yang efektif, lingkungan media harus baik untuk
pertumbuhan mikroba dan menjaga agar porositas tetap tinggi untuk
memudahkan penyediaan aliran udara.
Tabel 2. Karakteristik bahan pengisi Biofilter
Sumber : (Schmidt et al., 2004) Material Porositas Kapasitas
kelembaban
kompos Rata-rata baik baik baik
Kepingan kayu
Baik Rata-rata Rata-rata Rata-rata Penambahan
a. Kompos
Ketika kompos sebagai fasilitas biofilter didisain dan dioperasikan
secara tepat, kompos dapat menghilangkan lebih dari 90% senyawa berbau
(Spencer, 2003). Hal ini dikarenakan kompos memiliki karakter seperti pH
netral, kandungan organik yang baik, dan menyimpan air dengan baik
(Devinny, 1999).
Biofilter menggunakan beberapa tipe biomasa organik atau kompos
sebagai substrat dan media atau ”bed” untuk mendukung dan pertumbuhan
biofilm mikroba yang akhirnya dapat menyelesaikan degradasi senyawa
yang ditargetkan (Boswell, 2004).
b. Tanah
Tanah dapat digunakan sebagai bahan pengisi pada biofilter
sebab sangat murah, sangat mudah didapat, tersedia dalam jumlah yang
melimpah, serta mengandung populasi mikroba yang tinggi (Devinny et
al., 1999). Selain itu, tanah juga memiliki bahan organik yang
merupakan sumber tenaga yang utama untuk mikroorganisme dalam
tanah. Tidak adanya bahan organik akan membuat aktivitas biokimia
terhenti (Buckman dan Brady, 1982).
Kadar dan komposisi udara dalam tanah sebagian besar
ditentukan oleh hubungan tanah dan air. Udara tanah yang terdiri dari
campuran gas bergerak menuju ke pori-pori yang belum diduduki air.
Jika diberi air, yang mula-mula diisi air adalah pori besar lalu
pori-pori sedang (Buckman dan Brady, 1982). Tanah secara alamiah bersifat
hidrofilik dan tidak sulit untuk merehidrasi dibandingkan kompos atau
gambut dalam rangka pengeringan yang kurang hati-hati (Devinny et al,
1999).
c. Bahan Pengisi Tambahan
Bahan pengisi tambahan yang ditambahkan dalam media biofilter
berfungsi untuk meningkatkan porositas campuran kompos dan tanah
8 kulit kayu karet, dan serasah daun karet dipilih dengan alasan
kemudahannya dalam memperoleh bahan tersebut. Selain itu, menurut
Buckman dan Brady (1982), bahwa bahan tambahan ini bisa menjadi
sumber bahan organik bagi mikroorganisme karena jaringan asli seperti
sisa akar, bagian atas dari tumbuhan seperti daun dan kulit batang
menjadi sasaran penyerangan hebat oleh organisme tanah. Hasil
penguraian ini lebih kokoh dan seperti agar-agar yang dibentuk oleh
mikroorganisme dan dirubah dari jaringan tumbuhan asli menjadi
humus.
D. AMONIAK (NH3)
Amoniak adalah senyawa dari nitrogen dan hidrogen dengan formula
NH3. Pada suhu dan tekanan standar amoniak berbentuk gas. Amoniak bersifat
toksik, dan korosif untuk beberapa bahan, dan memiliki bau tajam. Amoniak
adalah gas tidak berwarna dengan karakteristik bau menyengat. Amoniak
mudah dicairkan, menjadi uap cair pada suhu -33,7oC dan menjadi solid pada suhu-75oC berupa masa kristal putih (Wikipedia, 2002).
Tabel 3. Dampak amoniak
Konsentrasi dari berat molaritas klasifikasi
5-10% 2,87 - 5,62 mol/L Iritasi
10-25% 5,62 - 13,29 mol/L Korosif
>25% >13,29 mol/L Berbahaya bagi
lingkungan
Sumber : Wikipedia (2002).
Menurut Solichin (1988), dalam industri lateks pekat amoniak
digunakan sebagai bahan anti pembeku yaitu bahan yang digunakan untuk
mencegah terjadinya prakoagulasi lateks di kebun dan selama perjalanan ke
tempat pengolahan. Amoniak digunakan oleh industri karet dengan
Mudah didapat di toko-toko bahan kimia, obat dan alat pertanian.
Harganya cukup murah dibandingkan dengan bahan anti pembeku
lainnya.
Tidak menimbulkan pengaruh sampingan terhadap mutu produk akhir
karena mudah dihilangkan dari lateks.
Bisa digunakan hampir semua jenis produk karet, kecuali jenis crepe
saja.
Untuk pengawetan jangka panjang bisa dicampurkan dengan bahan
pengawet sekunder.
10
E. BAKTERI PENGOKSIDASI AMONIAK (NH3)
Peningkatan konsentrasi amoniak di atmosfer berasal dari aktivitas
mikroba, industri amoniak, pengelolaan limbah, dan pengelolaan batubara
(Manik, 2003). Keadaan lingkungan yang aerobik akan menyebabkan
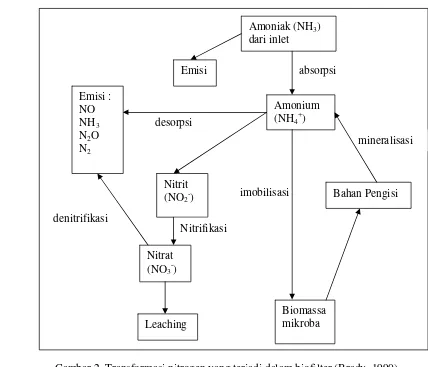
terjadinya proses oksidasi amoniak menjadi nitrit (NO2 -) dan selanjutnya
dioksidasi menjadi nitrat (NO3-). Organisme yang melaksanakan nitrifikasi
diantaranya Nitrosomonas sp yang mengubah amoniak menjadi nitrit.
Organisme yang mengubah nitrit menjadi nitrat adalah Nitrobacter
(Wikipedia, 2005). Menurut Schlegel dan Schmidt (1994) Nitrifikan
(penitrifikasi) adalah bakteri gram-negatif yang disatukan dalam keluarga
Nitrobacteraceae. Bakteri Nitrosomonas sp merupakan bakteri
kemolitrotropik yang menggunakan CO2 sebagai sumber karbon di dalam
sintesa biomassanya.
Tabel 4. Bakteri-bakteri pengoksidasi amoniak dan nitrit
Pengoksidasi amoniak Pengoksidasi nitrit
Nitrosomonas europaea Nitrobacter winogradsky
Nitrosococcus oceanus Nitrobacter agilis
Nitrosapira briensis Nitrospina gracilis
Nitrosolobus multiformis Nitrococcus mobilis
Sumber : Schlegel dan Schmidt (1994).
Menurut Buckman dan Brady (1982) perubahan enzimatik pada
proses nitrifikasi disajikan sebagai berikut:
2NH4+ + 3O2 2NO2- + 2H2O + 4H + energi
2NO2- + O2 2NO3- + energi
Menurut Broadbent dan Tyler (1957) di dalam Buckman dan Brady
nitrifikasi pada kecepatan yang sangat cepat. Kecepatan harian terdapat dari 6
sampai 22 pon nitrogen per 2 juta pon tanah, kalau 100 pon nitrogen dalam
bentuk amonium ditambahkan, kecepatan jauh lebih tinggi.
Nitrosomonas sp merupakan bakteri kemolitrotrof berbentuk batang
dengan metabolisme aerobik. Walaupun mereka tidak tumbuh dengan
fotosintesis, mereka biasa melakukan metabolisme dengan mengurai amoniak.
Membran dalam sel bakteri menggunakan elektron dari atom nitrogen
amoniak untuk menghasilkan energi. Oleh karena itu, untuk melengkapi divisi
sel, Nitrosomonas sp. harus mengkonsumsi amoniak dalam jumlah banyak
(Wikipedia, 2005).
Gambar 3. Nitrosomonas sp
F. HIDROGEN SULFIDA
Hidrogen sulfida adalah gas tidak berwarna, toksik, mudah
terbakar dan menyebabkan bau busuk seperti bau telor busuk. Sering
dihasilkan ketika bakteri menguraikan bahan organik jika tidak ada
oksigen, seperti rawa dan saluran air (selokan). Hidrogen sulfida juga bisa
terjadi dalam gas vulkanik, gas alam dan beberapa mata air (Wikipedia,
2006)
Hidrogen sulfida adalah polutan udara yang korosif dan beracun,
dikarakteristikan dalam bau yang tidak sedap (Martin et al., 2004). Sulfur
tereduksi dalam bentuk H2S juga terjadi di biosfer sebagai hasil aktivitas
12 kondisi anaerobik, tapi akan teroksidasi secara spontan dan cepat dengan
adanya oksigen. H2S merupakan polutan yang tidak menyebar luas seperti
SO2. Umumnya berasosiasi dengan sumber spesifik seperti bahan organik
terdekomposisi, lumpur dan limbah industri. Hidrogen sulfida (H2S)
mempunyai bau seperti telur busuk dan kadang lebih toksik daripada
karbon monoksida (Turk et al.,1972).
Penghilangan H2S diperlukan dengan alasan kesehatan, keamanan,
dan korosi. Selama penyebaran dan pendistribusian juga untuk mencegah
polusi oleh sulfur dioksida karena pembakaran gas (Jensen dan Webb,
1995).
G. BAKTERI PENGOKSIDASI HIDROGEN SULFIDA (H2S)
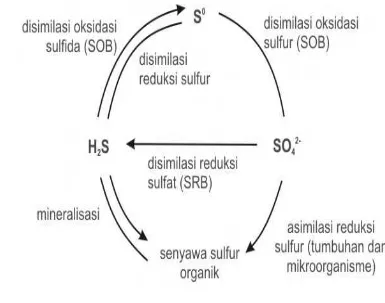
Menurut Saeni (1989), bakteri belerang hijau dan bakteri belerang
purpel mendapatkan energi untuk proses metabolismenya melalui oksidasi
H2S. Bakteri-bakteri ini menggunakan CO2 sebagai sumber karbon.
Bakteri-bakteri ini sangat anaerobik. Sedangkan bakteri belerang tidak
berwarna aerobik dapat menggunakan oksigen molekuler untuk
mengoksidasi H2S, yaitu :
H2S + O2 2S + 2H2O
2S + 2H2O + 3O2 4H+ + 2SO4
2-S2O32- + H2O + CO2 2H+ + 2SO42-
H2S di atmosfer secara cepat dirubah menjadi SO2 melalui reaksi :
H2S + 3/2 O2 SO2 + H2O
Beberapa bakteri yang dapat mengoksidasi senyawa sulfur adalah
Thiobacillus thioxidans dan Thiobacillus feroxidans. Kedua
mikroorganisme ini mengoksidasi H2S dan membentuk sulfur elemen yang
disimpan dalam selnya. Keduanya mengoksidasi bahan anorganik seperti
hidrogen sulfida, sulfur elemen dan besi mengubahnya menjadi asam
sulfat. Mereka dapat hidup pada keadaan yang sangat asam dengan nilai
pH 2 (Edmons, 1978). Sedangkan menurut Peck (1959) bahwa Hidrogen
sulfida dioksidasi menjadi sulfur elemen dengan ekstrak T.thioxidans dan
T. thioparus dan oleh Peck (1960) bahwa Ekstrak dari T. thioparus telah
menunjukkan adanya beberapa aktivitas enzimatik yang mungkin terkait
dengan oksidasi penguraian senyawa sulfur.
Menurut Schlegel dan Schmidt (1994), hidrogen sulfida oleh
beberapa bakteri lembayung bebas dan oleh bakteri hijau dioksidasi
menjadi sulfat. Pada proses ini belerang intermediasi oleh sebagian bakteri
lembayung belerang ditimbun sementara waktu dalam sel.
Thiobacillus sp adalah sekelompok kecil organisme yang
metabolisme energinya diubah untuk menghasilkan seluruh energi untuk
pertumbuhan. Energi berasal dari oksidasi senyawa sulfur anorganik
14 untuk sintesis material sel. Sebagian besar Thiobacilli (T. thioxidans, T.
thioparus, T. denitrificans) bersifat khemolitroototrof dan memerlukan
fiksasi CO2 (Schlegel dan Schmidt, 1994).
Tabel 5. Dampak menghirup H2S
Konsentrasi Efek Bagi Manusia
0.03 ppm Bisa dicium. Aman dihirup dalam 8 jam.
4 ppm Bisa menyebabkan iritasi mata. Harus menggunakan
masker karena bisa merusak metabolisme.
10 ppm Maksimum terhirup selama 10 menit. Bau membunuh
dalam 3 samapi 15 menit. Menyebabkan gas mata dan luka pada tenggorokan. Bereaksi secara keras dengan campuran isi raksa gigi.
20 ppm Terhirup lebih dari satu menit menyebabkan beberapa kerusakan urat saraf mata.
30 ppm Hilang penciuman, kerusakan sampai darah ke otak diteruskan dengan kerusakan organ penciuman.
100 ppm Kelumpuhan pernafasan dalam 30 sampai 45 menit. Pingsan dalam waktu singkat (maksimal 15 menit). 200 ppm Kerusakan mata serius dan kerusakan mata sampai pada
saraf. Melukai mata dan tenggorokan.
300 ppm Kehilangan keseimbangan dan fikiran. Kelumpuhan pernafasan dalam 30 sampai 45 menit.
500 ppm Menimbulkan kelumpuhan dalam 3 sampai 5 menit.
Dibutuhkan segera penyadaran buatan.
700 ppm Akan menimbulkan terhentinya nafas dan kematian jika tidak segera ditolong. Kerusakan otak secara permanen jika tidak ada pertolongan cepat.
Sumber : AlkenMurray.com
H. BAKTERI HETEROTROF
Menurut Fromageot dan Senez (1960), banyak organisme
heterotrof berkemampuan untuk mengoksidasi senyawa sulfur. Dalam
kultur campuran organisme ini bisa mengubah senyawa sulfur menjadi
senyawa sulfat. Hal ini juga dibenarkan oleh Peck (1962) bahwa banyak
organisme heterotrof yang berkemampuan mengoksidasi untuk
Beberapa bakteri heterotrof yang mempunyai kemampuan untuk
melakukan fiksasi nitrogen adalah Azotobacter, Beijerinchia, Clostridium,
Azotoccus dan sebagainya. Sedangkan bakteri heterotrof yang mempunyai
kemampuan memfiksasi sulfur antara lain adalah Atrhrobacter, Bacillus,
Mikrococcus, Mycobacterium dan Pseudomonas (Wild, 1995).
Tabel 6. Bakteri pengoksidasi senyawa sulfur
Organisme Energi Sumber Karbon
pH
Pertumbuhan Referensi
Clorobiaceae fototropik autotropik
Brune, 1989
ß-Proteobakteria kemolitotrof autotropik
Thiobacillus
thioparus kemolitotrof autotropik 6 sampai 8
Schlegel, 1995 Thiobacillus
denitrificans kemolitotrof autotropik 6 sampai 8
Schlegel, 1995
Thiobacillus sp. W5 kemolitotrof autotropik 7 sampai 9
Visser et al, 1997 Xantomonas kemolitotrof heterotrof 7
Sumber : Kleinjan (2005)
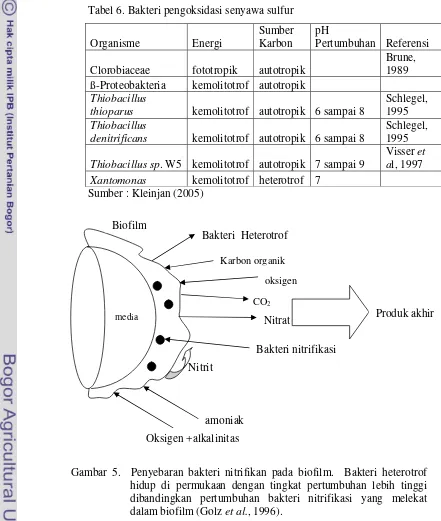
Gambar 5. Penyebaran bakteri nitrifikan pada biofilm. Bakteri heterotrof hidup di permukaan dengan tingkat pertumbuhan lebih tinggi dibandingkan pertumbuhan bakteri nitrifikasi yang melekat dalam biofilm (Golz et al., 1996).
Bakteri Heterotrof
amoniak
Bakteri nitrifikasi Karbon organik
oksigen
16
III. METODE PENELITIAN
A. BAHAN DAN ALAT
Bahan yang digunakan untuk persiapan biofilter ini adalah:
Na2S.9H2O, NH4Cl. xH2O. bahan untuk analisa proksimat, media sulfat bagi
pertumbuhan bakteri yang terdiri atas: CaCl2, KH2PO4, MgSO4.7H2O.
(NH4)2SO4, FeCl2, Fe-Sitrat, Fenol Red, larutan Penyerap Zn Acetat, Asam
Borat, NaCl, larutan Diamin (N,N-Dimethyl-1,4-Phenylen Diamonium
Diklorida), larutan FeCl3, larutan Natrium Thiosulfat 0.1 N, larutan Iodin 0.1
N, larutan Indikator Amilum dan larutan HCl.
Alat yang digunakan dalam persiapan biofilter ini adalah pipa paralon
PVC ukuran 8 inci, tutup paralon, blower, plastik, kawat, rubber stop, kran
udara, lem aquaproff, dan lain-lain.
Alat yang digunakan untuk analisa : erlenmeyer, cawan petri, tabung
ulir, pipet mekanik, tabung sentrifusi, spektrometer, clean bench, autoclave,
pH meter, inkubator, dan lain-lain.
B. REAKTOR BIOFILTER
Biofilter yang digunakan merupakan biofilter yang didesain oleh
Indriasari (2005). Biofilter ini sebelumnya telah digunakan oleh Indriasari
(2005) di gudang lump selama 33 hari, kemudian setelah beroperasi selama 33
hari biofilter ini sempat tidak beroperasi sekitar dua minggu. Selama tidak
beroperasi biofilter hanya dijaga kadar airnya saja agar bakteri tetap hidup.
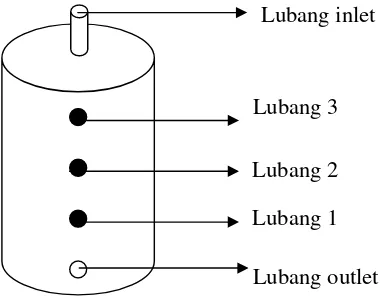
Perancangan kolom biofilter ini adalah dengan menyiapkan pipa paralon PVC
dengan diameter 8 inci dan panjang 70 cm sebanyak 6 buah (Gambar 6). Pipa
paralon diberi lubang yang berfungsi untuk mengambil sampel tanah untuk
mengukur parameter fisik kimia dan mikroba. Lubang inlet berada pada
Gambar 6. Model kolom biofilter
C. BAHAN PENGISI
Pada biofilter ini digunakan bahan pengisi kompos, tanah, bahan
tambahan (berupa sekam, serasah daun karet, kulit kayu karet) dan sludge.
Perbandingan yang digunakan dalam bahan pengisi untuk kompos, tanah,
bahan tambahan dan sludge adalah 4 : 2 : 1 : 1 (Devinny et al., 1999). Tinggi
bahan pengisi ini adalah 40 cm. Komposisi bahan pengisi :
Biofilter 1 berisi kompos, tanah, sekam dan sludge. Biofilter 2 berisi kompos, tanah dan sekam.
Biofilter 3 berisi kompos, tanah, serasah daun karet dan sludge. Biofilter 4 berisi kompos, tanah dan serasah daun karet.
Biofilter 5 berisi kompos, tanah, kulit kayu karet dan sludge. Biofilter 6 berisi kompos, tanah dan kulit kayu karet.
Kompos yang digunakan sebagai bahan pengisi biofilter diperoleh dari
pedagang tanaman komersial. Jenis kompos yang digunakan dalam penelitian
ini adalah kompos dengan merk dagang Kompos Penyubur Tanaman Super
yang diproduksi oleh Enka Saritani Jakarta.
Tanah yang digunakan sebagai bahan pengisi berasal dari tanah yang
ada di sekitar gudang lump, PTPN VIII kebun Cimulang, Bogor. Hal ini Lubang outlet
Lubang 1 Lubang 2 Lubang 3
18 bertujuan untuk memperoleh mikroba alami yang tumbuh di sekitar tempat
tersebut.
Sludge berasal dari endapan lumpur yang diperoleh dari sekitar
pembuangan limbah PTPN VIII kebun Cimulang, Bogor. Sludge yang dipilih
adalah sludge yang telah tua, bukan berasal air limbah segar. Penambahan
sludge ke dalam bahan pengisi bertujuan untuk meningkatkan kelimpahan
serta keragaman populasi mikroba di dalam biofilter. Dengan penambahan
sludge ini diharapkan jumlah dan berbagai jenis mikroba dapat meningkatkan
kinerja biofilter ini.
D. PENELITIAN UTAMA
Perlakukan dalam penelitian ini adalah perbedaan bahan pengisi
tambahan yaitu sekam, serasah daun karet dan kulit kayu. Fokus penelitian ini
adalah mengamati efisiensi biofilter, kapasitas penyerapan serta daya tahan
masing-masing bahan pengisi dalam kolom biofilter. Aliran gas inlet yang
ditetapkan dalam penelitian ini adalah 7 liter per menit.
Untuk mendapatkan hasil tersebut maka parameter-parameter utama
yang digunakan dalam penelitian ini sebagai berikut
a. Senyawa N dalam bentuk amoniak (NH3). Pengamatan dilakukan 30 hari
dengan pengambilan sampel pada inlet dan outlet setiap hari yaitu pagi
dan sore. Waktu sampling inlet dan outlet adalah 5 menit. Metode yang
digunakan dalam pengukuran amoniak adalah Metode Nessler, prosedur
pengukuran dapat dilihat pada lampiran.
b. Senyawa sulfida (total reduce sulfur, TRS) diukur sebagai hidrogen sulfida
(H2S). Pengamatan dilakukan 30 hari dengan pengambilan sampel pada
inlet dan outlet setiap hari yaitu pagi dan sore. Waktu sampling inlet dan
outlet adalah 5 menit. Metode yang digunakan dalam pengukuran hidrogen
sulfida adalah metode metilen blue, prosedur pengukuran dapat dilihat
c. Kadar air dan pH diukur satu minggu sekali untuk memastikan kondisi
media biofilter agar mikroba dapat hidup secara baik. Parameter suhu
diukur setiap hari. Prosedur pengukuran dapat dilihat pada Lampiran 3.
d. Pengukuran parameter total C, total S, total N, NO3-, NH4+ dan sulfat
dilakukan seminggu sekali untuk mengetahui perubahan unsur-unsur
dalam media biofilter. Prosedur pengukuran dapat dilihat pada Lampiran
3.
e. Penghitungan jumlah mikroorganisme pada bahan pengisi dilakukan setiap
seminggu sekali selama dua bulan untuk Nitrosomonas sp dan
Thiobacillus sp, sedangkan penghitungan bakteri heterotrof dan fungi
dilakukan pada setiap minggu. Hal ini bertujuan untuk mengetahui
perubahan serta perkembangan mikroba yang ada pada media biofilter.
Nitrosomonas sp dihitung menggunakan metode MPN, sedangkan
Thiobacillus sp, fungi dan bakteri heterotrof dihitung dengan
menggunakan metode TPC. Prosedur pengukuran dapat dilihat pada
Lampiran 4.
E. ANALISA DATA
Data yang diperoleh akan disajikan dengan menggunakan
Metode Deskriptif dengan grafik yang akan menggambarkan kondisi
seluruh parameter selama penelitian dilaksanakan (Walpole, 1995).
Kinerja biofilter akan diukur berdasarkan efisiensi, kapasitas penghilangan
IV. HASIL DAN PEMBAHASAN
A. GAS PENCEMAR DAN KARAKTERISTIK BAHAN PENGISI
a. Gas Pencemar
Hampir semua kegiatan manusia memasukkan pencemar ke dalam
atmosfer. Menurut Neiburger et al. (1995), pencemaran udara dapat
didefinisikan sebagai terdapatnya zat dalam atmosfer yang bersifat racun,
mengganggu, berbahaya bagi manusia atau bersifat merusak terhadap
nabatah (nabati), hewan dan tanah. Oleh karena kegiatan manusia
menghasilkan gas pencemar maka dibutuhkan pembatasan agar tidak
terlalu menggangu kesehatan manusia, hewan maupun lingkungan sekitar.
Berdasarkan keputusan Menteri Lingkungan Hidup nomor 13 tahun
1995 ada beberapa baku mutu emisi yang harus dipenuhi oleh beberapa
akitvitas manusia termasuk dalam pengolahan pabrik lateks pekat yang
dapat dilihat pada Tabel 7.
Tabel 7. Emisi yang terdapat pada pabrik karet
Gas Satuan
Nilai batas emisi
(Kep-b. Karakteristik Bahan Pengisi
Bahan pengisi merupakan bahan utama dalam biofilter, karena
mendukung hidup mikroorganisme dan memberikan akses untuk
kontaminan dalam aliran udara (Devinny et al., 1999). Berikut merupakan
kondisi bahan pengisi yang digunakan dalam penelitian ini.
Tabel 8. Karakteristik bahan pengisi yang digunakan
Biofilter
Berdasarkan data yang tersaji pada Tabel 8 dapat dilihat bahwa berat
basah pada masing-masing kolom berkisar antara 8998-10652 gram,
sedangkan kadar air pada masing-masing biofilter berkisar antara 47-62%.
Kadar air seperti ini cukup baik untuk pertumbuhan mikroorganisme. Secara
umum diperlukan sekali media yang memiliki kapasitas air tinggi dan sifat
media organik yang mungkin memiliki kandungan air 40% sampai 60% ketika
jenuh (Devinny et al., 1999). Prosentase kadar air setiap biofilter memiliki
kadar air di atas 40%. Kondisi ini sangat baik untuk pertumbuhan
mikroorganisme.
Nilai pH dari hasil pengukuran masing-masing bahan pengisi untuk
biofilter berkisar antara 7.22-7.59. Nilai pH untuk masing masing biofilter
hampir mendekati netral. Kondisi ini sangat baik untuk pertumbuhan
mikroorganisme. Mikroorganisme hidup dengan baik pada kondisi pH antara
6 sampai 8 (Kleinjan, 2005).
Berdasarkan pengukuran, kandungan nitrogen total dalam bahan
pengisi biofilter berkisar antara 0.43-0.57%. Nilai dari karbon total berkisar
antara 21-32%. Menurut Degorce-Dumas et al. (1997), kompos memiliki nilai
C total sebesar 37-50%, kemudian nilai sulfur total yang berada dalam media
biofilter berkisar antara 3000-3900 ppm. Ketiga unsur ini dibutuhkan oleh
22 energi. Nitrogen untuk bakteri Nitrosomonas sp, sulfur untuk bakteri
Thiobacillus sp dan karbon organik untuk bakteri heterotrof.
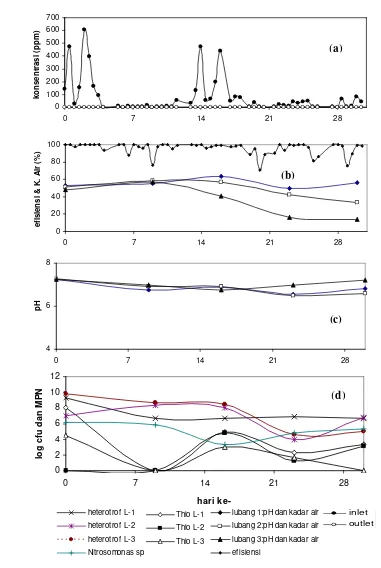
B. BIOFILTER 1 (kompos, tanah, sekam dan sludge)
1. Kinerja Penghilangan Amoniak
Kinerja penghilangan amoniak pada biofilter 1 selama
pengoperasian dapat dilihat pada Gambar 7. Bahan pengisi yang
digunakan dalam kolom biofilter 1 ini merupakan campuran dari kompos,
tanah, sekam dan sludge. Pada biofilter 1 ini terjadi ketidakstabilan kinerja
proses filtrasi. Hal ini terbukti dengan efisiensi yang sangat fluktuatif.
Efisiensi biofilter ini berselang antara 71% sampai 100%.
Konsentrasi gas inlet dan outlet dapat dilihat pada Gambar 7 (a),
sedangkan efisiensi penghilangan amoniak dapat dilihat pada gambar 7
(b). Berdasarkan data, terjadi ketidakstabilan efisiensi mulai dari hari
pertama sampai hari ke-30. Hal ini dikarenakan pada tiga hari pertama
konsentrasi inlet sangat tinggi mencapai 604 ppm yang mengakibatkan
efisiensi pada hari ke-6 turun menjadi 88% dan pada hari ke-9 turun
menjadi 77%. Setelah hari ke-9 sampai hari ke-18 efisiensi kembali naik
diatas 95%, kemudian pada hari ke-11 sampai hari ke-16 konsentrasi
kembali tinggi mencapai 471 ppm sehingga terjadi penurunan efisiensi
kembali pada hari ke-20 menjadi 71%. Selanjutnya efisiensi sampai hari
ke-30 turun naik antara 75% sampai 100%. Konsentrasi yang tinggi ini
terjadi pada saat proses pengolahan lateks pekat yang menggunakan
amoniak sebagai pengawet dan juga karena kebocoran pada tangki
Gambar 7. Kondisi dan kinerja penghilangan NH3 biofilter satu (a) inlet-outlet, (b)
efisiensi dan kadar air, (c) pH, (d) jumlah bakteri. 0
lubang 1:pH dan kadar air
lubang 2:pH dan kadar air
lubang 3:pH dan kadar air
24 Efisiensi yang tidak stabil ini juga dikarenakan pada biofilter 1
belum terbentuk banyak biofilm. Amoniak yang tersebar berupa fase gas
sampai pada biofilm akan dihentikan oleh mikroorganisme dan amoniak
dioksidasi sampai menjadi produk yang tidak berbahaya yaitu NO2- dan
NO3- (Shahmansouri, 2005). Rata-rata efisiensi pada biofilter 1 ini adalah
98%. Secara umum biofilter 1 ini mampu menghilangkan amoniak dengan
baik, namun pada konsentrasi diatas 470 ppm efisiensi mengalami
penurunan.
Populasi bakteri Nitrosomonas sp, Thiobacillus sp dan heterotrof
dapat dilihat pada Gambar 7 (d). Populasi bakteri Nitrosomonas sp terus
mengalami kenaikan setiap harinya, namun pada hari ke-9 dan ke-16
mengalami penurunan. Penurunan yang paling tajam terjadi pada hari
ke-16 karena konsentrasi inlet pada minggu pertama sangat tinggi sehingga
membuat beberapa bakteri Nitrosmonas sp menjadi mati. Pada hari ke-0
populasi bakteri Nitrosomonas sp berjumlah 6.15 sel/g-contoh. Pada
minggu pertama kadar air cenderung stabil di masing-masing lubang
sehingga populasi bakteri cenderung stabil. Pada hari ke-16 populasi
bakteri menurun menjadi 3.3 sel/g-contoh karena selain konsentrasi inlet
yang tinggi, kadar air pada lubang ke-3 mengalami penurunan menjadi
40.73%. Hari berikutnya populasi bakteri terus meningkat sampai hari
ke-30. Populasi bakteri pada hari ke-30 adalah 5.3 sel/g-contoh. Secara
keseluruhan terjadi peningkatan jumlah bakteri Nitrosomonas sp walaupun
terjadi penurunan pada hari ke-16.
Populasi bakteri (log cfu) Thiobacillus sp cenderung tidak stabil
karena mengalami penurunan dan kenaikan yang signifikan. Populasi
bakteri pada hari ke-0 terdapat hanya pada lubang satu dan tiga
masing-masing 9.48 cfu/g-contoh dan 4.48 cfu/g-contoh, kemudian pada hari
ke-16 bakteri Thiobacillus sp tidak ada yang hidup. Hal ini merupakan
dampak dari tingginya kosentrasi inlet H2S dan NH3 pada minggu
pertama, kemudian pada minggu berikutnya bakteri Thiobacillus sp ada
yang hidup tapi tidak pada masing-masing lubang karena kadar air yang
hanya 10%. Pada hari ke-54 bakteri Thiobacillus sp yang hidup hanya
terdapat pada lubang ke-1 (3.3 cfu/g-contoh) dan ke-2 (3.15 cfu/g-contoh).
Meskipun kadar air pada lubang pertama terbilang stabil yaitu 57%,
populasi bakteri Thiobacillus sp pada lubang satu mengalami penuruna
pada hari ke-30 karena banyak berisi bakteri Nitrosomonas spdan bakteri
heterotrof sehingga bakteri Thiobacillus sp tidak mendapatkan nutrien
yang cukup.
Bakteri heterotrof tumbuh cukup stabil pada biofilter satu ini.
populasi bakteri (log cfu) hari ke-0 adalah 9.26 cfu/g-contoh pada lubang
ke-1; 7 cfu/g-contoh pada lubang ke-2 dan 9.85 cfu/g-contoh pada lubang
ke-3. Bakteri heterotrof mengalami penurunan pada lubang ke-3 sampai di
hari ke-23 (5.04 cfu/g-contoh) dan ke-30 (6 cfu/g-contoh) karena kadar air
menurun di hari ke-23 (16%) dan hari ke-30 (13.8%). Perubahan kadar
air dapat dilihat pada Gambar 7 (b).
Populasi bakteri heterotrof cenderung stabil. Pada lubang
pertama berkisar antara 9.26 cfu/g-contoh - 6.7 cfu/g-contoh. Populasi
bakteri yang stabil ini dikarenakan kadar air pada lubang ke-1 diatas 49%.
Kadar air (kelembaban) optimal untuk pertumbuhan bakteri pada biofilter
antara 20% sampai 60% (Williams, 1992). Kadar air yang rendah pada
biofilter lubang ke-3 dikarenakan sekam kurang baik dalam menyerap air
sehingga air yang disiram dari atas langsung turun.
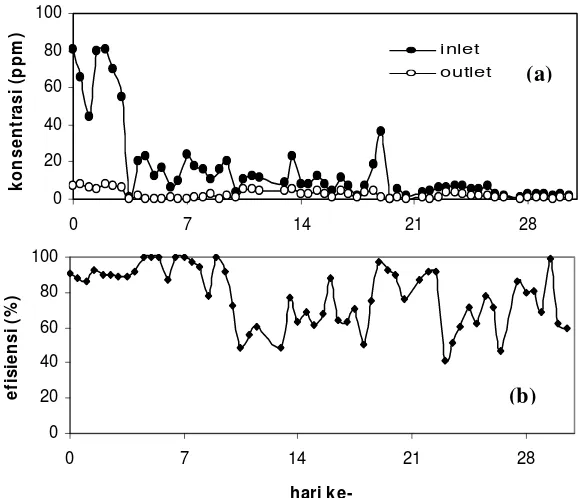
2. Kinerja Penghilangan Hidrogen Sulfida (H2S)
Kinerja penghilangan hidrogen sulfida pada biofilter 1 selama
pengoperasian dapat dilihat pada Gambar 8. Pada biofilter 1, penghilangan
hidrogen sulfida berlangsung kurang baik karena efisiensi penghilangan
ini sebagian besar dibawah 90%. Efisiensi hari pertama biofilter ini adalah
91%. Hal ini dikarenakan tingginya konsentrasi amoniak di awal sebesar
140 ppm dan hidrogen sulfida 80 ppm. Dengan tingginya konsentrasi ini
tidak memberikan kesempatan pada bakteri untuk beradaptasi lebih baik
26 Konsentrasi hidrogen sulfida ini masih tinggi sampai hari ke-2.
Setelah itu turun dibawah 25 ppm. Turunnya konsentrasi tidak diikuti
dengan meningkatnya efisiensi. Efisiensi mengalami fluktuatif yang sangat
signifikan sejak hari ke-8 sampai hari ke-30. Nilai efisiensi berkisar antara
42% sampai 100%. Rata-rata penghilangan hidrogen sulfida selama
pengoperasian adalah 78%. Pada biofilter 1 ini dengan konsentrasi 20 ppm
dapat menurunkan efisiensi penghilangan.
Konsentrasi hidrogen sulfida pada pabrik karet ini berasal dari
pembusukan lump dan konversi bahan hasil hidrolisis (organik) menjadi
molekul sederhana (asam lemak, alkohol, CO2, NH3 dan H2S) (Suwardin,
1989). Lump yang ditumpuk semakin banyak akan menimbulkan bau
busuk yang semakin menyengat. Hal ini yang menyebabkan konsentrasi
H2S tinggi.
3. Kandungan Nitrogen, Sulfur dan Karbon dalam Media Biofilter
Perubahan kandungan nitrogen, sulfur dan karbon dalam biofilter
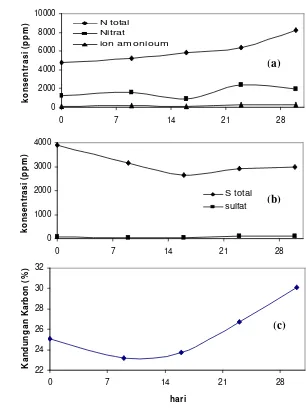
1 dapat dilihat pada Gambar 9 berikut ini.
Konsentrasi nitrat yang terbentuk pada biofilter ini cenderung
mengalami peningkatan walaupun pada hari ke-16 terjadi penurunan. Pada
hari ke-9 konsentrasi nitrat sebesar 1553.6 ppm, kemudian turun pada hari Gambar 9. Kandungan beberapa unsur dalam biofilter satu (a) Nitrogen, (b)
28 ke-16 menjadi 914.9 ppm. Konsentrasi naik kembali pada hari ke-23,
kemudian turun pada hari ke-30 menjadi 2353.58 ppm. Penurunan nitrat
pada media ini dapat disebabkan oleh kelebihan air dari penyiraman yang
menyebabkan kadar air merembas keluar dari media. Air ini disebut
leachet, bisa mengandung konsentrasi nitrat yang tinggi (Schmidt, 2004).
Peningkatan konsentrasi nitrat juga diikuti oleh konsentasi
nitrogen total dalam media. Nirogen yang biasanya terdapat dalam media
biofilter berupa nitrat, nitrit, ion amonium dan nitrogen organik.
Konsentrasi nitrogen total dalam media pada hari ke-0 adalah 4800 ppm,
kemudian meningkat sampai pada hari ke-30 dengan konsentrasi 8400
ppm.
Ion amonium yang terdapat dalam media relatif kecil berkisar
antara 96-290 ppm. Amoniak sangat mudah larut dalam air membentuk
ion amonium. Ion amonium terbentuk karena pada larutan asam atau
netral atom nitrogen bisa mengikat ion hidronium dan melepaskan air
sehingga membentuk ion amonium.
Konsentrasi sulfat yang terbentuk pada biofilter ini cenderung
meningkat walaupun terjadi penurunan di hari ke-9, ke-16 dan ke-30. Pada
awalnya konsentrasi sulfat yang terbentuk sebesar 57 ppm, kemudian pada
hari ke-30 sulfat yang terbentuk sebesar 111 ppm. Peningkatan sulfat juga
diikuti oleh penurunan pH. Sulfat dan nitrat merupakan kedua senyawa
yang menyebabkan pH media menjadi turun.
Konsentrasi sulfur total dalam media mengalami penurunan
sampai hari ke-16, kemudian naik kembali sampai hari ke-30. Pada hari
ke-0 konsentrasi sulfur total bernilai 3885 ppm, kemudian pada hari ke-16
bernilai 2646 ppm. Sedangkan pada hari ke-30 konsentrasi bernilai 2984
ppm. Terjadinya penurunan S total dikarenakan terjadinya perubahan
senyawa sulfat menjadi hidrogen sulfida kembali. Pembentukan ini
dikarenakan adanya bakteri anaerob yang terdapat dalam biofilm. Bakteri
yang merubah sulfat menjadi hidrogen sulfida disebut Sulfate Reduction
Kandungan karbon dalam media berhubungan dengan bakteri
heterotrof. Bakteri heterotrof menggunakan karbon organik sebagai
sumber energinya. Kandungan karbon pada biofilter 1 mengalami
kenaikan. Hal ini dikarenakan jumlah karbon yang dikonsumsi oleh
bakteri heterotrof lebih sedikit dibandingkan karbon yang dihasilkan dari
hasil dekomposisi bahan tambahan dalam biofilter (sekam). Penurunan
karbon dikarenakan pengkonsumsian oleh bakteri heterotrof. Penurunan
kandungan karbon hanya sampai hari ke-9 yaitu dari 25% menjadi 23%,
kemudian setelah hari ke-9 karbon naik sampai pada hari ke-30 menjadi
28%.
Nilai pH mengalami penurunan, namun masih dalam batas
dimana bakteri Thiobacillus sp dan Nitrosomonsas sp masih bisa hidup.
Penurunan pH ini dapat dilihat pada Gambar 7 (c). Nilai pH pada biofilter
1 ini berselang antara 5.76 sampai 7.25. Bakteri Thiobacillus sp hidup
antara pada pH 6 sampai 8. Peningkatan nitrat dan sulfat ini juga ditandai
dengan turunnya pH pada media. Nilai pH di awal untuk masing-masing
adalah 7.23 pada lubang ke-1; 7.27 pada lubang ke-2 dan 7.25 pada lubang
ke-3. Pada minggu terakhir pH turun menjadi 6.83 pada lubang ke-1; 6.59
pada lubang ke-2 dan 7.2 pada lubang ke-3.
C. BIOFILTER 2 (kompos, tanah dan sekam)
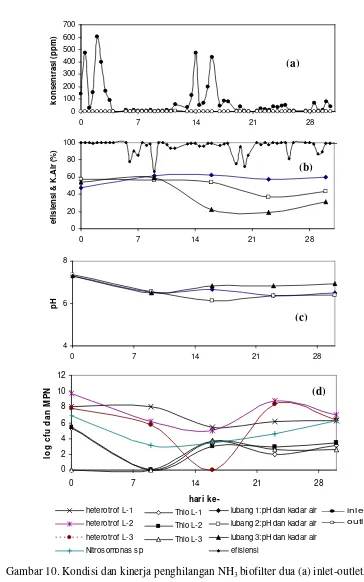
1. Kinerja penghilangan Amoniak (NH3)
Kinerja penghilangan amoniak pada biofilter 2 selama
pengoperasian dapat dilihat pada Gambar 10. Biofilter 2 ini menggunakan
bahan pengisi kompos, tanah dan sekam. Konsentrasi inlet dan outlet pada
biofilter dua dapat dilihat pada Gambar 10 (a), sedangkan efisiensi dapat
dilihat pada Gambar 10 (b). Biofilter 2 yang berisi kompos, tanah dan
sekam ini memiliki kinerja yang tidak jauh berbeda dengan biofilter 1. Hal
ini dapat dilihat dari efisiensi yang tidak stabil selama beberapa hari. Pada
30 pada sore harinya menjadi 90% dan turun lagi pada hari ke-9 dengan
efisiensi 67%.
Gambar 10. Kondisi dan kinerja penghilangan NH3 biofilter dua (a) inlet-outlet, (b)
efisiensi dan kadar air, (c) pH, (d) jumlah bakteri. 0
lubang 1:pH dan kadar air
lubang 2:pH dan kadar air
lubang 3:pH dan kadar air
Efisiensi hari ke-9 merupakan efisiensi terendah dari proses
selama 30 hari. Efisiensi yang tidak stabil dari hari ke-6 sampai hari ke-9
dikarenakan inlet NH3 yang sangat tinggi di awal, hari ke-0 sampai hari
ke-3. Selanjutnya hari ke-10 sampai hari ke-19 efisiensi relatif stabil
berselang antara 94% sampai 100%.
Hari ke-20 terjadi penurunan efisiensi kembali menjadi 72%
dikarenakan konsentrasi inlet kembali tinggi di hari ke-14 sebesar 471
ppm dan hari ke-16 sebesar 439.5 ppm. Selanjutnya efisiensi stabil sampai
hari ke-30 walaupun beberapa kali mengalami penurunan kemudian dapat
naik kembali. Efisiensi rata-rata untuk biofilter dua adalah 97%. Efisiensi
rata-rata biofilter dua lebih kecil dibanding biofilter pertama.
Populasi jumlah bakteri Nitrosomonas sp, Thiobacillus sp dan
heterotrof dapat dilihat pada Gambar 10 (d). Populasi bakteri
Nitrosomonas sp mengalami beberapa penurunan. Seperti pada minggu
hari ke-9 populasi bakteri turun dari 6.85 sel/g-contoh pada hari ke-0
menjadi 3.18 sel/g-contoh. Hal ini dikarenakan pada tiga hari pertama
konsentrasi inlet amoniak sangat tinggi yang menyebabkan bakteri
amoniak tidak bisa beradaptasi dengan baik. Tidak ditambahkannya sludge
juga menjadi faktor yang menyebabkan populasi bakteri sedikit. Menurut
Hirai et al. (2001), keuntungan dari campuran sludge dengan kompos
adalah meningkatkan populasi bakteri nitrifikasi untuk menurunkan waktu
aklimasi dan untuk mencoba mengurangi kepadatan pada media biofilter.
Populasi bakteri Nitrosomonas sp mengalami penambahan dari
hari ke-9 sampai hari ke-30. Pada hari ke-9 jumlah bakteri Nitrosomonas
sp sebanyak 3.18 sel/g-contoh, kemudian pada hari ke-30 jumlah bakteri
sebanyak 6.3 sel /g-contoh.
Populasi bakteri (log cfu) Thiobacillus sp pada hari ke-0 adalah
5.3 cfu/g-contoh pada lubang pertama, 5.48 cfu/g-contoh ada lubang ke-2
dan tidak ada pada lubang ke-3, kemudian pada hari ke-9 bakteri
Thiobacillus sp tidak ada yang tumbuh karena tingginya konsentasi inlet
amoniak dan hidrogen sulfida dalam tiga hari pertama. Menurut Chung et
32 CH11 mengoksidasi hidrogen sulfida menjadi sulfat dengan beban inlet
yang tendah.
Pada hari ke-16 sampai hari ke-30 populasi bakteri Thiobacillus
sp relatif stabil meskipun dalam jumlah yang sedikit. Populasi bakteri
populasi bakteri dari hari ke-16 sampai ke-30 berkisar antara 2
cfu/g-contoh sampai 3.7 cfu/g-cfu/g-contoh.
Populasi bakteri heterotrof selalu ada pada setiap biofilter
meskipun pada hari ke-16 di lubang ke-3 tidak ada bakteri yang tumbuh.
Hal ini dikarenakan pada lubang ke-3, hari ke-16 kadar air hanya 22.5 %.
Selain itu, pada hari ke-16, lubang ke-3 bakteri Thiobacillus sp
mengalami peningkatan yang menyebabkan nutrien yang berada pada
media digunakan oleh bakteri Thiobacillus sp.
Populasi jumlah bakteri (log cfu) heterotrof pada lubang ke-1 dan
ke-2 relatif lebih stabil. Nilai logaritma bakteri pada lubang satu berkisar
antara 5.48 cfu/g-contoh sampai 8 cfu/g-contoh. Populasi bakteri pada
lubang dua berkisar antara 5 cfu/g-contoh sampai 9.68 cfu/g-contoh.
Stabilnya populasi bakteri pada lubang satu dan dua dikarenakan kadar air
pada lubang satu dan dua sesuai dengan pertumbuhan bakteri. Pada lubang
satu kadar air berkisar antara 47% sampai 62%. Kadar air pada lubang dua
berkisar antara 32% sampai 57%. Perubahan kadar air ini dapat dilihat
pada Gambar 10 (b)
2. Kinerja Penghilangan Hidrogen Sulfida (H2S)
Kinerja penghilangan hidrogen sulfida pada biofilter dua selama
pengoperasian dapat dilihat pada Gambar 11. Kinerja penghilangan
hidrogen sulfida tidak jauh berbeda dengan kinerja penghilangan pada
biofilter 1. Namun, lebih baik sedikit. Hal ini dapat dilihat dari efisiensi
yang rendah sejak hari ke-11 yaitu 59%. Efisiensi yang berada dibawah
Hari ke-13 sampai hari ke-20 efisiensi berada pada selang 51%
sampai 89%, kemudian pada hari selanjutnya efisiensi terus mengalami
penurunan dan kenaikan secara signifikan. Seperti pada hari ke-29 dengan
efisiensinya 100% turun menjadi 61% pada hari ke-30. Rata-rata
penghilangan hidrogen sulfida pada biofilter 2 ini adalah 82%. Efisiensi
yang tidak stabil ini dikarenakan bakteri Thiobacillus sp yang jumlahnya
tidak stabil (Gambar 10 (d)) dan lebih tingginya konsentrasi inlet. Selain
itu, Pada konsentrasi NH3 rendah, efisiensi penghilangan H2S tinggi yaitu
99% pada waktu pengoperasian (Lee et al., 2002).
Berdasarkan grafik pada Gambar 11 dapat dilihat bahwa
akumulasi inlet pada awal pengoperasian yang cukup tinggi
mengakibatkan kemampuan biofilter yang kurang baik sejak awal
pengoperasian. Biofilter 2 ini membutuhkan adaptasi pada konsentrasi
yang lebih rendah dari pada konsentrasi inlet untuk pertumbuhan bakteri. Gambar 11. Kinerja penghilangan H2Sbiofilter dua (a) inlet-outlet, (b) efisiensi.
34
3. Kandungan Nitrogen, Sulfur dan Karbon dalam Media Biofilter
Perubahan kandungan nitrogen, sulfur dan karbon biofilter 2
selama penelitian dapat dilihat pada Gambar 12. Efisiensi penghilangan
amoniak yang sebagian besar diatas 96% ini juga berdampak pada
konsentrasi nitrat dalam media yang juga meningkat. Pada hari pertama
konsentrasi nitrat adalah 1286.9 ppm, kemudian meningkat sampai pada
hari terakhir menjadi 3638.8 ppm. Konsentrasi nitrat pada hari ke-16 ini
lebih kecil dibandingkan hari ke-9 dikarenakan nitrat terbawa air yang
setiap hari disiramkan untuk menjaga kadar air media (leachet) atau nitrat
telah berubah menjadi nitrogen organik.
Konsentrasi nitrat yang meningkat juga dibuktikan dengan
konsentrasi nitrogen total dalam media. Konsentrasi nitrogen total dalam
media pada hari ke-0 adalah 4300 ppm, kemudian meningkat sampai pada
hari ke-30 menjadi 8100 ppm. Selain itu, terjadi peningkatan ion amonium
dari 86 ppm pada hari ke-0 menjadi 178 ppm pada hari ke-30.
Konsentrasi nitrat yang terus meningkat juga diikuti kenaikan
konsentrasi sulfat dalam media. Pada hari ke-0 konsentarsi sulfat 69,7
ppm, kemudian terus meningkat sampai pada hari ke-30 menjadi 84 ppm.
Konsentrasi sulfur total pada media mengalami penurunan dari hari ke-0
(3153 ppm) sampai hari ke-16 (2533 ppm), kemudian naik kembali sampai
hari ke-30 (22759 ppm).
Kenaikan konsentrasi nitrat dan sulfat mengakibatkan pH media
menjadi turun. Hari ke-0 pH biofilter masih diatas tujuh yaitu 7.3 pada
lubang ke-1; 7.37 pada lubang ke-2 dan 7.3 pada lubang ke-3 sedangkan
pada hari terakhir pH turun menjadi 6.51 pada lubang ke-1; 6.41 pada
lubang ke-2 dan 6.95 pada lubang ke-3. Adapun terjadi peningkatan pH
selama proses filtrasi seperti di lubang dua dari hari 16 sampai hari
ke-30 hal ini disebabkan karena adanya akumulasi ion amonium di akibat
kelebihan gas amoniak (Yani et al., 1998). Menurut Cho et al. (2000),
bahwa polutan gas yaitu amoniak dan hidrogen sulfida yang masuk ke
asam kuat yaitu nitrat dan sulfat yang selanjutnya akan terkumpul dalam
media sehingga menyebabkan pH di dalam biofilter menjadi turun.
Kandungan karbon dalam media mengalami peningkatan yaitu
dari 28% pada hari ke-0 menjadi 28.4% pada hari ke-30. Peningkatan
karbon dikarenakan bakteri autotrof yang mengkonsumsi CO2 sebagai
sumber energinya.
Gambar 12. Kandungan beberapa unsur dalam biofilter dua (a) Nitrogen, (b) Sulfur, (c) Karbon.
36
D. BIOFILTER 3 (kompos, tanah, serasah daun karet dan sludge)
1. Kinerja penghilangan Amoniak (NH3)
Kinerja penghilangan amoniak pada biofilter 2 selama
pengoperasian dapat dilihat pada Gambar 13 berikut ini. Biofilter tiga
memiliki media dengan bahan pengisi kompos, tanah, serasah daun karet
dan sludge. Perubahan outlet-inlet serta efisiensi dapat dilihat pada
Gambar 13 (a) dan (b). Kinerja penghilangan amoniak biofilter tiga sangat
baik karena efisiensi biofilter sampai hari ke-30 masih bertahan 100 %.
Efisiensi mampu bertahan 100% meskipun beberapa hari di awal dan di
pertengahan pengoperasian konsentrasi inlet sangat tinggi.
Baiknya efisiensi ini disebabkan biofilm pada biofilter 3 ini
sudah terbentuk. Penelitian sebelumnya yang menggunakan biofilter yang
sama telah membantu proses terbentuknya biofilm. Menurut Vanotti et al.
(1999), dibutuhkan waktu penyesuaian enam minggu untuk
mengembangkan fungsi dari biofilm nitrifikasi di atas permukaan media,
yang ditandai dengan stabilnya aktifitas nitrifikasi. Biofilm terbentuk pada
partikel padat media biofilter yang memiliki kadar air yang cukup untuk
pertumbuhan bakteri. Bakteri akan hidup pada permukaan media padat,
kemudian akan berkembang biak sehingga membentuk biofilm (seperti
selaput). Semakin tinggi porositas partikel, semakin banyak biofilm yang
terbentuk.
Perubahan populasi bakteri selama pengoperasian dapat dilihat
pada Gambar 13 (d). Populasi bakteri Nitrosomonas sp pada hari ke nol
adalah 1.88 sel/g-contoh, kemudian meningkat pada hari ke-9 menjadi
4.85 contoh. Hari ke-16 populasi bakteri turun menjadi 2.6
sel/g-contoh. Selanjutnya populasi bakteri kembali naik pada hari ke-23 menjadi
Gambar 13. Kondisi dan kinerja penghilangan NH3 biofilter tiga (a) inlet-outlet, (b)
efisiensi dan kadar air, (c) pH, (d) jumlah bakteri. 0
lubang 1:pH dan kadar air
lubang 2:pH dan kadar air
lubang 3:pH dan kadar air
38 Populasi bakteri mengalami penurunan kembali pada hari ke-30
sebanyak 5.30 sel/g-contoh. Bakteri Nitrosomonas sp banyak tumbuh pada
lubang satu dan dua karena memiliki kadar air yang baik yaitu 49%-57%
pada lubang satu dan 30% - 56% pada lubang dua. Perubahan kadar air ini
dapat dilihat pada Gambar 13 (b).
Populasi bakteri (log cfu) Thiobacillus sp pada hari ke-0 ada di
lubang ke-2 dengan populasi 4.48 cfu/g-contoh, sedangkan hari ke-9
populasi bakteri tidak ada yang tumbuh. Bakteri kemungkinan dalam
keadaan dorman atau mati dimana akibat tingginya konsentrasi inlet
amoniak dan hidrogen sulfida di awal pengoperasian biofilter sehingga
bakteri belum melakukan adaptasi dengan baik. Hari ke-16 bakteri sudah
mulai tumbuh yaitu 3.95 contoh pada lubang pertama; 3.3
cfu/g-contoh pada lubang 2 dan 3.9 cfu/g-cfu/g-contoh pada lubang 3. Hari
ke-23 sampai hari ke-30 bakteri hidup pada setiap lubangnya walaupun
mengalami penurunan dan kenaikan jumlah. Jumlah bakteri dari hari ke-23
sampai hari ke-30 berkisar antara 2.18 - 6.78 cfu/g-contoh.
Populasi jumlah (log cfu) bakteri heterotrof pada lubang satu
cenderung stabil berkisar antara 5.78 - 6.48 cfu/g-contoh, sedangkan
lubang dua dan tiga mengalami beberapa penurunan yang signifikan. Pada
lubang dua populasi bakteri mengalami penurunan dari 9.68 cfu/g-contoh
pada hari ke-0, kemudian turun pada hari ke-16 menjadi 6 cfu/g-contoh.
Setelah hari ke-9 populasi bakteri di lubang dua relatif stabil berkisar
antara 5.7 cfu/g-contoh – 6.48 cfu/g-contoh. Pada lubang ke-3 penurunan
terjadi dari 8.3 cfu/g-contoh pada hari ke-9 menjadi 5 cfu/g-contoh pada
hari ke-16, selanjutnya bakteri stabil berkisar 5 contoh - 6
cfu/g-contoh.
Stabilnya jumlah bakteri heterotrof pada lubang satu juga di
dukung dengan kadar air yang stabil pada lubang satu. Kadar air pada
lubang satu berkisar antara 49.2% – 57.7%, sedangkan pada lubang tiga
kadar air sangat rendah sejak hari ke-16 sampai hari ke-54. Kadar air pada
lubang tiga hari ke-16 sampai hari ke-54 berkisar antara 7.2% - 12.7%.
sehingga jumlah bakteri mengalami penurunan antara hari ke-9 dampai
hari ke-16.
2. Kinerja Penghilangan Hidrogen Sulfida (H2S)
Kinerja penghilangan hidrogen sulfida pada biofilter tiga selama
pengoperasian dapat dilihat pada Gambar 14. Kinerja penghilangan
hidrogen sulfida pada biofilter 3 yang berisi kompos, tanah, serasah daun
karet dan sludge ini lebih baik dibandingkan biofilter satu dan dua. Hal ini
terbukti dengan efisiensi yang stabil sampai pada hari ke-16. Efisiensi
sampai pada hari ke-16 selalu diatas 95%. Pada hari ke-17 sore hari
efisiensi menurun sampai 77%, kemudian naik beberapa saat dan turun
lagi pada hari ke-19 sore menjadi 79%.
Penurunan ini bisa dikarenakan akumulasi dari konsentrasi inlet
amoniak pada hari ke-0, ke-2, ke-14 dan ke-16 yang sangat tinggi Gambar 14. Kinerja penghilangan H2Sbiofilter tiga (a) inlet-outlet, (b) efisiensi.