PENETAPAN KADAR KALIUM PADA DAUN SALAM
(
Eugenia polyantha
Wight) SEGAR, SIMPLISIA DAN INFUSA
SECARA SPEKTROFOTOMETRI SERAPAN ATOM
SKRIPSI
masi pada Fakultas Farmasi
Universitas terr
OLEH:
MAYANG SARI
NIM 121524169
PROGRAM EKSTENSI SARJANA FARMASI
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA
MEDAN
PENETAPAN KADAR KALIUM PADA DAUN SALAM
(
Eugenia polyantha
Wight) SEGAR, SIMPLISIA DAN INFUSA
SECARA SPEKTROFOTOMETRI SERAPAN ATOM
SKRIPSI
Diajukan Sebagai Salah Satu Syarat Untuk Memperoleh Gelar Sarjana Farmasi pada Fakultas Farmasi
Universitas Sumatera Utara masi pada Fakultas Farmasi
Universitas tera Utar
OLEH:
MAYANG SARI
NIM 121524169
PROGRAM EKSTENSI SARJANA FARMASI
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA
MEDAN
PENGESAHAN SKRIPSI
PENETAPAN KADAR KALIUM PADA DAUN SALAM
(
Eugenia polyantha
Wight) SEGAR, SIMPLISIA DAN INFUSA
SECARA SPEKTROFOTOMETRI SERAPAN ATOM
OLEH:
MAYANG SARI
NIM 121524169
Dipertahankan di Hadapan Panitia Penguji Skripsi Fakultas Farmasi Universitas Sumatera Utara
Pada Tanggal: 23 Mei 2015
Medan, Juni 2015 Fakultas Farmasi
Universitas Sumatera Utara Wakil Dekan I,
Prof. Dr. Julia Reveny, M.Si., Apt. NIP 195807101986012001
Disetujui Oleh:
Pembimbing I, Panitia Penguji,
Dra. Tuty Roida Pardede, M.Si., Apt. Prof. Dr. rer. nat. E. De Lux Putra, S.U., Apt. NIP 195401101980032001 NIP 195306191983031001
Pembimbing II, Dra. Tuty Roida Pardede, M.Si., Apt. NIP 195401101980032001
Prof. Dr. Muchlisyam, M.Si., Apt. Dra. Sudarmi, M.Si., Apt. NIP 195006221980021001 NIP 195409101983032001
iv
KATA PENGANTAR
Puji syukur kehadirat Allah SWT yang telah melimpahkan rahmat dan karunia kepada penulis, sehingga dapat menyelesaikan penyusunan skripsi yang berjudul Penetapan Kadar Kalium pada Daun Salam (Eugenia polyantha Wight)
Segar, Simplisia dan Infusa Secara Spektrofotometri Serapan Atom. Skripsi ini diajukan sebagai salah satu syarat untuk memperoleh gelar Sarjana Farmasi di Fakultas Farmasi Universitas Sumatera Utara.
Pada kesempatan ini, dengan segala kerendahan hati penulis mengucapkan terima kasih kepada Bapak Prof. Dr. Sumadio Hadisahputra, Apt., selaku Dekan Fakultas Farmasi yang telah menyediakan fasilitas kepada penulis selama perkuliahan di Fakultas Farmasi. Penulis juga mengucapkan terima kasih kepada Ibu Dra. Tuty Roida Pardede, M.Si., Apt., dan Bapak Prof. Dr. Muchlisyam, M.Si., Apt. selaku dosen pembimbing yang telah mengarahkan penulis dengan penuh kesabaran dan tanggung jawab, memberikan petunjuk dan saran-saran selama penelitian hingga terselesaikannya skripsi ini. Ucapan terima kasih juga penulis sampaikan kepada Bapak Prof. Dr. rer. nat. Effendy De Lux Putra, S.U., Apt., selaku ketua penguji, Ibu Dra. Sudarmi, M.Si., Apt., dan Ibu Dra. Masria Lasma Tambunan, M.Si., Apt., selaku anggota penguji yang telah memberikan saran untuk menyempurnakan skripsi ini, dan Ibu Dra. Anayanti Arianto, M.Si., Apt., selaku dosen penasehat akademik yang telah banyak membimbing penulis selama masa perkuliahan hingga selesai.
v
Noni Maulinarni, SST., Rusman Shiddiq, S. Ked., dan Adinda Intan Agusriati serta keluarga besar yang senantiasa memberikan doa, semangat dan dukungan yang tak ternilai. Penulis juga mengucapkan terima kasih kepada sahabat-sahabat, Almunadia, Silvia, Intan, Samira, Acut, Amel, Desi dan Kak Siti, serta teman-teman mahasiswa/mahasiswi farmasi yang selalu mendoakan dan memberi semangat.
Penulis menyadari sepenuhnya bahwa penulisan skripsi ini masih jauh dari sempurna. Oleh karena itu, penulis mengharapkan saran dan kritik yang membangun demi kesempurnaan skripsi ini. Semoga Allah membalas segala budi baik dan penulis berharap semoga skripsi ini bermanfaat bagi ilmu pengetahuan khususnya di bidang farmasi.
Medan, Mei 2015 Penulis,
vi
PENETAPAN KADAR KALIUM PADA DAUN SALAM (Eugenia polyantha Wight) SEGAR, SIMPLISIA DAN INFUSA
SECARA SPEKTROFOTOMETRI SERAPAN ATOM
ABSTRAK
Tanaman salam adalah tanaman penghasil daun rempah yang digunakan dalam masakan dengan nama latin (Eugenia polyantha Wight). Daun salam dapat dijadikan sebagai obat tradisional baik itu berupa daun segar maupun daun yang telah dikeringkan (simplisia) yang diolah dengan cara direbus (infusa) dan daun ini merupakan sumber mineral yang tinggi, terutama kalium. Ditinjau dari pengunaan daun maka penelitian ini bertujuan untuk mengetahui perbedaan kandungan kalium pada daun salam segar dan simplisia, serta pada infusa daun salam segar dan infusa simplisia.
Penelitian ini meliputi proses pembuatan infusa, destruksi basah, destruksi kering, analisis kualitatif dan analisis kuantitatif kalium dilakukan dengan menggunakan metode Spektrofotometri Serapan Atom (SSA) yaitu mineral kalium pada panjang gelombang 766,50 nm.
Hasil penelitian menunjukkan bahwa terdapat perbedaan kadar kalium pada sampel dengan kadar kalium pada simplisia sebesar (930,5100 ± 6,8009) mg/100g; pada daun salam segar sebesar (328,0410 ± 2,7313) mg/100g; pada infusa simplisia sebesar (1219,3333 ± 11,7515) µg/ml dan pada infusa daun salam segar sebesar (537,9700 ± 7,1442) µg/ml. Berdasarkan data dapat dilihat persentase perbedaan kadar kalium antara simplisia daun salam dengan daun salam segar adalah 64,7461% dan antara infusa simplisia daun salam dengan infusa daun salam segar adalah 55,8799%. Hasil uji perolehan kembali (recovery) kalium 93,11% dengan RSD 5,6833%. Dari hasil yang diperoleh menunjukkan bahwa metode yang dilakukan memiliki presisi yang baik.
Secara statistik uji beda rata–rata kandungan kalium pada sampel dengan menggunakan distribusi F, dapat disimpulkan bahwa kandungan kalium pada simplisia dan daun salam segar lebih tinggi secara signifikan dari pada infusa simplisia dan infusa daun salam segar.
vii
DETERMINATION OF POTASSIUM BAY LEAF
(Eugenia polyantha Wight) FRESH, SIMPLICIA AND INFUSION BY ATOMIC ABSORPTION SPECTROPHOTOMETRY
ABSTRACT
Bay leaf is the plants producing spice leaves are used in cuisine with the latin name (Eugenia polyantha Wight). Bay leaf can be used as a traditional medicine be it in the form of fresh leaves and the dried leaves (simplicia) made by boiling (infusion) and leaves it is a source of high minerals, especially potassium. Review of bay leaf are used, this research aims to determine the differences in the content of potassium fresh bay leaf, simplicia, bay leaf infusion and simplicia infusion.
This research includes the process of making infusion, wet destruction, dried destruction, qualitative analysis and quantitative analysis of potassium were calculated using Atomic Absorption Spectrophotometry (AAS) potassium is at a wavelength of 766.50 nm.
The results showed the contens of potassium in the simplicia is (930.5100 ± 6.8009) mg/100g; in fresh bay leaf (328.0410 ± 2.7313) mg/100g; simplicia infusion (1219.3333 ± 11.7515) µg/ml and in fresh bay leaf infusion (537.9700 ± 7.1442) µg/ml. The percentage differences in the levels of potassium between simplicia with fresh bay leaf is 64.7461% and between simplicia infusion with fresh bay leaf infusion is 55.8799%. The result of recovery test (recovery) potassium 93.11% with RSD 5.6833%. From the results obtained show that the method is carried out has good precision.
Statistically different test average content of potassium in the sample using the F distribution, the conclution is the content of potassium in simplicia and fresh bay leaf significantly higher than between simplicia infusion with fresh bay leaf infusion.
Key words: Bay leaf (Eugenia polyantha Wight), fresh, simplicia, infusion, potassium (K), atomic absorption spectrophotometry.
viii DAFTAR ISI
Halaman
JUDUL ... i
HALAMAN JUDUL ... ii
LEMBAR PENGESAHAN ... iii
KATA PENGANTAR ... iv
ABSTRAK ... vi
ABSTRACT ... vii
DAFTAR ISI ... viii
DAFTAR TABEL ... xii
DAFTAR GAMBAR ... xiii
DAFTAR LAMPIRAN ... xiv
BAB I PENDAHULUAN ... 1
1.1 Latar Belakang ... 1
1.2 Perumusan Masalah ... 3
1.3 Hipotesis ... 4
1.4 Tujuan Penelitian ... 4
1.5 Manfaat Penelitian ... 4
BAB II TINJAUAN PUSTAKA ... 5
2.1 Tanaman Obat ... 5
2.2 Simplisia ... 5
2.2.1 Klasifikasi simplisia ... 5
2.3 Tanaman Salam ... 6
ix
2.3.2 Morfologi tanaman salam ... 7
2.3.3 Kandungan senyawa aktif ... 8
2.4 Mineral ... 9
2.4.1 Kalium ... 9
2.4.2 Fungsi kalium ... 9
2.4.3 Kelebihan dan kekurangan kalium ... 10
2.5 Spektrofotometer Serapan Atom ... 10
2.5.1 Instrumen spektrofotometer serapan atom ... 11
2.5.2 Gangguan - gangguan pada spektrofotometri serapan atom ... 12
2.6 Validasi Metode Analisis ... 14
BAB III METODE PENELITIAN ... 17
3.1 Tempat dan Waktu Penelitian ... 17
3.2 Alat dan Bahan ... 17
3.2.1 Alat ... 17
3.2.2 Bahan ... 18
3.3 Pembuatan Pereaksi ... 18
3.3.1 Larutan asam nitrat(1:1) v/v ... 18
3.3.2 Larutan asam pikrat 1% b/v ... 18
3.4 Penyiapan Sampel ... 18
3.4.1 Pengambilan sampel ... 18
3.4.2 Identifikasi sampel ... 19
3.4.3 Pembuatan simplisia ... 19
3.4.4 Penyiapan sampel daun salam segar ... 19
x
3.5 Pemeriksaan Karakteristik Simplisia ... 20
3.5.1 Pemeriksaan kadar air ... 20
3.5.2 Pemeriksaan kadar sari yang larut dalam air ... 20
3.5.3 Pemeriksaan kadar sari yang larut dalam etanol 21
3.5.4 Penetapan kadar abu total ... 21
3.5.5 Penetapan kadar abu tidak larut dalam asam ... 21
3.6 Prosedur Penelitian ... 22
3.6.1 Destruksi kering sampel ... 22
3.6.2 Pembuatan larutan sampel ... 22
3.6.3 Pembuatan infusa ... 23
3.6.4 Destruksi basah pada infusa ... 23
3.7 Analisis Kualitatif Kalium ... 23
3.7.1 Uji dengan reaksi nyala ... 23
3.7.2 Uji kristal dengan asam pikrat 1% b/v ... 24
3.8 Analisis Kuantitatif Kalium ... 24
3.8.1 Pembuatan kurva kalibrasi kalium ... 24
3.8.2 Penetapan kadar kalium ... 24
3.9 Analisis Data Secara Statistik ... 25
3.9.1 Penolakan hasil pengamatan ... 25
3.9.2 Pengujian beda nilai rata-rata antar sampel ... 26
3.10 Validasi Metode Analisis ... 28
3.10.1 Uji perolehan kembali (recovery)... 28
3.10.2 Simpangan baku relatif ... 28
xi
BAB IV HASIL DAN PEMBAHASAN ... 30
4.1 Identifikasi Sampel ... 30
4.2 Pemeriksaan Karakteristik Simplisia ... 30
4.3 Analisis Kualitatif ... 32
4.4 Analisis Kuantitatif ... 32
4.4.1 Kurva kalibrasi kalium ... 32
4.4.2 Pengukuran kadar kalium dalam sampel ... 33
4.4.3 Uji perolehan kembali (recovery)... 36
4.4.4 Simpangan baku relatif ... 36
4.4.5 Batas deteksi dan datas kuantitasi ... 37
BAB V KESIMPULAN DAN SARAN ... 38
5.1 Kesimpulan ... 38
5.2 Saran ... 38
DAFTAR PUSTAKA ... 39
xii
DAFTAR TABEL
Halaman
Tabel 4.1 Hasil karakterisasi serbuk Simplisia daun salam ... 30
Tabel 4.2 Hasil analisis kualitatif dalam sampel daun salam yang telah didestruksi ... 32
Tabel 4.3 Hasil analisis kadar kalium dalam sampel ... 34
Tabel 4.4 Hasil perbedaan kadar kalium dalam sampel ... 34
Tabel 4.5 Hasil uji beda nilai rata-rata kadar kalium antar sampel ... 35
Tabel 4.6 Persen uji perolehan kembali (recovery)kadar kalium dalam sampel ... 36
Tabel 4.7 Nilai simpangan baku dan simpangan baku relatif kalium dalam sampel ... 36
xiii
DAFTAR GAMBAR
xiv
DAFTAR LAMPIRAN
Halaman Lampiran 1. Hasil identifikasi tanaman ... 41 Lampiran 2. Gambar sampel ... 42 Lampiran 3. Hasil analisis kualitatif kalium pada daun salam ... 43
Lampiran 4. Bagan alir pembuatan simplisia ... 44 Lampiran 5. Bagan alir proses destruksi kering daun salam segar ... 45 Lampiran 6. Bagan alir proses destruksi kering simplisia daun salam . 46 Lampiran 7. Bagan alir proses pembuatan infusa daun salam segar .... 47 Lampiran 8. Bagan alir proses pembuatan infusa simplisia daun salam 48 Lampiran 9. Bagan alir proses pembuatan larutan sampel secara
destruksi basah ... 49 Lampiran 10. Bagan alir proses pembuatan larutan sampel hasil
destruksi kering ... 50 Lampiran 11. Perhitungan penetapan kadar air pada serbuk simplisia
daun salam ... 51 Lampiran 12. Perhitungan penetapan kadar sari larut dalam air pada
serbuk simplisia daun salam ... 52 Lampiran 13. Perhitungan penetapan kadar sari larut dalam etanol
pada serbuk simplisia daun salam ... 53 Lampiran 14. Perhitungan penetapan kadar abu total pada serbuk
simplisia daun salam ... 54 Lampiran 15. Perhitungan penetapan kadar abu tidak larut dalam asam
pada serbuk simplisia daun salam ... 55 Lampiran 16. Data kalibrasi kalium dengan spektrofotometer serapan
xv
Lampiran 19. Perhitungan statistik kadar kalium dalam sampel ... 71
Lampiran 20. Persentase perbedaan kadar kalium dalam sampel ... 80
Lampiran 21. Pengujian beda nilai rata-rata kadar kalium dalam sampel 81 Lampiran 22. Hasil analisis kadar kalium sebelum dan setelah penambahan larutan baku dalam daun salam segar ... 85
Lampiran 23. Perhitungan uji perolehan kembali kadar kalium dalam daun salam segar ... 86
Lampiran 24. Perhitungan simpangan baku relatif (RSD) kadar kalium dalam sampel ... 92
Lampiran 25. Perhitungan batas deteksi dan batas kuantitasi dalam sampel ... 93
Lampiran 26. Gambar alat-alat yang digunakan ... 94
Lampiran 27. Tabel distribusi t ... 95
vi
PENETAPAN KADAR KALIUM PADA DAUN SALAM (Eugenia polyantha Wight) SEGAR, SIMPLISIA DAN INFUSA
SECARA SPEKTROFOTOMETRI SERAPAN ATOM
ABSTRAK
Tanaman salam adalah tanaman penghasil daun rempah yang digunakan dalam masakan dengan nama latin (Eugenia polyantha Wight). Daun salam dapat dijadikan sebagai obat tradisional baik itu berupa daun segar maupun daun yang telah dikeringkan (simplisia) yang diolah dengan cara direbus (infusa) dan daun ini merupakan sumber mineral yang tinggi, terutama kalium. Ditinjau dari pengunaan daun maka penelitian ini bertujuan untuk mengetahui perbedaan kandungan kalium pada daun salam segar dan simplisia, serta pada infusa daun salam segar dan infusa simplisia.
Penelitian ini meliputi proses pembuatan infusa, destruksi basah, destruksi kering, analisis kualitatif dan analisis kuantitatif kalium dilakukan dengan menggunakan metode Spektrofotometri Serapan Atom (SSA) yaitu mineral kalium pada panjang gelombang 766,50 nm.
Hasil penelitian menunjukkan bahwa terdapat perbedaan kadar kalium pada sampel dengan kadar kalium pada simplisia sebesar (930,5100 ± 6,8009) mg/100g; pada daun salam segar sebesar (328,0410 ± 2,7313) mg/100g; pada infusa simplisia sebesar (1219,3333 ± 11,7515) µg/ml dan pada infusa daun salam segar sebesar (537,9700 ± 7,1442) µg/ml. Berdasarkan data dapat dilihat persentase perbedaan kadar kalium antara simplisia daun salam dengan daun salam segar adalah 64,7461% dan antara infusa simplisia daun salam dengan infusa daun salam segar adalah 55,8799%. Hasil uji perolehan kembali (recovery) kalium 93,11% dengan RSD 5,6833%. Dari hasil yang diperoleh menunjukkan bahwa metode yang dilakukan memiliki presisi yang baik.
Secara statistik uji beda rata–rata kandungan kalium pada sampel dengan menggunakan distribusi F, dapat disimpulkan bahwa kandungan kalium pada simplisia dan daun salam segar lebih tinggi secara signifikan dari pada infusa simplisia dan infusa daun salam segar.
vii
DETERMINATION OF POTASSIUM BAY LEAF
(Eugenia polyantha Wight) FRESH, SIMPLICIA AND INFUSION BY ATOMIC ABSORPTION SPECTROPHOTOMETRY
ABSTRACT
Bay leaf is the plants producing spice leaves are used in cuisine with the latin name (Eugenia polyantha Wight). Bay leaf can be used as a traditional medicine be it in the form of fresh leaves and the dried leaves (simplicia) made by boiling (infusion) and leaves it is a source of high minerals, especially potassium. Review of bay leaf are used, this research aims to determine the differences in the content of potassium fresh bay leaf, simplicia, bay leaf infusion and simplicia infusion.
This research includes the process of making infusion, wet destruction, dried destruction, qualitative analysis and quantitative analysis of potassium were calculated using Atomic Absorption Spectrophotometry (AAS) potassium is at a wavelength of 766.50 nm.
The results showed the contens of potassium in the simplicia is (930.5100 ± 6.8009) mg/100g; in fresh bay leaf (328.0410 ± 2.7313) mg/100g; simplicia infusion (1219.3333 ± 11.7515) µg/ml and in fresh bay leaf infusion (537.9700 ± 7.1442) µg/ml. The percentage differences in the levels of potassium between simplicia with fresh bay leaf is 64.7461% and between simplicia infusion with fresh bay leaf infusion is 55.8799%. The result of recovery test (recovery) potassium 93.11% with RSD 5.6833%. From the results obtained show that the method is carried out has good precision.
Statistically different test average content of potassium in the sample using the F distribution, the conclution is the content of potassium in simplicia and fresh bay leaf significantly higher than between simplicia infusion with fresh bay leaf infusion.
Key words: Bay leaf (Eugenia polyantha Wight), fresh, simplicia, infusion, potassium (K), atomic absorption spectrophotometry.
1 BAB I PENDAHULUAN
1.1Latar Belakang
Pemakaian tanaman obat dalam dekade terakhir ini cenderung meningkat sejalan dengan berkembangnya industri jamu atau obat tradisional, farmasi, kosmetik, makanan dan minuman. Tanaman obat yang dipergunakan biasanya dalam bentuk simplisia (bahan yang telah dikeringkan dan belum mengalami pengolahan apa pun). Simplisia tersebut berasal dari akar, daun, bunga, biji, buah dan kulit batang (Syukur dan Hernani, 2001).
Tanaman salam adalah nama tanaman penghasil da digunakan dalam masakan. Daun salam dalam
Indonesian bay leaf atau Indonesian laurel, sedangkan nama ilmiahnya adalah
Syzygium polyanthum (Wight) Walp. dengan sinonim Eugenia polyantha Wight. Daun ini dicampurkan dalam keadaan utuh, kering atau pun segar dan turut dimasak bersamaan dengan makanan (Anonim, 2015).
2
Beberapa kandungan senyawa aktif yang terkandung dalam daun salam adalah minyak atsiri, tanin, flavonoid, alkaloida, serta polifenol dan beberapa senyawa aktif yang sangat penting bagi kesehatan tubuh yaitu vitamin dan beberapa mineral, salah satunya adalah kalium (Herliana, 2013).
Mineral memegang peranan penting dalam pemeliharaan fungsi tubuh, baik pada tingkat sel, jaringan, organ, maupun fungsi tubuh keseluruhan. Mineral digolongkan ke dalam mineral makro dan mineral mikro. Mineral makro adalah mineral yang dibutuhkan tubuh dalam jumlah yang lebih dari 100 mg/hari, sedangkan mineral mikro dibutuhkan kurang dari 100 mg/hari. Salah satu contoh mineral makro yang penting bagi fungsi tubuh adalah kalium (Almatsier, 2004).
Kalium merupakan kation yang terpenting dalam cairan intraseluler dan sangat esensial untuk mengatur keseimbangan asam basa serta isotoni sel. Selain itu kalium juga mengaktivasi banyak reaksi enzim dan proses fisiologi, seperti transmisi impuls di saraf dan otot, kontraksi otot dan metabolisme karbohidrat. Zat ini praktis terdapat dalam semua makanan (Tan dan Rahardja, 2008).
Menurut United States Department of Agriculture America (2014), daun salam atau bay leaf mengandung kadar kalium yang tinggi yaitu 529 mg/100g. Asupan kadar kalium yang tinggi dari daun salam sangat berperan penting bagi fungsi tubuh, terutama bagi masyarakat yang telah memanfaatkan air rebusan (infusa) daun salam segar maupun air rebusan (infusa) daun salam yang telah dikeringkan (simplisia) sebagai obat tradisional.
3
signifikan bagi kandungan yang terdapat di dalamnya jika dikonsumsi dalam jumlah yang sama, sehingga perlu dilakukannya penetapan kadar kalium yang terkandung di dalam daun salam segar, simplisia daun salam, infusa daun salam segar dan infusa simplisia daun salam. Berbagai metode dapat diterapkan dalam penetapan kadar kalium, antara lain seperti metode Gravimetri, Titrimetri,
Inductively Coupled Plasma dan Spektrofotometri Serapan Atom.
Berdasarkan uraian di atas, penulis tertarik untuk meneliti kandungan kalium yang terdapat pada daun salam segar, simplisia daun salam serta infusa daun salam segar dan infusa simplisia daun salam, yang merupakan bahan obat tradisional Indonesia. Metode yang dipilih dalam penelitian ini adalah Spektrofotometri Serapan Atom. Pemilihan ini didasarkan pada kepekaan yang tinggi (batas deteksi kurang dari 1ppm), pelaksanaannya relatif sederhana dan interferensinya sedikit (Rohman, 2007).
1.2Perumusan Masalah
Berdasarkan uraian di atas, maka perumusan masalah dalam penelitian ini
adalah sebagai berikut:
a. Berapakah kadar k alium yang terdapat pada simplisia daun salam dan daun salam segar, serta pada infusa simplisia daun salam dan infusa daun salam segar?
4 1.3Hipotesis
Berdasarkan perumusan masalah di atas, maka hipotesis dalam penelitian
ini adalah sebagai berikut:
a. Simplisia daun salam dan daun salam segar, serta pada infusa simplisia daun salam dan infusa daun salam segar memiliki kadar kalium dalam jumlah tertentu.
b. Terdapat perbedaan kadar kalium antara simplisia daun salam dengan daun salam segar dan antara infusa simplisia daun salam dengan infusa daun salam segar.
1.4Tujuan Penelitian
a. Untuk mengetahui kadar kalium yang terdapat pada simplisia daun salam dan daun salam segar, serta pada infusa simplisia daun salam dan infusa daun salam segar.
b. Untuk mengetahui perbedaan kadar kalium antara simplisia daun salam dengan daun salam segar dan antara infusa simplisia daun salam dengan infusa daun salam segar.
1.5Manfaat Penelitian
a. Untuk memberikan informasi kepada masyarakat bahwa daun salam merupakan bagian tanaman yang baik untuk mengimbangi asupan kalium. b. Hasil penelitian dapat dimanfaatkan oleh peneliti selanjutnya untuk
5 BAB II
TINJAUAN PUSTAKA
2.1 Tanaman Obat
Indonesia sangat kaya dengan berbagai spesies flora, dari 40 ribu jenis yang tumbuh di dunia, 30 ribu diantaranya tumbuh di Indonesia. Sekitar 26% telah dibudidayakan dan sisanya sekitar 74% masih tumbuh liar di hutan-hutan. Dari yang telah dibudidayakan, lebih dari 940 jenis digunakan sebagai obat tradisional (Syukur dan Hernani, 2001).
Pemakaian tanaman obat dalam dekade terakhir ini cenderung meningkat sejalan dengan berkembangnya industri jamu dan obat tradisional, kosmetik, makanan dan minuman. Tanaman obat yang dipergunakan biasanya dalam bentuk simplisia (bahan yang telah dikeringkan dan belum mengalami pengolahan apapun). Simplisia tersebut berasal dari akar, daun, bungan, biji, buah dan kulit batang (Syukur dan Hernani, 2001).
2.2 Simplisia
Simplisia ialah bahan alamiah yang dipergunakan sebagai obat yang belum mengalami pengolahan apapun juga dan kecuali dinyatakan lain, berupa bahan yang yang telah dikeringkan (Depkes RI, 1995).
2.2.1 Klasifikasi simplisia
Klasifikasi simplisia berdasarkan sumber bahan alamiah simplisia adalah: a. Simplisia nabati
6
tanaman. Eksudat tanaman ialah isi sel yang secara spontan keluar dari tanaman atau isi sel yang dengan cara tertentu dikeluarkan dari selnya, atau zat-zat nabati lainnya yang dengan cara tertentu dipisahkan dari tanamannya dan belum berupa zat kimia murni (Depkes RI, 1995).
b. Simplisia hewani
Simplisia yang berupa hewan utuh bagian hewan atau zat-zat berguna yang dihasilkan oleh hewan dan belum berupa zat kimia murni (Depkes RI, 1995). c. Simplisia pelikan (mineral)
Simplisia yang berupa bahan-bahan pelikan (mineral) yang belum diolah atau telah diolah dengan cara sederhana dan belum berupa zat kimia murni (Depkes RI, 1995).
2.3 Tanaman Salam
Tanaman salam adalah tanaman yang biasa dimanfaatkan daunnya untuk penyedap rasa pada masakan khas nusantara, selain itu daunnya juga digunakan sebagai rempah pengobatan tradisional indonesia. Nama ilmiahnya adalah
Syzygium polyanthum (Wight) Walp. dengan sinonim Eugenia polyantha Wight (Nurcahyati, 2014).
Adapun nama lain dari daun salam, diantaranya ubar serai (Malaysia),
Indonesian bay leaf, Indonesian laurel, Indian bay leaf (Inggris), salamblatt
7
Tanaman salam merupakan tanaman yang banyak tumbuh didaerah tropis khususnya di daerah Asia Tenggara. Tanaman salam biasanya sering dijumpai tumbuh liar di hutan dan kebun. Tanaman salam biasanya tumbuh pada ketinggian 225-450 m diatas permukaan laut dengan curah hujan 3.000-4.000 mm. Cara pembudidayaan tanaman salam sangat mudah, bisa dari biji, cangkok, atau stek. Setelah tumbuh, pohon ini tidak membutuhkan banyak perawatan. Cukup sesekali dipupuk dan disiram air (Nurcahyati, 2014).
2.3.1 Klasifikasi tanaman salam
Menurut Anonim (2000), klasifikasi tanaman salam Eugenia polyantha
Wight secara sistematik adalah sebagai berikut: Dunia : Plantae
Divisi : Spermatophyta Sub divisi : Angiospermae Kelas : Dicotyledonae Bangsa : Myrtales Suku : Myrtaceae Marga : Eugenia
Jenis : Eugenia polyantha Wight
Sinonim : Syzygium polyanthum (Wight) Walp. 2.3.2 Morfologi tanaman salam
8
lebar 3-8 cm, pertulangan menyirip, permukaan atas licin berwarna hijau tua, permukaan bawah berwarna hijau muda. Daun bila diremas berbau harum. Bunganya, bunga majemuk tersusun dalam malai yang keluar dari ujung ranting, warnanya putih, baunya harum. Buahnya bulat, diameter 8-9 mm, warnanya bila muda hijau, setelah masak menjadi merah gelap, rasanya agak sepat. Biji bulat, warnanya coklat (Nurcahyati, 2014).
2.3.3 Kandungan senyawa aktif
Daun salam memiliki banyak kandungan senyawa aktif yang bermanfaat bagi kesehatan tubuh manusia. Beberapa kandungan senyawa aktif terbesar yang terkandung dalam tanaman salam adalah minyak atsiri, tanin, flavonoid. Bagian daun dan kulit batang mengandung saponin dan flavonoid. Selain itu, daun salam juga mengandung alkaloid dan polifenol, sedangkan kulit batangnya mengandung tanin. Senyawa aktif lainnya juga terkandung dalam tanaman salam yang sangat penting bagi kesehatan tubuh seperti vitamin A, vitamin C, zat besi, mangan, kalsium, kalium, magnesium, fitonutrien, asam caffeic, rutin, salisilat dan parthenolide (Herliana, 2013).
9 2.4 Mineral
Menurut Almatsier (2004), mineral adalah bagian dari tubuh yang memegang peranan penting dalam pemeliharaan fungsi tubuh, baik pada tingkat sel, jaringan, organ maupun fungsi tubuh secara keseluruhan. Selain itu, mineral berperan dalam berbagai tahap metabolisme, terutama sebagai kofaktor dalam aktivitas enzim-enzim (Almatsier, 2004).
Mineral digolongkan kedalam mineral makro dan mineral mikro. Mineral makro adalah mineral yang ada di dalam tubuh lebih dari 0,01% berat badan dan mineral yang dibutuhkan tubuh dalam jumlah lebih dari 100 mg/hari, sedangkan mineral mikro terdapat dalam tubuh kurang dari 0,01% berat badan dan mineral yang dibutuhkan kurang dari 100 mg/hari. Yang termasuk mineral makro adalah natrium, kalium, kalsium, fosfor, magnesium, dan sulfur. Adapun yang termasuk mineral mikro adalah besi, seng, mangan, dan tembaga (Almatsier, 2004).
2.4.1 Kalium
Kalium merupakan salah satu mineral makro yang berperan dalam pengaturan keseimbangan cairan dan elektrolit serta keseimbangan asam basa tubuh. Sebanyak 95% kalium berada di dalam cairan intraseluler. Sumber utama kalium adalah sayuran, buah dan kacang-kacangan (Almatsier, 2004).
2.4.2 Fungsi kalium
10
kalium dalam otot berhubungan dengan masa otot dan simpanan glikogen, oleh karena itu bila otot berada dalam pembentukan dibutuhkan kalium dalam jumlah cukup. Tekanan darah normal memerlukan perbandingan antara natrium dan kalium yang sesuai di dalam tubuh (Almatsier, 2004).
2.4.3 Kelebihan dan kekurangan kalium
Kelebihan kalium dapat terjadi bila konsumsi melalui saluran cerna (enteral) lebih dari 18 gram untuk orang dewasa tanpa diimbangi oleh kenaikan eksresi. Kekurangan kalium dapat terjadi karena kehilangan banyak kalium dari saluran cerna karena muntah-muntah, diare kronis. Selain itu, kehilangan melalui ginjal karena penggunaan obat-obat diuretik terutama untuk pengobatan hipertensi (Almatsier, 2004).
Kekurangan kalium dapat menyebabkan lemah, lesu, kehilangan nafsu makan, kelumpuhan, letih, konstipasi, gangguan konsentrasi, gangguan ritme jantung dan menurunkan kemampuan jantung untuk memompa darah. Kelebihan kalium dapat menyebabkan gagal jantung (Almatsier, 2004).
2.5 Spektrofotometer Serapan Atom
11
Spektrofotometri serapan atom didasarkan pada penyerapan energi sinar oleh atom-atom netral atau absorbsi cahaya oleh atom. Atom-atom akan menyerap cahaya pada panjang gelombang tertentu, tergantung pada sifat. Jika suatu larutan yang mengandung suatu garam logam (suatu senyawa logam) dihembuskan kedalam suatu nyala (asetilena yang terbakar di udara) maka terbentuk uap yang mengandung atom-atom logam itu. Atom logam bentuk gas tersebut tetap berada dalam keadaan tak tereksitasi atau dengan perkataan lain, dalam keadaan dasar. Jadi jika cahaya dengan panjang gelombang yang khas dengan logam tersebut dilewatkan nyala yang mengandung atom-atom yang bersangkutan, maka cahaya tersebut akan diserap dan jauhnya penyerapan akan berbanding lurus dengan banyaknya atom keadaan dasar yang berada dalam nyala. Garis-garis spektrum serapan atom yang timbul karena serapan sinar yang menyebabkan eksitasi atom dari keadaan azas ke salah satu tingkat energi yang lebih tinggi disebut garis-garis resonansi (resonance line). Garis-garis ini akan dibaca dalam bentuk angka oleh
Readout (Rohman, 2007).
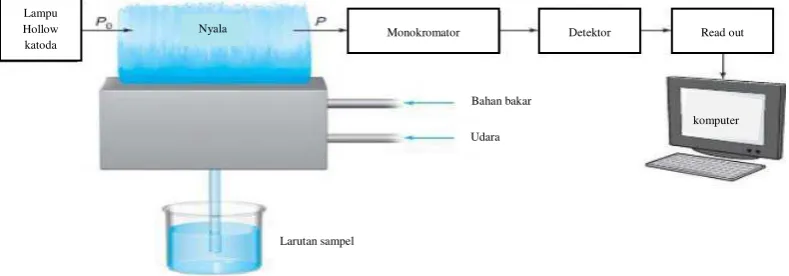
2.5.1 Instrumen spektrofotometer serapan atom
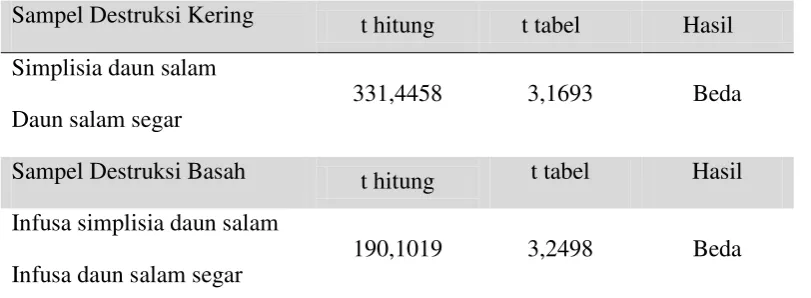
[image:28.595.115.510.588.726.2]Sistem peralatan spektrofotometer serapan atom dapat dilihat pada gambar di bawah ini:
Gambar 2.1 Sistem peralatan spektrofotometer serapan atom (Harris, 2010)
Lampu Hollow katoda
Monokromator Detektor Read out
komputer Bahan bakar
Udara
12
Menurut Rohman (2007), komponen penyusun dari sistem peralatan spektrofotometer serapan atom adalah sebagai berikut:
a. Sumber sinar yang lazim dipakai adalah lampu katoda berongga (hollow catodhe lamp). Lampu ini terdiri atas tabung kaca tertutup yang mengandung suatu katoda dan anoda. Katoda sendiri berbentuk silinder berongga yang terbuat dari logam atau dilapisi dengan logam tertentu.
b. Tempat sampel yang akan dianalisis harus diuraikan menjadi atom-atom netral yang masih dalam keadaan dasar.
c. Nyala digunakan untuk mengubah sampel yang berupa padatan atau cairan menjadi bentuk uap atomnya, dan juga berfungsi untuk atomisasi, mengeksitasikan atom dari tingkat dasar ke tingkat yang lebih tinggi.
d. Monokromator digunakan untuk memisahkan dan memilih panjang gelombang yang digunakan untuk analisis.
e. Detektor digunakan untuk mengukur intensitas cahaya yang melalui tempat pengatoman.
f. Read out merupakan suatu sistem pencatatan hasil yang berupa hasil pembacaan. Hasil pembacaan dapat berupa angka atau kurva.
2.5.2 Gangguan-gangguan pada spektrofotometri serapan atom
Gangguan-gangguan pada Spektrofotometri Serapan Atom adalah peristiwa-peristiwa yang menyebabkan pembacaan absorbansi unsur yang dianalisis menjadi lebih kecil atau lebih besar dari nilai yang sesuai dengan konsentrasinya dalam sampel (Rohman, 2007).
13
a. Gangguan yang berasal dari matriks sampel yang dapat mempengaruhi banyaknya sampel yang mencapai nyala.
Sifat-sifat tertentu matriks sampel dapat mengganggu analisis yakni matriks tersebut dapat berpengaruh terhadap laju aliran bahan bakar gas pengoksidasi. Sifat-sifat tersebut adalah viskositas, tegangan permukaan, berat jenis dan tekanan uap. Gangguan matriks yang lain adalah pengendapan unsur yang dianalisis sehingga jumlah atom yang mencapai nyala menjadi lebih sedikit dari konsentrasi yang seharusnya yang terdapat dalam sampel (Rohman, 2007). b. Gangguan kimia yang dapat mempengaruhi jumlah/banyaknya atom yang
terjadi di dalam nyala.
Terbentuknya atom-atom netral yang masih dalam keadaan dasar di dalam nyala sering terganggu oleh dua peristiwa kimia seperti disosiasi senyawa-senyawa yang tidak sempurna dan ionisasi atom-atom di dalam nyala. Terjadi disosiasi yang tidak sempurna disebabkam oleh terbentuknya senyawa-senyawa yang bersifat refraktorik (sukar diuraiakan di dalam nyala api). Contoh senyawa refraktorik adalah garam-garam fosfat, silikat, aluminat dari logam alkali tanah. Ionisasi atom-atom di dalam nyala dapat terjadi jika suhu yang digunakan untuk atomisasi terlalu tinggi. Prinsip analisis dengan Spektrofotometri Serapan Atom adalah mengukur absorbansi atom-atom netral yang berada dalam keadaan dasar. Jika terbentuk ion maka akan mengganggu pengukuan absorbansi atom netral karena atom-atom yang mengalami ionisasi tidak sama spektrum atom dalam keadaan netral (Rohman, 2007).
c. Gangguan oleh absorbansi
14
yakni absorbansi oleh molekul-molekul yang tidak terionisasi di dalam nyala. (Rohman, 2007).
Adanya gangguan-gangguan di atas dapat diatasi dengan menggunakan cara-cara seperti penggunaan nyala atau suhu atomisasi yang tinggi, penambahan senyawa penyangga, pengekstraksian unsur yang akan di analisis dan pengekstraksian ion atau gugus pengganggu (Rohman, 2007).
d. Gangguan oleh penyerapan non-atomik (non atomic absorption).
Gangguan jenis ini berarti terjadinya penyerapan cahaya dari sumber sinar yang bukan berasal dari atom-atom yang akan dianalisis. Penyerapan non atomik dapat disebabkan oleh adanya penyerapan cahaya oleh partikel-partikel padat yang berada di dalam nyala. Cara mengatasi gangguan penyerapan non atomik ini adalah dengan bekerja pada panjang gelombang yang lebih besar atau pada sushu yang lebih tinggi. Jikan kedua cara ini belum bisa membantu menghilangkan gangguan ini, maka cara yang dapat dilakukan dengan mengukur besarnya penyerapan non atomik menggunakan sumber sinar yang memberikan spektrum kontinyu (Rohman, 2007).
2.6 Validasi Metode Analisis
Menurut Harmita (2004), validasi metode analisis adalah suatu tindakan penilaian terhadap parameter tertentu berdasarkan percobaan laboratorium untuk membuktikan bahwa parameter tersebut memenuhi persyaratan untuk penggunaannya.
15 a. Kecermatan
Kecermatan adalah ukuran yang menunjukkan derajat kedekatan hasil analisis dengan kadar analit yang sebenarnya. Kecermatan dinyatakan sebagai persen perolehan kembali (recovery) analit yang ditambahkan. Kecermatan ditentukan dengan metode simulasi (spiked-placebo recovery) yang merupakan metode dilakukan dengan cara menambahkan sejumlah analit bahan murni ke dalam suatu bahan pembawa sediaan farmasi (placebo), campuran tersebut dianalisis dan hasilnya dibandingkan dengan kadar analit yang ditambahkan (kadar yang sebenarnya). Selain itu, dapat juga dilakukan dengan metode penambahan baku (standard addition method) yang merupakan metode dilakukan dengan cara menambahkan sejumlah analit dengan konsentrasi tertentu pada sampel yang diperiksa, lalu dianalisis dengan metode yang akan divalidasi. Hasilnya dibandingkan dengan sampel yang dianalisis tanpa penambahan sejumlah analit. Persen perolehan kembali ditentukan dengan menentukan berapa persen analit yang ditambahkan ke dalam sampel dapat ditemukan kembali (Harmita, 2004).
b. Keseksamaan (presisi)
Keseksamaan atau presisi diukur sebagai simpangan baku relatif atau koefisien variasi. Keseksamaan atau presisi merupakan ukuran yang menunjukkan derajat kesesuaian antara hasil uji individual ketika suatu metode dilakukan secara berulang untuk sampel yang homogen (Harmita, 2004).
c. Selektivitas (Spesifisitas)
16
komponen lain yang ada di dalam sampel (Harmita, 2004). d. Linearitas dan rentang
Linearitas adalah kemampuan metode analisis yang memberikan respon baik secara langsung maupun dengan bantuan transformasi matematika, menghasilkan suatu hubungan yang proporsional terhadap konsentrasi analit dalam sampel. Rentang merupakan batas terendah dan batas tertinggi analit yang dapat ditetapkan secara cermat, seksama dan dalam linearias yang dapat diterima (Harmita, 2004).
17 BAB III
METODE PENELITIAN
Metode yang digunakan dalam penelitian ini adalah Metode Deskriptif dengan percobaan di laboratorium. Bertujuan untuk mengetahui kandungan dan perbedaan kandungan mineral kalium dari daun salam segar, simplisia daun salam, infusa daun salam dan infusa simplisia daun salam yang diperoleh dari Kelurahan Sidomulyo, Kecamatan Medan Tuntungan, Kota Medan, Sumatera Utara.
3.1 Tempat dan Waktu Penelitian
Penelitian dilakukan di laboratorium Fitokimia, laboratorium Kimia Kualitatif, laboratorium Farmasetika Dasar dan laboratorium Penelitian Fakultas Farmasi USU Medan pada bulan November 2014 - Februari 2015.
3.2 Alat dan Bahan 3.2.1 Alat
18 3.2.2 Bahan
Sampel yang digunakan dalam penelitian ini adalah daun salam (Eugenia polyantha Wight) diperoleh dari daerah Kelurahan Sidomulyo, Kecamatan Medan Tuntungan, Kota Medan, Sumatera Utara.
Bahan kimia yang digunakan dalam penelitian ini berkualitas pro analisis produksi E-Merck antara lain toluena, kloroform, asam nitrat 65% v/v dan larutan baku kalium 1000 µg/ml. Bahan kimia lainnya yang digunakan dalam penelitian ini berkualitas teknis yaitu alkohol 96%, asam pikrat 1 % b/v, air suling dan air demineral.
3.3 Pembuatan Pereaksi
3.3.1 Larutan asam nitrat (1:1) v/v
Sebanyak 250 ml larutan asam nitrat65% v/v diencerkan dengan 250 ml air demineral (Isaac, 1988).
3.3.2 Larutan asam pikrat 1 % b/v
Sebanyak 1 g asam pikrat dilarutkan dalam air suling hingga 100 ml (Ditjen POM, 1995).
3.4 Prosedur Penelitian
3.4.1 Metode pengambilan sampel
19
sebagai sampling pertimbangan dimana sampel ditentukan atas pertimbangan bahwa populasi sampel adalah homogen dan sampel yang tidak diambil mempunyai karakteristik yang sama dengan sampel yang sedang diteliti (Sudjana, 2005).
3.4.2 Identifikasi sampel
Identifikasi daun salam (Eugenia polyantha Wight) dilakukan di Pusat Penelitian dan Pengembangan Biologi LIPI, Bogor.
3.4.3 Pembuatan simplisia
Bahan tumbuhan yang digunakan pada penelitian ini adalah daun salam yang masih segar. Daun salam dipisahkan dari pengotor lain lalu dicuci hingga bersih kemudian ditiriskan dan ditimbang. Diperoleh berat basah daun salam 5 kg. Selanjutnya daun salam dikeringkan dalam lemari pengering dengan temperatur 40°C. Simplisia yang telah kering ditimbang dan diperoleh berat kering daun salam 1,8 kg. Simplisia kemudian dihaluskan dengan cara diblender.
3.4.4 Penyiapan sampel daun salam segar
Daun salam segar dipisahkan dari pengotor lain, dicuci hingga bersih dengan air yang mengalir, dibilas dengan air demineral, ditiriskan dan dikeringkan dengan cara dianginkan. Daun salam segar kemudian dihaluskan dengan cara diblender.
3.4.5 Penyiapan sampel infusa
20 3.5 Pemeriksaan Karakteristik Simplisia
Pemeriksaan karakteristik simplisia meliputi pemeriksaan penetapan kadar air, penetapan kadar sari larut dalam air, penetapan kadar sari larut dalam etanol, penetapan kadar abu total, penetapan kadar abu tidak larut dalam asam (Depkes RI, 1995).
3.5.1 Penetapan kadar air
Pada labu bulat dimasukkan 200 ml toluena dan 2 ml air suling, didestilasi selama 2 jam. Destilasi dihentikan dan dibiarkan dingin selama 30 menit, kemudian volume air di dalam tabung penerima dibaca dengan ketelitian 0,1 ml. Kemudian ke dalam labu yang berisi toluena jenuh tersebut dimasukan 5 gram serbuk simplisia yang telah ditimbang saksama, lalu dipanaskan hati-hati selama 15 menit. Setelah toluena mulai mendidih, kecepatan tetesan diatur lebih kurang 2 tetes per detik hingga sebagian air tersuling. Kemudian kecepatan dinaikkan hingga 4 tetes per detik. Kemudian setelah semua air tersuling, bagian dalam pendingin dibilas dengan toluena. Destilasi dilanjutkan selama 5 menit, kemudian tabung penerima dibiarkan mendingin sampai suhu kamar. Setelah air dan toluena memisah sempurna, volume air dibaca dengan ketelitian 0,1 ml. Selisih kedua volume air yang dibaca sesuai dengan kandungan air yang terdapat dalam bahan yang diperiksa. Kadar air dihitung dalam persen (Depkes RI, 1995).
3.5.2 Penetapan kadar sari yang larut dalam air
21
kering dalam cawan penguap berdasar rata yang telah dipanaskan dan ditara. Sisa dipanaskan pada suhu 105˚C sampai bobot tetap. Kadar dalam persen sari yang larut dalam air dihitung terhadap bahan yang telah dikeringkan (Depkes RI, 1995).
3.5.3 Penetapan kadar sari yang larut dalam etanol
Sebanyak 5 gram serbuk simplisia, dimaserasi selama 24 jam dalam 100 ml etanol 95% dalam labu tersumbat sambil sesekali dikocok selama 6 jam pertama, kemudian dibiarkan selama 18 jam. Kemudian disaring cepat untuk menghindari penguapan etanol. Sejumlah 20 ml filtrat pertama diuapkan sampai kering dalam cawan penguap berdasar rata yang telah dipanaskan dan ditara. Sisa dipanaskan pada suhu 105˚C sampai diperoleh bobot konstan. Kadar sari yang larut dalam etanol 95% dihitung terhadap bahan yang telah dikeringkan (Depkes RI, 1995).
3.5.4 Penetapan kadar abu total
Sebanyak 2 gram sampai 3 gram zat yang telah digerus dan ditimbang seksama dimasukkan dalam krus porselin yang telah dipijar dan ditara, kemudian diratakan. Krus dipijarkan perlahan-lahan hingga arang habis, pijaran dilakukan pada suhu 600˚C kemudian didinginkan dan ditimbang sampai diperoleh bobot tetap. Kadar abu total dihitung terhadap bahan yang telah dikeringkan (Depkes RI, 1995).
3.5.5 Penetapan kadar abu tidak larut dalam asam
22
didinginkan dan ditimbang. Kadar abu yang tidak larut dalam asam dihitung terhadap bahan yang dikeringkan (Depkes RI, 1995).
3.6 Prosedur Penelitian
3.6.1 Destruksi kering sampel
Ditimbang saksama masing-masing sampel yang telah diblender sebanyak ± 10 gram, dimasukkan ke dalam krus porselen, diarangkan di atas hot plate, diabukan dalam tanur dengan temperatur awal 100ºC dan secara perlahan suhu dinaikkan menjadi 500ºC dengan interval 25ºC setiap 5 menit. Pengabuan dilakukan selama 45 jam (dihitung saat suhu 500 ºC), kemudian suhu diturunkan, setelah suhu tanur ± 27ºC, krus porselen dikeluarkan dan dibiarkan hingga dingin pada desikator. Abu dibasahi dengan 10 tetes asam nitrat (1:1), kemudian diuapkan pada hot plate sampai kering. Krus porselen dimasukkan kembali ke dalam tanur dan diabukan dengan temperatur awal 100ºC dan perlahan temperatur dinaikkan hingga suhu 500 ºC dengan interval 25ºC setiap 5 menit selama 1 jam dan dibiarkan hingga dingin dalam desikator (Isaac, 1988).
3.6.2 Pembuatan larutan sampel
23
Larutan ini digunakan untuk analisis kualitatif dan kuantitatif terhadap mineral kalium yang terkandung di dalamnya.
3.6.3 Pembuatan infusa
Ditimbang masing-masing 10 gram sampel, dimasukkan ke dalam panci infus dan ditambahkan 100 ml air demineral. Dipanaskan dalam penangas air selama 15 menit terhitung mulai suhu mencapai 90˚C sambil sekali -sekali diaduk, serkai selagi panas melalui kain flanel, ditambahkan air demineral secukupnya melalui ampas hingga diperoleh volume infusa 100 ml dan disaring dengan kertas saring Whatman no.42 dimana 5 ml filtrat pertama dibuang untuk menjenuhkan kertas saring kemudian filtrat selanjutnya ditampung ke dalam botol (Ditjen POM, 1995).
3.6.4 Destruksi basah pada infusa
Hasil infusa dimasukkan kedalam erlenmeyer, ditambahkan 10 ml asam nitrat 65% v/v (Bader, 2011). Didiamkan selama 24 jam, dan kemudian dipanaskan pada suhu 80˚C selama ± 2 jam hingga diperoleh larutan bening. Selanjutnya disaring dengan kertas saring Whatman no.42 dimana sebanyak 5 ml filtrat pertama dibuang untuk menjenuhkan kertas saring, filtrat selanjutnya ditampung ke dalam botol (Setyaningrum dan Sukesi, 2013).
3.7 Analisis Kualitatif Kalium
3.7.1 Uji dengan reaksi nyala
24 3.7.2 Uji kristal dengan asam pikrat 1% b/v
Larutan zat ditambahkan larutan asam pikrat 1% b/v menghasilkan endapan kuning, dibiarkan 5 menit pada object glass, kemudian diamati dibawah mikroskop. Jika terdapat kalium, akan terbentuk jarum–jarum panjang (Masfria, dkk., 2013).
3.8 Analisis Kuantitatif Kalium
3.8.1 Pembuatan kurva kalibrasi kalium
Larutan baku kalium (1000 µg/ml) sebanyak 1,0 ml dimasukan ke dalam labu tentukur 50 ml lalu dicukupkan hingga garis tanda dengan air demineral. Diperoleh konsentrasi 20 µg/ml kemudian dipipet masing-masing 2,5 ml; 5,0 ml; 7,5 ml; 10,0 ml; dan 12,5 ml, dimasukkan ke dalam labu tentukur 50 ml dan dicukupkan hingga garis tanda dengan air demineral sehingga diperoleh larutan dengan konsentrasi 1,0 µg/ml; 2,0 µg/ml; 3,0 µg/ml; 4,0 µg/ml; 5,0 µg/ml dan diukur absorbansi pada panjang gelombang 766,5 nm dengan tipe nyala udara-asetilen.
3.8.2 Penetapan kadar kalium
25
kalium dalam sampel ditentukan berdasarkan persamaan garis regresi dari kurva kalibrasi.
Menurut Rohman (2007), kadar kalium dalam sampel dapat dihitung dengan cara sebagai berikut:
Kadar Mineral (µg/g) =
Konsentrasi
(
μg ml⁄
)
× Volume(
ml)
× Faktor PengenceranBerat Sampel (g)
3.9 Analisis Data Secara Statistik 3.9.1 Penolakan hasil pengamatan
Kadar kalium yang diperoleh dari hasil pengukuran masing-masing larutan sampel dianalisis secara statistik. Menurut Sudjana (2005), standar deviasi dapat dihitung dengan menggunakan rumus:
SD =
�
∑(Xi-X)2
n-1
Keterangan: Xi = Kadar sampel
X = Kadar rata-rata sampel n = Jumlah pengulangan Untuk mencari t hitung digunakan rumus:
t hitung =
26
Untuk menghitung kadar mineral di dalam sampel dengan interval kepercayaan 99%, dk = n-1, dapat digunakan rumus:
µ = X ± (tα/2, dk) x SD / √n)
Keterangan: X = Kadar rata-rata sampel Xi = Kadar sampel
SD = Standar Deviasi
dk = Derajat kebebasan (dk = n-1) α = Interval kepercayaan
n = Jumlah pengulangan
3.9.2 Pengujian beda nilai rata-rata antar sampel
Menurut Sudjana (2005), sampel yang dibandingkan secara independen diambil dari populasi. Variansi (σ) tidak diketahui sehingga dilakukan uji F untuk
mengetahui apakah variansi kedua populasi sama (σ1 = σ2) atau berbeda (σ1 ≠ σ2)
dengan menggunakan rumus di bawah ini:
Fo = 2 2 2 1 S S
Keterangan: Fo = Beda nilai yang dihitung S1 = Standar deviasi terbesar S2 = Standar deviasi terkecil
27 (X1 – X2) to =
Sp √1/n1 + 1/n2
Keterangan: X1 = Kadar rata-rata sampel 1 X2 = Kadar rata-rata sampel 2 n1 = Jumlah pengulangan sampel 1 n2 = Jumlah pengulangan sampel 2
Sp = Simpangan baku
Jika F0 melewati nilai kritis F, dilanjutkan uji dengan distribusi t dengan rumus:
(X1 – X2) to =
√S12/n1 + S22/n2
Keterangan: X1 = Kadar rata-rata sampel 1 X2 = Kadar rata-rata sampel 2 S1 = Standar deviasi sampel 1 S2 = Standar deviasi sampel 2
n1 = Jumlah pengulangan sampel 1 n2 = Jumlah pengulangan sampel 2
28 3.10 Validasi Metode Analisis
3.10.1 Uji perolehan kembali (recovery)
Uji perolehan kembali (recovery) dilakukan dengan metode penambahan larutan baku (standard addition method). Dalam metode ini, kadar mineral dalam sampel ditentukan terlebih dahulu, selanjutnya dilakukan penentuan kadar mineral dalam sampel setelah penambahan larutan baku dengan konsentrasi tertentu (Ermer dan McB. Miller, 2005).
Sampel yang telah diblender kemudian ditimbang secara seksama sebanyak 10 gram, lalu ditambahkan 3,5 ml larutan larutan baku kalium (konsentrasi 1000 µg/ml), dan kemudian dilanjutkan dengan prosedur destruksi kering seperti yang telah dilakukan sebelumnya.
Menurut Harmita (2004), persen perolehan kembali dapat dihitung dengan rumus di bawah ini:
% Perolehan Kembali = 100% *
C C -C
A A F
×
Keterangan: CA = Kadar logam dalam sampel sebelum penambahan baku CF = Kadar logam dalam sampel setelah penambahan baku C*A = Kadar larutan baku yang ditambahkan
3.10.2 Simpangan baku relatif
29
homogen. Nilai simpangan baku relatif yang memenuhi persyaratan menunjukkan adanya keseksamaan metode yang dilakukan.
Menurut Harmita (2004), rumus untuk menghitung simpangan baku relatif adalah:
RSD = SD
X x 100%
Keterangan: X = Kadar rata-rata sampel SD = Standar Deviasi
RSD = Relative Standard Deviation
3.10.3 Penentuan batas deteksi dan batas kuantitasi
Batas deteksi merupakan jumlah terkecil analit dalam sampel yang dapat dideteksi yang masih memberikan respon signifikan. Sedangkan batas kuantitasi merupakan kuantitas terkecil analit dalam sampel yang masih dapat memenuhi kriteria cermat dan seksama (Harmita, 2004).
Menurut Harmita (2004), batas deteksi dan batas kuantitasi ini dapat dihitung dengan rumus sebagai berikut:
Simpangan Baku (SY X� ) =
�
∑(Y-Yi) 2n-2
Deteksi (LOD) = 3 x SY X�
slope
Batas kuantitasi (LOQ) = 10 x SY X�
30 BAB IV
HASIL DAN PEMBAHASAN
4.1 Identifikasi Sampel
Hasil identifikasi sampel dilakukan oleh bagian Herbarium Bogoriense Bidang Botani Pusat Penelitian Biologi LIPI-Bogor terhadap daun salam adalah
Eugenia polyantha Wight sinonim Syzygium polyanthum (Wight) Walp. suku
Myrtaceae. Hasil identifikasi sampel dapat dilihat pada Lampiran 1, halaman 41.
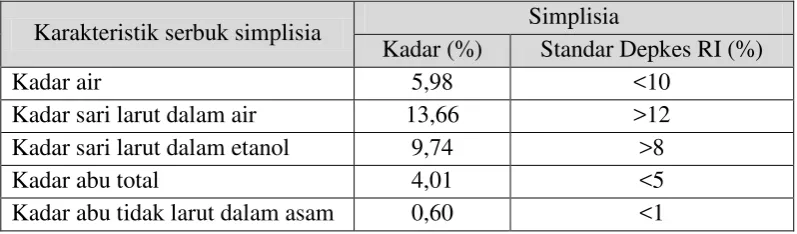
4.2Pemeriksaan Karakteristik Simplisia
[image:47.595.113.512.540.657.2]Pemeriksaan karakteristik simplisia meliputi pemeriksaan penetapan kadar air, penetapan kadar sari larut dalam air, penetapan kadar sari larut dalam etanol, penetapan kadar abu total, penetapan kadar abu tidak larut dalam asam. Hasil pemeriksaan karakterisasi serbuk simplisia daun salam dapat dilihat pada Tabel 4.1 dan perhitungannya dapat dilihat pada Lampiran 11 sampai Lampiran 15, halaman 51-55.
Tabel 4.1 Hasil karakterisasi serbuk simplisia daun salam Karakteristik serbuk simplisia Simplisia
Kadar (%) Standar Depkes RI (%)
Kadar air 5,98 <10
Kadar sari larut dalam air 13,66 >12
Kadar sari larut dalam etanol 9,74 >8
Kadar abu total 4,01 <5
Kadar abu tidak larut dalam asam 0,60 <1
31
dilakukan untuk memberikan batasan minimal atau rentang tentang besarnya kandungan air dalam simplisia karena tingginya kandungan air menyebabkan bakteri dan jamur cepat tumbuh dan bahan aktif yang terkandung didalamnya dapat terurai.
Penetapan kadar sari yang larut dalam air dan etanol dilakukan untuk mengetahui jumlah senyawa yang dapat tersari dalam air dan dalam etanol dari suatu simplisia. Senyawa yang bersifat polar dan larut dalam air akan tersari oleh air. Sedangkan senyawa-senyawa yang tidak larut dalam air dan larut dalam etanol akan tersari oleh etanol. Hasil penetapan kadar sari larut air simplisia daun salam adalah 13,66%. Kadar sari larut etanol dari simplisia daun salam adalah 9,74%. Kadar ini memenuhi syarat yang terdapat pada Materia Medika Indonesia (Depkes RI, 1980).
32
telah dilakukan memenuhi persyaratan yang terdapat dalam Materia Medika Indonesia (Depkes RI, 1980).
4.3 Analisis Kualitatif
[image:49.595.113.513.255.347.2]Analisis kualitatif dilakukan sebagai analisis pendahuluan untuk mengetahui ada atau tidaknya mineral kalium sampel. Data dapat dilihat pada Tabel 4.2 dan Lampiran 3 , halaman 43.
Tabel 4.2 Hasil analisis kualitatif dalam sampel daun salam yang telah didestruksi
Ion Pereaksi Hasil Reaksi Hasil
K Uji Nyala Warna ungu +
Asam pikrat 1% b/v Kristal jarum panjang + Keterangan : + = Mengandung ion
Pada Tabel 4.2 menunjukkan bahwa larutan sampel yang diperiksa mengandung ion kalium. Sampel positif mengandung ion kalium karena menghasilkan kristal jarum panjang kalium pikrat dengan penambahan asam pikrat 1% b/v sesuai dengan literatur (Masfria, dkk., 2013). Pada uji nyala menghasilkan nyala warna ungu pada kawat Ni/Cr yang dipijarkan pada nyala api sesuai dengan literatur (Vogel, 1990).
4.4 Analisis Kuantitatif
4.4.1 Kurva kalibrasi kalium
33
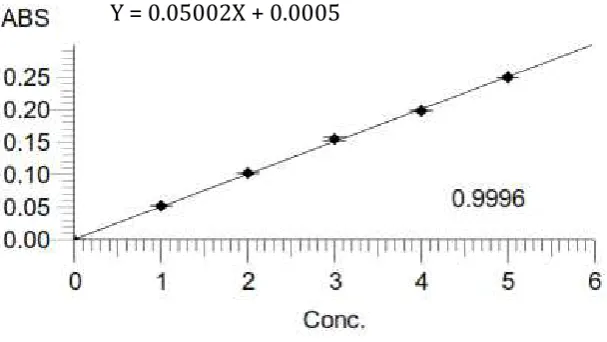
Gambar 4.1 Kurva kalibrasi kalium
Berdasarkan kurva di atas diperoleh hubungan yang linier antara konsentrasi dengan serapan, dengan koefisien korelasi (r) kalium 0,9996. Nilai ini menunjukkan adanya korelasi linier yang menyatakan adanya hubungan antara X (konsentrasi) dan Y (serapan). Data hasil pengukuran serapan larutan baku kalium dan perhitungan persamaan garis regresi dapat dilihat pada Lampiran 16, halaman 56-57.
4.4.2 Pengukuran kadar kalium dalam sampel
Pada pengukuran sampel yang dilakukan secara spektrofotometri serapan atom, terlebih dahulu dikondisikan alat dengan baik dan benar. Setelah itu, dilakukan pengenceran terhadap sampel. Pengenceran yang dilakukan yaitu 500 kali (50/0,1) untuk kalium. Selain itu, karena sampel memiliki kadar mineral yang cukup tinggi sehingga untuk memperoleh nilai serapan yang berada dalam rentang kalibrasi maka sampel harus diencerkan. Konsentrasi kalium dalam sampel ditentukan berdasarkan persamaan garis regresi kurva kalibrasi larutan baku
34
kalium. Data dan contoh perhitungan dapat dilihat pada Lampiran 17 sampai dengan Lampiran 18, halaman 58-79.
[image:51.595.112.502.237.391.2]Analisis dilanjutkan dengan perhitungan statistik (Perhitungan dapat dilihat pada Lampiran 19, halaman 71-79. Hasil analisis kuantitatif mineral kalium pada sampel dapat dilihat pada Tabel 4.3 berikut ini:
Tabel 4.3 Hasil analisis kadar kalium dalam sampel
Sampel Destruksi Kering Kadar Kalium (mg/100g)
Simplisia daun salam 930,5100 ± 6,8009
Daun salam segar 328,0410 ± 2,7313
Sampel Destruksi Basah Kadar Kalium (µg/ml) Infusa simplisia daun salam 1219,3333 ± 11,7515 Infusa daun salam segar 537,9700 ± 7,1442
Data yang didapat kemudian dihitung berapa besar persentase perbedaan kadar dari mineral pada sampel yaitu penurunan kadar kalium pada daun salam. Perhitungan dapat dilihat pada Lampiran 20, halaman 80.
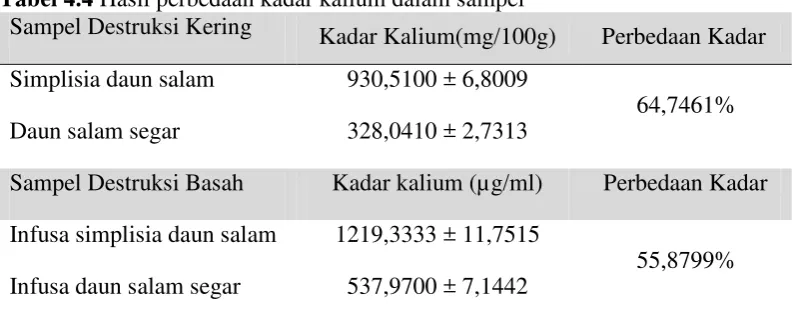
Tabel 4.4 Hasil perbedaan kadar kalium dalam sampel
Sampel Destruksi Kering Kadar Kalium(mg/100g) Perbedaan Kadar Simplisia daun salam 930,5100 ± 6,8009
64,7461% Daun salam segar 328,0410 ± 2,7313
Sampel Destruksi Basah Kadar kalium (µg/ml) Perbedaan Kadar Infusa simplisia daun salam 1219,3333 ± 11,7515
55,8799% Infusa daun salam segar 537,9700 ± 7,1442
[image:51.595.114.511.501.658.2]35
[image:52.595.113.519.211.360.2]dapat diketahui bahwa kadar kalium pada simplisia daun salam lebih besar dibandingkan kadar kalium di dalam infusa simplisia daun salam pada, serta kadar kalium pada daun salam segar lebih besar dibandingkan kadar kalium di dalam daun salam segar.
Tabel 4.5 Hasil uji beda nilai rata-rata kadar kalium antar sampel
Sampel Destruksi Kering t hitung t tabel Hasil Simplisia daun salam
331,4458 3,1693 Beda
Daun salam segar
Sampel Destruksi Basah t hitung t tabel Hasil Infusa simplisia daun salam
190,1019 3,2498 Beda
Infusa daun salam segar
36 4.4.3 Uji perolehan kembali (recovery)
Hasil uji perolehan kembali (recovery) kadar kalium setelah penambahan masing-masing larutan baku dapat dilihat pada Lampiran 22, halaman 85. Contoh perhitungannya pada Lampiran 23, halaman 86-91.
Persen perolehan kembali (recovery) kadar mineral kalium dalam sampel dapat dilihat pada Tabel 4.6.
Tabel 4.6 Persen uji perolehan kembali (recovery)kadar kalium dalam sampel Mineral Persen Perolehan Kembali (%) Syarat rentang persen recovery (%)
Kalium 93,1124% 80 – 120
Berdasarkan Tabel 4.6 di atas, dapat dilihat bahwa rata-rata hasil uji perolehan kembali (recovery) kalium adalah 93,1124%. Persen perolehan kembali (recovery) tersebut menunjukkan kecermatan kerja yang memuaskan pada saat pemeriksaan kadar kalium dalam sampel. Hasil yang diperoleh dari uji perolehan kembali memberikan ketepatan pada pemeriksaan kadar mineral dalam sampel. Menurut Ermer dan McB. Miller (2005), suatu metode dikatakan teliti jika nilai perolehan kembalinya antara 80-120%.
4.4.4 Simpangan baku relatif
[image:53.595.113.511.647.709.2]Nilai simpangan baku dan simpangan baku relatif untuk kalium pada sampel dapat dilihat pada Tabel 4.7 sedangkan perhitungannya dapat dilihat pada Lampiran 24, halaman 92.
Tabel 4.7 Nilai simpangan baku dan simpangan baku relatif kalium dalam sampel Mineral Simpangan Baku Simpangan Baku Relatif
37
Berdasarkan Tabel 4.7 di atas, dapat dilihat nilai simpangan baku (SD) untuk mineral kalium 5,2919 sedangkan nilai simpangan baku relatif (RSD) yang diperoleh sebesar 5,6833% untuk mineral kalium.
Menurut Harmita (2004), nilai simpangan baku relatif (RSD) untuk analit dengan kadar part per million (ppm) adalah tidak lebih dari 16% dan untuk analit dengan kadar part per billion (ppb) adalah tidak lebih dari 32%. Dari hasil yang diperoleh menunjukkan bahwa metode yang dilakukan memiliki presisi yang baik. 4.4.5 Batas deteksi dan batas kuantitasi
[image:54.595.115.509.402.451.2]Berdasarkan data kurva kalibrasi kalium diperoleh batas deteksi dan batas kuantitasi untuk mineral tersebut. Batas deteksi dan batas kuantitasi kalium dapat dilihat pada Tabel 4.8 berikut ini:
Tabel 4.8 Batas deteksi dan batas kuantitasi kalium
Mineral Batas Deteksi (µg/ml) Batas Kuantitasi (µg/ml)
Kalium 0,1859 0,6197
38 BAB V
KESIMPULAN DAN SARAN
5.1 Kesimpulan
a. Hasil penetapan kadar kalium secara spektrofotometri serapan atom menunjukkan adanya perbedaan kadar kalium pada simplisia daun salam, daun salam segar, infusa simplisia daun salam dan infusa daun salam segar. Hasil penelitian ini menunjukkan kadar kalium pada pada simplisia daun salam sebesar (930,5100 ± 6,8009) mg/100g; daun salam segar sebesar (328,0410 ± 2,7313) mg/100g; pada infusa simplisia daun salam sebesar (1219,3333 ± 11,7515) µg/ml dan pada infusa daun salam segar sebesar (537,9700 ± 7,1442) µg/ml.
b. Persentase perbedaan kadar kalium antara simplisia daun salam dengan daun salam segar adalah 64,7461% dan antara infusa simplisia daun salam dengan infusa daun salam segar adalah 55,8799%.
5.2 Saran
39
DAFTAR PUSTAKA
Almatsier, S. (2004). Prinsip Dasar Ilmu Gizi. Cetakan Keempat. Jakarta: PT. Gramedia Pustaka Utama. Halaman 228, 233, 234, 235, 249.
Anonim. (2000). Inventaris Tanaman Obat Indonesia (I). Jilid Kesatu. Jakarta: Departemen Kesahatan & Kesejahteraan Sosial RI, Badan Penelitian dan Pengembangan Kesehatan. Halaman 105.
Anonim. (2015). Salam (tumbuhan). Diakses: 3 Juni 2015. Bader, N. R. (2011). Sample Preparation For Flame Atomic Absorption
Spectroscopy: An Overview. Rasayan Journal Chemistry. 4(1): 51.
Depkes RI. (1980). Materia Medika Indonesia. Jilid Keempat. Jakarta: Departemen Kesehatan RI. Halaman 111,112,113.
Depkes RI. (1995). Materia Medika Indonesia. Jilid Keenam. Jakarta: Departemen Kesehatan RI. Halaman x, xi, 321,322, 323, 324, 325 .
Ditjen POM. (1995). Farmakope Indonesia. Edisi Keempat. Jakarta: Departemen Kesehatan RI. Halaman 9, 1203.
Ermer, J., dan McB. Miller. J. H. (2005). Method Validation in Pharmaceutical Analysis. Weinheim: Wiley-Vch Verlag GmbH & Co. KGaA. Halaman 171.
Harmita. (2004). Petunjuk Pelaksanaan Validasi Metode dan Cara Perhitungannya. Review Artikel. Majalah Ilmu Kefarmasian. 1(3): 117, 118, 119, 121,122, 127, 128, 130,131.
Harris, D. C. (2010). Quantitative Chemical Analysis. Eighth Edition. New York: W. H. Freeman and Company. Halaman 481.
Herliana, E. (2013). Diabetes Kandas Berkat Herbal. Jakarta: F Media. Halaman 55.
Isaac, R. A. (1988). Metals in Plants. Dalam: Helrich, K. (1990). Official Methods of the Association of Official Analytical Chemist. Fifteenth Edition. Virginia: AOAC International. Halaman 42.
40
Nurcahyati, E. (2014). Khasiat Dahsyat Daun Salam. Jakarta: Jendela Sehat. Halaman 8,15, 16, 18.
Rohman, A. (2007). Kimia Farmasi Analisis. Cetakan Kesatu. Yogyakarta: PustakaPelajar. Halaman 298, 299,302, 305-312, 314, 318-32.
Setyaningrum, A., dan Sukesi. (2013). Preparasi Penentuan Ca. Na, dan K dalam Nugget Ayam-Rumput Laut (Eucheuma cottonii). Jurnal Sains dan Seni Pomits. 2(1): 3.
Sudjana. (2005). Metode Statistika. Edisi Keenam. Bandung: Tarsito. Halaman 93, 168, 193, 202, 249.
Syukur, C., dan Hernani. (2001). Budi Daya Tanaman Obat Komersial. Jakarta: Penebar Swadaya. Halaman 1.
Tan, H.T., dan Rahardja, K. (2008). Obat-Obat Penting: Khasiat, Penggunaan, dan Efek-Efek Sampingnya. Edisi Keenam. Jakarta: PT. Elex Media Komputindo. Halaman: 870.
United States Department of Agriculture America. (2014). Nutrient Database for Standard Reference Release 27 Basic Report 02004, Spices, bay leaf. Diakses: 10 Agustus 2014. http://ndb.nal.usda.gov/ndb/foods/show/235. Utami, P., dan Puspaningtyas, D. E. (2013). The Miracle Of Herbs. Jakarta: Agro
Media Pustaka. Halama 61, 62.
42 Lampiran 2. Gambar sampel
a. Tanaman salam (Eugenia polyantha Wight)
43
Lampiran 3. Hasil analisis kualitatif kalium pada daun salam
Kristal kalium pikrat (perbesaran 10 x 10)
44 Lampiran 4. Bagan alir pembuatan simplisia
Daun salam
Simplisia
Karakteristik simplisia Destruksi kering
Penetapan : - Kadar air
- Kadar sari larut dalam air - Kadar sari larut dalam etanol - Kadar abu total
- Kadar abu tidak larut dalam asam
Dicuci dari pengotor hingga bersih Ditiriskan
Ditimbang
Dikeringkan di lemari pengering Ditimbang
Serbuk simplisia
45
Lampiran 5. Bagan alir proses destruksi kering daun salam segar
Sampel
Ditimbang 10 gram di dalam krus porselen Diarangkan di atas hot plate 6 jam
Diabukan dalam tanur dengan temperatur awal 100oC dan perlahan temperatur dinaikkan hingga suhu 500oC dengan interval 25oC setiap 5 menit
Ditambahkan 10 tetes HNO3 (1:1) Diuapkan pada hot plate sampai kering
Hasil
Dilakukan selama 45 jam dan dibiarkan hingga dingin pada desikator
Abu
Dilakukan selama 1 jam dan dibiarkan hingga dingin pada desikator
Dibersihkan dari pengotoran
Dimasukkan kembali ke dalam tanur dengan temperatur awal 100oCdan perlahan – lahan temperatur dinaikkan hingga suhu 500oC dengan interval 25oC setiap 5 menit. Diblender
Sampel yang telah dihaluskan
46
Lampiran 6. Bagan alir proses destruksi kering simplisia daun salam
Sampel
Ditimbang 10 gram di dalam krus porselen Diarangkan di atas hot plate 6 jam
Diabukan dalam tanur dengan temperatur awal 100oC dan perlahan temperatur dinaikkan hingga suhu 500oC dengan interval 25oC setiap 5 menit
Ditambahkan 10 tetes HNO3 (1:1) Diuapkan pada hot plate sampai kering
Hasil
Dilakukan selama 45 jam dan dibiarkan hingga dingin pada desikator
Abu
Dilakukan selama 1 jam dan dibiarkan hingga dingin pada desikator
Dimasukkan kembali ke dalam tanur dengan temperatur awal 100oCdan perlahan – lahan temperatur dinaikkan hingga suhu 500oC dengan interval 25oC setiap 5 menit. Diblender
47
Lampiran 7. Bagan alir proses pembuatan infusa daun salam segar
Sampel
Ditimbang 10 gram
Dimasukkan kedalam panci infus Dibasahi dengan 100 ml air demineral
Diserkai selagi panas dengan kain flanel, ditambahkan air demineral panas hingga diperoleh infusa 100 ml
Sampel infusa
Dibersihkan dari pengotoran Dicuci bersih dan ditiriskan
Dirajang ± 0,5 cm
Sampel yang telah dirajang
Dikeringkan di udara terbuka terhindar dari sinar matahari langsung
Dipanaskan dalam penangas air selama 15 menit terhitung mulai suhu 90˚C sambil sesekali diaduk
Disaring dengan kertas saring
Dibuang 5 ml untuk menjenuhkan kertas saring
Filtrat
48
Lampiran 8. Bagan alir proses pembuatan infusa simplisia daun salam
Sampel
Ditimbang 10 gram
Dimasukkan ke dalam panci infus Dibasahi dengan 100 ml air demineral
Diserkai selagi panas dengan kain flanel, ditambahkan air demineral panas hingga diperoleh infusa 100 ml
Sampel infusa
Dirajang ± 0,5 cm Sampel yang telah dirajang
Dipanaskan dalam penangas air selama 15 menit terhitung mulai suhu 90˚C sambil sesekali diaduk
Disaring dengan kertas saring
Dibuang 5 ml untuk menjenuhkan kertas saring Filtrat
49
Lampiran 9. Bagan alir proses pembuatan larutan sampel secara destruksi basah
Sampel Infusa
Ditambahkan 10 ml HNO3 65%v/v dalam erlenmeyer Didiamkan selama 24 jam
Dipanaskan di atas hot plate pada suhu 80˚C selama ± 2 jam
Dimasukkan ke dalam botol Larutan sampel
Disaring dengan kertas saring Whatman No.42
Filtrat
Dibuang 5 ml untuk menjenuhkan kertas saring
50
Lampiran 10. Bagan alir proses pembuatan larutan sampel hasil destruksi kering
Sampel yang telah didestruksi kering
Dilarutkan dengan 5 ml HNO3 (1:1) dalam krus porselen Dituangkan ke dalam labu tentukur 50 ml
Diencerkan dengan air demineral hingga garis tanda
Dimasukkan ke dalam botol Larutan sampel
Disaring dengan kertas saring Whatman No.42 42 42
Filtrat
Dibuang 5 ml untuk menjenuhkan kertas saring
Dilakukan analisis kualitatif
51
Lampiran 11. Perhitungan penetapan kadar air pada serbuk simplisia daun salam
Sampel I Volume air = 0,3 ml Berat sampel = 5,021 gram Kadar air = 0,3
5,021 x 100%
= 5,97% Sampel II Volume air = 0,3 ml
Berat sampel = 5,015 gram Kadar air = 0,3
5,015 x 100%
= 5,98% Sampel III Volume air = 0,3 ml
Berat sampel = 5,013 gram Kadar air = 0,3
5,013x 100%
= 5,98%
Kadar air rata-rata =5,97% + 5,98% +5,98%
3
= 5,97% Kadar air = Volume air
52
Lampiran 12. Perhitungan penetapan kadar sari larut dalam air pada serbuk simplisia daun salam
Sampel I Berat sari = 0,143 g Berat sampel = 5,032 g Kadar sari larut air =0,143 g
5,032 g x 100
20 x 100%
Kadar sari larut air = 14,21% Sampel II Berat sari = 0,138 g Berat sampel = 5,027 g Kadar sari larut air = 0,138 g
5,027 g x 100
20 x 100%
Kadar sari larut air = 13,72% Sampel III Berat sari = 0,131 g Berat sampel = 5,019 g Kadar sari larut air = 0,131 g
5,019 g x 100
20 x 100%
Kadar sari larut air = 13,05%
Rata-rata kadar sari larut air = 14,21% + 13,72% + 13,05%
3
= 13,66% Kadar sari larut air = Berat sari
Berat sampel x 100
53
Lampiran 13. Perhitungan penetapan kadar sari larut dalam etanol pada serbuk simplisia daun salam <