BAHAN DAN METODE PENELITIAN
Waktu dan Tempat PenelitianPenelitian dilaksanakan mulai bulan Juni 2010 sampai dengan Mei 2011 di Kebun Percobaan Pusakanagara, Laboratorium Mutu Benih Balai Besar Penelitian Tanaman Padi, Sukamandi dan Laboratorium Molekuler Balai Besar Bioteknologi dan Sumber Daya Genetik, Bogor.
Bahan Penelitian Bahan Tanaman
Galur tetua dari lima varietas hibrida digunakan untuk identifikasi marka SSR (Tabel 1), sedangkan untuk uji kemurnian benih digunakan dua varietas hibrida yaitu Hipa 6 dan Hipa 7.
Tabel 1 Lima varietas hibrida yang digunakan beserta galur tetuanya No Varietas Hibrida Galur Mandul Jantan Restorer
1 Hipa 6 IR 62829 A B 8094 F 2 Hipa 7 IR 58025 A IR 40750 3 Hipa 8 IR 58025 A BP 51-1 4 Hipa 9 IR 58025 A S4325 A 5 Hipa 10 IR 68897 A BIO-9 Bahan Kimia
Bahan Kimia yang digunakan terdiri atas NaCl 5M, Tris HCl 1M, EDTA 0.5 M, SDS, Chisam ( Chloroform Isoamil Alkohol) 24:1, Natrium Asetat, Etanol 95%, Ethanol 70%,TE buffer, RNAse, CTAB 10%, Tris base, Glacical acetid acid, EDTA 0.5M, Agarose gel, TaqDNA polymerase, buffer PCR, MgCl2, dNTPs mix,
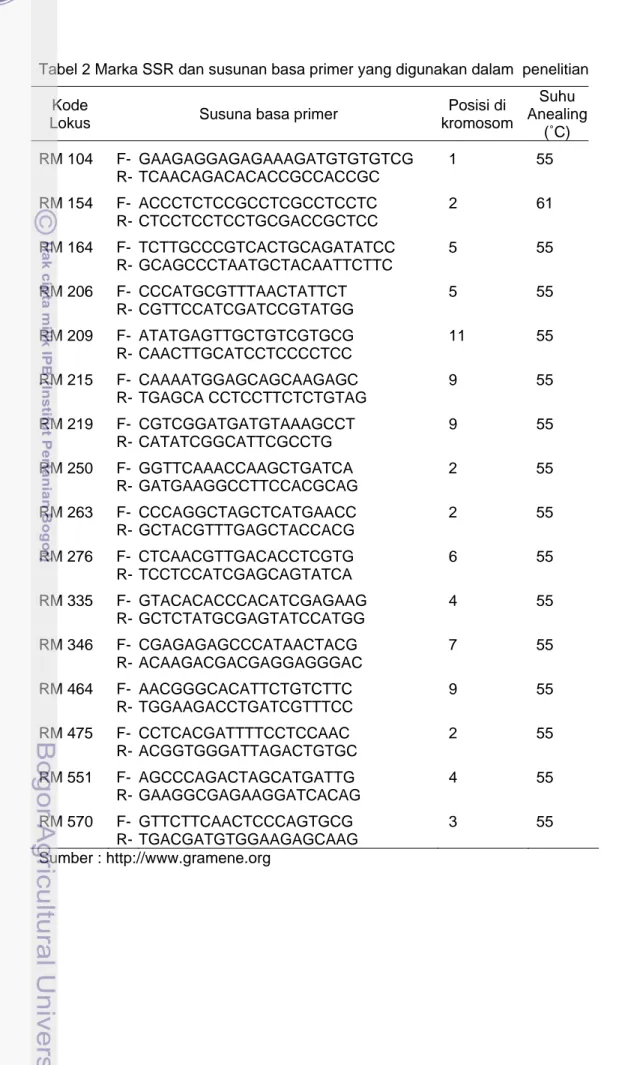
16 pasang primer, Etidium Bromide, Tris, EDTA, Boricacid, Bisacrylamid (40%), APS 10%, TEMED, ddH2O. Marka SSR yang digunakan pada penelitian ini
Tabel 2 Marka SSR dan susunan basa primer yang digunakan dalam penelitian Kode
Lokus Susuna basa primer
Posisi di kromosom Suhu Anealing (˚C) RM 104 F- GAAGAGGAGAGAAAGATGTGTGTCG 1 55 R- TCAACAGACACACCGCCACCGC RM 154 F- ACCCTCTCCGCCTCGCCTCCTC 2 61 R- CTCCTCCTCCTGCGACCGCTCC RM 164 F- TCTTGCCCGTCACTGCAGATATCC 5 55 R- GCAGCCCTAATGCTACAATTCTTC RM 206 F- CCCATGCGTTTAACTATTCT 5 55 R- CGTTCCATCGATCCGTATGG RM 209 F- ATATGAGTTGCTGTCGTGCG 11 55 R- CAACTTGCATCCTCCCCTCC RM 215 F- CAAAATGGAGCAGCAAGAGC 9 55 R- TGAGCA CCTCCTTCTCTGTAG RM 219 F- CGTCGGATGATGTAAAGCCT 9 55 R- CATATCGGCATTCGCCTG RM 250 F- GGTTCAAACCAAGCTGATCA 2 55 R- GATGAAGGCCTTCCACGCAG RM 263 F- CCCAGGCTAGCTCATGAACC 2 55 R- GCTACGTTTGAGCTACCACG RM 276 F- CTCAACGTTGACACCTCGTG 6 55 R- TCCTCCATCGAGCAGTATCA RM 335 F- GTACACACCCACATCGAGAAG 4 55 R- GCTCTATGCGAGTATCCATGG RM 346 F- CGAGAGAGCCCATAACTACG 7 55 R- ACAAGACGACGAGGAGGGAC RM 464 F- AACGGGCACATTCTGTCTTC 9 55 R- TGGAAGACCTGATCGTTTCC RM 475 F- CCTCACGATTTTCCTCCAAC 2 55 R- ACGGTGGGATTAGACTGTGC RM 551 F- AGCCCAGACTAGCATGATTG 4 55 R- GAAGGCGAGAAGGATCACAG RM 570 F- GTTCTTCAACTCCCAGTGCG 3 55 R- TGACGATGTGGAAGAGCAAG Sumber : http://www.gramene.org
Identifikasi Marka Molekuler
Pengujian SSR dilakukan pada tahap pertama penelitian, kegiatan ini dilakukan guna mengidentifikasi marka SSR polimorfik untuk tetua dari lima varietas hibrida yang digunakan. Identifikasi marka molekuler dilakukan di laboratorium biologi molekuler dengan kegiatan-kegiatan yang mencakup : ekstraksi DNA, amplifikasi PCR, elektroforesis dan visualisasi pita DNA.
Ekstraksi DNA
Sampel daun muda digerus menggunakan mortar dengan bantuan nitrogen cair sampai berbentuk bubuk. Sampel dimasukan dalam tabung mikro ukuran 1500 µl, kemudian ditambahkan ml 500 µl buffer ekstraksi. Tabung mikro yang berisi sampel dan buffer ekstrak dipanaskan menggunakan waterbath suhu 65˚C selama 60 menit sambil dilakukan pengocokan setiap 10 menit. Setelah itu sampel diangkat dan didiamkan pada suhu ruang selama 10 menit. Sampel ditambahkan Choloform:Isoamilalkohol (Chisam) dengan perbandingan 24:1 sebanyak 500 µl. Setelah itu sampel dicampur dengan cara divortex selama selama 5 menit, kemudian disentrifius selama 15 menit dengan kecepatan 1200 rpm. Bila sampel belum tercampur dengan baik dapat disentrifius sekali lagi.
Supernatan yang terbentuk diambil secara hati-hati dan dipindahkan ke tabung mikro yang baru. Supernatan ditambahkan dengan 2/3 x volume Isopropanol atau 2,5 x volume Etanol absolute yang sebelumnya telah ditaruh terlebih dahulu dalam freezer untuk presipitasi DNA. Sebanyak 100 µl Natrium asetat ditambahkan dan kemudian dicampur dengan cara membolak-balikan tabung secara perlahan. Sampel disentrifius pada kecepatan 1200 rpm selama 10 menit untuk mengendapkan DNA. Cairan yang ada dibuang dan kemudian endapan DNA yang terbentuk dicuci dengan cara menambahkan ethanol 70% yang kemudian disentrifius selama 5 menit. Pencucian dilakukan sebanyak dua kali. Cairan yang ada dibuang dan endapan DNA dikeringkan dengan mesin
vacum. Selanjutnya endapan DNA dilarutkan kembali dengan 50-100 µl buffer
TE dan ditambahkan RNAse 5 µl. Sampel diinkubasi selama 1 hari pada suhu ruang atau 1 jam pada suhu 37˚C.
Pengukuran konsentrasi dan kemurnian DNA dilakukan setelah proses isolasi selesai dengan menggunakan alat spektrofotometer. Perhitungan konsentrasi DNA dilakukan untuk mendapatkan konsentrasi DNA yang dibutuhkan untuk pengenceran. Setiap sampel dilakukan pengenceran untuk
menyamakan konsentrasi contoh kerja. Konsentrasi contoh kerja yang digunakan adalah 10 ng/µl.
Amplifikasi PCR, Elektroforesis dan Visualisasi Pita DNA
Sebanyak 3 µl DNA dari hasil pengenceran digunakan untuk setiap reaksi PCR. PCR mix dibuat terlebih dahulu untuk memudahkan dalam proses PCR. Larutan yang digunakan untuk PCR :
Buffer PCR (10 x) : 2 µl MgCl2 (25 mM) : 2,4 µl dNTPs mix (10 mM) : 0,4 µl Primer R (10 pmol) : 0,2 µl Primer F (10 pmol) : 0,2 µl TaqDNA polymerase (5 µ/µl) : 0,2 µl DNA : 3 µl ddH2O : 10,4 µl Total 20 µl
Profil reaksi PCR yang digunakan:
Denaturasi awal : 94˚C selama 5 menit Denaturasi : 94˚C selama 1 menit Annealing : 53˚C selama 30 detik Extention : 72˚C selama 1 menit Extention tambahan : 72˚C selama 5 menit siklus 35 kali
Elektroforesis hasil PCR, dilakukan dengan gel agarose 3 % dan 1 x buffer TAE. Sebanyak 6 µl produk PCR ditambahkan dengan 4 µl loading dye dan dicampur sempurna kemudian dimasukan ke dalam sumur gel. Sample DNA produk PCR di-running dengan voltase 87-88 volt selama 30-45 menit. Setelah itu gel agarose di-staining pada larutan ethidium bromide (10mg/l) selama 20 - 30 menit dan kemudian dicuci dengan air selama 5 menit. Gel Agarose kemudian divisualisasi dengan chemodoc gel system.
Elektroforeis gel poliakrilamid menggunakan alat elektroforesis vertikal. Alat elektroforesis vertikal terdiri dari dua lempengan kaca. Kedua lempengan kaca dibersihkan terlebih dahulu dengan menggunakan etanol sebelum digunakan. Kedua lapis plat kaca tersebut disatukan dengan terlebih dahulu meletakan
spacer diantara kaca tersebut. Sisi kanan, kiri dan bawah lempengan kaca
Larutan akrilamid 8% didapatkan dengan mencampur bisakrilamid 40%, TBE dan dH2O. Pembuatan gel dilakukan dengan mencampurkan akrilamid 8%
yang kemudain distirer sambil ditambahkan APS dan TEMED. Segera setelah tercampur larutan tersebut dituangkan dengan cepat dan hati-hati pada rongga antara kedua lempeng kaca, jangan sampai terbentuk gelembung. Setelah itu
comb dipasang untuk membentuk sumur-sumur. Larutan polyakrilamid didiamkan
selama selama ± 1 jam sampai larutan membentuk gel.
Lempengan berisi gel diletakan pada alat elektroforesis vertikal. Comb dilepaskan secara berlahan agar tidak merusak sumur-sumur yang terbentuk pada gel. Tangki elektroforesis diisi dengan buffer TBE 1x. Permukaan buffer yang diisikan kira-kira berjarak 1cm dari garis atas gel. Kotak tangki bagian bawah juga diisi buffer TBE 1x. Mesin elektroforesis ditutup dari bagian atas dan setelah itu baru alat dinyalakan. Elektroforesis dilakukan dengan arus konstan 100 volt selama 90 menit.
Analisis Marka Mikrosatelit (SSR) Skoring
Setiap pita yang muncul pada gel merepresentasikan alel. Profil DNA merupakan data alel yang teramati dengan ketentuan adanya pita DNA berdasarkan ukuran produk PCR pada satu lokus yang sama dari beberapa contoh yang digunakan. Alel-alel tersebut diterjemahkan menjadi data biner. Setiap alel dianggap mewakili satu karakter dan diberi nilai berdasarkan ada tidaknya suatu alel. Nilai 1 diberikan apabila alel ada dan nilai 0 bila tidak ada alel. Analisa data molekular dilakukan berdasarkan hasil skoring pita DNA yang muncul pada gel. Penilaian muncul tidaknya pita genetik dilakukan secara manual. Pada marka SSR setiap pita DNA yang terbentuk menunjukan posisi alel pada lokus, dimana 1 marka SSR merupakan satu lokus.
Analisis Tingkat Polimorfisme (Polimorphic Information Content = PIC)
Tingkat polimorfisme atau PIC dalam terminologinya sama dengan gene
diversity (heterozygosity) (Weir, 1996). Nilai PIC memberikan perkiraan kekuatan
pembeda dari marka dengan menghitung bukan saja jumlah alel dalam satu lokus tetapi juga frekuensi relatif dari sejumlah alel dari suatu populasi yang diidentifikasi. Lokus marka dengan jumlah alel yang banyak akan terdapat pada frekuensi yang seimbang dengan nilai PIC yang paling tinggi. Nilai PIC dihitung
untuk masing-masing marka mikrosatelit (Smith et al. 1997). Nilai PIC diukur dengan menggunakan software online (www.genomics.liv.ac.uk/animal/ Pic1.html)
Profil Hasil Karakterisasi Marka Mikrosatelit
Keragaman alelik adalah keragaman yang diukur atau diduga dari keragaman aleliknya, yaitu banyaknya alel per lokus dan banyaknya lokus polimorfik (Boer 2007). Adapun parameter yang dapat dihitung adalah :
Jumlah Rata-rata Alel per Lokus, A. Jumlah rata-rata alel per lokus adalah porporsi jumlah total alel pada semua lokus terhadap jumlah lokus monomorfik dan polimorfik, sebagai berikut :
Jumlah total semua alel pada semua lokus Jumlah lokus monomorfik dan polimorfik
Persentase Lokus Polimorfik, P. Persentase lokus polimorfik adalah proporsi jumlah lokus polimorfik terhadap jumlah lokus monomorfik dan polimorfik, sebagai berikut :
Jumlah lokus polimorfik
Jumlah lokus monomorfik dan polimorfik
Jumlah Rata-rata Alel per Lokus Polimorfik, AP. Jumlah rata-rata alel per lokus polimorfik adalah proporsi dari jumlah total alel pada semua lokus terhadap jumlah lokus polimorfik, sebagai berikut ;
Jumlah total alel pada semua lokus Jumlah lokus polimorfik
Analisis Kemiripan Individu
Tingkat kesamaan genetik dari tetua yang digunakan dilihat dengan menggunakan analisis kluster berdasarkan metode pautan rata-rata dengan alat bantu NTSYS-pc. Hasil skoring pita-pita yang muncul dan yang tidak, ditabulasikan ke dalam bentuk excel untuk memudahkan proses pembacaan data pada software. Pita polimorfik merupakan pita yang tidak dimiliki oleh individu tetua padi hibrida yang lain pada ukuran yang sama. Berdasarkan nilai kesamaan genetik tersebut, dilakukan analisis pengelompokan data matriks, dan
pembuatan dendogram kekerabatan menggunakan metode UPGMA (Unweighted Pair Group Methode Arithmetic) melalui program NTSYS (Numerical Taxonomy and Multivariate System) versi 2.02. Dendogram dikonstruksi untuk 8 inbrida (tetua). Analisis jarak genetik diperoleh dengan formula: S = 1 – GS, dimana S = Jarak genetik dan GS = kemiripan genetik.
Uji Sterilitas Malai Galur Mandul Jantan
Pengujian sterilitas malai dilakukan untuk mengetahui persentase tingkat sterilitas galur mandul jantan yang digunakan. Galur mandul jantan yang diuji adalah IR62829A, IR58025A, dan IR68897A. Penanaman dilakukan di rumah kaca dengan menggunakan 75 tanaman untuk masing-masing galur mandul jantan. Dua malai utama dari masing-masing individu tanaman disungkup dengan kantung kertas sebelum masa antesis. Pengamatan dilakukan menjelang fase generatif akhir. Selanjutnya dilakukan perhitungan jumlah gabah bernas (fertil) dan gabah hampa (steril) dari satu malai. Selain itu juga dihitung persentase individu tanaman yang menghasilkan gabah isi dari keseluruhan tanaman yang diuji.
Uji Kemurnian Benih Hibrida dan Karakterisasi Morfologi Tanaman Uji Kemurnian Benih
Penanaman hibrida di lapang dilakukan untuk pengujian kemurnian benih. Varietas yang digunakan adalah Hipa 6 dan Hipa 7. Penanaman dimulai pada bulan Juli 2010 sampai dengan November 2010 di kebun percobaan Pusakanagara Balai Besar Penelitian Tanaman Padi. Pemeriksaan lahan dan pengolahan tanah sempurna dilakukan pada petak yang akan ditanam untuk menghindari adanya tanaman sisa yang berasal dari pertanaman sebelumnya. Persemaian dilakukan terpisah pada petak persemaian, bibit dipindahkan ke petak percobaan pada umur 15 hari. Penanaman dilakuan satu bibit /lubang dengan jarak tanam 25 cm X 25 cm. Penyulaman dilakukan 1 minggu setelah tanam.
Pemeliharaan tanaman dilakukan sebagaimana halnya budidaya padi sawah. Pupuk yang diberikan adalah Urea 300 kg/ha, SP36 100 kg/ha dan KCl 100 kg/ha. Setengah dosis Urea, seluruh dosis SP36 dan KCl diberikan sebagai pupuk dasar sehari sebelum tanam, sedangkan sisa setengah dosis Urea
diberikan pada saat tanaman berumur 40 HST. Pengendalian hama dan penyakit dilakukan saat munculnya gejala serangan hama dan penyakit.
Empat puluh individu tanaman ditentukan secara acak sebagai tanaman contoh untuk masing-masing hibrida. Setiap individu tanaman contoh tersebut diambil sampel daunnya pada umur lima minggu untuk dilakukan pengujian kemurnian genetik dengan marka molekuler. Pengamatan morfologi untuk pengujian kemurnian benih di lapang juga dilakukan pada tanaman contoh yang sama.
Uji Kemurnian Genetik dengan Marka Mikrosatelit
Setelah didapatkan marka SSR yang polimorfik selanjutnya dilakukan uji kemurnian genetik benih F1 hibrida dengan menggunakan 2 varietas Hibrida (Hipa 6 dan Hipa 7). Sebanyak 40 sampel diambil dari petak pertanaman tiap hibrida. Sampel diambil dari daun muda setiap individu tanaman yang telah diberi kode pada petak yang ada di lapangan. Sampel kemudian diekstrak DNA-nya, dan selanjutnya dilakukan amplifikasi PCR menggunakan marka SSR polimorfis yang telah teridentifikasi.
Pendugaan persentase tingkat kemurnian hibrida dilakukan dengan menghitung jumlah pita yang sesuai dengan pola persilangan masing-masing hibrida. Hasil dari uji kemurnian genetik benih F1 hibrida, selanjutnya dibandingkan dengan uji kemurnian di lapang (grow out test).
Uji Kemurnian di Lapang (grow out test) dan Karakterisasi Morfologi Tanaman
Determinasi tingkat kemurnian di lapang dilakukan terhadap karakter morfologi dari tiap individu tanaman pada berbagai tahap pertumbuhan tanaman. Variable yang diamati meliputi : 1) kemurnian (tanaman campuran), 2) karakter kualitatif, 3) karakter kuantitatif tanaman. Pengamatan karakter tanaman dilakuan untuk mengindentifikasi adanya campuran varietas lain dan melengkapi deskripsi varietas yang sudah ada. Karakter morfologi yang diamati mencakup 45 karakter kualitatif dan 16 karakter kuantitatif tanaman (Lampiran 3 dan 4.). Jumlah campuran varietas lain dari hasil identifikasi dengan marka SSR dibandingkan dengan hasil uji kemurnian berdasarkan identifikasi morfologi di lapang.