KARAKTERISTIK Fe, NITROGEN, FOSFOR, DAN
FITOPLANKTON PADA BEBERAPA TIPE PERAIRAN
KOLONG BEKAS GALIAN TIMAH
ROBANI JUHAR
PROGRAM PASCA SARJANA
INSTITUT PERTANIAN BOGOR
BOGOR
2008
Dengan ini saya menyatakan bahwa tesis “Karakteristik Fe, Nitrogen,
Fosfor, Dan Fitoplankton Pada Beberapa Tipe Perairan Kolong Bekas Galian Timah” adalah karya saya sendiri dengan arahan komisi pembimbing dan
belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, Juni 2008
Robani Juhar C151050121
Dengan ini saya menyatakan bahwa tesis Karakteristik Fe, Nitrogen, Fosfor, dan Fitoplankton pada Beberapa Tipe Perairan Kolong Bekas Galian Timah adalah karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, Juni 2008
Robani Juhar C151050121
ROBANI JUHAR. Characteristics of Fe, Nitrogen, Phosphorous, and Phytoplankton on Ex-Tin Mining of the Ponds. Under the supervision of D. DJOKOSETIYANTO and HEFNI EFFENDI.
The aim of this study is to measure the concentration of Fe, nitrogen, and phosphorous and analyze the relation of the nutrient, elements with abundance of phytoplankton and primary productivity at some type ponds of ex-tin mining. The study was executed in September-October 2007. Concentration of total Fe in three ponds were 0.121 – 0.902 mg l-1, 0.024 – 0.487 mg l-1 and 0.146 – 0.390 mg l-1. Concentration of dissolved inorganic nitrogen (DIN) in three ponds were 0,068 – 643 mg l-1 0.021 – 0.291 mg l-1 and 0.027 – 0,452 mg l-1. Value of PO4-P in three
measured were 0.044 – 350 mg l-1, 0.074 – 0.326 mg l-1 and 0.023 – 0.841 mg l-1. DIN and PO4-P at station I (84.2%; p<5%) and station III (98.4%; p<5%) showed
strong correlation and significant, but not significant at station II (-79.7%; p>5%). Fe, DIN and PO4-P showed strong correlation with the abundance of phytoplankton at
station I (R2 = 83.4%), station II (R2 = 97.6%) and station III (R2 = 57.3%). Fe, DIN and PO4-P has not significant on the abundance of phytoplankton at station I and III
(p>0.05), but significantly effects at station II (p<0.05). Fe, DIN and PO4-P showed
strong correlation with net primary productivity at station II (R2 = 79.6%) and station III (R2 = 57.3%), but less at station II (R2 = 22.2%). Fe, DIN and PO4-P has not
significant on net primary productivity at station I and II (p>0.05), but significantly effects at station III (p<0.05).
ROBANI JUHAR. Karakteristik Fe, Nitrogen, Fosfor dan, Fitoplankton pada
Beberapa Tipe Perairan Kolong Bekas Galian Timah. Dibimbing oleh D. DJOKOSETIYANTO dan HEFNI EFFENDI.
Tujuan dari penelitian ini adalah untuk mengukur nilai unsur hara Fe, nitrogen, dan fosfor serta untuk menganalisis hubungan antar unsur hara, unsur hara dengan kelimpahan fitoplankton dan produktivitas primer pada beberapa tipe kolong bekas galian timah. Penelitian dilaksanakan pada bulan September-Oktober 2007. Nilai kisaran konsentrasi total Fe pada stasiun I sebesar 0,121 – 0,902 mg/l, stasiun II sebesar 0,024 – 0,487 mg/l, dan stasiun III sebesar 0,146 – 0,390 mg/l. Nilai kisaran dissolved inorganic nitrogen (DIN) pada stasiun I sebesar 0,068 – 643 mg/l, stasiun II sebesar 0,021 – 0,291 mg/l dan stasiun III sebesar 0,027 – 0,452 mg/l. Nilai kisaran PO4-P pada stasiun I sebesar 0,044 – 0,350 mg/l, stasiun II sebesar 0,074 –
0,326 mg/l, dan stasiun III sebesar 0,023 – 0,841 mg/l. DIN dan PO4-P stasiun I
(84,2%; p<5%) dan stasiun III (98,4%;p<5%) memiliki korelasi yang cukup erat dan signifikan, sedangkan pada stasiun II (-79,7%;p>5%) korelasinya cukup erat tapi tidak signifikan. Fe, DIN, dan PO4-P menunjukkan adanya hubungan linier yang kuat dengan kelimpahan fitoplankton pada stasiun I (R2 = 83,4%), stasiun II (R2 = 97,6%) dan stasiun III (R2 = 57,3%). Selanjutnya pengaruh unsur hara Fe, DIN, dan PO4-P terhadap kelimpahan fitoplankton pada stasiun I dan III terlihat kurang nyata (p>0,05), sedangkan pada stasiun II adalah sangat nyata (p<0,05). Fe, DIN, dan PO4-P menunjukkan adanya hubungan linier yang kuat dengan NPO4-PPO4-P pada stasiun II (R2 = 79,6%) dan stasiun III (R2 = 57,3%) serta lemah pada stasiun I (R2 = 22,2%). Selanjutnya pada stasiun I dan II tampak bahwa pengaruh unsur hara Fe, DIN, dan PO4-P terhadap kelimpahan fitoplankton kurang nyata (p>0,05), sedangkan pada stasiun III sangat nyata (p<0,05).
Robani Juhar. Characteristics of Fe, Nitrogen, Phosphorous and Phytoplankton at Some Types Ponds of The Ex-Tin Mining. Under the direction of D DJOKO SETIYANTO and HEFNI EFFENDI.
This study are aimed to measure the value of nutrient Fe, nitrogen and phosphorous and analyzed the relationship between element of nutrients, elements with abundance of phytoplankton and primer productivity at some type ponds of ex-tin mining. Study was executed in September-October 2007. Value of total Fe in three measured is 0.121 – 0.902 mg l-1, 0.024 – 0.487 mg l-1 and 0.146 – 0.390 mg l-1. Value of dissolved inorganic nitrogen (DIN) in three measured are 0,068 – 643 mg l-1 0.021 – 0.291 mg l-1 and 0.027 – 0,452 mg l-1. Value of PO4-P in three measured are
0.044 – 350 mg l-1, 0.074 – 0.326 mg l-1 and 0.023 – 0.841 mg l-1 in station I, II and III. DIN and PO4-P station I (84.2%; p<5%) and station III (98.4%; p<5%) has
correlation that is tightly enough and significant, while less significant at station II (-79.7%; p>5%). Fe, DIN and PO4-P showed strong correlation with the abundance of
phytoplankton at station I (R2 = 83.4%), station II (R2 = 97.6%) and station III (R2 = 57.3%). Fe, DIN and PO4-P has less effects on the abundance of phytoplankton at
station I and III (p>0.05), but significantly effects at station II (p<0.05). Fe, DIN and PO4-P showed strong correlation with net primer productivity at station II (R2 =
79.6%), station III (R2 = 57.3%) but less at station II (R2 = 22.2%). Fe, DIN and PO4
-P has less effects on net primary productivity at station I and II (p>0.05), but significantly effects at station III (p<0.05).
© Hak cipta milik Institut Pertanian Bogor, tahun 2008 Hak cipta dilindungi
1. Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumber:
a. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik atau tinjauan suatu masalah.
b. Pengutipan tidak merugikan kepentingan yang wajar IPB.
2. Dilarang mengumumkan dan memperbanyak sebagian atau seluruh karya tulis dalam bentuk apapun tanpa izin IPB.
FITOPLANKTON PADA BEBERAPA TIPE PERAIRAN
KOLONG BEKAS GALIAN TIMAH
ROBANI JUHAR
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Program Studi Ilmu Perairan
SEKOLAH PASCA SARJANA
INSTITUT PERTANIAN BOGOR
BOGOR
2008
Judul Tesis Nama NIM : : :
Karakteristik Fe, Nitrogen, Fosfor dan Fitoplankton Pada Beberapa Tipe Perairan Kolong Bekas Galian Timah
Robani Juhar C151050121 Disetujui Komisi Pembimbing Dr. Ir. D. Djokosetiyanto,DEA Ketua
Dr. Ir. Hefni Effendi, M.Phil Anggota
Diketahui
Ketua Program Studi Ilmu Perairan
Prof. Dr. Enang Harris, MS
Dekan Sekolah Pascasarjana
Prof. Dr. Ir. Khairil Anwar Notodiputro, MS
Puji dan syukur penulis panjatkan kehadirat Allah SWT, atas segala limpahan rahmat dan karunia-Nya sehingga tesis ini berhasil diselesaikan. Tesis ini merupakan hasil penelitian dengan judul “Karakteristik Fe, Nitorgen, Fosfor, dan Fitoplankton pada Beberapa Tipe Perairan Kolong Bekas Galian Timah”.
Pada kesempatan ini, penulis ucapkan terima kasih kepada:
1. Bapak Drs. H. Justiar Noer, S.T. MM. dan Ibu Ir. Ekawati, Dipl.Eng. yang selalu memberi doa restu, semangat, dorongan belajar serta kasih sayang kepada penulis. 2. Bapak Dr. Ir. D. Djokosetiayanto, DEA dan Dr. Ir. Hefni Effendi, M.Phil sebagai komisi pembimbing yang telah banyak memberikan arahan dan bimbingan kepada penulis hingga selesainya tesis ini.
3. Bapak Prof. Dr. Enang Harris, MS selaku ketua program studi Ilmu Perairan yang telah banyak memberikan arahan dan bimbingan kepada penulis hingga selesainya tesis ini.
4. Staf pengajar PS AIR atas bantuan dan dorongan yang diberikan selama penulis menempuh pendidikan di Sekolah Pascasarjana FPIK IPB Bogor.
5. Rekan-rekan mahasiswa S2 dan S3 PS AIR atas segala kerjasama dan dukungan serta kebersamaan selama ini.
6. Sekretariat PS AIR atas segala bantuan selama penulis mengikuti pendidikan. 7. Pemerintah Provinsi Kepulauan Bangka Belitung yang telah memberikan
rekomendasi untuk mengikuti pendidikan di FPIK IPB Bogor.
8. Semua pihak yang telah memberikan dukungan dan sumbangsih pemikiran dalam penyelesaian tesis ini.
Bogor, Juni 2008
Penulis dilahirkan di Bangka, pada tanggal 18 Nopember 1968 dari bapak Syamsudin Seman dan ibu Rotemah. Penulis merupakan anak pertama.
Tahun 1987 penulis lulus dari SMA Negeri Sungailiat dan pada tahun 1988 lulus seleksi masuk UNDIP melalui jalur Ujian Masuk Perguruan Tinggi Negeri (UMPTN). Penulis memilih Jurusan Perikanan Fakultas Peternakan dan lulus tahun 1994. Tahun 2005, penulis melanjutkan pendidikan pada program studi Ilmu Perairan Sekolah Pascasarjana Institut Pertanian Bogor.
Tahun 1994 sampai 1997 penulis bekerja pada PT. Suri Tani Pemuka, Sidoarjo sebagai Sales Executive pakan udang/ikan. Sejak tahun 1998, penulis bekerja sebagai Pegawai Negeri Sipil Daerah pada Dinas Kelautan dan Perikanan Provinsi Kepulauan Bangka Belitung.
Halaman DAFTAR TABEL ... DAFTAR GAMBAR ... DAFTAR LAMPIRAN ... PENDAHULUAN Latar Belakang ... Permasalahan dan Pendekatan Masalah ... Tujuan dan Manfaat ... Rumusan Hipotesa ...
TINJAUAN PUSTAKA
Penambangan Timah dan Kolong ...
Besi ...
Fosfor ... Nitrogen ... Fitoplankton ... Produktivitas Primer ...
BAHAN DAN METODE PENELITIAN
Tempat dan Waktu Penelitian ... Penentuan Stasiun Penelitian ... Contoh Air ... Analisis Data ...
HASIL DAN PEMBAHASAN
Unsur Hara ... Total Fe ... DIN (Dissolved Inorganic Nitrogen) ... Nitrogen Nitrit (NO2-N) ...
Nitrogen Nitrat (NO3-N) ...
Nitrogen Ammonia (NH3-N) ...
Ortofosfat (PO4-P) ...
Rasio N dan P ... Hubungan Total Fe dengan DIN dan PO4-P ...
Struktur Komunitas Fitoplankton ... Komposisi Jenis fitoplankton ... Kelimpahan Fitoplankton ... Indeks Biologi Fitoplankton ... Biomass (Klorofil-a) ... Produktivitas Primer Fitoplankton ...
x xi xii 1 2 3 4 6 7 8 9 9 10 12 14 14 21 23 23 25 25 26 26 27 29 30 31 31 33 36 38 39
Hubungan Unsur Hara dengan Kelimpahan Fitoplankton ... Hubungan Unsur Hara dengan Produktivitas Primer Fitoplankton Bersih (NPP) ... Evaluasi Kualitas Air pada Tiga Kolong di Kecamatan Pemali Kabupaten Bangka ... Pemanfaatan Kolong ...
SIMPULAN DAN SARAN
Simpulan ... Saran ... DAFTAR PUSTAKA ... LAMPIRAN ... 41 42 42 44 45 46 47 51
x
Halaman
1 Parameter-parameter, metode, dan alat yang digunakan dalam analisis kualitas air selama penelitian ...……….
2 Kandungan total Fe, nitrogen, dan fosfor per periode di tiga kolong Kecamatan Pemali Kabupaten Bangka ………..
3 Rasio massa nitrogen dan fosfor per periode di tiga kolong Kecamatan Pemali Kabupaten Bangka ……….
4 Jumlah genera fitoplankton per periode di tiga kolong Kecamatan Pemali Kabupaten Bangka ...
5 Nilai rata-rata kelimpahan (Ind/l) per periode kelas fitoplankton di tiga kolong Kecamatan Pemali Kabupaten Bangka ...
6 Indeks biologi fitoplankton pada tiga kolong di Kecamatan Pemali Kabupaten Bangka ……….
7 Nilai konsentrasi klorofil-a fitoplankton per periode pada tiga kolong pengamatan di Kecamatan Pemali Kabupaten Bangka ……….
8 Nilai produktivitas primer per periode pada tiga kolong pengamatan di Kecamatan Pemali Kabupaten Bangka...
16 24 29 32 34 37 39 40
xi
Halaman
1 Diagram alir perumusan masalah ……….. 2 Kolong Wasere Kecamatan Pemali Kabupaten Bangka ……….. 3 Kolong Open Pit Kecamatan Pemali Kabupaten Bangka ... 4 Kolong Dam Keramat Kecamatan Pemali Kabupaten Bangka ………… 5 Peta Lokasi Penelitian di Kabupaten Bangka ... 6 Komposisi Fe, nitrogen, dan fosfor pada tiga kolong di Kecamatan Pemali
Kabupaten Bangka ...
7 Kelimpahan Genera Fitoplankton pada tiga kolong di Kecamatan Pemali Kabupaten Bangka ...
8 Tingkat kualitas air menurut baku mutu air kelas II pada tiga kolong di Kecamatan Pemali Kabupaten Bangka ...
5 12 13 14 15 28 35 43
xii
Halaman
1 Peta lokasi penelitian ………. 2 Data cuaca bulan September dan Oktober 2007 wilayah Bangka ……... 3 Konsentrasi parameter-parameter fisika yang diukur pada tiga kolong
Kecamatan Pemali Kabupaten Bangka ………..
4 Konsentrasi parameter-parameter kimia yang diukur pada tiga kolong Kecamatan Pemali Kabupaten Bangka ………..
5 Kelimpahan fitoplankton (individu/liter) pada tiga kolong di Kecamatan Pemali Kabupaten Bangka ………
6 Hasil korelasi dan regresi linier berganda NO2-N, NO3-N, NH3-N dan PO4
-P dengan total Fe ...………
7 Hasil korelasi dan regresi linier berganda total Fe, DIN dan PO4-P dengan
kelimpahan fitoplankton ...
8 Hasil korelasi dan regresi linier berganda total Fe, DIN dan PO4-P dengan
produktivitas primer fitoplankton (NPP) ...
9 Kualitas air kolong di Kecamatan Pemali Kabupaten Bangka pada bulan September dan Oktober 2007 dibandingkan dengan mutu air kelas II (metode STORET) ...
10 Kualitas rataan air pada tiga kolong di Kecamatan Pemali Kabupaten Bangka berdasarkan katagori I (kecil), II (sedang), dan III (besar)... 51 52 54 55 56 58 60 62 64 66
Latar Belakang
Pertambangan timah di Indonesia dimulai pada abad ke-18. Sejak tahun 1815 penambangan timah di pulau Bangka dilaksanakan oleh pemerintah Hindia Belanda dan berlanjut sampai PT. Timah, Tbk. dalam pemerintahan Republik Indonesia.
Kolong adalah sebutan khas dari masyarakat Bangka Belitung untuk danau-danau yang terbentuk dari bekas penambangan timah. Kolong terbentuk akibat aktifitas penambangan timah yang dilakukan dengan sistem terbuka. Sistem penambangan tersebut menyebabkan terbentuknya kolong dalam berbagai ukuran dan hamparan tailing. Dampaknya adalah saat pirit (FeS) sebagai bentuk umum mineral sulfida terekspos ke lingkungan bereaksi dengan oksigen dan air membentuk asam sulfida dan hidroksida besi yang bersifat asam. Menurut Sukandarrumidi (2007) air yang mengandung asam sulfat didapatkan di daerah yang banyak mengandung mineral pirit. Lebih lanjut dijelaskan apabila endapan bahan galian terutama yang mengandung mineral sulfida tersingkap, maka segera mengalami proses oksidasi dan dilanjutkan dengan proses pelarutan oleh air hujan.
Perairan kolong sebagian berhubungan langsung dengan sungai atau laut, sehingga terjadi fluktuasi konsentrasi Fe di perairan kolong. Adanya aliran masuk yang berasal dari sungai atau laut juga mempengaruhi kandungan unsur hara di perairan kolong.
Pemanfaatan kolong di Bangka Belitung untuk perikanan belum optimal. Berdasarkan data Statistik Perikanan Budidaya Propinsi Kepulauan Bangka Belitung, produksi perikanan kolong tahun 2006 adalah 27,69 ton (produktivitas 3,08 ton/ha) dengan luas areal 8,98 ha dari total luas 1.712,65 ha. Produksi ikan pada perairan bekas tambang umumnya rendah (Bennet 1970). Hal ini diduga disebabkan perairan kolong memiliki ketersediaan makanan alami kurang, sehingga tidak mendukung pertumbuhan ikan. Pakan alami di perairan kolong tidak dapat tumbuh secara optimal karena kandungan unsur hara rendah dan konsentrasi mineral Fe yang tinggi. Untuk itu diperlukan manipulasi lingkungan agar kondisi perairan kolong dapat mendukung pertumbuhan pakan alami.
Pakan alami dalam hal ini fitoplankton dapat tumbuh secara optimal jika di perairan kolong terdapat unsur hara dalam jumlah mencukupi dan dapat dimanfaatkan oleh fitoplankton. Fitoplankton dalam pertumbuhannya membutuhkan unsur nitrogen dan fosfor. Di perairan alami, nitrogen dan fosfor berada dalam berbagai senyawaan. Fosfor di perairan alami berada dalam berbagai senyawaan terutama dengan Fe, Al, dan Ca, sedangkan kekuatan ikatannya tergantung pada nilai pH air. Amonia sebagai sumber nitrogen, selain dalam bentuk gas, juga membentuk senyawa dengan beberapa ion logam. Persentase amonia bebas meningkat dengan meningkatnya nilai pH.
Berdasarkan hal tersebut di atas dan mengingat belum adanya informasi ekologis mengenai keadaan perairan kolong, maka perlu dilakukan kajian tentang hubungan antara kelimpahan fitoplankton dengan kualitas air yang diperlukan sebagai dasar bagi dilakukannya manipulasi lingkungan perairan kolong.
Permasalah dan Pendekatan Masalah
Peranan Fe pada proses fisiologi seperti fotosintesis, respirasi, dan asimilasi nitrogen membuatnya menjadi salah satu faktor nutrien terpenting bagi pertumbuhan fitoplankton (MacKay et al. 2005) dan dalam jumlah kecil sangat dibutuhkan sebagai penyusun sitokrom dan klorofil, tetapi dalam jumlah yang berlebihan, Fe dapat menghambat fiksasi unsur lainnya (Effendi 2003).
Sumber Fe di alam diantaranya adalah pirit (FeS) dan hematit (Fe2O3). Pada
perairan alami, Fe berikatan dengan anion membentuk senyawa FeCl2, Fe(HCO3)2,
dan Fe(SO4) (Sukandarrumidi 2007).
Daerah penambangan timah banyak mengandung mineral pirit dan sufida lainnya yang teroksidasi membentuk asam sulfida sehingga perairan kolong bekas galian timah memiliki pH rendah (Abel 1989; Connell dan Miller 1995). Derajat keasaman merupakan faktor lingkungan yang mengendalikan fitoplankton dan proses pengambilan hara, keseimbangan nutrien (karbondioksida, fosfat, dan nitrogen) serta keseimbangan logam beracun.
Proses oksidasi dan reduksi besi tidak melibatkan oksigen dan hidrogen, tapi biasanya melibatkan bakteri kemosintesis sebagai mediator. Bakteri ini dapat
menghasilkan ion Fe3+, air, dan energi bebas yang digunakan untuk sintesis bahan
organik dan CO2. Pada pH 7,5–7,7, ion Fe3+ mengalami oksidasi dan berikatan
dengan hidroksida membentuk Fe(OH)3 yang bersifat tidak larut dan mengendap
di dasar perairan (Effendi 2003). Dalam bentuk Fe2+, besi dapat hilang bila
terjadi pencucian air, namun bila tidak terjadi pencucian, Fe2+ akan bereaksi
dengan sulfur membentuk sulfida dan senyawa-senyawa lainnya (Hardjowigeno 2003). Sulfida adalah produk sampingan reduksi sulfat dengan Fe seperti ferri sulfida dan pirit yang mengendap di sedimen (Glass 1997).
Proses oksidasi Fe2+ menjadi Fe3+ dalam bentuk Fe(OH)3 dapat membantu
menaikkan pH perairan. Pada perairan alami dengan pH sekitar 7 dan kadar oksigen terlarut yang cukup, ion Fe2+ yang bersifat terlarut dioksidasi menjadi Fe3+ yang bersifat tidak terlarut dan mengendap (Effendi 2003). Proses oksidasi besi pada perairan kolong sangat tergantung kepada sirkulasi dan waktu. Pada umumnya pH air kolong berkisar antara 4,5–7,0 dan kandungan logam beratnya sangat berkaitan dengan usia kolong dan berhubungan dengan sungai atau laut (UNSRI 1999).
Kelimpahan fitoplankton berfluktuasi secara periodik, dan kelimpahannya tergantung pada unsur hara yang tersedia. Struktur komunitas fitoplankton pada perairan kolong mengalami fluktuasi tergantung pada parameter fisika kimia air. Dengan meningkatnya pH, maka fiksasi unsur hara, terutama nitrogen dan fosfor sebagai makanan fitoplankton akan meningkat sehingga produktivitas primer juga meningkat. Pada kolong terbuka atau yang mendapat aliran air masuk dan keluar
terjadi fluktuasi unsur hara dan oksidasi Fe2+ menjadi Fe3+ sehingga dapat
dijadikan sebagai indikator kandungan unsur hara sebagai pakan alami dan struktur komunitas fitoplankton. Oleh sebab itu, apabila sebaran dan kandungan Fe di perairan kolong diketahui, maka kelimpahan dan struktur komunitas fitoplankton serta kandungan unsur hara diduga dapat diketahui.
Tujuan dan Manfaat
Tujuan dari penelitian adalah:
1. Mengetahui konsentrasi Fe, nitrogen, dan fosfor pada beberapa tipe kolong bekas galian timah.
2. Korelasi unsur nitrogen dan fosfor dengan Fe pada beberapa tipe kolong bekas galian timah.
3. Korelasi kelimpahan fitoplankton dengan unsur Fe, nitrogen, dan fosfor pada beberapa tipe kolong bekas galian timah.
4. Korelasi produktivitas primer fitoplankton dengan unsur Fe, nitrogen, dan fosfor pada beberapa tipe kolong bekas galian timah.
Hasil penelitian ini diharapkan dapat memberikan informasi tentang kondisi lingkungan di perairan kolong sebagai dasar bagi dilakukannya manipulasi lingkungan untuk kegiatan perikanan budidaya. Selanjutnya hal tersebut diharapkan dapat menjadi bahan masukan dan pertimbangan pengambil kebijakan sebagai dasar perencanaan dan pemanfaatan perairan kolong.
Rumusan Hipotesa
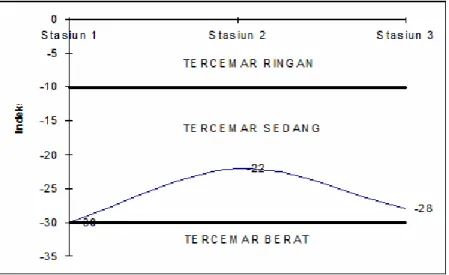
Jika konsentrasi Fe pada perairan kolong tinggi maka unsur hara yang tersedia tidak dapat digunakan secara optimal untuk pertumbuhan fitoplankton sehingga produktivitas primer fitoplankton menjadi rendah.
5 Gambar 1 Diagram alir perumusan masalah
Algae KA - Unsur Hara Sist. Drainage Flushing/tidak Struktur Komunitas Fitoplankton Produktivitas Primer Fitoplankton Manag KA Prod Biomass Algae Resorbsi Releasing Fe?? -+ +
Input Proses Output
N&P ?
Penambangan Timah dan Kolong
Pertambangan timah di Indonesia dimulai pada abad ke-18. Sejak tahun 1815 penambangan timah di pulau Bangka dilaksanakan oleh pemerintah Hindia Belanda. Tahun 1958 semua kegiatan penambangan timah dibawah Biro Urusan Perusahaan Tambang Timah Negara (BUPTAN) dan dibentuk Badan Pimpinan Umum Perusahaan Tambang Timah Negara pada tahun 1961. Selanjutnya tahun 1968 direorganisasi menjadi Perusahaan Negara Tambang Timah.
Timah putih berasal dari mineral Kasiterit (SnO), Stannit (Cu2FeSnS4) dan
Teallit (PbSnS2). Endapan timah primer terdapat pada batuan granit, sedangkan
timah sekunder berasal dari timah primer yang telah mengalami pelapukan. Apabila endapan tersingkap, maka endapan terutama yang mengandung mineral sulfida akan mengalami proses pelapukan oleh oksigen dan dilanjutkan proses pelarutan oleh air hujan (Sukandarrumidi 2007).
Penambangan timah di Bangka hampir secara keseluruhan meninggalkan lahan-lahan berupa kolong darat (hamparan tailing dan over burden) serta kolong air (bekas penggalian biji timah) berukuran 10–100 hektar, dengan kedalaman lima sampai 25 meter. Permasalahannya adalah kualitas hamparan tailing serta air kolong memiliki derajat keasaman yang tinggi (pH rendah), kandungan mikroba dan unsur hara yang rendah, serta adanya mineral-mineral berat terlarut (Geotek LIPI 2003).
Sistem penambangan timah dapat dikelompokkan menjadi empat cara, yaitu : (1) tambang dengan tenaga manusia (manual mining), (2) tambang semprot (hydraulic mining), (3) kapal keruk darat (dredging mining), dan (4) tambang terbuka (open pit mining). Dampak dari sistem penambangan tersebut menyebabkan terjadinya kolong dengan berbagai ukuran dan dimensi, baik yang berhubungan langsung dengan sungai dan laut ataupun tidak berhubungan langsung (UNSRI 1999). Bennet (1970) menjelaskan beberapa ”lubang” bekas galian gravel, batu kapur, batubara, atau deposit mineral permukaan lainnya yang dibuat oleh manusia kadang dipenuhi oleh air tanah dan diisi dengan ikan.
Pemanfaatan kolong sendiri tergantung dari kondisi masing-masing kolong. Ada dalam kolong dapat merupakan campuran dari air hujan dan air tanah, air sungai, atau air laut. Usia kolong sangat berpengaruh terhadap ketersediaan nutrien, karena biasanya berkaitan dengan seberapa kaya kehidupan biota dan mikroorganisme di kolong tersebut.
Menurut survei tahun 1998/1999 yang dilakukan tim dari Universitas Sriwijaya atas permintaan PT Timah, terdapat sebanyak 887 kolong dengan luas keseluruhan 1.712,65 ha dan rata-rata kedalaman 9,5 meter di Bangka Belitung, yaitu 544 kolong di Bangka (luas 1.035,51 ha) dan 343 kolong lainnya di Belitung (677,14 ha). Pada musim kemarau, 90 persen dari total kolong atau 789 buah dimanfaatkan masyarakat untuk mandi dan mencuci, terutama kebutuhan air minum. Pada keadaan normal, 21,31 persen atau 189 kolong dimanfaatkan untuk mandi, mencuci, sumber air minum, rekreasi, perikanan, dan industri.
Besi
Dibandingkan dengan makronutrien (C, N, dan P), mikronutrien (Fe, Zn, Mn, Cu, Ni, dan Co) dibutuhkan dalam jumlah kecil untuk mendukung proses metabolisme sel (McKay et al. 2004). Besi termasuk salah satu unsur esensial dan berperan sebagai penyusun sitokrom dan klorofil bagi tumbuhan akuatik. McKay et al. (2005) menjelaskan besi berperan pada proses fisiologi seperti fotosintesis, respirasi, dan asimilasi nitrogen sehingga menjadi salah satu faktor nutrisi terpenting bagi pertumbuhan fitoplankton. Pada alga, besi berperan dalam sistem enzim dan transfer elektron pada proses sintesis, namun dalam kadar berlebihan dapat menghambat fiksasi unsur lainnya.
Pada perairan alami, besi berikatan dengan anion membentuk senyawa FeCl2,
Fe(HCO)3 dan Fe(SO4). Pada perairan tawar, besi oksida dibentuk oleh reaksi
kimia besi dengan oksigen terlarut dalam air. Selanjutnya besi oksida akan menyerap fosfor dan menjebaknya dalam sedimen. Hal ini menyebabkan terbatasnya ketersediaan fosfor di air (Glass 1997). Blomqvist (2004) menjelaskan bahwa pada danau anoksik, fosfat umumnya diendapkan oleh Fe sebelum mencapai lapisan oksik di atasnya. Fe juga mempengaruhi kemampuan organisme untuk mengasimilasi nitrat, baik sebagai co-faktor yang berkaitan dengan enzim atau reduktan (Robert et al. 2004).
Pirit (FeS) adalah bentuk umum mineral sulfida, sebagai mineral ikutan, timah termasuk mineral gangue (bagian dari asosiasi mineral yang membentuk batuan dan bukan mineral bijih didalam suatu jebakan). Mineral gangue bijih timah terdapat dalam bentuk kaolin dan pasir kuarsa (Sukandarrumidi 2007). Berdasarkan proses geologinya, mineral gangue diendapkan terlebih dahulu, kemudian diikuti oleh mineral oksida dan yang paling akhir mengkristal adalah mineral sulfida.
Pirit yang terekspos ke lingkungan akan bereaksi dengan oksigen dan air membentuk asam sulfida dan hidroksi besi menghasilkan acid main drainage. Kondisi asam dimulai saat mineral besi sulfida diekspos dan bereaksi dengan oksigen dan air. Faktor lain yang mempengaruhi oksidasi mineral sulfida adalah suhu, pH, keseimbangan besi ferri dan ferro, dan aktivitas mikrobiologi, khususnya Thiobacillus ferrooxidan. Aliran asam ditandai oleh pH rendah dan tingginya konsentrasi logam berat terlarut (sulfur mudah melarutkan logam Fe, Cu dan Al).
Fosfor
Fosfor merupakan unsur essensial bagi pertumbuhan sehingga menjadi faktor pembatas bagi pertumbuhan alga akuatik serta sangat mempengaruhi tingkat produktivitas perairan. Fosfor dapat mempengaruhi pertumbuhan dan produktivitas seluruh ekosistem. Fosfor pada umumnya sering menjadi nutrien pembatas padaair tawar (Glass 1997).
Fosfor ditemukan dalam bentuk senyawa anorganik yang terlarut (ortofosfat dan polifosfat) dan senyawa organik yang berupa partikulat di perairan. Ortofosfat merupakan produk ionisasi dari asam ortofosfat yang paling sederhana dan dapat dimanfaatkan secara langsung oleh alga (Boyd 1988). Alga tidak dapat memanfaatkan fosfor yang berikatan dengan ion besi dan kalsium pada kondisi aerob karena bersifat mengendap (Jeffries dan Mills 1996).
Tinggi rendahnya kandungan fosfat dalam perairan merupakan pendorong terjadinya dominasi fitoplankton tertentu, yaitu perairan dengan kandungan fosfat rendah (0,00–0,02 ppm) akan didominasi oleh Diatom; pada kadar sedang (0,02–
0,05 ppm) didominasi oleh Chlorophyta dan pada kadar tinggi (lebih dari 0,10 ppm) didominasi oleh jenis Cyanophyta (Liaw 1969).
Nitrogen
Gas nitrogen, nitrat, nitrit, amonium, amonia, dan bentuk nitrogen organik adalah bentuk nitrogen dalam air (Boyd 1992). Nitrogen tidak dapat dimanfaatkan secara langsung oleh tumbuhan akuatik dan harus mengalami fiksasi terlebih dahulu menjadi amonia (NH3), amonium (NH4+) dan nitrat (NO3-).
Namun beberapa jenis Cyanophyta dapat memanfaatkan gas N2 secara langsung
dari udara (Effendi 2003).
Nutrien anorganik utama yang paling dibutuhkan fitoplankton bagi pertumbuhan dan perkembangbiakan adalah nitrogen dalam bentuk nitrat (Nybakken 1988). Namun untuk memanfaatkan nitrat, dibutuhkan penambahan energi dengan adanya enzim nitrat reduktase (Goldman dan Horne 1983). Senyawa-senyawa nitrogen dipengaruhi oleh kandungan oksigen terlarut, nitrogen berubah menjadi ammonia saat oksigen terlarut rendah, sebaliknya berubah menjadi nitrat saat oksigen terlarut tinggi.
Fitoplankton
Fitoplankton merupakan golongan plankton tumbuhan yang melayang dalam air dan tidak mampu menahan arus (Barnes 1980). Lebih lanjut dijelaskan bahwa fitoplankton mampu hidup di perairan atau mampu beradaptasi dengan kondisi lingkungan perairan sebagai media fitoplankton berada, terutama pada perairan yang tenang seperti kolam, danau, dan waduk.
Menurut Welch dan Lindell (1980), fitoplankton yang hidup di air tawar terdiri dari lima kelompok besar yaitu fillum Cyanophyta, Chlorophyta, Chrysophyta, Pyrrophyta, dan Euglenophyta. Setiap jenis fitoplankton yang berada dalam lima kelompok besar tersebut mempunyai respon yang berbeda-beda terhadap kondisi perairan, khususnya unsur hara makronutrien dan mikronutrien, sehingga komposisi jenis fitoplankton bervariasi dari satu tempat ke tempat lain.
Sebagaimana organisme lainnya, pertumbuhan dan perkembangan fitoplankton dipengaruhi oleh faktor-faktor lingkungannya. Faktor fisika-kimia air dan tipe komunitas perairan merupakan faktor yang sangat menentukan. Cahaya matahari dan suhu merupakan kebutuhan fisiologis untuk pertumbuhan, sedangkan sejumlah unsur hara tertentu berperan terhadap kelimpahan fitoplankton (Goldman dan Horne 1983). Dominasi beberapa jenis fitoplankton pada perairan tergantung kepekaan fitoplankton tersebut terhadap faktor-faktor lingkungan.
Produktivitas Primer
Fitoplankton merupakan produsen primer terpenting dalam ekosistem perairan. Salah satu peran fitoplankton di perairan adalah mengubah zat-zat anorganik menjadi organik dengan bantuan cahaya matahari melalui proses fotosintesis yang hasilnya disebut produksi primer. Produktivitas primer merupakan sumber pokok energi bagi proses metabolik yang terjadi dalam biosfer. Di ekosistem akuatik, sebagian besar produktivitas primer dilakukan oleh fitoplankton (Wetzel 2001). Faktor-faktor lingkungan yang mempengaruhi nilai produktivitas primer adalah cahaya matahari, suhu, ketersediaan unsur hara, dan gas-gas terlarut (Odum 1993).
Reaksi fotosintesis secara sederhana (Wetzel 2001) dapat diringkas dalam
persamaan umum sebagai berikut: cahaya
6C02 + 12 H20 C6 H12 06 + 6 H20 + 6 02
pigmen receptor
Dalam proses ini energi cahaya diserap oleh pigmen fotosintetik terutama klorofil dan dengan adanya CO2, air dan zat hara akan dihasilkan senyawa organik
yang mempunyai potensi kimiawi yang tinggi dan disimpan dalam sel. Potensi energi ini kelak dapat digunakan oleh tumbuhan untuk respirasi, pertumbuhan, dan berbagai proses fisiologi lainnya (Nybakken 1988).
Dalam pengukuran produktivitas primer di perairan ada beberapa metode yang dapat digunakan, salah satu diantaranya metode oksigen botol gelap-botol
terang. Prinsip kerja metode ini adalah mengukur perubahan kandungan oksigen dalam botol terang dan botol gelap yang berisi contoh air setelah diinkubasi dalam jangka waktu tertentu pada perairan yang mendapat sinar matahari. Pada botol terang terjadi proses fotosintesis dan respirasi, sedangkan dalam botol gelap terjadi respirasi. Dengan asumsi bahwa respirasi dalam ke dua botol itu sama, maka perbedaan kandungan oksigen pada botol terang dan botol gelap pada akhir percobaan menujukkan produktivitas primer kotor. Perbedaan antara kandungan oksigen pada botol terang dan botol awal yang tidak diinkubasi, menunjukkan produktivitas bersih. Satuan produktivitasnya masih dalam oksigen per satuan waktu. Produktivitas dalam satuan karbon kemudian dijabarkan dengan menggunakan faktor koreksi (Boyd 1981).
Berdasarkan tingkat kesuburannya, perairan tergenang (Effendi 2003), termasuk kolong dapat diklasifikasikan sebagai berikut:
a. Oligotrofik, yaitu perairan dengan produktivitas primer dan biomass rendah. Unsur hara nitrogen dan fosfor rendah serta jenuh dengan oksigen. b. Mesotrofik, yaitu perairan dengan produktivitas primer dan biomass
sedang. Perairan ini merupakan peralihan antara oligotrofik dan eutrofik. c. Eutrofik, perairan dengan unsur hara dan produktivitas primer tinggi. d. Hiper-eutrofik, perairan dengan unsur hara dan produktivitas primer sangat
tinggi. Pada perairan ini, terjadi kondisi anoksik pada lapisan hipolimnion. e. Distrofik, yaitu jenis perairan yang banyak mengandung bahan organik.
Pengelompokan status tingkat kesuburan (trofik) suatu perairan tergantung dari beberapa parameter, diantaranya adalah kandungan klorofil, kecerahan air, laju penurunan oksigen, kandungan hara, densitas alga, dan spesies indikator (Seller dan Markland 1987).
Berdasarkan ketentuan Welch dan Lindell (1980), perbandingan antara P dan N dapat menentukan tingkat kesuburan suatu perairan. Perairan eutrofik dicirikan oleh rasio N/P lebih kecil dari 16/1, sedangkan perairan oligotrofik rasio N/P lebih besar atau sama dengan 16/1.
Selain itu Reynolds (1984) mengemukakan pula bahwa, jika rasio N/P lebih besar dari 15/1, maka perairan dibatasi oleh unsur P, sedangkan rasio N/P lebih kecil dari 15/1 maka perairan dibatasi unsur N.
Tempat dan Waktu Penelitian
Penelitian ini dilakukan di desa Pemali Kecamatan Pemali Kabupaten Bangka Provinsi Kepulauan Bangka Belitung pada tanggal 7 September 2007 sampai tanggal 30 Oktober 2007. Pengamatan dilakukan setiap minggu sekali selama 6 minggu terhadap tiga stasiun pengambilan contoh air.
Stasiun pengamatan I (kolong Wasere) terletak pada 01053118211 LS dan 106003123711 BT berumur sekitar 15 tahun (usia lebih dari 10 tahun dan bersifat tertutup) dengan luas sekitar 1,6 ha (Gambar 2). Secara umum kondisi perairan ini banyak ditumbuhi vegetasi baik di dalam air atau sempadan, berada di pinggir jalan serta dekat dengan pemukiman. Kolong Wasere sudah dimanfaatkan sebagai sumber air unit Pusat Pengolahan Bijih Timah Wasprod Sungailiat dan Pusat Pendidikan dan Pelatihan milik PT. Timah Tbk. Selain itu, kolong ini juga dimanfaatkan oleh masyarakat sekitarnya untuk air minum, mandi, dan mencuci, terutama saat musim kemarau.
Gambar 2 Kolong Wasere Kecamatan Pemali Kabupaten Bangka
Stasiun II (kolong Open Pit) terletak pada 01053118111 LS dan 106002182811 BT adalah bekas areal pertambangan terbuka yang cukup dalam (open pit) hingga 60 meter dan mulai digenangi air sejak tahun 1999 (kolong muda, usia kurang dari
10 tahun dan bersifat terbuka) dengan luas sekitar 10,25 ha (Gambar 3). Kondisi umum stasiun II adalah berair jernih, vegetasi pada badan air dan sempadan belum banyak, malah pada kawasan sempadan dan sekitarnya dipakai lagi untuk aktivitas pertambangan rakyat dengan limbah pencucian yang langsung dibuang pada kolong tersebut.
Gambar 3 Kolong Open Pit Kecamatan Pemali Kabupaten Bangka
Stasiun III (kolong Dam Keramat) terletak pada 01051174211 LS dan 106004117011 BT berumur lebih dari 10 tahun dan bersifat terbuka dengan luas sekitar 20,4 ha (Gambar 4). Secara umum kondisi kolong ini banyak ditumbuhi vegetasi baik di dalam air atau sempadan kolong dan dekat dengan pemukiman dan lahan pertanian. Kolong ini sudah dimanfaatkan sebagai sumber air minum oleh Perusahaan Daerah Air Minum Kabupaten Bangka dan Balai Benih Ikan Sentral Provinsi Kepulauan Bangka Belitung. Selain itu, kolong ini juga dimanfaatkan oleh masyarakat sekitarnya untuk air minum, mandi dan cuci terutama saat musim kemarau.
Penelitian ini menggunakan metode survei, yaitu pengamatan, pengambilan sampel di lapangan (perairan kolong), sedangkan analisa dilakukan di Laboratorium Produktivitas dan Lingkungan Perairan (ProLing) Departemen Manajemen Sumberdaya Perairan Fakultas Perikanan dan Ilmu Kelautan Institut Pertanian Bogor.
Gambar 4 Kolong Dam Keramat Kecamatan Pemali Kabupaten Bangka Penentuan Stasiun Penelitian
Unsur hara kolong sangat tergantung pada usia dan tipe kolong (Unsri 1999). Penentuan stasiun pengamatan didasarkan pada usia dan tipe kolong. Stasiun I mewakili kolong tua tertutup, stasiun II mewakili kolong muda terbuka dan stasiun III mewakili kolong tua terbuka. Secara operasional penempatan titik pengambilan contoh sampel air dan fitoplankton dilakukan pada bagian kolong yang tidak mengalami surut atau kering saat musim kemarau. Adapun pengambilan sampel air dilakukan dengan cara spasial, yaitu mencampur sampel air permukaan dan sampel air dasar untuk dianalisa.
Contoh Air Pengambilan Contoh Air
Penelitian direncanakan dilakukan pada waktu proses fotosintesis fitoplankton aktif berlangsung. Pengambilan contoh dilakukan satu minggu sekali selama 6 (enam) minggu.
Bahan yang digunakan dalam penelitian adalah contoh air dan spesimen fitoplankton yang diambil dari tiap stasiun atau kolom air yang telah ditentukan. Alat untuk mengambil contoh air adalah pompa celup ”Showflow” dengan maksimum flow 0.2 m3/menit. Contoh air tersebut dibagi menjadi beberapa
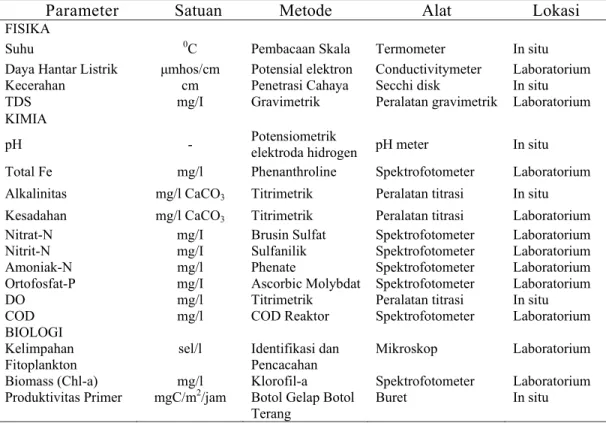
bagian untuk analisis fitoplankton dan produktivitas primer, serta analisis fisika- kimia air seperti pada Tabel 1.
Perlakuan Terhadap Contoh Air
Untuk menghindari terjadinya perubahan pada contoh air, maka contoh air yang akan dianalisis di laboratorium disimpan pada cool box yang berisi es. Contoh air untuk analisis fisika-kimia dibagi dalam 3 (tiga) botol sampel masing-masing berukuran 300 ml dengan distribusi sebagai berikut: (1) 300 ml contoh air diberi pengawet asam sulfat 90% untuk analisa total Fe, nitrat, amoniak, dan COD; (2) 300 ml diberi pengawet HgCl untuk analisa ortofosfat dan nitrit; (3) 300 ml tanpa diberi pengawet untuk analisa TDS, alkalinitas, DHL, dan kesadahan.
Untuk fitoplankton, contoh air yang diambil sebanyak 50 liter disaring menggunakan jaring plankton 35 µm. Berdasarkan hasil penelitian yang dilakukan oleh Unsri (1999), perairan kolong dinyatakan termasuk tipe oligotropik, sehingga sampel air yang diambil sebanyak 50 liter. Contoh fitoplankton disimpan dalam botol berkapasitas 10 ml dan diawetkan dengan larutan Lugol (1,0%) sampai berwarna seperti larutan teh tua (± 6 tetes), kemudian disimpan dalam kantong berwarna hitam dan selanjutnya dihitung dan diidentifikasi menggunakan mikroskop di laboratorium.
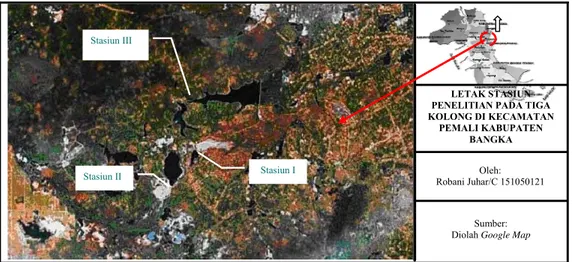
Gambar 5 Peta lokasi penelitian di Kabupaten Bangka (diolah dari Google map) Stasiun II
Stasiun III
Stasiun I
Sumber: Diolah Google Map
Oleh: Robani Juhar/C 151050121
LETAK STASIUN PENELITIAN PADA TIGA KOLONG DI KECAMATAN
PEMALI KABUPATEN BANGKA
Analisis Contoh Air (Parameter Fisika-Kimia)
Parameter yang diukur, metode, dan peralatan yang digunakan disajikan pada Tabel 1. Teknik analisis pengukuran contoh air mengikuti petunjuk APHA (1998). Parameter seperti suhu, kecerahan, pH, oksigen terlarut diukur secara
in-situ, sedangkan parameter kualitas air lainnya dianalisis di laboratorium.
Analisis Contoh Fitoplankton
Identifikasi dan klasifikasi contoh fitoplankton mengikuti petunjuk Davis (1955). Untuk mendapatkan gambaran karakteristik struktur komunitas fitoplankton pada perairan kolong dilakukan pendekatan yang bersifat kualitatif dan kuantitatif. Pendekatan kuantitatif adalah pendekatan analisis dengan mengamati komposisi jenis tertentu yang dominan dan kelimpahan sel. Pendekatan secara kualitatif (indeks biologi) yaitu dengan melakukan kalkulasi terhadap komponen tertentu dari struktur komunitas fitoplankton yang diamati. Tabel 1 Parameter-parameter, metode dan alat yang digunakan dalam analisis
kualitas air selama penelitian di perairan kolong
Parameter Satuan Metode Alat Lokasi
FISIKA
Suhu 0C Pembacaan Skala Termometer In situ
Daya Hantar Listrik μmhos/cm Potensial elektron Conductivitymeter Laboratorium
Kecerahan cm Penetrasi Cahaya Secchi disk In situ
TDS mg/I Gravimetrik Peralatan gravimetrik Laboratorium
KIMIA
pH - Potensiometrik
elektroda hidrogen pH meter In situ
Total Fe mg/l Phenanthroline Spektrofotometer Laboratorium
Alkalinitas mg/l CaCO3 Titrimetrik Peralatan titrasi In situ
Kesadahan mg/l CaCO3 Titrimetrik Peralatan titrasi Laboratorium
Nitrat-N mg/I Brusin Sulfat Spektrofotometer Laboratorium
Nitrit-N mg/I Sulfanilik Spektrofotometer Laboratorium
Amoniak-N mg/l Phenate Spektrofotometer Laboratorium
Ortofosfat-P mg/I Ascorbic Molybdat Spektrofotometer Laboratorium
DO mg/l Titrimetrik Peralatan titrasi In situ
COD mg/l COD Reaktor Spektrofotometer Laboratorium
BIOLOGI Kelimpahan
Fitoplankton sel/l Identifikasi Pencacahan dan Mikroskop Laboratorium
Biomass (Chl-a) mg/l Klorofil-a Spektrofotometer Laboratorium
Produktivitas Primer mgC/m2/jam Botol Gelap Botol
Kelimpahan Sel Fitoplankton
Kelimpahan plankton dinyatakan dalam jumlah sel per liter. Penentuan kelimpahan sel dilakukan dengan menggunakan metode Lackey drop
microtransect counting (modifikasi APHA 1998) dengan persamaan sebagai
berikut:
N = n x A/B x C/D x 1/E
Keterangan : N = jumlah total fitoplankton (sel/l)
n = jumlah rataan total individu per lapang pandang A = luas gelas penutup (1.000 mm2)
B = luas satu lapang pandang (20 mm2) C = volume air terkonsentrasi (30 ml)
D = volume air satu tetes (1 ml) dibawah gelas penutup E = volume air yang disaring (50 ml)
Indeks Keanekaragaman
Untuk menganalisis keragaman (diversitas) fitoplankton digunakan indeks keragaman Shannon-Weaver. Indeks keragaman Shannon-Weaver adalah suatu perhitungan matematik yang menggambarkan analisis mengenai jumlah individu dalam setiap spesies, jumlah macam spesies serta total individu yang ada dalam suatu komunitas. Keragaman adalah keheterogenan yang terdapat pada genera dari individu yang diambil secara acak dari suatu populasi. Semakin banyak terdapat jenis, maka semakin besar pula keheterogenannya. Besar indeks keragaman (H’) dirumuskan sebagai berikut (Wilhm dan Dorris 1968 diacu dalam Mason 1980):
n H’ = - Σ pi log pi
i=l
Keterangan : H’ = Indeks Keragaman Shannon-Weaver Pi = ni/N
Ni = jumlah individu jenis ke-i N = Jumlah total individu Nilai H’ dengan kriteria:
H’ ≤ 2,3062 : keanekaragaman rendah dan kestabilan komunitas rendah 2,3062 ≤ H’ ≥ 6,9078 : keanekaragaman rendah dan kestabilan komunitas sedang H’ ≥ 6,9078 : keanekaragaman rendah dan kestabilan komunitas tinggi
Indeks Keseragaman (Ekuitabilitas)
Indeks ini memberikan gambaran keseragaman sebaran individu dari jenis fitoplankton dalam suatu komunitas. Perhitungan indeks keseragaman (Odum 1971) adalah sebagai berikut:
E = H’ H’ maks
Keterangan: E = indeks keseragaman
H’ = indeks keragaman Shannon-Weaver H’ maks = ln S
S = jumlah spesies
Nilai keseragaman suatu populasi (E) berkisar antara 0,0 sampai 1,0. Semakin kecil nilai E (mendekati 0,0), akan semakin kecil keseragaman suatu populasi. Berarti penyebaran jumlah individu setiap jenis tidak sama, ada kecenderungan terjadi dominansi oleh jenis-jenis tertentu. Semakin besar nilai E (mendekati 1,0), menunjukkan keseragaman populasi yang tinggi, jumlah individu setiap jenis dapat dikatakan sama atau tidak jauh berbeda.
Indeks Dominasi
Indeks dominasi dihitung berdasarkan Indeks Simpson diacu dalam Legendre dan Legendre (1983), yang diaplikasikan untuk menganalisis komunitas fitoplankton di perairan kolong, yaitu dengan menggunakan perhitungan sebagai berikut:
C = Σ [ni / N] 2
Keterangan: C = indeks dominasi Simpson ni = jumlah individu jenis ke-i N = jumlah total individu
Indeks dominasi (C) berkisar antara 0 - 1 dengan kriteria sebagai berikut:
Jika nilai C mendekati 0,0 maka tidak ada spesies yang secara ekstrim mendominasi spesies lainnya dalam komunitas fitoplankton yang diamati. Hal ini menunjukkan struktur komunitas dalam keadaan stabil. Tetapi bila nilai C mendekati nilai 1,0 maka ada spesies yang mendominasi spesies lainnya dalam
struktur komunitas fitoplankton. Hal ini menunjukkan struktur komunitas fitoplankton dalam keaadan labil (Odum 1971).
Hubungan indeks keanekaragaman (H’), indeks keseragaman (E) dan indeks dominasi (C) adalah apabila nilai H’ tinggi berarti nilai E rendah dan tidak ada spesies yang mendominasi spesies lainnya (C rendah), demikian juga sebaliknya.
Biomassa fitoplankton
Biomassa diartikan sebagai banyaknya kloroplas per satuan luas atau volume pada saat tertentu (Wetzel 2001). Selain itu akumulasi fitoplankton merupakan produk akhir pertumbuhan fitoplankton yang ditentukan dengan laju produksi biomassa. Pengukuran biomassa dinyatakan dalam jumlah miligram klorofil-a per detik. Untuk analisis biomassa fitoplankton menggunakan formulasi dari Vollenweider (1974) sebagai berikut:
V 1000
Klorofil-a (μg/l) = 11,9 (A665 – A 750) x -- x ---
L S
Keterangan: A665 = Absorban pada panjang gelombang 665 nm A750 = Absorban pada panjang gelombang 750 nm V = Ekstraksi aseton (ml)
L = Panjang lintasan cahaya pada kuvet (cm) S = Volume contoh air yang disaring (l) Produktivitas Primer
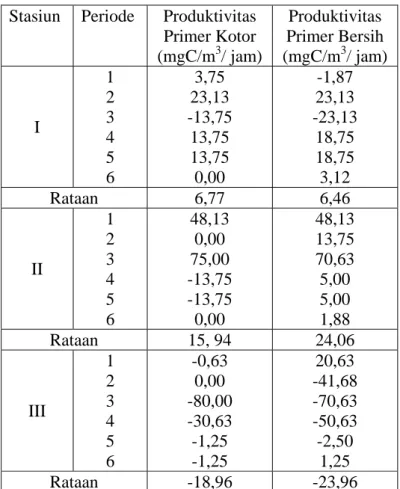
Pengukuran produktivitas primer dilakukan dengan menggunakan metode botol gelap-botol terang. Berhubung kecerahan pada ketiga kolong sampai dasar perairan, maka botol terang dan gelap yang digunakan pada penelitian ditempatkan sekitar 20 cm di atas dasar perairan. Dalam metode ini yang diukur adalah perubahan kandungan oksigen dengan menggunakan dua buah botol yang identik. Sebuah botol sepenuhnya tembus cahaya (bening), sedangkan botol yang lain tidak tembus cahaya (gelap).
Perhitungan produktivitas primer dilakukan menurut persamaan sebagai berikut (Umaly dan Cuvin 1988):
[ (O2 BT) – (O2 BG)] (1000) x 0,375 Fotosintesis kotor = --- (mg C/m3/jam) (PQ)(t) [ (O2 BT) – (O2 BA)] (1000) x 0,375 Fotosintesis bersih = --- (mg C/m3/jam) (PQ)(t)
Keterangan : O2 = oksigen terlarut (mg/1) BT = botol terang
BG = botol gelap BA = botol awal (initial)
PQ = Hasil bagi fotosintesis (1,2) T = lama inkubasi (jam)
x 1000 = konversi liter menjadi m3
0,375 = koefosien konversi oksigen menjadi karbon (12/32) PQ adalah perbandingan oksigen terlarut yang dihasilkan dengan CO2 yang digunakan melalui proses fotosintesis. Menurut Ryter (1965) dalam Parson
et al. (1984) PQ adalah 1,1 – 1,3 untuk organisme yang memiliki klorofil. Nilai
1,2 diperoleh dengan asumsi bahwa dalam proses fotosintesis didominasi oleh fitoplankton.
molekul O2 yang dibebaskan selama fotosintesis PQ adalah quotient fotosintetik = ---
molekul CO2 yang diasimilasikan molekul CO2 yang dilepas selama respirasi RQ adalah quotient respirasi = ---
molekul O2 yang dikonsumsi
Nilai PQ dan RQ untuk masing-masing jenis fitoplankton berbeda-beda. Rata-rata nilai PQ dan RQ untuk semua jenis fitoplankton adalah PQ = 1,2 dan RQ = 1,0 dengan asumsi bahwa aktivitas metabolisme sebagian besar disebabkan oleh komunitas fitoplankton. Produktivitas sebagai laju produksi, secara umum dilaporkan dalam satuan gram C per meter persegi per hari. Produksi kotor atau bersih dihitung untuk setiap kedalaman.
= mg C/m2 = mg O
2/liter x 12 x 1000 32
Produktivitas satu meter persegi kolom air ditentukan oleh potongan dari setiap pencahayaan kedalaman dan secara grafik dengan.mengintegrasikan area menurut kurva produktivitasnya.
Analisis Data Analisis Deskriptif
Gambaran mengenai struktur komunitas dan kelimpahan fitoplankton dan populasi fitoplankton disajikan dalam bentuk tabel. Demikian pula dengan konsentrasi nitrogen, fosfor serta beberapa parameter fisika-kimia air lainnya. Rataan dan hasil pengukurannya disajikan dalam satu tabel dan grafik.
Analisis Statistik
Untuk mengetahui hubungan fungsional atau keterkaitan antara unsur hara dengan kelimpahan fitoplankton dan produktivitas primer antar stasiun pengamatan, dilakukan analisis korelasi dan regresi linier berganda (Steele dan Torrie 1980).
Analisis data dilakukan secara komputerisasi dengan menggunakan program MINITAB versi 14 dan Microsoft office excel 2003. Sebagai peubah bebas, kualitas kimia air (Xi) dan sebagai peubah terikat, kelimpahan dan produktivitas primer fitoplankton (Yi). Persamaan fungsi regresinya adalah sebagai berikut:
Yi = ß0 + ß 1 X1 + ß 2 X2i + …..+ ß n Xn + €i Sebagai penduganya
Y = b0 + b1 X1 + b2 X2 + …… + bn Xn
Keterangan : Y = Kelimpahan/produktivitas primer fitoplankton. X1, X2, X3 = Peubah-peubah bebas (Fe, N (NO2-N, NO3-N,
NH3-N) dan PO4-P) b0 = Interseps b1, b2, b3 = Koefisien regresi
Selanjutnya dilakukan telaah dengan sidik ragam regresi, kemudian untuk mengetahui faktor-faktor yang memberikan pengaruh, maka dilakukan uji terhadap nilai koefisien regresi (ß) dari masing-masing peubah yang mempengaruhi dengan menggunakan hipotesis sebagai berikut :
H0 : ß1 = ß2 = 0 tidak ada pengaruh linier antara Fe, nitrogen (nitrat, nitrit, ammonium) dan ortofosfat dengan kelimpahan dan produktivitas primer fitoplankton
H0 : ß1 ≠ ß2 ≠ 0 ada pengaruh linier antara Fe, nitrogen (nitrat, nitrit, ammonium) dan ortofosfat dengan kelimpahan dan produktivitas primer fitoplankton
Jika F-hitung lebih besar dari t-tabel berarti tolak H0 dan terima H1, sebaliknya jika F-hitung lebih kecil dari t-tabel berarti terima H0 dan tolak H1.
Nilai koefisien determinasi (R2) digunakan untuk mengetahui besarnya peranan dari peubah X terhadap Y, nilai R2 berkisar antara 0,0 – 1,0. Jika nilainya lebih besar dari 0,5 atau mendekati 1,0, maka dapat diartikan bahwa X memiliki peranan yang besar terhadap Y.
Fitoplankton membutuhkan unsur hara makro dan mikro untuk mendukung pertumbuhannya. Besi (Fe) sebagai salah satu unsur hara mikro dalam jumlah kecil berperan dalam sistem enzim dan transfer elektron pada proses sintesis pada alga, namun dalam jumlah berlebihan dapat menghambat fiksasi unsur lainnya. Besi oksida akan menyerap fosfor dan menjebaknya dalam sedimen sehingga menyebabkan terbatasnya ketersediaan fosfor di air (Glass 1997). Besi juga mempengaruhi kemampuan organisme untuk mengasimilasi nitrat, baik sebagai co-faktor yang berkaitan dengan enzim atau reduktan (Robert et al. 2004). Sebaliknya, nitrogen dan fosfor merupakan unsur hara makro utama yang paling dibutuhkan sehingga sering menjadi faktor pembatas. Unsur hara nitrogen yang dibutuhkan fitoplankton adalah NO2-N, NO3-N, dan NH3-N, sedangkan fosfor dalam bentuk
ortofosfat (PO4-P). Unsur hara yang diperoleh selama pengamatan pada tiga stasiun
dapat dilihat pada Tabel 2.
Total Fe
Konsentrasi Fe tertinggi (dalam bentuk total Fe) yang diperoleh dari tiga stasiun pengamatan terdapat pada stasiun I periode 6 yaitu 0,902 mg/l, sedangkan terendah terdapat pada stasiun II periode 3 yaitu sebesar 0,024 mg/l. Hasil rataan pengukuran total Fe antara ketiga stasiun pengamatan tertinggi pada stasiun I yaitu 0,413 mg/l dan terendah pada stasiun II yaitu 0,268 mg/l (Tabel 2). Kisaran nilai ini hampir sama bila dibandingkan dengan hasil penelitian yang dilakukan oleh Badri (2004) di Dabo Singkep dengan nilai total Fe berkisar 0,12 – 0,50 mg/l.
Jika dicermati pola Fe pada tiga stasiun pengamatan menunjukkan karakter yang relatif berbeda. Konsentrasi total Fe pada kolong tertutup (stasiun I) cenderung lebih besar dibandingkan dengan kolong terbuka (stasiun II dan III). Hal ini diduga erat kaitannya dengan tingginya konsentrasi Fe terlarut (Fe2+). Konsentrasi Fe terlarut tinggi adalah akibat rendahnya alkalinitas pada stasiun I (4,078 mg/l) bila
dibandingkan dengan stasiun II (18,320 mg/l) dan stasiun III (10,745 mg/l) (Lampiran 4). Pada daerah yang selalu tergenang, senyawa Fe biasanya dalam bentuk terlarut (Fe2+) (Hardjowigeno 2003). Lebih lanjut dijelaskan Wetzel (2001) bahwa air dengan konsentrasi bicarbonat sangat rendah (soft water) umumnya mengandung konsentrasi Fe2+ lebih tinggi. Fe2+ memberi kontribusi besar terhadap Fe terlarut pada danau dimana oksidasi ulang Fe2+ terjadi saat Cl- dan SO4- lebih
sedikit dan kontribusi hidroksi terhadap oksidasi Fe2+ proporsional dengan [OH-]2 (MacKay et al. 2004).
Tabel 2 Kandungan total Fe, nitrogen, dan fosfor per periode di tiga kolong Kecamatan Pemali Kabupaten Bangka
Nitrogen (mg/l) Stasiun Periode (ulangan ke-) Fe (mg/l) NO 2-N NO3-N NH3-N DIN PO4-P (mg/l) 1 0,121 0,010 0,043 0,015 0,068 0,044 2 0,244 0,195 0,016 0,037 0,249 0,263 3 0,341 0,022 0,135 0,027 0,184 0,170 4 0,456 0,010 0,089 0,014 0,113 0,125 5 0,411 0,000 0,631 0,012 0,643 0,350 I 6 0,902 0,027 0,342 0,004 0,373 0,153 Rataan 0,413 0,044 0,209 0,018 0,272 0,184 1 0,141 0,002 0,013 0,006 0,021 0,204 2 0,248 0,049 0,046 0,053 0,148 0,131 3 0,024 0,009 0,099 0,028 0,136 0,220 4 0,439 0,005 0,082 0,000 0,087 0,326 5 0,487 0,024 0,237 0,014 0,274 0,041 II 6 0,268 0,086 0,196 0,009 0,291 0,074 Rataan 0,268 0,029 0,112 0,018 0,160 0,166 1 0,146 0,010 0,013 0,004 0,027 0,023 2 0,251 0,195 0,013 0,053 0,261 0,841 3 0,390 0,018 0,105 0,039 0,162 0,520 4 0,317 0,008 0,053 0,021 0,081 0,213 5 0,215 0,032 0,152 0,031 0,214 0,815 III 6 0,381 0,081 0,359 0,012 0,452 0,217 Rataan 0,283 0,057 0,116 0,027 0,200 0,438
DIN (Dissolved Inorganic Nitrogen)
Nitrogen inorganik terlarut di perairan terdiri dari nitrit-nitrogen (NO2-N),
nitrat-nitrogen (NO3-N), dan amomonia-nitrogen (NH3-N). Konsentrasi DIN yang
diperoleh dari ketiga stasiun pengamatan tertinggi terdapat pada stasiun I periode 5 yaitu 0,643 mg/l, sedangkan terendah terjadi pada stasiun II periode yaitu 0,021 mg/l. Hasil rataan pengukuran DIN antara ketiga stasiun pengamatan berkisar antara 0,160 – 0,272 mg/l. Tertinggi pada stasiun I yaitu sekitar 0,272 mg/l dan terendah pada stasiun II yaitu 0,160 mg/l (Tabel 2). Tingginya nilai DIN ini diduga karena adanya sumbangan yang besar dari nitrat (NO3-N) sebagai salah satu penyusun DIN.
Kelarutan NO3-N merupakan penyumbang utama masuknya nitrogen pada badan air
tawar (Mason 1980). Lebih lanjut dijelaskan bahwa ada korelasi antara penggunaan pupuk N dengan konsentrasi rataan tahunan N pada sungai.
Konsentrasi rataan DIN yang bervariasi selama pengamatan di ketiga stasiun (I, II dan III) diduga terjadi karena ketiga kolong memiliki karakter yang berbeda. Stasiun I merupakan kolong berusia lebih dari 10 tahun dan tertutup (tidak memiliki inlet dan outlet) sehingga bahan organik dan inorganik banyak yang tertahan; stasiun II merupakan kolong berusia kurang dari 10 tahun dan terbuka (memiliki inlet dan outlet) serta stasiun III adalah kolong berusia lebih dari 10 tahun dan terbuka. Kondisi ini diduga menyebabkan unsur hara yang terdapat pada stasiun II dan III ikut keluar seiring dengan keluarnya air kolong. Hal ini terlihat dari nilai DIN yang jumlah konsentrasinya lebih kecil dibandingkan dengan konsentrasi total DIN pada stasiun I.
Nitrogen Nitrit (NO2-N)
Konsentrasi nitrogen nitrit (NO2-N) yang diperoleh dari ketiga stasiun
pengamatan tertinggi terjadi pada stasiun I periode 2 dan stasiun III periode 2 yaitu 0,195 mg/l, sedangkan terendah terjadi pada stasiun I periode 5 sebesar 0,000 mg/l. Sedangkan hasil rataan pengukuran NO2-N antara ketiga stasiun pengamatan berkisar
0,029 – 0,057 mg/l. Tertinggi pada stasiun III yaitu sekitar 0,057 mg/l dan terendah pada stasiun II yaitu 0,029 mg/l (Tabel 2).
Jika dicermati pola NO2-N pada tiga stasiun pengamatan menunjukkan karakter
yang relatif berbeda. Konsentrasi NO2-N pada kolong tua (stasiun I dan III)
cenderung lebih besar dibandingkan dengan kolong muda (stasiun II).
Nitrogen Nitrat (NO3-N)
Konsentrasi nitrogen nitrat (NO3-N) yang diperoleh dari ketiga stasiun
pengamatan tertinggi terjadi pada stasiun I periode 5 yaitu 0,631 mg/l, sedangkan terendah terjadi pada stasiun II periode 1 dan III periode 1 dan periode 2 yaitu sebesar 0,013 mg/l. Sedangkan hasil rataan pengukuran NH3-N antara ketiga stasiun
pengamatan berkisar antara 0,112 – 0,209 mg/l. Tertinggi pada stasiun I yaitu sekitar 0,209 mg/l dan terendah pada stasiun II yaitu 0,112 mg/l (Tabel 2).
Jika dicermati pola NO3-N pada tiga stasiun pengamatan menunjukkan karakter
yang relatif berbeda. Konsentrasi NO3-N pada kolong tertutup (stasiun I) cenderung
lebih besar dibandingkan dengan kolong terbuka (stasiun II dan III). Hal ini diduga perairan kolong tersebut juga mendapatkan input nitrat dari dari tanah pertanian, air tanah, dan limbah (Reynold 1984).
Nitrogen Ammonia (NH3-N)
Konsentrasi NH3-N yang diperoleh dari ketiga stasiun pengamatan tertinggi
terjadi pada stasiun II periode 2 dan stasiun III periode 2 yaitu 0,053 mg/l, sedangkan terendah terjadi pada stasiun II periode 4 yaitu 0,000 mg/l. Hasil rataan pengukuran NH3-N antara ketiga stasiun pengamatan berkisar 0,018 – 0,027 mg/l. Tertinggi pada
stasiun III yaitu sekitar 0,027 mg/l dan terendah pada stasiun I dan II yaitu 0,018 mg/l (Tabel 2).
Jika dicermati pola NH3-N pada tiga stasiun pengamatan menunjukkan karakter
yang relatif berbeda. Konsentrasi NH3-N pada kolong tua dan terbuka (stasiun III)
cenderung lebih besar dibandingkan dengan kolong muda yang terbuka (stasiun II) atau dengan kolong tua tertutup (stasiun I).
Ortofosfat (PO4-P)
Konsentrasi PO4-P yang diperoleh dari ketiga stasiun pengamatan tertinggi
terjadi pada stasiun III periode 2 yaitu 0,841 mg/l, sedangkan terendah terjadi pada stasiun III sebesar 0,023 mg/l. Sedangkan hasil rataan pengukuran PO4-P antara
ketiga stasiun pengamatan berkisar antara 0,166 – 0,438 mg/l. Tertinggi pada stasiun III yaitu 0,438 mg/l dan terendah pada stasiun II yaitu 0,166 mg/l (Tabel 2).
Jika dicermati pola PO4-P pada tiga stasiun pengamatan menunjukkan karakter
yang relatif berbeda. Konsentrasi PO4-P pada kolong tua dan terbuka (stasiun III)
cenderung lebih besar dibandingkan dengan kolong muda terbuka (stasiun II) atau atau dengan kolong tua tertutup (stasiun I).
Secara umum, konsentrasi rataan ortofosfat yang ditemukan di tiga stasiun menunjukkan karakteristik yang kontradiksi dengan konsentrasi rataan NO3-N,
karena saat konsentrasi ortofosfat tinggi, konsentrasi NO3-N rendah. Hal ini diduga
karena total Fe yang cukup tinggi berpengaruh terhadap konsentrasi ortofosfat pada stasiun I. Holtz et al. (1996) membuktikan pada percobaan di laboratorium bahwa penambahan Fe sulfat efektif menurunkan total fosfat 42 sampai 61%. Lebih lanjut dijelaskan bahwa Fe akan menjebak fosfat dalam bentuk floc dan mengendap pada sedimen perairan. Fe(OH)3 terlarut pada kolom air akan menyerap P dan
menjebaknya pada sedimen (Glass 1997). Rasio Fe : P diharapkan dapat menjelaskan hubungan Fe dengan P. Rasio rataan Fe : P yang didapat selama pengamatan adalah stasiun I > 2 (2,24), stasiun II < 2 (1,62) dan stasiun III < 2 (0,65). Pada oksidasi hidrolisis Fe dan presipitasi fosfat, minimum dibutuhkan 2 atom Fe untuk mengikat 1 molekul fosfat (Fe : P = 2). Sebagian besar danau memiliki rasio Fe : P > 2, bila Fe : P > 2 maka fosfat terlarut akan terikat dalam bentuk partikel (Blomqvist et al. 2004).
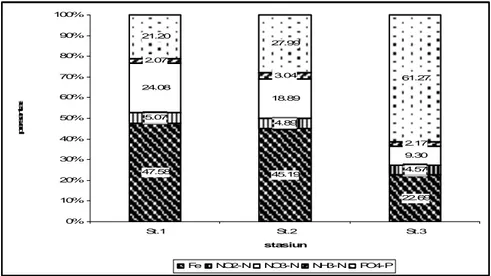
Mencermati hasil yang diperoleh dari rataan DIN (NO2-N, NO3-N, dan NH3-N)
dan ortofosfat, konsentrasi tertinggi rataan DIN terjadi di stasiun I, sedangkan ortofosfat terjadi di stasiun III (Gambar 6). Sebenarnya pada stasiun I yang merupakan kolong tua dan tidak berhubungan, diharapkan unsur DIN dan ortofosfat akan lebih tinggi dibanding stasiun II dan III, karena padatan tersuspensi yang masuk
ke perairan kolong tersebut cukup tinggi akibat masukan bahan organik dan inorganik dari daratan dan tertahan. Namun, kenyataannya terjadi kontradiksi karena pada stasiun ini diperoleh konsentrasi ortofosfat relatif kecil. Hal ini diduga karena adanya pengaruh konsentrasi total Fe yang cukup tinggi. Keadaan ini sejalan dengan kelimpahan sel dan keragaman fitoplankton yang ditemukan, dimana tertinggi terjadi pada stasiun I. Meningkatnya DIN pada stasiun I diduga adanya pengaruh dari beberapa faktor lingkungan seperti pH dan kandungan bahan organik relatif lebih tinggi dari stasiun lainnya (Lampiran 3). Goldman dan Horne (1983) mengemukakan ketersediaan ortofosfat di perairan ditentukan oleh beberapa faktor lingkungan antara lain alkalinitas, pH dan kandungan bahan organik.
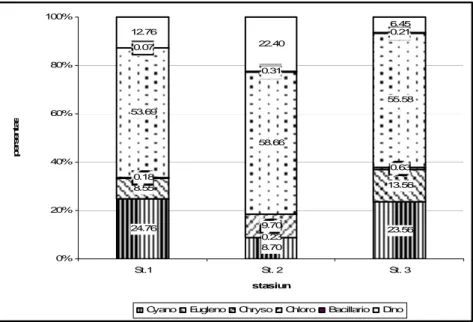
47.58 45.19 22.69 5.07 4.89 4.57 24.08 18.89 9.30 2.07 3.04 2.17 21.20 27.99 61.27 0% 10% 20% 30% 40% 50% 60% 70% 80% 90% 100% St.1 St.2 St.3 stasiun p e rs e n ta s e
Fe NO2-N NO3-N NH3-N PO4-P
Gambar 6 Komposisi Fe, nitrogen dan fosfor pada tiga kolong di Kecamatan Pemali Kabupaten Bangka
Konsentrasi unsur hara N-P yang ditemukan di lokasi penelitian secara umum cukup tinggi. Dikemukakan Seller dan Markland (1987), konsentrasi nitrogen dan fosfor yang melebihi kandungan 0,01 ppm untuk fosfor dan 0,3 ppm untuk nitrogen akan menyebabkan terjadinya blooming fitoplankton. Unsur hara NO3-N yang
ditemukan umumnya lebih tinggi dari NO2-N dan NH3-N, hal ini karena NO3-N lebih
banyak dijumpai baik dalam kondisi aerob dan diserap fitoplankton dari pada NO2-N
dan NH3-N. Nitrat merupakan nitrogen utama di perairan dan merupakan unsur hara
sering menjadi faktor pendorong terjadinya dominasi fitoplankton. Dalam penelitian ini kandungan fosfor cukup tinggi, dan terjadi dominasi fitoplankton terutama dari kelas Chlorophyceae.
Rasio N dan P
Rasio nitrogen dan fosfor juga merupakan salah satu faktor yang menentukan dominansi fitoplankton di suatu perairan selain konsentrasi unsur hara tersebut. Rasio massa nitrogen meliputi: NO2-N, NO3-N, dan NH3-N serta PO4-P. NO2-N
merupakan bentuk peralihan dari NH3-N dan NO3-N, sedangkan NO3-N merupakan
nitrogen utama di perairan dan merupakan unsur hara utama bagi pertumbuhan fitoplankton dan alga lainnya. NH4-N adalah hasil akhir dari proses nitrifikasi
(denitrifikasi). Sedangkan fosfat dalam bentuk ortofosfat di perairan digunakan untuk pertumbuhan fitoplankton, karena sering menjadi faktor pembatas di perairan. Rasio N : P yang diperoleh pada tiga stasiun terlihat pada Tabel 3.
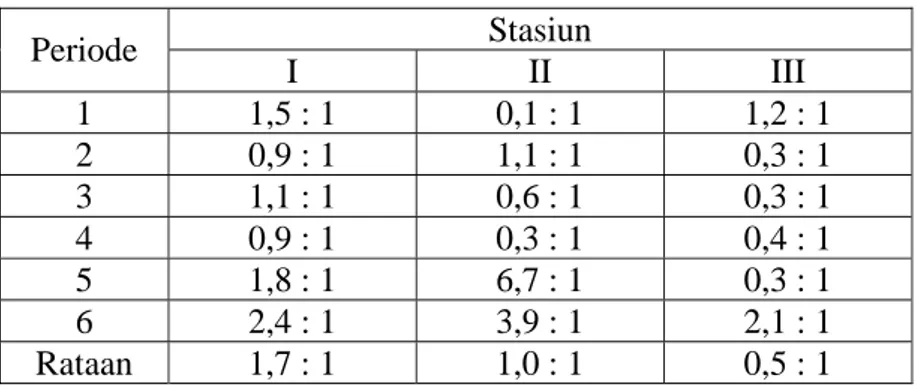
Tabel 3 Rasio massa nitrogen dan fosfor perperiode di tiga kolong Kecamatan Pemali Kabupaten Bangka
Stasiun Periode I II III 1 1,5 : 1 0,1 : 1 1,2 : 1 2 0,9 : 1 1,1 : 1 0,3 : 1 3 1,1 : 1 0,6 : 1 0,3 : 1 4 0,9 : 1 0,3 : 1 0,4 : 1 5 1,8 : 1 6,7 : 1 0,3 : 1 6 2,4 : 1 3,9 : 1 2,1 : 1 Rataan 1,7 : 1 1,0 : 1 0,5 : 1
Rasio N : P pada ketiga stasiun pengamatan dengan enam kali ulangan umumnya relatif sama (Tabel 3), kecuali pada stasiun II periode 5 yaitu dengan rasio 6,7 N : 1 P. Berdasarkan hasil pengamatan rataan rasio N : P tertinggi pada stasiun I yaitu 1,7 N : 1 P dan terendah terjadi pada stasiun III yaitu 0,5 N : 1 P.
Jika dicermati rasio N : P yang ditemukan selama penelitian sangat kecil (< 16). Hal ini disebabkan adanya penambahan unsur hara nitrogen dan fosfor yang
berlebihan dan tidak seimbang di perairan, terutama kandungan ortofosfat yang diperoleh sangat tinggi. Selain itu juga mungkin adanya pemanfaatan nitrogen yang besar oleh fitoplankton. Grahame (1987) mengemukakan, rasio antara nitrogen dan fosfor yang diperlukan berkisar antara 10 : 1 sampai 20 : 1 dan penambahan nitrogen dapat meningkatkan alga. Selanjutnya dijelaskan Person et al. (1977) dan Mason (1980) bahwa bila N : P lebih rendah atau lebih tinggi dari 16 : 1 menyebabkan perubahan tipe produsen.
Rasio N : P yang ditemukan di perairan kolong selama penelitian semuanya lebih kecil dari 16 (<16), tetapi nilai konsentrasi nitrogen yang ditemukan selama penelitian cukup tinggi, sehingga memungkinkan rasio N : P di perairan ini tidak terlalu berpengaruh terhadap kelimpahan fitoplankton. Keadaan ini juga menunjukkan bahwa kelimpahan fitoplankton yang ditemukan selama penelitian cukup tinggi tetapi tidak sampai melimpah (blooming). Akan tetapi ada jenis fitoplankton tertentu yang banyak dijumpai dan mendominasi selama penelitian yaitu dari jenis Clorophyceae. Berdasarkan nilai rasio yang didapat, nitrogen merupakan faktor pembatas perairan kolong, sedangkan ortofosfat bukan merupakan faktor pembatas karena rata-rata nilai yang diperoleh tinggi.
Hubungan Total Fe dengan DIN dan PO4-P
Untuk melihat seberapa jauh tingkat keeratan hubungan linier yang terjadi antara DIN dan PO4-P dengan total Fe, maka dilakukan analisis koefisien korelasi
Pearson. Berdasarkan hasil uji korelasi tersebut, terdapat korelasi yang cukup erat dan signifikan antara DIN dan PO4-P pada stasiun I (84,2%; p<5%) dan stasiun III
(98,4%;p<5%), sedangkan pada stasiun II (-79,7%;p>5%) korelasinya cukup erat tapi kurang signifikan (Lampiran 6).
Korelasi yang cukup erat antara DIN dan PO4-P pada ketiga stasiun diduga
karena nitrogen dan fosfor merupakan unsur utama untuk pertumbuhan fitoplankton. Fitoplankton dalam pertumbuhannya membutuhkan unsur hara makro (C, H, O, N, S, P, Mg, Ca, Na dan Cl) dan unsur hara mikro (Fe, Mn, Cu, Zn, Si, Mo, V dan Co
(Reynolds 1984). Diantara unsur hara tersebut, unsur hara N dan P biasanya sering menjadi faktor pembatas pertumbuhan fitoplankton di perairan alami.
Dari fungsi regresi regresi linier berganda didapat nilai R2 pada stasiun I, II dan III (38,6%; 19,7%; 26,7%) cukup kecil artinya kemampuan peubah DIN dan PO4-P
untuk menduga konsentrasi Fe cukup kecil. N dan P memiliki sifat yang berbeda, dimana anion nitrat akan tercuci bila tidak terpakai oleh tanaman, sedangkan P akan diendapkan oleh Fe3+, Ca dan Al yang kemudian dilepas secara perlahan (Mason 1980). Hasil analisis sidik ragam stasiun I, II dan III menunjukkan bahwa konsentrasi DIN dan PO4-P tersebut tidak secara nyata mempengaruhi konsentrasi
total Fe (P>0,05). Hal ini diduga ada pengaruh rendahnya alkalinitas yang didapat selama pengamatan (<40 mg/l). Air dengan konsentrasi bicarbonat sangat rendah (soft water) umumnya mengandung konsentrasi Fe2+ lebih tinggi (Wetzel 2001) dan sering terjadi perubahan pH (Effendi 2003).
Struktur Komunitas Fitoplankton
Komposisi Jenis Fitoplankton
Berdasarkan hasil pengamatan, fitoplankton yang ditemukan di tiga perairan kolong adalah sebanyak 25 genera yang mewakili 6 kelas, yaitu Cyanophyceae 3 genera (12%), Euglenophyceae 2 genera (8%), Crysophyceae 1 genera (4%), Chlorophyceae 16 genera (64%), Bacillariophyceae 2 genera (8%), dan Dinophyceae 1 genera (4%). Komposisi fitoplankton ini tersebar di tiga stasiun pengamatan, yaitu: sebanyak 13 genera dari 6 kelas pada stasiun I, 10 genera dari 6 kelas pada stasiun II dan 15 genera dari 6 kelas pada stasiun III. (Tabel 4; Lampiran 3). Tetapi berdasarkan jumlah kelimpahan individu per genera terbanyak adalah dari kelas Chlorophyceae. Reynolds (1984) menyatakan bahwa saat konsentrasi P menurun, Diatom, Dinophyceae, dan Chlorophyceae akan terbantu, sedangkan Cynophyceae akan menurun.
Welch dan Lindell (1980) menyatakan komposisi jenis fitoplankton yang umum dijumpai pada perairan tawar terdiri dari lima kelompok besar yaitu fillum Cyanophyta, Chlorophyta, Chrysophyta, Pyrrophyta, dan Euglenophyta. Kelas
Chlorophyceae dan Cyanophyceae merupakan jenis yang paling dominan di perairan tawar tergenang. Komunitas fitoplankton perairan tergenang (khususnya perairan tawar seperti danau, waduk dan kolam) cenderung didominasi oleh genera-genera fitoplankton dari kelas Chlorophyceae dan Cyanophyceae (Seller dan Markland 1987).
Tabel 4 Jumlah genera fitoplankton per periode di tiga kolong Kecamatan Pemali Kabupaten Bangka
Kelas Fitoplanton Stasiun Periode Cyano
phyceae Eugleno phyceae Cryso phyceae Chloro phyceae Bacillario phyceae Dino phyceae I 1 2 3 4 5 6 3 2 2 1 1 2 1 1 1 1 1 1 1 0 0 0 1 0 6 4 4 7 5 4 1 1 0 0 0 0 1 1 1 1 1 1 Subtotal 11 6 2 30 2 6 II 1 2 3 4 5 6 1 1 0 1 1 0 0 0 1 1 0 0 1 1 1 1 1 1 6 4 2 5 4 2 1 0 0 1 0 0 1 1 1 1 1 1 Subtotal 4 2 6 23 3 6 III 1 2 3 4 5 6 3 2 0 1 1 1 2 1 1 1 1 1 1 0 0 0 1 1 7 6 6 4 7 6 1 2 1 1 1 2 1 1 1 1 1 1 Subtotal 8 7 3 36 8 6 Total 23 15 11 89 13 18
Tabel 4 memperlihatkan perbedaan komunitas fitoplankton antar stasiun, dan spesies yang teridentifikasi tertinggi selama enam periode terjadi pada stasiun III. Hal ini diduga karena stasiun III merupakan kolong tua dan bersifat terbuka menerima masukan air dari anak sungai dan rawa yang diduga ikut juga membawa jenis fitoplankton tertentu sehingga memungkinkan di stasiun ini komposisi spesiesnya relatif tinggi. Selain itu, konsentrasi rataan PO4-P tertinggi yang