ISNA RAHMADINI
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2012
© Hak Cipta milik IPB, tahun 2012 Hak Cipta dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tidak merugikan kepentingan yang wajar IPB.
Dilarang mengumumkan dan memperbanyak sebagian atau seluruh karya tulis dalam bentuk apapun tanpa izin IPB.
Dengan ini saya menyatakan bahwa Tesis Pemurnian dan Karakterisasi Enzim Selulase dari Bakteri yang Diisolasi dari Limbah Rumput Laut adalah karya saya sendiri yang merupakan bagian dari penelitian kelompok peneliti Bioteknologi BBP4BKP tahun anggaran 2010/2011 dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau kutipan dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, Mei 2012
Isna Rahmadini NIM P051090191
Bacteria Isolated from Seaweed Waste. Under direction of NISA RACHMANIA MUBARIK and EKOWATI CHASANAH.
Seaweedwasteis a sourceof bacteria thatcanproduce cellulaseenzyme. PMP0126yisolateis one collection isolateof the Research and Development Center for Marine and Fisheries Product Proecessing and Biotechnology Agency for Marine and Fisheries Research and Development Ministry of Marine Affairs and Fisheries obtainedfromseaweed wastefrom Pameungpeukarea, Garut, West Java. The aims this research were to purify, characterize the cellulase enzyme, and identify the bacteria producing the enzyme using 16S-rRNA. PMP 0126yisolatewasa Gram-negativeshortrodshape bacteria. Based on thesequencingof the 16S-rRNA genfrom 1282base pairPMP0126y isolate had96%similaritywith Chryseobacteriumindologenesstrain McR-1. Theisolate had 1.9 cellulolytic index onCarboxymethyl Cellulose(CMC) agar medium. The highestcellulaseactivityobtained onthe thirdday offermentation timewith acellulaseactivityof0.108U/mLandspecificactivityof0.120U/mg.
Initialpurificationof cellulasebyultrafiltrationproducedactivityof0.112U/mL. Purificationthe enzyme byanionexchange chromatographyproducedthe highestpeak of proteininthefraction no. 48withcellulaseactivityof0.154U/mLat 37.3mMNaCl.Optimumactivity ofthe cellulaseenzymeafterultrafiltrationwaspH 5and300C,while optimumactivity ofthe cellulaseenzymebyanionexchange chromatographywaspH 5and400C. At 300C, the enzymeremainedstableup to4hourincubation.Theactivity ofthe cellulasewasincreasedbyaddition ofCaCl2ions
by 53%anddecreased bythe additionof ZnCl2 ions by 78%. Thecellulase showed
the highest activity i.e. 0.149U/mL using treated seaweed wasteGlacilariasp. as substrate. Using SDS-PAGE and zimogram analysis, the molecular weight of the cellulase was estimated to be 39 kDa, 30 kDa, and 14 kDa.
yang Diisolasi dari Limbah Rumput Laut. Dibimbing oleh Nisa Rachmania Mubarik dan Ekowati Chasanah.
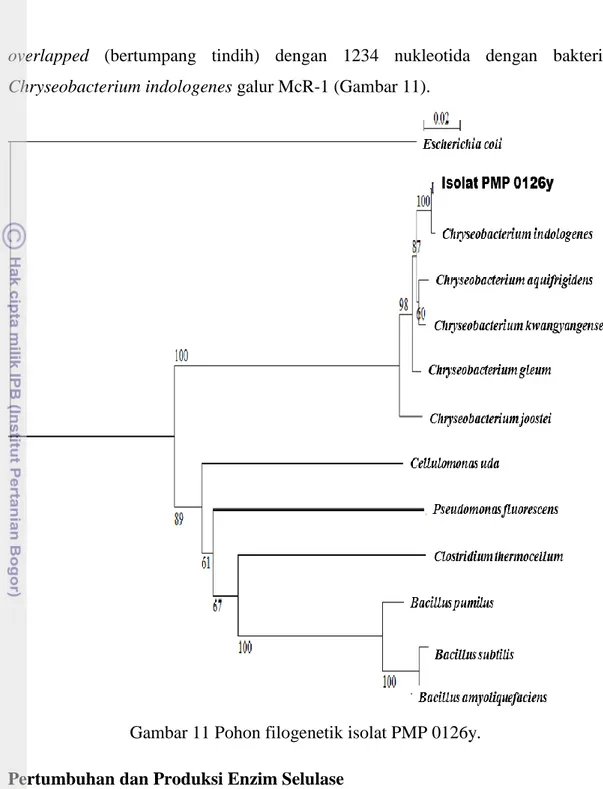
Limbah pengolahan rumput laut merupakan salah satu sumber bakteri yang dapat menghasilkan enzim selulase. Industri pengolahan agar-agar dari rumput laut Glacilaria sp. di daerah Pemeungpeuk Garut, Jawa Barat merupakan sumber isolat PMP 0126y yang mampu menghasilkan enzim selulase. Isolat ini merupakan koleksi BBP4BKP yang dapat tumbuh baik pada suhu 37 0C. Hasil pewarnaan Gram isolat PMP 0126y bersifat Gram negatif dengan bentuk batang pendek. Berdasarkan hasil sekuensing gen penyandi16S-rRNA dari 1282 pasang basa, isolat PMP 0126y memiliki kemiripan sebesar 96% dengan bakteri Chryseobacterium indologenes galur McR-1.
Uji kualitatif dilakukan dengan mengukur indeks selulolitik yang dihasilkan oleh bakteri pada media agar-agar yang mengandung Carboxymethyl Cellulose (CMC). Indeks selulolitik yang dihasilkan oleh isolat PMP 0126y pada media agar-agar CMC 1% sebesar 1,9 pada hari kelima dengan suhu inkubasi 37 0C. Uji kuantitatif yang dilakukan terhadap selulase yang dihasilkan oleh isolat PMP 0126y menghasilkan aktivitas selulase tertinggi pada hari ketiga produksi dengan aktivitas selulase sebesar 0,108 U/ml dan aktivitas spesifik sebesar 0,120 U/ml.
Enzim selulase dipekatkan dengan melakukan pengendapan amonium sulfat dan ultrafiltrasi. Persentase amonium sulfat yang terbaik dihasilkan pada 50% amonium sulfat dengan aktivitas selulase yang diperoleh sebesar 0,072 U/ml dan aktvitas spesifik 0,128 U/mg pada endapan. Pemekatan dengan ultrafiltasi menghasilkan aktivitas selulase sebesar 0,112 U/ml dan aktivitas spesifik 0,136 U/mg. Pemurnian selanjutnya dilakukan dengan kromatografi penukar anion (KPA) yang menghasilkan puncak tertinggi pada fraksi ke-48 dengan aktivitas selulase sebesar 0,154 U/ml ketika dielusi dengan NaCl sebesar 37,3 mM. Pra pemurnian enzim selulase dengan ultrafiltrasi menghasilkan rendemen sebesar 17,5% dengan tingkat kemurnian 15,82 kali. Enzim hasil pemurnian dengan KPA menghasilkan rendemen sebesar 19,6% dengan tingkat kemurnian sebesar 15,08 kali. Hasil SDS-PAGE dan zimogram menunjukkan ada tiga protein enzim selulase dari isolat PMP 0126y pada berat molekul yaitu 39 kDa, 30 kDa, dan 14 kDa.
Aktivitas optimum enzim selulase PMP 0126y hasil ultrafiltrasi tertinggi pada bufer sitrat fosfat pH 5 dan suhu 30 0C. Enzim tetap stabil selama 4 jam inkubasi pada suhu 30 0C. Aktivitas relatif tertinggi enzim selulase meningkat dengan penambahan logam CaCl2 sebesar 53% dan menurun pada penambahan
logam ZnCl2 sebesar 78%. Aktivitas enzim selulase tertinggi pada substrat limbah
pengolahan rumput laut Pameungpeuk yang telah didelignifikasi dengan NaOH 6% sebesar 0,149 U/ml.
ISNA RAHMADINI
Tesis
Sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Program StudiBioteknologi
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2012
NIM : P051090191
Disetujui Komisi Pembimbing
Dr. Nisa Rachmania Mubarik, M.Si. Ketua
Dr. Ekowati Chasanah, M.Sc. Anggota
Diketahui
Ketua Program Studi Bioteknologi
Prof. Dr. Ir. Suharsono, DEA.
Dekan Sekolah Pascasarjana
Dr. Ir. Dahrul Syah, M.Sc.
Penulis dilahirkan di Lahat pada tanggal 19 April 1988 dari Ayah H. Hardi Bustanuddin dan Ibu Hj. Muchlisa. Penulis merupakan anak kelima dari lima bersaudara.
Tahun 2005 penulis lulus dari SMA Negeri 2 Lahat dan masuk seleksi PBUD di Universitas Riau pada Program Studi Teknologi Hasil Perikanan (THP) dan berhasil menyelesaikan kuliah pada tahun 2009. Pada tahun yang sama, penulis melanjutkan sekolah dan masuk ke dalam Mayor Multidisiplin, Program Studi Bioteknologi, IPB.
Penulis melaksanakan penelitian di Balai Besar Penelitian dan Pengembangan Pengolahan Produk dan Bioteknologi Kelautan dan Perikanan (BBP4BKP) dan berhasil menyelesaikan penelitian dengan judul tesis Pemurnian dan Karakterisasi Enzim Selulase dari Bakteri yang Diisolasi dari Limbah Rumput Laut.
Puji syukur Alhamdulillah penulis panjatkan kepada Allah SWT atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Februari 2011 ini ialah enzim selulase, dengan judul Pemurnian dan Karakterisasi Enzim Selulase dari Bakteri yang Diisolasi dari Limbah Rumput Laut.
Penulis mengucapkan terima kasih dan penghargaan yang tinggi kepada Ibu Dr. Nisa Rachmania Mubarik, M.Si. selaku ketua komisi pembimbing yang telah memberikan bimbingan dan perhatian penuh dalam penulisan tesis. Ucapan terima kasih dan penghargaan yang tinggi juga kepada Ibu Dr. Ekowati Chasanah, M.Sc. selaku anggota komisi pembimbing yang telah memberikan kesempatan kepada penulis untuk melakukan penelitian dan bimbingan selama penelitian, serta kepada Ibu Ir. Yusro Nuri Fawzya, M.Si. yang telah banyak memberikan saran dan bimbingan selama penelitian. Tidak lupa penulis mengucapkan terima kasih banyak kepada Ibu Prof. Dr. Anja Meryandini, M.S. sebagai penguji ujian tesis dan Bapak Prof. Dr. Ir. Suharsono, DEA. sebagai ketua Program Studi Bioteknologi yang telah memberikan saran dan masukan terhadap penulisan demi kesempurnaan tesis ini. Di samping itu, penulis menyampaikan terima kasih kepada Balai Besar Penelitian Pengembangan Pengolahan Produk dan Bioteknologi Kelautan dan Perikanan (BBP4BKP) yang telah membiayai dan memberikan segala fasilitas kepada penulis untuk melakukan penelitian di Laboratorium Bioteknologi dan Mikrobiologi BBP4BKP Petamburan, Jakarta Pusat.
Ucapan terima kasih yang sangat mendalam kepada Papa tersayang H. Hardi Bustanuddin dan Mama tersayang Hj. Muchlisa atas doa dan kasih sayang tulus yang tidak hentinya kepada penulis. Kepada saudaraku Uni Neci, Uni Neva, Uni Nani, Kakak Aden, dan semua kakak ipar serta seluruh keponakanku yang telah memberikan semangat dan doa kepada penulis selama kuliah sehingga dapat menyelesaikan sekolah di Institut Pertanian Bogor. Rasa terima kasih kepada rekan-rekan di Laboratorium Bioteknologi BBP4BKP (Mbak Asri, Mbak Maya, Mbak Ayu, Mbak Dewi, Mas Gintung, Bu Ifah, Bu Devi, Bu Dewi) yang telah
Fakultas Perikanan dan Ilmu Kelautan Universitas Riau yang sedang sekolah di IPB atas persahabatan, dorongan, semangat, dan bantuan dalam penyelesaian tesis ini. Semoga Allah SWT membalas semua kebaikan yang telah diberikan dengan balasan yang sempurna. Semoga karya ilmiah ini bermanfaat.
Bogor, Mei 2012
Halaman
DAFTAR TABEL ... xv
DAFTAR GAMBAR ... xvi
DAFTAR LAMPIRAN ... xvii
PENDAHULUAN Latar belakang. ... 1 Tujuan Penelitian ... 3 Manfaat Penelitian ... 3 TINJAUAN PUSTAKA Selulosa ... 5 Rumput Laut ... 6 Enzim Selulase... 7
Mikroorganisme Penghasil Enzim Selulase ... 12
Pemekatan Enzim ... 13
Kromatografi Kolom... 15
Elektroforesis ... 19
Identifikasi Mikroorganisme dengan 16S-rRNA ... 20
BAHAN DAN METODE Waktu dan Tempat ... 23
Bahan dan Alat Penelitian... 23
Peremajaan Isolat PMP 0126y ... 24
Pengamatan Morfologi Isolat PMP 0126y... 24
Identifikasi Bakteri secara Molekuler ... 24
Uji Kualitatif Enzim Selulase ... 26
Penentuan Waktu Optimum Produksi Enzim Selulase ... 27
Produksi Enzim Kasar Selulase ... 28
Pemurnian Enzim Selulase ... 29
Analisis Elektroforesis SDS-PAGE dan Zimogram ... 30
Pengukuran Kadar Protein ... 32
Karakterisasi Enzim Selulase ... 32
HASIL Identifikasi Isolat PMP 0126y ... 35
Pertumbuhan dan Produksi Enzim Selulase ... 37
Pemurnian Enzim Selulase ... 40
Analisis Berat Molekul Enzim Selulase Menggunakan SDS- PAGE dan Zimogram ... 42
Pertumbuhan dan Produksi Enzim Selulase ... 50
Pemurnian dan Karakterisasi Enzim Selulase ... 51
SIMPULAN ... 59
DAFTAR PUSTAKA ... 61
Halaman
1 Komposisi kimia rumput laut ... 7
2 Hidrolisis berbagai substrat oleh enzim selulase ... 9
3 Substrat selulosa berdasarkan kelarutan air dan jenis enzim selulase ... 10
4 Metode kromatografi untuk fraksinasi protein ... 15
5 Teknik kromatografi yang digunakan pada pemurnian selulase ... 16
6 Komposisi gel pemisah dan gel penahan untuk sepasang gel ... 30
7 Aktivitas selulase hasil ultrafiltrasi ... 41
8 Hasil uji aktivitas selulase PMP 0126y pada beberapa tahap pemurnian ... 42
9 Pemurnian dan karakterisasi selulase dari berbagai jenis bakteri ... 54
Halaman
1 Struktur serat selulosa ... 5
2 Struktur selulosa teratur (kristalin) dan kurang teratur (amorphous) ... 6
3 Pemecahan selulosa menjadi glukosa oleh enzim selulase ... 8
4 Klasifikasi enzim selulase... 9
5 Mekanisme degradasi selulosa ... 11
6 Pemurnian enzim dengan kromatografi penukar ion ... 17
7 Isolat PMP 0126y ... 35
8 Pewarnaan Gram isolat PMP 0126y dengan perbesaran 1000 x ... 35
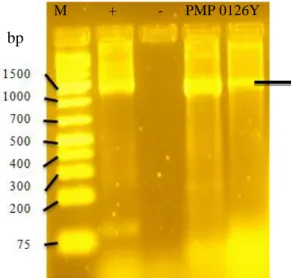
9 Hasil amplifikasi dari gen penyandi 16S-rRNA isolat PMP 0126y . 36 10 Sebagian sekuen DNA penyandi 16S-rRNA isolat PMP 0126y dari(arah 5’-3’)... 36
11 Pohon filogenetik isolat PMP 0126y ... 37
12 Zona bening isolat PMP 0126y ... 38
13 Kurva pertumbuhan isolat PMP 0126y... 38
14 Kurva aktivitas selulase, aktivitas spesifik, dan jumlah sel bakteri PMP 0126y ... 39
15 Kurva aktivitas selulase, aktivitas spesifik, dan jumlah sel bakteri PMP 0126y pada media glukosa 0,1% ... 39
16 Aktivitas spesifik dari pengendapan amonium selulase dengan amonium sulfat ... 40
17 Profil elusi enzim selulase pada kromatografi DEAE penukar ionmenggunakan matriks Sepharose ... 41
18 Hasil elektroforesis SDS-PAGE enzim ultrafiltrasi dan fraksi pemurnian kromatografi penukar anion dan ilustrasi pita-pita protein selulase PMP 0126y ... 43
mengandung CMC 0,1% dan ilustrasi pita yang terbentuk dalam
zimogram ... 44
20 Pengaruh pH terhadap aktivitas selulase PMP 0126y hasil
ultrafiltrasi... 45
21 Pengaruh pH terhadap aktivitas selulase PMP 0126y hasil
kromatografi penukar anion ... 45
22 Suhu optimum aktivitas selulase PMP 0126y hasil ultrafiltrasi
dan kromatografi penukar anion ... 46
23 Pengaruh suhu dan waktu inkubasi terhadap aktivitas
selulase PMP 0126y ... 46
24 Substrat spesifik enzim selulase PMP 0126y hasil ultrafiltrasi ... 47
25 Aktivitas relatif selulase PMP 0126y hasil ultrafiltrasi pada
Halaman 1 Prosedur pembuatan media dan reagen yang digunakan dalam
penelitian ... 73
2 Kurva standar glukosa ... 77
3 Kurva standar bovin serum albumin (BSA) ... 78
4 Kurva hubungan log sel dan kerapatan optis dan jumlah sel isolat
PMP 0126y selama 27 jam pengamatan ... 79
5 Hasil uji aktivitas selulase isolat PMP 0126y ... 80
6 Prosedur delignifikasi limbah rumput laut dengan NaOH dan H2SO4
oleh BBP4BKP ... 82
7 Gambar metafile hasil sekuensing isolat PMP 0126y (primer f) ... 83
PENDAHULUAN
Latar Belakang
Perkembangan industri berbasis hayati termasuk hayati laut dengan memanfaatkan senyawa biologi seperti enzim yang berasal dari mikroorganisme seperti bakteri dan kapang saat ini terus ditingkatkan di berbagai negara. Telah banyak peneliti yang mengisolasi bakteri baru dan memanfaatkan senyawa metabolit bakteri tersebut. Salah satu sumber yang dapat dimanfaatkan pada sektor Kelautan dan Perikanan yaitu limbah hasil pengolahan rumput laut. Mengingat bahwa 75% wilayah Indonesia terdiri atas perairan laut, maka berbagai jenis rumput laut telah banyak dimanfaatkan untuk produk pangan seperti agar-agar maupun karagenan. Pengolahan agar-agar-agar-agar memanfaatkan rumput laut jenis Glacilaria sp., sedangkan karagenan menggunakan rumput laut jenis Eucheuma sp. Berbagai industri rumput laut akan menghasilkan limbah sekitar 65-70% dari bahan baku segar yang masuk dan diolah (Kim et al. 2008).
Peningkatan pengolahan rumput laut Glacilaria sp. untuk diolah menjadi agar-agar tentu saja akan meningkatkan jumlah limbah rumput laut sehingga akan menjadi masalah pencemaran karena limbah tersebut mengandung selulosa yang sulit larut dalam air. Limbah rumput laut Glacilaria sp. mengandung selulosa sebanyak 15-25% (Kim et al. 2008). Salah satu alternatif pemanfaatan yang dapat dilakukan ialah dengan memanfaatkan bakteri asal limbah rumput laut tersebut. Bakteri yang hidup pada limbah ini diduga dapat menghasilkan enzim yang dapat menguraikan limbah selulosa menjadi sumber nutrisi untuk pertumbuhannya. Enzim yang dihasilkan oleh bakteri tersebut dapat menghidrolisis limbah selulosa menjadi glukosa, yang selanjutnya dapat digunakan sebagai bahan untuk fermentasi dalam memproduksi bioetanol. Pemanfaatan limbah selulosa dan bakteri penghasil enzim penghidrolisis selulosa dapat memberikan peluang pada pengembangan bioenergi dari bahan hayati laut.
Enzim selulase adalah suatu sistem enzim yang terdiri atas tiga tipe enzim utama yaitu kompleks endo-β-1,4-glukanase (CMCase, Cx selulase endoselulase, atau carboxymethyl cellulase), kompleks ekso-β-1,4-glukanase (aviselase, selobiohidrolase, C1 selulase), dan β-1,4-glukosidase atau selobiase (Crueger &
Crueger 1984). Ketiga enzim ini bekerja secara sinergis mendegradasi selulosa dan melepaskan gula reduksi (selobiosa dan glukosa) sebagai produk akhirnya (Deng & Tabatabai 1994). Enzim selulase akan memutuskan ikatan glikosidik β-1,4 di dalam selulosa yang memiliki ikatan β-β-1,4-glikosidik pada polimer glukosanya (Jeong et al. 2004) sehingga menjadi gula sederhana turunannya.
Proses hidrolisis selulosa dapat dilakukan dengan menggunakan asam dan suhu tinggi. Proses ini relatif mahal karena kebutuhan energi yang besar serta dapat mengakibatkan degradasi produk monosakarida yang dihasilkan sehingga produk yang akan dihasilkan rendah. Riyanti (2008) juga melaporkan efisiensi proses hidrolisis dengan asam masih rendah karena proses yang dilakukan cukup panjang dan membutuhkan banyak tahap. Kekurangan lain dari proses ini antara lain penanganan limbah asam yang tidak mudah. Baru pada tahun 1980-an, mulai dikembangkan hidrolisis selulosa dengan menggunakan enzim selulase (Coral et al. 2002). Hidrolisis secara enzimatik akan berjalan spesifik dan efisien sehingga produk yang akan dihasilkan lebih tinggi dan menghasilkan produk monosakarida dengan biaya produksi rendah.
Pemanfaatan mikrob dalam menghasilkan enzim selulase akan menjadi alternatif yang akan terus dikembangkan karena produksi enzim dari mikrob memiliki beberapa keuntungan. Jika dibandingkan dengan sel hewan maupun tumbuhan, sel mikrob relatif mudah ditumbuhkan, relatif lebih singkat kecepatan pertumbuhannya, skala produksi sel besar dan lebih mudah ditingkatkan, biaya produksi relatif rendah disebabkan waktu yang dibutuhkan untuk produksi enzim lebih singkat, dan kondisi selama produksi tidak tergantung musim (Poernomo & Djoko 2003). Beberapa contoh bakteri penghasil enzim selulase, yaitu Bacillus amyoliquefaciens DL-3 (Jung et al. 2008), B. pumilus EB3 (Arifin 2006), B. flexus (Trivedi et al. 2011), B. licheniformis C108 (Aygan et al. 2011), Cellulomonas biazotea (Rajoka & Malik 1997), C. flavigena (Ponce & Torre 2001), Streptomyces sp. galur J2 (Jaradat et al. 2008), S. ruber (El-Sersy et al. 2010), Pseudomonas sp (Gautam et al. 2010), P. fluorescens sub sp. cellulosa (Shimada et al. 1994). Beberapa isolat bakteri penghasil enzim selulase untuk bioetanol yaitu Escherichia coli KO11 (Jong et al. 2011), Zymomonas mobilis
NRRL-B-14023 (Ruanglek et al. 2006), Z. mobilis ATCC 10988 (Tanaka et al. 1999).
Selain dalam bidang industri, pemanfaatan enzim selulase dari bakteri dapat memberikan solusi dalam masalah pencemaran yakni mengurangi jumlah limbah selulosa, salah satunya dari industri pengolahan agar-agar dan karagenan, dan mendapatkan produk bernilai tambah dari pemanfaatan limbah rumput laut tersebut. Balai Besar Penelitian Pengembangan Pengolahan Produk dan Bioteknologi Kelautan Perikanan (BBP4BKP) telah melakukan eksplorasi mikrob dari rumput laut termasuk limbah pengolahan rumput laut. Beberapa isolat bakteri yang memiliki aktivitas selulase ekstraseluler yaitu isolat PMP 0126y berhasil diisolasi dari limbah pengolahan agar-agar rumput laut Glacilaria sp. dari daerah Pameungpeuk, Garut Jawa Barat (Munifah et al. 2011).
Tujuan Penelitian
Penelitian ini bertujuan untuk memproduksi, melakukan pemurnian parsial, dan mengkarakterisasi enzim selulase yang dihasilkan oleh isolat PMP 0126y penghasil enzim selulase dari limbah pengolahan rumput laut Glacilaria sp., serta melakukan identifikasi secara molekuler bakteri tersebut.
Manfaat Penelitian
Penelitian ini diharapkan dapat memberikan tambahan informasi mengenai bakteri penghasil enzim selulase dari limbah rumput laut dan enzim yang dihasilkan nantinya diharapkan dapat diaplikasikan dalam proses produksi bioetanol berbahan dasar limbah rumput laut.
TINJAUAN PUSTAKA
Selulosa
Selulosa merupakan polimer karbohidrat terbanyak yang terdapat di alam (Han & Chen 2007). Selulosa merupakan komponen utama penyusun dinding sel tumbuhan bersama-sama dengan hemiselulosa dan pektin. Komposisi selulosa dalam tumbuhan dapat mencapai 40-50% dari massa tumbuhan sehingga selulosa merupakan biopolimer terbarukan yang paling berlimpah di alam (Milala et al. 2005). Classen (1999) menambahkan bahwa diperkirakan 50% dari biomassa tumbuhan berupa selulosa dan jumlahnya sekitar 50 milyar ton. Selulosa merupakan polimer glukosa yang dihubungkan dengan ikatan β-1,4-D-glukosidik (Gambar 1).
Gambar 1 Struktur serat selulosa (Beguin & Aubert 1994).
Polimer glukosa tersusun secara paralel dan berikatan silang membentuk struktur kristalin yang disebut mikrofibril. Panjang mikrofibril ini bervariasi dari 2.000-15.000 unit glukosa, tergantung organismenya. Bentuk mikrofibril selulosa ditentukan oleh kompleks geometri sintase dan lingkungan lokal. Pada tumbuhan, unit mikrofibril mempunyai jumlah sekitar 3-4 unit dan terdiri atas sekitar 36 rantai selulosa dan seringkali dikemas dalam bentuk lebih besar (Doblin et al. 2002).
Mikrofibril pada selulosa memiliki orientasi beragam, tersusun secara pararel, dan setiap molekul glukosa dapat berotasi hingga 1800 (Beguin & Aubert 1994; Brown 1996). Mikrofibril ini pada tempat-tempat tertentu memiliki struktur yang teratur (crystalin) dan pada tempat-tempat tertentu memiliki struktur yang
kurang teratur (amorphous). Struktur amorphous terjadi karena proses kristalisasi yang berlangsung secara tidak sempurna pada mikrofibril yang terbentuk (Gambar 2). Dimensi serat selulosa dan proporsi dari bagian kristalin dan amorf sangat tergantung pada keadaan alaminya (Linder & Teeri 1997). Setiap serat selulosa tersusun oleh kira-kira 3.000 molekul glukosa dan berat molekulnya diperkirakan mencapai 500.000 (Hardjo et al. 1984).
Gambar 2 Struktur selulosa teratur (kristalin) dan kurang teratur (amorphous) (Beguin & Aubert 1994).
Secara alamiah molekul selulosa tersusun dalam fibril yang terdiri atas beberapa molekul glukosa yang dihubungkan dengan ikatan hidrogen yang kuat mengakibatkan dapat tahan terhadap tarikan tinggi. Fibril-fibril ini membentuk struktur kristal yang dibungkus oleh lignin, oleh karena itu sumber selulosa dari tumbuh-tumbuhan sulit sekali dihidrolisis secara langsung oleh katalis asam. Molekul selulosa berbentuk lurus dan tidak pernah bercabang, serta gugus hidroksilnya bebas membentuk ikatan hidrogen dengan gugus hidroksil molekul selulosa lainnya yang terletak sejajar (paralel) dengannya (Beguin & Aubert 1994).
Rumput Laut
Selulosa juga diproduksi oleh tanaman laut yaitu rumput laut (Linder & Teeri 1997). Rumput laut merupakan makroalga laut yang dapat digolongkan ke dalam alga merah, alga hijau, dan alga coklat. Rumput laut tidak memiliki daun, batang, dan akar sejati. Akan tetapi, bagian tubuhnya disebut dengan talus, dapat berupa filamen, lembaran tipis berdaun banyak, persegi dengan kulit keras, dan lumut raksasa. Uji proksimat yang dilakukan pada ampas rumput laut kering
didapatkan presentase masing-masing komponen kadar air sebesar 11.28%, kadar abu 36,05%, kadar lemak 0,42%, kadar protein 1,86%, kadar serat kasar 8,96% dan karbohidrat 41,43% (Harvey 2009).
Jenis rumput laut yang telah banyak dimanfaatkan berasal dari marga Euchema, Gelidium, Gracilaria, Hypnea, dan Sargassum. Selain itu, terdapat jenis lainnya seperti Caulerpa dan Dictosphaeria masih dimanfaatkan dalam skala kecil untuk konsumsi lokal (Atmadja et al. 1996). Beberapa jenis rumput laut memiliki komposisi kandungan selulosa maupun kandungan senyawa kimia lainnya yang berbeda. Berikut ini komposisi kimia dari beberapa jenis rumput laut (Tabel 1).
Tabel 1 Komposisi kimia rumput laut (Kim et al. 2008)
Jenis alga Selulosa
(%) Galaktan (%) Karbo- hidrat (%) Protein (%) Lipid (%) Alga merah Gelidium amansii, marocco
Gelidium amansii, joju Glacilaria E. cottonii 16,8 23 19,7 7,1 55,2 56,4 54,4 43,4 72,0 79,4 74,1 50,5 21,1 11,8 11 4,9 6,9 8,8 14,9 44,6 Alga hijau Codium fragile 10,9 47,8 58,7 34,7 6,6 Alga coklat Undaria pinattinda Laminaria japonica 2,4 6,7 38,7 40,0 41,1 46,7 24,2 12,2 34,7 38,1
Rumput laut Glacilaria sp. banyak dimanfaatkan dalam industri pengolahan agar-agar. Limbah industri agar-agar yang dihasilkan mengandung selulosa sebesar 15-25% (Kim et al. 2008). Selain itu, limbah agar-agar Glacilaria sp. merupakan salah satu sumber bakteri yang berpotensi menghasilkan enzim selulase. Pemanfaatan limbah agar-agar dan enzim selulase dari bakteri tersebut memegang peranaan yang sangat penting dalam pengembangan bioenergi.
Enzim Selulase
Enzim selulase atau enzim yang dikenal dengan nama sistematik β-1,4 glukan-4-glukano hidrolase adalah enzim yang dapat menghidrolisis selulosa dengan memutus ikatan glikosidik β-1,4 dalam selulosa, selodektrin, selobiosa, dan turunan selulosa lainnya menjadi gula sederhana atau glukosa. Sistem
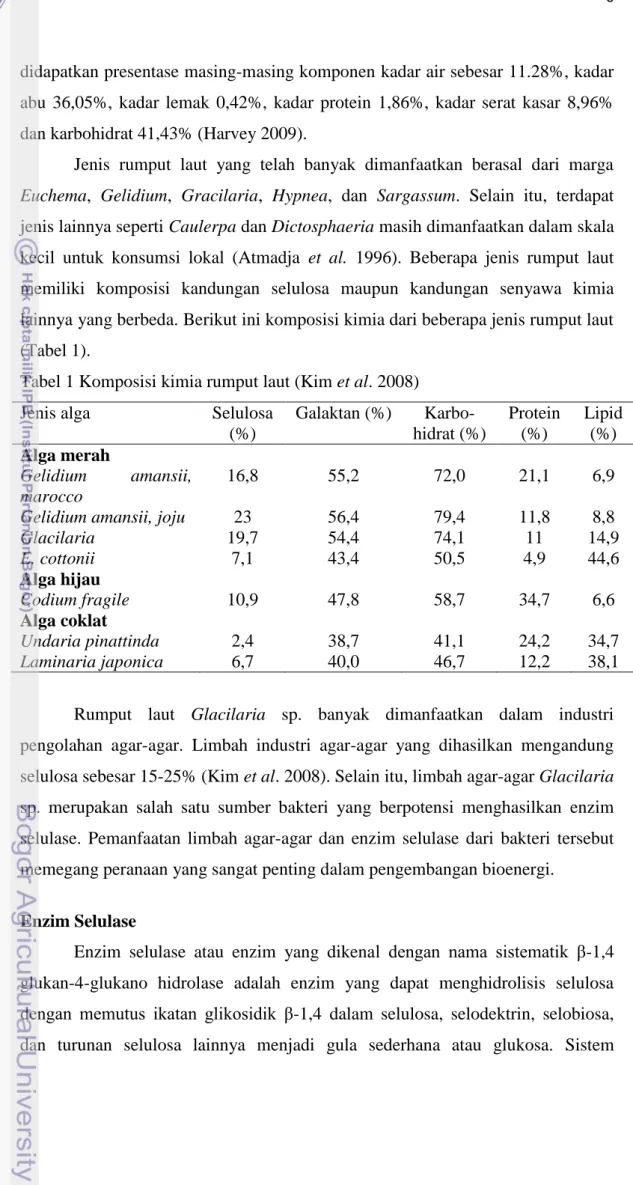
pemecahan selulosa menjadi glukosa terdiri atas tiga jenis enzim selulase yaitu endo-β-1,4-glukanase, ekso-β-1,4-glukanase, dan β-glukosidase. Endo-β-1,4-glukanase menyerang bagian tengah rantai secara random, ekso-β-1,4-Endo-β-1,4-glukanase (selobiohidrolase) memecah unit-unit disakarida (selobiosa) dari ujung rantai, dan β-glukosidase memecah selobiosa menjadi glukosa (Da silva et al. 2005) (Gambar 3).
Gambar 3 Pemecahan selulosa menjadi glukosa oleh enzim selulase.
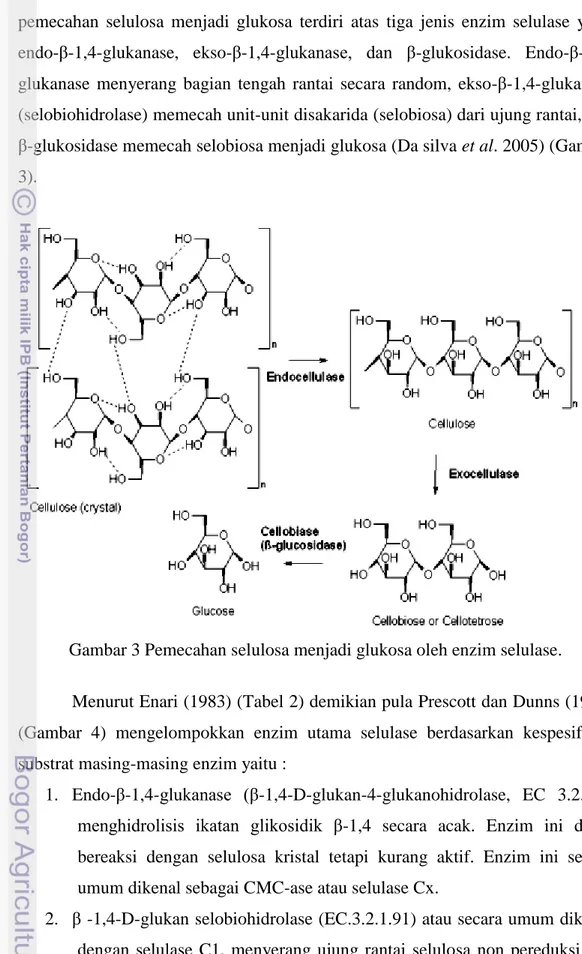
Menurut Enari (1983) (Tabel 2) demikian pula Prescott dan Dunns (1981) (Gambar 4) mengelompokkan enzim utama selulase berdasarkan kespesifikan substrat masing-masing enzim yaitu :
1. Endo-β-1,4-glukanase (β-1,4-D-glukan-4-glukanohidrolase, EC 3.2.1.4) menghidrolisis ikatan glikosidik β-1,4 secara acak. Enzim ini dapat bereaksi dengan selulosa kristal tetapi kurang aktif. Enzim ini secara umum dikenal sebagai CMC-ase atau selulase Cx.
2. β -1,4-D-glukan selobiohidrolase (EC.3.2.1.91) atau secara umum dikenal dengan selulase C1, menyerang ujung rantai selulosa non pereduksi dan membebaskan selobiosa.
3. β-1,4-D-glukan glukohidrolase (EC.3.2.1.74) menyerang ujung rantai selulosa non pereduksi dan membebaskan glukosa. Enzim ini menghidrolisis selulosa yang telah dilunakkan dengan asam fosfat, selo-oligosakarida dan CMC.
4. β-1,4-glikosidase (β-1,4-D-glukosida glukohidrolase, EC 3.2.1.21) menghidrolisis selobiosa dan rantai pendek selo-oligosakarida yang menghasilkan glukosa. Enzim ini tidak dapat memecah selulosa dan selodekstrin.
Gambar 4 Klasifikasi enzim selulase (Prescott & Dunns 1981).
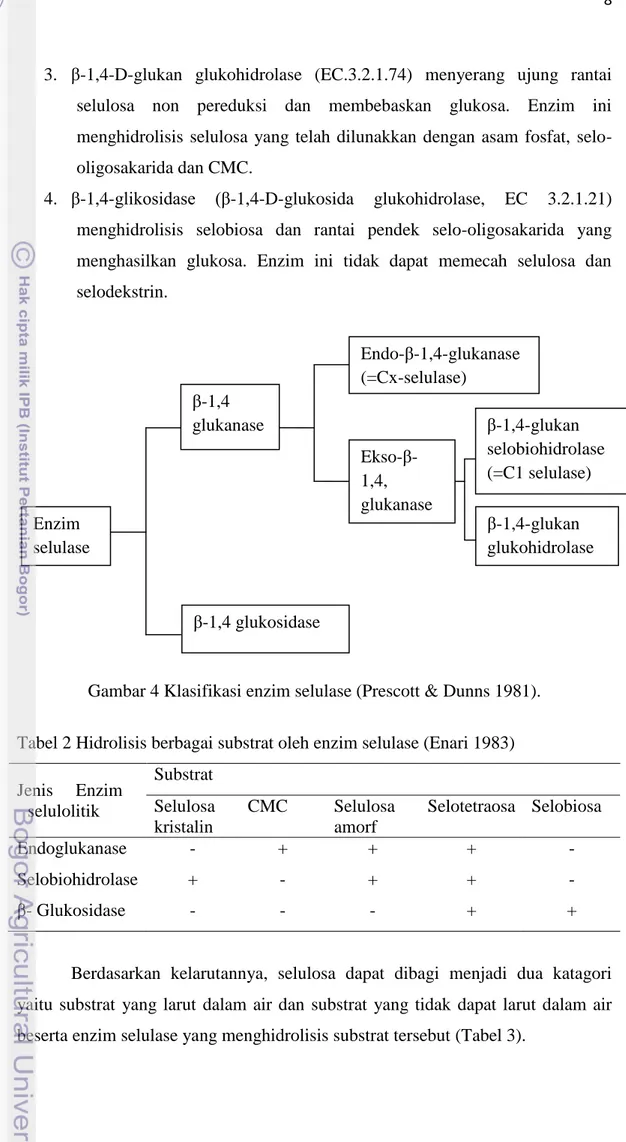
Tabel 2 Hidrolisis berbagai substrat oleh enzim selulase (Enari 1983)
Jenis Enzim selulolitik Substrat Selulosa kristalin CMC Selulosa amorf Selotetraosa Selobiosa Endoglukanase - + + + - Selobiohidrolase + - + + - β- Glukosidase - - - + +
Berdasarkan kelarutannya, selulosa dapat dibagi menjadi dua katagori yaitu substrat yang larut dalam air dan substrat yang tidak dapat larut dalam air beserta enzim selulase yang menghidrolisis substrat tersebut (Tabel 3).
Enzim selulase β-1,4 glukanase β-1,4-glukan glukohidrolase β-1,4-glukan selobiohidrolase (=C1 selulase) Endo-β-1,4-glukanase (=Cx-selulase) Ekso-β-1,4, glukanase β-1,4 glukosidase
Tabel 3 Substrat selulosa berdasarkan kelarutan air dan jenis enzim selulase (Zhang et al. 2006)
Substrat Selulosa Enzim Selulase
Larut dalam air
- Rantai pendek (derajat polimerisasi rendah) Silodekstrin
Radio-labeled selodekstrin - Turunan silodekstrin
β-methyllumberlliferil oligosakarida p-nitrofenol oligosakarida
- Turunan selulosa dengan rantai panjang Carboxymethylecellulose (CMC) Dye CMC
Tidak larut dalam air - Selulosa kristalin
Katun, selulosa mikrokristalin (Avisel), selulosa bakteri
- Selulosa Amorf – PASC - Dyed Selulosa
- Kromogenik dan turunan fluoreforik Trinitrofenil-karboksimetilselulase (TNP-CMC) - Flurant Selulosa - α-selulosa Endo, ekso, BG Endo, ekso, BG Endo, ekso, BG Endo, ekso, BG Endo Endo Total,endo, ekso Total, endo.ekso Total, endo Endo Endo, total Total
Endo ; endoglukanase, Ekso ; eksoglukanase, BG ; glukosidase, Total ; ketiga tipe enzim selulase.
Perbedaan antara masing-masing enzim selulase terletak pada kespesifikan struktur di sekeliling substrat. Perbedaan kespesifikan dari enzim endoglukanase dan selobiohidrolase bersifat tidak mutlak karena kedua enzim tersebut dapat menghidrolisis ikatan β-1,4 glukosida dari selulosa amorf. Penentuan aktivitas enzim selulase akan sulit apabila filtrat yang akan diukur aktivitas enzimnya merupakan campuran dari berbagai enzim selulase. Enzim-enzim ini tidak hanya dapat menghidrolisis substrat yang sama tetapi juga dapat bekerja secara sinergis memecah substrat yang sama, sehingga menyebabkan aktivitas yang diukur dipengaruhi oleh proporsi dari masing-masing enzim yang ada (Enari 1983).
Aktivitas enzim endoglukanase pada umumnya dapat diuji dengan substrat CMC (Carboxymethyl cellulose) sehingga enzim endoglukanase juga disebut dengan istilah CMCase, sedangkan aktivitas enzim selobiohidrolase atau
eksoglukanase seringkali diuji dengan substrat avisel sehingga enzim eksoglukanase disebut dengan aviselase (Zhang et al. 2006).
Tahapan hidrolisis selulosa tergantung kepada struktur selulosa, interaksi antara enzim selulase dengan serat selulosa, mekanisme hidrolisis enzim tersebut di alam dan inhibitor yang terbentuk. Fase adsorbsi dan pembentukan kompleks enzim substrat adalah fase kritis di dalam hidrolisis selulosa. Glukosa dan selobiosa adalah inhibitor enzim dalam menghidrolisis selulosa. Selobiosa menghambat enzim selobiohidrolase dan glukosa menghambat enzim penghidrolisis selobiosa yaitu β-glukosidase pada kompleks enzim selulase. Selobiosa mempunyai potensi lebih kuat menjadi inhibitor dibandingkan dengan glukosa (Coughlan 1985). Laju hidrolisis enzim selulase ditentukan oleh struktur substrat (Mandels 1985). Struktur kristal lebih sulit dihidrolisis dibandingkan dengan struktur amorf maka hidrolisis dilakukan oleh enzim endoselulase atau endoglukanase (Coughlan 1985) (Gambar 5).
Gambar 5 Mekanisme degradasi selulosa (Beguin & Aubert 1994).
Aktivitas enzim selulase dipengaruhi oleh beberapa faktor antara lain derajat keasaman (pH), suhu, dan senyawa penghambat. Aktivitas enzim dipengaruhi oleh pH karena sifat ionik gugus karboksil dan gugus amino mudah dipengaruhi oleh pH sehingga apabila terjadi perubahan pH maka akan menyebabkan denaturasi enzim dan menghilangkan aktivitas enzim. Suhu memiliki peranan yang sangat penting dalam reaksi enzimatik. Ketika suhu
bertambah sampai suhu optimum, kecepatan reaksi enzim naik karena energi kinetik bertambah. Bertambahnya energi kinetik enzim akan mempercepat gerak vibrasi, translasi, dan rotasi baik enzim maupun substrat. Hal ini akan memperbesar peluang enzim dan substrat bereaksi. Ketika suhu lebih tinggi dari suhu optimum, protein enzim berubah konformasi sehingga gugus reaktif terhambat. Perubahan konformasi ini dapat menyebabkan enzim terdenaturasi. Substrat juga dapat berubah konformasinya pada suhu yang tidak sesuai, sehingga substrat tidak dapat masuk ke dalam sisi aktif enzim (Ottaway 1984).
Selain pH dan suhu, faktor lain yang mempengaruhi aktivitas selulase yaitu adanya senyawa penghambat berupa ion logam. Penghambatan tersebut dapat dinetralkan dengan menambahkan sistein sehingga aktivitas enzim dapat berlangsung kembali (Kulp 1975). Beberapa senyawa logam dan senyawa lainnya yang dapat menghambat aktivitas selulase ialah Hg2+, Ag2+, dan Cu2+ (Deng & Tabatai 1994; Oikawa et al. 1994), glukanolakton (Kulp 1975), surfaktan, senyawa pengkelat khususnya Sodium Dodecyl Sulphate (SDS), Ethylene Diamine Tetraacetyc Acid (EDTA) (Oikawa et al. 1994), laktat dalam konsentrasi agak rendah (Chesson 1987), dan etanol serta alkohol lainnya (Ooshima et al. 1985). Senyawa penghambat tersebut dapat menekan seluruh kecepatan hidrolisis dengan menghambat adsorbsi eksoglukanase dan endoglukanase pada selulosa, dan menghambat aksi sinergis eksoglukanase dan endoglukanase yang bekerja pada permukaan selulosa.
Mikroorganisme Penghasil Enzim Selulase
Mikroorganisme didefinisikan sebagai organisme yang berukuran sangat kecil (biasanya kurang dari 1 milimeter) sehingga untuk mengamatinya diperlukan bantuan mikroskop atau alat pembesar. Mikroorganisme dapat berupa sel tunggal atau kelompok sel yang mempunyai kemampuan untuk mengatur proses hidupnya tanpa bergantung sel lainnya. Mikroorganisme terdiri atas bakteri, virus, dan cendawan (fungi) yang masing-masing memiliki perbedaan karakteristik secara morfologi, ekologi, dan fisiologi. Bakteri merupakan sel prokariot dengan rRNA bakteri yang dihubungkan oleh ikatan ester dan membran lipid yang merupakan diasil gliserol dieter (Madigan et al. 2000).
Beberapa contoh genus bakteri yang diketahui mempunyai aktivitas selulolitik ialah Acetobacter, Bacillus, Clostridium, Cellulomonas, Pseudomonas, Cytophaga, Sarcina, dan Vibrio, sedangkan contoh genus cendawan yang mempunyai aktivitas selulolitik ialah Bulgaria, Chaetomium, Helotium, Coriolus, Phanerochaete, Poria, Schizophyllum, Serpula, Aspergillus, Cladosporium, Fusarium, Geotrichum, Myrothecium, Paecilomyces, Penicillium, dan Trichoderma (Rao 1994). Beberapa jenis organisme juga dapat menghasilkan enzim selulase seperti rayap (Watanabe & Tokuda 2001), remis (Xu et al. 2000), dan arabidopsis.
Di alam, degradasi selulosa kebanyakan dilakukan oleh mikroorganisme aerobik. Mikroorganisme aerobik menghasilkan enzim selulase nonkompleks yang terdiri atas endoglukanase, eksoglukanase, dan glukosidase yang bekerja secara sinergis untuk menghidrolisis selulosa. Mikroorganisme anaerobik menghasilkan enzim selulase kompleks yang disebut selulosom (Doi et al. 2003; Bayer et al. 2004). Meskipun mikroorganisme anaerobik hanya menyumbang sekitar 5-10% dari biodegradasi total selulosa di alam, namun peranannya sangat penting karena bertanggung jawab terhadap degradasi daerah anoksik pada danau, laut, dan saluran pencernaan hewan pemamah biak maupun rayap, yang tidak dapat dilakukan oleh mikroorganisme aerobik (Zhang et al. 2006).
Pemekatan Enzim
Pada tahap awal pemurnian enzim biasanya dilakukan klarifikasi dan pengendapan protein enzim. Klarifikasi berfungsi memisahkan larutan enzim dari partikel-partikel yang tidak larut, misalnya debris sel dan partikel substrat. Klarifikasi dapat dilakukan dengan penyaringan atau sentrifugasi. Pemekatan protein enzim merupakan tahap awal dari prosedur pemurnian enzim sebelum tahap pemurnian berikutnya atau dapat pula digunakan untuk keperluan analisis enzim. Pemekatan protein enzim berfungsi untuk meningkatkan konsentrasi protein enzim, mereduksi volume larutan enzim, dan memisahkan protein enzim dengan protein pengotor yang lain (Harris 1989).
Pemekatan protein dapat dilakukan dengan dua metode, yaitu analitik dan preparatif (penyiapan). Metode analitik menggunakan pengendapan asam (misalnya asam trikloroasetat), pengendapan organik (misalnya aseton atau
etanol), dan imunopresipitasi yang dapat menyebabkan denaturasi protein. Pemekatan protein dengan metode preparatif tetap mempertahankan aktivitas protein misalnya dengan menggunakan pengendapan garam, pengendapan dengan pelarut organik, pengendapan dengan polimer organik, ultrafiltrasi, liofilisasi, dan dialisis (Harris 1989).
Metode pengendapan protein yang biasa dilakukan dalam pengendapan selulase ialah dengan menggunakan amonium sulfat (Jung et al. 2008) dan ultrafiltrasi (Arifin 2006). Amonium sulfat merupakan garam yang paling sering digunakan untuk mengendapkan protein karena memiliki daya larut tinggi di dalam air, relatif tidak mahal, dan kestabilan protein di dalam larutan amonium sulfat (2M- 3M) tahan bertahun-tahun (Scopes 1987).
Prinsip pengendapan dengan garam berdasarkan pada kelarutan protein yang berinteraksi polar dengan molekul air, interaksi ionik protein dengan garam, dan daya tolak menolak protein yang bermuatan sama. Kelarutan protein (pada pH dan suhu tertentu) meningkat pada kenaikan konsentrasi garam (salting in). Kenaikan kelarutan protein akan meningkatkan kekuatan ion larutan. Pada penambahan garam dengan konsentrasi tertentu menyebabkan kelarutan protein menurun (salting out). Molekul air yang berikatan dengan ion-ion garam semakin banyak yang menyebabkan penarikan selubung air yang mengelilingi permukaan protein. Peristiwa ini mengakibatkan protein saling berinteraksi, beragregasi, dan kemudian mengendap (Harris 1989; Scopes 1987).
Garam berlebih yang terdapat di dalam larutan enzim setelah tahap fraksinasi dapat dihilangkan dengan cara dialisis. Pada tahap dialisis, protein ditempatkan di dalam kantung (membran) semipermeabel yang direndam di dalam larutan bufer tertentu. Molekul yang berukuran kecil akan ke luar melalui membran, dan molekul yang berukuran besar akan tertahan di dalam membran dialisis. Ukuran pori kantung dialisis yang terbuat dari bahan selulosa asetat berdiameter 1-20 nm. Ukuran ini menunjukkan berat molekul minimum yang dapat tertahan di dalam membran. Selain dengan dialisis, penghilangan garam dapat dilakukan dengan filtrasi gel. Metode ini biasanya diterapkan untuk sampel yang sedikit, yaitu tidak melampaui 25-30% volume kolom untuk mendapatkan resolusi yang memadai antara protein dan garam. Matriks filtrasi gel memiliki
pori yang berukuran kecil, misalnya Sephadex G-25 buatan Phamacia. Kekurangan metode ini adalah terjadi pengenceran sampel protein (Harris 1989). Ultrafiltrasi merupakan suatu metode untuk mengkonsentrasikan protein dengan menekan cairan larutan protein enzim supaya tertahan di dalam membran. Ukuran cairan yang akan ditahan (retentat) dan yang dikeluarkan (permeat) sesuai dengan ukuran membran yang digunakan. Prinsip pemisahan dengan ultrafiltrasi adalah pemisahan komponen berdasarkan berat molekul (Bollag & Edelstein 1991). Pemisahan komponen ini terjadi karena adanya membran ultrafiltrasi. Membran ultrafiltrasi berfungsi sebagai penghalang (barrier) tipis yang sangat selektif di antara dua fasa, hanya dapat melewatkan komponen tertentu dan menahan komponen lain dari suatu aliran fluida yang dilewatkan melalui membran (Mulder 1996). Proses membran ultrafiltrasi merupakan upaya pemisahan dengan membran yang menggunakan gaya dorong beda tekanan yang dipengaruhi oleh ukuran dan distribusi pori membran (Malleviale 1996).
Kromatografi Kolom
Kromatografi kolom pada prinsipnya yaitu pengaliran suatu cairan melalui kolom yang mengandung bahan pengisi dan substanta yang ingin dipisahkan menjadi beberapa komponen dengan adanya perbedaan terhadap daya ikat bahan pengisi (Tabel 4).
Tabel 4 Metode kromatografi untuk fraksinasi protein (Ersson et al. 1998)
Sifat Protein Jenis Kromatografi
Ukuran dan bentuk Filtrasi gel
Muatan neto dan distribusi grup bermuatan
Penukar ion
Titik isoelektris Kromatofokusing
Hidrofobisitas Interaksi hidrofobik dan fase balik Pengikatan logam Afinitas ion logam terimobilisasi Kandungan tiol yang terbuka Kovalen
Afinitas biospesifik terhadap ligan, inhibitor, reseptor, antibodi, dsb
Afinitas
Teknik kromatografi kolom banyak digunakan dalam bioteknologi untuk mengamati tingkat kemurnian dan stabilitas protein (Neville 1998). Beberapa peneliti melakukan pemurnian enzim selulase yang dihasilkan oleh bakteri dengan berbagai teknik kromatografi kolom (Tabel 5).
Tabel 5 Teknik kromatografi yang digunakan pada pemurnian selulase
Selulase Metode Kromatografi Sumber
Endoglukanase dari Sinorhizobium fredii
Penukar ion, interaksi hidrofobisitas
Po et al. (2004)
Endoglukanase dari Mucor circinelloides
Gel filtrasi Saha (2003)
Endoglukanase dari Bacillus sp
Penukar ion, gel filtrasi Mawadza et al. (2000)
Endoglukanase dari Bacillus sp
Penukar ion Singh et al. (2004)
Endoglukanase dari Pseudomonas fluorescens
Penukar ion, gel filtrasi Bakare et al. (2005)
Endoglukanase dari Bacillus sp
Penukar ion Ji et al. (2005)
Endoglukanase dari Bacillus pumilus
Gel filtrasi, penukar ion Christakopoulus et al. (1999)
Kromatografi penukar ion memanfaatkan perbedaan afinitas antara molekul bermuatan di dalam larutan dengan senyawa yang tidak reaktif yang bermuatan berlawanan sebagai pengisi kolom (Scopes 1987). Kromatografi penukar ion memisahkan protein berdasarkan muatan bersih protein dan kekuatan relatif dari muatan bersih protein tersebut. Kromatografi penukar ion memerlukan fase diam yang biasanya merupakan polimer terhidratasi yang bersifat tidak larut seperti selulosa, dekstran dan agarosa. Gugus penukar ion diimobilisasikan pada matriks. Beberapa gugus penukar anion yaitu aminoetil (AE-), kuaternari aminoetil (QAE-), dan dietilaminoetil (DEAE-). Gugus penukar kation yaitu sulfopropil (SP-), metil sulfonat dan karboksimetil (CM-). Penukar ion lemah seperti DEAE- (penukar anion lemah) dan CM- (penukar kation lemah) hanya dapat mempertahankan kondisi terionisasi pada rentang pH sempit dan kehilangan muatannya pada pH tertentu. Gugus penukar anion lemah DEAE- terionisasi sempurna di bawah pH 6,0 dan akan kehilangan muatannya pada pH 9,0, sedangkan gugus penukar kation lemah CM- akan kehilangan muatannya di bawah pH 4,5. Penukar ion kuat dapat mempertahankan kondisi terionisasi pada rentang pH yang luas. Gugus penukar ion QAE- (penukar anion kuat) dan SP- (penukar kation kuat) dapat mempertahankan kondisi terionisasi pada rentang pH 1-10 (Coligan et al. 2003).
Kolom untuk kromatografi penukar ion biasanya tidak panjang dan memiliki diameter lebih besar dari pada kolom untuk filtrasi gel. Banyaknya sampel yang dimasukkan umumnya sekitar 10-20% dari kapasitas kolom. Pembilasan dengan gradien konsentrasi NaCl yang linier baik digunakan untuk memisahkan molekul-molekul yang memiliki perbedaan muatan bersih yang tidak terlalu besar sedangkan gradien NaCl bertahap baik digunakan untuk memisahkan molekul-molekul yang memiliki perbedaan muatan bersih yang besar.
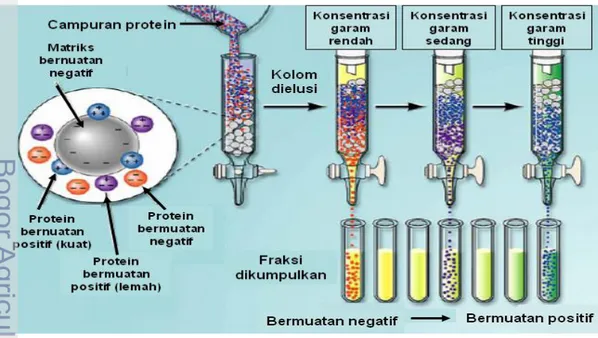
Pada dasarnya prinsip kromatografi penukar ion adalah ion bermuatan bebas dipertukarkan dengan ion yang memiliki tipe muatan yang sama. Protein yang bermuatan negatif dapat ditukar dengan ion klorida. Awalnya gugus fungsional matriks yang bermuatan negatif mengikat ion dari bufer (misalnya Na+). Pada saat sampel dimasukkan ke dalam kolom, maka protein yang bermuatan positif akan menggantikan ion Na+ sedangkan protein yang bermuatan negatif atau netral tidak akan terikat. Protein yang tidak terikat dibilas dengan menggunakan bufer (biasanya dengan konsentrasi 10-50 mM). Selanjutnya ikatan protein yang terikat gugus fungsional matriks akan terlepas setelah dibilas dengan bufer yang mengandung NaCl atau KCl secara linier atau bertahap sehingga protein yang memiliki ikatan lemah dengan matriks akan lepas terlebih dahulu dan diikuti oleh protein yang memiliki ikatan lebih kuat (Gambar 6).
Gambar 6 Pemurnian enzim dengan kromatografi pertukar ion
Pemilihan penukar ion tergantung pada muatan protein target. Muatan bersih protein tergantung pada pH yaitu protein akan bermuatan positif dengan menurunkan pH dan bermuatan negatif dengan menaikkan pH. Pada saat menentukan pH untuk kromatografi, kestabilan protein target pada pH yang dipilih perlu dijaga. Apabila protein stabil pada pH di atas titik isoelektriknya (pI) maka digunakan penukar anion (positif), tetapi bila protein stabil pada pH di bawah pI nya maka digunakan penukar kation (negatif). Jika protein stabil pada rentang 1 unit di atas dan di bawah pI maka kedua penukar ion dapat digunakan. Matriks yang mengikat gugus fungsional menentukan sifat aliran, ion yang dapat diikat, kestabilan mekanik dan kimia. Ada 3 kelompok matriks yang biasanya digunakan, yaitu: 1) polistiren, poliakrilik atau polifenol; 2) selulosa; dan 3) dekstran (Sephadex) atau agarosa (Sepharose). Matriks polistiren dan polifenolik lebih sering digunakan untuk memisahkan molekul-molekul kecil seperti asam-asam amino, peptida kecil, nukleotida, nukleotida siklik, asam-asam-asam-asam organik. Matriks selulosa biasanya digunakan untuk memisahkan protein (termasuk enzim), polisakarida dan asam nukleat. Matriks DEAE-selulosa, CM-selulosa dan fosfoselulosa paling sering digunakan. Matriks polidekstran dan agarosa (misalnya DEAE-Sephadex, CM-Sephadex) digunakan untuk memisahkan protein, hormon, tRNA dan polisakarida (Scopes 1987).
Pemilihan penukar ion kuat atau lemah tergantung pada pH molekul target. Molekul yang memerlukan pH sangat rendah atau sangat tinggi untuk dapat berionisasi atau apabila molekul stabil pada pH ekstrem maka penukar ion kuat harus digunakan. Penukar ion lemah akan memberikan hasil pemisahan yang lebih baik untuk protein-protein yang memiliki muatan bersih yang berdekatan. Keuntungan kromatografi penukar ion diantaranya adalah tidak merusak protein yang dimurnikan dan pada umumnya memiliki kapasitas pengikatan yang tinggi. Kelemahannya adalah protein-protein yang memiliki distribusi gugus bermuatan pada permukaannya atau memiliki pI yang sama atau mirip akan sulit dipisahkan dengan cara kromatografi penukar ion. Selain itu larutan enzim hasil kromatografi penukar ion mengandung kadar garam cukup tinggi yang harus dihilangkan untuk proses pemurnian selanjutnya (Scopes 1987).
Elektroforesis
Elektroforesis adalah suatu proses perpindahan partikel-partikel bermuatan atau suatu cara untuk memisahkan fraksi-fraksi suatu campuran berdasarkan atas pergerakan partikel koloid yang bermuatan di bawah pengaruh medan listrik (Suhartono 1989). Elektoforesis dengan menggunakan gel polakrilamida sodium dodesil sulfat (SDS-PAGE) merupakan teknik elektroforesis gel yang menggunakan poliakrilamida untuk memisahkan protein yang bermuatan berdasarkan berat molekulnya. Penentuan berat molekul yang menyusun enzim selulase dianalisis dengan menggunakan metode SDS-PAGE (Sodium dodecyl sulphate-polyacrylamide gel electrophoresis). Pada metode ini digunakan 2 gel yaitu gel penahan (stacking gel) dan gel pemisah (separating gel). Gel akrilamida diperoleh dengan cara polimerisasi akrilamida dengan sejumlah crosslinking agent metilen bis akrilamida dan amonium persulfat (APS) sebagai katalisator. Radikal bebas yang terbentuk dari pelarutan amonium persulfat dalam air akan bereaksi dengan akrilamida membentuk akrilamida aktif yang dapat bereaksi satu dengan yang lain membentuk polimer (Janson & Ryden 1998).
Ada beberapa jenis elektroforesis, yaitu elektroforesis kertas, elektroforesis selulosa asetat/nitrat dan elektroforesis gel. Elektroforesis gel berguna untuk pemisahan protein, sedangkan dua jenis lainnya berguna untuk memisahkan molekul yang lebih kecil. Matriks gel dapat berupa pati, agarosa atau poliakrilamida. Saat ini gel poliakrilamida lebih sering digunakan. Matriks ini disusun oleh akrilamida dan N,N’-metilen-bis-akrilamida yang berpolimerisasi dengan bantuan katalisator amonium persulfat dan N,N,N’,N’tetrametilen diamin (TEMED). Elektroforesis gel dengan SDS digunakan untuk meneliti jumlah dan ukuran rantai protein atau rantai subunit protein. SDS merupakan detergen lemah anionik yang akan memutuskan ikatan di antara subunit penyusun dan membentuk kompleks yang bermuatan negatif sehingga pergerakan protein dalam medan listrik hanya berdasarkan pada ukuran molekul sedangkan β-merkaptoetanol digunakan untuk mereduksi ikatan disulfida pada protein. Protein yang berukuran kecil akan bergerak lebih cepat dibandingkan yang berukuran besar (Copeland 1994).
Elektroforesis protein dapat dilakukan dengan proses denaturasi (SDS-PAGE) dan nondenaturasi (Native-(SDS-PAGE). Mekanisme pada SDS-PAGE dijelaskan bahwa protein akan bereaksi dengan SDS yang merupakan detergen anionik membentuk kompleks yang bermuatan negatif. Protein akan terdenaturasi dan terlarut membentuk kompleks berikatan dengan SDS yang berbentuk elips atau batang yang ukurannya sebanding dengan berat molekul protein. Protein dalam bentuk kompleks yang bermuatan negatif ini akan dapat terpisahkan berdasarkan muatan dan ukurannya secara elektroforesis di dalam matriks gel poliakrilamida (Smith 1984).
Berbeda dengan SDS-PAGE, pada gel pemisah disisipi substrat yang akan dihidrolisis oleh enzim selama masa inkubasi yang disebut sebagai zimogram. Elektroforesis zimogram memisahkan protein terlarut yang tidak mengendap atau beragregasi selama elektroforesis. Pada elektroforesis gel yang terdenaturasi, seperti pada SDS-PAGE, molekul-molekul protein yang telah terpisah dengan elektroforesis dapat kehilangan aktivitas biologi dan biokimianya, tetapi pada elektroforesis zimogram aktivitas tersebut masih bertahan (Dunn 1989). Enzim dipisahkan dalam gel denaturasi (SDS), namun dalam kondisi tidak tereduksi. SDS dilepaskan dengan penambahan larutan renaturasi (misalnya detergen Triton X-100) dan kembali terjadi pelipatan protein. Kemudian gel diwarnai dengan pewarna yang sesuai dengan enzim yang diujikan. Metode zimogram bersifat mudah, sensitif, dan kuantitatif dalam menganalisis aktivitas enzim (Kleiner & Stetler-Stevenson 1994; Leber & Balkwil 1997).
Berat molekul protein dapat ditetapkan dengan menggunakan protein standar yang telah diketahui berat molekulnya dan memperbandingkan nilai Rf (mobilitas relatif) yang diperoleh. Pita pada gel dapat divisualisasi dengan pewarnaan, misalnya menggunakan pewarna coomasie blue atau pewarna perak nitrat (Suhartono 1989).
Identifikasi Mikroorganisme dengan 16S-rRNA
Madigan et al. (2000) menyatakan bahwa pada bakteri atau prokariot memiliki tiga macam ribosom RNA (rRNA) yaitu 23S-rRNA (2900 unit nukleotida), 16S-rRNA (1500 nukleotida) dan 5S-rRNA (sekitar 120 nukleotida). Gen penyandi 16S-rRNA mempunyai daerah sekuen yang konservatif yang dapat
digunakan untuk menduga hubungan kekerabatan secara alami antara spesies yang mempunyai kekerabatan dekat sehingga sangat menguntungkan untuk analisis filogenetik bakteri di tingkat famili, genus, spesies, maupun subspesies. (Chen et al. 2000). Woese (1987) menambahkan bahwa molekul 16S-rRNA paling banyak digunakan sebagai target asam nukleat untuk mendeteksi dan mengidentifikasi bakteri yang belum pernah terdeteksi sebelumnya. Sekuen variabel berevolusi pada laju yang berbeda sehingga memberikan cukup informasi untuk menentukan kedekatan atau jauhnya hubungan filogenetik suatu organisme (Woese 1987).
Madigan et al. (2000) menyatakan sekuen gen penyandi 16S-rRNA digunakan untuk menentukan pohon filogenetik dari keragaman makhluk hidup di bumi. Kekerabatan evolusi antar spesies dalam keseluruhan sistem biologi diperlukan parameter yang memenuhi persyaratan sebagai berikut : 1) terdapat pada semua makhluk hidup, 2) fungsinya identik, 3) dapat dibandingkan secara obyektif, dan 4) parameter tersebut berubah sesuai dengan jarak evolusinya sehingga dapat dijadikan sebagai kronometer evolusi yang handal.
Analisis molekuler dengan sekuen gen penyandi 16S-rRNA pada prinsipnya meliputi ekstraksi DNA total, amplifikasi gen penyandi 16S-rRNA, penentuan sekuen klon yang mengandung gen 16S-rRNA dan analisis perbandingan sekuen yang telah diketahui dalam database (Madigan et al. 2000).
BAHAN DAN METODE
Waktu dan Tempat
Penelitian ini dilakukan pada bulan Februari 2011 sampai Februari 2012 di Laboratorium Bioteknologi, Balai Besar Penelitian Pengembangan Pengolahan Produk dan Bioteknologi Kelautan Perikanan (BBP4BKP), Jakarta.
Bahan dan Alat Penelitian
Bahan yang digunakan pada penelitian ini antara lain ialah isolat PMP 0126y koleksi dari BBP4BKP hasil isolasi dari limbah pengolahan rumput laut Glacilaria sp. dari daerah Pameungpeuk Jawa Barat. Beberapa bahan kimia yang digunakan dalam penelitian ini yaitu agar-agar nutrien (NA), kaldu nutrien (NB), Carboxymethyl Cellulose (CMC), MgSO4.7H2O, K2HPO4, FeSO4.7H2O,
CaCl2.2H2O, ekstrak khamir, NH4NO3, KH2PO4, glukosa. Bahan kimia lain yang
digunakan antara lain yaitu bovin serum albumin (BSA) standar, sodium tartarat, asam dinitrosalisilat (DNS), bufer sitrat-fosfat, bufer asetat, bufer tris-HCl, NaCl, etanol, merah kongo, sodium dodesil sulfat (SDS), Triton X-100, glysin, dan membran ultrafiltrasi yaitu polyetersulfon (Model UFP-10-E-4MA, dengan area permukaan 420 cm2 dan tipe membran sebesar 10.000 NMWC (Nominal Molecular Weigth Cutoff)) (GE Healthcare Bio-Sciences Corp), matriks DEAE SepharoseTM Fast Flow (Amersham Bioscience, Upsalla Sweden).
Alat yang akan digunakan antara lain : laminar/transfer box (Labconco), jarum tanam bulat (ose), jarum tanam tajam, marker OHP permanen, penggaris, gunting, pematik api mekanik, cawan petri steril, tabung reaksi, tabung erlenmeyer, gelas beaker, gelas ukur, pembakar spritus, botol alkohol, spatel Drygalski, Colony counter (Chiltern), spektrofotometer UV (Spectronic ® 20 Genesys TM), sentrifugasi mikro suhu rendah (Beckman Coulter TM Microfuge ® 22 R Centrifuge), timbangan analitik (Mettler Toledo Model : ML204/02 Type New Classic MF), timbangan digital (Mettler PE 360 Deltra Range®), pemanas air kompor listrik (Maspion), vorteks (Thermolyne maxi mix plus), tabung mikro, autoklaf (Hirayama Tokyo Japan), oven (Sanyo), inkubator (GallenKamp), inkubator statis/goyang (Shel Lab), mikropipet 10 mL, 1 mL, 200 µL, dan 20 µL (NICHIRYO Tokyo Japan), lemari pendingin, PCR (Gen Amp PCR System 9700
Applied Biosystem dan BIOMETRA Tprofesional Thermoclyne), Microspin (FV-2400), piranti elektroforesis SDS-PAGE (Amersham Bioscience, Swedia), piranti elektroforesis DNA (Portsmouth NH, USA), batang pengaduk, Akta Purifier (Amersham Biosciences UPC-900, Upsalla Sweden), Blok panas (Biometra), Ultrafiltrasi (Watson Marlow).
Peremajaan Isolat PMP 0126y
Peremajaan isolat PMP 0126y dilakukan dengan menumbuhkan isolat bakteri pada media agar-agar nutrien (NA). Bakteri tersebut diinkubasi di dalam inkubator selama 1 x 24 jam pada suhu 37 0C (Munifah et al. 2011). Kemudian, dilanjutkan dengan pengamatan secara morfologi bakteri yaitu pewarnaan Gram.
Pengamatan Morfologi Isolat PMP 0126y
Morfologi isolat PMP 0126y diamati dengan melakukan pewarnaan Gram yang dilihat dengan menggunakan mikroskop. Pewarnaan Gram dilakukan dengan cara memfiksasi bakteri pada kaca objek gelas dengan menggunakan larutan KH2PO4 (Lampiran 1) sebanyak 3 tetes di atas api bunsen. Preparat olesan bakteri
yang telah difiksasi panas digenangi pewarna ungu kristal violet selama 1 menit, dibilas dengan air, dan ditiriskan. Olesan digenangi iodium Gram selama 1 menit dan dicuci dengan 95% etanol (decoloration solution) selama 30 detik sampai pewarna ungu kristal pada preparat tidak terbilas lagi dan dicuci dengan akuades sampai warna olesan menjadi bening. Olesan digenangi kembali dengan larutan safranin selama 1 menit, dibilas dengan akuades, dan ditiriskan sampai kering. Bakteri yang telah diwarnai diamati dengan mikroskop medan terang pada perbesaran 1000-2000 x (Cappucino & Sherman 1983). Hasil pewarnaan Gram isolat PMP 0126y difoto menggunakan kamera mikroskop (Olympus DP12) yang dikerjakan di laboratorium Mikrobiologi, BBP4BKP.
Identifikasi Bakteri secara Molekuler
Identifikasi isolat bakteri secara molekuler dilakukan berdasarkan sekuen gen penyandi 16S-rRNA (Suwanto et al. 2000). Identifikasi isolat dilakukan dengan menentukan sekuen gen penyandi 16S-rRNA melalui PCR dan membandingkannya dengan data sekuen yang tersedia di Gene Bank. Tahap-tahap
analisis isolasi bakteri secara molekuler meliputi a) isolasi DNA total, b) amplifikasi gen penyandi 16S-rRNA dengan PCR, c) verifikasi dengan elektroforesis gel agarosa, d) ekstraksi DNA dari agarosa, e) cycle sequencing, f) purifikasi hasil PCR, dan g) sequencing hasil PCR.
Isolasi DNA Total (Maniatis et al. 1989). Isolasi DNA total dilakukan dengan menggunakan kit Genomic DNA Purification (Fermentas Life Biosciences, EU). Isolat bakteri dikulturkan pada media kaldu nutrien selama 12-14 jam. Sebanyak 1,5 mL kultur dimasukkan ke dalam tabung mikro dan disentrifugasi selama 10 menit dengan kecepatan 9000 x g. Supernatan dibuang dan ditambahkan kultur lagi berulang-ulang sampai diperoleh pelet dalam jumlah yang cukup. Ke dalam pelet ditambahkan 200 µL bufer TE dan 50 µL lisozim (10 mg dalam 167 ml), dibolak-balik dan diinkubasi selama semalam pada suhu 37 0C. Selanjutnya ke dalam tabung mikro ditambahkan 200 µL bufer lisis, diinkubasi pada suhu 65 0C selama 10 menit (setiap 3 menit dilakukan inversi/tabung dibolak-balik). Kemudian ditambahkan 600 µL kloroform, diinversi perlahan sampai terbentuk dua fase yaitu fase atas dan fase bawah. Selanjutnya disentrifugasi pada suhu 4 0C dengan kecepatan 13.000 x g selama 10 menit. Saat sedang dilakukan sentrifugasi, disiapkan larutan pengendapan dengan mencampurkan 80 µL larutan pengendapan dengan 720 µL air distilasi. Setelah sentrifugasi selesai dilanjutkan dengan mengambil fase atas/fase cair (aqueous phase) perlahan-lahan dan dimasukkan ke dalam larutan pengendapan. Pada saat dimasukkan ke dalam larutan pengendapan akan terlihat benang-benang DNA dan didiamkan selama 2 menit pada suhu ruang.
Setelah itu, dilakukan sentrifugasi pada suhu 4 0C dengan kecepatan 13.000 x g selama 10 menit. Supernatan hasil sentrifugasi dibuang dan DNA yang mengendap ditambahkan dengan 100 µL NaCl dan dikocok kuat dengan vortex. Selanjutnya ditambahkan 300 µL etanol absolut (100%) dan diinkubasi pada suhu 4 0C selama 20 menit. Kemudian disentrifugasi pada suhu 4 0C dengan kecepatan 13.000 x g selama 10 menit. Supernatan hasil sentrifugasi dibuang dan DNA yang mengendap ditambahkan dengan etanol 70% dan disentrifugasi kembali pada suhu 4 0C dengan kecepatan 13.000 x g selama 10 menit. Supernatan dibuang dan
DNA yang mengendap dikeringkan sebelum diresuspensi dengan bufer TE untuk penyimpanan di dalam lemari es suhu 4 0C.
Amplifikasi Gen Penyandi 16S-rRNA dengan PCR (Suwanto et al. 2000). DNA template diamplifikasi dengan PCR menggunakan dua primer universal spesifik untuk bakteri yaitu 63f (5’-CAGGCCTAACACAGGCAAGTC) dan 1387r (5’-GGGCGGWGTGTACAAGGC) (Marchesi et al. 1998). Ke dalam tabung mikro steril dimasukkan 18 µL ddH2O; 1,0 µL primer 63f; 1,0 µL primer
1387r; dan 25 µL Taq polymerase, kemudian dimasukkan ke dalam PCR. Kondisi PCR terdiri atas tahap: pre-PCR (95 0C, 5 menit), denaturasi (95 0C, 1 menit), annealing atau pelekatan primer (56 0C, 1 menit 15 detik), elongasi atau pemanjangan primer (72 0C, 1 menit 30 detik), post-PCR (72 0C, 7 menit), dan penyimpanan/pendinginan (4 0C). Proses PCR tersebut dilakukan sebanyak 30 siklus. Hasil PCR kemudian divisualisasi dengan elektroforesis 1% gel agarosa.
Proses selanjutnya yaitu ekstraksi DNA dari agarosa, analisis sekuen parsial gen penyandi 16S-rRNA, dan sequencing hasil PCR dilakukan oleh 1st base, Singapura. Data sekuen DNA yang telah diperoleh dibandingkan dengan data sekuen di Gene Bank untuk menentukan pohon filogenetiknya. Analisis klaster dilakukan dengan menggunakan program dari National Center Biotechnology Information (NCBI) (Van de Peer & De Watcher 1993), sedangkan pembuatan pohon filogenetik menggunakan program Clustal X2 dan NJ-plot.
Uji Kualitatif Enzim Selulase
Uji aktivitas selulolitik dilakukan secara kualitatif dan kuantitatif. Uji kualitatif dilakukan dengan metode pewarnaan merah kongo 0,1%. Isolat PMP 0126y ditotolkan pada media agar-agar CMC (Lampiran 1). Bakteri diinkubasi selama 5 hari pada suhu 37 0C. Kemudian dilakukan uji aktivitas bakteri dengan menambahkan merah kongo 0,1% sebanyak 15 mL dan didiamkan selama 30-60 menit. Setelah itu dibilas sebanyak 2-3 kali dengan 15 mL NaCl 1 M dan didiamkan selama 15 menit. Diameter zona bening dan diameter koloni yang terbentuk diukur. Uji aktivitas selulase dilihat dari indeks selulase yang terbentuk. Indeks selulase merupakan nisbah antara diameter zona bening dengan diameter koloni. Semakin besar indeks selulolitik yang dihasilkan maka semakin besar enzim yang dihasilkan oleh isolat bakteri tersebut. Indeks selulolitik atau indeks
aktivitas selulase (IAS) diperoleh dengan menggunakan rumus sebagai berikut (Kader & Omar 1998):
Indeks selulolitik =
Penentuan Waktu Optimum Produksi Enzim Selulase
Penentuan waktu optimum produksi enzim selulase diawali dengan penentuan waktu penuangan inokulum. Hal ini dilakukan agar dapat diketahui waktu pertumbuhan eksponensial bakteri pada inokulum yang akan digunakan. Penentuan waktu inokulum dilakukan dengan mengkultur 2 lup isolat di dalam 10 mL kaldu nutrien dan diinkubasi selama 12-14 jam, kemudian dituang ke dalam 50 mL media cair CMC. Kultur diinkubasi pada suhu 30 0C di dalam penangas goyang dengan kecepatan agitasi 150 rpm. Pengambilan sampel dilakukan selama 27 jam inkubasi dengan rentang waktu sampling 3 jam untuk diukur nilai Optical Density (OD) pada panjang gelombang 600 nm. Setelah itu, dibuat kurva pertumbuhan bakteri untuk menentukan waktu yang terbaik pada penuangan inokulum pada media produksi. Selanjutnya, dilakukan penghitungan jumlah koloni total pada cawan (TPC) untuk memperkirakan jumlah sel bakteri pada setiap nilai OD yang dihasilkan.
Setelah waktu penuangan inokulum ke dalam media produksi diketahui, dilanjutkan dengan penentuan waktu optimum aktivitas enzim selulase. Sebanyak 5 mL kaldu nutrien yang telah mengandung biakan sel diinokulasikan ke dalam 25 mL media inokulum yang mengandung glukosa 0,1%. Inokulum tersebut dituang ke dalam 250 mL media produksi tanpa glukosa (sebanyak 10% dari media produksi). Waktu penuangan inokulum dilihat dari waktu pertumbuhan eksponensial bakteri (fase pertumbuhan logaritmik) yang telah diketahui dari kurva pertumbuhan bakteri. Pengambilan sampel dilakukan setiap hari selama 6 hari waktu inkubasi dilakukan.
Supernatan yang dihasilkan kemudian diuji aktivitas enzimnya dengan menggunakan metode Miller yang dimodifikasi berdasarkan absorbansi maksimum larutan pereaksi (Wood & Saddler 1988). Larutan sampel disentrifugasi pada suhu 4 0C dengan kecepatan 9000 x g selama 10 menit. Sebanyak 1,8 mL substrat (selulosa 1%) yang dilarutkan dalam 0,1 M bufer sitrat
fosfat pH 5, kemudian ditambah dengan 0,2 mL enzim selulase, dikocok kuat dengan vortex, selanjutnya diinkubasi selama 30 menit pada suhu 30 0C, dan reaksi enzim dihentikan dengan pendidihan pada suhu 100 0C selama 15 menit. Setelah itu, diambil sebanyak 1 mL dari campuran reaksi dan ditambah dengan 1 mL DNS, dididihkan pada suhu 100 0C selama 15 menit. Setelah larutan dingin absorbansi diukur pada λ 575 nm. Perlakuan kontrol dan blanko dilakukan secara bersamaan dengan metode dan tahapan yang sama. Pada kontrol, enzim yang akan direaksikan dengan substrat telah diinaktivasi terlebih dahulu dengan memanaskan enzim selama 15 menit dalam air mendidih. Pada blanko, larutan enzim diganti dengan akuades untuk direaksikan dengan substrat. Aktivitas enzim diukur pada setiap pengambilan sampel yang dilakukan sehingga dapat diketahui waktu optimum produksi enzim selulase.
Aktivitas selulase dinyatakan dalam satuan internasional yaitu U/mL. Satu unit merupakan jumlah enzim yang dibutuhkan untuk memecah 1 µmol selulosa menjadi gula pereduksi per menit pada kondisi pengujian. Kadar glukosa yang dihasilkan dari hidrolisis selulosa dengan enzim selulase berdasarkan nilai absorbansi pada λ 575 nm.
Absorbansi = ((As - Ab) - (Ak - Ab))
Nilai absorbansi yang diperoleh kemudian dimasukkan ke dalam persamaan yang diperoleh dari kurva standar glukosa (Lampiran 2). Kemudian, aktivitas selulase dihitung berdasarkan rumus sebagai berikut (Irawan et al. 2008) yang dimodifikasi.
Aktivitas selulase (U/mL) =
Keterangan : As = Absorbansi sampel
Ab = Absorbansi blanko
Ak = Absorbansi kontrol
V = volume enzim (0,2 mL) t = waktu inkubasi (30 menit)
BM = Berat molekul glukosa (180 Dalton)
Produksi Enzim Kasar Selulase
Produksi enzim selulase dilakukan berdasarkan prosedur dan waktu inkubasi yang telah diketahui aktivitas selulase tertinggi pada kurva aktivitas
selulase yang dihasilkan. Media pertumbuhan produksi diinkubasi pada suhu 30 0C di dalam penangas goyang dengan kecepatan agitasi 150 rpm, kemudian enzim selulase dipanen selama waktu produksi tertinggi yang telah didapatkan sebelumnya.
Kultur sel pada media produksi yang mengandung enzim selulase ekstraseluler disentrifugasi pada kecepatan 10.000 x g selama 15 menit untuk memisahkan larutan enzim dengan pelet bakteri. Supernatan hasil sentrifugasi kemudian disimpan pada suhu 10 0C sebagai enzim ekstrak kasar.
Pemurnian Enzim Selulase
Pemurnian awal enzim dilakukan dengan melakukan pemekatan enzim menggunakan ultrafiltrasi dan pengendapan amonium sulfat. Pemekatan enzim ekstrak kasar dengan ultrafiltrasi pada penelitian ini dilakukan dengan menggunakan alat ultrafiltrasi dan membran filtrasi. Enzim ekstrak kasar dimasukkan ke dalam tabung dan kecepatan pompa ultrafiltrasi sebesar 200-250 rpm. Pemekatan enzim dilakukan sampai 10 kali pemekatan, sehingga pada akhirnya akan menghasilkan enzim hasil ultrafiltrasi dan filtrat yang keluar dari membran filtrasi.
Pengendapan enzim kasar selulase dengan amonium sulfat dilakukan dengan menambahkan amonium sulfat ke dalam 20 mL enzim kasar selulase pada beberapa tingkat konsentrasi yaitu 30-90% dengan selang konsentrasi 10% kemudian diaduk perlahan dengan pengaduk magnetik pada suhu dingin selama 30 menit sampai semua amonium sulfat larut. Sebelum hasil endapan disentrifugasi, campuran enzim dan amonium sulfat pada berbagai konsentrasi didiamkan di dalam lemari pendingin suhu 4 0C selama semalam. Hal ini dilakukan agar amonium sulfat yang diberikan pada enzim dapat mengendapkan semua enzim selulase. Kemudian hasil pengendapan disentrifugasi dengan kecepatan 9000 x g pada suhu 4 0C selama 15 menit. Endapan yang dihasilkan dipisahkan dengan supernatan, kemudian endapan ditambah dengan bufer sitrat fosfat 0,05 M pH 5 sebanyak dua kali volume pelet yang dihasilkan (Rosenberg 1996). Endapan enzim dengan amonium sulfat ini akan dihitung aktivitas enzim selulase, kadar protein, dan diukur volume enzim hasil pemurnian. Selanjutnya