BAB III. PERTUMBUHAN DAN PERKEMBANGAN ULAT
SUTERA (Bombyx mori L.) C301 YANG DIBERI
KEJUT PANAS (HEAT SHOCK)
Abstrak
Pertumbuhan dan perkembangan ulat sutera (Bombyx mori) sangat di pengaruhi oleh perubahan lingkungan seperti suhu. Peranan suhu pada pertumbuhan dan per-kembangan ulat termasuk studi baru pada protein heat shock. Pertumbuhan dan perkembangan ulat sutera yang diberi kejut panas dengan suhu yang berbeda telah dilakukan di Laboratorium Fisiologi Hewan Departemen Biologi Universitas Sumatera Utara. Rancangan Penelitian yang digunakan adalah Rancangan Acak lengkap (RAL) dengan 4 perlakuan dan lima ulangan masing-masing terdiri dari 20 ulat. Perlakuan terdiri dari pemberian kejut panas yaitu suhu 34, 38 dan 42oC serta tanpa kejut panas. Kejut panas dilakukan pada awal instar IV selama 3 jam. Hasil penelitian menunjukkan bahwa pemberian kejut panas dapat meningkatkan persentase mortalitas, mempercepat stadium instar, menurunkan bobot tubuh dengan cara menurunkan pertumbuhan, konsumsi pakan dan daya cerna. Selain itu juga menurunkan produktivitas serta menimbulkan kegagalan pembentukan kokon, pupa dan imago serta keperidian.
Kata kunci : Bombyx mori, kejut panas, perkembangan, pertumbuhan
Pendahuluan
metamor-fosis, survival dan laju multiplikasi serta memodifikasi proses melanisasi dan me-ningkatkan level enzim lisozim dan phenoloxidase (PO) (Khaliq et al. 2014; Adamo dan Lovett 2011).
Suhu memiliki korelasi langsung dengan pertumbuhan ulat sutera. Fluktuasi suhu yang lebar berbahaya bagi perkembangan ulat. Kenaikan suhu akan mem-pengaruhi peningkatan fisiologis dan penurunan suhu akan menimbulkan kegiatan fisiologis menurun (Rahmathulla et al. 2004). Peningkatan suhu selama pemeliha-raan khususnya instar akhir mempercepat pertumbuhan ulat dan memperpendek periode instar. Di sisi lain pada suhu rendah, pertumbuhan dan periode instar men-jadi lambat. Lebih dari sepertiga dari serangga herbivora menunjukkan penurunan tingkat konsumsi pada suhu tinggi (Lemoine et al. 2014).
Ulat dipelihara untuk menghasilkan benang sutera dalam bentuk kepom-pong dengan mengkonsumsi daun murbei selama periode makan. Karakter biologi serangga pada fase kepompong sangat dipengaruhi oleh suhu lingkungan. Ke-mampuan individu untuk bertahan di lingkungan yang bervariasi akan mem-berikan modal dasar yang kuat bagi organisme tersebut untuk beradaptasi pada lingkungan yang tidak stabil atau ekstrim. Tetapi, keadaan ini akan membuat suatu organisme yang apabila tidak mampu mengatasi stres akan berakibat fatal dan menimbulkan kematian pada level individual dan kepunahan pada level popu-lasi (Badyaev 2005).
berbagai strategi. Jika stres lingkungan disebabkan oleh faktor biotik, maka bebe-rapa perubahan terutama perubahan perilaku akan disesuaikan interaksinya dengan faktor biotik tersebut, ada yang bersifat mutual, parasit, atau pemangsa dan mangsa (Badyaev 2005). Sebaliknya jika stres lingkungan berasal dari faktor abiotik, umumnya respon organisme akan berupa perubahan fisiologi yang di-manifestasikan dengan perubahan fenotip, misalnya memperpendek atau memper-panjang stadium instar dalam siklus hidup. Hal ini dilakukan sebagai strategi ber-tahan dan melanjutkan tahap kehidupan selanjutnya (Whitman dan Agrawal 2009).
Bahan dan metode
Telur ulat sutera yang digunakan adalah strain polihibrida yang diperoleh dari Pusat Pembibitan Ulat Sutera (PPUS) Candiroto Temanggung Jawa tengah. Bahan yang digunakan terdiri dari daun murbei, kapur tembok, kaporit, formalin, alkohol, akuades dan larutan NaCl 0,9%. Peralatan yang dipakai adalah kotak penetasan yang terbuat dari kertas putih ukuran 10x20 cm, keranjang wadah pe-meliharaan berukuran 30-40 cm, petri plastik, baskom untuk tempat penyimpanan daun murbei, gunting stek, pisau, ember, jaring ulat, ayakan, kain penutup daun, kuas, kertas alas, kertas parafin, tisu, timbangan analitik, oven dan termometer.
Penelitian ini dilakukan dengan menggunakan metode Rancangan Acak Lengkap (RAL) yang terdiri empat perlakuan dengan lima ulangan dan masing-masing ulangan terdiri dari 20 ulat sutera. Perlakuan adalah kejut panas yang di-berikan pada ulat awal instar IV selama 3 jam dengan suhu kejut panas yang ber-beda-beda. Perlakuan kejut panas terdiri dari :
P1 = kejut panas suhu 34oC P2 = kejut panas suhu 38oC P3 = kejut panas suhu 42oC
Tahapan kerja
A.Penyediaan pakan daun murbei dan penetasan telur
Daun murbei sebagai pakan ulat sutera diperoleh dari kebun murbei yang terletak di area Laboratorium Departemen Biologi, diambil setiap pagi sesuai kebutuhan untuk satu hari pemberian pakan. Daun murbei yang digunakan adalah Morus sp. Telur yang ditetaskan untuk setiap perlakuan masing-masingnya se-banyak 100 butir, kemudian dilakukan inkubasi telur agar penetasannya seragam. Inkubasi telur dilakukan dengan cara: telur disebarkan pada 4 kotak penetasan, masing-masing kotak berisikan 100 butir telur dan ditutup dengan kertas putih yang tipis. Setelah terlihat bintik biru pada telur, kemudian telur dibungkus dengan kain hitam untuk menghindari cahaya sehingga diharapkan penetasan dapat terjadi secara bersamaan. Telur diamati setiap hari. Tiga hari sebelum peme-liharaan, ruangan dan semua peralatan didesinfeksi dengan menggunakan forma-lin 2-3% dengan cara disemprotkan secara merata. Upaya desinfeksi dilakukan untuk menjaga kesehatan ulat. Setelah menetas, kemudian ulat instar I dipindah-kan ke wadah pemeliharaan. Penetasan telur dan pemeliharaan ulat sutera berda-sarkan prosedur kerja Pusat Penelitian dan Pengembangan Hutan Departemen Kehutanan Bogor (Sasmijah dan Andadari 1992).
B.Pemeliharan ulat
yang baru menetas (instar I) didesinfeksi dengan bubuk campuran kapur dan ka-porit (19:1), lalu diberi daun murbei yang muda dan segar yang sebelumnya sudah dipotong kecil-kecil. Setelah itu ulat dipindahkan ke cawan petri. Untuk menjaga kelembaban cawan petri diberi tisu yang telah dibasahi dan dialasi kertas parafin. Cawan petri ditutup dengan kertas parafin. Pemberian pakan dilakukan 3 kali se-hari yaitu pagi, siang, dan sore.
Pada setiap instar ulat akan mengalami masa istirahat dan pergantian kuti-kula. Apabila sebagian besar ulat istirahat (90%) dengan cara memperhatikan ulat tidak lagi makan dan mengangkat kepala ke atas, pemberian pakan dihentikan dan ditaburi kapur. Pada setiap akhir instar dilakukan penjarangan dan daya tampung tempat disesuaikan dengan perkembangan ulat. Pembersihan wadah pemeliharaan, pencegahan hama dan penyakit dilakukan secara teratur.
Pada instar I dan II, pembersihan dilakukan masing-masing 1 kali sedang-kan instar III sampai V dilakusedang-kan 2 kali yaitu setelah pemberian masedang-kan kedua dan menjelang moulting. Penempatan keranjang pada meja tidak boleh menyentuh dinding ruangan dan pada kaki meja diberi kaleng berisi air, untuk mencegah gangguan semut. Desinfeksi tubuh ulat dilaksanakan setiap kali ganti kutikula dan sebelum pemberian pakan pertama.
alumini-um foil dan dikeringkan dalam oven selama 24 jam pada suhu 105oC. Hal ini dila-kukan untuk mendapatkan data berat kering ulat untuk menghitung indeks nutrisi.
C.Pemberian perlakuan
Perlakuan kejut panas dilakukan pada ulat awal instar IV. Ulat diletakkan dalam keranjang yang dialasi kertas dan tetap diberikan pakan daun murbei. Kejut panas diberikan dengan cara meletakkan ulat ke dalam oven selama 3 jam sesuai dengan suhu kejut panas perlakuan yaitu suhu 34, 38 dan 42oC. Setelah 3 jam ulat dikeluarkan dari oven kemudian diletakkan kembali pada ruangan pemeliharaan.
D.Peubah yang diamati
Peubah yang diamati terdiri atas :
a. Stadium ulat, meliputi :
- Persentase mortalitas. Persentase mortalitas didapatkan dengan cara meng-hitung jumlah ulat pada akhir instar dari jumlah total awal ulat. Permeng-hitungan pa-da setiap instar dilakukan dengan menggunakan rumus:
Mortalitas =jumlah ulat awal instar − jumlah ulat akhir instar
jumlah ulat awal instar x 100%
- Stadium instar (hari). Menghitung berapa hari setiap instar dari instar awal sampai akhir atau sampai ulat berhenti makan, dilakukan pada instar IV dan V. - Bobot larva akhir instar IV dan V. Dilakukan penimbangan bobot ulat instar
awal dan instar akhir. Pertambahan bobot badan didapatkan dengan cara me-ngurangi bobot akhir dengan bobot awal instar menggunakan timbangan digital preset counter yang mempunyai akurasi 0,01g.
Menurut Scriber dan Slansky (1981), efisiensi konversi pakan dapat diketahui dengan mengetahui :
Berat kering pakan yang diberikan – berat kering sisa pakan
Berat kering pakan yang diberikan = berat basah pakan x 1 - % kadar air pakan. Berat kering sisa pakan diperoleh dengan menimbang sisa pakan setelah dioven selama 24 jam, pada suhu 105oC.
- Daya cerna (%), dihitung dengan menggunakan rumus :
Daya cerna =BK konsumsi pakan − BK feses
BK konsumsi pakan x 100%
Bobot kering (BK) feses diperoleh dengan menimbang feses yang diekskresi-kan setelah dioven selama 24 jam dengan suhu 105oC.
- Efisiensi konversi pakan dikonsumsi (ECI), dihitung dengan menggunakan rumus :
ECI = pertambahan BK bobot ulat
BK konsumsi pakan − BK feses x 100%
Pertambahan bobot kering ulat (gram) = BK ulat akhir instar – BK ulat awal instar. Bobot kering ulat diperoleh dengan menimbang sampel (5 ulangan se-tiap perlakuan) sebagai bobot basah dan dikeringkan dalam oven dengan suhu 105oC, selama 24 jam sehingga diketahui bobot kering ulat. Bobot kering ulat = bobot basah ulat x % bobot kering ulat sampel.
- Efisiensi konversi pakan di cerna (ECD), dihitung dengan menggunakan rumus:
ECD =pertambahan BK bobot ulat
BK konsumsi pakan x 100%
b. Stadium pupa, meliputi :
- Bobot kokon. Bobot kokon ditimbang dengan cara : setelah 10 hari ulat mem-bentuk kokon. Kokon dilepaskan dari tempat pengokonan kemudian ditimbang dengan menggunakan timbangan digital preset counter yang mempunyai akurasi 0,01g.
- Bobot kulit kokon. Bobot kulit kokon ditimbang setelah kokon dibelah kemudian dikeluarkan pupanya. Penimbangan kulit kokon memakai timbangan digital preset counter yang mempunyai akurasi 0,01g.
c. Stadium imago
Setiap satu pasang imago diletakkan dalam satu wadah plastik berdiameter 14 cm dengan tinggi 8 cm. Pengamatan terhadap peneluran antara lain: waktu me-letakkan telur, jumlah telur dan kematian induk dilakukan setiap hari mulai ino-kulasi sampai imago mati.
Banyaknya telur yang diletakkan ngengat betina pada masing-masing per-lakuan dan ulangan dihitung lalu dijumlahkan. Ngengat betina yang telah mati segera dibedah untuk mengetahui banyaknya telur yang masih ada di dalam ova-rium. Pembedahan dilakukan sepanjang abdomen bagian ventral dengan menggu-nakan gunting kecil dan jarum.
Untuk menghitung banyaknya telur yang ada di dalam ovarium, ngengat diletakkan di bawah mikroskop binokuler. Keperidian ngengat betina ditentukan dengan menghitung banyaknya telur yang diletakkan oleh setiap ngengat betina ditambah dengan banyaknya telur yang masih ada dalam ovarium, lalu dijumlah-kan sesuai masing-masing perlakuan.
Pengamatan bentuk, perubahan warna dan saat telur menetas dilakukan setiap hari.
Analisis data
Data kuantitatif (variable dependent) yang didapatkan, diuji kemaknaannya terhadap pengaruh kelompok perlakuan (variable independent) dengan bantuan program statistik komputer yaitu program SPSS release 20. Uji sidik ragam berbeda dapat dilihat pada Tabel 3.1.
Tabel 3.1 Persentase mortalitas ulat sutera (B.mori) C301 yang diberi kejut panas dengan suhu yang berbeda = kejut panas suhu 42oC. Nilai rataan dalam kolom yang diikuti dengan hurut yang berbeda menunjukkan perbedaan yang nyata (P<0,05)
ditemukan ulat yang mati. Persentase mortalitas pada ulat akhir instar IV dan instar V dengan perlakuan kejut panas suhu 34oC sebesar 20%, dimana dari 20 ulat yang diperlakukan terdapat 4 ulat yang mati.
Demikian pula pada perlakuan kejut panas 38oC persentase mortalitas men-capai 35% (7 ulat yang mati), persentase mortalitas semakin meningkat pada akhir instar IV dan V yaitu masing-masing sebesar 55% yang artinya terdapat 9 ulat yang mati dari 20 ulat yang diperlakukan, sedangkan pada perlakuan kejut panas 42oC pada akhir instar VI persentase mortalitas sebesar 45%, namun pada akhir instar V menjadi 70%, berarti hanya ada 6 ulat yang dapat bertahan hidup. Paparan panas pada ulat sutera suhu 17-33oC masih mampu ditoleransi sedangkan suhu 43oC menimbulkan kematian (Sinha dan Sanyal 2013). Hal ini disebabkan ketidakmampuan ulat mengadaptasikan diri terhadap kejut panas yang diberikan. Kejut panas tersebut akan menimbulkan stres, apabila tidak mampu mengatasi stres akan berakibat fatal dan menimbulkan kematian pada level individual dan kepunahan pada level populasi (Badyaev 2005). Suhu tinggi mempengaruhi reaksi biokimia dan fisiologis (Willmer et al. 2004; Regniere et al. 2012). Pemeliharaan ulat pada suhu tinggi dapat menimbulkan kematian (Khaliq et al. 2014). Suhu optimum untuk pertumbuhan normal dari ulat sutera adalah antara 20-28oC dan suhu yang diinginkan untuk rentang produktivitas maksimum adalah 23-28oC. Suhu di atas 30oC langsung mempengaruhi kesehatan ulat (Neven 2000; Rahma-thulla 2012).Ulat sutera yang mati ditandai dengan menurunnya pertumbuhan dan mengeluarkan cairan kuning (Gambar 3.1).
ber-warna kuning. Keluarnya cairan tubuh ini disebabkan ketidakmampuan ulat dalam beradaptasi terhadap perubahan lingkungan yang ekstrim sehingga mempengaruhi proses fisiologi dan metabolisme tubuh. Akibat gangguan tersebut ulat tidak mampu mempertahankan homeostatis cairan tubuh. Cairan tubuh yang keluar menimbulkan sel menjadi nekrosis dan akhirnya ulat menjadi mati (Tabel 3.1)
Gambar 3.1 Morfologi ulat sutera (B. mori) C301 yang mati setelah diberi kejut panas pada suhu yang berbeda. a = tanpa kejut panas; b = kejut panas suhu 34oC; c =kejut panas suhu 38oC dan d = kejut panas suhu 42oC -Lama stadium instar (hari)
4 hari (P<0,05), sedangkan pada kejut panas 38 dan 42oC, stadium instar selama 3,23 dan 3,18 hari, ini berbeda nyata dengan tanpa kejut panas dan suhu 34oC. Tanpa kejut panas dan suhu 34oC tidak memberikan pengaruh yang berbeda, hal ini disebabkan ulat masih bisa mentoleransi kejut panas sampai pada suhu 34oC dibandingkan kejut panas suhu 38 dan 42oC. Menurut Benchamin (1983) masa stadium ulat setiap instar dapat menjadi lebih cepat apabila dilakukan pada suhu di atas optimal sampai batas yang dapat ditoleransi.
Tabel 3.2 Rataan lama stadium instar ulat sutera (B. mori) C301 yang diberi kejut panas dengan suhu yang berbeda = kejut panas suhu 42oC. Nilai rataan dalam kolom yang diikuti dengan hurut yang berbeda menunjukkan perbedaan yang nyata (P<0,05)
memberikan dampak sinergis mengenai periode instar (Reddy 2002). Perubahan suhu bersama dengan kelembaban memberikan efek terhadap periode pergantian kutikula (Mishra dan Upadhyay 2002). Penurunan suhu meningkatkan durasi pergantian kutikula ulat sutera (Morohoshi 1969; Kamili dan Masoodi 2004). Beberapa studi menunjukkan bahwa ulat sutera lebih peka terhadap suhu tinggi pada instar IV dan V (Ueda dan Lizuka 1962; Tazima dan Ohuma 1995).
-Pertambahan bobot ulat akhir instar IV dan V.
Pengamatan terhadap pertambahan bobot ulat akhir instar IV dan V yang diberi kejut panas dengan suhu yang berbeda dapat dilihat pada Tabel 3.3.
Tabel 3.3 Rataan pertambahan bobot ulat sutera (B. mori) C301 yang diberi kejut panas dengan suhu yang berbeda
Perlakuan Rataan pertambahan bobot ulat (g)
Instar IV Instar V = kejut panas suhu 42oC. Nilai rataan dalam kolom yang diikuti dengan hurut yang berbeda menunjukkan perbedaan yang nyata (P<0,05)
imago dan fase fertilisasi. Pada Gryllus texensis suhu 33oC meningkatkan jumlah telur dan bobot badan (Adamo dan Lovett 2011).
Fluktuasi suhu yang bervariasi menyebabkan serangga tidak mampu men-capai kinerja fisiologis yang optimal dan akan bisa dimen-capai apabila ditempatkan pada kondisi ideal dan menguntungkan. Seleksi alam akibat kondisi lingkungan yang kurang ideal, menyebabkan serangga memiliki kemampuan tertentu untuk mengevaluasi lingkungan dan membuat keputusan dalam melibatkan respon fisio-logis, perilaku, dan genetik. Tanggapan ini sering melibatkan perubahan konsumsi dan pemanfaatan pakan, tingkat konsumsi dan waktu makan, penyimpangan peri-laku, metabolisme, sintesis enzim, gizi, proses fisiologis dan perilaku lainnya. Perlakuan suhu dapat mempengaruhi kinerja fisiologis yang berbeda dibanding-kan pada suhu konstan. Suhu yang berfluktuasi adibanding-kan merangsang kinerja pertum-buhan (Scriber dan Slansky 1981; Jaworski dan Hilszczanski 2013).
Perkembangan adaptasi berbagai proses enzimatik dan metabolik yang me-mungkinkan ulat untuk bertahan hidup dan berkembang dalam berbagai suhu. Aklimatisasi suhu dan fisiologis serta perilaku termoregulasi memungkinkan se-rangga untuk berkompensasi pada berbagai tingkat perubahan suhu lingkungan (Heinrich 1981). Ulat instar V yang diberi stres suhu 35±1oC dapat meningkatkan aktifitas enzim katalase terutama pada jaringan lemak namun pada suhu 40±1oC terjadi penurunan aktifitas (Nabizadeh dan Kumar 2010).
mengarah ke pertumbuhan yang tidak teratur dan kesehatan menjadi buruk (Tana-ka et al. 1971). Tingkat konsumsi pakan dan kualitas nutrisi mempengaruhi per-tumbuhan ulat, berat badan, dan kelangsungan hidup (Murugan dan George 1992). Konsumsi pakan secara keseluruhan meningkat antara suhu 20-30oC dan bila suhu dinaikkan konsumsi pakan akan mengalami penurunan (Lemoine et al. 2014).
Serangga memperoleh energi dan nutrisi melalui makan untuk mendukung pertumbuhan dan perkembangan. Jalur yang terlibat pada regulasi makan adalah keberadaan insulin di hemolimf. Pada Tribolium castaneum, keberadaan insulin mengatur asupan pakan melalui kerja dari neuropeptida sulfakinin yang ada di sistem saraf. Neuropeptida sulfakinin berfungsi sebagai reseptor insulin. Pem-blokiran reseptor insulin (INR) menurunkan asupan pakan pada masa instar IV dan V yang akan menimbulkan penurunan berat badan dan kematian terutama ke-matian ulat pada saat proses metamorfosis menjadi pupa (Lin et al. 2016). Efek panas dapat menimbulkan kerusakan sistem saraf dan endokrin (Neven 2000).
Menurut Miranda et al. (2002) hormon juvenil dapat mempertahankan per-tumbuhan ulat. Pemberian metopren (analog hormon juvenil) 48 jam setelah ecdy-sis ulat instar IV pada integumen dorsal segmen toraks ke-2 dapat meningkatkan durasi instar V, bobot ulat, kelenjar sutera, kulit kokon dan bobot pupa. Selain itu dapat mengontrol kenaikan produksi sutera sekitar 24% serta dapat memperta-hankan kualitas kokon sekitar 12%.
-Efisiensi pakan
dengan P2 (kejut panas suhu 38oC) dan P3 (kejut panas 42oC) yaitu sebesar 0,40 dan 0,32 g/ulat. Hal yang sama juga pada data efficiency conversion of feed diges-tibility (ECD) dan konversi pakan. ECD dan konversi pakan pada perlakuan tanpa kejut panas (P0) dan kejut panas suhu 34oC (P1) berturut-turut adalah 24,80%; 23,56% dan 1,31; 1,17(P>0,05). Sedangkan pada perlakuan kejut panas suhu 38oC dan 42oC, ECD dan konversi pakannya adalah 20,61%; 20,09% dan 0,99; 0,91. Tabel 3.4 Rataan konsumsi bahan kering, daya cerna, ECI, ECD dan konversi panas suhu 42oC; ECI = efficiency of conversion of feed ingested; ECD = efficiency conversion of feed digestibility
Peningkatan suhu pemeliharaan ulat sutera menurunkan indeks nutrisi se-perti daya serap, daya cerna dan persentase daya cerna (Rahmathulla et al. 2004). Indek nutrisi pada beberapa ulat masih bisa dipertahankan, hal ini kemungkinan adanya aktivitas enzim α-amilase yang masih dapat membantu proses metabo-lisme tubuh. Menurut Kaur et al. (2014) dalam kondisi fisiologis, α-amilase me-ningkatkan kinerja pencernaan serangga yang menyebabkan hidup dalam kondisi yang berbeda dan meningkatkan kebugaran biologis. Sekresi α-amilase tergan-tung pada kalsium dan ion klorida untuk integritas dan aktivitas struktural.
dilakukan secara in vitro, efek acarbose pada indeks nutrisi dan aktivitas ami-lolitik secara in vivo dan penentuan gen yang bertanggung jawab untuk sekresi α -amilase dan respon ekspresi metabolisme acarbose pada larva (Kaur et al. 2014). Dari Tabel 3.4 dapat juga dilihat untuk nilai persentase daya cerna ulat sutera instar IV antar perlakuan tanpa kejut panas berbeda nyata dengan yang diberi kejut panas pada suhu 34, 38 dan 42oC yaitu 58,75%; 47,62%; 42,07% dan 40,45%. Hal ini juga sama dengan nilai efficiency of conversion of feed ingested (ECI), bahwa tanpa kejut panas berbeda nyata dengan yang diberi kejut panas. Analisis indeks nutrisi seperti tingkat konsumsi, pencernaan, asimilasi, dan kon-versi pakan pada perkembangan ulat berguna dalam memahami perbedaan rasial pada sistem pencernaan dan kemampuan asimilasi ulat sutera.
Tingkat efisiensi konsumsi pakan ulat pada instar V dapat dilihat pada Tabel 3.5 berikut ini.
nyata antara perlakuan tanpa kejut panas dengan kejut panas suhu 34oC dengan perlakuan kejut panas suhu 38 dan 42oC. Begitu juga untuk nilai ECI mengalami penurunan, semakin tinggi suhu yang diberikan efficiency of conversion of feed ingested semakin berkurang. Nilai efficiency of conversion of feed ingested (ECI) ulat berbeda nyata antara perlakuan tanpa kejut panas dan kejut panas suhu 34oC dengan perlakuan kejut panas suhu 38 dan 42oC.
pencernaan akan baik pada suhu 23-25oC dan kondisi kelembaban 65-70%. Menu-rut Rahmathulla (2003) kelembaban dan indeks nutrisi berpengaruh terhadap per-kembangan kelenjar sutera.
Suhu merupakan faktor penting pada aktivitas enzimatik. Menaikkan suhu media dari nilai optimal meningkatkan laju reaksi katalis enzim karena energi kinetik dan frekuensi molekul menjadi lebih tinggi (Delkash-Roudsari et al. 2014). Nilai optimal untuk aktivitas α-amilase pada serangga pada suhu 30-60oC (Zibaee 2012).
b. Stadium pupa.
Pengamatan pada stadium pupa, meliputi bobot kokon, kulit kokon dan pu-pa ulat sutera yang diberi kejut pu-panas dengan suhu yang berbeda disajikan pu-pada Tabel 3.6 berikut ini.
Tabel 3.6 Rataan bobot kokon, kulit kokon dan pupa ulat sutera (B. mori) C301 yang diberi kejut panas dengan suhu yang berbeda.
Perlakuan Bobot kokon (g) Bobot kulit kokon (g) Bobot pupa (g)
P0 1,26a 0,28a 0,99a
P1 1,10b 0,19a 0,89a
P2 0,90bc 0,09b 0,78b
P3 0,61c 0,08b 0,49c
Keterangan : P0 = tanpa kejut panas; P1 = kejut panas suhu 34oC; P2 = kejut panas suhu 38oC; P3 = kejut panas suhu 42oC
Pada Tabel 3.6 juga dapat dilihat bahwa bobot kulit kokon dan bobot pupa juga mengalami penurunan. Semakin tinggi suhu kejut panas yang diberikan se-makin turun bobot kulit kokon dan pupa. Penurunan bobot kulit kokon antara per-lakuan tanpa kejut panas dengan kejut panas suhu 34oC tidak berbeda nyata yaitu sebesar 0,28 dan 0,19g, namun berbeda nyata dengan perlakuan kejut panas suhu 38 dan 42oC yaitu sebesar 0,09 dan 0,08g. Pengamatan terhadap bobot pupa anta-ra perlakuan tanpa kejut panas dan kejut suhu 34oC tidak berbeda nyata tetapi ber-beda nyata dengan perlakukan kejut panas suhu 38 dan 42oC, secara berurutan adalah 0,99; 0,89; 0,78 dan 0,49g. Dari pengamatan di atas dapat dinyatakan bah-wa perlakuan kejut panas berpengaruh terhadap kualitas kokon dan pupa.
Perlakuan kejut panas menimbulkan kegagalan pembentukan pupa (Gambar 3.2). Pada gambar dapat dilihat bahwa pada perlakuan tanpa kejut panas ter-bentuk pupa yang sempurna (Gambar 3.2a), sedangkan perlakuan kejut panas suhu 34, 38 dan 42oC terjadi kegagalan pembentukan pupa. Pupa terlihat meng-alami bentuk yang abnormal, kering dan mati (Gambar 3.2b, 3.2c dan 3.2d)
Gambar 3.2 Kegagalan pembentukan pupa ulat sutera (B. mori) C301 yang diberi kejut panas dengan suhu yang berbeda. a = tanpa kejut panas; b = kejut panas suhu 34oC; c =kejut panas suhu 38oC dan d = kejut panas suhu 42oC
c. Stadium imago
Pada gambar terlihat imago perlakuan tanpa kejut panas dikawinkan dan terjadi fertilisasi sehingga dapat menghasilkan telur (Gambar 3.3a) sedangkan pada perlakuan kejut panas suhu 34, 38 dan 42oC, dari lima pasang yang dikawinkan semua mengalami kegagalan fertilisasi sehingga telur yang dihasilkan sedikit (Gambar 3.3b) dan bahkan tidak menghasilkan telur terutama pada kejut panas suhu 42oC (Gambar 3.3d).
Gambar 3.3 Gambaran keperidian ulat sutera (B. mori) C301 yang diberi kejut panas dengan suhu yang berbeda. a = tanpa kejut panas; b = kejut panas suhu 34oC; c = kejut panas suhu 38oC dan d = kejut panas suhu 42oC
tetua untuk program pembibitan. Untuk mencapai keberhasilan yang lebih besar, diperlukan pemahaman mekanisme molekuler toleransi suhu pada ulat, identi-fikasi berbagai kelompok heat shock protein (Hsp) (Neven 2000). Hal ini diperlu-kan untuk menemudiperlu-kan gen yang bertanggung jawab terhadap induksi panas dengan langkah-langkah menemukan genomnya pada ulat sutera.
Kesimpulan
Perkembangan dan pertumbuhan ulat sutera (B. mori) dipengaruhi suhu. He-at shock He-atau kejut panas yang diberikan pada awal instar IV meningkHe-atkan per-sentase mortalitas sebesar 45% pada akhir instar IV dan 70% pada akhir instar V, memperpendek masa stadium instar, menurunkan pertambahan bobot ulat dan nilai indeks nutrisi serta produktivitas kokon dan menimbukan kegagalan per-kembangan pupa dan imago.
Saran
BAB. IV ISOLASI FRAGMEN cDNA GEN PENYANDI AKTIN
ULAT SUTERA (Bombyx mori L.) C301
Abstrak
Bombyx mori adalah serangga yang tidak tahan terhadap pengaruh lingkungan ekstrim seperti suhu tinggi. Ekspresi gen yang diinduksi dengan kejut panas me-merlukan gen kontrol internal. Gen kontrol internal yang biasa digunakan adalah aktin. Gen aktin termasuk gen housekeeping. Penelitian ini bertujuan untuk meng-isolasi fragmen cDNA yang menyandikan gen aktin dari B. mori. RNA total di-isolasi dari bagian kepala ulat dan dijadikan cetakan untuk sintesis cDNA total melalui transkripsi balik. Fragmen cDNA yang menyandikan aktin dari B. mori C301 telah berhasil diisolasi. Primer yang digunakan adalah forward (5’-ATC ACC ATC GGA AAC GAA AG-3’) dan reverse (5’-GGT GTT GGC GTA CAA GTC CT-3’)]. Fragmen gen cDNA selanjutnya dinamai BmAct1. Analisis kese-jajaran berdasarkan urutan nukleotida menunjukkan bahwa BmAct1 memiliki ke-miripan 99% dengan B. mori isolat W5-30 actin-4 mRNA.
Kata kunci : aktin, Bombyx mori, gen kontrol internal
Pendahuluan
Aktin adalah protein yang paling berlimpah di sebagian besar sel-sel euka-riotik, berperan pada interaksi protein. Aktin memiliki monomer G-aktin dan F-aktin yang berfungsi dalam pengendalian hidrolisis nukleotida, ion dan sejumlah besar protein aktin. Hal ini membuat aktin berperan penting dalam banyak fungsi sel, mulai dari motilitas sel dan pemeliharaan bentuk sel serta polaritas untuk re-gulasi transkripsi. Selain itu, interaksi aktin filamen dengan myosin membentuk dasar dari kontraksi otot (Dominguez dan Holmes 2011).
namun pada kondisi eksperimental yang berbeda dapat saja menimbulkan variasi (Bustin 2000; Suzuki et al. 2000; Warrington et al. 2000).
Quantitative polymerace chain reaction (qPCR) adalah teknik yang efisien dan banyak digunakan untuk memantau ekspresi gen. Penggunaan HKGs sebagai acuan untuk menormalkan ekspresi gen harus memenuhi tiga kriteria. Pertama, amplifikasi mirip dengan gen target. Kedua, tingkat ekspresi harus jelas. Ketiga, ekspresinya harus stabil di semua sampel uji (Teng et al. 2012). HKGs diatur oleh regulator yang berbeda dibawah pengaruh kondisi eksperimental (Bustin 2000), oleh karena itu HKGs harus divalidasi sebelum digunakan sebagai gen referensi.
HKGs juga digunakan untuk memantau posisi serangan infeksi BmNVP pada B. mori (Kokusho et al. 2015).
Kontrol internal digunakan sebagai indikator ekstraksi asam nukleat yang sempurna, kualitas sampel dan kualitas PCR menjaga gen yang biasanya diper-lukan untuk pemeliharaan fungsi selular basal. Peran HKG pada RT-qPCR untuk mempertahankan tingkat ekspresi gen yang konstan dalam analisis ekspresi gen (Vandesompele et al. 2001). Pada L. decemlineata dilakukan uji stabilitas gen housekeeping seperti : β-aktin, RP4 dan RP18. Diantara ketiga gen tersebut yang paling stabil sebagai gen referensi adalah RP4 (Zhu et al. 2011).
Bahan dan metode
elektro-foresis pada gel agarose 1% di dalam larutan penyangga TAE 1x. Visualisasi RNA total dilakukan di atas UV transiluminator GelDoc (Labquip) setelah diwar-nai dengan EtBr (0,5µg/ml) selama 15 menit dan dibilas dengan air. Dilarutkan RNA total dengan DEPC-water dan inkubasi pada 55oC selama 10 menit.
Sintesis cDNA Total. Sintesis cDNA total dilakukan dengan menggunakan qPCR BIO cDNA Synthesis Kit (oligo (dT), random hexamer, 15mM MGCl2 dan 5mM dNTPs. Master mix divorteks kemudian di ambil 4µl 5x cDNA synthesis mix, 4µl RNA total dan di tambah DEPC water sampai volume 20µl. Dihomogenkan ke-mudian diinkubasi pada suhu 42oC selama 30 menit dan untuk denaturasi RTase diinkubasi pada suhu 85oC selama 10 menit.
Desain Primeraktin. Desain primer merupakan salah satu bahan yang digunakan dalam proses perbanyakan untai DNA dengan menggunakan metode Polymerase Chain Reaction (PCR). Desain primer dilakukan untuk membuat untaian basa nukleotida yang akan menempel dan mengapit daerah untaian DNA tertentu dari total genom yang ada pada kromosom. Pengapitan daerah untaian DNA diperlu-kan untuk melakudiperlu-kan perbanyadiperlu-kan (amplifikasi) hanya pada daerah untaian DNA tertentu sehingga lebih mudah dalam melakukan analisis terhadap daerah untai DNA tersebut. Keberhasilan melakukan amplifikasi daerah untai DNA sangat di-pengaruhi oleh kesesuaian primer terhadap kondisi untai DNA target pada posisi nukleotida 150-200 pb.
forward (5’-ATC ACC ATC GGA AAC GAA AG-3’) dan reverse (5’-GGT GTT GGC GTA CAA GTC CT-3’).
Validasi primer aktin dilakukan pada target gen 150 pb menggunakan PCR dengan primer aktin yang sudah didesain. cDNA diamplifikasi dengan mengguna-kan rotor-gene 3000 RT-PCR dengan cara diawali dengan denaturasi pada suhu 95oC selama 90 menit, dan 40 siklus pada 95oC selama 5 menit dan 58oC selama 30 menit.
Hasil dan pembahasan
RNA total diisolasi dari kepala B. mori, kemudian diukur rasio panjang gelombang 260/280 nm bernilai 1,9 yang menunjukkan bahwa isolasi RNA total mempunyai kemurnian yang cukup tinggi, sehingga dapat digunakan sebagai cetakan untuk sintesis cDNA. PCR dengan menggunakan cDNA total sebagai cetakan dari primer aktin [forward (5’-ATC ACC ATC GGA AAC GAA AG-3’) dan reverse (5’-GGT GTT GGC GTA CAA GTC CT-3’)] menghasilkan pita pada posisi 300 pb, selanjutnya dinamakan aktin B. mori (BmAct1) (Gambar 4.1).
Gambar 4.1 Fragmen BmAct1 hasil PCR dengan menggunakan primer aktin universal untuk B. mori
mori isolat W5-30 actin-4 mRNA. Hubungan filogenetiknya dapat dilihat pada Gambar 4.2 dan urutan basa fragmen gen BmAct1 dapat dilihat pada Gambar 4.3.
Gen aktin dan transkripsi mengendalikan target dari proses diferensiasi, karena gerakan sel aktin terkoordinasi dalam pertumbuhan sel dan diferensiasi. Peristiwa munculnya kelompok gen aktin akan terlihat dalam jaringan tertentu dan pada saat tertentu juga. Proses ini melibatkan interaksi protein regulator dengan urutan tertentu yang terletak di dalam atau segera mengapit gen yang diinginkan (Gustafson dan Kedes 1989). Ekspresi gen ini adalah multigen pada organisme yang berbeda (Herman 1993).
Gambar 4.3 Urutan nukleotida fragmen gen BmAct1 B. mori C301
Gen ini juga dijadikan sebagai model untuk mempelajari mekanisme dasar regulasi transkripsi pada cacing pipih dan telah ditemukan pada cis-linked untuk aktivitas transkripsi dari dua gen aktin pada E. Granulosus, yaitu EgactI dan EgactII (Silva et al. 1993). EgactI dan EgactII promotor fungsional pada E. granulosus dan promotor cestoda lainnya dapat dilakukan dalam baris sel hete-rolog (Gimba et al. 2000). Promotor Aktin AI sangat ideal untuk transgenik sel pada Antheraea pernyi (Liu et al. 2014).
Helico-verpa armigera, keempat gen terdapat intron dalam kodon 117, posisi asli tidak ditemui pada spesies lain. Perbandingan dari empat gen mengungkapkan bahwa gen B. mori dan H. armigera berbeda pada urutan coding dan intron, itu lebih mi-rip pada paralogous gen dalam setiap spesies dan gen orthologous dari dua spe-sies. Sebaliknya, yang lain (noncoding) daerah kesamaan terbesar antara gen dari satu spesies dan gen dari spesies lain, adalah dua pasang gen orthologous, BmA3 dan HaA3a di satu sisi dan BmA4 dan HaA3b di sisi lain.
Hal ini menunjukkan bahwa konversi gen juga bisa bertanggung jawab un-tuk transfer intron dalam salinan gen yang akhirnya dapat membedakan garis ke-turunan antara B. mori dengan H. armigera (Mange dan Prudhomme 1999). Gen aktin sitoplasma B. mori dikendalikan promotor BmA3 (Tamura et al. 2000).
Ekspresi beberapa gen GRP pada B.mori diprediksi menyandi protein kuti-kula dalam sel epidermis (Suzuki et al. 2002; Zhong et al. 2006). Tiga gen GRP kutikula telah diidentifikasi dari strain tahan insektisida yaitu kumbang kentang Colorado Leptinotarsa decemlineata. Gen ini muncul karena diinduksi oleh insek-tisida (Zhang et al. 2015).
Gen kontrol menampilkan ekspresi yang sangat beragam pada organisme se-lama tahapan pertumbuhan dan di bawah kondisi lingkungan yang berbeda. Menurut Selvey et al. (2001) gen template yang digunakan adalah 18S rRNA yang memiliki keunggulan kompetitif sebagai kontrol internal untuk aplikasi RT-qPCR. β-Actin paling sesuai sebagai kontrol internal untuk RT-qPCR.
juga digunakan sebagai standar internal (Thellin 1999). RNA yang diisolasi dari darah dalam menentukan ekspresi gen protein asam ribosom manusia dibutuhkan gen housekeeping untuk menormalkan mRNA (Dheda, et al. 2004).
Kesimpulan
Analisis kesejajaran berdasarkan urutan nukleotida gen aktin B.mori C301 yang diisolasi menunjukkan bahwa BmAct1 memiliki kemiripan 99% dengan B. mori isolat W5-30 actin-4 mRNA.
Saran
BAB V. ISOLASI, PENGKLONAN DAN ANALISIS EKSPRESI
GEN PENYANDI HEAT SHOCK PROTEINS (HSPs)
DARI ULAT SUTERA (Bombyx mori L.) C301
Abstrak
Gen penyandi Heat shock protein (Hsp) berfungsi sebagai molekul chaperone yang bertanggungjawab dalam mempertahankan diri dari stres lingkungan. Untuk mendapatkan gen Hsp diawali dengan isolasi RNA total dari kepala, kelenjar sutera, kutikula dan rektum dengan menggunakan reagen Trizol, kemudian isolasi fragmen gen Hsp dengan PCR menggunakan qiagen one step (Invitrogen) dengan 3 primer spesifik (HspBmC, Hsp20,4 dan Hsp70) dan ekspresi gen Hsp yang diberi kejut panas pada suhu 34, 38 dan 42oC serta tanpa kejut panas sebagai kontrol. Analisis ekspresi gen di lakukan dengan RT-qPCR. Hasil penelitian me-nunjukkan bahwa isolasi RNA total ditemukan pada kepala, kelenjar sutera dan rektum sedangkan pada kutikula terjadi penggupalan kapur yang tidak larut dengan pemberian DEPC water dan ddH2O. Analisis urutan nukleotida me-nunjukkan bahwa fragmen gen HspBmC memiliki ukuran 712 pb homolog ter-hadap heat shock proteins 25.4 B. mori dengan E value 0.0 (max identity 99%). Fragmen gen Hsp20,4 berukuran 535 pb homolog terhadap heat shock proteins 20.4 mRNA B. mori dengan E value 3e-105 (max identity 99%) dan Hsp70 ber-ukuran 240 pb homolog terhadap heat shock proteins 70 mRNA B. mori dengan E value 5e-96 (max identity 99%). Ekspresi gen Hsp25,4 dan Hsp70 tertinggi pada kejut panas suhu 34oC, sedangkan Hsp 20,4 tertinggi pada kejut panas suhu 42oC. Kejut panas suhu 34oC dan 38oC pada Hsp20,4 menunjukkan ekspresi yang ham-pir sama. Ekspresi gen terendah pada Hsp70 setelah pemaparan suhu 38oC. Kata kunci : Bombyx mori, Hsp, kelenjar sutera, kutikula, rectum
Pendahuluan
mampu menyesuaikan diri terhadap perubahan kondisi lingkungan atau mampu menampilkan lebih dari satu bentuk morfologi, status fisiologi dan tingkah laku, maka dikatakan memiliki kelenturan fenotipik (phenotypic plasticity) yang di-kontrol oleh gen. Komponen lingkungan yang ekstrim mempengaruhi ekspresi ge-notip (Rahmathulla 2012).
Gen terdapat di dalam sel, mengandung protein, DNA dan RNA. RNA me-rupakan molekul tidak stabil dan memiliki waktu paruh yang sangat singkat sete-lah diekstrak dari sel atau jaringan (Brooks 1998). Dibutuhkan penanganan khu-sus karena RNA rentan terhadap degradasi (Kojima dan Ozawa 2002; Bucking-ham dan Flaws 2007). Ada beberapa jenis RNA, termasuk RNA ribosom (rRNA) (80%-90%), RNA messenger (mRNA) (2,5% -5%) dan RNA transfer (tRNA) (Buckingham dan Flaws 2007). Isolasi RNA dari sel dan jaringan merupakan pro-sedur awal untuk analisis ekspresi gen (Chomczynski dan Sacchi 2015).
RNA merupakan biomolekul yang berisikan untaian panjang unit nukleo-tida. Nukleotida RNA tersusun atas basa nitrogen, gugus gula dan phospate. RNA mirip dengan DNA, akan tetapi berbeda berdasarkan stuktur penyusunnya. RNA berutas tunggal, dan DNA utas ganda. Nukleotida RNA berisikan ribose dan DNA deoksiribosa (tipe dari ribose yang kurang satu atom oksigen). Pada RNA terdapat Urasil dan DNA terdapat timin. Ekstraksi biomolekul, DNA, RNA, dan protein, adalah metode yang paling penting yang digunakan dalam biologi molekuler (Wink 2006).
ada-lah aktivitas RNAse dan struktur RNA yang utas tunggal. RNAase merupakan en-zim yang mempunyai kemampuan untuk mendegradasi RNA. Struktur RNA yang utas tunggal jika terdapat suhu tinggi maka RNA dapat terdegradasi. Ketidak-stabilan RNA terutama karena enzim RNase yang pada semua jaringan, serta bakteri dan jamur di lingkungan (Brooks 1998; Buckingham dan Flaws 2007). Denaturan yang kuat selalu digunakan dalam isolasi RNA total untuk meng-hambat RNase endogen (Doyle 1996). Pada sel eukariotik terdapat empat jenis rRNA (28S, 18S, 5.8S, dan 5S) yang bervariasi dalam ukuran dan urutan (Mitra 2003).
Keberhasilan dari setiap strain larva baru di lapangan tergantung pada meka-nisme molekuler dari sel yang melibatkan respon gen heat shock proteins (Hsp). Peristiwa ini merupakan sintesis cepat protein khusus yaitu protein heat shock (Park et al. 2008). Protein heat shock (Hsp) bertindak sebagai molekul chaperone untuk menjamin kelangsungan hidup yang lebih baik dalam kondisi stres, ter-masuk thermostress (Mosser dan Morimoto 2004). Heat shock proteins adalah protein yang memungkinkan sel untuk mengatasi masalah protein. Hal ini bia-sanya terjadi setelah sel mengalami stres, kemudian gen akan dapat mengenali dan mengikat ke sisi yang terkena. Dengan demikian molekul chaperone mencegah kelompok sisi terikat untuk terlibat dalam interaksi yang tidak tepat dengan komponen seluler lainnya, serta menstabilkan protein terikat. Heat shock proteins melakukan peran dengan cara membentuk polipeptida baru, sedangkan yang diin-duksi Hsp berfungsi dalam menanggapi denaturasi protein akibat stres (Li et al. 2016).
(stres) dapat mengaktifkan Hsf, menyebabkan terjadi pemisahkan diri dari Hsp. Hsf terfosforilasi oleh protein kinase dan terbentuk trimer dalam sitosol. Trimer Hsf kompleks memasuki inti dan mengikat untuk memanaskan elemen kejut (Hse) di wilayah promotor dari gen Hsp. mRNA Hsp kemudian ditranskripsi dan me-ninggalkan inti menuju sitosol, sehingga Hsp baru disintesis (Kregel 2002).
Protein Heat shock (Hsp) sebagai molekul chaperone dan disebut juga se-bagai protein stres. Protein Heat shock (Hsp) ditemukan di hampir semua orga-nisme. Hsp dikenal sebagai protein stres dan molekul chaperone yang diinduksi oleh beberapa stress termasuk panas, dingin, kekeringan, kelaparan dan anoksia (King dan MacCae 2015) serta parasit (Wang et al. 2016). Berdasarkan urutan ho-mologi dan berat molekul Hsp dapat dibagi menjadi lima kelompok termasuk heat shock protein kecil (12-42 kDa), Hsp60, Hsp70, Hsp 90 dan Hsp100 (Nover dan Scharf 1997; Li et al. 2009; Zhang et al. 2015).
membantu pelipatan dari rantai polipeptida yang baru disintesis dan Hsp70 da-lam pelipatan kembali akibat protein yang terdenaturasi dan yang gagal melipat karena diinduksi oleh stres (Morimoto 1998). Kelompok Hsp70 bekerja sama dengan kofaktor dari gen DnaJ/Hsp40 dengan ATP-dependent. Selain hidrolisis ATP, Hsp40 co-pendamping juga terlibat dalam mengarahkan protein substrat baik untuk refold atau terdegradasi ke Hsp70. Selain itu, ada yang sangat nyata korelasi antara ekspresi Hsp70 dan termotoleran pada banyak organisme (Feder dan Hofmann 1999).
baru di lapangan tergantung pada mekanisme molekuler dalam sel yang disebut sebagai respon heat shock (Howrelia et al. 2011).
Mekanisme pertahanan yang dilakukan gen Hsp akibat stres suhu tinggi, diharapkan dapat diterapkan dalam mempertahankan pertumbuhan dan perkem-bangan ulat sutera yang dibudidayakan di daerah tropis. Bibit ulat yang dibudi-dayakan di Indonesia terutama kota Medan, berasal dari daerah subtropis sehingga akan mengalami cekaman (stres) akibat perubahan suhu pemeliharaan, maka di-coba melakukan isolasi gen penyandi heat shock proteins (Hsp) pada ulat sutera. Gen yang diperoleh akan diklon dan ditransformasikan dengan harapan didapat-kan plasmid yang tersisipi fragmen gen Hsp dalam upaya perbanyadidapat-kan bibit trans-genik dari ulat sutera yang tahan terhadap perubahan suhu.
Bahan dan metode
RNA total dari beberapa bagian tubuh ulat yaitu: kepala, kelenjar sutera, kutikula dan rektum.
Tahapan kerja
a. Penetasan dan pemeliharan ulat sutera
Telur ditetaskan sebanyak ±100 butir, kemudian dilakukan inkubasi telur secara baik agar penetasannya seragam. Pemeliharaan ulat sutera meliputi peme-liharaan ulat instar I-V (Sasmijah dan Andadari, 1992).
b. Isolasi RNA total
Sampel (kepala, kelenjar sutera, kutikula dan retum) sebanyak ±5g digerus dengan bantuan nitrogen cair di dalam mortar sampai menjadi tepung. Hasil gerusan dimasukkan ke tube yang telah berisi 1ml trizol dihomogenisasi dan dilisis dengan pipetting, kemudian divorteks dan diinkubasikan pada suhu ruang selama 5 menit. Ditambahkan 0,2ml kloroform dan digoyang dengan tangan kemudian inkubasi selama 3 menit. Campuran kemudian divorteks dan disentrifu-gasi dengan kecepatan 12000rpm pada suhu 4oC selama 15 menit. Cairan bagian atas dipindahkan ke tube baru, ditambahkan 500µl isopropil alkohol dan diinku-basi pada suhu ruang selama 10 menit. Campuran disentrifugasi pada 12000rpm pada suhu 4oC selama 10 menit. Cairan dibuang, endapan RNA total dibilas dengan 1ml alkohol 75% dan disentrifugasi 12000rpm pada suhu 4oC selama 5 menit. Endapan RNA total dikeringkan dengan vaccum dryer dan disuspensikan di dalam ddH2O.
diwarnai dengan EtBr (0,5µg/ml) selama 15 menit dan dibilas dengan air. RNA total dilarutkan dengan DEPC-water atau ddH2O dan diinkubasi pada 55oC selama 10 menit.
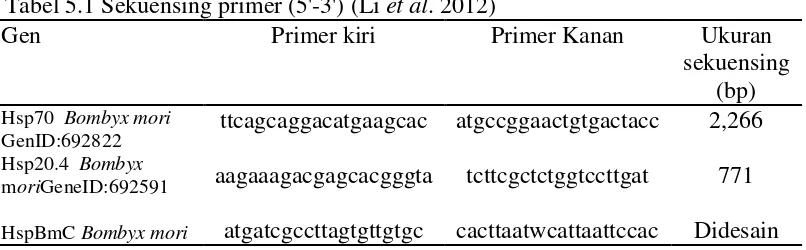
Sintesa fragmen gen Hsp. Sintesis fragmen gen dilakukan dengan mencam-purkan 1µg RNA total, 10 pmol oligo(dT), dan ditambahkan ddH2O untuk volume total reaksi 20µl, kemudian diinkubasi pada suhu 65oC selama 5 menit dan 4oC se-lama 5 menit. Kemudian ke dalam larutan ditambahkan 1x (5xqiagen RT-PCR buffter, 10 mM dNTP mix, 5-10 U DNAse inhibitor, 100 U qiagen one step RT-PCR enzyme mix (Invitrogen one step). Isolasi fragmen gen Hsp dengan PCR menggunakan 3 primer (Tabel 5.1).
Komposisi PCR untuk amplifikasi fragmen gen Hsp adalah 1µl cDNA, 1xbuffer (5xqiagen one step RT-PCR buffer), 2µl dNTP mix,10 pmol primer forward, 10 pmol primer reverse, 2µl qiagen one step RT-PCR enzyme mix dan ddH2O dengan volume reaksi 20µl. Primer spesifik didapatkan dengan menggu-nakan soft-ware primer 3 (v.0.4.0, http://www.frodo.wi.mit.edu/cgi-bin/primer3 /primer3www.cgi). cDNA diamplifikasi dengan menggunakan rotor-gene 3000 RT-PCR de-ngan cara diawali dengan denaturasi pada suhu 95oC selama 90 me-nit, dan 40 siklus pada 95oC selama 5 menit dan 58oC selama 30 menit.
Tabel 5.1 Sekuensing primer (5'-3') (Li et al. 2012)
Gen Primer kiri Primer Kanan Ukuran
sekuensing
dinaikkan hingga 95oC, data kejernihan pada suhu 55-95oC interval 80 siklus pada 0,5oC/ siklus.
Pengklonan fragmen gen Hsp. Fragmen gen Hsp diligasi dengan pGEM-T-Easy (Promega Inc.) dengan mencampur 1µl hasil PCR, 25 ng pGEM-T-Easy, 1,5U T4DNA ligase, 2,5µl 2x rapid buffer ligasi dan ddH2O dalam volume total 5µl di-inkubasi selama 1 jam pada suhu ruang. Hasil ligasi diintroduksi ke dalam E coli galur DH5α.
Seleksi E. coli yang mengandung vektor rekombinan. E. coli galur DH5α yang mengandung pGEM-T-Easy rekombinan diseleksi menggunakan antibiotik ampi-silin dengan seleksi biru putih. Konfirmasi koloni putih mengandung vektor re-kombinan yang tersisipi fragmen gen Hsp dilakukan dengan menggunakan PCR koloni dan memotong plasmid rekombinan dengan enzim EcoRI (Promega Inc.).
Perunutan DNA dan analisis urutan DNA. Perunutan DNA dilakukan dengan menggunakan automatic DNA sequenser (Macro gene). Analisis kesejajaran gen Hsp dilakukan dengan menggunakan program BLASTN.
Sintesis cDNA gen penyandi Hsp. Untuk analisis ekspresi gen digunakan cDNA sebagai template. Sintesis cDNA total dilakukan dengan menggunakan (qPCR-BIO cDNA Synthesis Kit). Komposisi campuran qPCR(qPCR-BIO cDNA Synthesis Kit yang digunakan yaitu 5x cDNA synthesis mix 4µl, 20x RTase 1µl, RNA total (antara 4pg dan 4µg) x µl dan PCR grade H2O sampai volume akhir menjadi 20µl. Mix divorteks kemudian diinkubasi pada suhu selama 30 menit. Kemudian dilan-jutkan inkubasi ke dua pada suhu 85oC selama 10 menit untuk mendenaturasi TRase.
me-nempel dan mengapit daerah untaian DNA tertentu dari total genom yang ada pa-da kromosom. Pengapitan pa-daerah untaian DNA diperlukan untuk melakukan per-banyakan (amplifikasi) hanya pada daerah untaian DNA tertentu sehingga lebih mudah dalam melakukan analisis terhadap daerah untai DNA tersebut. Keberhasi-lan melakukan amplifikasi daerah untai DNA sangat dipengaruhi oleh kecocokan primer terhadap kondisi untai DNA target pada posisi nukleotida 150 pb. Desain primer dilakukan dengan mempertimbangkan kodisi optimum PCR sesuai dengan kondisi target DNA yang akan dituju dan kondisi peralatan yang ada di dalam laboratorium. Primer acuan berdasarkan penelitian Sakano et al. (2006). Desain primer untuk analisis RT-qPCR dengan menggunakan program Primer3, melalui situs www.genome.wi.mit.edu/cgi-bin/primer/primer3.cgi/cgi. Desain primer spe-sifik berdasarkan untaian nukleotida gen Hsp yang didapatkan. Sekuen primer yang digunakan untuk analisis RT-qPCR dapat dilihat pada Tabel 5.2.
Tabel 5.2 Sekuen primer yang digunakan untuk RT-qPCR
No Gen Forward Reverse
1. Hsp25,4(2) acattggccgtatcaccatt Caacgacagctccttcatca 2. Hsp70(2) ttcagcaggacatgaagcac Catttttgtcagcaccatgc 3. Hsp20,4(2) tcttcgctctggtccttgat Gaatcgcgactgtcatcaga
Analisis ekspresi gen Hsp. Analisis ekspresi gen menggunakan RT-qPCR merk AB 96 well. Kit RT-qPCR yang di pakai adalah 2x qPCRBIO Sygreen mix Hi-Rox. Komposisi campuran 2x qPCRBIO Sygreen Mix Hi-Rox yang digunakan yaitu 2x qPCRBIO Sygreen mix 1µl, forward primer dan reverse primer (10µM) sebanyak 0,8µl, template cDNA (<100 ng) dan PCR grade ddH2O) sampai volu-me akhir volu-menjadi 20µl. Sebelum dilakukan mix reagen terlebih dahulu divorteks untuk homogenisasi reagen.
se-lama 2 menit 1 siklus untuk aktivasi polymerase, 95oC selama 5 detik 40 siklus untuk proses denaturasi dan 60oC selama 30 detik 40 siklus untuk proses anne-ling/extension serta melt analysis disesuaikan dengan instruksi alat dengan suhu 3oC selama 5 menit.
Hasil dan pembahasan
A. Isolasi RNA total
Isolasi RNA total dari beberapa bagian organ tubuh ulat sutera (B. mori) telah berhasil diisolasi. Berdasarkan pengukuran nanospektrofotometer UV-Vis, rasio λ260/280nm dari RNA total menunjukkan bahwa RNA total yang diisolasi mempunyai kemurnian yang tinggi dari kontaminan protein. Elektroforesis RNA total untuk analisis keutuhannya menunjukkan adanya dua pita RNA yang dominan. Kedua pita ini adalah RNA ribosomal (rRNA) 28S dan 18S. Pita hasil elektroforesisi RNA total dapat dilihat pada Gambar 5.1.
Gambar 5.1 RNA total dari beberapa organ ulat sutera (B. mori) C301
Konsen-trasi RNA total cukup tinggi pada setiap organ yang diisolasi, dengan kemurnian 1,825-1,896 pada λ260/280nm dan 1,810-1,907 pada λ260/230nm, hal ini berarti isolasi RNA total yang dilakukan dengan menggunakan reagen trizol sangat tepat untuk organ-organ tersebut.
Tabel 5.3 Kuantitas RNA total hasil isolasi dari beberapa bagian tubuh ulat sutera (B. mori) C301 instar V dengan nanospektrofotometer UV-Vis
Organ Konsentrasi ng/µl Absorbansi (nm)
λ260/280 λ260/230
Pada kutikula terjadi gumpalan (endapan) putih yang tidak dapat disuspensi- kan dengan DEPC water maupun ddH2O. Endapan tersebut kemungkinan berupa garam karena isopropanol dapat mengendapkan garam. Isopropanol sering digu-nakan untuk presipitasi pertama, tetapi tidak untuk tahap akhir karena cenderung mengendapkan garam. Garam adalah pengotor umum dalam sampel asam nukleat. Pemisahan satu atau beberapa tahap lanjutan isolasi RNA total diperlukan tahap pemurnian. Pada tahap pemurnian diperlukan cara untuk menghilangkan garam (Smarason dan Smith 2003). Dalam kondisi asam, RNA total akan tetap dalam fase air, sementara DNA dan protein tetap berada di interfase atau lebih rendah fase organik. Pemulihan RNA total kemudian dilakukan presipitasi dengan isopro-panol (Sambrook dan Russel 2001).
me-lalui hidrolisis kitin integumen. Mengisolasi RNA total dari organ yang mengan-dung kitinase memerlukan penanganan yang khusus (Smarason dan Smith 2003; Buckingham dan Flaws 2007). Abdel-Banat dan Koga (2016) mengisolasi RNA total dari jaringan kutikula B.mori menggunakan RNeasy Midi kit (Qiagen, Inc.). Larutan trizol dapat digunakan untuk mengisolasi RNA total dari jaringan lemak yang terdapat dibawah kutikula B.mori (Li et al. 2016; Gao et al. 2016).
seperti insulin (Nagasawa et al. 1986). Menurut Suzuki et al. (1983); Nagasawa et al. (1984); dan Kataoka et al. (1991)hormon-hormon yang terdapat pada bagian kepala ulat sutera adalah prothoracicotropic hormone (PPTH), Eclocion hormone (EH), diapauses hormone (DH) dan melanization reddish and coloration hormone (MRCH).
GCY-GGX-GCY-GGX-[UCZ(atauAGCU)-GGX-(GCY-GGX)2]8-UCZ(atauAG-CU)GGX-GCY-GCY-GGX-UACU, dimana X, Y dan Z terdapat pada setiap ribo-nucleotide (Suzuki dan Brown 1972). Isolasi RNA total B. mori pada kelenjar su-tera untuk mengawali isolasi gen yang dapat digunakan mendeteksi kerusakan ke-lenjar sutera akibat penurunan sintesis protein dan tingkat perkembangan kepom-pong. Gen yang berhubungan dengan metabolisme protein adalah Ser2, Ser3, fib-L, P25, dan CYP450 (Li et al. 2015). Ekspresi sericin-1 diatur oleh gen hox yaitu gen yang terdapat pada kelenjar sutera (Tsubota et al. 2016). Selain itu isolasi RNA total dapat juga dilakukan pada mesenteron ulat (Yu et al. 2015; Ito et al. 2016). Analisis genome lncRNAs secara komprehensif dari ulat merupakan sum-ber daya untuk studi genetik, evolusi, dan genom B. mori (Wu et al. 2016).
ekspresi aquarins pada sel-sel columnar (Mayurama dan Azuma 2015). Yassin et al. (2010), mengisolasi RNA total dari jaringan mesenteron B. mori untuk iden-tifikasi, isolasi dan kloning cDNA yang mengkode aminopeptidase.
B.Isolasi fragmen gen Hsp
Isolasi fragmen gen Hsp menggunakan RNA total dari kepala ulat sutera. RNA total hasil isolasi dari bagian kepala ulat sutera dapat dilihat pada Gambar 5.2.
Gambar 5.2 RNA total dari kepala ulat sutera (B. mori) C301 Hasil isolasi RNA total berdasarkan pengukuran nanospectrophotometer UV-Vis, rasio λ260/280nm adalah 2,0 yang berarti bahwa RNA total yang diisolasi me-miliki kemurnian yang tinggi. Hasil ini menunjukkan bahwa RNA total yang di-isolasi ini mempunyai keutuhan yang tinggi sehingga sangat baik dijadikan cetak-an (template) untuk sintesis fragmen gen. Hasil PCR fragmen gen dengcetak-an primer Hsp70 B. mori (GenID : 692822) menghasilkan fragmen gen berukuran ± 230 pb (Gambar 5.3).
Gambar 5.3 Hasil PCR optimalisasi suhu primer Hsp70. M = marker; 1 = Hsp70 suhu 52oC; 2 = Hsp70 suhu 52oC; 3 = Hsp70 suhu 55oC; 4 = Hsp70 suhu 55oC
Hasil PCR dengan primer HspBmC (didesain) dan Hsp20.4 B. mori (GeneID: 692591) menghasilkan fragmen gen berukuran 750 pb dan 250 pb (Gambar 5.4) dan hasil PCR ini dilanjutkan untuk disekuensing (Gambar 5.5).
Gambar 5.4 Hasil PCR optimalisasi suhu primer Hsp BmC dan 20,4. M = marker; 1 = HspBmC suhu 52oC; 2 = HspBmC suhu 55oC; 3 = Hsp20,4 suhu 52oC; 4 = Hsp20.4 suhu 55oC
Gambar 5.5 Fragmen gen Hsp hasil PCR dengan primer HspBmC; Hsp 20,4 dan Hsp 70. M = marker; 1 = Hsp BmC (750 pb); 2 = Hsp20,4 (250 pb); 3 = Hsp70 (250 pb).
Protein Heat shock (Hsp) merespon berbagai macam situasi stres. Faktor genetik dan non-genetik yang mempengaruhi ekspresi beberapa Hsp pada ulat yang dipanaskan atau yang diberi kejut panas. Heat shock protein (Hsp) sangat di-perlukan untuk menjaga disintesis protein di semua organisme dalam menanggapi berbagai tekanan lingkungan dan rangsangan seperti panas, hipoksia, medan mag-net, paparan bahan kimia, infeksi dan tumorigenesis (Lindquist dan Craig 1988; Feder dan Hofmann 1999; Bierkens 2000).
Pada dasarnya, sebagian besar Hsp terlibat dalam perakitan protein (Fink 1999). Pada kondisi stres, Hsp bermigrasi ke inti sel untuk memperbaiki atau
me-750 500 250 750
lindungi protein inti dan meminimalkan agregasi protein untuk mencegah keru-sakan genetik (Bensaude et al. 1990; Otsuka dan Hata 2000).
Berdasarkan penelitian yang dilakukan Li et al. (2009) urutan genome gen Hsp pada ulat sutera terdapat 16 gen Hsp. Kebanyakan terdistribusikan di dua kro-mosom yaitu krokro-mosom 5 dan 27. Dari 16 gen tersebut yang dapat terekspresi hanya 15. Analisis komparatif Hsp serangga dari B. mori, D. melanogaster, Apis mellifera, Tribolium castaneum, dan Anopheles gambiae menunjukkan bahwa hanya ada satu cluster orthologous sedangkan cluster yang tersisa adalah cluster spesifik pada pohon filogenetik. Hal ini menunjukkan bahwa sebagian besar Hsp kemungkinan telah terjadi menyimpangan fungsi pada serangga tersebut. Selain itu, diungkapkan bahwa Hsp di cluster orthologous sangat bertahan di kedua pola urutan dan ekspresi. Singkatnya, Hsp serangga menunjukkan pola evolusi yang sama sekali berbeda dari yang ditemukan pada Hsp vertebrata. Tingkat mRNA dari Hsp dapat diukur dengan metode RT-PCR kuantitatif dan dibandingkan dengan ekspresi pada profil proteome. Hasil penelitian menunjukkan terdapat up-regulasi dua protein heat shock kecil (Hsps), Hsp19.9 dan Hsp20.4 dan down-regulasi Hsp70 di lemak tubuh, testis dan ovarium ulat yang dikenai panas. Vari-asi yang tinggi dari Hsp70 yang diamati dalam kondisi yang berbeda seperti perlakuan kejut panas dan latar belakang genetik. Perbedaan yang signifikan da-lam ekspresi Hsp19.9 antara dua keturunan pada gen ini dapat mengambarkan perbedaan genetik (Li et al. 2011).
Gambar 5.6 Urutan nukleotida gen HspBmC ulat sutera (B. mori) C301
Hasil analisis blastn (www.ncbi) gen HspBmC ulat sutera homolog terhadap B. mori heat shock protein 25.4 dengan E value 0.0 (max identity 99%) (Lampiran 3). Hal ini berarti gen HspBmC adalah gen Hsp25,4. (No. aksesi NM001118903. 1). Hasil blastn sekuens gen tersebut dapat dilihat pada Tabel 5.4.
Tabel 5.4 Hasil analisis blastn sekuen gen HspBmC ulat sutera (B. mori) C301 No. Aksesi Deskripsi Total
Score
Query Cover
E Value
Max ident 1. NM001118903.1 Bombyx mori heat shock
protein 25,4 (LOC100141506)
1219 95% 0,0 99%
2. AK383480.1 Bombyx mori mRNA clone: MF8-08C10
1214 95% 0,0 99%
3. XM 004923804.1 Predicted: Bombyx mori
uncharactericed
(LOC101736516) mRNA
793 94% 0,0 89%
Gambar 5.7 Hubungan filogenetik gen Hsp BmC dari ulat sutera (B. mori) C301 Hasil sekuensing dan dianalisis untuk gen Hsp20,4 urutan nukleotidanya dapat dilihat pada Gambar 5.8.
Gambar 5.8 Urutan nukleotida gen Hsp20,4 ulat sutera (B. mori) C301 Hasil analisis blastn (www.ncbi) gen Hsp20,4 ulat sutera homolog terhadap B. mori heat shock protein 20.4 mRNA dengan E value 3e-105 (max identity 99%) (Lampiran 4) dengan nomor aksesi MN001043753.1 seperti terlihat pada Tabel 5.5.
Tabel 5.5 Hasil analisis blastn sekuen gen Hsp20,4 ulat sutera (B. mori) C301 1. MN001043753.1 Bombyx mori heat shock protein 20,4
(Hsp20,4) mRNA
392 29% 3e-105 99%
2. AK386425.1 Bombyx mori mRNA clone: fprW07G01
375 29% 3e-100 98%
3. AF309497.1 Bombyx mori mRNA clone: B-1+1Alpha-crystallin (hsp) mRNA
5. FJ602772.1 Bombyx mori heat shock protein 20,8 (Hsp20,8) mRNA complete cds
363 28% 2e-96 97%
6. NM001098324.1 Bombyx mori heat shock protein 20,8 (Hsp 20,8) mRNA
363 28% 2e-96 97%
7. AF315319.1 Bombyx mori heat shock protein 20,8A (Hsp 20,8A)gene
9. FJ602788.1 Bombyx mori heat shock protein 22,6 (Hsp 22,6) mRNA complete.cds
348 29% 7e-92 95%
Analisis filogenetik juga menunjukkan gen Hsp20,4 mengelompok dengan B. mori heat shock proteins 20,4 mRNA (LOC100141506) (Gambar 5.9).
Gambar 5.9 Hubungan filogenetik gen Hsp20,4 dari ulat sutera (B. mori) C301 Hasil sekuensing dan analisis untuk gen Hsp70 urutannya dapat dilihat pada Gambar 5.10.
Gambar 5.10 Urutan nukleotida gen Hsp70 ulat sutera (B.mori) C301 Hasil analisis blastn (www.ncbi) gen Hsp70 ulat sutera homolog terhadap B. mori heat shock 70 mRNA dengan E value 5e-96 (max identity 99%) (Lampiran 5) dengan nomor aksesi MN001043931.1 seperti terlihat pada Tabel 5.6.
Tabel 5.6 Hasil analisis blastn sekuen gen Hsp70 ulat sutera (B. mori) C301 No. Aksesi Deskripsi Total 1. MN001043931.1 Bombyx mori heat shock
protein 70 (Hsp70)
4. JF836794.1 Bombyx mori heat shock protein 70B mRNA complete, cds
355 47% 2e-94 99%
Analisis filogenetik juga menunjukkan gen Hsp70 mengelompok dengan B. mori heat shock proteins 70 (Hsp70) mRNA dengan no aksesi MN001043931.1 (Gambar 5.11).
Gambar 5.11 Hubungan filogenetik gen Hsp70 dari ulat sutera (B. mori) C301 Induksi heat shock proteins (Hsp) dianggap sebagai pelindung penting, eko-fisiological adaptif, dan respon genetik terhadap stres lingkungan di semua orga-nisme. Di antara Hsp yang yang ada, heat shock protein 70 (Hsp70) yang paling ekstensif untuk karakterisasi dan induksi dalam menanggapi stres ling-kungan dalam berbagai spesies. Protein stres Hsp70 sering dijadikan model untuk gen Hsp. Hsp70 lainnya adalah Hsc70, Hsp72, Hsp75 dan glucoseregulated proteins 78 (GRP78) (Lindquist dan Craig 1988; Feder dan Hofmann 1999; Kregel 2002). Pada copepoda, Tigriopus japonicus ekspresi Hsp70 lebih jelas daripada Hsp lainnya (Rhee et al. 2009). Heat shock protein dari protein stres yang paling utama adalah Hsp70. Hsp Ini mendukung homeostatis intraseluler dan mencegah kerusakan protein setelah kenaikan suhu dan rangsangan stres ling-kungan lainnya serta selama penuaan. Andreeva et al. (2016) melakukan kultur Hsp70 pada mesenchymal stem cells (MSCs) yang berpotensi digunakan untuk perpanjangan hidup dengan menunda berbagai manifestasi dari penuaan pada
tingkat molekuler dan seluler. Pada moluska, Hsp70 dijadikan biomarker untuk menunjukkan tingkat polusi (Boutet et al. 2003; Wepener et al. 2005). Selain itu, penelitian in vitro oleh (Gao et al. 2004; Hassen et al. 2005; Niu et al. 2006) me-nunjukkan bahwa induksi Hsp70 merupakan respon sitoprotektif dari sel untuk paparan bahan kimia beracun.
C.Analisis ekspresi gen Hsp
Validasi dilakukan untuk membuktikan target gen pada posisi 150 pb dengan cara elekroforesis hasil dari PCR. Gambaran hasil elektroforesis dapat di-lihat pada Gambar 5.12.
Gambar 5.12 Fragmen gen Hsp B. mori yang diberi kejut panas pada beberapa perlakuan suhu yang berbeda hasil PCR menggunakan primer Hsp 25,4, 70 dan 20,4. 1 = kontrol aktin; 2 = kontrol Hsp70; 3 = kontrol Hsp25,4; 4 = kontrol Hsp20,4; 5 = 34oC aktin; 6 = 34oC Hsp70; 7 = 34oC Hsp25,4; 8 = 34oC Hsp20,4; 9 = 38oC aktin; 10 = 38oC Hsp70; 11 = 38oC Hsp25,4; 12 = 38oC Hsp20,4; 13 = 42oC aktin; 14 = 42oC Hsp70; 15 = 42oC Hsp25,4
Gambar 5.12 menunjukkan bahwa hasil elektroforesis pada ukuran gen tar-get pada 150 pb terdapat pita yang utuh dengan ukuran pb yang relatif sama baik itu primer aktin maupun primer Hsp25,4, Hsp70 dan Hsp20,4 dengan kejut panas yang berbeda. Dari hasil tersebut maka dapat dijadikan template sintesis cDNA untuk analisis ekspresi gen. Sebelun running PCR dilakukan uji kuantitas RNA
total yang dijadikan template untuk sintesis cDNA. Uji kuantitas RNA total dapat dilihat pada Lampiran 1.
Hasil uji kuantitas hasil isolasi RNA total yang akan digunakan sebagai tem-plate untuk sintesis cDNA adalah sampel yang terbaik atau yang memiliki kemur-nian atau absorbansi λ260/280nm sebesar 1,7-1,8 (Lampiran 1). Hasil amplifikasi RT-qPCR untuk masing-masing primer dapat dilihat pada Gambar 5.13, 5.14 dan 5.15. Kurva amplifikasi merupakan grafik akumulasi emisi fluorescent pada setiap siklus reaksi. Kurva dapat dibagi menjadi empat fase yang berbeda: fase linear,
se awal eksponensial, fase log-linear, dan fase plateau. Data dikumpulkan dari
fa-se ini untuk menghitung sinyal cycle threshold (Ct) dan efisiensi amplifikasi. Rn
adalah intensitas emisi fluorescent dari pewarna reporter dibagi dengan intensitas
emisi fluorescent dari pewarna pasif (pewarna referensi yang dimasukkan ke
da-lam Master mix PCR untuk mengendalikan perbedaan dada-lam volume campuran
master mix). ∆Rn dihitung sebagai perbedaan dalam nilai-nilai Rn sampel dan
kontrol template, dan dengan demikian mewakili besarnya sinyal yang dihasilkan
selama qPCR. Grafik ini dihasilkan dari ABI Prism SDS versi 1.9 software
(App-lied Biosystems) (Wong dan Medrano 2005).
Efisiensi amplifikasi tercermin dari efisiensi reaksi yang terlihat pada plot
amplifikasi. Amplifikasi yang efisien dapat mencapai 100%, hal ini menunjukkan
dua kali lipat dari produk qPCR pada setiap siklus dari jumlah awal template
1,322559, amplifikasi untuk kejut panas suhu 38oC pada siklus 28, suhu 42oC pada siklus antara 30-32 dan perlakuan tanpa kejut panas dan suhu 34oC pada siklus 32-36.
Gambar 5.13 Plot amplifikasi RT-qPCR gen Hsp25,4 yang diberi kejut panas dengan beberapa suhu yang berbeda
Plot amplifikasi RT-qPCR untuk primer Hsp70 dapat dilihat pada Gambar 5.14.
Dari Gambar 5.14 terlihat amplifikasi RT-qPCR yang paling cepat ter-amplifikasi adalah perlakuan kejut panas suhu 38oC yang diawali pada siklus ke 26, diikuti perlakuan suhu 42oC, 34oC dan kontrol terlihat sama diawali ampli-fikasi pada siklus ke 28. Berdasarkan titik treshold untuk primer Hsp70 pada ∆Rn 1,587138 amplifikasi untuk perlakuan suhu 38oC pada siklus 30, suhu 42oC pada siklus antara 30-32 dan suhu 34oC pada siklus 32 serta tanpa kejut panas pada siklus antara siklus 32-34.
Plot amplifikasi RT-qPCR untuk gen Hsp20,4 dapat dilihat pada Gambar 5.15.
Gambar 5.15 Plot amplifikasi RT-qPCR gen Hsp20,4 yang diberi kejut dengan beberapa suhu yang berbeda
38oC pada siklus 24, suhu 42oC pada siklus 26 dan perlakuan kontrol pada siklus 32 dan suhu 340C pada siklus 34.
Perbedaan siklus pada plot amplifikasi menandakan adanya ekspresi gen yang berbeda pada masing-masing primer dan perlakuan kejut panas. Plot am-plifikasi menunjukkan kurva sigmoid RT-qPCR untuk gen target dan gen
refe-rensi. Perhitungan parameter efisiensi untuk setiap pasangan primer dilakukan
dengan terlebih dahulu menentukan nilai Ct dari log kurva (Lampiran 2).
Untuk setiap transkrip gen dibangun kurva standar dengan memplot nilai Ct
sesuai untuk setiap seri pengenceran terhadap log konsentrasi template yang
di-nyatakan sebagai jumlah salinan. Kuantifikasi mutlak dan amplifikasi gen target
dibandingkan dengan kurva standar berdasarkan jumlah copy diketahui dari gen
target. Pola ekspresi gen Hsp25,4, Hsp70 dan Hsp 20,4 dibandingkan dengan kontrol (tanpa kejut panas) dapat dilihat pada Gambar 5.16.
Gambar 5.16 Pola ekspresi gen Hsp24,5, Hsp70 dan Hsp20,4 pada ulat sutera (B. mori) C301 yang diberi kejut panas dengan suhu yang berbeda
Dari Gambar 5.16 terlihat pola ekspresi gen Hsp24,5 dan Hsp70 tertinggi pada kejut panas 34oC, sedangkan Hsp 20,4 tertinggi pada kejut panas suhu 42oC.
0
340C 380C 420C 340C 380C 420C 340C 380C 420C
Kejut panas 34 dan 38oC pada gen Hsp20,4 menunjukkan ekspresi yang hampir sama. Ekspresi gen terendah pada Hsp70 pada kejut panas suhu 38oC. Hal ini terlihat adanya perbedaan ekspresi pada masing-masing gen Hsp.
Hasil ekspresi ini berbeda dengan yang ditemukan pada penelitian Velu et al. (2008) melaporkan ekspresi yang lebih tinggi pada gen Hsp70 dan Hsp40 pada tingkat jaringan setelah diberi kejut panas selama 1 jam pada 38oC dan 42oC pada larva Nistari (multivoltine) dari thermo rentan dan ulat NB4D2 (bivoltine), dengan menggunakan analisis RT-qPCR. Ekspresi gen Hsp70 dan Hsp40 tertinggi pada jaringan lemak kemudian mesenteron dan kelenjar sutera. Li et al. (2005) analisis ekspresi protein heat shock kecil gen BmHsp19,9 pada ulat sutera meng-gunakan RT-qPCR dan menemukan berbagai tingkat protein ini dalam testis, ova-rium, kelenjar sutera dan pupa. Li et al. (2014) menyatakan tingkat ekspresi Hsp yang tinggi menandakan bahwa terjadi perlawanan penting dari ulat sutera ter-hadap tekanan suhu tinggi. Pada Tigriopus japonicus ekspresi gen Hsp70 lebih jelas daripada Hsp lainnya (Rhee et al. 2009).
melin-dungi diri dari denaturasi suhu melalui molekul chaperone (Nakamoto dan Vigh 2007). Sakano et al. (2006) mengisolasi dan karakterisasi enam gen yang meng-kode Hsp B. mori. Semua Hsp yang meningkat setelah di beri kejut panas, kecuali Hsp21,4. Hasil elektroforesis B. mori menghasilkan tiga kelompok heat shock protein, termasuk Hsp82, Hsp70 dan Hsps (Lohmann dan Riddiford 1992).