M Y R N A S A S K I A N A S U T I O N
M iK ROPRQPAGASI S O L A N U M W R !G H T !I BEN T H
D A L A M M ED I A B U A T A N
MIKROPROPAGASI SOLANUM WRIGHTII BENTH DALAM MEDIA BUATAN
SKRIPSI
DIBUAT UNTTJK MEMENUHI TUGAS AKHIR MENCAPAI GELAR SARJANA FARMASI
PADA FAKULTAS FARMASI UNIVERSITAS AIRLANGGA
1988
Oleh
MYRNA SASKIA NASUTION
058110382
Disetujui oleh pembimbing
Drs.__I.G.P. SANTA
KATA PENGANTAR
Dengan mengucap syukur kehadirat Tuhan yang Maha Kua- sa, saya telah selesai melaksanakan tugas untuk menyusun skripsi sebagai salah satu syarat untuk mencapai gelar sarjana pada Fakultas Farmasi Universitas Airlangga.
Hasil yang saya peroleh dari skripsi yang berjudul "Mikropropagasi Solanum wrightii Benth. dalam media buatan" ini sangatlah sederhana dan jauh dari sempurna* Namun sa ya berharap semoga dari surabangan yang kecil ini membawa manfaat yang besar bagi perkembangan ilmu pengetahuan pa da umumnya dan bagi pihak-pihak yang raembutuhkan pada khu- susnya.
Pada kesempatan ini saya mengucapkan terima kasih yang tulus dan sedalam-dalamnya kepada :
Almamater Fakultas Farmasi Universitas Airlangga yang telah memberi kesempatan kepada saya untuk belajar dan te lah mendidik saya selama ini,
Bapak Drs. I#G.P#Santa* Bapak DR. Gunawan Indrayanto dan Ibu Dra. Augustina Adams yang telah mendidik, membim- bing, memberi saran, pengarahan dan semangat serta dorongan moral yang sangat berharga dalam pelaksanaan hingga penye- lesaian skripsi ini dengan penuh kesabaran dan kebijaksa- naan.
mem-bantu kelancaran dalam penyediaan sampel batang Solanum wrightii Benth.
Kepada Ketua Jurusan Biologi Farmasi, Kepala Labora- torium Bioteknologi Farmasi dan seluruh stafnya juga saya sampaikan rasa terima kasih yang sebesar-besarnya atas pemberian ijin untuk menggunakan Laboratorium Bioteknolo gi Farmasi dengan segala fasilitasnya.
Terakhir kepada ayah, ibu, saudara-saudaraku dan se- taua pihak yang tidak dapat saya sebutkan satu persatu yang telah memberikan doa restu, bantuan serta dorongan moral maupun materiil sehingga saya dapat menyelesaikan tugas ini, saya sampaikan terima kasih yang tak terhingga.
DAFTAR ISI
Halaman
KATA PENGANTAR ... ii
DAFTAR IS I ... ... iv
DAFTAR TABEL ... ... vi
DAFTAR GAMBAR ... vii
BAB I. PENDAHULUAN ... X II. TINJAUAN PUSTAKA 1. Mikropropagasi ... ...
4
1.1. Tahapan mikropropagasi ... ... 5
1
.2
. Metode mikropropagasi ... ...6
1.2.1. Propagasi tanaman dari kuncup ketiak .
'9
1.2.2. Propagasi melalui pembentukan organ secara langsung ...12
1.2.3- Propagasi melalui pembentukan organ secara tidak langsung
13
1.3* Media mikropropagasi ... ... Ilf 1.4* Peranan hormon/ zat pengatur tumbuh dalam mikropropagasi ...15
l.i+.l. Auksin ... 16
1.4*2. Sitokinin ... . ...
17
1.4*3* Gibrelin ... ... 17
1.4*4- Etilen ... 18
DAFTAR TABEL
Tabel Halaman
I Koraposisi media dasar Murrashi^e dan Skoog
23
II Rancangan kombinaei dan kadar hormon per-tumbuhan yang ditambahkan pada media dasar MS untuk penusbuhan kuncup (plantlet)
Solanum ■.vri;:htii Benth ... 2.1+
III Kombinasi hormon dan pertunbuhan kuncup (plantlet) dari eksplan Solanun ?/ri;:htii
Benth, pada media dasar MS ... 33 IV Jumlah kuncup dan wakcu penbentukannya
dari eksplan oolanurn \ v ri/rhtil Sentk...
40
V* Hasil pemindahan (SubKultur) kuncup
Halaman
1.2. Sterilisasi eksplan ... ... 21
1.3. Media ... ... 22
2. Alat-alat ... ... 26
3
. Metode ... ... 273*1. Sterilisasi alat dan b a h a n ... ... 27
3.2. Pembuatan media ... ... 27
3-3* Penanaman eksplan ... ... 29
3*4* Pemeliharaan kuncup (plantlet) yang telah tumbuh ... ...
31
IV. HASIL PENELITIAN 1* Media yang menumbuhkan kuncup (plantlet) 32 2# Jumlah kuncup (plantlet) dan waktu pem-bentukkannya ... ....
40
3# Hasil pemindahan (subkultur) ... 40
V. PEMBAHASAN ... ... 42
VI. KESIMPULAN ... ... ... 47
VII. SAEAN-SARAN ... ... 48
VIII. RINGKASAN ... ... 49
DAFTAR GAMBAR
Gambar : Halaman
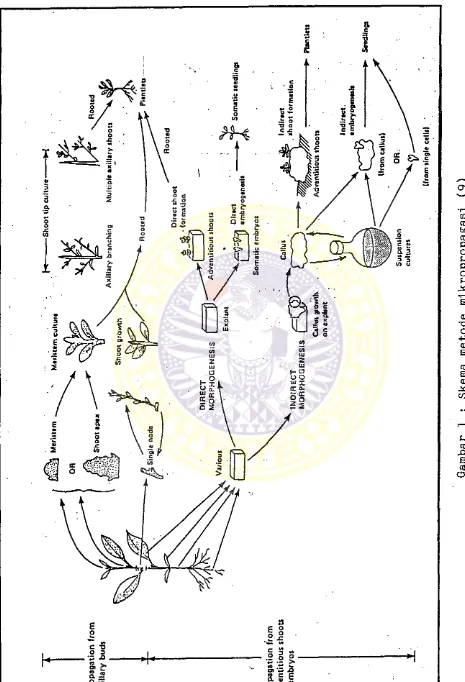
1. Skema metode mikropropagasi ...
8
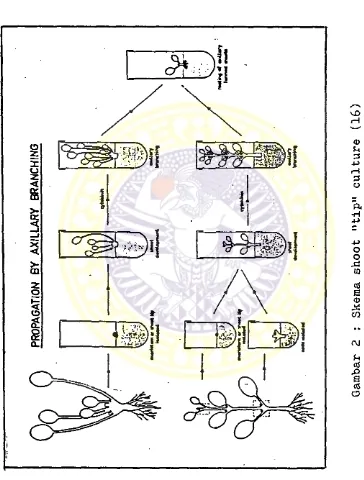
2. Skema metode Shoot "tip" culture ... 10 3* Skema metode Single "node” culture ... 11 4- Ekeplan Solanum wrightii Benth... 21
5* Skema pembuatan media ... 28
6
. Skema penanaman eksplan ... 30 7. Kuncup (plantlet) dan kalus padaberba-gai kombinasi hormon kinetin vs BA .... ... 35
8
. Kalus pada berbagai kombinasi hormon kinetin vs 2,4 D ... 36
9* Kalus pada berbagai kombinasi hormon ki
netin vs IAA ... 3 7
10. Kuncup (plantlet) dan kalus pada berbagai
kombinasi hormon kinetin vs NAA * ... 38 11. Kuncup (plantlet) dan kalus pada berbagai
kombinasi hormon kinetin vs GA^ ...
39
12. Sebelum dan sesudah subkultur kuncup
PENDAHULUAN
• Latar belakang
Banyak sekali jenis-jenis tumbuhan yang raempunyai nilai ekonomis dipergunakan sebagai bahan dasar dalam berbggai bidang, antara lain di bidang farmasi atau media. Hal ini disebabkan karena senyawa bahan alami umumnya tidak ada atau ringan efek sampingnya bila di- bandingkan dengan senyawa sintetik (1). Salah satu bahan alami yang mempunyai potensi sebagai suraber ste roid untuk bahan baku kontrasepsi oral ialah jenis-je- nis terong (Solanum spp.) dan Dioscorea spp. (2,3)*
Di Indonesia jumlah Solanum mencapai 71 jenis, sedan^kan di pulau Jawa diperkirakan terdapat 21 jenis
(2). Beberapa jenis Solanum mengandung solasodina dalam bentuk senyawa alkaloid steroid.
Pada penelitian terdahulu diketahui bahwa pada buah beberapa jenis Solanum yang ada di Jawa Timur ter dapat kandungan solasodina yang berbeda-beda kadarnya dan ternyata jenis Solanum wrightii dan Solanum mammo- sum mengandung solasodina yang relatif besar (if).
Untuk memproduksi hormon steroid dalam skala be- sar dibutuhkan sumber bahan dasar, yang dalam hal ini adalah tanaman dalam jumlah yang banyak. Kesulitan yang dihadapi dalam memperoleh jumlah tanaman yang banyak antara lain disebabkan karena kesulitan penanaman, wak- tu yang diperlukan terlalu lama dan juga semakin terba- tasnya lahan yang tersedia. Untuk itu dicarilah metode alternatif yaitu metode kultur jaringan.
Adapun kelebihan metode kultur jaringan (5) bila dibandingkan dengan metode konvensional adalah:
- Kondisi dapat dikontrol sehingga dapat dihasilkan produk-produk tertentu sesuai dengan keinginan. - Bebas dari pengaruh mikroba dan insekta.
- Dapat ditanam dimana saja tidak tergantung pada letak geografis dan iklim.
Tehnik kultur jaringan in vitro pada hakekatnya merupa- kan suatu alat tehnik penunjang di dalam penyelidikan fundamental dan aplikasinya mempunyai potensi sebagai alat tehnik propagasi vegetatif dan pemuliaan tanaman
(
6
) .Dengan melihat keuntungan-keuntungan di atas maka metode kultur jaringan tanaman sangat bermanfaat ter- utama untuk tanaman yang berpotensi, tanaman yang lang- ka, atau untuk tanaman yang tidak mudah tumbuh bila
nik kultur jaringan tanaman telah banyak digunakan da lam propagasi tanaman, Propagasi tanaman dengan tehnik kultur jaringan ini disebut mikropropagasi. Dengan mi- kropropagasi ini memungkinkan jaringan meristera suatu tanaman akan dapat raerabentuk individu baru (plantiet) yang dalam segala hal adalah identik dengan induknya
(
8
) .Sukses yang pertama dapat disebut adalah penyeli- dikan Morel yang raeraperoleh tanaman anggrek secara ve- getatif (9)* Penelitian tentang mikropropagasi tanaman sekarang telah banyak dilakukan antara lain pada tebu, kelapa, Digitalis lanata. Curcuma s p p . . Angelica acu-
tiloba, Valeriana wallichii dan lain-lain (9,10,11,12, 13).
Mengingat Solanum wrightii Benth. mempunyai poten- si sebagai bahan baku obat, tetapi tidak mudah dan mem- butuhkan waktu yang cukup lama untuk dikembangbiakkan secara konvensional, maka perlu dilakukan penelitian dengan cara mengembangbiakkan tanaman tersebut secara mikropropagasi.
2. Tu.iuan penelitian
B A B II TINJAUAN PUSTAKA
1. Mikronronagasi
Mikropropagasi adalah pengembangbiakaa tanaman se- cara in vitro dengan metode kultur jaringan (
10
).Kultur jaringan dapat didefinisikan sebagai bagian jaringan tanaman yang telah dipisahkan dari tanaman a- salnya dan ditumbuhkan dalam keadaan steril pada suatu medium artifisial dan sel-selnya mampu tumbuh dan me- ngadakan pembelahan (
5
)•Dasar dari kultur jaringan adalah teori sel yang dikemukakan oleh Schwann dan Schleiden (1833), yang me- nyatakan bahwa sel tumbuhan merypakan satuan biologis terkecil yang mampu melakukan aktivitas metabolisme, reproduksi dan tumbuh (9,13)* Dari teori tersebut tim- bullah teori totipotensi sel tumbuhan yang menyatakan bahwa semua sel tumbuhan mengandung informasi genetik yang sama sehingga apabila sel tumbuhan tersebut ditanam pada media yang sesuai mampu tumbuh menjadi tumbuhan baru (
9
).kan tanaman/ individu baru (plantlet) dalam jumlah yang banyak dan dalam waktu yang relatif cepat.
- Sifat tanaman baru sama (identik) dengan tanaman in- duknya.
- Dapat digunakan untuk tanaman yang sukar dikembang- biakkan.
- Bebas dari pengaruh penyakit.
- Tidak tergantung pada letak geografis dan cuaca. - Dapat disimpan dalam jangka waktu yang lama.
Adapun kerugian dari metode mikropropagasi ini ialah kondisi harus selalu steril dan biaya yang diperlukan relatif lebih mahal.
•1* Tahapan mikropropagasi
Proses mikropropagasi dilakukan melalui bebera- pa tahapan. Menurut Murrashige ada 3 tahapan dalam multiplikasi tanaman secara in vitro (9,10,16) yaitu Tahap permulaan: Seleksi dan persiapan tanaman induk Sebelum melakukan mikropropagasi secara seksama diseleksi tipe dan varietas dari tanaman induk yang bebas penyakit. Tahapan ini penting agar tingkat kon taminasi dari eksplan berkurang dan merupakan suatu tahap yang ikut menentukan dalam program mikropropa gasi.
Tahap I: Penetapan suatu kultur steril
tahap ini adalah bahwa eksplan dapat dipindahkan ke- lingkungan kultur dan yang kedua adalah eksplan itu bisa tumbuh. Tahap ini dianggap memuaskan bila sejum- lah eksplan dapat bertahan tanpa kontaminasi dan se- lanjutnya tumbuh.
Tahap II: Produksi kuncup-kuncup vane sesuai
Maksud dari tahap II adalah memperoleh multipli- kasi dari organ sehingga terjadi perturabuhan tanaman baru yang sempurna. Kuncup-kuncup yang dihasilkan pada tahap II dapat dikultur kembali untuk memperoleh
jumlah yang banyak.
Tahap III: Persiapan untuk tumbuh dalam lingkungan alam
Kuncup-kuncup atau plantlet-plantlet yang bera- sal dari tahap II aangat kecil dan belum mampu untuk tumbuh sendiri di tanah. Pada tahap III ini individu plantlet dapat tumbuh dan melakukan fotosintesa dan dapat bertahan hidup tanpa pemberian karbohidrat. Yang juga termasuk dalam tahap III ini ialah penum- buhan akar secara in vitro dari kuncup-kuncup terse but untuk kemudian dipindahkan ke tanah.
Menurut Debeigh dan Maene tahap III dibagi dalam dua bagian :
tahap III B.
Tahap III B: pengakaran secara in vitro tunas tahap III A*
Tahap IV: Pemindahan ke lingkungan alam
Meskipun Murrashige tidak memberikan suatu uru- tan nomor yang khusus pada tahap ini, maka metode un tuk memindahkan plantiet dari in vitro ke ekstra vi- trum adalah sangat penting. Jika tidak diselenggara- kan dengan hati-hati, maka pemindahan dapat mengaki- batkan kehilangan tanaman yang cukup berarti.
1.2. Metode mikropropagasi
Metode-metode yang secara teoritis digunakan un tuk propagasi tanaman secara in vitro (mikropropagasi) antara lain (9,16) :
- Multiplikasi dari kuncup ketiak.
- Pembentukan kuncup dan/ atau pembentukan embrio so- matik baik secara langsung pada bagian jaringan a- tau organ tanaman induk dan/ atau tidak langsung melalui massa kalus.
Gambar skema metode mikropropagasi tertera pada gambar
1*2.1. Propagasi tanaman dari kuncup ketiak
Metode ini sangat umum digunakan, dan dalam penggunaannya ada dua cara antara lain :
--'Shoot "tip" culture - Single "node” culture
Keduanya tergantung pada stimulasi pertumbuhan da ri kuncup ketiak, dengan cara mengatasi pengaruh pertumbuhan dari meristem apikal.
Shoot "tip" culture
Merupakan metode yang umum digunakan untuk mikropropagasi tanaman komersial. Eksplan yang di gunakan adalah kuncup ketiak daun dan kuncup ujung batang. Pengaruh dari pertumbuhan meristem apikal dihilangkan, dan untuk perkembangan eksplan selan- jutnya dapat distimulir dengan pemberian hormon pertumbuhan pada media pertumbuhan. Hasilnya ada lah tumbuhan kecil dengan kuncup yang bercabang banyak. Kuncup-kuncup yang terbentuk dapat digu nakan sebagai eksplan baru. Pada penanaman sebaik- nya digunakan kuncup-kuncup besar*
Single "node" culture
Metode ini merupakan tehnik in vitro lain yang dapat dipakai untuk propagasi kuncup ketiak tana man, Ujung kuncup ditumbuhkan menjadi kuncup yang tidak bercabang sepanjang
5
-10
cm yang mengandung beberapa buku (node) yang nyata dan dapat dipisah- kan.Kuncup-kuncup ketiak yang baru yang diperoleh dari kedua raetode tersebut di .atas, dapat ditumbuh- kan lagi menjadi kuncup yang tidak bercabang untuk memulai subkultur baru.
Multiplikasi plantlet dari kuncup ketiak dimu- lai dengan lambat, tetapi kemudian meningkat sela- ma beberapa kali pengkulturan dan akhirnya menjadi konstan pada siklus subkultur seterusnya (
15
). Tanaman yang diperoleh dari kultur kuncup ketiak biasanya horaogen secara fenotipe, dengan demikian menunjukkan kestabilan genetik (15
).1.2.2. Propagasi melalui pembentukan organ secara langsung Inisiasi kuncup secara langsung
kuncup kecil tumbuh secara cepat dari setiap eksplan.
Pembentukan embrio secara langsung
Beberapa eksplan tertentu secara in vitro mampu langsung raenghasilkan embrio. Kejadian ini hanya terbatas pada jaringan pre-embrional.
1*2.3* Propagasi melalui pembentukan organ secara tidak langsung.
Inisiasi kalus
Bagian ini membicarakan tentang kalus dengan kemampuannya membentuk kuncup dan selanjutnya plantlet. Karena kuncup yang terbentuk bukanber- asal dari jaringan tanaman induk, tetapi berasal dari kultur kalus atau kultur suspensi, maka dika- takan regenerasi secara tidak langsung. Kultur ka lus mempunyai kemampuan morfogenesis yang berbeda beda. Dalam praktek, kecepatan dan efisiensi rege nerasi plantlet dari kalus tergantung dari:
- interval antara inisiasi kultur dan morfogenesis - kecepatan dan jumlah inisiasi kuncup
- regenerasi tunas harus sudah siap bila kalus su- dah di subkultur.
- Jumlah subkultur yang dimungkinkan tanpa kehi- langan morfogenesis.
Kultur kalus yang normal relatif lambat meng- hasilkan tunas, tetapi pada beberapa jenis tanaman , atau pada kondisi tertentu, kalus mempunyai ke- mampuan yang tinggi untuk regenerasi tunas,
Metode-metode mikropropagasi ini telah banyak diteliti antara lain pada tanaman anggrek, tebu, Di gitalis lanata, Curcuma spp., Angelica acutiloba. Valeriana wailichi dan lain sebagainya. Pada tana man Digitalis lanata ternyata tanaman hasil mikro- propagasinya tetap mengandung kardenolida seperti tanaman induknya, sedangkan pada Curcuma spp. pun tanaman hasil mikropropagasinya tetap mengandung mi- nyak atsiri seperti induknya (
11
,12
).1*3* Media mikropropagasi
Keberhasilan tehnik mikropropagasi juga sangat tergantung pada media yang digunakan. Nutrien yang dibutuhkan untuk pertumbuhan yang optimal dari ja ringan bermacam-macam, tergantung jenis tanamannya.
Terlepas dari komposisi atau konsentrasinya, media umumnya berisi : (
5
»9
)- anorganik makronutrien: dalam hal ini nitrat, amo- nium, fosfat, kalium, kalsium, magnesium dan sul-
- Vitamin-vitamin: berupa tiamin, piridoksin, myo inositol, nikotinamid dan asam amino seperti sis- tein, glisin dan kasein hidrolisat.
- Sebagai sumber karbon: adalah sukrosa, glukosa, fruktosa dan laktosa.
Zat-zat ini berangsur-angsur dilepas ke dalam media kultur dan ini dimanfaatkan oleh sel hidup.
1.4* Peranan hormon/ zat pengatur tumbuh dalam mikropro pagasi.
Untuk mempercepat perkembangbiakan tanaman de ngan metode kultur jaringan selain unsur media dia- tas juga perlu ditambahkan hormon-hormon pertumbuhan.
Zat pengatur tumbuh atau hormon pertumbuhan (growth regulator) adalah senyawa organik yang bukan nutrient, yang dalam jumlah sedikit dapat mendukung, menghambat dan dapat merubah proses fisiologis tum- buhan (17).
Di dalam dunia tumbuhan, zat pengatur tumbuh/ hormon pertumbuhan mempunyai peranan dalam pertum buhan dan perkembangan untuk kelangsungan hidupnya
(18).
Zat pengatur tumbuh. di dalam tanaman terdiri dari lima kelompok yaitu (9,10,17,18,19) :
-.Oibrelin
- Etilen - Inhibitor
Dua kelompok yang disebut terdahulu adalah hormon pertumbuhan yang paling penting untuk tumbuh dan morfogenesis dalam kultur jaringan tanaman (
10
). Pertumbuhan dan morfogenesis in vitro tergantung pa da interaksi dan keseimbangan hormon pertumbuhan yang ada pada media dan hormon yang diproduksi oleh kultur sel (10
).l.if.l. Auksin
Auksin adalah senyawa yang dicirikan oleh ke- mampuannya dalam mendukung terjadinya perpanjangan sel pada pucuk, dengan struktur kimia dicirikan o- leh adanya cincin indol (17)* Zat yang termasuk kelompok senyawa ini antara lain: Indole Acetic A- cid (IAA), Naphthyl Acetic Acid (NAA), dichloro phenoxy acetic acid (2,4D), Indole Butyric Acid
(IBA) dan lain-lain. Gambar struktur kimianya a- dalah sebagai berikut :
crttco ot\
cHj-t^-a^-coort
CA - ocH4cooH
/
IBA 2,4 D
1.4*2. Sitokinin
Sitokinin adalah senyawa yang mempunyai ben- tuk dasar Adenin
(6
amino purine) yang mendukung terjadinya pembelahan sel (17
).Zat yang termasuk senyawa golongan ini antara lain: Kinetin dan Benzyl adenin (BA). Adapun struk- tur kimianya adalah sebagai berikut :
1.4*3* Gibrelin
Gibrelin adalah senyawa yang mengandung Gib- ban skeleton, menstimulasi pembelahan sel, peman- jangan sel atau keduanya. Zat yang termasuk
kelom-Kinetin BA
Gibrellic Acid
1.4*4« Etilen
Etilen adalah hormon pertumbuhan yang secara umum berlainan dengan auksin, sitokinin dan gibre lin. Dalam keadaan normal, etilen akan fcerbentuk gas dan struktur kimianya sangat sederhana sekali. Di alam, etilen akan berperan apabila terjadi pe- rubahan secara fisiologis pada suatu tanaman. Hormon ini akan berperan pada proses pematangan buah (17). Struktur kimia senyawa ini adalah seba^ gai berikut:
Etilen
l*if.5* Inhibitor
kelompok ini adalah Abscisic acid (ABA), adapun struktur kimianya adalah:.
cooH
2. Tin.iauan tentang Solanum wrightii Benth.
Solanum adalah suatu marga tanaman yang terdapat di berbagai negara tropik dan subtropik yang terdiri dari banyak jenis.
Klasifikasi tanaman ini menurut sistem Engler a- dalah (
20
) :: Embryophyta Siphonogama : Angiospermae
: Dicotyledoneae : Tubiflorae : Solanaceae : Solanum
: Solanum wrightii Benth. Nama lainnva (sinonim) :
Solanum glandiflorum Auct non R & P Asal tanamannva :
Batang
Daun
Bunga
Buah
Biji
ditanam, tumbuh pada ketinggian 5 - 1400 meter.
: bentuknya bulat, tingginya sampai 10 meter, warna coklat.
: daun tunggal tersebar, berbentuk jorong sam pai bulat telur, berlekuk menyirip sampai bercangap menyirip dengan bulu-bulu seperti sikat pada permukaan daun. Lebar daun
5
“ 32 cm, panjang daun 9 - 3 5 cm, warna hijau. : berbunga sepanjang tahun, aktinomorf.Warna mahkota bunga ungu dan setelah tiga sampai empat hari berubah menjadi putih ke- mudian gugur, jumlahnya ligia. Jumlah bunga pada setiap perbungaan 7 - 1 0 kuntum. Bunga berkelamin dua dengan panjang tangkai bunga 1 - 2 cm, kelopak bunga tingginya 1 , 5 - 2 cm, terbagi sampai dekat pangkal, kepala sari berwama kuning.
: merupakan buah buni berbentuk bulat dengan penampang 5 - 7 cm. Warna buah hijau.
B A B III
METODOLOGI PENELITIAN
1* Bahan penelitian 1.1. Eksplan
Eksplan yang digunakan berasal dari kuncup ketiak daun yang masih muda dari Solanum wrightii Benth. yang diperoleh dari Kebun Raya Cabang Purwodadi Pasuruan Jawa Timur yang telah diketahui identi-
tasnya.
Gambar : Eksplan Solanum wrightii Benth.
- Air suling steril
- Clorox yang mengandung 5 ,2 .5 % Na hipochlorit produksi Clorox Company.
1.3* Media
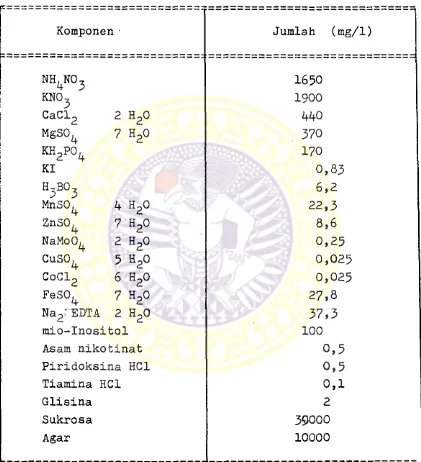
Media yang digunakan adalah media dasar Murrashige dan Skoog (MS) yang diraodifikasi. Komposisi media dasar MS yang digunakan tertera pada tabel I.
Tabel I :
KGMPOSISI MEDIA DASAR MURRASHIGE DAM SKOOG (9)
Komponen Jumlah (mg/1)
Tabel II :
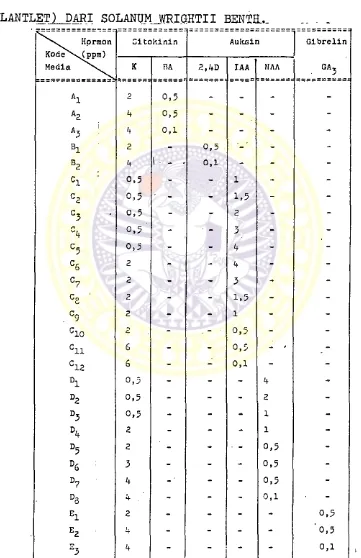
RANCANGAN KOMBINASI DAN KADAR HORMON PERTUMBUHAN YANG DI- TAMBAHKAN PADA MEDIA. DASAR MS UNTUK PENUMBUHAN KUNCUP
(PLANTLET) DARI SOLANUMJRIQHTII BENTH... ..
Keterangan tabel : K : Kinetin
BA : Benzyl adenin
2,4
D :2,4
dichloro phenoxy acetic acid. IAA : Indole acetic acidAlat-alat
Laminar Air Flow Cabinet "Dalton" untuk penanaman se cara aseptis.
Autoclave 25 1 "American Portable WAF CO Inc" untuk sterilisasi media dan air suling.
pH meter "Corning model" untuk mengukur dan raengatur pH media.
Neraca analitis "Sartorius"
Oven "Despatch" untuk sterilisasi alat gelas, logam.
Metode
3*1* Sterilisasi alat dan bahan 3.1.1. Alat gelas dan logam
Dimasukan dalam bungkus aluminium foil ke- mudian disterilkan di dalam oven 170°C se- lama
3
jam (22
).3.1.2. Air suling
Sterilisasi dilakukan di dalam autoclave 121°C selama 20 menit (22).
3.2. Pembuatan media
Pembuatan media dilakukan sesuai dengan meto de Murrashige (1974) (9).
dat dengan penambahan agar 1% , Jadi untuk memper-
oleh media dengan volume satu liter, dibuat seba-
gai berikut :
dari masing-masing larutan stok diambil
10
ml, di-tambah
100
mg mio-Inositol,30
g sukrosa dan hormon pertumbuhan yang tergantung pada konsentrasi dan macara yang digunakan dalam percobaan, lalu ditambah air suling sampai volume lebih kurang tiga per empat volume akhir. pH larutan diatur antara 5*7 - 5,8 dengan penambahan larutan NaOH 0,1 N atau larutan HC1 0,1 N. Setelah itu ditambah agar
10
g dan volume dibuat menjadi satu liter de ngan menambahkan air suling. Campuran tersebut di- panaskan sambil diaduk sampai jernih, lalu dituang kedalam botol kultur, masing-masing sebanyak lebih kurang20
ml dan ditutup rapat-rapat dengan alu minium foil. Kemudian media ini disterilkan dalam autoclave 121°C selama 20 menit.Larutan stok
komponen media MS
dengan konsentrasi
100
kaliT
Masing-masing diambil 10 ml
« ■
Ditambah 100 mg mio-Inositol
I
Ditambah 30 S sukrosa
1
Ditambah hormon pertumbuhan ( jumlah sesuai dengan macam yang akan dibuat untuk perco baan )
i
Ditambah air suling sampai 3 / k volume
Ditambah agar 10 g, volume dibuat
1
literI
*
3*3* Penanaman eksplan
Penanaman eksplan dilakukan menurut metode yang dikemukakan oleh Reinert dan Yeoman (1982)
(7).
Pangkal tangkai daun (bagian ketiak daun) yang ma- sih muda dari Solanum wrightii Benth yang akan di- pakai sebagai eksplan dicuci bersih dengan air su- ling, kemudian direndam dalam alkohol
90
% selama 2 menit, Setelah itu disterilkan dalam larutan pen- steril "Clorox11 k0% (Clorox 100% mengandung NaOClE X P L A N T S
T R I M M I N G
S U R F A C E S T E R I L I Z A T I O N *
I
S E V E R A L W A S H E S I N S T E R I L I Z E D 0 I S T 1 L L E 0 W A T E R
1
F I N A L T R I M M I N G A N O C U L T U R E E S T A B L I S H M E N T
I N C U B A T I O N
S U B C U L T U R E
B u d s N oda l se gm e nt s
lilliiir ‘I r7 o, 151
m r o n g f f f f r n f f
h
n n u u g f f g
3*4* Pemeliharaan Kuncup (plantiet) yang telah tumbuh Untuk pemeliharaan dan perbanyakan kuncup
(plantiet) dilakukan subkultur yaitu kuncup (plant- let) dari satu botpl dipindahkan ke beberapa media segar (
22
), dengan cara sebagai berikut :botol kultur yang berisi kuncup-kuncup (plantiet) dibuka tutup aluminium foilnya kemudian mulut bo tol diflambeer dengan lampu spiritus. Dengan meng- gunakan pinset steril kuncup (plantiet) tersebut dikeluarkan dan ditaruh pada gelas petri steril untuk kemudian dipotong-potong dengan skapel ste ril dan digunakan sebagai sumber eksplan baru. Dengan menggunakan pinset steril, potongan kuncup (plantiet) tadi dimasukkan ke dalam media segar dan ditutyp kembali dengan aluminium foil setelah diflambeer dengan lampu spiritus.
Pekerjaan ini dilakukan dalam Laminar Air Flow Ca binet.
B A B IV HASIL PENELITIAN
1. Media vans menumbuhkan kuncup (plantlet)
Hasil penanaman eksplan pangkal tangkai daun (ke tiak daun) Solanum wrightii Benth. menunjukkan bahwa pembentukan kuncup (plantlet) terjadi pada media dasar MS dengan penambahan kinetin if ppm dan BA 0,5 PP®> me dia dasar MS dengan penambahan kinetin 0,5 ppm dan NAA if ppm, media dasar MS dengan penambahan kinetin 2 ppm dan NAA 0,5 ppm> media dasar MS dengan penambahan ki netin if ppm dan NAA 0,1 ppm, media dasar MS dengan penambahan kinetin
2
ppm dan GA-^0,5
ppm, media dasar MS dengan penambahan kinetin if ppm dan GA^ 0,5 ppm.Tabel III :
KOMBINASI HORMON DAN PERTUMBUHAN KUNCUP (PLANTLET) DARI EKSPLAN SOLANUM WRIGHTII BENTH. PADA MEDIA DASAR MS.
Hormon
Kode sJppm)
Media
o.ltokin in /'uk;.:j.n PmnljontuUun
K BA 2,ifD IAA NAA GA^ Plantlet Kalus
Keterangan tabel K
BA
2
,4
D IAA NAA GA-zPlantlet
Kinetin
Benzyl Adenin
2,4
dichloro phenoxy acetic acid Indole acetic acidNaphthyl acetic acid Gibrellic acid
tidak tumbuh tumbuh
Gambar 7 : Kuncup (plantlet) dan kalus pada berbagai kombinasi hormon kinetin vs Benzyl Adenin (BA)
Keterangan:
NAA
0
,
5
ppm2
ppm 3 ppm 4 . ppm0,1
ppm0,5 ppm
b/ C C \
f
f %
1
ppm®
Z ppm
k ppm f w
Gambar 10 : Kuncup (plantlet) dan kalus pada berbagai kombina si hormon Kinetin vs NAA
Keterangan:
Gambar 11 : Kuncup (plantlet) dan kalus pada berbagai kombinasi hormon Kinetin vs GA^
Keterangan:
2* Jumlah kuncup (plantlet) dan waktu pembentukannva
Tabel IV :
JUMLAH KUNCUP DAN WAKTU PEMBENTUKANNYA DARI EKSPLAN SOLANUM WRIGHTII BENTH.
Kode
3* Hasil pemindahan (subkultur) Tabel V :
HASIL PEMINDAHAN (SUBKULTUR) KUNCUP (PLANTLET) YANG TUMBUH Kode
media
Pembentukan jumlah kuncup rata-rata
Keterangan tabel :
B A B V PEMBAHASAN
Teori sel dan totipotensi sel menyatakan bahwa semua sel tumbuhan mengandung inforraasi genetik sehingga apabila sel tumbuhan tersebut ditanam pada media yang sesuai mampu tumbuh menjadi tumbuhan baru (
9
).Walaupun demikian setiap organ dari tanaman yang di- gunakan sebagai eksplan mempunyai derajat keberhasilan yang berbeda-beda. Beberapa faktor yang mendasari pemilih- an eksplan antara lain : organ yang akan digunakan, umur organ, ukuran organ dan kualitas tanaman penghasil eksplan*
Pada propagasi tanaman dengan metode kultur jaringan (mikropropagasi) ini organ tanaman yang dipilih adalah bagian ketiak daun. Hal ini disebabkan karena pada ketiak daun terdapat kuncup, dimana dengan adanya hormon pertum buhan pada media tersebut akan merangsang kuncup tersebut mengadakan multiplikasi (9)« Hasil tanaman baru tersebut yang diperoleh dari sistem di atas biasanya homogen se cara fenotipe, sehingga kandungan zatnya sama (identik) dengan tanaman induknya (
15
)*oksidase yang dilepaskan atau diproduksi oleh jaringan yang
agak tua bila jaringan tersebut dilukai (
9
)* Untuk itu pada penelitian ini digunakan organ dengan umur yang sangat
rauda sekali.
Faktor ukuran organ juga mempengaruhi keberhasilan propagasi secara vegetatif. Pada penelitian ini ukuran or gan yang digunakan adalah ukuran terbesar yang dapat di- peroleh dalam kondisi steril (+ 1 cm). Eksplan dengan u- kuran besar mempunyai keuntungan antara lain (
9
):- mempunyai kemampuan hidup yang lebih tinggi. - pertumbuhan lebih cepat.
- menghasilkan kuncup lebih banyak.
Akan tetapi makin besar ukuran eksplan, makin sulit untuk menghilangkan kontaminasi bakteri, sehingga kondisi ste ril sukar didapat.
Dari 28 macam kombinasi yang digunakan untuk penana- man ternyata yang dapat menumbuhkan kuncup (plantlet) ada
BA 0,5 ppm dan media dasar MS +■ Kinetin k ppm + GA-^ 0,5 ppm. Disini terlihat bahwa pada penanaman pertama, eksplan tersebut mampu membentuk kuncup (plantlet) akan tetapi se- telah disubkultur ada yang tidak lagi mampu membentuk kun cup (plantlet). Hal ini disebabkan karena pada penanaman pertama tersebut eksplannya masih dalam tahap beradaptasi dengan media buatan, sedangkan setelah disubkultur kuncup (plantlet) yang ditanam sudah beradaptasi dan konsentrasi hormon yang ada merangsang pembentukan kalus. Menurut Abidin (17) rasio/ perbandingan antara hormon-hormon per tumbuhan tersebut mempengaruhi differensiasi sel yaitu a- pabila konsentrasi sitokinin lebih besar dari auksin akan memperlihatkan stimulasi pertumbuhan tunas dan daun.
Sebaliknya apabila sitokinin lebih rendah dari auksin, ma- ka akan mengakibatkan stimulasi pertumbuhan akar, sedang kan apabila perbandingan sitokinin dan auksin berimbang maka pertumbuhan tunas, daun dan akar akan berimbang pula, tetapi apabila konsentrasi sitokinin intermediat (sedang) dan konsentrasi auksin rendah, maka akan terbentuk kalus,
Dari hasil penelitian ini ternyata media dengan kon sentrasi Kinetin 0,5 ppm dan NAA 4 ppm dapat menumbuhkan kuncup (plantlet). Ini dapat terjadi karena tanaman adalah mahluk hidup, dimana selain faktor hormon pertumbuhan ter- dapat banyak faktor yang juga ikut mempengaruhi.
Pada penelitian ini didapatkan kuncup (plantlet) yang juga disertai kalus, Menurut metode mikropropagasi (9) jika digunakan eksplan ketiak daun maka akan tumbuh kuncup
(plantlet) langsung tanpa disertai kalus. Hal ini dapat terjadi karena bagian ketiak daun yang digunakan jaringan- nya sudah tua, sedangkan menurut teori harus jaringan muda
(jaringan meristem). Secara teoritis yang dikehendaki ada lah dari eksplan langsung tumbuh kuncup, karena sifatnya secara genetik akan sama (identik) dengan induknya.
Jika eksplan tumbuh menjadi kuncup (plantlet) dan kalus ma ka akan terjadi variasi genetik, karena kalus adalah sel yang tak terorganisasi dimana sel yang tak terorganisasi memberikan variasi genetik.
Dalam penelitian ini hasil yang diperoleh adalah kun- cup-kuncup bukan tanaman kecil, hal ini dikarenakan untuk mengakarkan kuncup-kuncup tersebut sehingga menjadi tana man kecil memerlukan hormon-hormon pertumbuhan yang ber- fungsi merangsang pembentukan akar.
Media yang menumbuhkan kuncup (plantlet) paling banyak dari penanaman eksplan adalah media dasar MS + Kinetin 4 ppm + GA^
0,5
ppm, sedangkan setelah disubkultur media yang menumbuhkan kuncup (plantlet) paling banyak adalah meriiasuk golorigan gibrelin yang mempunyai sifat mendukung per-
B A B VI KESIMPULAN
1. Komposisi media yang dapat menumbuhkan kuncup (plantlet) dari eksplan Solanum wrightii Benth adalah :
1. Media dasar MS + Kinetin if ppm + BA 0,5 ppm 2. Media dasar MS + Kinetin 0,5 ppm + NAA if ppm 3. Media dasar MS + Kinetin 2 ppm + NAA 0,5 ppm if. Media dasar MS + Kinetin i+ ppm + NAA 0,1 ppm 5- Media dasar MS + Kinetin 2 ppm + GA^ 0,5 ppm
6
. Media dasar MS + Kinetin if ppm + GA^ 0,5 ppmMedia dasar MS + Kinetin if ppm + GA^ 0,5 ppm menghasil- kan jumlah kuncup (plantlet) yang paling banyak.
(dalam
2
kali penanaman),2* Media yang tetap menghasilkan kuncup (plantlet) setelah disubkultur adalah :
1. Media dasar MS + Kinetin 4 ppm + BA 0,5 ppm 2. Media dasar MS + Kinetin if ppm + GA^ 0,5 ppm
B A B VII SARAN-SARAN
Dari hasil penelitian ini perlu dilakukan penelitian lebih lanjut yaitu :
1. mengoptimasi pertumbuhan kuncup (plantlet) Solanum wrightii Benth. dengan konsentrasi hormon pertumbuhan yang berbeda atau modifikasi pada media dasar MS.
2
. melanjutkan tahapan-tahapan mikropropagasi berikutnya sehingga dapat ditanam di alam.B A B VIII RINGKASAN
Pada saat ini penggunaan obat yang bahan bakunya ber- asal dari tumbuh-tumbuhan masih mempunyai kedudukan yang cukup penting pada negara yang sedang berkembang maupun di negara maju.
Metode pembudidayaan tanaman yang selama ini diguna kan masih mempunyai kekurangan atau bahkan mengalami bebe- rapa kesulitan antara lain kesulitan penanaman, waktu yang diperlukan terlalu lama dan juga lahan yang tersedia sema- kin terbatas. Oleh karena itu bukan tidak mungkin akan ter
jadi kekurangan sumber bahan alam nabati untuk bahan baku obat.
Melihat kenyataan tersebut maka perlu dilakukan usa- ha untuk mencari suatu cara yang tepat dalam pembudidayaan tanaman obat, dalam hal ini bisa dilakukan dengan tehnik kultur jaringan,
Tehnik kultur jaringan ini merupakan metode alterna- tif untuk pembudidayaan tanaman obat, terutaraa untuk tana man yang berpotensi tetapi langka dan sukar untuk dikem- bangbiakkan.
Tahapn yang dilakukan pada penelitian ini ialah :
pembuatan media, penanaman eksplan dan pemindahan (sub
kultur) kuncup (plantlet) yang tumbuh.
Dari hasil penelitian ini didapat 6 macam kombinasi
yang mampu menumbuhkan eksplan Solanum wrightii Benth.
menjadi kuncup (plantlet) yaitu ;
- media dasar MS + Kinetin
4
ppm + BA 0,5 ppm - media dasar MS + Kinetin 0,5 ppm + NAA 4 ppm - media dasar MS + Kinetin 2 ppm + NAA 0,5 ppm - media dasar MS + Kinetin4
ppm + NAA 0,1 ppm - media dasar MS + Kinetin 2 ppm + GA^ 0,5 ppm - media dasar MS + Kinetin /+ ppm + GA-^ 0,5 ppmSetelah dilakukan pemindahan (subkultur) dari kuncup (plantlet) yang tumbuh, media yang tetap menghasilkan kun cup (plantlet) adalah ;
- media dasar MS + Kinetin
4
ppm + BA 0,5 ppm - media dasar MS + Kinetin4
ppm + GA^ 0,5 ppmDAFTAR PUSTAKA
1. Vi/i do do, S H. 1983* Morfologi beberapa jenis Solanum dan penyebarannya. Laporan penelitian. Institut Tekno- logi Bandung, pp: 1-2, 10,11, 23-24.
2* Tarigan, P. 1980. Beberapa aspek kimia sapogenin stero- id pada tumbuhan di Indonesia. Alumni. Bandung, pp:
6
.3* Sudiarto dan Rosita M D. 1982. Upaya penyediaan bahan baku kontrasepsi oral. Jurnal Litbang Pertanian. Bogor. 2 : 1-3*
4. Wahyudi. 1985* Pengaruh diameter buah Solanum wrightii Benth. terhadap kadar solasodina. Skripsi. Uni- versitas Airlangga. Surabaya, pp: 5-6.
5. Indrayanto, G. 1986. Prospek kultur jaringan tanaman pada bidang farmasi. Buletin ISFI Jatira. 12 (1) :
12
-
20.
6
. Noerhadi, E. 1976. Kultur jaringan sebagai salah satu alat tehnik pemuliaan tanaman. Simposium ilmu pe- muliaan dalam bidang pertanian I . Universitas Padjajaran. Bandung, pp: 1 - 2 .7. Isnaeni. 1986. Optimasi pembentukan kalus dan identifi-kasi steroid dari Solanum mammosum L.Tesis. Uni versitas Airlangga. Surabaya. pp:l 35
16. Pierik, R L M. 1987. in vitro culture of Higher Plants; Martinus Nijhoff Publisher. Dordrecht/ Boston/ Lancaster, pp: 183 - 230.
17- Abidin, Z. 1985- Dasar-dasar pengetahuan tentang zat •pengatur tumbuh. Angkasa. Bandung, pp: 1,3,37»55j 63,69.
18. Kusumo, S. 1984- Zat pengatur tumbuh tanaman. CV Jasa Guna. Jakarta. pp:7
19* Heddy, S. 1986. Hormon tumbuhan. CV Rajawali. Jakarta PP: 2
20. Lawrence, G M H. 1951. Taxonomy of vascular plant. The Mac Millan Comp, pp: 472 - 473, 676.
21. Backer, C A and R C Bakhuizen van den Brink Jr. 1965* Flora of Java. Vol: II. Wolters - Noodhoof Gro ningen. The Netherlands, pp: 474.
22. Dodds, J H and L W Roberts. 1982. Experiments in plant tissue culture. Cambridge University Press. Cam bridge. pp: 11