D
I
S
U
S
U
N
OLEH : KELOMPOK 1
Abia Appu Sirenden
Ines Patandianan
Julio C. Malamassam
Karunia Meiliana Masseleng
Sonia Pratiwi
Yashinta Rumpa
KELAS : XII IPA 1 (SMA KRISTEN BARANA’)
KATA PENGANTAR
ini dengan baik. Makalah ini dibuat dalam rangka melaksanakan tugas mata
peajaran kimi yang diberikan oleh Ibu Elisabeth Kuddi. Kami menyadari bahwa di
dalam makalah ini masih banyak kekurangan yang perlu perbaikan. Olehnya
itu,tangan kami terbuka lebar untuk menerima kritik dan saran dari para pembaca
demi penyempurnaan makalah ini.
Harapan kami adalah semoga makalah ini dapat berguna bagi siapapun yang
membacanya. Terimakasih…
Barana’, 28 September 2015
Penyusun
Kelompok 1
DAFTAR ISI
Kata Pengantar……….…………ii
Daftar Isi………...iii
BAB I PENDAHULUAN……….1
BAB II ISI……….2
BAB III PENUTUP……….13
Daftar Pustaka……….16
BAB I
PENDAHULUAN
A. Latar Belakang
sifatnya ke dalam beberapa golongan, yaitu golongan A (golongan utama) dan golongan B (golongan transisi). Selain itu, unsur-unsur kimia dapat dikelompokkan menjadi unsur logam, nonlogam, semilogam, dan gas mulia
Beberapa usur logam dan nonlogam, dalam bentuk unsur maupun senyawa, banyak dimanfaatkan didalam kehidupan sehari-hari. Penggunaan beberapa unsur logam dan nonlogam meningkat dengan berkembang pesatnya industri, baik sebagai alat, bahan dasar, maupun sumber energi.
Unsur-unsur logam umumnya diperoleh sebagai bijih logam dalam batuan. Alam Indonesia sangat kaya akan sumber mineral bijih logam, karena itu perlu penguasaan teknologi untuk mengolahnya menjadi logam yang dibutuhkan.
Unsur Logam yang sudah akrab dengan kehidupan kita sehari-hari diantaranya adalah, besi, tembaga, atau perak. Ternyata unsur natrium pun bersifat logam. Namun, karena tak stabil dalam keadaan unsurnya, ia lebih banyak kita temui dalam bentuk senyawanya.
Keberadaan unsur kimia di alam sangat melipah. Sumber
unsur-Unsur kimia terdapat di kerak bumi, dasar laut, dan atmosfer, baik dalam bentuk unsur bebas, senyawa ataupun campurannya. Unsur-unsur kimia yang terdapat di alam dalam bentuk unsur bebasnya (tidak bersenyawa dengan unsur lainnya), diantaranya logam platina (Pt), emas (Au), karbon (C), gas nitrogen (N2), oksigen (O2), dan gas-gas mulia. Adapun unsur-unsur lainnya ditemukan dalam bentuk bijih logam. Bijih logam merupakan campuran antara mineral yang mengandung unsur-unsur kimia dan pengotornya. Mineral-mineral tersebut berbentuk senyawa oksida, halida, fosfat, silikat, karbonat, sulfat, dan sulfida. Logam platina (Pt) dan emas (Au) disebut logam mulia. Sumber logam mulia dan mineral-mineral dapat ditemukan di kerak bumi, sedangkan sumber gas oksigen, nitrogen, dan gas mulia (kecuali He) terdapat di lapisan atmosfer.
Sulit dibayangkan jika kita hidup tanpa adanya unsur kimia karena semua benda yang ada di alam ini mengandung unsur kimia, baik dalam bentuk logam atau unsur bebasnya,
senyawanya, atau paduan logamnya. Tak bisa dipungkiri, selain memberikan manfaat, beberapa unsur kimia memberikan dampak negatif terhadap lingkungan dan kesehatan. Kegunaan dan dampak dari unsur-unsur kimia beserta cara mencegah dan menanganinya tidak terlepas dari sifat yang dimiliki unsur-unsur tersebut. Melalui makalah ini kami harapkan pembaca dapat
memahami dan mengetahui kimia unsur lebih spesifik lagi.
B. Tujuan Penulisan
1. Mengetahui dan memahami keberadaan gas mulia, halogen, logam alkali, dan alkali tanah di alam.
2. Mengetahui dan memahami reaksi dan sifat-sifat gas mulia, halogen, logam alkali, dan alkali tanah.
3. Mengetahui dan memahami kegunaaan gas mulia, halogen, logam alkali, dan alkali tanah.
C. Rumusan Masalah
1. Seberapa banyak keberadaan gas mullia, halogen, logam alkali, dan alkali tanah di alam? 2. Bagaimana sifat-sifat dan reaksi-reaksi gas mulia, halogen, logam alkali, dan alkali tanah? 3. Apakah kegunaan dari gas mulia, halogen, logam alkali, dan alkali tanah?
D. Tujuan Penulisan
Hasil dari penulisan ini diharapkan dapat memberikan manfaat kepada semua pihak yang membacanya umumnya dan khususnya kepada siswa untuk menambah wawasan dan
BAB II
ISI
A. GAS MULIA (GOLONGAN VIIIA)
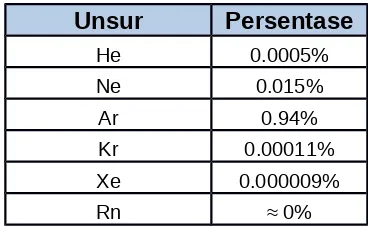
Kelimpahan di alam
Tabel persentase kelimpahan gas mulia di alam
Unsur Persentase
Sifat Fisik Gas Mulia
Tabel data kuantitatif sifat fisik gas mulia di alam
Data Fisik He Ne Ar Kr Xe Rn
Nomor atom 2 10 18 36 54 86
Elektron valensi 2 8 8 8 8 8
Jari-jari atom (Å) 0,50 0,65 0,95 1,10 1,30 1,45
Titik leleh (⁰C) -272,2 -248,6 -189,4 -157,2 -111,8 -71
Titik didih ( C)⁰ -268,9 -246,0 -185,9 -153,4 -108,1 -62
Energi ionisasi (El, kJ/mol) 2640 2080 1520 1350 1170 1040
Afinitas elektron (AE, kJ/mol) 0,178 0,900 1,78 1,78 5,89 9,73
Sifat Kimia Gas Mulia
- Energi ionisasi tinggi dan afinitas electron rendah, sehingga sukar bereaksi.
- Keelektronegatifan rendah.
- Stabil sebagai unsur monoatom.
- Makin ke bawah : energi ionisasi makin rendah, sehingga Ar, Kr, Xe, dan Rn dapat
direaksikan dengan atom yang sangat elektronegatif (F dan O)
- Makin ke bawah, jari-jari atom (r), kerapatan (ρ), titik leleh, titik didih, dan kereaktifan meningkat.
Walaupun senyawa gas mulia telah berhasil dibuat, namun tetap harus diakui bahwa unsur gas mulia lebih stabil dari semua golongan lainnya. Unsur gas mulia hanya dapat berikatan dengan unsur yang sangat elektronegatif, seperti fluorin dan oksigen.
Reaksi-reaksi Gas Mulia
Unsur Reaksi Nama Senyawa yang
6XeF4(s) + 12H2O(l) → 2XeO3(s) + 4Xe(g) +3O2(g) + 24HF(aq)
Rn Rn(g) + F2(g) → RnF2(g) Radon difluorida
Kegunaan Gas Mulia
Gas
Mulia Kegunaan Sifat-sifat atau Alasan
He
1 Pengisi balon udara Tidak mudah terbakar.
2 Campuran He/O2, di samping N2/O2, untuk pernapasan penyelam Kelarutan dalam darah rendah,
3 Pelarut untuk anestesi gas mencegah narkosis nitrogen.
4 Campuran He/O2 untuk pernapasan pasien Tidak reaktif. Densitas rendah,
5 Transfer panas sedang untuk reaktor nuklir mudah mengalir. Transfer panas
6 Atmosfer inert untuk pengelasan logam cepat, tidak menjadi radioaktif
7 He cair digunakan untuk menjaga suhu rendah dalam penelitian Sukar bereaksi. Titik didih sangat
(kriogenik) rendah. Walaupun lebih berat
8 Pendingin untuk superkonduktor dalam scanner daripada hidrogen, tetapi He
9 Pendorong bahan bakar cair pada roket cocok untuk tujuan ini karena
10 Untuk mengangkat peralatan-peralatan ke atmosfer yang lebih tinggi He tidak terbakar.
untuk mengukur kondisi atmosfer
Ne
1 Lampu neon Pada tekanan yang rendah Ne
pun, arus listrik yang sedang
2 Cahaya fluoresensi dapat menyebabkan cahaya
merah-orange menjad terang,
3 TV tabung dapat dimodifikasi dengan kaca
merah atau pencampuran
4 Laser neon dengan uap air Ar atau Hg.
Ar
1 Atmosfer inert untuk pengelasan Sukar bereaksi sehingga
mencegah penguapan filamen
2 Pengisi bola lampu tungsten dan penghitaman bola
Kr
Memberikan berkas cahaya yang
Pemandu pesawat tinggal landas lebih lama daripada Ar, tetapi
lebih mahal
Xe Campuran Xe dan Kr dengan intensitas tinggi digunakan untuk Kedua gas memiliki respon yang
pencahayaan dalam lampu fotografi cepat terhadap arus listrik.
Rn Terapi kanker secara radiokimia Radioaktif
B. HALOGEN (GOLONGAN VIIA)
Kelimpahan di Alam
Klor terdapat di alam karena daya gabung klor terhadap unsur-unsur lain yang biasanya
sangat besar membentuk senyawaan terutama dalam garam dapur NaCl, KCl dan MgCl2. Brom
mula-mula diperoleh dari dalam air laut. Unsur-unsur ini sekarang diusahakan dalam jumlah
yang besar sebagai bromida, misal NaBr, MgBr2. Iod terdapat sebagai Na-iodat dalam
mutterlauge, sendawa chili sebagai iodida dalam ganggang laut dan dalam sumber air iodium di
Jawa Timur (Mojokerto) serta dalam kelenjar gondok manusia dan hewan. Oleh karena daya
gabung terhadap unsur-unsur lain lebih besar daripada halogen lainnya, maka fluor selalu
Sifat Fisik Halogen
Sifat-sifat F Cl Br I At
Wujud (25 C)⁰ Gas Gas Cair Padat Padat
Warna Kuning
Jari-jari atom (Å) 0,72 1,00 1,14 1,33 1,40
Jari-jari anion X-(Å) 1,19 1,67 1,82 2,06 ―
Konfigurasi e– valensi 2s2 2p5 3s2 3p5 4s2 4p5 5s2 5p5 6s2 6p5
Energi ionisasi pertama (kJ/mol) 1681 1251 1140 1008 890
Afinitas elektron (kJ/mol) -328 -349 -325 -249
Keelektronegatifan 4,0 3,0 2,8 2,5 2,1
Titik leleh ( C, 1 atm)⁰ -220 -101 -7,1 114 ―
Potensial reduksi standar (volt)
X2→2Xˉ 2,87 1,36 1,06 0,54 ―
Titik didih ( C, 1 atm)⁰ -188 -35 59 184 ―
Energi ikatan X―X (kJ/mol) 155 242 193 151 ―
Kerapatan (g/cm3) 1,11 1,56 3,212 4,93 ―
Sifat Kimia Halogen
- Unsur-unsur halogen terdapat sebagai molekul diatomic.
- Halogen merupakan unsur nonlogam yang paling reaktif dengan kecenderungan untuk
menarik electron yang kuat, karena halogen memiliki keelektronegatifan dan afinitas electron yang tinggi.
- Unsur halogen juga berperan sebagai oksidator kuat dalam suatu reaksi redoks.
- Halogen cenderung berikatan dengan atom-atom lain, baik logam maupun nonlogam,
membentuk senyawa ionic maupun kovalen.
Reaksi-reaksi Halogen
Dengan Logam Dengan Hidrogen Dengan Nonlogam danMetaloid Tertentu H2 + X2 → 2HX
2Al + 3Br2 → 2AlBr3 H2 + F2 → 2HF Si + 2X2 → SiX4
2Fe + 3Cl2 → 2FeCl3 H2 + Cl2 → 2HCl 2B + 3X2 → 2BX3
Cu + F2 → CuF2 H2 + Br2 → 2HBr P4 + 6X2 → 4PX3
2Na + Cl2 → 2Nacl H2 + I2 → 2HI P4 + 10X2 → 4PX5
Dengan Hidrokarbon Dengan Nitrogen Dengan Basa
CH4 + F2 → CH3F + HF Tidak bereaksi
Reaksi-reaksi Ion-Ion Halida
Asam sulfat memiliki sifat sebagai oksidator maupun sebagai asam. Semua senyawa halida dapat bereaksi dengan H2SO4.
- Ion fluorida dan ion klorida bereaksi dengan H2SO4 pekat berturut-turut menghasilkan
asam fluorida dan asam klorida.
- Ion bromide dan ion iodide bereaksi dengan H2SO4 pekat berturut-turut tidak
menghasilkan asam bromide dan asam iodida, tetapi menghasilkan belerang dioksida (SO2) dan asam sulfide (H2S)
Asam fosfat pekat adalah asam lemah dan oksidator lemah yang dapat bereaksi dengan semua garam halida menghasilkan garam-garam halide. Reaksi ini banyak diterapkan dalam
pembuatan asam-asam halida di laboratorium dengan persamaan reaksi umum : 3Xˉ + H3PO4
→ PO43ˉ + 3HX
Kegunaan-kegunaan dan Produksi Halogen
Halogen Sumber Kegunaan
Fluorin 1 Terdapat dalam air laut, gigi, tulang, dan darah dalam jumlah yang sedikit
1 Sebagai senyawa organik berfluor yang stabil dan tidak mudah terbakar. Senyawa-senyawa ini antara lain digunakan sebagai pendingin, pelumas, pelapis (misalnya teflon), insektisida, dan propelan aerosol.
2 Terdapat melimpah dalam mineral fluorapatit
(Ca5(PO4)3F), fluorspar atau fluorit (CaF2), dan
kriolit (Na3AlF3)
3 Gas kuning pucat F2 dibuat melalui elektrolisis
campuran lelehan KF + HF atau KHF2 dalam
kondisi tanpa air, karena H2O lebih mudah
teroksidasi daripada Fˉ
2 Stanno fluorida, SnF2, digunakan dalam
pasta gigi.
4 Diperoleh melalui reaksi antara
heksafluoromanganat (VI) dengan antimoni (V) fluorida dalam wadah baja-teflon pasif pada suhu 150 C selama 1 jam dengan perolehan F⁰ 2
sebanyak 40%. Reaksi keseluruhan ditunjukkan sebagai berikut :
2K2MnF6(s) + 4SbF5(l) → 4KSbF5(s) + MnF3(s) +F2(g)
Klorin 1 Terdapat sebagai HCl dalam cairan asam lambung. 1 Digunakan dalam produksi polivinil klorida (PVC) yang dikenal sebagai pralon.
(bahasa
Yunani 2 Terdapat melimpah sebagai NaCl, KCl, MgClCaCl2 dalam air garam dan tempat-tempat 2, dan 2 Dalam bentuk Cl2, NaClO, Ca(ClO)2,
Xˉ Reaksi dengan H3PO4
Fˉ 3NaF(aq) + H3PO4(aq) → Na3PO4(aq) + 3HF(aq)
Clˉ 3NaCl(aq) + H3PO4(aq) → Na3PO4(aq) + 3HCl(aq)
Brˉ 3NaBr(aq) + H3PO4(aq) → Na3PO4(aq) + 3HBr(aq)
"chloros" = hijau)
bergaram. atau Ca(ClO) banyak digunakan sebagai pemutih untuk bubur kertas
atau tekstil. 3 Dibuat melalui elektrolisis larutan NaCl pekat.
4 Klorin merupakan unsur penyusun utama garam
dapur, NaCl 3 Digunakan untuk pengelantang atau desinfektan dalam pengolahan air,
karena Cl2 bereaksi secara lambat
dengan H2O membentuk HCl dan
HClO. Asam hipoklorit selanjutnya terurai menjadi HCl dan O radikal yang membunuh bakteri.
Bromin 1 Bromin kurang melimpah dibandingkan fluorin dan
klorin.
1 Produksi perak bromida atau kacamat sensitif-cahaya dan film fotografi. (bahasa
Yunani "bromos" = amis)
2 Pada umumnya dijumpai dalam bentuk senyawa NaBr, KBr, MgBr2, dan CaBr2 dalam larutan garam,
di dalam air asin bawah tanah, dan tempat-tempat bergaram.
2 Produksi natrium bromida, suatu obat penenang ringan.
Iodin 1 Diperoleh dari ganggang laut kering atau kerang
membentuk pengotor NaIO3 dalam endapan nitrat
Chile (NaNO3).
Terkandung dalam hormon pengatur pertumbuhan tiroksin yang dihasilkan oleh kelenjar tiroid.
1 Garam meja beriodium mengandung sekitar 0,02% KI yang membantu mencegah penyakit gondok.
3 Identifikasi senyawa kanji dalam suatu bahan.
3 Dapat dibuat melalui reduksi ion iodat dari NaIO3
dengan natrium hidrogen sulfit (NaHSO3).
2IO3ˉ(aq) + 5HSO3ˉ →3HSO4ˉ(aq) + 2SO42ˉ(aq) +
H2O(l) + I2(s)
Iodin yang diperoleh selanjutnya dimurnikan melalui sublimasi.
Penggunaan Halogen dalam Kehidupan Sehari-hari :
a. Penggunaan fluor
-
Untuk membuat pendingin dan deterjen.
-
Memproduksi uranium heksafluorida dan senyawa fluor lainnya.
-
Untuk bahan bakar roket.
-
Ion fluorida digunakan dalam pasta gigi untuk mencegah gigi berlubang.
-
Senyawa terfluorinasi dapat digunakan untuk membuat plastik dan juga
untuk sketsa kaca.
-
Senyawa terfluorinasi juga untuk menandai bola kaca tipis untuk dukir.
b. Penggunaan klor
-
Sebagai pemutih kertas dan kain.
-
Penggunaan dalam air minum dan kolam renang karena dapat membunuh
bakteri berbahaya.
-
Untuk produksi insektisida, pelarut, pewarna makanan, plastik, pewarna
tekstil, produk minyak bumi, produk kertas, dan lain-lain.
c. Penggunaan brom
-
Sebagai decomposer yang baik karena brom memiliki afinitas terhadap
hidorgen.
-
Digunakan dalam pemadam api, pewarna, dan obat-obatan.
d. Penggunaan iod
-
Digunakan dalam pengobatan, fotografi, dan pewarna.
-
Untuk mengidentifikasi amilum.
-
Sebagai pengontras X-ray dan untuk injeksi intravena.
e. Penggunaan astatine
Astatin berupa padatan pada suhu kamar. Salah satu karakteristik khusus dari
astatine adalah tidak ditemukan di alam sama sekali. Astatin dihasilkan oleh
bombardier bismut dengan partikel alpha. Pemanfaatan astatin belum
ditemukan.
C. LOGAM ALKALI (GOLONGAN IA)
Kelimpahan di Alam
Logam alkali yang banyak di kulit bumi adalah natrium dan kalium, sedangkan litium, rubidium, dan cesium jauh lebih kecil. Fransium (Fr) sebagai unsur ke enam golongan alkali tidak stabil (radioaktif) dengan waktu paro 21 menit, sehingga sulit dipelajar. Diperkirakan hanya sekitar 30 g fransium di kulit bumi. Karena kereaktifannya, unsur alkali tidak ditemukan dalam keadaan bebas di alam, tetapi sebagai ion positif (L+) dalam senyawa ion. Kebanyakan
senyawanya larut dalam air sehingga logam ini banyak terdapat di air laut.
Sifat Fisik Logam Alkali
Sifat-sifat Li Na K Rb Cs Fr
Elektron terluar 2s1 3s1 4s1 5s1 6s1 7s1
Titik leleh (⁰C) 186 97,8 63,6 38,9 28,5 27
Titik didih ( C)⁰ 1347 904 774 688 678 677
Kerapatan (g/cm3) 0,534 0,971 0,862 1,53 1,87
-Jari-jari atom (Å) 1,52 1,86 2,27 2,48 2,65
-Keelektronegatifan 1,0 0,9 0,9 0,9 0,8 0,8
-Energi ionisasi (kJ/mol) : M(g) → M+(g) + eˉ 520 496 419 403 377
M+
(g) → M2+(g) + eˉ 7298 4562 3051 2632 2420
-∆H⁰hidrasi(kJ/mol) : M(g) + xH2O→ M+(aq) -544 -435 -351 -293 -264
-
Sifat Kimia Logam Akali
- Logam alkali juga bersifat korosif. Cesium (tampak seperti emas) meleleh di tangan dan
dapat terjebak dalam plastik karena korosif.
- Titik leleh dan titik didih logam alkali relatif rendah karena lemahnya ikatan logam. Setiap atom hanya dapat member satu electron untuk membentuk ikatan logam.
- Logam-logam alkali menjadi penghantar listrik dan panas yang baik, karena elektron
valensinya begitu mudah berpindah.
- Atom-atom logam alkali terionisasi jika disinari dengan cahaya berenergi rendah (efek fotolistrik). Efek ini makin besar dengan bertambahnya ukuran atom. Itulah sebabnya, cesium digunakan dalam sel fotolistrik.
- Logam-logam alkali memiliki energi ionisasi yang rendah karena elektron valensi
atom-atom logam alkali sangat mudah dilepaskan.
- Dalam senyawa-senyawanya, semua logam alkali memiliki bilangan oksidasi +1.
- Garam-garam logam alkali dengan anion-anion yang kecil sangat mudah larut dalam air,
tetapi garam-garam dengan anion yang besar dan kompleks, seperti silikat dan aluminosilikat, sangat tidak larut dalam air.
- Semakin ke bawah dalam golongan, reaktivitas makin besar.
Reaksi-reaksi Logam Akali
Reaksi Keterangan
Kegunaan Logam Akali
Logam Kegunaan
Litium dan seyawanya 1 Digunakan sebagai media transfer panas dalam percobaan reaktor nuklir, karena Li memiliki kapasitas panas yang tinggi.
2 Paduan litium-aluminium yang sangat ringan digunakan dalam konstruksi pesawat terbang.
3 Digunakan dalam sel kering yang ringan dan baterai
karena memiliki masa pakai yang lama, bahkan pada suhu yang sangat tinggi sekalipun.
proses-proses pengeringan di industri dan pengatur kondisi udara (air conditioning)
Natrium dan
senyawanya 1 Digunakan sebagai pereduksi dalam pembuatan bahan obat-obatan dan penyelup dalam metalurgi logam seperti titanium dan zirkonium.
2 Logam Na menghasilkan cahaya kuning yang terang, sehingga digunakan sebagai lampu penerangan jalan raya. 3 Natrium banyak dijumpai dalam bentuk senyawa, seperti
NaOH (soda kaustik), Na2CO3 (soda abu), Na2CO3.10H2O
(soda cuci), dan NAHCO3 (soda kue atau soda bikarbonat).
4 NaCl (garam meja) sebagai sumber senyawa-senyawa Na dan Cl yang lain.
5 NaNO3 (sendawa Chili) sebagai bahan pupuk.
6 Na2SO4 sebagai bahan untuk produksi HCl
7 NaH digunakan untuk sintesis NaBH4 sebagai bahan untuk recovery perak dan merkuri dari air limbah.
8 NaOH digunakan dalam industri rayon, cairan pembersih, sabun, kertas, tekstil, dan polimer.
Logam alkali yang lain 1 KNO3 dikenal sebagai sendawa (saltpeter), digunakan sebagai pupuk kalium dan nitrogen.
2 Kalium-40 digunakan dalam peluruhan radioaktif kalium-argon untuk mengetahui umur benda-benda kuno. 3 Pada penanganan pernapasan darurat, KO2 bereaksi
dengan H2O dan CO2 dalam udara pernapasan
membentuk O2.
4 Logam rubidium, cesium, dan fransium saat ini masih sangat jarang digunakan.
5 Cesium digunakan dalam beberapa sel fotolistrik.
D. ALKALI TANAH (GOLONGAN IIA)
Kelimpahan di Alam
Magnesium dan kalsium melimpah dalam kerak bumi sebagai senyawa karbonat dan sulfat. Kalsium banyak dijumpai dalam batu-batuan di daerah berkapur sebagai senyawa kalsium karbonat dan kalsium fosfat dan cangkang kerang binatang. Berilium, stronsium, dan barium terdapat kurang melimpah di bumi. Radium merupakan isoto radioaktif sehingga jarang
ditemukan. Logam-logam IIA dapat diperoleh melalui elektrolisis lelehan garam-garam klorida.
Sifat Fisik Alkali Tanah
Sifat-sifat Be Mg Ca Sr Ba Ra
Elektron terluar 2s2 3s2 4s2 5s2 6s2 7s2
Titik leleh ( C)⁰ 1283 689 839 770 725 700
Titik didih ( C)⁰ 2484 1105 1484 1384 1640 1140
Kerapatan (g/cm3) 1,85 1,74 1,55 2,60 3,51 5
Jari-jari atom (Å) 1,12 1,60 1,97 2,15 2,22 2,20
Jari-jari ion, M2+ (Å) 0,59 0,85 1,14 1,32 1,49
E⁰red(volt) : M+(aq)+eˉ → M(s) -1,85 -2,37 -2,87 -2,89 -2,90 -2,92
Energi ionisasi (kJ/mol) : M(g) → M+(g) + eˉ 899 738 599 550 503 509
M+(g) → M2+(g) +
eˉ 1757 1451 1145 1064 965 -979
∆H hidrasi(kJ/mol) : M⁰ (g) + xH2O→ M+(aq) - -1925 -1650 -1485 -1276
-
Sifat Kimia Alkali Tanah
- Sifat logam unsur alkali tanah bertambah dengan bertambahnya nomor atom
- Semua logam alkali tanah teroksidasi di tanah membentuk senyawa oksida, kecuali Be.
- Oksida alkali tanah, kecuali BeO, bersifat basa karena bereaksi dengan air membentuk
senyawa hidoksida
- Berilium hidroksida, Be(OH)2, tidak terlalu larut dalam air dan bersifat amfoter. Selain
itu, ion Be2+ bereaksi dengan larutan basa kuat membentuk endapan Be(OH)
2. Jika basa
kuatnya berlebih, endapan Be(OH)2 larut membentuk ion kompleks [Be(OH)4]2-.
- Magnesium hidroksida hanya sedikit larut dalam air. Ca(OH)2, Sr(OH)2, dan Ba(OH)2
adalah basa kuat.
- Makin besar nomor atom, makin reaktif logam alkali.
Reaksi-reaksi Alkali Tanah
a.
Reaksi-reaksi Logam Alkali Tanah (Golongan IIA)
Reaksi dengan
Oksigen, O2 Reaksi dengan Air Reaksi dengan Asam
M(s) + O2(g) → MO (s) M + 2H2O → M(OH)2 + H2 Be(s) + HCl(aq) → BeCl2(aq) + H2(g)
(M=Be, Mg, Ca, Sr, Ba, Ra) (M=Mg, Ca, Sr, Ba) Be(s) + H2SO4(aq) → BeSO4(aq) + H2(g)
Berilium tidak bereaksi dengan air murni, walaupun
dipanaskan. Mg bereaksi dengan air panas
Ba(s) + HCl(aq) → BaCl2(aq) + H2(g) Ba(s) + H2SO4(aq) → BaSO4(s) + H2(g)
b.
Persamaan reaksi pembentukan senyawa oksida, hidrida, dan nitrida logam
IA dan IIA
Senyawa Logam IA Logam IIA
Oksida 4M + O2 → 2M2O 2M + O2 → 2MO
Hidrida 2M + H2 → 2MH M + H2 → MH2
Air Sadah
Air sadah (hard water) adalah air yang sulit digunakan untuk mencuci karena
mengandung ion-ion Ca2+ dan Mg2+ yang berlebih. Ion-ion ini mengendapkan sabun atau deterjen
sehingga daya cuci sabun atau deterjen menurun bahkan hilang.
Sabun/deterjen + Ca2+/Mg2+(aq) → Ca(sabun/deterjen)2(s)
Contoh :
2C17H35COONa(s) + Ca(HCO3)2(aq) → Ca(C17H35COO)2(S) + 2NaHCO3(aq)
Akibatnya, sabun atau deterjen dalam air sadah sulit berbuih. Tingkat kesadahan air bergantung pada konsentrasi Ca2+ dan atau Mg2+.
Tingkat Kesadahan Konsentrasi Mg2+ dan Ca2+ (gpg)*
Lunak Kurang dari 1,0
Sedikit sadah 1,0-3,5
Setengah sadah 3,5-7,0
Sadah 7,0-10,5
Sangat sadah Lebih dari 10,5
Kegunaan Alkali Tanah (dan Senyawa-senyawanya)
Logam Sifat Kegunaan
Berilium (Be) Senyawa berilium sangat toksis
Karena jarang, berilium hanya memiliki sedikit penggunaan. Berilium terutama terdapat sebagai beril, Be3Al2Si6O18, berwarna hijau. Karena dapat ditembus oleh sinar-X,maka jendela lubang sinar tabung sinar-X dibuat dari Be.
(Mg) 1 Logam Mg dapat terbakar di udara dengan pancaran cahaya putih yang terang.
1 Mg banyak digunakan dalam pencahayaan fotografi dan sebagai bahan kembang api.
2 Ringan. 2 Pembuatan paduan logam untuk
bahan bangunan. 3 Mudah bereaksi dengan
oksigen di udara. 3 Pelindung korosi. Kalsium (Ca) 1 Mudah bereaksi dengan
oksigen dan air membentuk senyawa oksida dan
hidroksida.
1 Sebagai zat pereduksi dalam metalurgi uranium, thorium, dan logam-logam yang lain.
2 Sebagai perangkap untuk
menghilangkan pengotor seperti oksigen dan belerang dalam lelehan logam dan untuk menghilangkan gas-gas yang tertinggal dalam tabung hampa udara.
dalam banyak logam paduan.
4 Bahan baku pembuatan kapur
tohor dan semen untuk bahan-bahan bangunan.
Stronsium (Sr) 1 Mudah bereaksi dengan oksigen dan air membentuk senyawa oksidadan
hidroksida, dengan
reaktivitas yang lebih tinggi
stronsium yang khas dalam nyala. 2 Logam stronsium sendiri tidak
banyak digunakan. Stronsium klorida banyak digunakan dalam pasta gigi untuk orang-orang yang bergigi sensitif.
2 Reduktor kuat.
Barium (Ba) Semua garam barium
terlarut bersifat toksik 1 Barium merupakan unsur paduan yang digunakan untuk busi karena mudahnya melepaskan elektron ketika dipanaskan.
2 Barium digunakan sebagai zat pengisap gas untuk tabung hampa.
3 Lempung barium sulfat halus, BaSO4, digunakan untuk melapisi alat saluran usus dalam penyiapan fotografi sinar-X karena barium sulfat dapat menyerap sinar-X dengan baik.
BAB III
PENUTUP
Kesimpulan :
1. Gas mulia adalah kelompok unsur-unsur golongan VIIIA yang terdiri dari helium (He),
neon (Ne), Argon (Ar), kripton (Kr), xenon (Xe), dan radon (Ra).
2. Sifat-sifat fisik gas mulia antara lain :
- Gas mulia memiliki daya hantar listrik yang tidak baik.
- He tidak dapat dipadatkan dengan penurunan suhu, tetapi dengan menaikkan tekanan.
- Kerapatan bertambah dari He ke Rn, karena jari-jari, massa atom dan gaya London
bertambah.
- Titik leleh, titik didih, kalor peleburan (∆Hfus) dan kalor penguapan (∆Hv) bertambah dari
He ke Rn, karena kerapatan dan gaya London bertambah.
- Daya hantar panas berkurang dari He ke Rn, karena kerapatan dan gaya London
bertambah, sehingga partikel semakin sulit bergerak, transfer energi panas antarpartikel semakin sulit.
3. Sifat-sifat kimia gas mulia antara lain :
- Energi ionisasi tinggi dan afinitas electron rendah, sehingga sukar bereaksi.
- Keelektronegatifan rendah.
- Stabil sebagai unsur monoatom.
- Makin ke bawah : energi ionisasi makin rendah, sehingga Ar, Kr, Xe, dan Rn dapat
direaksikan dengan atom yang sangat elektronegatif (F dan O)
- Makin ke bawah, jari-jari atom (r), kerapatan (ρ), titik leleh, titik didih, dan kereaktifan meningkat.
4. Halogen adalah kelompok unsur-unsur golongan VIIA. Halogen memiliki sifat sebagai
berikut :
- Golongan unsur yang paling dekat dengan gas mulia, sangat tidak stabil (reaktif) dan afinitas elektron tinggi, dengan urutan afinitas: Cl>F>Br>I>At.
- Keelektronegatifan : F>Cl>Br>At
- Unsur bebasnya terbentuk molekul diatomic (F2, Cl2, Br2, I2).
- Wujud zat pada suhu kamar sesuai dengan ukuran molekulnya. F2 dan Cl2 : gas (jarak
antarmolekul jauh), dan Br2 : cair, I2: padat, karena jari-jari mokeul dari F2 ke I2 makin
besar.
- Sifat oksidator : F2>Cl2>Br2>I2
5. Halogen dapat bereaksi dengan logam, hidrogen, nitrogen, hidrokarbon, basa, nonlogam dan metaloid tertentu, dan antarhalogen.
6. Logam alkali adalah kelompok logam-logam golongan IA yang terdiri dari Li, Na, K, Rb,
Cs, dan Fr.
7. Semua logam alkali memiliki bilangan oksidasi +1 dalam senyawa-senyawanya.
8. Oksida dalam IA adalah oksida basa. Jika dilarutkan dalam air, oksida-oksida IA larut membentuk larutan basa kuat. Semua basa alkali adalah basa kuat.
9. Logam alkali tanah adalah kelompok logam-logam golongan IIA yang terdiri dari Be,
Mg, Ca, Sr, Ba, dan Rs.
10.Semua logam alkali tanah teroksidasi di udara menjadi oksida, kecuali Be. Semua logam
alkali tanah bereaksi dengan asam menghasilkan garam dan gas H2. Makin besar nomor
atom, reaksi dengan asam makin reaktif.
11. Air sadah adalah air yang sulit digunakan untuk mencuci karena mengandung ion-ion
Ca2+ dan Mg2+.
12.Air sadah sementara dihilangkan atau dilunakkan melalui :
- Pemanasan
- Penambahan larutan karbonat.
13.Air sadah tetap dapat dihilangkan melalui :
- Penambahan larutan karbonat
- Melewatkan air sadah ke dalam kolom penukar ion.
Lampiran…
DAFTAR PUSTAKA
Watoni A. Haris, Juniastri Meta. 2015. Buku Siswa Kimia. Bandung : Yrama Widya.
http://perpustakaancyber.blogspot.com/2013/07/kelimpahan-golongan-viia-7a-halogen-di-alam.html
https://www.google.co.id/search?q=gambar+jari-jari+atom+kimia+unsur&biw=1366&bih=696&source=lnms&tbm=isch&sa=X&ved=0C AYQ_AUoAWoVChMIn6bamNqeyAIVhECOCh3VsAs9#imgrc=_
http://sukiman-barcitizen.blogspot.co.id/2013/11/makalah-kimia-unsur.html
http://la-randy.blogspot.co.id/2012/12/makalah-kimia-unsur.html