Rpp kimia unsur 1 docx
Teks penuh
Gambar
Garis besar
Dokumen terkait
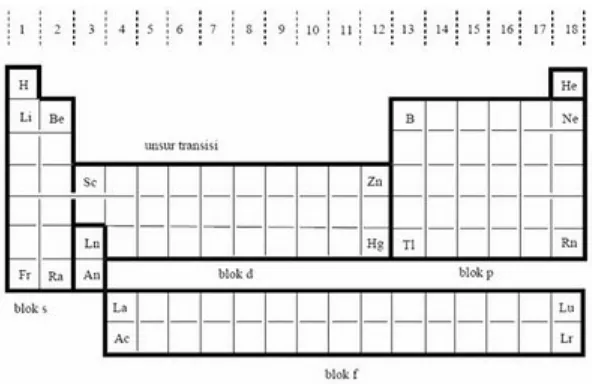
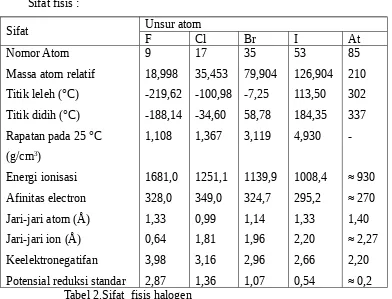
Unsur bromin dengan nomor atom 35, dalam sistem periodik unsur terletak pada periode dan golongan.. Kelompok senyawa dibawah ini yang mempunyai ikatan
Jika atom tersebut mempunyai 48 neutron maka logam tersebut pada sistem periodik terletak pada periode dan golongan……….. Terletak pada perioda dan golongan berapa unsur yang
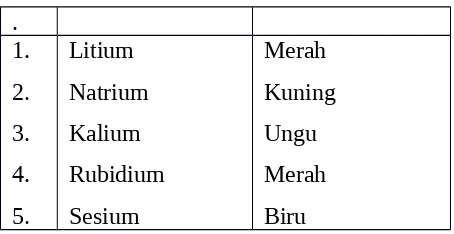
(a) merupakan unsur sangat reaktif (b) terdapat dalam keadaan bebas di alam (c) dibuat dengan cara elektrolisis lelehan garam (d) ionnya bermuatan positip satu.. (e) senyawanya
Unsur periode ketiga yang mempunyai sifat reduktor paling kuat adalah ..... Sifat oksidator terkuat pada periode ketiga dimiliki
MAKALAH KIMIA TENTANG UNSUR-UNSUR GOLONGAN VIIA.. ANGGOTA KELOMPOK XII IPA 3 :
Dari kiri ke kanan, unsur-unsur periode ketiga memiliki harga ionisasi yang semakin besar sehingga semakin sukar melepas electron.. Penyebabnya electron Dari unsur tersebut akan
Materi yang didiskusikan antara lain komposisi kelimpahan unsur di alam, komposisi udara bersih dan kering, kandungan mineral utama dalam air laut, dan berbagai mineral
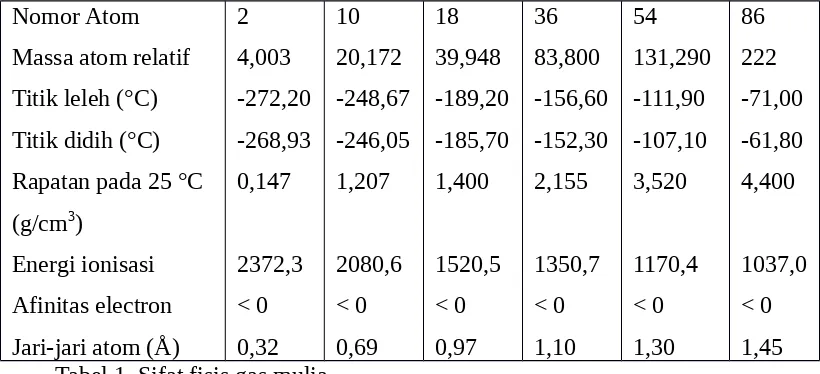
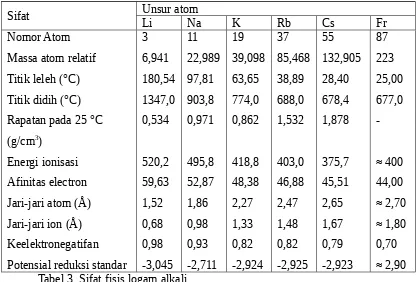
Diberikan data hasil percobaan, secara mandiri siswa dapat membuat laporan percobaan tentang sifat fisik dan sifat kimia unsur golongan alkali, alakali tanah, gas mulia,