Informasi Dokumen
- Sekolah: universitas
- Mata Pelajaran: kimia
- Topik: kimia unsur
- Tipe: essay
Ringkasan Dokumen
I. KELIMPAHAN UNSUR DAN PRODUK-PRODUKNYA
Bagian ini membahas tentang kelimpahan unsur-unsur di alam dan produk-produk yang dihasilkan dari unsur-unsur tersebut. Unsur-unsur golongan utama dalam sistem periodik, seperti gas mulia, halogen, alkali, dan alkali tanah, memiliki karakteristik dan kegunaan yang berbeda. Pengetahuan tentang kelimpahan unsur sangat penting untuk memahami pemanfaatannya dalam industri dan kehidupan sehari-hari. Misalnya, helium sebagai gas mulia paling banyak di alam semesta, sementara argon paling banyak di udara. Hal ini menunjukkan pentingnya penguasaan teknologi untuk mengolah sumber daya mineral di Indonesia.
1.1. Unsur Golongan Utama
Dalam sub-bagian ini, dibahas tentang unsur-unsur golongan utama yang meliputi gas mulia, halogen, alkali, dan alkali tanah. Unsur-unsur ini memiliki sifat fisika dan kimia yang unik. Misalnya, gas mulia tidak membentuk senyawa di alam, sedangkan halogen sangat reaktif dan hanya ditemukan dalam bentuk senyawa. Pemahaman tentang sifat-sifat ini penting dalam aplikasi industri dan kimia.
1.2. Kelimpahan Unsur
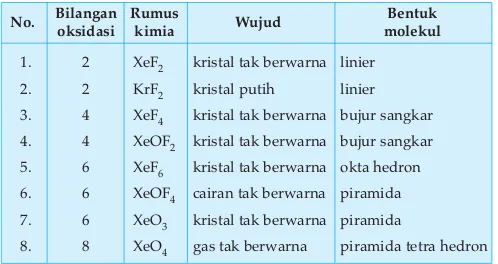
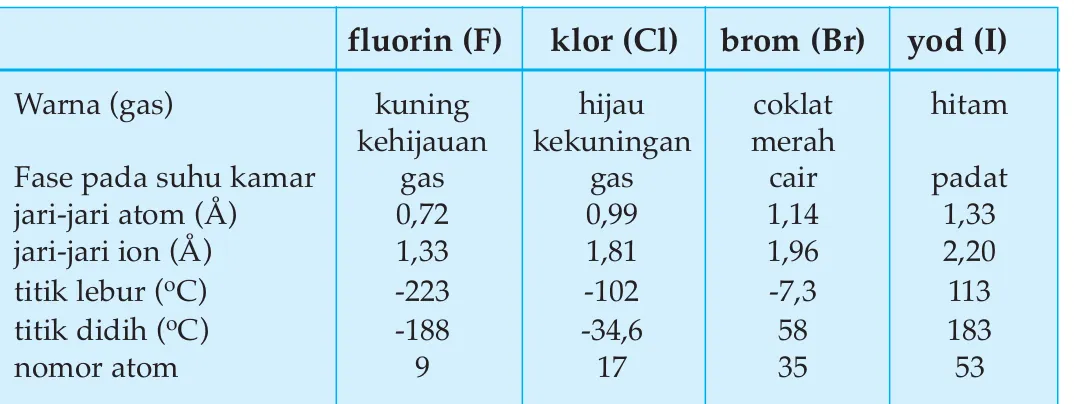
Kelimpahan unsur di alam sangat bervariasi. Tabel yang disajikan dalam dokumen menunjukkan kelimpahan gas mulia dan halogen. Unsur seperti argon dan klorin memiliki aplikasi penting dalam berbagai industri, termasuk pembuatan bahan kimia dan teknologi lingkungan. Memahami kelimpahan ini membantu siswa untuk mengaitkan teori dengan praktik di lapangan.
1.3. Produk yang Mengandung Unsur
Bagian ini menjelaskan berbagai produk yang dihasilkan dari unsur-unsur tersebut. Misalnya, produk yang mengandung gas mulia seperti argon dan xenon serta produk halogen yang sering digunakan dalam kehidupan sehari-hari. Pengetahuan ini memberi wawasan kepada siswa tentang bagaimana unsur-unsur kimia berperan dalam kehidupan sehari-hari dan industri.
II. SIFAT-SIFAT UNSUR
Sifat-sifat unsur dikelompokkan menjadi dua kategori utama: sifat fisika dan sifat kimia. Sifat fisika mencakup karakteristik seperti massa jenis, titik lebur, dan daya hantar listrik, sedangkan sifat kimia berhubungan dengan reaktivitas dan kemampuan unsur untuk membentuk senyawa. Pemahaman ini penting untuk aplikasi dalam berbagai bidang seperti farmasi, material, dan teknologi.
2.1. Sifat Fisika
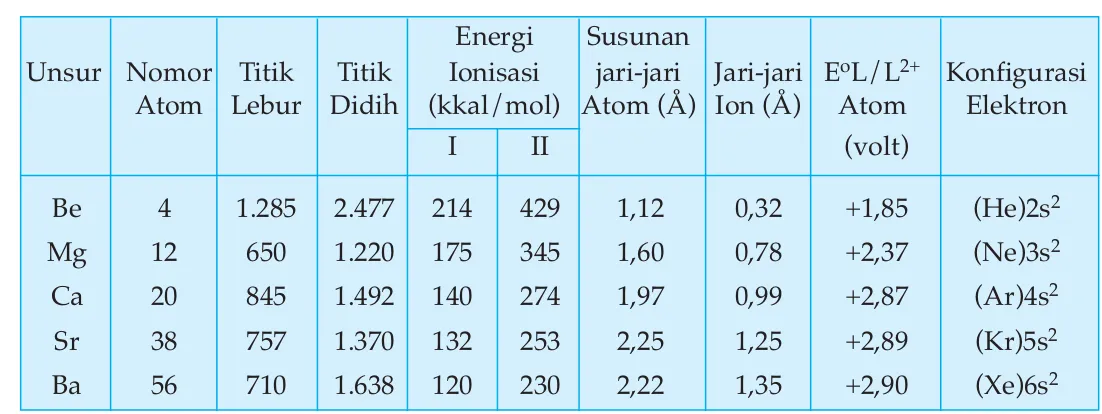
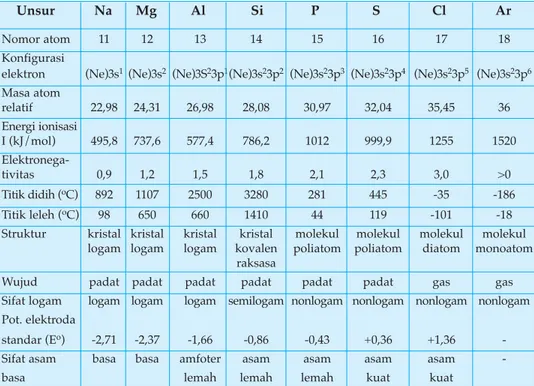
Sifat fisika dari unsur-unsur seperti gas mulia dan halogen menunjukkan perbedaan yang signifikan. Misalnya, gas mulia memiliki titik didih yang sangat rendah, sementara halogen menunjukkan variasi dalam wujud dan titik didih. Memahami sifat fisika ini membantu siswa dalam eksperimen laboratorium dan aplikasi praktis di industri.
2.2. Sifat Kimia
Sifat kimia unsur menggambarkan kecenderungan mereka untuk bereaksi dengan unsur lain. Halogen, misalnya, sangat reaktif dan cenderung membentuk senyawa dengan logam dan non-logam. Pengetahuan tentang sifat kimia ini sangat penting dalam pengembangan senyawa baru dan aplikasi dalam kimia organik dan anorganik.
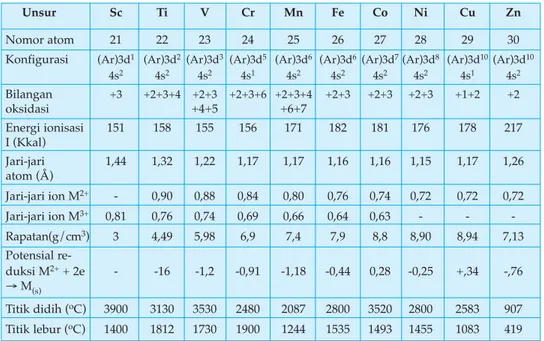
III. UNSUR-UNSUR TRANSISI
Unsur-unsur transisi memiliki karakteristik unik yang membedakannya dari unsur lain. Mereka sering memiliki beberapa bilangan oksidasi dan dapat membentuk senyawa berwarna. Bagian ini membahas pentingnya unsur transisi dalam industri dan teknologi, serta aplikasinya dalam berbagai produk.
3.1. Kelimpahan dan Produk Unsur Transisi
Unsur transisi seperti krom, tembaga, dan besi memiliki kelimpahan yang signifikan di alam dan banyak digunakan dalam industri. Misalnya, tembaga digunakan dalam kabel listrik dan paduan logam. Memahami kelimpahan dan produk ini penting untuk aplikasi praktis dan inovasi teknologi.
3.2. Sifat Fisika dan Kimia Unsur Transisi
Sifat fisika dan kimia unsur transisi, seperti daya hantar listrik dan kemampuan membentuk senyawa berwarna, sangat penting dalam aplikasi industri. Unsur-unsur ini juga memiliki sifat magnetik yang unik, yang dapat dimanfaatkan dalam teknologi modern. Pengetahuan ini membantu siswa memahami bagaimana sifat-sifat ini diterapkan dalam teknologi dan penelitian.