SKL 1 SOAL KIMIA
1. Unsur X dengan konfigurasi electron 1S2 2S2 2p6 3S2 3p6 dan
mempunyai 17 netron. Notasi yang tepat untuk unsur X adalah…..
a.
dengan unsur 168O maka rumus kimia senyawa yang terbentuk dan jenis ikatan nya berturut – turut adalah ....
a. XY , ionik b. X2Y , ionik
c. XY2 , ionik
d. XY2 , kovalen
e. X2Y , kovalen
1. Unsur 19K mempunyai konfigurasi elektron pada kulit K, L, M, dan N
berturut-turut . . . .
a. 2, 8, 9, 0
b. 2, 8, 8, 1
c. 2, 4, 8, 5
d. 2, 6, 8, 3
e. 2, 2, 8, 7
2. Unsur bromin dengan nomor atom 35, dalam sistem periodik unsur terletak pada periode dan golongan . . . .
a. 3 dan VA
b. 4 dan IVA
c. 4 dan VA
d. 4 dan VIIA
e. 7 dan IA
3. Kelompok senyawa dibawah ini yang mempunyai ikatan ion adalah . . . .
a. NaCl, K2O dan H2O
b. H2O, CO2 dan HF
c. Ca(OH)2, BaCl2 dan MgCl2
d. NaCl, HCl dan CaO e. MgCl2, NH3 dan Na2O
4. Massa molekul relatif air adalah 18, sedang H2S adalah 34, tetapi
titik didih air lebih tinggi dari H2S. Unsur oksigen dan belerang
terdapat dalam satu golongan. Perbedaan titik didih tersebut terjadi karena antar molekul air terdapat ikatan . . . .
a. hidrogen b. ion
c. kovalen
d. kovalen polar e. kovalen koordinat
1. Konfigurasi electron suatu ion adalah 2 8 8 , bila unsur tersebut mempunyai nomor atom 17, maka muatan ion tersebut adalah …. a. – 2
b. – 3 c. + 2 d. + 3 e. + 4
a. [Ar] 4s2 3d8
b. [Ar] 4s2 4p1
c. [Ar] 4s2 3d10 4p1
d. [Xe] 6s2 4f3
e. [Xe] 6s2 5d3
3. Perhatikan sifat- sifat unsur berikut:
Unsur Daya Hantar listrik Keelektronegati fan
X Lelehannya dapat
menghantarkan listrik
rendah
Y Larutannya dapat
menghantarkan listrik
tinggi
Unsur – unsur tersebut akan membentuk senyawa dengan jenis ikatan ....
a. hidrogen b. logam c. ionik
d. kovalen non polar e. kovalen koordinat
4. Unsur Y dengan konfigurasi elektron 2 8 7 , membentuk senyawa dengan unsur X (No. Atom = 6) dengan ikatan kovalen. Rumus senyawa yang terbentuk adalah ....
a. XY b. X2Y
c. XY2
d. XY3
e. XY4
5. Konfigurasi elektron suatu unsur yang terletak pada golongan VI B dan periode 4 adalah ....
a. [Ar] 4s2 3d4
b. [Ar] 4s1 3d5
c. [Kr] 4s2 4p4
d. [Kr] 5s2 4d6
e. [Kr] 5s2 4d4
Data berikut untuk menjawab soal no 1 dan 2
atom
X 8 8 8
Y 11 11 12
Z 13 13 14
1. Berdasarkan data tersebut maka muatan ion untuk unsur Z yang tepat adalah ....
2. Harga keempat bilangan kuantum dari electron terakhir yang mungkin dari atom Y adalah… .
3. Berikut ini data sifat fisik dua buah unsure yang tidak dikenal :
Unsur Titik leleh Titik didih keelektronega
tifan
Q -219,62 -188,14 besar
R 180,54 1347 kecil
Dari data tersebut, jenis ikatan yang terjadi antara unsur Q dan R adalah… .
4. Perhatikan konfigurasi elektron unsur di bawah ini : X : 1s22s22p4
Y : 1s22s22p63s23P1
Rumus senyawa dan jenis ikatan yang terbentuk antara unsur X dan Y adalah...
2. 10 elektron dan 12 netron 3. 15 proton dan 16 netron 4. 20 netron dan 19 proton 5. 12 proton dan 12 netron
Yang memiliki sifat mirip dalam sistem periodik adalah ...
A.1 dan 2
B.2 dan 3
C.2 dan 4
D.3 dan 4
E.1 dan 5
2. Berdasarkan tabel berikut :
Molekul PH3 memiliki titik didih terendah. Penyebabnya adalah ...
A.Mr terkecil
B.Molekulnya kecil
C.Terdapatnya ikatan hydrogen
D.Terdapatnya ikatan gaya London
E.Terdapatnya ikatan gaya van der walls
1. Di antara unsur-unsur 12 P, 16 Q, 19 R, 34 S dan 53 T yang terletak pada golongan yang sama dalam sistem periodik unsur adalah ... A. P dan Q
B. P dan R C. S dan T D.Q dan S E. R dan T
2. Unsur B, N, F dan H masing-masing mempunyai elektron valensi 3, 5, 7 dan 1. Antara unsur-unsur ini dapat terbentuk senyawa BF3NH3. Ikatan
apakah yang terdapat dalam senyawa tersebut ... A. heteropolar dan homopolar
B. heteropolar dan kovalen koordinasi C. homopolar dan kovalen koordinasi D. heteropolar
E. kovalen koordinasi
3. Nomor atom unsur X sama dengan 27. Jumlah elektron tidak berpasangan dalam ion X2+ adalah
1. Isotop terdiri dari ...
A. 13 proton, 14 elektron dan 27 neutron B. 13 proton, 13 elektron dan 27 neutron C. 13 proton, 13 elektron dan 14 neutron D. 14 proton, 14 elektron dan 13 neutron E. 27 proton, 27 elektron dan 14 neutron
2. Konfigurasi elektron dari unsur X adalah 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6
5s2 4d10 5p3. Unsur tersebut terletak pada ...
A. golongan IIIA perioda 5 B. golongan VA perioda 5 C. golongan VA perioda 3 D. golongan IIIA perioda 4 E. golongan VIA perioda 5
3. Diketahui keelektronegatifan H = 2,1; Cl = 3,5; F = 4,0; Br = 2,8. Senyawa yang paling polar di bawah ini adalah ...
A. HCl B. HF C. ClF D. BrF E. BrCl
1. Diagram orbital yang paling tepat untuk elektron terakhir dari unsur X adalah ...
(Nomor atom Ar = 18, Kr = 36, Ne = 10) A. [Kr]
B. [Ar]
C. [Ne]
D. [Ne]
E. [Ne]
2. Unsur Y dalam sistem periodik terletak pada ... A. golongan IVB, periode 5
B. golongan VIIIB, periode 4
C. golongan IVA, periode 3
4. Perhatikan data hasil percobaan berikut ini:
No Sifat Fisik Zat A Zat B ikatan yang terdapat pada zat A dan zat B berturut-turut adalah ... a. ionik dan kovalen non polar
b. kovalen dan polar dan ionik c. kovalen non polar dan ionik d. kovalen koordinasi dan logam e. hidrogen da kovalen
1. Unsur dengan nomor massa 45 dan mempunyai jumlah netron 24 melepaskan 3 elektron, konfigurasi elektronnya adalah ….
A. 1s2 2s2 2p6 3s2 3p6 4s2 3d1
B. 1s2 2s2 2p6 3s2 3p6 4s1 3d5
C. 1s2 2s2 2p6 3s2 3p6 4s2 3d4
D. 1s2 2s2 2p6 3s2 3p6 4s0 3d0
E. 1s2 2s2 2p6 3s2 3p6 4s2 3d7
2. Kelompok unsur/ion berikut yang mempunyai konfigurasi elektron yang sama adalah ....
A. 12Mg
Yang mempunyai ikatan ion dan kovalen dalam senyawa tersebut adalah ....
Diketahui 2 buah unsur berikut nomor atom dan massanya: 1. Konfigurasi elektron dari unsur X tersebut adalah ....
A. [He] 1S2 2S2 2P2
B. [He] 2S2 2P4
C. [Ne] 3S2 3P4
D. [Kr] 5S2 4d1
E. [Ar] 4S1
2. Unsur Y dalam sistem periodik terletak pada golongan .... , periode .... A. IA, 4
B. IIA, 4 C. VIA, 2 D. VIA, 3 E. IIIB, 5
B. Henri Becquerel C. J. Chadwick D. R.A.Millikan E. Rutherford
2. Unsur-unsur dalam sistem periodik modern disusun berdasarkan …….. A. kenaikan massa atom dan kemiripan sifat
B. kenaikan jumlah proton dan kemiripan sifat C. kenaikan jumlah proton dan neutron
D. kenaikan titik leleh dan titik didih E. sifat kimia dan sifat fisis
3. Unsur X dengan nomor atom 12 dan unsur Y dengan nomor atom 17 akan membentuk senyawa dengan rumus dan jenis ikatan ....
A. X7Y2 ; ikatan ion
B. XY2 : ikatan ion
C. XY2 : ikatan kovalen0020
D. X2Y : ikatan ion
E. X2Y5 : ikatan kovalen
1. iketahui ion X3+ mempunyai 10 elektron dan 14 neutron. Nomor unsur
X adalah … a. 7 b. 14 c. 10 d. 27 e. 13
2. Konfigurasi elektron dari unsur dengan nomor atom 24 adalah … A. (Ar) 3d4 4s2
B. (Ar) 3d3 4s1 4p2
C. (Ar) 3d5 4s1
D. (Ar) 3d4 4p2
E. Ar) 3d3 4s2 4p1
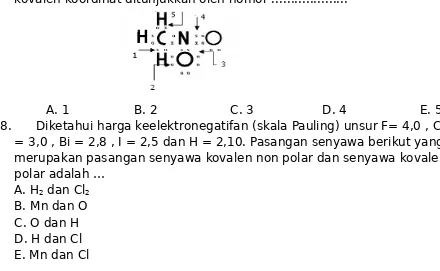
3. Gambar di bawah menyatakan rumus lewis dari CH3NO2. Ikatan kovalen
koordinat ditunjukkan oleh nomor ...
01. Elektron ditemukan oleh ……….
A. J.J. Thomson D. Henri Becquerel
B. J. Chadwick E. R.A.Millikan
C. E. Rutherford
02. Unsur-unsur dalam sistem periodik modern disusun berdasarkan …….. A. kenaikan massa atom dan kemiripan sifat
B. kenaikan jumlah proton dan kemiripan sifat C. kenaikan jumlah proton dan neutron
D. kenaikan titik leleh dan titik didih E. sifat kimia dan sifat fisis
03. Unsur X dengan nomor atom 12 dan unsur Y dengan nomor atom 17 akan membentuk senyawa dengan rumus dan jenis ikatan .... A. X7Y2 ; ikatan ion
B. XY2 : ikatan kovalen
C. X2Y5 : ikatan kovalen
D. XY2 : ikatan ion
E. X2Y : ikatan ion
01. Isotop 13
27Al
terdiri dari ....
A. 13 proton,14 elektron dan 27 neutron B. 13 proton,13 elektron dan 27 neutron C. 13 proton,13 elektron dan 14 neutron D. 14 proton, 14 elektron dan 13 neutron
E. 27 proton, 27 elektron dan 14 neutron
02. Kelompok-kelompok unsur berikut merupakan unsur segolongan, kecuali …..
A. Be, Mg dan Ca B. Li, Na dan K C. He, Ar dan Kr D. F, Cl dan Br
E. Be, C dan N
03. Empat unsur A, B, C, D masing-masing mempunyai nomor atom 16, 17, 18, 19. Pasangan yang dapat membentuk ikatan ion adalah …
A. A dan B
B. A dan C
C. B dan D
D. B dan C
01. Konfigurasi electron dari unsur 31
70Ga
adalah ………. A. 2 8 18 2 1
B. 2 8 18 3 C. 2 8 10 8 3
D. 2 18 18 8 3
E. 2 18 32 18
02. Diketahui unsur X dengan nomor massa 35. Unsur tersebut mempunyai 18 neutron dalam intinya,maka unsur tersebut dalam sistem periodik terletak pada ...
A. golongan VIIA/ periode ke-3 B. golongan VIIIA/ periode ke-3 C. golongan VIIA/ periode ke-4 D. golongan IVA/ periode ke-4 E. golongan IIIA/ periode ke-7
03. Diantara senyawa berikut ini yang merupakan senyawa yang berikatan kovalen adalah …
A. NaCl, KI, Mg(OH)2
B. ZnSO4, HgO, CH3COOH
C. Cl2, CaO, O3
D. H2O, HCl, LiOH
E. H3PO4, CH3OH, CO2
3. Berdasarkan tabel berikut :
Urutan unsur-unsur tersebut dalam suatu perioda dari kiri ke kanan adalah ...
A. T, Q, R, S dan P
B. T, R, Q, P dan S
C. T, P, Q, R dan S
D. T, S, Q, R dan P
E. T, Q, S, R dan P
4. Berdasarkan gambar berikut :
A. 1
B. 2
C. 3
D. 4
E. 5
5. Berdasarkan tabel berikut :
Senyawa yang paling polar di bawah ini adalah ...
A. CO2
B. ClO
C. CH4
D. HCl
E. PH3
1. Diketahui nomor atom unsur karbon, oksigen, natrium, belerang dan kalsium berturut-turut adalah 6, 8, 11, 16 dan 20. Unsur yang mempunyai jumlah elektron valensi paling sedikit adalah . . . .
A. karbon B. oksigen C. natrium D.belerang E. kalsium
2. Konfigurasi elektron unsur X: (Ar) 3d3 4s2
Dalam sistem periodik, unsur X tersebut terletak pada periode dan golongan . . .
A. 3 dan IIA
B. 3 dan IIIB
C. 4 dan IIA
D. 4 dan IIIB
E. 4 dan VB
Ikatan kovalen dapat terbentuk antara pasangan unsur . . . .
A. P dengan R
B. P dengan S
C. S dengan Q
D. S dengan T
E. P dengan S
4. Diketahui nomor atom unsur F = 9 dan I = 53. Maka geometri dan kepolaran molekul IF3 adalah . .
A. segi tiga sama sisi, non polar
B. tetrahedron, non polar
C. planar bentuk T, polar
D. piramida trigonal, polar
E. bipiramida trigonal, non polar
1. Elektron ditemukan oleh ……….
A. J.J. Thomson D. Henri Becquerel B. J. Chadwick E. R.A.Millikan C. E. Rutherford
2. Isotop 27 Al terdiri dari ………
13
A. 13 proton,14 elektron dan 27 neutron D. 14 proton, 14 elektron dan 13 neutron
B. 13 proton,13 elektron dan 27 neutron E. 27 proton, 27 elektron dan 14 neutron
C. 13 proton,13 elektron dan 14 neutron
3. Konfigurasi electron dari unsur 70 Ga adalah ……….
31
4. Unsur Boron mempunyai 2 isotop, yaitu 10B dan 11B. Jika isotop 11B =
81%, massa atom relatif Boron adalah …………..
A. 9,8 D. 10,81 B. 10 E. 11 C. 10,25
5. Diantara unsure-unsur 12 A, 14 B, 15 C, 18 D dan 14 E yang
merupakan pasangan isotop adalah 6 7 7 8 6
A. A dan B D. D dan E B. B dan C E. A dan C C. C dan D
6. Diketahui ion X3+ mempunyai 10 elektron dan 14 neutron. Nomor unsur
X adalah …
A. 7 D. 14 B. 10 E. 27 C. 13
7. Jika diketahui massa rata-rata 1 atom unsur X adalah x gram dan massa 1 atom C-12 adalah p gram, maka massa atom relatif unsur X adalah …………..
A. 12 x D. px
p 12 B. 12 p E. p
x 12x
C. 12px
SISTEM PERIODIK
1. Unsur-unsur dalam sistem periodik modern disusun berdasarkan …….. A. kenaikan massa atom dan kemiripan sifat
B. kenaikan jumlah proton dan kemiripan sifat C. kenaikan jumlah proton dan neutron
D. kenaikan titik leleh dan titik didih E. sifat kimia dan sifat fisis
2. Kelompok-kelompok unsur berikut merupakan unsur segolongan, kecuali …..
3. Diketahui unsur X dengan nomor massa 35. Unsur tersebut mempunyai 18 neutron dalam intinya,maka unsur tersebut dalam sistem periodik terletak pada ...
A. golongan VIIA/ periode ke-3 D. golongan IVA/ periode ke-4 B. golongan VIIIA/ periode ke-3 E. golongan IIIA/ periode ke-7 C. golongan VIIA/ periode ke-4
4. Jika jari-jari atom unsur Li, Na, K, Be dan B secara acak (tidak berurutan) dalam angstrong adalah: 2,01; 1,23; 1,57; 0,80; dan 0,89, maka jari-jari atom Na adalah ….
A. 2,03 D. 0,89 B. 1,57 E. 0,80 C. 1,23
5. Dalam sistem periodik unsur-unsur mempunyai sifat-sifat A. dalam satu golongan mempunyai kemiripan sifat
B. mempunyai elektronvalensi sesuai dengan golongannya C. ke kanan, energi ionisasi cenderung menaik
D. dalam perioda dari kiri ke kanan, jari-jari atom semakin besar E. afinitas elektron ke kanan semakin besar
6. Nomor atom unsur-unsur P. Q, R dan S berturut-turutadalah 20, 19, 18 dan 12. Unsur-unsur yang terletak pada golongan yang sama adalah … A. P dan Q
B. Q dan R C. R dan S D. P dan S E. Q dan S
7. Data sifat periodik unsur sebagai berikut
Berdasarkan data di atas urutan keempat unsur dalam satu golongan adalah …
IKATAN KIMIA
1. Unsur X dengan nomor atom 12 dan unsur Y dengan nomor atom 17 akan membentuk senyawa dengan
rumus dan jenis ikatan .... A. X7Y2 ; ikatan ion
B. XY2 : ikatan kovalen
C. X2Y5 : ikatan kovalen
D. XY2 : ikatan ion
E. X2Y : ikatan ion
2. Empat unsur A, B, C, D masing-masing mempunyai nomor atom 16, 17, 18, 19. Pasangan yang dapat membentuk ikatan ion adalah …
A. A dan B B. A dan C C. B dan D D. B dan C E. C dan D
3. Manakah diantara spesi berikut yang konfigurasi elektronnya tidak sama dengan neon?
A.Na+ B. Mg2+ C. F- D. O2-
E. S
2-4. Diantara kelompok senyawa berikut ini yang hanya berikatan kovalen adalah
A. KCl dan CCl4 D. CH4 dan H2O
B. NH3 dan KNO3 E. Ba(OH)2 dan HBr
C. NaCl dan H2O
5. Diantara sifat berikut ini yang bukan sifat senyawa ion adalah …… A. rapuh
B. titik leleh tinggi
C. larutannya dapat menghantar listrik D.lelehannya dapat menghantar listrik E. padatannya dapat menghantar listrik
6. Diantara senyawa berikut yang tidak memenuhi kaidah oktet adalah …….
A. BF3 D. SF2
B. NH3 E. NaCl
7. Gambar di bawah menyatakan rumus lewis dari CH3NO2. Ikatan
kovalen koordinat ditunjukkan oleh nomor ...
A. 1 B. 2 C. 3 D. 4 E. 5 8. Diketahui harga keelektronegatifan (skala Pauling) unsur F= 4,0 , Cl
= 3,0 , Bi = 2,8 , I = 2,5 dan H = 2,10. Pasangan senyawa berikut yang merupakan pasangan senyawa kovalen non polar dan senyawa kovalen polar adalah …
A. H2 dan Cl2