SOAL-SOAL TENTANG IKATAN KIMIA DAN JAWABANNYA
1. Pasangan senyawa di bawah ini yang merupakan senyawa ion adalah …
a. NaCl dan KBr
b. CH4 dan NH3
c. SO2 dan HCl
d. H2O dan KBr
e. KCl dan HCl
Jawab: a
Syarat ikatan ion: golongan I A / II A berikatan dengan VI A / VII A Na dan K golongan I A
Cl dan Br golongan VII A
2. Nomor atom unsur P, Q, R dan S adalah 6, 9, 11, dan 18. Pasangan unsur-unsur yang diharapkan dapat membentuk ikatan ion adalah …
a. P dan Q
b. R dan Q
c. Q dan S
d. S dan R
e. P dan S
Jawab: b.
6P = 2 4 Golongan IV A
9Q = 2 7 Golongan VII A
11R = 2 8 1 Golongan I A
18S = 2 8 8 Golongnan VIII A
3. Suatu senyawa dengan rumus molekul XY. Jika konfgurasi elektron atom X: 1s2 2s2 2p6 3s2 dan konfgurasi elektron atom Y: 1s2 2s2 2p4,
maka XY mempunyai ikatan …
a. Kovalen polar
b. Kovalen non polar
c. Kovalen koordinasi
d. Elektrovalen
e. Logam
Jawab: d
X : 3s2 Golongan II A Ikatan ion / elektrovalen
Y : 2p4 2s2 Golongan VI A Ikatan ion / elektrovalen
4. Pasangan unsur yang membentuk ikatan kovalen adalah …
a. 17X dan 11Y
b. 12P dan 17Q
c. 6R dan 17Q
d. 20M dan 16T
e. 19A dan 35B
Jawab: c
Syarat ikatan kovalen: golongan IV A, V A, VI A, VII A, dan H
17X : 2 8 7 dan 11Y : 2 8 1 ikatan ion
12P : 2 8 2 dan 17Q : 2 8 7 ikatan ion
6R : 2 4 dan 17Q : 2 8 7 ikatan kovalen
20M : 2 8 8 2 dan 16T : 2 8 6 ikatan ion
5. Deretan senyawa berikut ini tergolong senyawa kovalen, kecuali …
a. HF, HCl, HI
b. BH3, BF3 CO2
c. H2O, NH3, CO2
d. Li2O, CaO, MgO
e. IF5, CCl4, CF4
Jawab: d
Syarat ikatan kovalen: golongan IV A, V A, VI A, VII A, dan H Pilihan D : terdapat Ca dan Mg Golongan II A
6. Di antara senyawa berikut yang bukan molekul kovalen polar adalah …
a. HCl
b. NaCl
c. NH3
d. H2O
e. PCl3
Jawab : b
Molekul Penyusun Keterangan Ikatan
HCl Gas – Gas 2 atom tidak
golongan V A PEB = 5 – 3 = 2
H2O Gas – Gas PEI = 2 O golongan VI A PEB = 6 – 2 = 4
Kovalen polar
PCl3 Gas – Gas PEI = 3 P golongan V A PEB = 5 – 3 = 2
Kovalen polar
7. Di antara senyawa berikut yang paling polar adalah …
a. HF
b. HCl
c. F2
d. HBr
e. HI
Jawab: a
Paling polar → beda keelektronegatifan besar
HF → golongan I A dan VII A maka elektronegativitasnya besar
8. Di antara senyawa-senyawa berikut, yang dapat membentuk ikatan hidrogen adalah …
(1) HF (2) NH3
(3) H2O
(4) HCl
a. (1), (2) dan (3)
b. (2) dan (3)
d. (1), (2) dan (4)
e. (1), (2), (3) dan (4)
Jawab: a
Syarat ikatan hidrogen: H berikatan langsung dengan N, F, atau O. Pilihan (1), (2) dan (3) benar.
9. Titik didih HF lebih tinggi daripada HCl. Hal ini disebabkan karena antara molekul-molekul HF terdapat ikatan …
a. kovalen
b. ion
c. hidrogen
d. van der waals
e. kovalen koordinat
Jawab: c
HF → H berikatan langsung dengan F, artinya ikatan hidrogen Ikatan hidrogen membuat senyawa mempunyai titik didih tinggi.
10. Diketahui nomor atom H = 1; C=6; N = 7; O = 8; P=15; dan Cl =17. Senyawa berikutmengikuti aturan octet, kecuali …
a. CHCl3
b. NH3
c. H2O
d. CH4
e. PCl5
Jawab : e.
Teori octet menyatakan bahwa disekitar atom pusat terdapat 4 pasang electron ikatan
( 8 elektron), sedangkan pada PCl¬5, atom pusatnya P terdapat 5
11. Unsur X mempunyai nomor atom 20. Senyawa garamnya bila dipanaskan akan menghasilkan
gas yang dapat mengeruhkan air barit. Rumus senyawa tersebut adalah …
a. X2SO4 b. XSO4 c. X2CO3 d. XCO3 e. XCl2
Jawab : d
Unsur X yang mempunyai nomor atom 20, berarti unsur Ca. Senyawa yang dipanaskan dan menghasilkan gas adalah CaCO3. Reaksinya : CaCO3(s) → CaO(s) + CO2(g)
CO2(g) + Ba(OH)2(aq) → BaCO3(s) + H2O(l)
Air barit (barium hidroksida)
12. Senyawa manakah yang tidak membentuk ikatan hidrogen antar molekulnya ?
a. CH3CHO b. CH3NH2 c. CH3OH d. NH3 e. NH4OH
Jawab : a
Ikatan hidrogen antar molekul terdapat pada molekul-molekul yang mempunyai atom hidrogen yang terikat pada atom N, O atau F. Pada molekul CH3CHO, atom H tidak terikat pada atom O.
H
H-C-C-H H
13. Unsur X mempunyai konfgurasi elektron 2. 8. 6. Unsur tersebut akan membentuk ion . . . .
a. X
3-b. X
-d. X+
e. X2+
Jawab : b
Elektron Valensinya 6, sehingga untuk mencapai kestabilan unsur X akan menerima 2 elektron dan membentuk ion negatif.
14. Jika unsur A memiliki nomor atom 8 dan nomor massa 18, struktur dari A2- terdiri atas . . . .
a. 10 elektron, 8 proton, 8 neutron b. 10 elektron, 8 proton, 10 neutron c. 8 elektron, 8 proton, 10 neutron d. 8 elektron, 8 proton, 18 neutron e. 6 elektron, 8 proton, 10 neutron
Jawab : b
Jika unsur A memiliki nomor atom 8 maka elektron valensinya adalah 6 sehingga menerima 2 elektron dan jumlah elektronnya menjadi 10. Nomor atomnya 8 sehingga mempunyai 8 proton. Jumlah neutron sama dengan nomor massa dikurangi proton, 18 – 8 = 10 neutron.
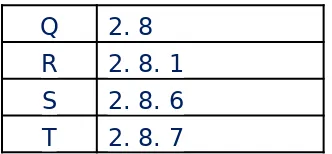
15. Cermati tabel berikut ! Unsur Konfgurasi
Q 2. 8 R 2. 8. 1 S 2. 8. 6 T 2. 8. 7
Tabel diatas menunjukan konfgurasi elektron unsur P, Q, R, S dan T. Unsur yang paling mudah menangkap 1 elektron adalah . . . .
a. P b. Q c. R d. S e. T
Jawab : e
Unsur T mempunyai elektron valensi 7. Sehingga paling mudah menangkap 1 elektron untuk mencapai kestabilan agar elektron valensinya menjadi 8.
16. Kr yang mempunyai nomor atom 36 termasuk golongan gas mulia. Hal ini ditunjukan oleh . . . .
a. Keelektronegatifan Kr besar
b. Mudahnya bereaksi dengan unsur lain c. Membentuk ikatan ion
d. Elektron valensinya 8 e. Termasuk golongan VII A
Jawab : d
Golongan gas mulia atau golongan VIII A, unsur-unsurnya
mempunyai elektron valensi 8. Nomor atom Kr adalah 36. Sehingga konfgurasi elektronnya 2. 8. 18. 8
17. Diantara unsur-unsur berikut ini yang cenderung melepas 2 elektron adalah . . . .
a. 9F
b. 12Mg
d. 17Cl
e. 18Ar
Jawab : b
Konfgurasi elektron dari 12Mg adalah 2. 8. 2. Sehingga untuk
mencapai kestabilan, unsur tersebut akan melepas 2 elektron.
18. Atom 15P akan mencapai kestabilan dengan cara . . . .
a. Menangkap 1 elektron b. Melepas 2 elektron c. Menangkap 2 elektron d. Melepas 3 elektron e. Menangkap 3 elektron
Jawab : e
15P konfgurasi elektronnya adalah 2. 8. 5. Sehingga untuk
mencapai kestabilan unsur tersebut menangkap 3 elektron agar elektron valensinya 8.
19. Atom berikut ini yang mencapai kestabilan dengan mengikuti kaidah duplet adalah . . . .
a. Litium b. Natrium c. Magnesium d. Aluminium e. Klor
Jawab : a
20. Unsur Y mempunyai konfgurasi elektron 2. 8. 2. Unsur ini lebih mudah membentuk ikatan ion dengan unsur lain yang mempunyai konfgurasi elektron
. . . .
a. 2. 8. 1 b. 2. 8. 4 c. 2. 8. 5 d. 2. 8. 6 e. 2. 8. 7
Jawab : d
Unsur Y memiliki elekron valensi 2. Unsur ini lebih mudah membentuk ikatan ion dengan unsur lain yang mempunyai konfgurasi elektron 2. 8. 6
Dengan elekron valensi 6.
1. Susunan elektron valensi gas mulia di bawah ini adalah oktet, kecuali ….
A. Ar B. Ne C. Kr D. Xe E. He
Jawaban : E (He), karena He mempunyai 2 elektron valensi. Sedangkan Ne Ar Kr Xe Rn mempunyai 8 elektron valensi (memenuhi kaidah octet).
2. Unsur dengan konfgurasi elektron: 2, 8, 8, 2, jika akan mengikat unsur lain untuk membentuk senyawa, maka langkah terbaik dengan … .
Jawaban : B (melepaskan 2 e sehingga muatannya menjadi 2+) pelepasan elektron terjadi untuk mecapai kestabilab (kaidah octet).
3. Suatu unsur dengan konfgurasi elektron: 2, 6. Kecenderungan unsur tersebut bila akan berikatan dengan unsur lain adalah … .
A. Pelepasan 2 elektron, sehingga bermuatan 2+ B. Pelepasan 4 elektron, sehingga bermuatan 4+ C. Penyerapan 2 elektron, sehingga bermuatan 2– D. Penyerapan 4 elektron, sehingga bermuatan 4– E. Memasangkan 6 elektron
Jawaban : C (penyerapan/mengikat 2 e sehingga muatannya menjadi 2-, pengikatan elektron dilakukan agar memperoleh kestabilan)
Baca Juga : Rangkuman Materi Stoikiometri Kelas X
4. Nomor atom unsur P, Q, R dan S adalah 6, 9, 11, 18. Pasangan unsur-unsur yang dapat membentuk ikatan ionic adalah…
A. P dan Q B. R dan Q C. Q dan S D. S dan R E. P dan S
Jawaban :
P = atom karbon (non logam) golongan IV A
Q= atom for (non logam) golongan VII A
R= atom natrium (logam) golongan IA
S= atom argon (non logam) golongan VIII A Yang dapat membentuk ikatan ionic adalah unsure logam dan non logam dari golongan IA dan VII A. jawabannya adalah B
5. Kulit terluar atom pusat suatu molekul mempunyai 6 pasang elektron yang terdiri dari 4 pasang elektron terikat dan 2 pasang elektron bebas. Bentuk molekilnya adalah..
B. Tetrahedron C. Segitiga planar D. Linier
E. Trigonal bipiramida
Jawaban : A (bentuk molekulnya octahedron)
6. Pasangan senyawa berikut yang keduanya berikatan ionik adalah… A. HF dan HCl
B. NaBr dan K2O C. FeCl2 dan H2O D. C2H4 dan CaC2 E. CO2 dan N2O4
Jawaban : B (NaBr dan K2O, karena yang berikatan adalah logam dan non logam)
7. Deret senyawa berikut ini tergolong senyawa kovalen, kecuali… A. HF, HCl, HI
B. BH3, BF3, CO¬2 C. H2O, NH3, CO2 D. Li2O, CaO, MgO E. IF5, CCl4, ClF3.
Jawaban : D (ikatan antara logam dan non logam)
8. Zat yang bersifat polar adalah… A. BCl3
B. H¬2O C. CCl¬4 D. PCl5 E. CHCl3
Jawaban : B (yang mempunyai ikatan kovalen polar adalah H2O).
9. Diketahui nomor atom H=1, C=6, N=7, O=8, P=15 dan Cl=17, senyawa berikut yang mengikuti aturan octet kecuali..
A. CHCl3 B. NH3 C. H2O D. CH4 E. PCl5
10. Diketahui senyawa dibawah ini,
senyawa manakah yang dapat membenttuk ikatan hidrogen antarmolekul…. A. 1,3 dan 5
11. Atom X mempunyai konfgurasi electron 1s2 2s2 2p6 3s2 . senyawa yang mungkin dibentuk oleh atom X adalah..
A. HX B. HCl C. CaX D. XSO4 E. X2(PO4¬)3
Jawaban : D ( atom X akan melepaskan 2 e untuk mencapai kestabilan sehingga muatannya menjadi 2+, jadi atom X dapat berikatan dengan melekul SO4, karena SO4 memerlukan 2 e)
12. Molekul unsur berikut yang mempunyai ikatan kovalen rangkap tiga
Jawaban : E (atom N2 dapat membentuk ikatan kovalen rangkap 3)
13. Kelompok senyawa berikut ini yang seluruhnya berikatan ion adalah … . A. CaCl2, CaO, H2O, dan N2O
E. KCl, CaO, NaCl, dan MgCl2
Jawaban : E (karena yang berikatan adalah logam dan non-logam)
14. Senyawa berikut mempunyai ikatan kovalen tunggal, kecuali … . A. H2O (nomor atom H = 1 dan O = 8 )
B. HCl (nomor atom H = 1 dan Cl = 17) C. NH3 (nomor atom N = 7 dan H = 1) D. CH4 (nomor atom C = 6 dan H = 1) E. CO2 (nomor atom C = 6 dan O = 8)
Jawaban : CO2 mempunyai ikatan kovalen rangkap 2. Jawaban yang benar adalah E
15. Senyawa yang mempunyai ikatan kovalen, ikatan ion dan ikatan kovalen koordinat secara bersamaan adalah…
Jawaban : D ( pada senyawa NH4Cl terdapat ikatan kovalen dan ionic)
16. Perhatikan data hasil percobaan berikut ini, Sifat fsik Zat A Zat B
Wujud zat Padat Padat
Kelarutan dalam air Larut Tidak larut
Daya hantar listrik larutan Konduktor Isolator Titik leleh dan titik didih Tinggi Rendah
Berdasarkan data tersebut, maka dapat disimpulkan bahwa jenis ikatan yang terdapat pada zat A dan zat B berturut-turut adalah….
A. Ionic dan kovalen nonpolar B. Kovalen polar dan ionic C. Kovalen nonpolar dan ionic D. Kovalen koordinasi dan logam E. Hydrogen dan kovalen.
Jawaban : A (ionic dan kovalen non-polar, dilihat dari data table)
17. Zat yang bersifat polar adalah… A. CH4
D. CO2 E. PCl5
Jawaban : C (yang bersifat kovalen polar adalah NH3)
18. Senyawa yang dapat larut dalam air adalah.. A. NaCl
B. CCl4 C. HCl D. NH3 E. Cl
Jawaban : senyawa ionic yang mudah larut dalam air adalah senyawa NaCl. Jawaban yang benar adalah A.
19. Kelompok senyawa yang memiliki ikatan hydrogen adalah… A. H2O, H2S dan HCl
B. H2O, PH3, dan HBr C. NH3, H2O, dan HBr D. NH3, H2S, dam HF E. HF, NH3 dan H2O
Jawaban : E
20. Etanol (CH3CH2OH) dan dimetil eter (CH3-O-CH3) mempunyai massa molekul relative (Mr) sama yaitu 46. Pernyataan berikut yang benar adalah… A. Titik didih etanol lebih tinggi karena terdapat ikatan hydrogen
B. Titik didih dimetil eter lebih tinggi karena terdapat ikatan hydrogen C. Titik didih etanol sama dengan titik didih dimetil eter
D. Titik didih etanol lebih tinggi karena terdapat gaya London
E. Titik didih dimetil eter lebih itnggi karena terdapat gaya London.