IKATAN KIMIA
1. Pada molekul CH4 terdapat ikatan kovalen
SEBAB
paa tiap molekul CH4 terdapat 4 atom hidrogen Jawaban : B
SMU/Ebtanas/Kimia/Tahun 1988
Penyelesaian :
Ikatan Kovalen adalah ikatan kimia yang terjadi karena penggunaan elektron secara bersama.
6C 2 ) 4 1H 1
2. Berikut adalah rumus elektron nitrometana yang disederhanakan. Huruf yang menunjukkan pasangan elektron yang membentuk ikatan kovalen koordinat ialah ….
A. P B. Q C. R D. S E. T Jawaban : B SMU/Ebtanas/Kimia/Tahun 1989 Penyelesaian : 7N : 1s² 2s² 2p³ 8O : 1s² 2s² 2p4 6C : 1s2 2s2 2p2 1H : 1s1
Ikatan kovalen koordinat adalah ikatan dimana elektron-elektron yang dipakai bersama-sama hanya berasal dari satu atom.
3. Senyawa NI3 mempunyai 3 pasangan elektron yang terikat dan
1 pasangan elektron bebas. Bentuk geometri molekul tersebut adalah ….
A. piramida segitiga D. segitiga datar B. piramida bujur sangkar E. segi empat datar C. oktahedron Jawaban : D SMU/Ebtanas/Kimia/Tahun 1989 Penyelesaian : 7N = 1s² 2s² 2p³ 53I = 1s² 2s² 2p6 3s² 3p6 4s² 3d10 4p6 5s² 4d10 5p5 atau Kr = 4d10 5s² 5p5
4. Kelompok senyawa yang masing-masing mempunyai ikatan ion adalah ….
A. SO2, NO2 dan CO2 D. NH3, H2O dan SO3
B. KOH, HCN dan H2S E. HCl, NaI dan CH4
C. NaCl, MgBr2 dan K2O Jawaban : C
SMU/Ebtanas/Kimia/Tahun 1990
Penyelesaian :
Ikatan ion : terjadi antara : - ion+dan ion
-- Golongan IA, IIA (logam) dengan VIA, VIIA (bukan logam) - Unsur-unsur dengan potensial ionisasi kecil
- Unsur-unsur dengan keelektronegatifan besar
Unsur-unsur yang berikatan ion adalah NaCl, MgBr2, K2O
5. Gambar rumus elektron dari senyawa NH4Cl sebagai berikut :
Ikatan kovalen pada gambar di atas ditunjukkan oleh …. A. (1) dan (3) D. (4) dan (2) B. (2) dan (5) E. (5) dan (1) C. (3) dan (4) Jawaban : E SMU/Ebtanas/Kimia/Tahun 1990 Penyelesaian :
6. Pasangan senyawa di bawah ini, manakah yang kedua-duanya mempunyai ikatan hidrogen ….
A. HF dan HI D. HBr dan H2O B. HCl dan HBr E. NH3 dan HI C. HF dan H2O Jawaban : C SMU/Ebtanas/Kimia/Tahun 1990 Penyelesaian :
Ikatan Hidrogen adalah ikatan antara Hidrogen dengan unsur F, O, N
7. Bentuk hibrida beberapa senyawa :
Dari data tersebut yang merupakan pasangan tepat adalah …. A. 1 B. 2 C. 3 D. 4 E. 5
Jawaban : B
SMU/Ebtanas/Kimia/Tahun 1990
Penyelesaian : a. CH4 6C 2) 4)
b. HCl
8. Struktur kristal logam natrium adalah kubus berpusat badan, ditunjukkan oleh gambar . . .
A. 1 B. 2 C. 3 D. 4 E. 5
Jawaban : C
SMU/Ebtanas/Kimia/Tahun 1990
Penyelesaian :
Struktur kristal logam natrium adalah kubus berpusat badan gambarnya adalah no. 3
9. Berikut ini merupakan gambar bentuk orbital d :
Yang merupakan gambar bentuk orbital dxy adalah …. A. 1 B. 2 C. 3 D. 4 E. 5 Jawaban : D SMU/Ebtanas/Kimia/Tahun 1991 Penyelesaian : Gambar 1 dyz Gambar 2 dxz Gambar 3 dyz Gambar 4 dxy Gambar 5 dz
10. Keelektronegatifan unsur-unsur sebagai berikut :
Berdasarkan data tersebut di atas dapat ditafsirkan bahwa ikatan ion paling lemah adalah ….
A. BeCl2 D. SrCl2 B. MgCl2 E. BaCl2 C. CaCl2 Jawaban : A SMU/Ebtanas/Kimia/Tahun 1991 Penyelesaian :
Ikatan ion terjadi pada : - ion (+) dan ion (-)
- unsur elektron (+) dengan unsur elektron (-) - golongan IA, IIA dengan logam (VIA, VIIA)
- antara atom yang mempunyai potensial ionisasi rendah, - afinitas elektron tinggi
- mempunyai perbedaan keelektronegatifan tinggi - Cl - Be :
11. Berikut ini data titik didih dari beberapa senyawa hidrogen :
Diantara senyawa-senyawa di atas yang mempunyai ikatan hidrogen paling kuat ialah ….
A. HCN D. HBr B. HI E. HCl C. HF Jawaban : A SMU/Ebtanas/Kimia/Tahun 1991 Penyelesaian :
Senyawa di dalam ikatan Hidrogen yang paling kuat adalah mempunyai titik didih tinggi yaitu HCN.
12. Unsur Xe dengan nomor atom 54 dan unsur F dengan nomor atom 9 pembentuk senyawa XeF4. Yang bentuk molekulnya
adalah ….
A. linier D. tetra hedron
B. segitiga datar E. bujur sangkar C. okta hedron
Jawaban : B
SMU/Ebtanas/Kimia/Tahun 1991
Penyelesaian :
54Xe (Kr) 4d10. 5s² , 5p6, 5s², 5p6, 5d, ...
Sebelum mengadakan ikatan kovalen dengan atom F 13. Banyaknya pasangan elektron terikat dan pasangan elektron bebas suatu senyawa 3 dan 1. Bentuk molekul senyawa itu adalah ….
A. segitiga planar D. tetrahedron B. piramida segitiga E. segiempat datar C. bentuk V
Jawaban : A
SMU/Ebtanas/Kimia/Tahun 1991
Penyelesaian :
Bentuk molekul dari senyawa yang mempunyai pasangan elektron terikat 3 dan pasangan elektron
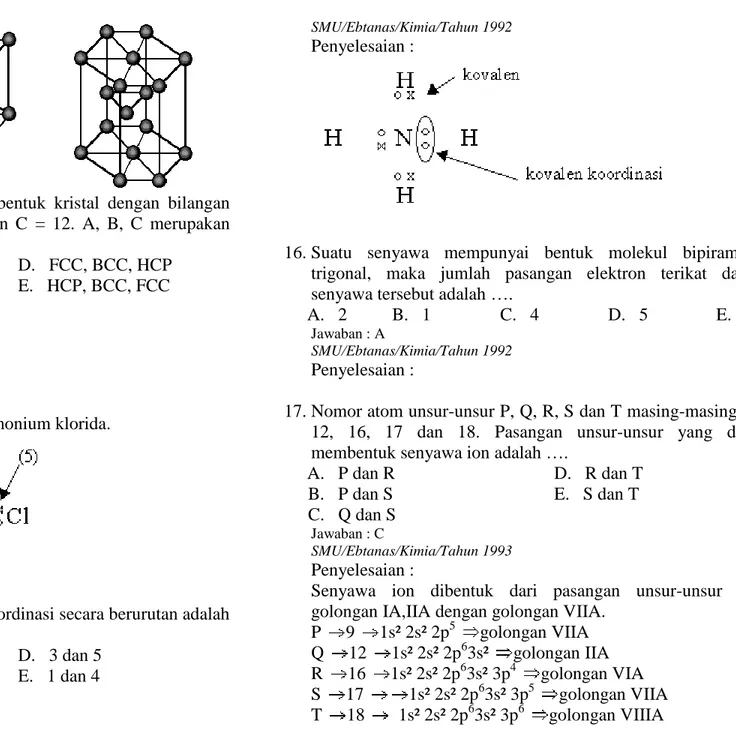
Gambar A, B dan C adalah bentuk kristal dengan bilangan Koordinasi A = 12, B = 8 dan C = 12. A, B, C merupakan bentuk kristal dari ...
A. BCC, HCP, FCC D. FCC, BCC, HCP B. HCP, FCC, BCC E. HCP, BCC, FCC C. FCC. HCP, BOC Jawaban : D SMU/Ebtanas/Kimia/Tahun 1991 Penyelesaian : FCC, BCC, HCP
15. Gambar rumus elektron dari amonium klorida.
Ikatan kovalen dan kovalen koordinasi secara berurutan adalah …. A. 1 dan 2 D. 3 dan 5 B. 1 dan 3 E. 1 dan 4 C. 2 dan 5 Jawaban : A SMU/Ebtanas/Kimia/Tahun 1992 Penyelesaian :
16. Suatu senyawa mempunyai bentuk molekul bipiramidal trigonal, maka jumlah pasangan elektron terikat dalam senyawa tersebut adalah ….
A. 2 B. 1 C. 4 D. 5 E. 6
Jawaban : A
SMU/Ebtanas/Kimia/Tahun 1992
Penyelesaian :
17. Nomor atom unsur-unsur P, Q, R, S dan T masing-masing : 9, 12, 16, 17 dan 18. Pasangan unsur-unsur yang dapat membentuk senyawa ion adalah ….
A. P dan R D. R dan T B. P dan S E. S dan T C. Q dan S Jawaban : C SMU/Ebtanas/Kimia/Tahun 1993 Penyelesaian :
Senyawa ion dibentuk dari pasangan unsur-unsur dari golongan IA,IIA dengan golongan VIIA.
P 9 1s² 2s² 2p5 golongan VIIA Q 12 1s² 2s² 2p63s² golongan IIA R 16 1s² 2s² 2p63s² 3p4 golongan VIA S 17 1s² 2s² 2p63s² 3p5 golongan VIIA T 18 1s² 2s² 2p63s² 3p6 golongan VIIIA
18. Jika unsur P dengan nomor atom 5 bersenyawa dengan unsur Q dengan nomor atom 17, maka bentuk molekulnya adalah …. A. linier D. segi empat planar
B. segitiga planar E. tetrahedral C. piramida segitiga
Jawaban : B
SMU/Ebtanas/Kimia/Tahun 1993
Penyelesaian :
Jumlah elektron valensi P = 3 Jumlah elektron valensi 3Q = 3 Jumlah elektron = 6
Jumlah pasangan elektron terikat = 3 Jumlah pasangan elektron tak terikat = 0 Bentuk molekulnya segitiga planar
19. Diketahui atom : 12X, 17Y, 20Z, 35Q. Pasangan yang dapat membentuk ikatan kovalen non polar adalah ….
A. X dan Y D. Z dan Q B. Y dan Q E. Q dan X C. Y dan Z Jawaban : B SMU/Ebtanas/Kimia/Tahun 1994 Penyelesaian :
Ikatan kovalen non polar = ikatan kovalen yang mempunyai perbedaan elektronegatifitas kecil.
A = X & Y = ikatan ion B = Y & Q = ikatan kovalen C = Y & = ikatan ion D = Z & Q = ikatan ion E = Q & X = ikatan ion 20. Bentuk molekul NH3 adalah …. (nomor atom N = 7, H = 1)
A. linier D. oktahedral
B. bujur sangkar E. piramida trigonal C. tetrahedral
Jawaban : E
SMU/Ebtanas/Kimia/Tahun 1994
Penyelesaian :
Konfigurasi elektron : 7N = (1s² 2s² 2p³)
sp³ dengan sudut 107 terdapat 3 pasang elektron terikat dan 1 elektron bebas.
21. Data konfigurasi elektron dari beberapa unsur sebagai berikut : P = 1s² 2s² 2p63s²
Q = 1s² 2s² 2p63s² 3p³ R = 1s² 2s² 2p63s² 3p6 S = 1s² 2s² 2p63s² 3p5
Unsur yang dapat membentuk ikatan kovalen adalah . . . .
A. Q dan S D. P dan Q
B. P dan R E. P dan S
C. Q dan R
Jawaban : A
Penyelesaian :
22. Unsur X dan Y masing-masing mempunyai nomor atom 16 dan 9 kedua unsur ini membentuk senyawa dengan rumus XY6, bentuk molekul senyawa XY6 adalah ….
A. linier D. trigonal bipiramidal B. segitiga sama sisi E. oktahedral
C. tetrahedral Jawaban : E SMU/Ebtanas/Kimia/Tahun 1995 Penyelesaian : 16X : (Ne) 3s23p4 9Y : (He) 2s22p5
Karena ada 6 pasangan elektron disekitar atom pusat, maka bentuk molekulnya oktahedral.
23. Struktur lewis molekul amonium klorida digambarkan sebagai berikut :
Pasangan elektron yang merupakan ikatan kovalen dan kovalen koordinasi dalam senyawa diatas berturut-turut adalah …. A. 1 dan 2 D. 3 dan 1 B. 2 dan 3 E. 2 dan 4 C. 3 dan 4 Jawaban : C SMU/Ebtanas/Kimia/Tahun 1996 Penyelesaian :
Ikatan Kovalen : ikatan dimana sepasang elektron dipakai bersama
24. Nomor Atom unsur-unsur. P, Q, R, S, dan T masing-masing 8, 9, 12, 16, dan 17. Pasangan unsur yang dapat membentuk senyawa ion adalah ….
A. R dan T D. S dan P B. Q dan S E. T dan Q C. P dan T Jawaban : A SMU/Ebtanas/Kimia/Tahun 1996 Penyelesaian : 8 P = 2) 6) gol VIA 9 Q = 2) 7) gol VIIA 12 R = 2) 8) 2) gol IIA 16 S = 2) 8) 6) gol VIA 17 T = 2) 8) 7) gol VIIA
Senyawa ion adalah terjadinya antara gol IA, IIA berikatan dengan VIA dan VIIA.
25. Antara unsur B (nomor atom 5) dengan F (nomor atom 9) dapat membentuk senyawa BP Bentuk molekul BP3 adalah ….
A. B. C. D. E. Jawaban : C SMU/Ebtanas/Kimia/Tahun 1996 Penyelesaian : 5 B = 2) 3) 9 F = 2) 7)
Ada elektron yang berpasangan dengan bentuk segitiga sama sisi.
26. Senyawa amonia mempunyai tiga pasang elektron terikat dan sepasang elektron bebas, bentuk molekulnya adalah ….
A. linier D. piramida segi empat B. tetrahedron E. piramida trigonal C. oktahedron
Jawaban : E
SMU/Ebtanas/Kimia/Tahun 1998
Penyelesaian :
Senyawa amoniak mempunyai 3 pasang elektron terikat dan sepasang elektron bebas, bentuk molekulnya Piramida Trigonal atau Piramida sisi tiga.
27. Diketahui senyawa :
1. H2O (l) 3. CH4 (g) 5. NH3 (l)
2. NH4Cl (aq) 4. HF (l)
Kelompok senyawa yang mempunyai ikatan hidrogen adalah …. A. 1, 2, 3 D. 2, 3, 5 B. 1, 3, 4 E. 3, 4, 5 C. 1, 4, 5 Jawaban : C SMU/Ebtanas/Kimia/Tahun 1998 Penyelesaian :
28. Diketahui harga keelektronegatifan unsur: H = 2,1; 0 = 3,5; C = 2,5; N = 3,0; CI = 3,0. Yang merupakan pasangan senyawa kovalen non polar dan senyawa kovalen polar adalah …. A. Cl2 dan O2 D. CCl4 dan HCI
B. Cl2 dan N2 E. NH3 dan H2O
C. NH3 dan HCl Jawaban : D
SMU/Ebtanas/Kimia/Tahun 1999
Penyelesaian :
Ikatan kovalen non polar jika pasangan elektron yang dipakai bersama tertarik sama kuat dan mengandung jenis atom yang sama dan simetris. Contoh : CH4 ; CCl4.
Ikatan kovalen polar terbentuk antara atom yang berikatan mempunyai beda keelektronegatifan besar : H - CI
29. Dari grafik titik didih beberapa senyawa berikut ini, kelompok senyawa yang memiliki ikatan hidrogen adalah ….
A. H2O, H2S, H2TC D. CH4, NH3, PH3 B. HF, HCL, HBr E. H2O, HF, NH3 C. NH3, PH3, AsH3 Jawaban : E SMU/Ebtanas/Kimia/Tahun 1999 Penyelesaian : H2O, HF, NH3
30. Diketahui unsur-unsur P, Q, P, 5 dan T dengan nomor atom berturut-turut 19, 11, 13,15, dan 17. Ikatan ion dapat terjadi antara atom-atom unsur ….
A. P dan Q D. Q dan T B. R dan P E. T dan S C. Q dan R Jawaban : D SMU/Ebtanas/Kimia/Tahun 2000 Penyelesaian :
Susunan konfigurasi elektron masing-masing unsur : P(19) = 2 8 8 1
Q(11) = 2 8 1 R(13) = 2 8 3 S(15) = 2 8 5 T(17) = 2 8 7
Ikatan ion dapat terbentuk dari :
- Unsur logam dengan unsur non logam
- Unsur yang mudah melepaskan elektron dengan unsur yang mudah menerima elektron membentuk unsur yang stabil. 31. Perhatikan gambar berikut :
A. 1 B. 2 C. 3 D. 4 E. 5
Jawaban : E
SMU/Ebtanas/Kimia/Tahun 2001
Penyelesaian :
Ikatan kovalen koordinat ditunjukkan oleh nomor 5. Ikatan kovalen koordinasi : ikatan yang dipakai bersama, dimana pasangan elektron tersebut berasal dari salah satu atom, sedangkan atom yang satunya lagi tidak menyumbangkan elektronnya.
32. Pasangan molekul berikut yang mempunyai ikatan hidrogen paling kuat adalah ….
A. HCl dan HBr D. HF dan H2O B. HF dan HCl E. HF dan HI C. HF dan NH3 Jawaban : D SMU/Ebtanas/Kimia/Tahun 2001 Penyelesaian :
Ikatan hidrogen : ikatan antara atom H dengan 3 unsur yang bersifat elektro negatif (F, O, N). Paling kuat H dengan F, H dengan O.
33. Nomor atom unsur A, B, C, D dan E berturut-turut 6, 8, 9, 16, 19. Pasangan unsur yang dapat membentuk ikatan ion adalah pasangan antara unsur ….
A. A dan C D. D dan C B. C dan E E. A dan B C. B dan D Jawaban : B SMU/Ebtanas/Kimia/Tahun 2002 Penyelesaian :
Pembentukan ion dapat terjadi melalui dua cara :
1. Pelepasan elektron dari atom itu kepada atom lain (pembentukan ion positif).
2. Penerimaan elektron dari atom lain (pembentukan ion negatif). K L M N A(6) = 2 4 - - B(8) = 2 6 - - C(9) = 2 7 - - D(16) = 2 8 6 - E(19) = 2 8 8 1
Pelepasan elektron cenderung terjadi pada unsur E (kulit terluar 1) dan penerimaan elektron pada unsur C (kulit terluar 7).
34. Diketahui unsur-unsur P, Q, R, S dan T dengan nomor atom berturut-turut 19, 20, 13, 15, dan 35. Ikatan ion dapat terjadi antara atom-atom unsur ….
A. Q dan T D. R dan P B. T dan S E. Q dan R C. P dan Q Jawaban : A SMU/Ebtanas/Kimia/Tahun 2003 Penyelesaian :
Unsur-unsur P, Q, R, S dan T dengan nomor atom 19, 20, 13, 15 dan 35.
Konfigurasi unsur-unsur tersebut adalah :
19P : 2, 8, 8, 1 Golongan I A 20Q : 2, 8, 8, 2 Golongan II A 13R : 2, 8, 3 Golongan III A 15S : 2, 8, 5 Golongan IV A 35T : 2, 8, 18, 7 Golongan VII A
Ikatan ion terjadi antara atom yang cenderung melepaskan elektron dengan yang cenderung menerima elektron (Gol. IA atau IIA dengan VIIA) yaitu Q dan T.
1. NH3 dengan BF 4. NH3 dengan HBr
2. H2O dengan HCl 5. NH3 dengan H2S
3. BF dengan H2O
Kelompok senyawa yang mempunyai ikatan hidrogen adalah …. A. 2 dan 3 D. 1 dan 3 B. 4 dan 5 E. 3 dan 4 C. 1 dan 5 Jawaban : D SMU/Ebtanas/Kimia/Tahun 2003 Penyelesaian :
Ikatan hidrogen adalah ikatan antar molekul pada senyawa kovalen yang memiliki perbedaan keelektronegatifan besar. Contoh: HF, H2O, NH3