RENCANA PELAKSANAAN PEMBELAJARAN (RPP)
IDENTITAS
Sekolah : SMA Mata Pelajaran : Kimia Kelas/Semester : X/1 (satu) Alokasi Waktu : 3 jam pelajaran
A. KOMPETENSI INTI KI 1
KI 2
KI 3
KI 4
: Menghayati dan mengamalkan ajaran agama yang dianutnya
: Menghayati dan mengamalkan perilaku jujur, disiplin, tanggungjawab, peduli (gotong royong, kerjasama, toleran, damai), santun, responsif dan pro-aktif dan menunjukkan sikap sebagai bagian dari solusi atas berbagai permasalahan dalam berinteraksi secara efektif dengan lingkungan sosial dan alam serta dalam menempatkan diri sebagai cerminan bangsa dalam pergaulan dunia.
: Memahami ,menerapkan, menganalisis pengetahuan faktual, konseptual, prosedural berdasarkan rasa ingintahunya tentang ilmu pengetahuan, teknologi, seni, budaya, dan humaniora dengan wawasan kemanusiaan, kebangsaan, kenegaraan, dan peradaban terkait penyebab fenomena dan kejadian, serta menerapkan pengetahuan prosedural pada bidang kajian yang spesifik sesuai dengan bakat dan minatnya untuk memecahkan masalah.
: Mengolah, menalar, dan menyaji dalam ranah konkret dan ranah abstrak terkait dengan pengembangan dari yang dipelajarinya di sekolah secara mandiri, dan mampu menggunakan metoda sesuai kaidah keilmuan.
B. KOMPETENSI DASAR DAN INDIKATOR
C. Kompetensi Dasar Indikator
3.6
Menentukan bentuk molekul dengan menggunakan teori tolakan pasangan elektron kulit valensi (VSEPR) atau Teori Domain
1. Menjelaskan teori Domain elektron 2. Menerapkan teori Domain elektron
Elektron elektron kulit valensi (VSEPR)
4. Menentukan bentuk molekul berdasarka teori tolakan pasangan elektron kulit valensi (VSEPR)
5. Menentukan sifat kepolaran berdasarkan bentuk molekul
4.6
Membuat model bentuk molekul dengan menggunakan bahan-bahan yang ada di lingkungan sekitar atau perangkat lunak kimia
1. Mengaplikasikan teori domain elektron untuk meramalkan bentuk molekul
2. Membuat bentuk molekul.dengan menggunakan balon
3. Mengomunikasikan hasil diskusi mengenai bentuk molekul.
D. MATERI PEMBELAJARAN 1. Teori Domain Elektron
2. Teori Tolakan Pasangan Elektron (VSEPR) 3. Bentuk molekul
E. KEGIATAN PEMBELAJARAN 1. Pertemuan Pertama: ( 3 JP)
Indikator:
3.6:
1. Menjelaskan teori Domain elektron
2. Menerapkan teori Domain elektron dalam menentukan bentuk molekul 3. Menjelaskan teori tolakan pasangan elektron kulit valensi (VSEPR)
4. Menentukan bentuk molekul berdasarkan teori tolakan pasangan elektron kulit valensi (VSEPR)
5. Menentukansifatkepolaranberdasarkanbentukmolekul 4.6:
2. Membuat bentuk molekul.dengan menggunakan balon 3. Mengomunikasikan hasil diskusi mengenai bentuk molekul.
a. Kegiatan Pendahuluan
Guru menyampaikan salam, berdoa, memeriksa kehadiran siswa
Apersepsi:
1. Menyampaikan IPK
2. Tanya-jawab tentang ikatan kovalen, tayangan gambar antara air dalam gelas dan gas karbon dioksida.
Motivasi: Mengamati gambar bentuk molekul CH4; H2O; NH3 dan CO2
b. Kegiatan Inti
No .
Sistaks/Tahapan Pembelajaran
Deskripsi Kegiatan Pembelajaran
1. Stimulasi (pemberian stimulus)
Diberikan 4 gambar bentuk molekul senyawa H2O, CO2, NH3 dan CH4.
Siswa mengamati bentuk molekul beberapa senyawa melalui gambar/ molymod/animasi.
2. Problem Statement (Identifikasi Masalah)
Diharapkan siswa bertanya:
- mengapa bentuk molekul keempat senyawa tersebut berbeda ?
- Bagaimana menentukan bentuk molekul suatu senyawa?
- Bagaimana hubungan antara bentuk molekul dengan kepolaran senyawa?
3. Data Callecting (Mengumpulkan Data)
Siswa mengkaji literature tentang teori domain electron dan teori VSEPR
Siswa melakukan diskusi dalam kelompok untuk menyimpulkan teori domain elektron dan teori VSEPR
Siswa melakukan diskusi kelas hasil kajian literature dan diskusi kelompok untuk menyamakan persepsi tentang teori domain elektron dan teori VSEPR
senyawa. 4. Data Proccesing
(Mengolah Data)
Siswa mengerjakan LKS tentang bentuk molekul dengan cara berdiskusi kelompok
5. Verification (Menguji Hasil)
Siswa dapat memahami bentuk molekul melalui diskusi informasi dengan bimbingan guru
6. Zeneralication (Menyimpulkan )
Siswa dapat menentukan bentuk molekul berdasarkan teori domain electron dan teori VSEPR
Siswa dapat menentukan kepolaran senyawa berdasarkan bentuk molekul
c. Kegiatan Penutup
Siswa mengerjakan latihan soal mengenai materi yang dipelajari.
Siswa mendapat tugas untuk membuat model molekul dari bahan-bahan yang ada di lingkungan sekitar atau perangkat lunak kimia
F. TEHNIK PENILAIAN
1. Pengetahuan: Tertulis Soal PG dan Uraian (Terlampir)
2. Keterampilan: Unjuk Kerja membuat bentuk molekul dari balon
F. Media/alat, Bahan, dan Sumber Belajar
1. Media/alat : molymode, LKS dan Power Point
2. Bahan : balon
3. Sumber Belajar : Buku pegangan Kimia jilid 1 dan buku penunjang yang relevan
Lampiran-lampiran:
REFLEKSI :
Setelah mengerjakan LK 2 kita dapat menentukan :
1. RPP
2. Model Pembelajaran yang diterapkanpadakegiatanpembelajaran
3. Penilaian pengetahuan dan penilaian psikomotorik yang akandilakukan untuk mengukur ketercapaian IPK
Lampiran 1:
Materi Pembelajaran
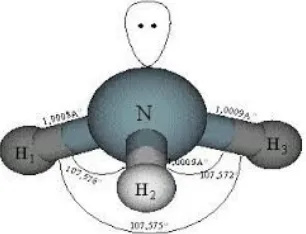
Bentuk molekul dapat diperkirakan dengan menggunakan struktur Lewis. Misalnya struktur Lewis amoniak:
Gambar Struktur Lewis amoniak
Dengan tiga pasangan elektron yang berikatan dan sepasang electron bebas, maka menurut domain elektron, akan tersusun dalam bentuk tetrahedral, tapi itu kurang tepat karena besarnya tolakan antar atom H, dengan tolakan antara atom H dan pasangan electron ternyata tidak sama besar, maka pasangan electron bebas diperhitungkan dengan cara terpisah, sehingga bentuk yang tepat adalah piramida.
Bentuk dasar dari suatu molekul ditentukan oleh jumlah pasangan elektron yang ada pada atom pusatnya. Ada 5 bentuk molekul dasar dari suatu senyawa, yakni :
1. Linear
4. Trigonal Bipiramida 5. Oktahedral
Bentuk-bentuk molekul tersebut bersifat simetris, apabila suatu senyawa yang memiliki jumlah pasangan elektron pada atom pusat sama dengan bentuk molekul dasar tersebut, namun memiliki bentuk yang berbeda. Hal tersebut disebabkan perbedaan komposisi PEI dan PEB dari pasangan elektron yang ada pada atom pusatnya. Sehingga bentuk molekul dasar (simetris) tersebut terdistorsi menjadi bentuk molekul yang berbeda dan tidak simetris.
BENTUK MOLEKUL
Tabel Hubungan antara PEI, PEB, bentuk molekul dan contoh serta gambar
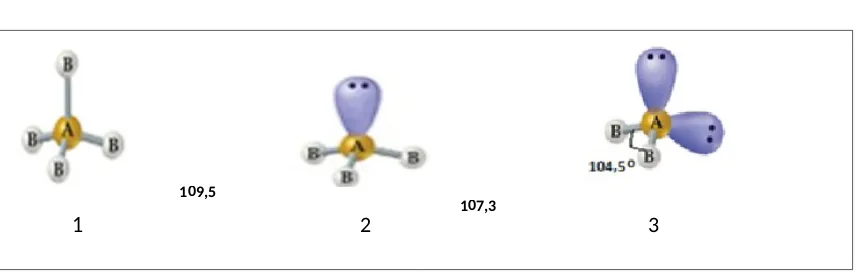
1 2 107,3 3
Konsep teori domain elektron
Carilah bentuk molekul berdasarkan PEI dan PEB berikut, tuliskan bentuk molekul pada tabel berikut!
PEB PEI
1 2 3
2 3 4 5 6
Dengan membaca Tabel Hubungan antara PEI, PEB, bentuk molekul dan contoh serta gambar, Coba kalian rangkai bentuk molekul senyawa mengunakan mollymood dan gambarkan hasilnya dalam tabel berikut ini !
NO Rumus Kimia
Jumlah PEI
Jumlah PEB
Senyawa
1 CO2
2 BH3
3 CH4
4 PCl5
5 SF6
Meramalkan Bentuk Molekul
Untuk meramalkan bentuk molekul, terlebih dahulu menentukan atom pusat (A), jumlah atom yang diikat (X), PEB (E), jumlah PEI (n), dan jumlah PEB (m). Dengan menggunakan notasi :
Lampiran 2:
Instrumen Penilaian
A. Rumusan Soal Pengetahuan
IndikatorSoal rdasarkanteori domain elektron
Menetukanjbentukmolekuldanjumlah PEB suatusenyawa
1. Menurut teori domainelektron bentuk molekul senyawa CH4 adalah ....
A. Segitiga pelanar B. Piramida trigonal C. Tetrahedral
D. Segitiga bipiramida E. Segi empat datar
2. Jumlah pasangan terikat atom pusat suatu molekul senyawa=3, sedangkan pasangan elektron bebasnya =0, maka bentuk molekul-molekulnya
A. Oktahedral B. Segitiga sama sisi C. Tetrahedral
D. Bipiramida segitiga E. Linier
3. Nomor atom P adalah 15, sedangkan Br adalah 35, bentuk molekul PBr5 adalah
A. tetrahedral B. segitiga sama sisi C. trigonal bipiramida D. trigonal piramida E. bujur sangkar
Menentukanbentukmolekuldanjumlah PEB senyawaamoniak
Menentukanposisidari PEB keduabentukmolekul octahedral
MenentukanbentukmolekulberdasarkanTipe /Rumussuatusenyawa
Menjelaskanteori domain electron dan VSEPR
HOTS
HOTS
LOTS
HOTS
kovalen. Apakah bentuk molekul dari amoniak dan jumlah pasangan elektron bebasnya berturut-turut;
A. Trigonal piramida, 1 B. Trigonal piramida, 3 C. Segitiga sama sisi, 1 D. segitiga sama sisi, 2 E. Segitiga planar, 1
5. Dalam bentuk oktahedral, pasangan elektron bebas pertama dapat menempati posisi manapun. Dimanakah posisi pasangan elektron bebas yang tipe XY4 adalah
Diberikandatano atom ,
dapatmenggambarkanbentukmolekuluntukb eberapasenyawadari data
Menggolongkansenya polar dan non polar
HOTS
Uraian :
1. Jelaskan pengertian tentang konsep dasar dari teori domain electron danVSEPR!
2. Gambarkan struktur Lewis anjelaskansenyawa yang tergolongpolardan non polar H2O , CO2, , NH3 , PCl5 ddan CH4
B. Lembar Observasi dan kinerja presentasi
LEMBAR PENGAMATAN OBSERVASI DAN KINERJA PRESENTASI Mata Pelajaran: Kimia
Kelas/Program: X/M-IPA
N
o Nama Siswa
Observasi Kinerja Presentasi
Jml
Skor Nilai Ak
t
Dis
l Kerjsm Prnsrt Visual Isi
1. 2. 3. 4.
Keterangan pengisian skor 4 = Sangat tinggi
3 = Tinggi 2 = Cukup tinggi 1 = Kurang
Lampiran 3: LKS
Teori Singkat:
Sebagai analogi bentuk molekul berdasarkan teori tolakan pasangan electron cobalah membuat model bentuk-bentuk molekul dengan balon.
Langkah Kerja:
1. Tiuplah 20 balon dengan ukuran hamper sama.
2. Buatlah ikatan balon, masing-masing 2, 3, 4, 5, dan 6 buah balon. Ikatlah balon dengan ketat, sehingga satu sama lain tolak menolak.
Gambar analogi Bentuk Molekul dengan balon
Jumlah balon menganalogikan jumlah electron yang mengelilingi atom pusat, bentuk-bentuk molekul bergantung dari jumlah pasangan electron yang tolak-menolak di sekitar atom.
Keterangan:
A: Atom Pusat
X: PEI
E: PEB
n: jumlah PEI
m: jumlah PEB
Dengan menggunakan model balon, Coba ramalkan bentuk molekul senyawa dalam tabel berikut ini:
Gambar Bentuk Molekul Contoh Senyawa
1. Dua balon
2. Tiga balon
3. Empat balon
4. Lima Balon
5. Enam balon
Lengkapi Tabel Berikut:
N O
Rumus Kimia Senyawa
A X n m Bentuk
Molekul
Nama Bentuk
Sifat Kepolara
n
1 BeCl2
3 SO2
4 NH3
5 ClF3
6..
CH4
7 TeCl4
9 IF5
10 XeF4
Jawablah pertanyaan berikut:
1. Apakah yang dimaksud dengan PEI dan PEB?
2. Ada berapa pasang electron ikatan (PEI) pada H2O, NH3 dan CO2? 3. Ada berapa pasang electron bebas (PEB) pada H2O, NH3 dan CO2?
4. Masih ingatkah kalian mengenai muatan elektron, Bagaimanakah jika antara satu elektron dengan elektron yang lain saling mendekat?
5. Gambarkan kemungkian interaksi yang terjadi antara elektron atom pusat dalam molekul-molekul air dan karbondioksida!
6. Buatlah kesimpulan mengenai interaksi PEI – PEI; PEI – PEB; PEB – PEB