Sifat Unsur Periodik Ketiga A. Kelimpahan di Alam
Keberadaan unsur kimia di alam sangat melipah. Hingga saat ini, unsur-unsur kimia berjumlah sekitar 114 unsur-unsur. Unsur kimia terdapat di kerak bumi, dasar laut, dan atmosfer, baik dalam bentuk unsur bebas, senyawa ataupun campurannya. Unsur-unsur kimia yang terdapat di alam dalam bentuk unsur bebasnya (tidak bersenyawa dengan unsur lainnya), diantaranya logam platina (Pt), emas (Au), karbon (C), gas nitrogen (N2), oksigen (O2), dan gas-gas mulia. Adapun unsur-unsur lainnya ditemukan dalam bentuk bijih logam. Bijih logam merupakan campuran antara mineral yang mengandung unsur-unsur kimia dan pengotornya. Mineral-mineral tersebut berbentuk senyawa oksida, halida, fosfat, silikat, karbonat, sulfat, dan sulfida. Logam platina (Pt) dan emas (Au) disebut logam mulia. Sumber logam mulia dan mineral-mineral dapat ditemukan di kerak bumi, sedangkan sumber gas oksigen, nitrogen, dan gas mulia (kecuali He) terdapat di lapisan atmosfer.
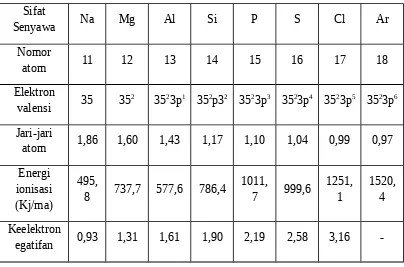
Unsur – unsur periode ketiga terdiri atas Na, Mg, Al, Si, P, S, Cl dan Ar. Harga keelektronegatifan unsur periode ketiga dari kiri ke kanan semakin besar dan sebaliknya, harga keelektropositifan semakin kecil. Hal ini disebabkan oleh harga keelektronegatifan Y semakin besar sehingga semakin mudah membentuk ion negative.
Table 3-13, data sifat periodic unsur-unsur periode ketiga Sifat
atom 1,86 1,60 1,43 1,17 1,10 1,04 0,99 0,97
Energi ionisasi (Kj/ma)
495,
8 737,7 577,6 786,4
1011,
-Berdasarkan tabel tersebut, anda dapat mengetahui bahwa dari kiri ke kanan, jumlah elektron valensi semakin banyak, sedangkan jumlah kulitnya tetap. Akibatnya, jari-jari atom semakin kecil sehingga semakin sukar melepaskan elektron (ionisasinya semakin besar).
B. Sifat-sifat unsur periodik ketiga
1. Sifat Fisik Unsur Periode KeTiga
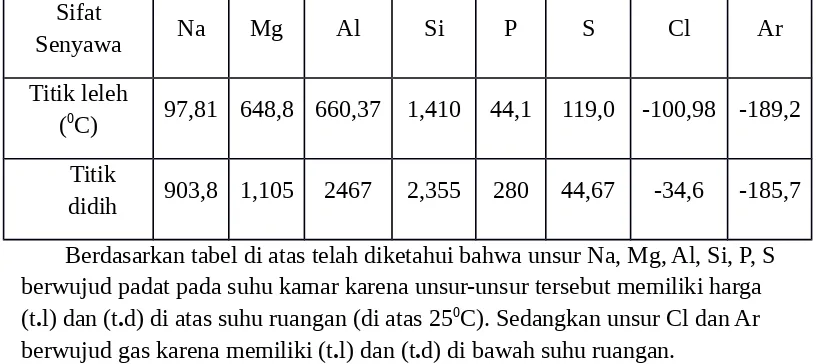
Table 3.14 titik leleh dan titik didih unsure periode ke tiga Sifat
Senyawa Na Mg Al Si P S Cl Ar
Titik leleh
(0C) 97,81 648,8 660,37 1,410 44,1 119,0 -100,98 -189,2 Titik
didih 903,8 1,105 2467 2,355 280 44,67 -34,6 -185,7 Berdasarkan tabel di atas telah diketahui bahwa unsur Na, Mg, Al, Si, P, S berwujud padat pada suhu kamar karena unsur-unsur tersebut memiliki harga (t.l) dan (t.d) di atas suhu ruangan (di atas 250C). Sedangkan unsur Cl dan Ar berwujud gas karena memiliki (t.l) dan (t.d) di bawah suhu ruangan.
Dalam periode ketiga, letak logam disebelah kiri, makin ke kiri sifat logam semakin reaktif, Na >Mg> Al. Jadi Na paling reaktif. Bukan logam terletak sebelah kanan makin ke kanan sifat bukan logamnya makin kuat, a> 5> P> Si. Klor paling reaktif dan Si paling tidak reaktif. Jadi , unsur periode ketiga dari Na ke Cl sifat logamnya makin bertambah.
2. Sifat Kimia Unsur Periode Ketiga
Unsur – unsur periode ketiga memiliki keteraturan sifat secara berurutan dari kiri kekanan sebagai berikut :
a. Sifat preduksi berkurang dan sifat pengoksidasi bertambah b. Sifat logam semakin lemah dan sifat nonlogam semakin kuat c. Sifat basa semakin lemah dan sifat asam semakin kuat
Sifat Pereduksi dan Sifat Pengoksidasi
Sifat
Senyawa Na Mg Al Si P S Cl Ar
Potensial reduksi
(volt)
-2,711 -2,375 -1,706
-0,13 -0,276 -0,508 +1,358 -Dari kiri ke kanan unsur periode ketiga memiliki harga potensial reduksi 5 standart yang semakin positif sehingga sifat pereduksinya semakin berkurang dan sifat pengoksidasinya semakin bertambah.
Natrium merupakan pereduksi yang reaktif terhadap air. Sifat pereduksi magnesium lebih lemah dibandingkan natrium. Sehingga logam Mg hanya dapat bereaksi dengan air panas.
Contoh :
2Na (5) + 2H O (l) 2Na OH (ag) + H2 (g) Mg (5) + H2O (l) (tidak bereaksi)
Mg (5) + 2H2O (l) panas Mg (OH)2 + H2 (g) Al (5) + H2O (l) (tidak bereaksi)
2Al (5) + 3H2O (g) panas Al2 O3 (5) + 3H2 (g)
Sedangkan silicon memiliki sifat pereduksi lebih lemah dibandingkan aluminium sehingga silicon yang bereaksi dengan oksidator kuat, seperti oksigen dan klorin.
Contoh :
Si (5) + O2 (g) Si O2 (5) Si (5) + 2Cl2 (g) Si Cl4 (l)
Sifat Logam dan Nonlogam
Unsur-unsur periode ketiga, seperti Na, Mg, dan Al merupakan unsur logam, sedangkan unsur-unsur P, S, dan Cl merupakan unsur nonlogam. Adapun Si merupakan unsur yang memiliki sifat peralihan antara unsur logam dan
nonlogam sehingga disebut unsur metalloid (semi logam). Argon (Ar) termasuk golongan gas mulia yang bersifat insert (sulit bereaksi) sehingga tidak dibahas lebih lanjut dalam bab ini.
Sifat Asam-Basa
Sifat asam berkaitan dengan sifat non logam,sedangkan sifat basa berkaitan dengan logam. Sifat basa atau sifat asam dari suatu unsure bergantung pada konfigurasi electron dan harga ionisasi unsure-unsur tersebut.
Dari kiri ke kanan, unsur-unsur periode ketiga memiliki harga ionisasi yang semakin besar sehingga semakin sukar melepas electron. Penyebabnya electron Dari unsur tersebut akan kurang tertarik kea rah atau oksigen sehingga
kecenderungan untuk membentuk ion OH menjadi berkurang. Contoh :
M – OH M+ + OH
-Jadi, dari kiri kekanan sifat basa usnur periode ketiga semakin lemah.
b. Sifat Asam
Energi ionisasi unsur periode ketiga dari kiri ke kanan semakin besar sehingga semakinmudah menarik electron dari atom oksigen. Jadi dari kiri ke kana sifat asam unsur periode ketiga semakin kuat.
Contoh :
M – OH MO- + H+
Senyawa asam unsur periode ketiga, yaitu : asam siukat (H2SiO3) asam fosfat (H3DO4) asam sinfat (H2SO4) dan asam paklorat (HCO4). Senyawa H2SiO3 merupakan asam sangat lemah sehingga mudah terurai menjadi senyawa SiO2 dan H2O1
Unsur Pembuatan Kegunaan TerdapatPada Rumus Senyawa
Na
Elektrolisis leburan NaCl (Proses Down)
· Pembuatan TEL · Mereduksi bijih
loga (Ti) · Lampu Kabut
Garam NaCl
Sendawa Chili NaNO3
Kriolit Na3AlF6
Bijih silikat Na2SiO3
Mg Elektrolisis lelehan MgCl2
· Magnalium untuk bahan kerangka pesawat terbang
Air laut MgCl2
Magnetit MgCO3
Kiserit MgSO4.3H2O
Dolomit MgCO3.CaCO3
Karnalit KCl.MgCl2.6H2O
Asbes CaMg(SiO3)4
Mika K-Mg-Al Silikat
Si Reduksi pasir SiO2 dengan C
dalam tanur listrik
· Bahan
semikonduktor untuk kalkulator, mikrokomputer, polimer silikon
Pasir/kuarsa SiO2
untuk mengubah jaringan pada tubuh
Asbes Mg-Ca-Silikat dan C pada suhu
1300oC dalam tanur listrik)
· Fosfor putih (beracun) untuk
bahan baku pembuatan H3PO4
· Fosfor merah (tidak beracun) untuk bidang gesek
korek api titik leleh Al2O3
· Alat masak, karena tahan panas
dan tahan karat karena membentuk
lapisan oksida · Paduan Al untuk
pesawat terbang · Al(OH)3 untuk
obat maag
dengan 2 cara: 1) Metode
Frasch (yang
ada di dalam tanah)
· Pembuatan korek api
· Proses vulkanisasi karet
2) Metode
Sisilia (yang ada di permukaan
tanah)
Pembuatan H2SO4 ada 2
cara: 1) Proses
Kontak dengan
bahan baku SO2, katalisnya V2O5
2) Proses Bilik
Timbal dengan
bahan baku SO2, katalisnya uap
nitroso
(campuran NO
dan NO2)
· Pembuatan CS2 (bahan baku serat
rayon)
· (NH4)SO4 atau pupuk ZA
· H2SO4 untuk elektrolit pada aki
(accumulator)
· CuSO4.5H2O (terusi) untuk anti