Kimia inti?
Kimia inti adalah ilmu yang mempelajari
struktur inti atom dan pengaruhnya
terhadap kestabilan inti serta reaksi-reaksi inti yang terjadi pada proses peluruhan
radio nuklida dan transmutasi inti
Radiokimia: mempelajari zat radioaktif
dan penggunaannya dengan teknik2 kimia.
Kimia radiasi: bidang kimia yang
Nuklida
Berdasarkan kesamaan dalam nilai A, Z,
dan N, nuklida-nuklida digolongkan menjadi 4 tipe.
A N
Penggolongan Nuklida
Isotop kelompok nuklida dengan Z sama
Contoh: 82Pb204, 82Pb206, 82Pb207,82Pb208
Isobar kelompok nuklida dengan A sama
Contoh: 6C14, 7N14, 8O14
Isoton kelompok nuklida dengan N sama
Contoh: 1H3, 2He4
Isomer inti nuklida dengan A dan Z sama
tetapi berbeda dalam tingkat energinya
5 Kelompok nuklida berdasar
kestabilan dan proses
pembentukannya di alam
Nuklida stabil secara alamiah tidak mengalami
perubahan A maupun Z, misal: 1H1, 6C12, 7N14
Radionuklida alam primer radionuklida yang
terbentuk secara alamiah dan bersifat radioaktif. Disebut primer karena waktu paruh panjang
sehingga masih bisa ditemukan sampai sekarang. Contoh: 92U238 dengan waktu paruh=4,5x109 th
Radionuklida alam sekunder radiaktif dan
dapat ditemukan dialam. Waktu paruh pendek, tidak dapat ditemukan di alam, tetapi dapat
Radionuklida alam terinduksi Misal
6C14 yang dibentuk karena interaksi sinar
kosmik dan nuklida 7N14 di atmosfr.
Radionuklida buatan merupakan
Kestabilan inti
Faktor penentu kestabilan:
Angka banding jumlah netron terhadap
proton (n/p) yang terkandung dalam inti. Inti yang paling stabil adalah inti yang
mempunyai nomor atom sampai 20, memiliki n/p=1 (kestabilan diagonal)
Pasangan nukleon yang ditunjukkan oleh
hukum genap-ganjil
Angka Banding n/p
Apabila nuklida-nuklida stabil
dihubungkan maka akan diperoleh pita kestabilan inti.
Unsur-unsur sampai dengan nomor atom
20 pita kestabilan inti membentuk sudut 45o dengan sumbu N dan Z (n/p=1).
Suatu inti dikatakan bersifat radioaktif
Jenis radiasi yang dipancarkan
Partikel
dasar Massa relatif Muatan Simbol Jenis
Hukum Genap Ganjil
Dari jumlah nuklida stabil di alam, jika dikelompokkan
berdasarkan jumlah proton (Z) dan jumlah netron (N) penyusunnya maka akan diperoleh data sbb:
Data diatas menunjukkan urutan kestabilan relatif adalah Z
genap, N genap > Z genap, N ganjil> Z ganjil, N ganjil > Z ganjil, N ganjil.
Inti yang stabil menghendaki jumlah proton dan netron
genap
Jenis nuklida Jumlah nuklida stabil
Z genap, N genap 165
Energi Pengikat Inti
Massa suatu inti selalu lebih kecil dari
jumlah massa proton dan netron.
Berdasarkan hukum kesetaraan massa
dan energi, selisih massa tersebut adalah merupakan energi pengikat nukleon
dalam inti.
Semakin besar energi pengikat inti per
Reaksi Inti Spontan dan Buatan
Unsur paling berat yang terjadi secara alamiah adalah uranium.
Isotop uranium 92U238 secara spontan akan
memancarkan partikel alfa menjadi 90Th234.
Peluruhan 90Th234 dengan memancarkan sinr
beta akan menghasilkan 91Pa234.
Unsur-unsur dengan Z > 92 yang dikenal dengan unsur buatan dihasilkan dari
penembakan inti dengan proton, partikel
Jenis Peluruhan Radioaktif
Peluruhan alfa
Peluruhan beta
Peluruhan gamma (transisi isomerik)
Pembelahan spontan
Pemancaran netron
Peluruhan alfa
Partikel alfa terdiri atas 2 proton dan dua
netron (partikel relatif besar).
Agar suatu nuklida mampu melepaskan
partikel alfa, inti harus relatif besar.
Contoh:
Peluruhan beta
3 jenis peluruhan beta:
Pemancaran negatron (beta negatif)
Pemancaran positron (beta positif)
Penangkapan elektron (electron capture, EC).
Contoh:
19K40 20Ca40 + -1 0;
Pemancaran negatron terjadi jika n/p > isobar yang lebih
stabil, maka dalam inti terjadi perubahan 1 n menjadi 1 p : 0n1
1H1 + -1 0 +
Peluruhan Gamma (transisi
isomerik)
Transisi diantara isomer inti.
Seringkali suatu inti berada pada tingkat
kuantum diatas tingkat dasarnya (metastabil).
Waktu paruh transisi isomerik
kebanyakan dalam orde <10-6 detik.
Contoh:
Pembelahan spontan
Peluruhan dengan pembelahan spontan
hanya terjadi pada nuklida sangat besar.
Nuklida yang sangat besar membelah diri
menjadi 2 nuklida yang massanya hampir sama disertai pelepasan beberapa
netron.
Contoh:
Pemancaran netron
Prose peluruhan ini terjadi pada nuklida
yang memiliki kelebihan netron relatif terhadap inti yang stabil.
Contoh:
Pemancaran netron
terlambat
Proses peluruhan terjadi dengan
didahului oleh pemancaran negatron kemudian dilanjutkan dengan
pemancaran netron.
Contoh:
35Br87 36Kr87 + -1 0 36Kr86 + 0n1
Kinetika reaksi inti dan waktu
paruh
Kebolehjadian suatu nuklida untuk meluruh
tidak tergantung lingkungan (suhu, tekanan, keasaman, dll).
Tetapi, bergantung pada jenis dan jumlah
nuklida.
Kecepatan peluruhan berbanding lurus dengan
jumlah radionuklida, yang dinyatakan dengan: -dN/dt N;
dengan
Kinetika reaksi inti dan waktu
paruh
Perbandingan dapat diubah menjadi
persamaan dengan memasukkan tetapan perbandingan .
Kinetika reaksi inti dan waktu
paruh
Jika N0 dan diketahui maka dapat
dihitung radionuklida N pada tiap waktu t.
Daftar tetapan peluruhan tidak ada, yang
Satuan keradioaktifan dan dosis
radiasi
Keaktifan suatu zat radioaktif adalah jumlah
peluruhan (disintegrasi) per satuan waktu.
Satuan keaktifan suatu zat radioaktif adalah
Curie (Ci), semula didasarkan pada laju
disintegrasi 1 gram radium, tetapi sekarang didefnisikan sebagai 3,7 x 1010 disintegrasi S-1.
Satuan keaktifan dalam SI adalah becquerel (Bq)
yang didefniskan sebagai 1 disintegrasi S-1.
1 Bq = 1 disintegrasi/S
Keaktifan jenis adalah keaktifan per gram
Satuan keradioaktifan dan dosis
radiasi
Satu rad adalah jumlah energi radiasi
yang diserap 100 erg per gram bahan.
Dalam SI satuan dosis adalah Gray (Gy)
yang didefnisikan sebagai 1 JKg-1.
Reaksi Fisi
Reaksi Fisi : reaksi pembelahan inti menghasilkan netron
Setiap reaksi pembelahan inti selalu dihasilkan energi sekitar 200 Mev.
Netron yang dihasilkan dapat digunakan untuk menembak inti lain sehingga terjadi pembelahan inti secara berantai.
Energi yang dihasilkan pada pembelahan 235 gram 235U ekivalen dengan energi yang
Reaksi Fusi
Reaksi penggabungan dua atau beberapa inti
ringan menjadi satu inti yang lebih berat.
Reaksi fusi menghasilkan energi yang sangat
besar.
Reaksi ini memiliki energi pengaktifan,
terutama untuk mengatasi gaya tolak
menolak kedua inti yang akan bergabung.
Reaksi hanya mungkin terjadi pada suhu
sangat tinggi, sekitar 100 juta derajat.
Pada suhu tersebut tidak terdapat atom
Reaksi Fusi
Energi yang dihasilkan pada reaksi fusi sangat
besar.
Energi yang dihasilkan cukup untuk
menyebabkan terjadinya reaksi fusi berantai yang dapat menimbulkan ledakan termonuklir.
Energi fusi dari 1 kg hidrogen setara dengan
energi pembakaran 20ribu ton batubara.
Keuntungan reaksi fusi dibandingkan reaksi fsi:
Energi yang dihasilkan lebih tinggi
Aplikasi Reaksi Inti dan
Keradioaktifan
Reaksi inti (fusi dan fsi) sebagai penghasil energi
listrik.
Penentuan umur (dating) batuan atau fosil.
Dalam bidang kimia:
Analisis pengenceran isotop
Analisis pengaktifan netron sebagai perunut dalam
menentukan mekanisme reaksi kimia.
Dalam bidang kedokteran, radioisotop digunakan
sebagai perunut dalam terapi kanker.
Dalam bidang pertanian, radioisotop digunakan
Contoh soal:
Ditemukan tulang suatu binatang purba
yang mempunyai keaktifan C14 2,75 dpm/
g. Perkirakan berapa tahun yang lampau binatang itu hidup? (t½ C14 = 5668
II. SISTEM PERIODIK UNSUR-UNSUR
Sistem periodik unsur-unsur mula-mula disusun oleh Mendeleeff dan Lotar Meyer berdasarkan masa atom .
Hukum periodik unsur-unsur tersebut menyatakan
Meskipun pernyataan ini benar, namun ada beberapa kelemahannya,
Mis. ada beberapa pasangan unsur yang
tidak cocok dengan hukum periodik, yakni unsur dengan masa atom lebih besar
ditempatkan didepan unsur dengan masa atom lebih kecil, agar sifatnya berulang.
Co (massa atom 58,93) didepan Ni (masa atom 58,70); Te ( massa atom 127,6) didepan I (massa atom 126,9).
Hal ini karena setiap inti atom tersusun atas proton dan neutron, jumlah proton dalam setiap atom suatu unsur sama, tetapi
jumlah neutronnya dapat berbeda
sehingga massa atomnya dapat berbeda pula.
Padahal yang menentukan sifat unsur dan banyaknya elektron adalah jumlah proton. Jumlah proton dalam atom disebut nomor
Jadi hukum periodik seharusnya berbunyi : jika unsur disusun menurut
kenaikkan nomor atomnya, maka
Tabel Periodik yang disusun berdasarkan nomor atom:
Dalam tabel Periodik tersebut, unsur-unsur dalam
deret mendatar dinamakan perioda, sedangkan kolom vertikal dinamakan golongan.
Perioda I : 2 unsur, Perioda II dan III : 8 unsur
Bilangan-bilangan 2, 8, 18 dan 32 menunjukkan jumlah elektron maksimum dalam orbital
dengan
n = 1, n = 2, n = 3 dan n = 4.
Karena orbital yang dihuni elektron dalam atom terdiri atas orbital-orbital s, p, d dan f maka bilangan-bilangan ini merupakan bilangan
yang terbentuk dari penggabungan bilangan 2, 6, 10 dan 14 , yaitu bilangan yang
Dalam tabel Periodik unsur-unsur dikelompokkan ke dalam golongan :
- Unsur-unsur utama dengan indeks A
- Unsur transisi / peralihan dengan indeks B
Unsur nomor atom 57 sampai dengan 71 terletak dalam satu kotak, dan dikenal sebagai unsur-unsur
Lantanida.
Sedangkan unsur-unsur nomor atom 89 sampai
Unsur-unsur Golongan Utama
Unsur-unsur golongan utama adalah unsur-unsur yang pengisian elektronnya berakhir pada orbital-orbital s dan p.
Unsur-unsur Golongan Transisi:
Unsur-unsur transisi adalah unsur-unsur yang pengisian elektronnya berakhir pada orbital d.
Fenomena yang terdapat pada orbital-orbital d ialah: Elektron-elektron dalam orbital- orbital d cenderung berada dalam keadaan penuh (d10) atau setengah
penuh (d5).
Oleh karena itu, konfigurasi elektron 24 Cr adalah 4s1
3d5 bukannya 4s2 3d4 dan
29Cu adalah 4s1 3d10,
Cara penomoran golongan unsur-unsur transisi: 1. Nomor golongan harus dibubuhi huruf B
2. Nomor golongan = jumlah elektron s + d ( jumlah elektron dikulit terluar + jumlah elektron d yang diisi terakhir).
Beberapa sifat khas unsur-unsur transisi:
1. Semua unsur transisi adalah logam
2. Hampir semua unsur transisi berwujud padat pada suhu kamar, kecuali Hg
3. Memiliki sifat katalis
4. Bersifat para magnetik ( tertarik oleh medan magnet )
5. Mempunyai valensi dan bilangan oksidasi umumnya lebih dari satu
Logam Transisi
Jika unsur-unsur block d membentuk ion-ion, elektron-elektron pada 4s hilang pertama kali.
Untuk menulis struktur elektronik dari Co2+:
Co [Ar] 3d74s2
Co2+ [Ar] 3d7
Ion 2+ dibentuk dengan kehilangan dari dua
elektron 4s. Untuk menulis struktur elektronik untuk V3+ :
V [Ar] 3d34s2
V3+ [Ar] 3d2
Variabel tingkat oksidasi (nomor)
Contoh dari variabel tingkat oksidasi dalam logam-logam transisi.
Besi
Besi biasanya mempunyai dua tingkat oksidasi dalam (+2 dan +3) , Sebagai contoh, Fe2+ dan Fe3+. Ia juga dapat mempunyai tingkat
Pembentukan
ion-ion
komplek
Apakah ion kompleks itu ?
Suatu ion komplek mempunyai ion metal pada
pusatnya dengan sejumlah molekul atau ion lain mengelilinginya yang terikat pada ion pusat
tersebut melalui ikatan koordinasi.
Beberapa contoh ion kompleks yang dibentuk oleh logam transisi:
[Fe(H2O)6]2+
[Co(NH3)6]2+
[Cr(OH)6]
2-Pembentukan senyawa-senyawa yang berwarna.
The origin of colour in the transition metal ions The origin of colour in the transition metal ions The origin of colour in the transition metal ions
The origin of colour in the transition metal ions
Keaslian warna dalam ion-ion metal transisi.
Jika sinar putih melalui larutan dari salah satu ion-ion ini,
atau dipantulkannya, beberapa warna dalam sinar diabsorbsi.
Warna yang terlihat adalah bagaimana mata kita melihat apa yang tertinggal.
Aktivitas katalitik :
Iron in the Haber Process
Proses Haber mereaksikan hidrogen dan nitrogen untuk membuat amonia menggunakan katalis besi.
Transition metal compounds as catalysts Transition metal compounds as catalysts
Transition metal compounds as catalysts
Senyawa-senyawa logam transisi sebagai katalis.
Vanadium(V) oksida dalam proses kontak.
The chemistry of some specific transition metals
Senyawa beberapa logam-logam transisi yang spesifk.
VANADIUM
Vanadium(V) oksida sebagai catalis dalam proses reaksi.
Bagaimana jalannya reaksi ?
Sulfur dioksida dioksidasi menjadi sulfur trioksida oleh vanadium (V)
(V) Oksida . Dalam proses, vanadium(V) oksida direduksi menjadi
vanadium(IV) oksida.
Tingkat oksidasi Vanadium
Tingkat oksidasi Vanadium dalam senyawanya adalah +5, +4, +3 dan +2.
Tahap reduksi vanadium(V) ke vanadium(II)
Reduksi dari +4 ke +2
Penggantian air oleh ion sulfat.
Penggantian air dengan ion klorida.
Dalam adanya ion klorida (misalnya dengan
chromium(III) klorida), biasanya warna yang teramati adalah hijau.
Ini terjadi jika dua molekul air digantikan oleh ion klorida memberikan
Reaksi ion chromium(III)heksa hidrat dengan ion hidroksida
Oksidasi dari chromium(III) ke chromium(VI)
Beberapa Sifat Periodik Unsur 1. Jari-jari atom
Jari-jari atom adalah jarak dari inti atom sampai kulit
terluar suatu atom.
Jari-jari atom unsur segolongan dari atas ke bawah umumnya makin besar, sedangkan untuk unsur-unsur dalam satu periode dari kiri ke kanan jari-jari atomnya semakin kecil.
Nomor atom unsur-unsur seperiode dari kiri ke kanan makin besar, sehingga muatan inti
Makin besar muatan inti, maka gaya tarik
elektrostatik terhadap elektron akan lebih kuat, sehingga jarak inti elektron ( jari-jari atom)
makin kecil.
Pada unsur-unsur segolongan memiliki ukuran
orbital dan muatan inti yang berbeda satu sama lain
Makin besar ukuran orbital dalam suatu atom, makin besar pula jari-jari unsur tsb.
Unsur-unsur segolongan dari atas ke bawah
Faktor ukuran orbital lebih menentukan
dibandingkan dengan faktor muatan inti.
Perubahan dari atom menjadi ion positif
mengurangi gaya tolak antar elektron karena jumlah elektron menjadi berkurang sedang muatan intinya tetap, sehingga jari-jari
menjadi berkurang.
Sebaliknya pada perubahan atom menjadi ion negatif, kenaikkan jumlah elektron
mengakibatkan semakin besarnya gaya tolak antar elektron, sehingga jari-jari menjadi
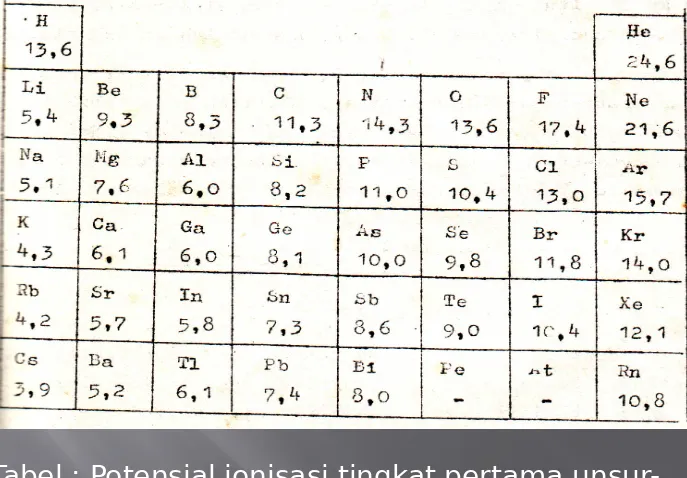
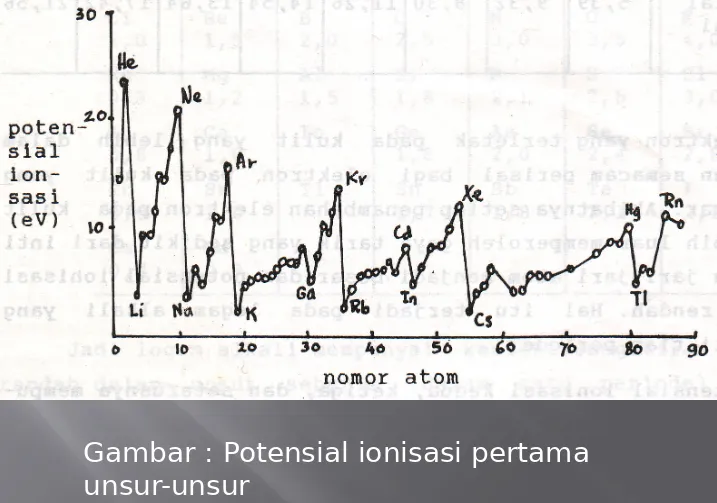
2. Potensial ionisasi
Potensial ionisasi adalah energi yang diperlukan untuk melepaskan satu
elektron yang terikat paling lemah dari suatu atom netral atau dari suatu ion. Energi yang diperlukan untuk melepaskan
elektron pertama dari suatu atom netral dinamakan potensial ionisasi tingkat
pertama, sedangkan energi yang
diperlukan untuk melepaskan elektron berikutnya dinamakan potensial ionisasi tingkat ke dua, tingkat ke tiga dan
Potensial ionisasi kedua, ketiga dst.
mempunyai harga yang lebih besar dari pada potensial ionisasi.
Hal ini disebabkan karena setelah
melepaskan elektronnya yang pertama jari-jari menjadi jauh lebih kecil.
Bila elektron dilepaskan dari kulit yang lebih dalam maka potensial ionisasi menjadi
Potensial ionisasi biasanya dinyatakan dalam satuan elektron volt.
1 elektron volt (eV) adalah banyaknya energi yang diperoleh elektron, ketika elektron tersebut melalui medan listrik dengan perbedaan potensial sebesar 1 volt.
eV merupakan besaran energi yang sangat kecil, karena itu sesuai untuk
Tetapi apabila yang dibicarakan adalah
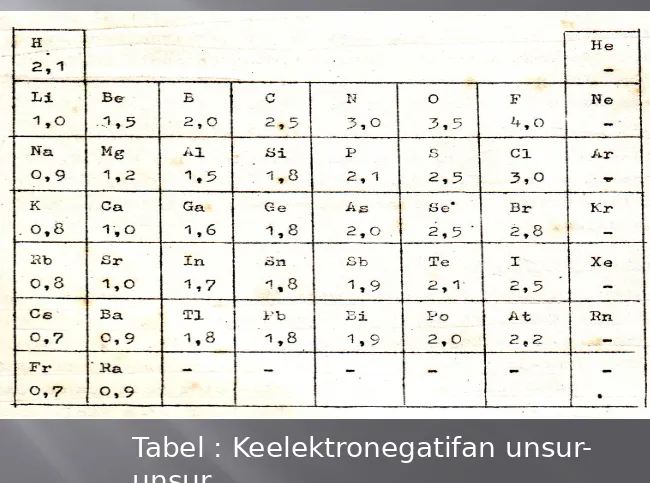
3. Keelektronegatifan
Keelektronegativan adalah suatu ukuran
kemampuan atom untuk menarik elektron terluarnya baik elektron bebas ataupun
ikatan sehingga atom tersebut cenderung bermuatan negatif.
Atom-atom dengan jari-jari atom yang kecil mempunyai kecenderungan lebih besar untuk menarik elektron dari pada atom-atom yang memp. jari-jari lebih besar.
Makin tinggi potensial ionisasi suatu unsur, makin besar pula elektronegatiftas unsur tersebut.
Dalam sistem periodik, dari atas kebawah
4. Afnitas elektron
Afnitas elektron suatu unsur adalah besarnya
energi yang dilepaskan apabila atom unsur itu menangkap sebuah elektron dari luar.
Bila potensial ionisasi merupakan ukuran kemampuan suatu unsur untuk berubah menjadi ion positif, maka afnitas elektron