STRUKTUR ATOM DAN
SISTEM PERIODIK
UNSUR
Nama Kelompok Santika Nurkholipah
Rahma Affifah
Anastacia Mellia .s
Domas Andini
TEORI DAN MODEL ATOM
A. Teori Atom Bohr dan Teori Mekanika Kuantum
Bohr yang menyatakan:
1. Elektron dalam atom mempunyai tingkat energi tertentu atau elektron bergerak mengelilingi inti dalam lintasan tertentu.
2. Pada lintasannya elektron tidak menyerap atau memancarkan energi. 3. Elektron dapat pindah dari satu tingkat ke tingkat energi yang lain. Jika elektron pindah ke tingkat energi yang lebih tinggi elektron tersebut dikatakan dalam keadaan tereksitasi.
Pada tahun 1923 Louis de Broglie mengemukakan bahwa semua materi
memiliki sifat gelombang dan setiap partikel yang bergerak memiliki sifat gelombang dengan panjang gelombang tertentu. Elektron yang bergerak mengelilingi inti,
gerakannya seperti sebuah gelombang, keberadaan dalam lintasannya tidak pasti.
Hal ini tidak sesuai dengan yang dikemukakan Bohr yaitu elektron bergerak pada lintasan tertentu.
Pada tahun 1926 Erwin Schrodinger dan Werner Heisenberg mengemukakan teori bahwa lokasi elektron dalam atom tidak dapat ditentukan secara pasti, yang dapat ditentukan hanyalah daerah kemungkinan keberadaan elektron. Oleh karena
keberadaan elektron diperkirakan dengan mekanika kuantum maka teori ini disebut teori atom mekanika kuantum.
B. Bilangan Kuantum dan Bentuk Orbital
1. Bilangan Kuantum
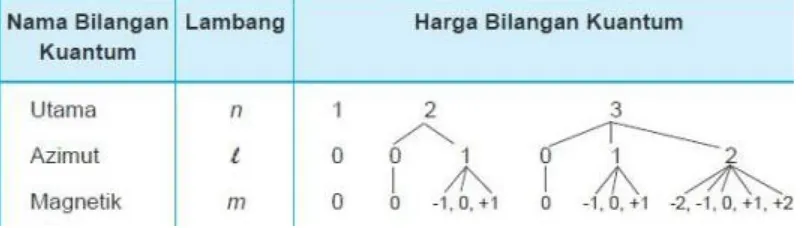
Schrodinger menggunakan tiga bilangan kuantum yaitu bilangan kuantum utama (n), bilangan kuantum azimut (l), dan bilangan kuantum magnetik (m). Ketiga bilangan kuantum tersebut menjelaskan tingkat energi, bentuk, dan orientasi elektron di dalam orbital. Selain ketiga bilangan kuantum tersebut ada bilangan kuantum spin (s) yang menunjukkan perputaran elektron pada sumbunya.
a. Bilangan Kuantum Utama
Bilangan kuantum utama memiliki lambang n. Harga n melambangkan tingkat energi elektron atau kulit elektron. Harga n untuk berbagai kulit elektron yaitu sebagai berikut.
Elektron pada kulit ke-1, memiliki harga n = 1. Elektron pada kulit ke-2, memiliki harga n = 2. Elektron pada kulit ke-3, memiliki harga n = 3. Elektron pada kulit ke-4, memiliki harga n = 4.
Bilangan kuantum azimut memiliki lambang l. Bilangan kuantum azimut
menyatakan tingkat energi elektron pada subkulit. Subkulit elektron mempunyai lambang s, p, d, f. Huruf-huruf tersebut berasal dari kata sharp (s), principal (p), diffuse (d), dan fundamental (f) yang diambil dari nama-nama seri spektrum unsur. Harga l untuk berbagai subkulit yaitu sebagai berikut.
Elektron pada subkulit s memiliki harga l = 0 Elektron pada subkulit p memiliki harga l = 1 Elektron pada subkulit d memiliki harga l = 2 Elektron pada subkulit f memiliki harga l = 3
Hubungan harga n dengan l adalah harga l mulai dari 0 sampai dengan n-1.
Contoh:
Jika n = 1 maka l = 0. Jika n = 2 maka l = 0, 1. Jika n = 3 maka l = 0, 1, 2. Jika n = 4, maka l = 0, 1, 2, 3.
c. Bilangan Kuantum Magnetik
Bilangan kuantum magnetik memiliki lambang m yang menunjukkan arah orbital elektron. Bilangan kuantum magnetik menyatakan jumlah orbital pada subkulit elektron. Bilangan kuantum ini bernilai negatif, nol, dan positif. Secara
matematika harga m dapat ditulis mulai dari -l sampai dengan +l. Harga m untuk berbagai l atau sib kulit.
Tabel 1.1 Harga m untuk berbagai subkulit
Tabel 1.2 Harga bilangan kuantum n, l, danm untuk berbagai bilangan kuantum
Bilangan kuatum spin dengan
lambang s, menyatakan arah perputaran elektron pada sumbunya.
Bilangan kuantum suatu elektron di dalam orbital dapat memiliki harga
spin + 1/2 dan -1/2,tetapi kesepakatan para tokoh kimia,untuk elektron pertama didalam orbital harga spinnya =+1/2.
Contoh Soal
2. Bentuk Orbital
Elektron-elektron bergerak pada setiap orbitalnya. Orbital-orbital mempunyai
bentuk yang berbeda-beda sesuai dengan arah gerakan elektron di dalam atom.Bentuk berbagai orbital adalah sebagai berikut:
a. Orbital s
Orbital s digambarkan berbentuk bola dengan inti sebagai pusat.
b. Orbital p
c. Orbital d
Bentuk orbital d terdiri atas lima orbital yaitu dx2 –y2 , dxz, dz2 , dxy, dan dyz.
C. Konfigurasi Elektron
Konfigurasi elektron merupakan distribusi elektron-elektron di dalam orbitalorbital suatu atom. Distribusi elektron didasarkan pada tingkat-tingkat energi dari
orbital. Konfigurasi elektron harus memenuhi berbagai aturan atau prinsip. Berikut ini dijelaskan beberapa aturan atau prinsip tentang konfigurasi elektron
1. Prinsip Aufbau
Subkulit atau orbital-orbital elektron mempunyai tingkat energi yang berbeda. Tingkat-tingkat energi dan subkulit elektron dari periode ke-1 sampai ke-7 digambarkan seperti Gambar 1.5(a).
Urutan subkulit dari energi terendah sampai tertinggi yaitu sebagai berikut. 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d, 7p, 6f, 7d
Contoh:
Konfigurasi elektron dari atom-atom 2He, 3Li, 7N, 11Na, 18Ar, 22Ti, dan 26Fe adalah sebagai barikut:
Prinsip Aufbau adalah:
Elektron-elektron dalam suatu atom selalu berusaha menempati subkulit yang tingkat energinya rendah. Jika subkulit yang tingkat energinya rendah sudah penuh, baru elektron berikutnya akan mengisi subkulit yang tingkat energinya lebih tinggi.
2. Prinsip Eksklusi atau Prinsip Larangan Pauli
Helium memiliki dua elektron yang terletak pada orbital yang sama. Kedua elektron memiliki harga bilangan kuantum n, l, dan m yang sama, tetapi bilangan kuantum s berbeda yaitu + 1/2
dan – 1/2
. Harga bilangan kuantum masing-masing
elektron pada He adalah: n = 1, l = 0, m = 0, s = + 1/2 dan n = 1, l = 0, m = 0, s = – 1/2
Atas dasar pengamatan ini ahli fisika Austria Wolfgang Pauli merumuskan suatu prinsip yang dikenal dengan prinsip eksklusi atau larangan Pauli. Prinsip larangan Pauli adalah:
Tidak ada dua elektron di dalam atom memiliki empat bilangan kuantum
3. Aturan Hund
Konfigurasi elektron dapat pula ditulis dalam bentuk diagram orbital. Contoh diagram orbital yaitu:
1s 2s 2p
orbital terisi satu elektron.
Misalnya konfigurasi elektron pada diagram orbital dari unsur O dengan nomor atom 8 adalah
Aturan pengisian elektron tersebut sesuai dengan aturan Hund. Aturan Hund menyatakan:
Pada subkulit yang orbitalnya lebih dari satu, elektron-elektron akan mengisi dulu semua orbital, sisanya baru berpasangan.
Contoh Soal
Buat konfigurasi elektron dan diagram orbital dari titanium, besi, nikel, dan tembaga dengan nomor atom berturut-turut 22, 26, 28, dan 29!
Penyelesaian:
Penulisan konfigurasi elektron suatu atom dapat disingkat dengan menuliskan lambang atom golongan VIIIA pada periode sebelumnya diikuti konfigurasi sisanya.
Contoh:
: 1s2 2s2 2p4 ditulis : (He) 2s2 2p4
17Cl : 1s2 2s2 2p6 3s2 3p5 ditulis 17Cl : (Ne) 3s2 3p5 23V : 1s2 2s2 2p6 3s2 3p6 4s2 3d3 ditulis 23V : (Ar) 4s2 3d3
II. SISTEM PERIODIK
Dasar dan Penyusunan Sistem Periodik Unsur Modern
Sistem periodik unsur modern (lihat gambar) disusun berdasarkan kenaikan nomor atom dan kemiripan sifat. Lajur horizontal, yang selanjutnya disebut periode, disusun menurut
kenaikan nomor atom, sedangkan lajur vertikal, yang selanjutnya disebut golongan, disusun menurut kemiripan sifat.
golongan A yang disebut unsur golongan utama, dan unsur-unsur yang menempati golongan B yang disebut unsur transisi (James E. Brady, 1990).
Sistem periodik unsur modern yang disebut juga sistem periodik bentuk panjang, terdiri atas 7 periode dan 8 golongan. Periode 1, 2, dan 3 disebut periode pendek karena berisi sedikit unsur, sedangkan periode lainnya disebut periode panjang. Golongan terbagi atas golongan A dan golongan B. Unsur-unsur golongan A disebut golongan utama, sedangkan golongan B disebut golongan transisi. Golongan-golongan B terletak antara golongan IIA dan IIIA. Golongan B mulai terdapat pada periode 4.
Dalam sistem periodik unsur yang terbaru, golongan ditandai dengan golongan 1 sampai dengan golongan 18 secara berurutan dari kiri ke kanan. Dengan cara ini, maka unsur transisi terletak pada golongan 3 sampai dengan golongan 12. Cara seperti itu dapat dilihat pada sistem periodik unsur pada gambar
a. Periode
Sistem periodik unsur modern mempunyai 7 periode. Unsur-unsur yang mempunyai jumlah kulit yang sama pada konfigurasi elektronnya, terletak pada periode yang sama.
b. Golongan
unsur-unsur tersebut terletak pada golongan yang sama (golongan utama/A).
Ringkasan Materi
Struktur Atom Dan Sistem Periodik Unsur
Apakah yang dimaksud dengan atom? Atom adalah partikel terkecil dari unsur yang masih memiliki sifat unsur yang disusunnya. Atom berukuran sangat kecil sehingga tidak dapat dilihat dengan mata telanjang. Akan tetapi, para ilmuwan mampu menentukan ukuran dan sifat-sifat atom. Penentuan itu diperoleh dari berbagai penelitian yang mereka lakukan. Perkiraan mengenai gambar atom disebut model atom. Karena penelitian mengenai atom dilakukan secara bertahap, model atom mengalami beberapa penyempurnaan atau mengalami perkembangan sesuai teori atomnya.
1. Perkembangan Teori Atom
Teori atom dibuat untuk memudahkan dalam mempelajari atom 1. Teori atom Dalton
1. Atom adalah bahagian terkecil suatu unsur 2. Atom tidak dapat dibagi lagi
3. Atom-atom unsur sejenis mempunyai sifat-sifat yang sama, sedangkan atom-atom unsur tidak sejenis mempunyai sifat-sifat yang berbeda.
4. Reaksi kimia terjadi karena penggabungan dan pemisahan atau pemutusan ikatan antar atom
5. Atom merupakan bola kecil yang keras, padat, dan tidak dapat dibagi lagi
Kelebihan : Teori atom yang pertama kali dikemukan dan didilandasi data ilmiah
Kekurangan :Belum mengemukakan adanya muatan dalam suatu atom 1. Teori Atom Thomson
Atom merupakan bola bermuatan positif serbasama yang mengandung electron
1. Atom merupakan bola bermuatan positif dan ditempat-tempat tertentu terdapat electron yang bermuatan negative.
2. Muatan positif sama dengan muatan negatif, sehingga atom bermuatan netral
Dasarnya : dengan percobaan tabung sinar katode
Kelebihan : sudah mengemukakan adanya muatan atom yaitu muatan positif dan negatif
Kekurangan : belum menggambarkan letak dan lintasan electron dalam suatu atom 1. Ernest Rutherford
1. Atom tersusun atas inti atom yang bermuatan positif karena mengandung proton dan electron yang bermuatan negatif yang beredar mengelilingi inti. 2. Atom bersifat netral, maka jumlah proton dalam inti sama dengan jumlah
electron yang mengelilingi inti.
Dasarnya : hamburan sinar £ dari uranium yang disimpan dalam wadah terbuat dari timbal. Sinar alfa yang keluar diarahkan pada lempeng tipis logam emas.
Kelebihan : sudah mengemukakan adanya electron yang mengelilingi inti
Kelemahan : electron yang bergerak makin lama jatuh keinti dengan lintasan bentuk spiral
1. Neils Bohr
1. Electron beredar mengelilingi inti pada lintasan (n) atau kulit tertentu yang berbentuk lingkaran.
2. Energi electron dalam lintasannya menyatakan tingkat energi. 3. Electron dapat berpindah dari lintasan.
Jika berpindah dari lintasan dalam keluar memerlukan energi.
o Dasarnya : Spektrum Hidrogen
o Kelebihan : Bisa menjelaskan kenapa electron tidak bisa jatuh keinti.
o Kelemahan : tidak dapat menerangkan penguraian garis-garis spectrum atom hidrogen dibawah medan magnet.
1. Model atom modern
1. Electron dalam atom dapat dipandang sebagai partikel gelombang (Broglie) 2. Letak dan kedudukan electron dalam atom tidak dapat dipastikan, yang ada hanyalah kebolehjadian (kemungkinan) electron berada yang disebut orbital (Heisenberg)
3. Gambaran gerakan electron dalam atom berupa gelombang (menurut Schrodinger).
Dasarnya : teori dualisme dan persamaan gelombang.
Kelebihan : bias menerangkan penguraian garis-garis spectrum atom hidrogen.
Gambar model atom
Buatlah gambar model masing-masing teori atomnya! 1. Perkembangan Tabel Periodik Unsur
Pengelompokkan CD dan kaset ditoko kaset ditoko music akan memudahkan pengunjung menemukan barang yang dicari, demikian juga dengan penyusunan unsur-unsur kimia dalam tabel periodik.
Unsur dapat memiliki sifat yang sama atau berbeda, untuk mempermudah mempelajari dilakukan upaya pengelompokkan. Perkembangan pengelompokkan tersebut dimulai dari : 1. Pengelompokkan Unsur Logam dan Non Logam
Oleh : Antonie Lauren Lavoisier
Sampai abad ke-16 Lavoisier mencatat 16 unsur logam dan 7 unsur bukan logam.
Dasar pengelompokkan : Kemiripan sifat fisik
Kelebihan : Merupakan upaya pertama pengelompokkan unsur
Oleh JW Dobereiner
“Jika tiga unsur didalam triade disusun menurut kenaikan massa atomnya, massa atom ditengah sama dengan massa rata-rata unsur ke-1 dan ke-3”
Dasar pengelompokkan : Kenaikan massa atom
kelebihan : Merupakan upaya pertama penggolongan unsur
Kekurangan : tidak berhasil menunjukkan cukup banyak triade. 1. Hukum Oktaf
Oleh John Newlands
“Jika unsur-unsur disusun berdasarkan kenaikan massa atomnya, sifatnya akan berubah secara teratur atau periodik”
Dasar pengelompokkan : kenaikan massa atomnya.
Kelebihan : lebih kompleks dibandingkan hukum triade
Kekurangan : pengulangan setiap delapan unsur hanya cocok untuk unsur-unsur yang massa atomnya kecil/unsur-unsur ringan.
1. Sistem Periodik Meyer Oleh Lothar meyer
“Jika unsur disusun berdasarkan pertambahan massa atomnya, sifat fisis akan berubah dan berulang-ulang secara periodik”
Dasar pengelompokkan : pertambahan massa atom
Kelebihan :
1. Sistem Periodik Mendeleev Oleh Dimitri Mendeleev
“Sifat-sifat unsur merupakan fungsi dari periodik dari massa atom relatifnya”
Dasar pengelompokkan : massa atom relative
Kelebihan : Unsur-unsur yang belum ditemukan dapat diramalkan sifat-sifatnya secara tepat.
1. Sistem Periodik Modern Oleh Mosley
“Sifat-sifat unsur merupakan fungsi periodik dari nomor atomnya”
Dasar pengelompokkan : kenaikan nomor atom
Kelebihan : lebih sempurna dibandingkan periodik Mendeleyev (
Struktur Atom Dan Sistem Periodik Unsur
1. Penentuan Struktur Atom Berdasarkan Tabel Periodik
Penentuan Struktur Atom berhubungan dengan letak unsur dalam tabel periodik, 1. Penentuan Golongan dan Periode Unsur-Unsur dalam tabel periodik
Sistem Periodik Modern terdiri dari periode dan golongan, berdasarkan konfigurasi electron, periode dan golongan suatu unsur dapat ditentukan.
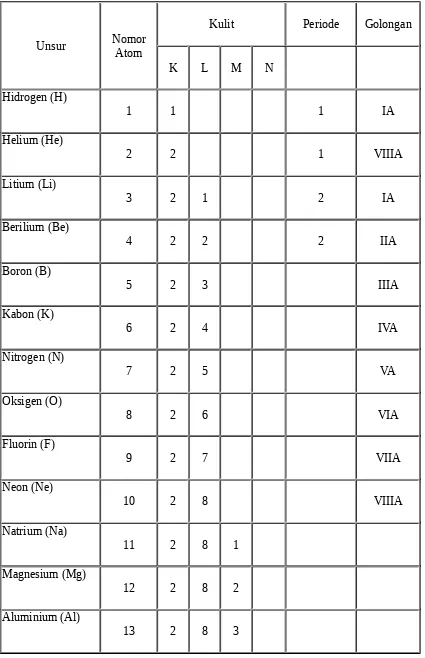
Berdasarkan teori atom Bohr, Konfigurasi elektron menyatakan susunan elektron pada lintasannya. Lintasan elektron disebut dengan kulit atom. Kulit elektron disimbolkan dengan n (n =1 untuk kulit pertama, n=2 untuk kulit kedua dan seterusnya). Kulit atom n = 1, n = 2, n = 3, . . . dinamakan kulit K, L, M, . . . secara umum, konfigurasi elektron untuk atom unsur-unsur ≤ 20 mengikuti aturan berikut,
Pengisian elektron dimulai dari tingkat enenrgi terendah, yakni kulit K.
Jumlah maksimum elektron pada kulit K adalah 2, sedangkan pada kulit L dan M masing-masing 8
Untuk atom dengan nomor atom 19 sampai 20, pengisian elektron sampai kulit N. Untuk unsur golongan utama (IA s/d VIIIA), periode dan golongan dapat ditentukan sebagai berikut:
Nomor Periode : Jumlah kulit (n)
Nomor golongan : Jumlah electron valensi (jumlah elektron pada kulit terluar) Ketentuan ini tidak berlaku untuk He
Tabel kedudukan suatu unsur dalam system periodik berdasarkan konfigurasi elektronnya untuk nomor atom ≤ 20
Silicon (Si)
14 2 8 4 Fosforus (P)
15 2 8 5 Belerang (S)
16 2 8 6 Klorin (Cl)
17 2 8 7 Argon (Ar)
18 2 8 8 Kalium (K)
19 2 8 8 1 Kalsium (Ca)
20 2 8 8 2 1. Periode
Nomor periode dinyatakan oleh ……
Sistem periodik modern terdiri atas 7 periode, yaitu sebagai berikut. Periode 1 berisi 2 unsur, disebut periode pendek
Periode 2 berisi 8 unsur , disebut periode pendek Periode 3 berisi . . . , disebut periode . . . Periode 4 berisi . . . , disebut periode panjang Periode 5 berisi . . . , disebut periode . . .
Periode 6 berisi . . . , disebut periode sangat panjang Periode 7 berisi . . . , disebut periode . . .
1. Golongan
Nomor golongan dinyatakan oleh jumlah . . .
Golongan IA disebut golongan alkali, kecuali H Golongan IIA disebut golongan alkali tanah
Golongan IIIA disebut golongan boron
Golongan IVA disebut golongan karbon
Golongan VA disebut golongan nitrogen
Golongan VIA disebut golongan oksigen
Golongan VIIA disebut golongan halogen
Golongan VIIIA disebut golongan gas mulia
1. Penentuan elektron Valensi dari konfigurasi elektron pada tabel periodik
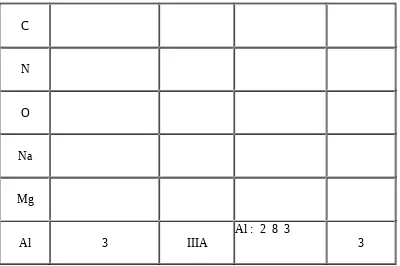
Elektron valensi suatu unsur adalah jumlah elektron yang terdapat pada kulit terluar atom suatu unsur.
Elektron valensi unsur dalam system periodik untuk nomor atom 1 sampai 12 Atom Konfigurasi elektron Elektron Valensi
1H Kedudukan atom dalam system periodik
Unsur
Letak Unsur dalam tabel periodik
C N O Na Mg
Al 3 IIIA
Al : 2 8 3
3
Letak suatu unsur dalam tabel periodik berhubungan dengan struktur atom. Periode dari suatu unsur sama dengan jumlah kulit yang ditempati oleh elektron atom-atomnya, sedangkan golongan menyatakan elektron valensi dari atom- atomnya. Tabel berikut menunjukkan contoh struktur atom beberapa unsu berdasarkan tabel periodik.
Atom Letak unsur dalamtabel periodik Struktur atom Keterangan
11Na Periode ke – 3
Golongan IA
Elektron dari atom-atom natrium menempati 3 kulit elektron dan memiliki 1 elektron valensi
12Mg 13Al
6C 8O
1. Diketahui unsur dengan notasi 17Cl 2. Diketahui unsur dengan
notasi 8O
2-1. Buatlah konfigurasi elektronnya! a. Buatlah konfigurasi elektronnya!
2. Berapakah elektron valensinya? b. Berapakah elektron valensinya?
3. Buatlah gambar struktur atom tersebut! C. Buatlah gambar srtuktur ionnya!
Pembahasan : Pembahasan : 1. 17Cl : 2 8 7 a. 8O2- : 2 8
K L M K L
2. Elektron valensi = 7 b. elektron valensi = 2 3. Gambar struktur atomnya : c. Gambar struktur ionnya:
Latihan
1. Tuliskan konfigurasi elektron dan tentukan valensi dari masing-masing spesi dibawah ini !
a. 15P b. 12Mg c. 13Al3+ g. d. O2- e. 11Na+ f. 9F g. 8O h. . 7N3- i. 9F–