STRUKTUR ATOM
DAN SISTEM
MATE
RI
TEORI ATOM DAN
PERKEMBANGAN MODEL ATOM STRUKTUR ATOM
TANDA ATOM
KONFIGURASI ELEKTRON
BERDASARKAN KULIT ATOM (MODEL ATOM NIELS BOHR)
TEORI ATOM MEKANIKA KUANTUM
TEORI ATOM
TEORI ATOM
Democrit us
Democrit
us
Dalton
Dalton
Thomso
Thomso
n
n
DEMOCRIT
US
DEMOCRIT
US
“Semua materi tersusun
dari partikel kecil yang
tidak dapat terbagi lagi
yang disebut
atomos
.
“Semua materi tersusun
dari partikel kecil yang
tidak dapat terbagi lagi
yang disebut
Teori
Atom
Dalton
Bola Pejal
Unsur terdiri dari partikel kecil dan
tidak dapat dibagi lagi yang disebut atom
Unsur terdiri dari partikel kecil dan
tidak dapat dibagi lagi yang disebut atom
Atom tidak dapat diciptakan dan dimusnahkan
Atom tidak dapat diciptakan dan dimusnahkan
Atom- atom dari suatu unsur adalah identik
Atom- atom dari suatu unsur adalah identik
Senyawa terbentuk dari penggabungan atom dari dua jenis unsur/ lebih dengan perbandingan tertentu
Teori Atom Thomson
Percobaan dengan
sinar katoda
Ditemukan partikel bermuatan
negatif
Lanjutan ...
Atom
merupakan bola pejal bermuatan
positif Didalam
atom tersebar
elektron
seperti kismis dalam roti
kismis
Atom tidak bermuatan
Teori Atom Rutherford
Percobaan Rutherford
Sebagian besar volume atom merupakan ruang
kosong
Sebagian besar volume atom merupakan ruang
kosong
Atom tersusun dari inti atom (proton dan
neutron) bermuatan positif dan elektron bermuatan negatif yang mengelilingi inti
Atom tersusun dari inti atom (proton dan
neutron) bermuatan positif dan elektron bermuatan negatif yang mengelilingi inti
Atom bersifat netral Atom bersifat netral
Teori Atom Bohr
Elektron mengelilingi inti atom pada
lintasan
tertentu yang stasioner yang
disebut kulit. Elektron mengelilingi inti atom pada
lintasan
tertentu yang stasioner yang
disebut kulit.
Elektron dapat berpindah
lintasan apabila
menyerap atau memancarkan
energi
Elektron dapat berpindah
lintasan apabila
menyerap atau memancarkan
Struktur
Atom
Struktur
Atom
Elektr
on
Elektr
on
Atom
Atom
Inti
Inti
Proton
Proton
Neutro
n
Partikel Penyusun Atom
Partikel Penyusun Atom
Partik
el
Muata
n
Penemu
Massa
(gram)
Elektro
n
-
J.J. Thomson 9,11 x 10
-28
Proton
+
Goldstein
1,67 x 10
-24
Neutro
n
Netral
Chadwick
James
1,67 x 10
TANDA ATOM
Keterangan :
X = Lambang Unsur
A = Nomor Massa
Z = Nomor Atom
Keterangan :
X = Lambang Unsur
A = Nomor Massa
Z = Nomor Atom
X
A
Nomor Atom (Z)
Pada atom tidak bermuatan
listrik/ netral
Pada atom tidak bermuatan
listrik/ netral
Jumlah muatan positif sama dengan jumlah muatan negatif
Jumlah muatan positif sama dengan jumlah muatan negatif
Nomor Massa (A)
Atom terdiri atas proton, neutron,
dan elektron
Atom terdiri atas proton, neutron,
dan elektron
Massa atom =
Massa elektron << massa proton dan massa neutron, maka massa elektron dapat
diabaikan
Massa elektron << massa proton dan massa neutron, maka massa elektron dapat
diabaikan
Komposisi Ion
Ion –> Atom yang
bermuatan listrik
Ion –> Atom yang
bermuatan listrik
Ion positif
(Kation)
⇒
Atom yang
melepaskan
elektron
Ion positif
(Kation)
⇒
Atom yang
melepaskan
elektron
Ion negatif
(Anion)
⇒
Atom yang
menerima
elektron
Ion negatif
(Anion)
⇒
Atom yang
Berdasarkan nomor atom dan
nomor massa
Ato
berbeda dan A sama
Unsur dengan Z
berbeda dan A sama dengan
jumlah neutron
sama Unsur dengan
jumlah neutron
sama
Konfigurasi elektron berdasarkan
kulit atom (Model atom Niels Bohr)
• Elektron mengelilingi
inti pada lintasan/ kulit tertentu yang disebut kulit atau tingkat energi
• Konfigurasi elektron
menyatakan susunan elektron pada atom
Nomo
r kulit Nama kulit
Konfigurasi elektron beberapa atom
Tanda
atom elektronJumlah Konfigurasi elektron
3Li 3 2 1
12Mg 12 2 8 2 17Cl 17 2 8 7
19K 19 2 8 8 1 31Ga 31 2 8 18 3
>> Jumlah elektron yang menempati kulit terluar disebut elektron valensi.
>> Elektron valensi hanya boleh mengandung maksimal 8 elektron >> Jumlah elektron yang menempati kulit terluar disebut elektron
valensi.
Teori Atom Mekanika
Kuantum
Max Planck
Atom suatu zat hanya dapat menyerap/ memancarkan energi pada paket- paket gelombang tertentu yang disebut “kuanta”
Louis de Broglie
Materi dapat bersifat sebagai partikel dan sekaligus dapat mempunyai sifat sebagai gelombang
Prinsip Ketidakpastian Heisenberg
Akibat dualisme materi, letak dan kecepatan elektron tidak dapat dipastikan secara
Persamaan gelombang
Schrodinger
Persamaan gelombang yang digunakan
untuk mendeskripsikan keberadaan elektron dalam atom, dikenal dengan bilangan
kuantum
Orbit
al
Daerah/ ruang disekitar inti atom
yang mempunyai peluang terbesar /kebolehjadian untuk
menemukan elektron
Bentuk- bentuk orbital
Bilangan
kuantum
Bilangan
kuantum
Bilangan
kuantum
utama (n)
Bilangan
kuantum
utama (n)
Bilangan
kuantum
azimut (l)
Bilangan
kuantum
azimut (l)
Bilangan
kuantum
magnetik
(m)
Bilangan
kuantum
magnetik
(m)
Bilangan
kuantum
spin (s)
Bilangan
kuantum
Bilangan kuantum
utama (n)
Kulit K
L
M
N
O
P
Q
Nilai
n
1
2
3
4
5
6
7
Menentukan besarnya tingkat
energi suatu elektron yang
mencirikan ukuran orbital
Menentukan besarnya tingkat
energi suatu elektron yang
Bilangan kuantum
azimut (l)
Harg
a l
0
1
2
3
4
5
6
Subk
ulit
s
p
d
f
g
h
i
Menyatakan subtingkat energi
(subkulit) yang menunjukkan
bentuk orbital
Menyatakan subtingkat energi
(subkulit) yang menunjukkan
Bilangan kuantum
magnetik (m)
Subk
ulit l Jumlah Orbital (2l + 1) m (-l….+l)
s 0 1 0
p 1 3 -1, 0, +1
d 2 5 -2, -1, 0, +1, +2 f 3 7 -3, -2, -1, 0, +1,
+2, +3
Menentukan arah orientasi dari
orbital didalam ruang relatif
terhadap orbital lain
Menentukan arah orientasi dari
orbital didalam ruang relatif
Bilangan kuantum spin (s) menyatakan rotasi elektron.
s dapat mempunyai nilai +½ (dinyatakan dengan tanda )
s dapat mempunyai nilai -½ (dinyatakan dengan tanda )
Bilangan kuantum spin (s) menyatakan rotasi elektron.
s dapat mempunyai nilai +½ (dinyatakan dengan tanda )
s dapat mempunyai nilai -½ (dinyatakan dengan tanda )
Bilangan kuantum spin tidak berhubungan secara langsung dengan tiga bilangan kuantum
lainnya
Bilangin kuantum spin
(s)
Aturan
menulisk
an
konfigura
si
elektron
Aturan Aufbau
Laranga n Pauli
Aturan Hund
KONFIGURASI ELEKTRON BERDASARKAN ORBITAL
Aturan
Aufbau
Elektron mempunyai
kecenderungan
untuk menempati
subkulit dengan
tingkat energi lebih
Larangan Pauli
Larangan pauli menyatakan bahwa
didalam satu atom tidak boleh
terdapat dua elektron dengan empat
bilangan kuantum yang sama
Kulit
n
l
m
s
L
2
0
0
+½
Aturan Hund
Diagram Orbital
1s 2s 2p
Pada orbital yang memiliki tingkat
energi sama, pengisian elektron dalam
orbital dilakukan dengan spin sejajar
terlebih dahulu (setengah penuh).
Contoh =
8O : 1s
22s
2Contoh penulisan
konfigurasi elektron
Ato
m
Konfigurasi elektron
2
He
1s2 [He]4
Be
1s2 2s2 [He] 2s210
Ne
1s2 2s2 2p6 [Ne]17
Cl
1s2 2s2 2p6 3s2 3p5 [Ne] 3s2 3p5 18Ar
1s2 2s2 2p6 3s2 3p6 [Ar]24
Cr
1s2 2s2 2p6 3s2 3p6 4s13d5
Penyimpangan dari
Aturan Umum
Contoh :
Unsu
r
Konfigurasi Elektron
Kurang
stabil
Stabil
24
Cr
[Ar] 4s
23d
4[Ar] 4s
13d
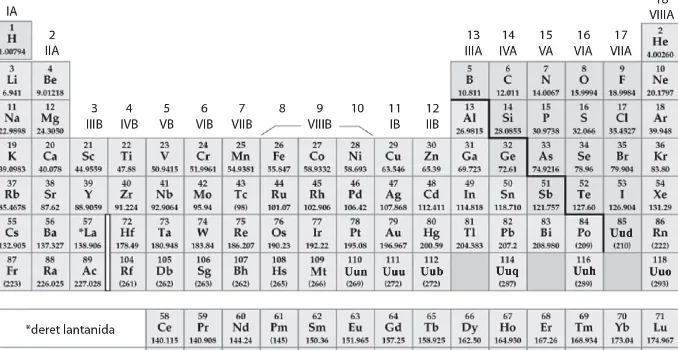
5SISTEM PERIODIK UNSUR
SISTEM PERIODIK UNSUR
Perkembangan sistem periodik
Logam
dan
Nonloga
m
Triade
Doberein
Sistem
Periodik
Mendele
ev
Sistem
Periodik
Triade
Dobereiner
“Berdasarkan massa atom relatifnya,
unsur – unsur dapat dikelompokkan
ke dalam kelompok tiga unsur
dimana massa unsur yang ditengah
merupakan rata- rata dari massa
unsur ditepi”
“Berdasarkan massa atom relatifnya,
unsur – unsur dapat dikelompokkan
ke dalam kelompok tiga unsur
dimana massa unsur yang ditengah
merupakan rata- rata dari massa
unsur ditepi”
Triade Ar Rata- rata Ar unsur pertama dan ketiga
Kalsium 40 Stronsiu
Teori Oktaf Newlands
“Jika unsur- unsur disusun berdasarkan kenaikan massa atom, maka sifat unsur tersebut akan
MENDELEEV
“Unsur-unsur disusun 12 baris mendatar (periode)
berdasarkan kenaikan massa atom dan 8 kolom
tegak (golongan) berdasarkan kemiripan
sifat.”
“Unsur-unsur disusun 12 baris mendatar (periode)
berdasarkan kenaikan massa atom dan 8 kolom
tegak (golongan) berdasarkan kemiripan
sifat.”
Mendeleev menyiapkan tempat kosong dengan keyakinan banyak unsur
yang belum ditemukan Mendeleev menyiapkan
tempat kosong dengan keyakinan banyak unsur
MODERN
H. G. J. Moseley membuat sistem periodik modern
untuk menyempurnakan klasifikasi unsur Mendeleev
“Unsur-unsur dalam satu periode disusun berdasarkan
kenaikan nomor atom dan unsur dalam satu golongan disusun berdasarkan kemiripan
Penentuan periode dan golongan
Konfigurasi elektron
valensi Golongan Utama Periode
ns1 IA n
Periode : Nomor kulit terluar
Periode : Nomor
kulit terluar Golongan : Jumlah elektron valensi Golongan : Jumlah
SIFAT- SIFAT KEPERIODIKAN
Jari- jari atom
Keelektronegat
ifan
Energi ionisasi
Afinitas
elektron
Logam dan
Jari- jari
atom
Jarak dari inti atom sampai kulit elektron terluar yang ditempati elektron
Jumlah kulit bertambah maka jari-jari makin besar
Jumlah kulit bertambah maka jari-jari makin besar
Jumlah kulit sama tetapi muatan inti makin besar, gaya tarik inti
terhadap elektron makin kuat, maka jari-jari makin kecil
Jumlah kulit sama tetapi muatan inti makin besar, gaya tarik inti
terhadap elektron makin kuat, maka jari-jari makin kecil
Energ
i
ionisa
si
Energi minimum yang dibutuhkan suatu atom untuk melepaskan satu
Jumlah kulit bertambah, jari-jari makin besar, tarikan inti lemah,
maka energi ionisasi kecil
Jumlah kulit bertambah, jari-jari makin besar, tarikan inti lemah,
maka energi ionisasi kecil
Muatan inti bertambah, tarikan inti makin kuat dan elektron terluar sulit lepas, maka energi
ionisasi besar
Muatan inti bertambah, tarikan inti makin kuat dan elektron terluar sulit lepas, maka energi
ionisasi besar
Afinitas
elektron
Energi yang dihasilkan oleh suatu atom apabila suatu atom menerima
Jumlah kulit bertambah, jari-jari makin besar, tarikan inti lemah,
maka afinitas elektron kecil Jumlah kulit bertambah, jari-jari makin besar, tarikan inti lemah,
maka afinitas elektron kecil
Muatan inti bertambah, tarikan inti makin kuat maka afinitas
elektron besar
Muatan inti bertambah, tarikan inti makin kuat maka afinitas
elektron besar
Keelektronegatifan
Kecenderun
gan suatu
atom untuk
menarik
elektron
valensi dari
atom lain
dalam
Jumlah kulit bertambah, jari-jari makin besar, tarikan inti lemah,
maka keelektronegatifan kecil Jumlah kulit bertambah, jari-jari makin besar, tarikan inti lemah,
maka keelektronegatifan kecil Muatan inti bertambah, tarikan
inti makin kuat maka keelektronegatifan besar
Muatan inti bertambah, tarikan inti makin kuat maka
keelektronegatifan besar
Logam dan
nonlogam
Logam
• Konduktor
• Warna mengkilap
khas logam
• Keras dan ulet
Nonlogam
• Non-konduktor
• Titik didih dan titik
leleh rendah
Periode
Sifat logam bertambah Sifat logam bertambah
Sifat nonlogam bertambah Sifat nonlogam
Kereaktif
an
Bergantung pada kecenderungan
melepas atau menerima elektron
Kereaktifan bertambah Kereaktifan bertambah
Kereaktifan menurun kemudian bertambah.
Golongan VIII A (gas mulia) tidak reaktif
Kereaktifan menurun kemudian bertambah.