STRUKTUR ATOM
&
SISTEM PERIODIK UNSUR
OLEH:
FEBRIANTO MANIK, S.Pd.
INDIKATOR
1. Menjelaskan penemuan dan perkembangan
struktur atom, mulai dari teori atom Dalton hingga teori atom modern.
2. Menentukan susunan atom (jumlah proton,
elektron, dan neutron dalam atom) berdasarkan nomor atom dan nomor massa.
3. Mengklasifikasikan atom ke dalam isotop,
isobar, dan isoton berdasarkan nomor atom dan nomor massa.
4. Menentukan konfigurasi elektron dan elektron
valensi.
5. Menentukan bilangan - bilangan kuantum dan
ATOM
A= Tidak dapat Tomos = Dibagi
Pengertian Atom
Jadi atom itu apa yah?
Bahasa Yunani
Atomos
Lima abad sebelum Masehi, filsuf dari
Yunani yang
bernama Democritus menjelaskan dan
percaya bahwa semua materi (zat) tersusun dari partikel
yang sangat kecil dan tidak dapat
PERKEMBANGAN MODEL ATOM
J. Dalton J.JThomson Rutherford Niels Bohr MekanikaKuantum
Sifat Sama
= 1 atom Besi
Paku
Unsur Besi
Sifat Sama
= 1 atom Emas
Emas
Unsur Emas yang dapat kamuDari gambar apa
Digiling
Menurut Dalton atom
Pada tahun 1808, John Dalton mengemukakan gagasannya tentang atom sebagai partikel penyusun materi.
Teori atom Dalton adalah sebagai berikut.
1. Materi terdiri atas partikel-partikel terkecil yang tidak dapat dibagi yang disebut dengan atom dan digambarkan sebagai bola pejal yang sangat kecil.
2. Atom satu unsur sama dalam segala hal, tetapi berbeda dari atom unsur lain.
3. Atom dapat bergabung satu sama lain secara kimia membentuk molekul dengan perbandingan sederhana.
4. Molekul terbentuk dari penggabungan atom beberapa unsur. 5. Atom suatu unsur adalah permanen, tidak dapat diuraikan,
Model atom Dalton ternyata mempunyai kelemahan.
Teori atom Dalton tidak dapat
menerangkan, mengapa larutan dapat menghantarkan arus listrik. Bola pejal tidak mungkin dapat meng-hantarkan arus listrik.
Listrik adalah elektron yang bergerak. Berarti pada larutan ada partikel lain yang dapat menghantarkan arus
Elektrom ditemukan oleh JJ.Thomson pada tahun
1897. Ia melakukan percobaan dengan sinar
katode.
Kesimpulannya bahwa sinar katode yang
Partikel yang bermuatan listrik negatif tersebut oleh J.J. Thomson disebut elektron dan diberi lambang:
Keterangan:
e = lambang elektron
–1 = muatan elektron 0 = massa elektron
Pada 1911, Robert Andrew Milikan seorang ahli fisika Amerika,
melakukan eksperimen
tetes minyak. Dari eksperimen tersebut dapat ditentukan
muatan listrik elektron yaitu
Teori Atom Thomson
Menurut
Thomson
, atom merupakan bola
pejal yang bermuatan positif dan
Pada tahun 1886, Goldstein
menemukan bahwa
bila pada katode diberi lubang, maka gas di
belakang katode menjadi berpijar. Hal ini
Keterangan:
Radiasi tersebut disebut
sinar
anode
atau
sinar positi
f atau
sinar terusan
. Partikel sinar
terusan terkecil diperoleh dari
gas hidrogen. Partikel ini
Laju reaksi dipengaruhi oleh :
Teori
Atom Rutherford
Pada tahun 1910,
Ernest Rutherfor
d bersama dua orang
asistennya, yaitu
Hans Geige
r dan
Ernest Marsden
,
Kelemahannya model atom Rutherford yaitu
ketidakmampuan untuk menerangkan mengapa elektron tidak jatuh ke inti atom akibat gaya tarik
elektrostatis inti terhadap elektron.
Berdasarkan satu asas fisika klasik, elektron
sebagai partikel bermuatan bila mengitari inti yang
muatannya berlawanan, lintasannya akan berbentuk spiral sehingga akhirnya
jatuh ke inti.
Pada tahun 1932, James Chadwick, ahli fisika
kebangsaan Inggris melakukan suatu eksperimen.
Caranya, yaitu dengan menembaki atom berilium dengan sinar alfa (α).
Dari hasil penembakan itu terdeteksi adanya partikel tidak bermuatan yang mempunyai massa hampir sama dengan proton. Karena sifatnya netral, partikel tersebut dinamakan neutron dan tergolong partikel dasar karena semua atom mengandung partikel tersebut kecuali isotop hidrogen yang hanya mempunyai proton dan tidak
Neutron ditulis dengan lambang:
Keterangan:
n = lambang neutron 0 = muatan neutron 1 = massa neutron
Tanda Atom
X = lambang atom(= lambang unsur)
Z = nomor atom = jumlah proton (p) = jumlah elektron (e) A = nomor massa = jumlah proton + jumlah neutron = p + n
Contoh:
Jumlah proton, elektron,
dan neutron dalam atom Al
tersebut adalah
proton (
p
) = 13
elektron (
e
) = 13
neutron (
n
) = 27
–
13 =
2.
Nomor atom = 8
Nomor massa = 16
Jumlah proton = 8
Jumlah elektron = 10
Jumlah neutron = 8
1
Nomor atom = 11
Nomor massa = 23
Jumlah proton = 11
Jumlah elektron = 10
Jumlah neutron = 12
Bagaimana cara menentukan jumlah proton, elektron dan
neutron untuk atom bermuatan???
Proton = Nomor Atom
Elektron = Nomor atom - Muatan
Isobar adalah atom-atom unsur dengan nomor atom berbeda, tetapi nomor massanya sama.
Contoh:
isobar dengan
Teori
Atom Niels Bohr
Percobaan
Spektrum Atom Hidrogen
Oleh Niels Bohr
Warna spektrum garis menunjukkan panjang gelombang tertentu. Hal ini menunjukkan adanya tingkat energi tertentu di dalam suatu atom, sesuai
Menurut Bohr, spektrum garis menunjukkan bahwa elektron dalam atom hanya dapat beredar pada lintasan-lintasan dengan tingkat energi tertentu. Lintasan eletron tersebut berupa lingkaran dengan jari-jari tertentu yang disebut sebagai kulit atom. Setiap kulit ditandai dengan suatu bilangan yang disebut bilangan kuantum (n).
Bohr berhasil merumuskan jari-jari lintasan dan energi elektron pada atom hidrogen sebagai berikut.
Bilangan kuantum (n) 1 2 3 4 dan seterusnya
Lambang kulit K L M N dan seterusnya
r = nn 2 a0
Model atom hidrogen menurut Niels Bohr
adalah sebagai berikut.
1. Atom terdiri atas inti yang bermuatan positif
dan di sekitarnya beredar elektron-elektron
yang bermuatan negatif.
2. Dalam atom, elektron beredar mengelilingi
inti atom pada lintasan (orbit) tertentu yang
dikenal sebagai keadaan gerakan yang
3. Sepanjang elektron berada dalam lintasan stasioner energi akan konstan,
sehingga tidak ada cahaya yang dipancarkan maupun diserap.
4. Elektron hanya dapat
berpindah dari lintasan yang lebih rendah ke lintasan yang lebih tinggi jika menyerap
energi. Sebaliknya, jika elektron berpindah dari lintasan yang tinggi ke lintasan rendah terjadi pembebasan energi.
Kedudukan elektron dalam atom tidak tersebar
sembarangan tetapi menempati kulit atom. Kedudukan elektron pada kulit-kulit atom tersebut dinamakan
Sifat kimia suatu unsur ditentukan oleh jumlah
elektron atau susunan elektron dalam suatu atom.
Penyebaran elektron atau jumlah elektron
maksimal pada semua kulit suatu atom secara
matematis dirumuskan sebagai berikut.
Pengisian atau penyebaran elektron pada kulit atom dinamakan konfigurasi elektron. Pengisian elektron pada kulit atom
mempunyai aturan-aturan tertentu, yaitu sebagai berikut.
1. Jumlah maksimal elektron pada suatu kulit memenuhi
2n
2. 2. Jumlah maksimal pada kulit terluar adalah 8. Hal inidisebabkan pada sistem periodik hanya ada 8 golongan. 3. Pada keadaan normal, pengisian elektron dimulai dari kulit
bagian dalam (kulit K). Untuk atom unsur dengan nomor
atom 1 sampai dengan 18, kulit bagian luar diisi setelah kulit bagian dalam terisi penuh.
Contoh:
a. Atom C, jumlah elektronnya = 6 Konfigurasi elektron: K L
2 4 b. Atom Na, jumlah elektronnya = 11
Konfigurasi elektron: K L M
Kelemahan model atom Bohr
adalah hanya dapat menerangkan
spektrum
dari
atom
hidrogen
secara
akurat
tetapi
gagal
Planck dan Einstein menyatakan bahwa radiasi energi selain
bersifat gelombang juga bersifat partikel.
Louis de Broglie mengemukakan teorinya bahwa materi yang
bergerak selalu disertai
gelombang. Jadi, partikel selain bersifat materi juga dapat bersifat gelombang.
Bentuk gelombang yang
Werner Heisenberg (1927) membuktikan bahwa kedudukan partikel seperti elektron tidak dapat ditentukan dengan pasti pada saat yang sama. Konsep Heisenberg itu dikenal sebagai konsep ketidakpastian Heisenberg.
Elektron tidak mungkin mempunyai orbit (kulit) yang pasti dalam mengelilingi inti, yang mungkin dapat ditentukan adalah
kebolehjadian menemukan elektron di daerah tertentu dalam atom. Daerah atau ruang tempat elektron dapat ditemukan
disebut orbital. Orbital merupakan tingkat energi tertentu dalam atom. Besar, bentuk, dan kedudukan dalam ruang suatu orbital ditentukan berdasarkan teori mekanika gelombang atau
Model Atom Mekanika Kuantum
Pada tahun 1926, Shrödinger
mengajukkan suatu persamaan,
kini
disebut
persamaan
gelombang Shrödinger, untuk
mendeskripsikan
keberadaan
elektron dalam atom.
Dalam teori atom mekanika kuantum, posisi elektron
tidak dipastikan. Hal yang dapat dikatakan tentang
posisi elektron adalah peluang menemukan elektron
pada setiap titik dalam ruang di sekitar inti.
Bilangan Kuantum
Untuk menentukan kedudukan atau posisi elektrondalam atom secara teoretis dilakukan dengan menggunakan bilangan kuantum.
Ada empat bilangan kuantum, yaitu bilangan kuantumutama (n), bilangan kuantum azimut (l), bilangan
kuantum magnetik (m), dan bilangan kuantum spin (s).
Bilangan kuantum utama, azimut, dan magnetikmenyatakan posisi suatu elektron dalam atom,
Elektron berada pada tingkat energi tertentu. Bilangan kuantum utama (n) menyatakan di tingkat energi utama
(kulit) mana elektron berada. Nilai n dari bilangan kuantum utama adalah satu sampai dengan tujuh.
Bilangan kuantum azimut menyatakan di subkulit mana elektron berada. Orbital dinyatakan dalam
lambang s untuk l = 0, p untuk l = 1, d untuk l = 2, dan f untuk l = 3. Banyaknya orbital pada tiap tingkat
Bilangan kuantum magnetik menyatakan di orbital mana elektron berada. Nilai bilangan kuantum magnetik (m)
tergantung pada harga bilangan kuantum azimut (l), yaitu dari
– l sampai dengan + l . Orbital biasanya digambarkan dalam
bentuk segi empat.
1. Orbital s (l = 0) mempunyai harga m = 0. Artinya, orbital s hanya ada satu.
2. Orbital p (l = 1) mempunyai harga m = –1, 0, +1.
Artinya, orbital p ada tiga. Ketiga orbital itu mempunyai tingkat energi yang sama.
3. Orbital d (l = 2) mempunyai harga m = –2, –1, 0, +1, +2. Artinya, orbital d ada lima yang tingkat energinya sama.
4. Orbital f (l = 3) mempunyai harga m = –3, –2, –1, 0, +1, +2, +3. Artinya orbital f ada tujuh, yang memiliki
Bilangan kuantum spin menyatakan ke arah mana elektron berputar.
Jika arah putaran berlawanan maka elektron akan berlaku sebagai kutub magnet yang berlawanan, jadi akan tarik-menarik.
Jika arah putaran searah maka elektron akan tolak-menolak, sehingga satu orbital maksimal hanya berisi dua elektron.
Masing-masing elektron mempunyai harga s = (searah
jarum jam) dan s = (berlawanan arah jarum jam).
Elektron di dalam orbital digambarkan dengan anak panah, yang dikenal dengan diagram orbital.
Harga s = digambarkan dengan anak panah ke atas:
Harga s = digambarkan dengan anak panah ke bawah:
Jika orbital terisi penuh elektron maka digambarkan dengan anak panah ke atas dan ke bawah: .
Satu orbital maksimal berisi dua elektron maka:
– orbital s maksimal berisi 2 elektron:
– orbital p maksimal berisi 6 elektron:
– orbital d maksimal berisi 10 elektron:
Bentuk-bentuk orbital s
Asas aufbau
menyatakan bahwa
pengisian elektron pada orbital dimulai dari
tingkat energi terendah ke tingkat energi yang lebih tinggi.
Orbital s mempunyai tingkat energi terendah dan berturut-turut makin tinggi untuk orbital p, d,
Asas larangan Pauli menyatakan bahwa tidak mungkin dalam satu atom ada dua elektron yang harga keempat bilangan
kuantumnya sama.
Contoh:
Li (n.a Na = 3): Elektron pertama dan kedua dari atom litium mempunyai harga keempat bilangan kuantum yang sama dengan elektron pertama dan
elektron kedua helium. Bilangan kuantum elektron ketiga litium adalah sebagai berikut.
n = 2 m = 0 l = 0 s =
Pada orbital yang memeiliki tingkat energi
yang sama elektron
–
elektron akan
tersebar kesemua orbital dengan arah spin
yang sejajar (spin sama), selanjutnya orbital
diisi dengan elektron berikutnya dengan
arah spin yang berlawanan
Contoh:
C (n.a C = 6):
Tulislah konfigurasi elektron unsur-unsur berikut.
Menyingkat Penulisan Konfigurasi
Elektron dengan Menggunakan
Konfigurasi Elektron Gas Mulia
Coba kerjakan!!
8
O : 1s
22s
22p
48
O : [He] 2s2 2p4
17
Cl : 1s
22s
22p
63s
23p
517
Cl :
23
V : 1s
22s
22p
63s
23p
64s
23d
3Pada tabel periodik ini lajur-lajur horizontal yang disebut periode disusun berdasarkan kenaikan nomor atom, sedangkan lajur
vertikal yang disebut golongan disusun berdasarkan kemiripan sifat.
Unsur-unsur blok s dan blok p masuk dalam golongan utama (golongan A), sedangkan unsur-unsur blok d dan blok f masuk dalam golongan transisi (golongan B).
Golongan ditentukan oleh jumlah elektron valensi atomnya,
sedangkan periode ditentukan oleh jumlah tingkat energi utama (kulit) atom yang sudah terisi elektron.
Sistem Periodik dan Konfigurasi
Elektron
Oleh karena elektron valensi khas bagi setiap unsur, maka kita dapat menentukan letak unsur dalam sistem periodik berdasarkan elektron valensinya, atau
Unsur-unsur yang tersusun dari atom dengan konfigurasi elektron terakhirnya berada pada orbital s, termasuk
unsur-unsur blok s.
Contoh:
Na (n.a = 11): Unsur Na terletak pada
golongan IA, periode 3, blok
s
Unsur-unsur yang tersusun dari atom dengan
konfigurasi elektron terakhirnya berada pada
orbital s
dan orbital p
termasuk unsur-unsur
blok p.
Contoh:
Al (n.a = 13): Unsur Al terletak pada
golongan IIIA, periode 3, blok p
Untuk unsur blok
d
, elektron valensi adalah elektron
pada tingkat energi utama (kulit) terluar dan elektron
pada orbital
d
dari tingkat energi utama (kulit) kedua
terluar.
Contoh:
Sc (n.a = 21): Unsur Sc terletak pada
golongan IIIB, periode 4, blok d
Atom unsur blok f mempunyai elektron valensi orbital s
pada tingkat energi utama (kulit) terluar dan elektron pada orbital f dari tingkat energi utama (kulit) ketiga terluar. Blok f terdiri dari dua golongan, yaitu golongan lantanida dan
golongan aktinida. Contoh:
N
A
Unsur Nd, Ho, dan Yb terletak pada golongan lantanida,
periode 6, blok d
Unsur Am, Fm, dan No terletak pada golongan aktinida,
Elektron Valensi Atom Unsur Blok s
Elektron Valensi Atom Unsur Blok p
Elektron Valensi Atom Unsur Blok d
Pada awalnya unsur-unsur digolongkan ke dalam unsur logam dan nonlogam.
Sifat yang dimiliki logam, yaitu dapat menghantarkan listrik dan panas, merupakan benda padat kecuali air raksa, dan
rupanya mengilap. Contoh unsur logam, yaitu besi, tembaga, perak, dan emas.
Johann Wolfgang Döbereiner
pada tahun 1829
menggolongkan unsur-unsur yang mempunyai sifat
sama. Masing-masing kelompok terdiri atas tiga unsur
yang disebut
triad
.
Dalam satu triad
massa
atom relatif unsur yang
terletak di tengah
merupakan harga
rata-rata massa atom relatif
unsur yang pertama dan
yang ketiga
. Penemuan
Döbereiner disebut
John Alexander Reina Newlands (1838–1898) seorang ahli kimia bangsa Inggris pada tahun 1864 menyusun unsur-unsur berdasarkan kenaikan massa atom relatif.
Ia mendapatkan bahwa unsur kedelapan mempunyai sifat kimia yang mirip dengan unsur pertama, unsur kesembilan
mempunyai sifat yang mirip dengan unsur kedua, dan seterusnya.
Kelemahan hukum oktaf adalah pengulangan setiap delapan unsur itu hanya cocok untuk unsur-unsur yang massa atomnya kecil dan pengelompokan terlalu dipaksakan.
Sebagai contoh pada tahun tersebut unsur H, F, dan Cl
mempunyai sifat yang mirip, begitu pula dengan O, S, dan Fe berada dalam lajur vertikal sehingga dapat dikatakan
Menurut Mendeleyev, sifat-sifat unsur merupakan fungsi
periodik dari massa atom relatifnya. Unsur-unsur yang sifatnya serupa ditempatkan pada satu lajur tegak yang disebut golongan.
Pengelompokan ini lebih mengutamakan kesamaan sifat unsur-unsur daripada kenaikan massa atom relatifnya, sehingga tersisa tempat-tempat yang kosong dalam
tabel periodik yang terbentuk.
Tempat-tempat kosong tersebut menurut Mendeleyev kelak akan diisi dengan unsur-unsur yang akan
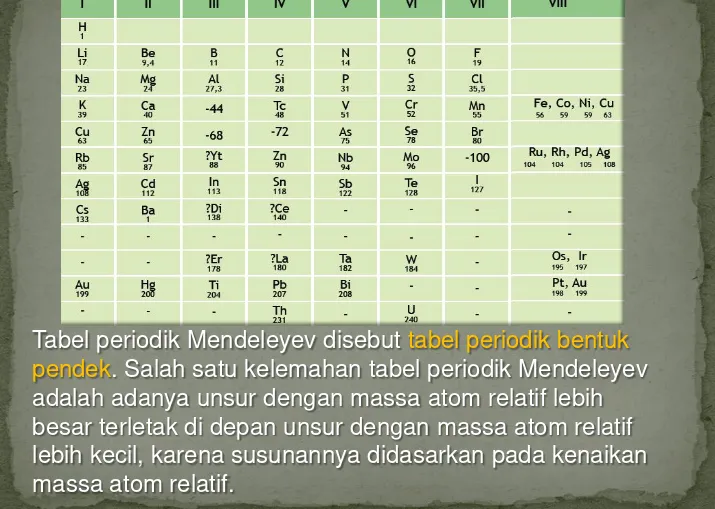
Tabel periodik Mendeleyev disebut tabel periodik bentuk pendek. Salah satu kelemahan tabel periodik Mendeleyev adalah adanya unsur dengan massa atom relatif lebih
Tabel periodik modern yang sekarang digunakan adalah tabel periodik bentuk panjang.
Tahun 1941, Henry Moseley (1887–1915) melakukan eksperimen dan menyimpulkan bahwa sifat dasar atom adalah nomor atom dan bukan massa atom relatif.
Dengan penemuan itu, hukum periodik Mendeleyev diperbarui menjadi Hukum Periodik Modern yaitu: sifat-sifat unsur merupakan fungsi periodik dari nomor
a. Jari-Jari Atom
Atom terdiri dari inti atom dan elektron. Gaya tarik muatan positif inti atom
terhadap elektron menarik elektron ke arah inti atom, sedangkan gaya tolak antara muatan negatif elektron
mendorong elektron menjauh dari atom. Gabungan gaya tarik inti atom terhadap elektron dengan gaya tolak antar
1. Untuk unsur
golongan utama, dari kiri ke kanan dalam satu periode jari-jari atom
cenderung makin kecil.
2. Untuk unsur
golongan utama, dari atas ke bawah dalam satu
Dalam satu periode dari kiri ke kanan jari-jari atom
cenderung menurun karena meningkatnya kekuatan inti atom menarik elektron, khususnya elektron paling luar.
Dalam satu golongan dari atas ke bawah, nomor atom semakin bertambah.
Muatan inti atom dan kulit atom juga bertambah. Walaupun
dengan bertambahnya muatan
inti atom mengurangi ukuran kulit, tetapi efek penambahan kulit atom lebih dominan. Penambahan nomor kulit atom menyebabkan jarak antara inti atom dengan elektron terluar
b. Energi Ionisasi (Potensial Ionisasi)
Energi ionisasi
adalah energi minimal yang
diperlukan untuk melepaskan satu elektron dari
atom atau ion dalam bentuk gas sampai pada jarak
dimana tidak ada lagi intereaksi di antara ion dan
elektron. Energi ionisasi disebut juga
potensial
ionisasi
.
1. Untuk unsur golongan utama, dari kiri ke kanan
dalam satu periode, energi ionisasi cenderung
makin besar.
c. Afinitas Elektron
Afinitas elektron adalah perubahan energi yang terjadi bila reaksi atom atau ion dengan elektron membentuk ion
negatif dalam keadaan gas.
Besarnya afinitas elektron merupakan ukuran bagaimana kuatnya inti atom menarik elektron.
1. Untuk unsur golongan utama, dari kiri ke kanan dalam satu periode sampai golongan VII, afinitas elektron
cenderung makin besar.