STRUKTUR ATOM DAN SISTEM
PERIODIK UNSUR
PARTIKEL DASAR PENYUSUN ATOM ISOTOP, ISOBAR, & ISOTON
PERKEMBANGAN SPU KONFIGURASI
ELEKTRON
PENUTUP
SIFAT PERIODIK UNSUR PERKEMBANGAN TEORI ATOM
PERKEMBANGAN TEORI ATOM
PERKEMBANGAN
TEORI ATOM
DEMOKRIT
US
DALTON
J.J
THOMSON
RUTHERFO
RD
BOHR
Apakah partikel
terkecil dari
suatu unsur?
Emm..
Emm..
Anu.
.
Anu.
.
ISOTOP, ISOBAR, & ISOTON
PERKEMBANGAN SPU KONFIGURASI
ELEKTRON
PENUTUP
SIFAT PERIODIK UNSUR PARTIKEL DASAR
PERKEMBANGAN TEORI ATOM
PERKEMBANGAN
TEORI ATOM
DEMOKRIT
US
DALTON
J.J
THOMSON
RUTHERFO
RD
BOHR
ISOTOP, ISOBAR, & ISOTON
PERKEMBANGAN SPU KONFIGURASI
ELEKTRON
PENUTUP
SIFAT PERIODIK UNSUR
No. …
No. …
No….
No….
No. …
No. …
No. …
No. …
Kayu jika dibelah terus menerus
akan menghasilkan belahan kayu
yang
paling kecil.
Partikel(belahan terkecil ini
t
idak
dapat dibagi lagi dan disebut
ATOM.
Kayu jika dibelah terus menerus
akan menghasilkan belahan kayu
yang
paling kecil.
Partikel(belahan terkecil ini
t
idak
dapat dibagi lagi dan disebut
ATOM.
PERKEMBANGAN TEORIATOM
ATOM
ATOM
A = tidak,
A = tidak,
TOMos =
TOMos =
dipotong-potong
ISOTOP, ISOBAR, & ISOTON
PERKEMBANGAN SPU KONFIGURASI
ELEKTRON
PENUTUP
SIFAT PERIODIK UNSUR
TEORI ATOM
DEMOKRITUS
PERKEMBANGAN TEORI ATOM
MODEL DAN TEORI ATOM
DALTON
DASAR : Konsep atom demokritus
sesuai dengan hukum
kekekalan massa dan
perbandingan tetap.
TEORI:
1.
Atom adalah bagian terkecil yang
tidak dapat dibagi lagi
2.
Atom berbentuk bola sederhana
yang sangat kecil, tidak dapat
dibelah, diciptakan, ataupun
dimusnahkan
DEMOKRIT
US
DALTON
J.J
THOMSON
RUTHERFO
RD
BOHR
ISOTOP, ISOBAR, & ISOTON
PERKEMBANGAN SPU KONFIGURASI
ELEKTRON
PENUTUP
SIFAT PERIODIK UNSUR
1803 atom
1803 atom
PERKEMBANGAN TEORI ATOM
Benarkah bahwa atom adalah
bagian terkecil dari benda dan
tidak dapat dibagi lagi?
Tidak Benar
Ada partikel yang lebih kecil dari
ukuran atom sebagai penyusun atom
MODEL DAN TEORI ATOM
DALTON
lanjutan
DEMOKRIT
ISOTOP, ISOBAR, & ISOTON
PERKEMBANGAN SPU KONFIGURASI
ELEKTRON
PENUTUP
SIFAT PERIODIK UNSUR
3. Atom suatu unsur semuanya serupa
dan tidak
dapat berubah
menjadi unsur lain
4. Dua atom atau lebih dapat membentuk
molekul; misal H
2O
5. Pada reaksi kimia atom-atom berpisah
dan
bergabung dengan unsur
lain, tetapi
massa seluruhnya
tetap
3. Atom suatu unsur semuanya serupa
dan tidak
dapat berubah
menjadi unsur lain
4. Dua atom atau lebih dapat membentuk
molekul; misal H
2O
5. Pada reaksi kimia atom-atom berpisah
dan
bergabung dengan unsur
lain, tetapi
massa seluruhnya
tetap
Kelebihan Teori Atom Dalton
1. Dapat menjelaskan hukum kekekalan massa.
Jika atom-atom dari unsur-unsur tidak dapat dihancurkan, maka atom-atom yang
sama harus ada setelah reaksi selesai. Seperti halnya sebelum reaksi berlangsung
maka massa keseluruhan dari pereaksi dari hasil reaksi harus sama.
2. Dapat menjelaskan hukum perbandingan tetap.
Kelemahan Teori Atom Dalton
1. Asumsinya bahwa semua atom dari suatu unsur memiliki massa
2. dan sifat yang sama terbukti tidak benar.
Setelah diketemukannya isotop oleh Mc. Coy dan Ross pada
1907. Isotop yang hampir tidak dapat dipisahkan satu sama lain secara kimia,
Mempunyai susunan elektron yang sama tetapi mempunyai massa yang berbeda.
2.
Asumsinya bahwa selama reaksi kimia, atom tidak bisa diciptakan dan
dimusnahkan
(tidak mengalami perubahan), teori ini kurang tepat.
Bagaimana atom dapat saling mengadakan ikatan baik dengan atom-atom lain
yang
sejenis maupun yang tidak sejenis, jika sama sekali tidak mengalami perubahan?
sekarang ditemukan fakta bahwa ada sedikit perubahan energi listrik pada bagian
luar atom sehingga atom dapat mengadakan ikatan satu dengan lainnya.
3.
Teori atom Dalton tidak dapat menerangkan suatu larutan dapat
menghantarkan arus
listrik.
Bagaimana mungkin bola pejal dapat menghantarkan arus listrik? padahal listrik
adalah elektron yang bergerak. Berarti ada partikel lain yang dapat menyebabkan
terjadinya
daya hantar listrik.
PERKEMBANGAN TEORI ATOM
MODEL DAN TEORI ATOM
J.J
THOMSON
DASAR: percobaan dengan
sinar katoda (Penemuan
Elektron)
Click to viev video
Click to viev video
DEMOKRIT
US
DALTON
J.J
THOMSON
RUTHERFO
RD
BOHR
ISOTOP, ISOBAR, & ISOTON
PERKEMBANGAN SPU KONFIGURASI
ELEKTRON
PENUTUP
SIFAT PERIODIK UNSUR PARTIKEL DASAR
PERKEMBANGAN TEORI ATOM
MODEL DAN TEORI ATOM J.J
THOMSON
lanjutan
ATOM BERBENTUK
SEPERTI BOLA YANG
BERMUATAN POSITIF
DAN
ELEKTRON-ELEKTRON TERSEBAR
DALAM BOLA TERSEBUT
Seperti
ROTI KISMIS
Percobaan ini membuktikan
bahwa sinar katode adalah
berkas partikel yang bermuatan
negatif (berkas elektron)
Percobaan ini membuktikan
bahwa sinar katode adalah
berkas partikel yang bermuatan
negatif (berkas elektron)
DEMOKRIT
US
DALTON
J.J
THOMSON
RUTHERFO
RD
BOHR
ISOTOP, ISOBAR, & ISOTON
PERKEMBANGAN SPU KONFIGURASI
ELEKTRON
PENUTUP
SIFAT PERIODIK UNSUR PARTIKEL DASAR
PERKEMBANGAN TEORI ATOM
MODEL DAN TEORI ATOM
RUTHERFORD
DASAR: PERCOBAAN PENEMBAKAN LEMPENG EMAS
DENGAN SINAR KATODA (PENEMUAN INTI ATOM)
DASAR: PERCOBAAN PENEMBAKAN LEMPENG EMAS
DENGAN SINAR KATODA (PENEMUAN INTI ATOM)
DEMOKRIT
US
DALTON
J.J
THOMSON
RUTHERFO
RD
BOHR
ISOTOP, ISOBAR, & ISOTON
PERKEMBANGAN SPU KONFIGURASI
ELEKTRON
PENUTUP
SIFAT PERIODIK UNSUR PARTIKEL DASAR
Lempeng logam Au
Sumbe
r
partikel
alfa(inti
2He
4)
celah
PERKEMBANGAN TEORI ATOM
DEMOKRIT
US
DALTON
J.J
THOMSON
RUTHERFO
RD
BOHR
ISOTOP, ISOBAR, & ISOTON
PERKEMBANGAN SPU KONFIGURASI
ELEKTRON
PENUTUP
SIFAT PERIODIK UNSUR
MODEL DAN TEORI ATOM
RUTHERFORD
lanjutan
Lempeng logam Au
Sumber
partikel
alfa
(inti
2He
4)
celah
+
PERKEMBANGAN TEORIATOM
DEMOKRIT
US
DALTON
J.J
THOMSON
RUTHERFO
RD
BOHR
ISOTOP, ISOBAR, & ISOTON
PERKEMBANGAN SPU KONFIGURASI
ELEKTRON
PENUTUP
SIFAT PERIODIK UNSUR
MODEL DAN TEORI ATOM
RUTHERFORD
lanjutan
Kesimpulan: atom tersusun atas inti
atom yang bermuatan positif sebagai
pusat massa dan dikelilingi
elektron-elektron yang bermuatan negatif
.
PERKEMBANGAN TEORI ATOM
DEMOKRIT
US
DALTON
J.J
THOMSON
RUTHERFO
RD
BOHR
ISOTOP, ISOBAR, & ISOTON
PERKEMBANGAN SPU KONFIGURASI
ELEKTRON
PENUTUP
SIFAT PERIODIK UNSUR
MODEL DAN TEORI ATOM
RUTHERFORD
lanjutan
Kelemahan ;
Tidak bisa menjelaskan mengapa
elektron yang
bermuatan negatif
tidak tertarik ke inti yang bermuatan
positif
1. Atom dalam beredar
mengeliling inti pada tingkat
energi atau kulit-kulit tertentu
2. Atam dalam beredar
mengelilingi inti tanpa
menyerap atau memancarkan
energi kecuali kalau elektron
berpindah
+
Atom
Hidrogen, H
KELEMAHAN : tidak bisa menjelaskan
spektrum atom selain atom hidrogen.
KELEMAHAN : tidak bisa menjelaskan
spektrum atom selain atom hidrogen.
PERKEMBANGAN TEORIATOM
DEMOKRIT
US
DALTON
J.J
THOMSON
RUTHERFO
RD
BOHR
ISOTOP, ISOBAR, & ISOTON
PERKEMBANGAN SPU KONFIGURASI
ELEKTRON
PENUTUP
SIFAT PERIODIK UNSUR
MODEL DAN TEORI ATOM BOHR
PERKEMBANGAN TEORI ATOM
Tokoh
Tokoh
Model Atom
Model Atom
Bukti
Bukti
kelemahan
kelemahan
Dalton
Dalton
Bola pejal
Bola pejal
HUkum Lavoiser,
HUkum Lavoiser,
Proust, dan
Proust, dan
Dalton
Dalton
Atom masih
Atom masih
dapat dibagi
dapat dibagi
lagi
lagi
Thomson
Thomson
Bola dg sebaran
Bola dg sebaran
elektron
elektron
Percobaan
Percobaan
tabung sinar
tabung sinar
katoda
katoda
Elektronnya
Elektronnya
tidak
tidak
bergerak
bergerak
Rutherford
Rutherford
Elektron
Elektron
mengelilingi inti
mengelilingi inti
Percobaan
penembakan
Percobaan
penembakan
lempeng Au
lempeng Au
dengan sinar
dengan sinar
katoda
katoda
Tdk bisa
Tdk bisa
menjelaskan
menjelaskan
mengapa
mengapa
lektron tak
lektron tak
jatuh ke inti
jatuh ke inti
Bohr
Bohr
Orbital elektron
Orbital elektron
Spektra garis
Spektra garis
Hanya
Hanya
berlaku
berlaku
untuk atom
untuk atom
hidrogen
hidrogen
PARTIKEL DASAR PENYUSUN ATOM ISOTOP, ISOBAR, & ISOTON
PERKEMBANGAN SPU KONFIGURASI
ELEKTRON
PENUTUP
SIFAT PERIODIK UNSUR
PROTON, NEUTRON, dan
ELEKTRON
ISOTOP, ISOBAR, & ISOTON
PERKEMBANGAN SPU KONFIGURASI
ELEKTRON
PENUTUP
SIFAT PERIODIK UNSUR
PARTIKEL DASAR PENYUSUN ATOM
PERKEMBANGAN TEORI ATOM
Proton
Proton
Neutron
Neutron
Elektron
Elektron
lambang
lambang
p
p
n
n
e
e
penemu
penemu
Eugen
Eugen
Goldstein
Goldstein
Chadwick
Chadwick
James
James
Thomson
Thomson
J.J.
J.J.
Massa
Massa
(g)
(g)
1,673.10
1,673.10
–
9,11.10
–28–28muatan
muatan
+1
+1
0
0
-1
-1
+
+
proton
neutro
LAMBANG UNSUR
X = lambang Atom (jenis suatu atom)
A = nomor massa (Jumlah proton dan
neutron)
Z = nomor atom (jumlah proton, untuk
atom netral juga menyatakan jumlah
elektron)
N = neutron = A – Z
Contoh:
Na
p = 11,
n= 23-11 = 12,
e = 11
ISOTOP, ISOBAR, &ISOTON
PERKEMBANGAN SPU KONFIGURASI
ELEKTRON
PENUTUP
SIFAT PERIODIK UNSUR
PARTIKEL DASAR PENYUSUN ATOM
PERKEMBANGAN TEORI ATOM
23
23
11
LAMBANG UNSUR
Atom dapat bermuatan positif atau
negatif,
•
Bermuatan positif
melepas
elektron,
contoh : Na
+
Na
Na
+
+ e
-Na
+
maka p = 11, n=12, e = 10
•
Bermuatan negatif
menangkap
elektron
Contoh: Cl
-
Cl + e
-
Cl
-Cl
-
Maka p=17, n = 35-17=18, e= 18
ISOTOP, ISOBAR, & ISOTON
PERKEMBANGAN SPU KONFIGURASI
ELEKTRON
PENUTUP
SIFAT PERIODIK UNSUR
PARTIKEL DASAR PENYUSUN ATOM
PERKEMBANGAN TEORI ATOM
23
23
11
11
Soal
Soal
Tentukan Nomor massa, nomor atom,
jml proton, jml elektron dan jml
neutron dari atom-atom sbb :
Z = 26
ISOTOP, ISOBAR, & ISOTON
PERKEMBANGAN SPU KONFIGURASI
ELEKTRON
PENUTUP
SIFAT PERIODIK UNSUR
PARTIKEL DASAR PENYUSUN ATOM
PERKEMBANGAN TEORI ATOM
Isotop
adalah unsur-unsur sejenis
yang memiliki
nomor atom sama
,
tetapi memiliki massa atom berbeda.
Isotop
adalah unsur-unsur sejenis
yang memiliki
nomor atom sama
,
tetapi memiliki massa atom berbeda.
C
12
6
C
13
6
C
14
6
Contoh :
Contoh :
PERKEMBANGAN SPU KONFIGURASI
ELEKTRON
PENUTUP
SIFAT PERIODIK UNSUR
ISOTOP
ISOTOP, ISOBAR, ISOTON
PERKEMBANGAN TEORI ATOM
ISOTOP
ISOBAR
ISOTON
ISOBAR
Isobar
adalah atom dari unsur
yang berbeda (mempunyai
nomor atom berbeda), tetapi
mempunyai nomor massa yang
sama.
Isobar
adalah atom dari unsur
yang berbeda (mempunyai
nomor atom berbeda), tetapi
mempunyai nomor massa yang
sama.
Contoh :
Contoh :
C
14
6
14
7
N
PERKEMBANGAN SPU KONFIGURASI
ELEKTRON
PENUTUP
SIFAT PERIODIK UNSUR
ISOTOP, ISOBAR, ISOTON
PERKEMBANGAN TEORI ATOM
ISOTOP
ISOBAR
ISOTON
ISOTON
Isoton
adalah atom dari unsur yang
berbeda (mempunyai nomor atom
berbeda), tetapi mempunyai jumlah
neutron sama.
Isoton
adalah atom dari unsur yang
berbeda (mempunyai nomor atom
berbeda), tetapi mempunyai jumlah
neutron sama.
Contoh :
Contoh :
P
31
15
32
16
S
PERKEMBANGAN SPU KONFIGURASI
ELEKTRON
PENUTUP
SIFAT PERIODIK UNSUR
ISOTOP, ISOBAR, ISOTON
PERKEMBANGAN TEORI ATOM
ISOTOP
ISOBAR
ISOTON
KONFIGURASI ELEKTRON
Konfigurasi elektron merupakan susunan
elektron-elektron dalam kulit-kulit atau
subkulit-subkulit.
Konfigurasi elektron merupakan susunan
elektron-elektron dalam kulit-kulit atau
subkulit-subkulit.
KONFIGURASI ELEKTRONISOTOP, ISOBAR, & ISOTON
PENUTUP
SIFAT PERIODIK UNSUR PERKEMBANGAN TEORI ATOM
PERKEMBANGAN SPU PARTIKEL DASAR PENYUSUN ATOM
23
23
11
11
11p
12n
Na
ATURAN PENGISIAN
1.Tiap kulit maksimum mampu
menampung 2
n
2
elektron,
n
adalah nomor kulit.
Kulit K (
n
= 1)
maksimum menampung elektron 2.1
2
=
2
2
.
Kulit L (
n
= 2)
maksimum menampung elektron 2.2
2
=
8
8
.
Kulit M (
n
= 3)
maksimum menampung elektron 2.3
2
=
18.
18.
Kulit N (
n
= 4)
maksimum menampung elektron 2.4
2
=
32.
32.
1.Tiap kulit maksimum mampu
menampung 2
n
2
elektron,
n
adalah nomor kulit.
Kulit K (n = 1)
maksimum menampung elektron 2.1
2
=
2
2
.
Kulit L (n = 2)
maksimum menampung elektron 2.2
2
=
8
8
.
Kulit M (n = 3)
maksimum menampung elektron 2.3
2
=
18.
18.
Kulit N (
n
= 4)
maksimum menampung elektron 2.4
2
=
32.
32.
KONFIGURASI ELEKTRON
ISOTOP, ISOBAR, & ISOTON
PENUTUP
SIFAT PERIODIK UNSUR PERKEMBANGAN TEORI ATOM
PERKEMBANGAN SPU PARTIKEL DASAR PENYUSUN ATOM
KONFIGURASI ELEKTRON
ISOTOP, ISOBAR, & ISOTON
PENUTUP
SIFAT PERIODIK UNSUR PERKEMBANGAN TEORI ATOM
PERKEMBANGAN SPU PARTIKEL DASAR PENYUSUN ATOM
K
L
M
N
2.Pengisian elektron dimulai dari tingkat
energi yang paling rendah (kulit K)
K
L
2
2
K
L
2
2
KONFIGURASI ELEKTRONISOTOP, ISOBAR, & ISOTON
PENUTUP
SIFAT PERIODIK UNSUR PERKEMBANGAN TEORI ATOM
PERKEMBANGAN SPU PARTIKEL DASAR PENYUSUN ATOM
K
L
M
N
2.Pengisian elektron dimulai dari tingkat
energi yang paling rendah (kulit K)
2.Pengisian elektron dimulai dari tingkat
energi yang paling rendah (kulit K)
9
9
4
4
Be
Be
K
L
L
4
Be
e = 4
Konfigurasi elektron:
4
Be
e = 4
ATURAN PENGISIAN
3.Jumlah maksimum elektron di kulit
terluar (elektron valensi) adalah 8
4.Untuk unsur dengan nomor atom
lebih dari 18, kulit bagian luar
diisi, walaupun kulit M belum
terisi penuh
3.Jumlah maksimum elektron di kulit
terluar
(elektron valensi)
adalah 8
4.Untuk unsur dengan nomor atom
lebih dari 18, kulit bagian luar
diisi, walaupun kulit M belum
terisi penuh
KONFIGURASI ELEKTRON
ISOTOP, ISOBAR, & ISOTON
PENUTUP
SIFAT PERIODIK UNSUR PERKEMBANGAN TEORI ATOM
PERKEMBANGAN SPU PARTIKEL DASAR PENYUSUN ATOM
ATURAN PENGISIAN
20
Ca
e = 20
Konfigurasi elektron:
K
L
M
N
20
Ca
e = 20
Konfigurasi elektron:
KONFIGURASI ELEKTRON
Konfigurasi elektron
Konfigurasi elektron
KONFIGURASI ELEKTRON
ISOTOP, ISOBAR, & ISOTON
PENUTUP
SIFAT PERIODIK UNSUR PERKEMBANGAN TEORI ATOM
PERKEMBANGAN SPU PARTIKEL DASAR PENYUSUN ATOM
KONFIGURASI ELEKTRON
Lambang
Lambang
unsur
unsur
Konfigura
si
Konfigura
si
elektron
elektron
Elektron
Elektron
KONFIGURASI ELEKTRON ION
KONFIGURASI ELEKTRON
ISOTOP, ISOBAR, & ISOTON
PENUTUP
SIFAT PERIODIK UNSUR PERKEMBANGAN TEORI ATOM
PERKEMBANGAN SPU PARTIKEL DASAR PENYUSUN ATOM
Atom dapat bermuatan positif atau
negatif,
Ion positif
•
atom melepas elektron
•
umumnya unsur logam
Contoh:
Na
Na
+
+ e
-Konfigurasi e
-
=
2, 8, 1 2, 8
p
= 11
11
e
= -11
-10
Jml muatan
= 0
+1
Atom dapat bermuatan positif atau
negatif,
Ion positif
•
atom melepas elektron
•
umumnya unsur logam
Contoh:
Na
Na
+
+
e
-Konfigurasi e
-
=
2, 8, 1
2, 8
p
= 11
11
e
= -11
-10
KONFIGURASI ELEKTRON : ION
POSITIF
Lambang
unsur
Konfigurasi
elektron
Jumlah
elektron
lepas
Lambang
ion
Konfigurasi
elektron ion
KONFIGURASI ELEKTRON ION
KONFIGURASI ELEKTRON
ISOTOP, ISOBAR, & ISOTON
PENUTUP
SIFAT PERIODIK UNSUR PERKEMBANGAN TEORI ATOM
PERKEMBANGAN SPU PARTIKEL DASAR PENYUSUN ATOM
Ion negatif
•
atom menangkap elektron
•
Umumnya unsur non logam
Contoh:
Cl + e
-
Cl
-Konfigurasi e
-
=
2, 8, 7
2, 8,
8
p
= 17
17
e
= -17
-18
Jml muatan
= 0
-1
Ion negatif
•
atom menangkap elektron
•
Umumnya unsur non logam
Contoh:
Cl +
e
-
Cl
-Konfigurasi e
-
=
2, 8, 7
2, 8,
8
p
= 17
17
e
= -17
-18
KONFIGURASI ELEKTRON : ION
NEGATIF
Lambang
unsur
Konfigurasi
elektron
Jumlah
elektron
ikat
Stela
h
mene
rima
e
-Jml
muat
an
Lambang
ion
Konfigurasi
elektron ion
p
e
9
F
8
O
16
S
35
Br
Lambang
unsur
Konfigurasi
elektron
Jumlah
elektron
ikat
Stela
h
mene
rima
e
-Jml
muat
an
Lambang
ion
Konfigurasi
elektron ion
p
e
9
F
2, 7
1
9
10
-1
F
-2, 8
8
O
2, 6
2
8
10
-2
O
2-2, 8
16
S
2, 8, 6
2
16
18
-2
S
2-2, 8, 8
Lambang
unsur
Konfigurasi
elektron
Jumlah
elektron
ikat
Stela
h
menaj
di ion
e
-Jml
muat
an
Lambang
ion
Konfigurasi
elektron ion
p
e
Se
2-2, 8, 18, 8
Be
2+2
Sr
2+2, 8, 18, 8,
34
Se
2, 8, 18, 6
2
34
36
-2
4
Be
2, 2
2
4
2
+2
38
Sr
2, 8, 18, 8,
2
Apa satuan massa untuk atom?
Apa satuan massa untuk atom?
Ar dan Mr
IUPAC (
The International Union of Pure
and Applied Chemistry
) menetapkan
satuan massa untuk atom
IUPAC (
The International Union of Pure
and Applied Chemistry
) menetapkan
satuan massa untuk atom
Ar dan Mr
ISOTOP, ISOBAR, & ISOTON
PENUTUP
SIFAT PERIODIK UNSUR PERKEMBANGAN TEORI ATOM
PERKEMBANGAN SPU PARTIKEL DASAR PENYUSUN ATOM
Unified atomic mass unit
Unified atomic mass unit
(m
(m
u
u
) =
) =
satuan massa atom (sma)
satuan massa atom (sma)
Unified atomic mass unit
Unified atomic mass unit
(m
(m
u
u
) =
) =
satuan massa atom (sma)
satuan massa atom (sma)
Ar
Massa atom relatif (Ar) adalah
perbandingan massa rata-rata satu
atom unsur terhadap massa satu
atom C-12.
Misal:
Diketahui massa 1 atom
12
C adalah
12,00 sma. Tentukan Ar dari unsur N
jika massa rata-rata 1 atom N adalah
14,0067 sma!
Ar
Massa atom relatif (Ar) adalah
perbandingan massa rata-rata satu
atom unsur terhadap massa satu
atom C-12.
Misal:
Diketahui massa 1 atom
12
C adalah
12,00 sma. Tentukan Ar dari unsur N
jika massa rata-rata 1 atom N adalah
14,0067 sma!
Ar dan Mr
ISOTOP, ISOBAR, & ISOTON
PENUTUP
SIFAT PERIODIK UNSUR PERKEMBANGAN TEORI ATOM
Ar dan Mr
ISOTOP, ISOBAR, & ISOTON
PENUTUP
SIFAT PERIODIK UNSUR PERKEMBANGAN TEORI ATOM
Ar dan Mr
Ar dan Mr
Ar dan Mr
ISOTOP, ISOBAR, & ISOTON
PENUTUP
SIFAT PERIODIK UNSUR PERKEMBANGAN TEORI ATOM
PERKEMBANGAN SPU PARTIKEL DASAR PENYUSUN ATOM
Menentukan Ar dari kelimpahan
isotopnya
Ar= (A
1
x %
1
)
+ (
A
2
x %
2
) + ...
Ar= ∑(A x %)
Menentukan Ar dari kelimpahan
isotopnya
Ar= (A
1
x %
1
)
+ (
A
2
x %
2
) + ...
Ar= ∑(A x %)
Keterangan:
A
1
= nomor massa isotop 1
A
2
= nomor massa isotop 2
%
1
= presentase kelimpahan
isotop 1
%
2
= presentase kelimpahan
isotop 2
Keterangan:
A
1
= nomor massa isotop 1
A
2
= nomor massa isotop 2
%
1
= presentase kelimpahan
isotop 1
Ar dan Mr
Ar dan Mr
Ar dan Mr
ISOTOP, ISOBAR, & ISOTON
PENUTUP
SIFAT PERIODIK UNSUR PERKEMBANGAN TEORI ATOM
PERKEMBANGAN SPU PARTIKEL DASAR PENYUSUN ATOM
Unsur Klorin mempunyai dua isotop,
yaitu
35
Cl dan
37
Cl . Isotop
35
Cl di alam
kelimpahannya 75,53% dan massanya
34,969 sma, sedangkan
37
Cl di alam
kelimpahannya 24,47% dan massanya
36,966 sma. Tentukan Ar dari unsur k
lorin tersebut!
Unsur Klorin mempunyai dua isotop,
yaitu
35
Cl dan
37
Cl . Isotop
35
Cl di alam
kelimpahannya 75,53% dan massanya
34,969 sma, sedangkan
37
Cl di alam
kelimpahannya 24,47% dan massanya
36,966 sma. Tentukan Ar dari unsur k
lorin tersebut!
Jawab:
Ar= ∑(A x % )
Ar = ( no. massa
35Cl x % ) + (no. massa
37Cl x % )
Ar= (34,969 sma x 75,53%) + (36,966 sma x
24,47%)
= 35,45
Jawab:
Ar= ∑(A x % )
Ar = ( no. massa
35Cl x % ) + (no. massa
37Cl x % )
Ar= (34,969 sma x 75,53%) + (36,966 sma x
24,47%)
Ar dan Mr
Ar dan Mr
Ar dan Mr
ISOTOP, ISOBAR, & ISOTON
PENUTUP
SIFAT PERIODIK UNSUR PERKEMBANGAN TEORI ATOM
PERKEMBANGAN SPU PARTIKEL DASAR PENYUSUN ATOM
1. Galium terdiri atas 2 jenis isotop yaitu
69Ga dan
71
Ga. Apabila massa atom relatif (Ar) Galium
adalah 69,8 maka tentukan kelimpahan isotop
69
Ga!
1. Galium terdiri atas 2 jenis isotop yaitu
69Ga dan
71
Ga. Apabila massa atom relatif (Ar) Galium
adalah 69,8 maka tentukan kelimpahan isotop
69
Ga!
Jawab:
total kelimpahan dari isotop-isotop Galium
adalah 100%.
misal kelimpahan isotop Ga-69 adalah a%,
maka :
Ar=∑(no.Massa isotop x %)
69,8 = {69 x a%} + {71 x (100%-a%)}
69,8 = -2a% + 71
a% = 60%
Jawab:
total kelimpahan dari isotop-isotop Galium
adalah 100%.
misal kelimpahan isotop Ga-69 adalah a%,
maka :
Ar=∑(no.Massa isotop x %)
69,8 = {69 x a%} + {71 x (100%-a%)}
69,8 = -2a% + 71
Ar dan Mr
Ar dan Mr
Ar dan Mr
ISOTOP, ISOBAR, & ISOTON
PENUTUP
SIFAT PERIODIK UNSUR PERKEMBANGAN TEORI ATOM
PERKEMBANGAN SPU PARTIKEL DASAR PENYUSUN ATOM
Mr
Massa molekul relatif adalah perbandingan
massa antara suatu molekul dengan
suatu standar.
Mr
suatu zat = jumlah
Ar
dari atom-atom
penyusun molekul zat tersebut.
Mr
=
Ar
Khusus untuk senyawa ion digunakan istilah
Massa Rumus Relatif
(
Mr
) karena
senyawa ion tidak terdiri atas molekul.
Mr
Massa molekul relatif adalah perbandingan
massa antara suatu molekul dengan
suatu standar.
Mr
suatu zat = jumlah
Ar
dari atom-atom
penyusun molekul zat tersebut.
Mr
=
Ar
Khusus untuk senyawa ion digunakan istilah
Massa Rumus Relatif
(
Mr
) karena
Ar dan Mr
Ar dan Mr
Ar dan Mr
ISOTOP, ISOBAR, & ISOTON
PENUTUP
SIFAT PERIODIK UNSUR PERKEMBANGAN TEORI ATOM
PERKEMBANGAN SPU PARTIKEL DASAR PENYUSUN ATOM
Tentukan Mr dari senyawa berikut!
a. NaCl
b. H
2
SO
4
c. H
2
O
(Diketahui Ar H = 1, Ar Na = 23, Ar Cl = 35,5;
Ar S= 32, Ar O=16)
Tentukan Mr dari senyawa berikut!
a. NaCl
b. H
2
SO
4
c. H
2
O
(Diketahui Ar H = 1, Ar Na = 23, Ar Cl = 35,5;
Ar S= 32, Ar O=16)
Mr NaCl = Ar Na + Ar Cl = 23 + 35,5 = 58,5
Mr H
2
SO
4
= 2.Ar H + Ar S + 4.Ar O
= 2.1 + 32 + 4.16
= 98
Mr H
2
O = 2.Ar H + Ar O = 2.1 + 16 = 18
Dasar pemikiran :
Dasar pemikiran :
manusia cenderung mengelompokkan
manusia cenderung mengelompokkan
sesuatu dgn kriteria tertentu agar
sesuatu dgn kriteria tertentu agar
mudah mengingat, mencari, dan
mudah mengingat, mencari, dan
memakainya.
memakainya.
PARTIKEL DASARPENYUSUN ATOM ISOTOP, ISOBAR, & ISOTON
KONFIGURASI ELEKTRON
PENUTUP
SIFAT PERIODIK UNSUR PERKEMBANGAN TEORI ATOM
PENGELOMPOKAN UNSUR CARA
LAVOISER
Pengelompokan unsur oleh
Lavoisier (saat itu baru 20 jenis
unsur).
DASAR : kemiripan sifat fisik,
unsur-unsur dikelompokkan dalam logam
dan bukan logam.
Unsur logam
bukan logam
besi, emas, dan
tembaga
karbon,
belerang,
oksigen dan
nitrogen.
PERKEMBANGAN SPU
LAVOISER
DOBEREINE
R
NEWLANDS
MENDELEE
V
MODERN
ISOTOP, ISOBAR, & ISOTON
KONFIGURASI ELEKTRON
PENUTUP
SIFAT PERIODIK UNSUR PERKEMBANGAN TEORI ATOM
PENGELOMPOKAN UNSUR CARA
DOBEREINER
Pada 1829 telah dikenal 40 jenis
(TRIADE)
unsur
DASAR: kemiripan sifat kimia dan
kenaikan massa atom,
Hukum Triade berbunyi,
“Jika tiga unsur di dalam triade disusun
menurut kenaikan massa atomnya,
massa atom unsure di tengah (ke-2)
sama dengan massa rata-rata dari
massa kedua atom yang mengapitnya
(massa rata-rata unsure 1 dan
ke-3)”.
PERKEMBANGAN SPU
LAVOISER
ISOTOP, ISOBAR, & ISOTON
KONFIGURASI ELEKTRON
PENUTUP
SIFAT PERIODIK UNSUR PERKEMBANGAN TEORI ATOM
PENGELOMPOKAN UNSUR CARA
NEWLANDS
Telah ditemukan 63 jenis unsur
(OKTAF)
DASAR: kenaikan massa atom
relatifnya.
Ternyata unsur-unsur yang
berselisih 1 oktaf (unsur nomor
1 dengan nomor 8, 15, 22, 29 ;
nomor 2 dengan nomor 9, 16,
23, 30, dan seterusnya )
menunjukkan kemiripan sifat.
Kelemahan Sistem Oktaf :
Sistem ini hanya berlaku untuk
unsur-unsur ringan.
PERKEMBANGAN
SPU
LAVOISER
DOBEREINE
R
NEWLANDS
MENDELEE
V
MODERN
ISOTOP, ISOBAR, & ISOTON
KONFIGURASI ELEKTRON
PENUTUP
SIFAT PERIODIK UNSUR PERKEMBANGAN TEORI ATOM
PENGELOMPOKAN UNSUR CARA
NEWLANDS
(OKTAF)
Do
1
Re
2
Mi
3
Fa
4
Sol
5
La
6
Si
7
H
Li
Be
B
C
N
O
F
Na
Mg
Al
Si
P
S
Cl
K
Ca
Cr
Ti
Mn
Fe
Co, Ni
Cu
Zn
Y
In
As
Se
PERKEMBANGAN
SPU
LAVOISER
DOBEREINE
R
NEWLANDS
MENDELEE
V
MODERN
ISOTOP, ISOBAR, & ISOTON
KONFIGURASI ELEKTRON
PENUTUP
SIFAT PERIODIK UNSUR PERKEMBANGAN TEORI ATOM
TABEL PERIODIK
MENDELEEV
(HUKUM PERIODIK)
Tahun 1869 telah dikenal 63
jenis Unsur
Dimitri Ivanovich Mendeleev dan
Lothar Meyer secara terpisah
mengelompokkan unsur-unsur
berdasarkan
kenaikan massa
atom,
PERKEMBANGAN
SPU
LAVOISER
ISOTOP, ISOBAR, & ISOTON
KONFIGURASI ELEKTRON
PENUTUP
SIFAT PERIODIK UNSUR PERKEMBANGAN TEORI ATOM
“
Jika unsur-unsur
disusun berdasarkan
kenaikan massa
atomnya maka sifat
unsur akan berulang
secara periodik
“
(Hk. Periodik)
“
Jika unsur-unsur
disusun berdasarkan
kenaikan massa
atomnya maka sifat
unsur akan berulang
secara periodik
“
(Hk. Periodik)
TABEL PERIODIK
MENDELEEV
(HUKUM PERIODIK)
TABEL PERIODIK
MENDELEEV
(HUKUM PERIODIK)
DAFTAR PERIODIK MENDELEEV DIBUAT TAHUN 1871
YANG DISUSUN ATAS :
* 12 BARIS
* 8 KOLOM
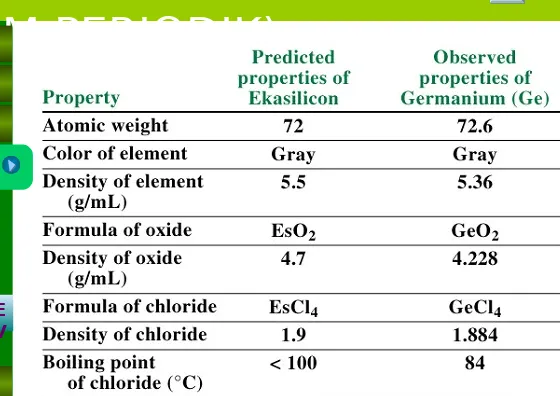
Kelebihan
• Dapat meramalkan tempat kosong
untuk unsur yang belum ditemukan
(diberi tanda “?”).
Contoh: Unsur Eka-silikon
(Germanium-Ge) berada di antara Si
dan Sn.
• Menyajikan data massa atom yang
lebih akurat, seperti Be dan U.
Kelebihan
• Dapat meramalkan tempat kosong
untuk unsur yang belum ditemukan
(diberi tanda “?”).
Contoh: Unsur Eka-silikon
(Germanium-Ge) berada di antara Si
dan Sn.
• Menyajikan data massa atom yang
lebih akurat, seperti Be dan U.
PERKEMBANGAN SPU
LAVOISER
ISOTOP, ISOBAR, & ISOTON
KONFIGURASI ELEKTRON
PENUTUP
SIFAT PERIODIK UNSUR PERKEMBANGAN TEORI ATOM
Kelebihan
• Dapat meramalkan tempat kosong
untuk unsur yang belum ditemukan
(diberi tanda “?”).
Contoh: Unsur Eka-silikon
(Germanium-Ge) berada di antara Si
dan Sn.
• Menyajikan data massa atom yang
lebih akurat, seperti Be dan U.
Kelebihan
• Dapat meramalkan tempat kosong
untuk unsur yang belum ditemukan
(diberi tanda “?”).
Contoh: Unsur Eka-silikon
(Germanium-Ge) berada di antara Si
dan Sn.
• Menyajikan data massa atom yang
lebih akurat, seperti Be dan U.
TABEL PERIODIK
MENDELEEV
(HUKUM PERIODIK)
PERKEMBANGAN SPU
LAVOISER
DOBEREINE
R
NEWLANDS
MENDELEE
V
MODERN
ISOTOP, ISOBAR, & ISOTON
KONFIGURASI ELEKTRON
PENUTUP
SIFAT PERIODIK UNSUR PERKEMBANGAN TEORI ATOM
SISTEM PERIODIK
MODERN
Henry moseley (1914)
Hukum periodik: sifat unsur merupakan fungsi periodik
dari nomor atomnya
“tabel periodik unsur modern
bentuk panjang” _
• Berdasarkan :
– kenaikan nomor atom
• Terbagi atas :
– Golongan (16)
– Periode (7)
PERKEMBANGAN SPU
LAVOISER
DOBEREINE
R
NEWLANDS
MENDELEE
V
MODERN
ISOTOP, ISOBAR, & ISOTON
KONFIGURASI ELEKTRON
PENUTUP
SIFAT PERIODIK UNSUR PERKEMBANGAN TEORI ATOM
SISTEM PERIODIK MODERN
H
1,01
H
1,01
1
1
1
1
Nomor Atom
Nomor Atom
Nomor massa
Nomor massa
PERKEMBANGAN SPULAVOISER
DOBEREINE
R
NEWLANDS
MENDELEE
V
MODERN
ISOTOP, ISOBAR, & ISOTON
KONFIGURASI ELEKTRON
PENUTUP
SIFAT PERIODIK UNSUR PERKEMBANGAN TEORI ATOM
SISTEM PERIODIK MODERN
Periode adalah lajur yang
horizontal.
Menunjukan jumlah kulit elektron.
Unsur-unsur yang terletak dalam
satu
periode
memiliki
jumlah kulit yang
sama
.
Golongan adalah lajur yang
vertikal
Dalam satu golongan,
elektron valensi nsur sama, serta
Memiliki sifat-sifat kimia dan fisik yang
hampir mirip.
Golongan terdiri dari:
1) Golongan Utama / Gol A
2) Golongan unsur transisi/ Gol B
Golongan adalah lajur yang
vertikal
Dalam satu golongan,
elektron valensi nsur sama,
serta
Memiliki sifat-sifat kimia dan fisik yang
hampir mirip.
Golongan terdiri dari:
1) Golongan Utama / Gol A
2) Golongan unsur transisi/ Gol B
PERKEMBANGAN SPU
LAVOISER
ISOTOP, ISOBAR, & ISOTON
KONFIGURASI ELEKTRON
PENUTUP
SIFAT PERIODIK UNSUR PERKEMBANGAN TEORI ATOM
SISTEM PERIODIK MODERN
PERKEMBANGAN SPU
LAVOISER
DOBEREINE
R
NEWLANDS
MENDELEE
V
MODERN
ISOTOP, ISOBAR, & ISOTON
KONFIGURASI ELEKTRON
PENUTUP
SIFAT PERIODIK UNSUR PERKEMBANGAN TEORI ATOM
PARTIKEL DASAR
PENYUSUN ATOM
Golongan utama (golongan A), terdiri dari:
Golongan IA
: Golongan Alkali
Golongan IIA
: Golongan Alkali tanah
Golongan IIIA
: Golongan Aluminium
Golongan IVA
: Golongan Karbon
Golongan VA
: Golongan Nitrogen
Golongan VIA
: Golongan Kalkogen/
Oksigen
HUBUNGAN KONFIGURASI
ELEKTRON DG PERIODE &
GOLONGAN
PERKEMBANGAN SPU
LAVOISER
ISOTOP, ISOBAR, & ISOTON
KONFIGURASI ELEKTRON
PENUTUP
SIFAT PERIODIK UNSUR PERKEMBANGAN TEORI ATOM
PARTIKEL DASAR
PENYUSUN ATOM
No. golongan = elektron valensi
No. periode = jumlah kulit terisi
No. golongan = elektron valensi
No. periode = jumlah kulit terisi
No Uns
ur
Konfigur
asi
lektron
perio
de
golo
ngan
Konfigurasi elektron
1s
2s
2p
3s
3p
3d
4s
4p
4d
4f
5s
5p
5d
5f
6s
6p
6d
Aturan Konfigurasi Elektron
1. Elektron menempati orbital sedemikian rupa untuk
meminimumkan energi atom tersebut. (urutan
energinya ditampilkan di slide selanjutnya)
2. Tidak ada dua elektron dalam sebuah atom yang boleh
memiliki keempat bilangan kuantum yang sama
3. Jika terdapat orbital dengan energi yang sama, elektron
akan menempatinya sendiri2 sebelum menempati
HUBUNGAN KONFIGURASI
ELEKTRON DG PERIODE &
GOLONGAN
PERKEMBANGAN SPU
LAVOISER
DOBEREINE
R
NEWLANDS
MENDELEE
V
MODERN
ISOTOP, ISOBAR, & ISOTON
KONFIGURASI ELEKTRON
PENUTUP
SIFAT PERIODIK UNSUR PERKEMBANGAN TEORI ATOM
PARTIKEL DASAR PENYUSUN ATOM
Tentukan letak unsur berikut
dalam tabel periodik!
SIFAT UNSUR
KATAGORI UNSUR
1. LOGAM
2. NON LOGAM
3. METALOID
4. GAS MULIA
SIFAT
UNSUR
JARI_JARI
ATOM
ENERGI
IONISASI
AFINITAS
ELEKTRON
KEELEKTRON
EGATIFAN
ISOTOP, ISOBAR, & ISOTON
PENUTUP
PERKEMBANGAN TEORI ATOM
PERKEMBANGAN SPU KONFIGURASI
ELEKTRON
SIFAT PERIODIK UNSUR
SISTEM PERIODIK MODERN
IA
IA
1,01H
H
1,01
1
1
Nomor Atom
Nomor Atom
Nomor massa
Nomor massa
LOGAM
LOGAM
NON LOGAM
NON LOGAM
METALOID
METALOID
GAS MULIA
GAS MULIA
IIA
IIA
IIIA IVA VA VIA VIIA
IIIA IVA VA VIA VIIA
VIIA
LOGAM
Hanya memiliki sejumlah kecil elektron
pada kulit terluar
Sifat kimia
– mudah melepaskan satu atau lebih
elektron membentuk ion positif
•
Sifat fisika
– mampu menghantarkan listrik &
panas
– dapat dibentuk (ductility)
– dapat ditempa (meleability)
– Mengkilat (shine)
SIFAT
UNSUR
JARI_JARI
ATOM
ENERGI
IONISASI
AFINITAS
ELEKTRON
KEELEKTRON
EGATIFAN
ISOTOP, ISOBAR, & ISOTON
PENUTUP
PERKEMBANGAN TEORI ATOM
PERKEMBANGAN SPU KONFIGURASI
ELEKTRON
SIFAT PERIODIK UNSUR
NON LOGAM
DAN
METALOID
N O N L O G A M
Unsur yang dapat memperoleh
konfigurasi elektron seperti Gas Mulia
dengan cara menerima sejumlah kecil
elektron
METALOID
•Menunjukkan sifat-sifat logam dan
non logam
•Terletak pada diagonal antara
golongan logam transisi dan non
logam
B (IIIA)
Si (IVA)
As (VA)
Te (VIA)
At (VIIA)
SIFAT
UNSUR
JARI_JARI
ATOM
ENERGI
IONISASI
AFINITAS
ELEKTRON
KEELEKTRON
EGATIFAN
ISOTOP, ISOBAR, & ISOTON
PENUTUP
PERKEMBANGAN TEORI ATOM
PERKEMBANGAN SPU KONFIGURASI
ELEKTRON
SIFAT PERIODIK UNSUR
•
EI besar
•
Afinitas elektron
•
Keelektronegatifan
besar
•
EI besar
•
Afinitas elektron
•
Keelektronegatifan
besar
•
Jari jari
besar
•
Jari jari
JARI-JARI ATOM
Jarak dari elektron terluar sampai dengan inti
atom.
SIFAT
UNSUR
JARI_JARI
ATOM
ENERGI
IONISASI
AFINITAS
ELEKTRON
KEELEKTRON
EGATIFAN
ISOTOP, ISOBAR, & ISOTON
PENUTUP
PERKEMBANGAN TEORI ATOM
PERKEMBANGAN SPU KONFIGURASI
ELEKTRON
SIFAT PERIODIK UNSUR
JARI_JARI ATOM
jari-jari atom
makin besar
sebab
jumlah kulit yang dimiliki atom
makin banyak, sehingga kulit
terluar makin jauh dari inti atom.
jari-jari atom
makin besar
sebab
jumlah kulit yang dimiliki atom
makin banyak, sehingga kulit
terluar makin jauh dari inti atom.
jari-jari atom makin ke
kanan makin kecil.
Sebab
jumlah proton makin
banyak,
jari-jari atom makin ke
kanan makin kecil.
Sebab
jumlah proton makin
banyak,
SIFAT
UNSUR
JARI_JARI
ATOM
ENERGI
IONISASI
AFINITAS
ELEKTRON
KEELEKTRON
EGATIFAN
ISOTOP, ISOBAR, & ISOTON
PENUTUP
PERKEMBANGAN TEORI ATOM
PERKEMBANGAN SPU KONFIGURASI
ELEKTRON
SIFAT PERIODIK UNSUR
tarik-menarik inti
dengan elektron
makin kuat
tarik-menarik inti
dengan elektron
makin kuat
ENERGI IONISASI
EI
energi minimum yg dibutuhkan
oleh suatu atom untuk melepaskan
satu elektron yang terikat paling
luar.
EI
energi minimum yg dibutuhkan
oleh suatu atom untuk
melepaskan
satu
elektron
yang terikat paling
luar.
SIFAT
UNSUR
JARI_JARI
ATOM
ENERGI
IONISASI
AFINITAS
ELEKTRON
KEELEKTRON
EGATIFAN
ISOTOP, ISOBAR, & ISOTON
PENUTUP
PERKEMBANGAN TEORI ATOM
PERKEMBANGAN SPU KONFIGURASI
ELEKTRON
SIFAT PERIODIK UNSUR
PARTIKEL DASAR PENYUSUN ATOM
Untuk atom-atom yang berelektron
valensi banyak, dikenal :
ENERGI IONISASI
(KJ/mol)
SIFAT
UNSUR
JARI_JARI
ATOM
ENERGI
IONISASI
AFINITAS
ELEKTRON
KEELEKTRON
EGATIFAN
ISOTOP, ISOBAR, & ISOTON
PENUTUP
PERKEMBANGAN TEORI ATOM
PERKEMBANGAN SPU KONFIGURASI
ELEKTRON
SIFAT PERIODIK UNSUR
PARTIKEL DASAR PENYUSUN ATOM
H
Semakin kecil EI semakin mudah
membentuk ion positif (kation)
Kecenderungan energi ionisasi dalam sistem
periodik
EI semakin besar
Energi ionisasi erat hubungannya dengan
jari-jari atom dan kestabilan.
Makin besar jari-jari atom makin kecil
energi ionisasinya.
Makin stabil suatu atom makin besar
energi ionisasinya.
ENERGI IONISASI
SIFAT
UNSUR
JARI_JARI
ATOM
ENERGI
IONISASI
AFINITAS
ELEKTRON
KEELEKTRON
EGATIFAN
ISOTOP, ISOBAR, & ISOTON
PENUTUP
PERKEMBANGAN TEORI ATOM
PERKEMBANGAN SPU KONFIGURASI
ELEKTRON
SIFAT PERIODIK UNSUR
ENERGI IONISASI
SIFAT
UNSUR
JARI_JARI
ATOM
ENERGI
IONISASI
AFINITAS
ELEKTRON
KEELEKTRON
EGATIFAN
ISOTOP, ISOBAR, & ISOTON
PENUTUP
PERKEMBANGAN TEORI ATOM
PERKEMBANGAN SPU KONFIGURASI
ELEKTRON
SIFAT PERIODIK UNSUR
PARTIKEL DASAR PENYUSUN ATOM
Dalam 1 periode
dari kiri ke kanan
Dalam 1 golongan
dari atas ke bawah
Semakin besar
Alasan: jari-jari
makin kecil,
gaya
tarik inti thd
elektron makin
besar, sehingga
elektron sukar
lepas
Semakin kecil
Alasan: jari-jari
makin besar,
gaya
tarik inti thd
ENERGI IONISASI
3p
11p
12n
Dalam satu golongan…
Dalam satu golongan…
SIFAT
UNSUR
JARI_JARI
ATOM
ENERGI
IONISASI
AFINITAS
ELEKTRON
KEELEKTRON
EGATIFAN
ISOTOP, ISOBAR, & ISOTON
PENUTUP
PERKEMBANGAN TEORI ATOM
PERKEMBANGAN SPU KONFIGURASI
ELEKTRON
SIFAT PERIODIK UNSUR
PARTIKEL DASAR PENYUSUN ATOM
Dari atas ke
bawah, EI makin
kecil
Dari atas ke
ENERGI IONISASI
4p
3 p
Dalam satu periode…
Dalam satu periode…
SIFAT
UNSUR
JARI_JARI
ATOM
ENERGI
IONISASI
AFINITAS
ELEKTRON
KEELEKTRON
EGATIFAN
ISOTOP, ISOBAR, & ISOTON
PENUTUP
PERKEMBANGAN TEORI ATOM
PERKEMBANGAN SPU KONFIGURASI
ELEKTRON
SIFAT PERIODIK UNSUR
PARTIKEL DASAR PENYUSUN ATOM
Dari kiri ke
kanan, EI
meningkat
AFINITAS ELEKTRON
Afinitas elektron
energi yang terlibat (dilepas
atau diserap) ketika satu elektron diterima oleh
atom suatu unsur dalam keadaan gas.
Contoh : Cl(g) + 1e
–
Cl
-(g)
Harga Afinitas (kJ/mol)
Afinitas elektron
energi
yang terlibat (dilepas
atau diserap) ketika satu
elektron diterima
oleh
atom suatu unsur dalam keadaan
gas.
Contoh : Cl(g) + 1e
–
Cl
-(g)
Harga Afinitas (kJ/mol)
SIFAT
UNSUR
JARI_JARI
ATOM
ENERGI
IONISASI
AFINITAS
ELEKTRON
KEELEKTRON
EGATIFAN
ISOTOP, ISOBAR, & ISOTON
PENUTUP
PERKEMBANGAN TEORI ATOM
PERKEMBANGAN SPU KONFIGURASI
ELEKTRON
SIFAT PERIODIK UNSUR
PARTIKEL DASAR PENYUSUN ATOM