A
Z
X
g
STRUKTUR ATOM
I. TEORI
Struktur atom adalah susunan partikel dasar dalam atom.
Atom sebagai partikel penyusun materi dapat menentukan sifat materi. Berukuran sangat kecil dan kita tidak sanggup untuk melihatnya. Sedangkan para ahli memperkirakan bentuk molekul dari berbagai percobaan dan fakta yang ada dengan suatu model. Kebenaran suatu model atau teori atom tidak mutlak. Dalam perkembangannya model atau teori atom terus mengalami perbaikan dan penyempurnaan.
II. MATERI
A. Partikel-partikel dasar atom B. Nomor atom dan massa atom C. Isotop, Isobar dan Isoton D. Susunan elektron dalam atom E. Perkembangan Teori Atom
A.
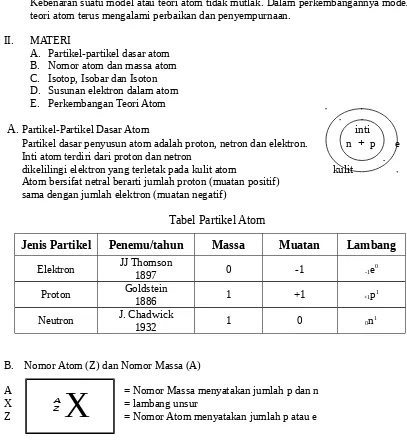
Partikel-Partikel Dasar Atom inti Partikel dasar penyusun atom adalah proton, netron dan elektron. n+
p e Inti atom terdiri dari proton dan netrondikelilingi elektron yang terletak pada kulit atom kulit Atom bersifat netral berarti jumlah proton (muatan positif)
sama dengan jumlah elektron (muatan negatif)
Tabel Partikel Atom
Jenis Partikel
Penemu/tahun
Massa
Muatan
Lambang
Elektron JJ Thomson
1897 0 -1 -1e0
Proton Goldstein1886 1 +1 +1p1
Neutron J. Chadwick
1932 1 0 0n1
B. Nomor Atom (Z) dan Nomor Massa (A)
A = Nomor Massa menyatakan jumlah p dan n
X = lambang unsur
C. Isotop, Isobar dan Isoton
Isotop ialah atom dari unsur yang sama tetapi berbeda massanya. Contoh:
6C12 : 6 proton, 6 elektron, 6 neutron 6C13 : 6 proton, 6 elektron, 7 neutron
Perbedaan massa pada isotop disebabkan perbedaan jumlah neutron.
Isobar ialah atom dari unsur yang berbeda (mempunyai nomor atom berbeda), tetapi mempunyai nomor massa yang sama.
Contoh: 14
6 C dengan 147 N; 2411Na dengan 24 12Mg
Isoton ialah atom dari unsur yang berbeda (mempunyai nomor atom berbeda), tetapi mempunyai jumlah neutron sama.
Contoh : 136 C dengan 14
7N; 31
15P dengan 32 16S
D. Susunan Elektron Dalam Atom
Elektron yang selalu bergerak mengelilingi inti atom ternyata berada pada tingkat-tingkat energi tertentu yang disebut sebagai kulit-kulit atom.
Konfigurasi Elektron
Konfigurasi elektron ialah penyusunan atau pengaturan elektron berdasarkan tingkat energinya dalam suatu atom. Tingkat energi paling dekat dengan inti atau tingkat energi pertama (n=1) diberi lambang K atau disebut kulit K. Tingkat energi kedua diberi lambang L, ketiga M dan seterusnya.
Jumlah elektron maksimum yang dapat menempati setiap tingkat energi sesuai dengan 2n2(akan diterangkan lebih rinci di kelas 3), sehingga jumlah elektron dalam tiap-tiap
tingkat energi utama dapat anda lihat pada tabel di bawah ini.
TABEL: KULIT DAN JUMLAH ELEKTRON MAKSIMUM
Tingkat Energielektron
Lambang Kulit Jumlah elektron Maksimum
1 K 2 elektron
2 L 8 elektron
3 M 18 elektron
4 N 32 elektron
5 O 50 elektron
6 P 72 elektron
7 Q 98 elektron
Perhatikan Contoh Berikut ini!
Atom Jumlahelektron
Kulit K (n = 1)
Kulit L (n = 2)
Kulit M (n = 3)
Kulit N (n = 4)
1H 1 1
7Li 3 2 1
6C 6 2 4
12Mg 12 2 8 2
33As 33 2 8 18 5
Jumlah elektron maksimum perkulit = 2n2
Kulit K (n = 1), elektron maksimum = 2(1)2 = 2
Kulit L (n = 2), elektron maksimum = 2(2)2 = 8
Kulit M ( = 3), elektron maksimum = 2(3)2 = 18 dst.
ELEKTRON VALENSI
Elektron valensi adalah jumlah elektron yang terdapat pada kulit terluar atom suatu unsur. Elektron valensi digunakan untuk membentuk ikatan kimia. jadi elektron valensi merupakan penentu sifat kimia atom unsur.
Contoh:
3Li, elektron valensi = 1; 6C, elektron valensi = 4 12Mg, elektron valensi = 2
E. Perkembangan Teori Atom
No.
Gambar
Teori Atom
Penjelasan
1. Teori atom - atom bagian terkecil suatu materi yang tidak dapat dibagi lagi
- atom-atom suatu unsur sama dalam segala hal, tetapi berbeda dengan atom-atom unsur lain
- atom tidak dapat diciptakan dan dimusnahkan
- pada reaksi kimia terjadi penggabungan dan pemisahan atom
- senyawa adalah hasil reaksi atom-atom penyusunnya
2.
Elektron
Materi Bermuatan positif
JJ. Thomson - dalam atom terdapat elektron tersebar merata dalam bola muatan +
No.
Gambar
Teori Atom
Penjelasan
3. Rutherford Atom terdiri atas inti yang menjadi pusat massa atom dan muatan positifnya, sedang elektron berputas di sekelilingnya.
Rutherford tidak dapat menjelaskan mengapa elektron tidak tertarik pada inti. Dalam inti atom terdapat proton dan neutron. Dasar pemikiran tentang spektrum unsur.
4. Niels Bohr 1. Elektron dalam atom bergerak melalui lintasan yang merupakan tingkat energi tertentu, dengan demikian elektron juga mempunyai energi tertentu
2. Selama bergerak dalam lintasannya elektron tidak memancarkan energi disebut keadaan stationer atau dasar. 3. Elektron dalam atom dapat menyerap
energi dan pindah ke lintasan/tingkat energi yang lebih tinggi (disebut eksitasi atau promosi).
5.
simpul bulat
Kontur 90%
Modern (Mekanika Gelombang)
Dasar pemikiran: materi mempunyai sifat gelombang. Elektron-elektron yang bergerak dalam atom juga mempunyai sifat gelombang. Sehingga kedudukan elektron tidak jelas. Kita hanya dapat berbicara tentang kebolehjadian untuk menemukan suatu elektron pada berbagai jarak dari inti dan pada berbagai arah dalam ruang. Daerah-daerah dalam atom dengan kebolehjadian menemukan elektron paling besar disebut orbital bukan orbit.
LATIHAN SOAL
1. Lengkapi Tabel Berikut:
Lambang proton elektron netron
55
25Mn …. …. ….
....
78Pt …. …. 117
7
....Li 3 …. ….
....
....
....K 19 …. 200
1. Klorin yang terdapat di alam terdiri dari Cl35 dan Cl37 dan massa atom relatif rata-rata Cl =
35,5. Berapa % tiap-tiap isotop yang ada di alam? 2. Tuliskan konfigurasi dari:
a.
8O2-b.
12Mg2+c.
17Cl-d.
19K+e.
16S2-3. Suatu atom mempunyai 18 netron dengan nomer massa 35, tentukan: a. elektron valensinya
b. gambar struktur atomnya
4. Unsur A yang berwujud gas mempunyai massa 1 gram dan volumenya 560 ml (STP), jika dalam intinya terdapat 22 neutron, tentukanlah:
a. nomer atom A
b. konfigurasi elektronnya c. elektron valensinya
EVALUASI
A. Pilihlah Jawaban yang Paling Tepat! 1. Suatu isotop belerang mengandung 16
proton dan 17 neutron. Isotop belerang yang lain mengandung 16 proton dan 19 neutron. Nomer atom dan momer massa isotop pertama adalah… merupakan isotop dari 31
15X adalah .…
atom relatif klorin adalah… a. 35
b. 35,5
c. 36,5 d. 35 dan 37 e. 37
4. Pasangan yang memiliki jumlah elektron valensi sama adalah…
5. Lambang suatu unsur 3016 X, maka dalam
satu atom unsur tersebut terdapat… a. 16 proton, 14 elektron dan 14 netron b. 14 proton, 16 elektron dan 30 netron c. 30 proton, 30 elektron dan 16 netron d. 16 proton, 16 elektron dan 14 netron e. 16 proton, 16 elektron dan 30 netron
6. Di dalam ion Au3+; 197
79Au terdapat….
7. Tercantum di bawah ini lambang unsur-atom unsur tersebut adalah…
a. 58, 24, 58 b. 52, 52, 58 c. 58, 58, 24 d. 58, 58, 140 e. 58, 58, 82
9. Ion X2+ mempunyai konfigurasi elektron
2-8-8. Nomer atom X adalah… a. 16
b. 18 c. 19 d. 20 e. 22
10. Ion X-2 mempunyai konfigurasi elektron
2-8-8. Nomer atom X adalah… a. 16
b. 17 c. 18 d. 20 e. 22
11. Jika atom X mempunyai elektron valensi 7 pada kulit N, maka nomer atom X elektron 2-8-8-2, maka ….
a. nomer atom A = 10 b. massa atom A = 20
c. ion A2+ mempunyai 20 elektron
d. nomer atom dan nomer massa A = 20 elektron dan lima elektron valensi serta mempunyai 16 netron, maka nomer atom dan nomer massa unsur tersebut adalah… a. 15 dan 16
b. 13 dan 31 c. 15 dan 31 d. 31 dan 13 e. 16 dan 15
16. Konfigurasi elektron berikut yang tidak dijumpai pada suatu atom adalah …. a. 2e, 8e, 5e d. 2e, 8e, 8e
b. 2e, 8e, 6e e. 2e, 8e, 9e c. 2e, 8e, 7e
17. Ion X2- mempunyai konfigurasi elektron 2e, 8e, 8e. Nomor atom unsur X adalah ….
a. 16 d. 19
b. 17 e. 20
c. 18
a. 16 d. 19
b. 17 e. 20
c. 18
19. Suatu atom mempunyai tiga kulit elektron dan lima elektron valensi. Nomor atom unsur tersebut adalah ….
a. 11 d. 17
b. 13 e. 19
c. 15
20. Atom Al memiliki 13 elektron, susunan elektron ion Al3+ adalah ….
a. 2e, 8e d. 2e, 8e, 3e b. 2e, 8e, 1e e. 2e, 8e, 6e c. 2e, 8e, 2e
3. Unsur boron yang terdapat di alam terdiri atas dua jenis isotop dengan ~rsentase isotop I~B = 20% dari isotop I~B = 80%. Perkiraan tentang massa atom relatif yang paling mendekati adalah ….
A. 10,0 D. 10,8 B. 10,2 E. 11.0 C. 10,5
14. Unsur galium terdiri atas dua jenis isotop dengan massa isotop relatif berturut-turut 68,95 dan 70,95. Bila massa atom relative galium 69,75 maka persentase isotop 69Ga yang
terdapat di alam adalah ….
a. 40 d. 70
b. 50 e. 80
c. 60
BAB
X
SISTEM PERIODIK
UNSUR-UNSUR
A. PERKEMBANGAN PENGELOMPOKAN UNSUR
1. Setelah ditemukan unsur-unsur di alam maka para ahli kimia berusaha mengklasifikasikan unsur-unsur berdasarkan persamaan sifat-sifat ke dalam kelompok-kelompok. Tujuan pengelompokan ini adalah untuk memudahkan menggambarkan senyawa jika unsur tersebut bergabung dengan unsur lain.
2. Hukum TRIADE DOBEREINER
Bandingkan massa unsur yang di tengah dengan jumlah massa unsur petama dan ketiga pada data di bawah ini!
5 , 35
17
Cl
1 , 39
19
K
31 15
P
80 35
Br
5 , 85
37
Rb
74 33
As
127
53
I
13255,9Cs
12151Sb
Pengolahan data
……… ……… ……… Buatlah Kesimpulan dari data di atas
……… ……… ……… 3. Hukum OKTAF dari Newlands
Jelaskan keteraturan yang ditemukan oleh J. newlands tersebut dan dikenal dengan nama Hukum Oktaf!
……… ……… ………
4. Pada tahun 1869, Dimitri Mendeleyev mengelompokkan unsur-unsur berdasarkan kenaikan massa atom relatifnya dan ternyata sifat unsur akan berulang secara periodik. Mendeleyev menempatkan unsur-unsur yang sifatnya mirip delam lajur vertikal yang disebut golongan, sedangkan deret horisontal disebut periode.
5. Pada tahun 1914, Henry Moseley menyempurnakan sistem periodik Mendeleyev di mana unsur-unsur disusun menurut pertambahan nomer atom dan berdasarkan konfigurasi elektron. Sistem periodik modern ini disebut juga periodik bentuk panjang yang tersusun atas:
- baris-baris horisontal disebut eriode - kolom-kolom vertikal disebut golongan
B. Hubungan Konfigurasi Elektron Dengan Sistem Periodik Unsur
Penetapan golongan dan periode dapat ditentukan dengan cara menggambarkan konfigurasi elektron. Elektron valensi merupakan nomer golongan, sedangkan jumlah kulit yang sudah terisi elektron menunjukkan letak periode. Penetapan golongan dan periode untuk kelas I hanya untuk golongan utama (golongan A), sehingga nomer golongan merupakan golongan A.
Contoh Soal:
tentukan golongan dan periode unsur berikut:
6C; 11Na; 20Ca; 35Br
Jawab:
tuliskan konfigurasi elektron masing-masing unsur!
Unsur K (n = 1) L (n = 2) M (n = 3) N (n = 4)
6C 2 4
11Na 2 8 1
20Ca 2 8 8 2
35Br 2 8 18 7
Jadi,
6C terletak pada golongan IVA, periode 2 11Na terletak pada golongan IA, periode 3 20Ca terletak pada golongan IIA, periode 4 35Br terletak pada golongan VIIA, periode 4
LATIHAN SOAL
1. Jelaskan arti golongan dan periode!
……… ……… Bagaimana cara penentuannya?
……… ……… 2. Tentukan golongan dan periode masing-masing unsur berikut:
a. 9F
b. 18Ar
……… ……… 3. Diketahui konfigurasi elektron unsur-unsur berikut, tentukan = nomer atom, periode dan
golongannya! X = 2, 8,18, 6 Y = 2, 8, 18, 18, 8,1
……… ………
C. SIFAT-SIFAT SISTEM PERIODIK
Sifat-sifat unsur dalam sistem periodik meliputi: a. jari-jari atom
b. energi ionisasi c. afinitas elektron d. keelektromagnetan
LATIHAN SOAL
1. Jelaskan dengan singkat hubungan antara energi ionisasi dengan jari-jari atom!
……… ……… 2. Mengapa energi ionisasi tingkat kedua lebih besar dari pada tingkat pertama!
……… ……… 3. Diketahui: 9X; 10Y; 11Z; 19P
a. Yang mempunyai energi ionisasi terbesar adalah… b. Yang keelektronegatifannya terbesar adalah…
……… ……… ……… ………
EVALUASI
A. Pilihlah jawaban yang Paling tepat! 1. Pengelompokan unsur dimana terjadi
pengulangan sifat yang sama pada unsur ke delapan, dikemukakan oleh…
a. Rothar Meyer b. Dalton c. Mendeleyev d. Newlands e. Dobereiner
2. Mendeleyev menyusun unsur-unsur dalam bentuk sistem periodik
a. Jumlah elektron sama b. jumlah proton sama
c. jumlah elektron valensi sama d. jumlah kulit elektron sama e. nomer atom sama
4. Unsur berikut yang terletak pada periode ketiga adalah…
a. Golongan IA/periode 4 b. Golongan IIA/periode 4 c. Golongan VIA/periode 4 d. Golongan VA/periode 4 e. Golongan IVA/periode 4
7. Suatu unsur X terletak pada golongan VIA, periode 3, maka nomer atom unsur tersebut adalah… perubahan energi ionisasi unsur-unsur periode ke 3 adalah….
9. Afinitas elektron unsur-unsur dalam satu periode adalah dari kiri ke kanan… a. bertambah besar, sebab kemampuan
tarik-menarik elektron semakin kuat b. jari-jari atomnya semakin kecil c. potensial ionisasinya semakin besar d. keelektronegatifannya makin kecil e. afinitasnya makin kecil
10. Hubungan yang benar dalam satu periode pada sistem periodik adalah….
a. nomor atom d. nomor atom
jari-jari atom afinitas elektron
b. nomor atom e. nomor atom
jari-jari atom potensial ionisasi
c. nomor atom
kelektronegatifan
11.
Diberikan sebagian sistem periodik
yang unsur-unsurnya dimisalkan
sebagai berikut:
Golongan
Periode VIA VIIA IA IIA
2 A B C D
3 E F G H
Unsur yang paling elektronegatif a. A sifat unsur dalam satu periode adalah… a. sifat basa bertambah
b. sifat asam berkurang c. muatan inti bertambah d. energi ionisasi berkurang e. jumlah proton berkurang
13. Di antara unsur-unsur 4A; = 12B; 18C; dan 16D yang terletak dalam golongan yang
sama pada sistem periodik adalah… a. A dan B
b. A dan C c. B dan C d. B dan D e. A dan D
14. Elektronegatifitas atau keelektronegatifan suatu atom adalah sifat yang menyatakan….
a. Besarnya energi yang dilepaskan apabila atom menangkap sebuah elektron dan menjadi ion negatif. b. Besarnya tendensi (kecenderungan)
untuk menarik elektron dalam pembentukan ion negatif
c. Besarnya energi yang diperlukan apabila atom melepaskan sebuah elektron dan menajdi ion isotop d. Besarnya tendensi (kecenderungan)
untuk melepaskan sebuah elektron dalam pembentukan ion positif e. Besarnya tendensi (kecenderungan)
satu atom untuk menarik elektron 15.
Data keelektonegatifan beberapa
26. Titik didih dan titik lebur unsur-unsur periode ketiga a. naik secara beraturan sepanjang periode
b. naik bertahap sampai golongan IIIA kemudian turun drastis c. naik bertahap sampai golongan IV A kemudian turun teratur d. naik bertahap sampai golongan IV A kemudian turun drastis e. turun secara beraturan sepanjang periode
27. Kelompok unsur berikut yang disusun berdasarkan bertambahnya titik leleh adalah …. a. B, C, N d. C, Si, Ge
b. Na, Mg, Al e. S, Cl, Ar c. Al, Si, P
28. Unsur dengan konfigurasi elektron: 2, 8, 8, 2 da1am sistem periodik terletak pada a. periode 4 golongan lIA
b. periode 4 golongan lIB c. periode 2 golongan IV A d. periode 2 golongan IVB e. periode 4 golongan IV A
29. Unsur X dengan nomor atom 35 mempunyai sifat sebagai berikut, kecuali …. a. mempunyai 7 elektron va1ensi
b. mempunyai bilangan oksidasi -1 c. membentuk molekul diatomik d. tergolong logam
e. dapat bereaksi dengan logam membentuk garam
30. Jika jari-jari atom unsur Li, Na, K, Be dan B secara acak (tidak berurutan) dalam angstrom (A) adalah: 2,01; 1,23; 1,57; 0,80; dan 0,89, maka jari-jari atom litium adalah ….