II. TINJAUAN PUSTAKA
Botani Tanaman Anyelir
Anyelir atau carnation (Dianthus cariophyllus Linn.) adalah tanaman hias bunga yang berasal dari daerah Mediterania. Kata ‘Dianthus’ berasal dari bahasa Yunani, yang berarti dewa (dios) bunga ( anthos).
Menurut Hardjoko (1999) klasifikasi taksonomi anyelir adalah sebagai berikut : Divisio : Spermatophyta
Subdivisio : Angiospermae
Class : Magnoliopsida (Dicotyledonae) Subclass : Carryophyllidae
Ordo : Caryophyllales Famili : Caryoplyllaceae Tribe : Diantheae Genus : Dianthus
Species : caryophyllus (Linn.)
Dianthus sp. termasuk tanaman herba, dapat mencapai tinggi 30-100 cm. Buku batang terlihat nyata pada bagian yang sudah menua. Daun runcing dengan tulang daun yang menyirip, panjang dan sempit, terletak bertolak belakang. Warna daun hijau muda keputih-putihan. Diameter bunga sekitar 5 – 10 cm. Daun mahkota bunga kelipatan lima dengan warna yang sangat bervariasi. Ujung mahkota bunga bergerigi atau tidak bergerigi. Kelopak bunga bergabung membentuk silinder dengan dua putik dan lima benang sari. Tunas samping keluar di antara daun dan batang (Bailey 1953).
Menurut Pertwee (1996) terdapat beberapa tipe anyelir baik berdasarkan teknik budidaya maupun secara genetik :
1. “Standard carnation” (D. caryophyllus) dibentuk dengan cara membuang pucuk lateral pada saat budidaya tanaman dilakukan. Tangkai bunga akan tumbuh kekar dengan panjang berkisar 60-80 cm, dan mempunyai satu bunga yang besar.
2. “Mid i carnation”, yaitu anyelir tipe standar yang mengalami pemotesan pada beberapa pucuk lateralnya saja, tapi tidak pada pucuk batang utamanya. Diameter bunga sekitar 75% dari ukuran bunga standar.
3. “Mignon carnation”, merupakan “standar carnation” yang berukuran kecil, akibat dibuangnya pucuk terminal dan beberapa pucuk lateral. Ukuran bunga sekitar setengah dari ukuran “standard carnation”
4. “Spray carnation” (D. caryophyllus) dimana pucuk terminal dibuang, dan pucuk lateral yang dibiarkan berkembang. Panjang tangkai sekitar 40-70 cm.
5. “Micro pink” adalah tipe anyelir yang berkluster dan kecil-kecil, dimana semua pucuk dibiarkan tumbuh dan berkembang.
6. “Diantini carnation”. Bunga ini mirip D. barbatus (Sweet William), tetapi pucuk terminalnya dibuang.
Budidaya Tanaman Anyelir
Perbanyakan anyelir bisa dilakukan melalui biji atau stek pucuk. Biji anyelir dapat berkecambah pada suhu 18-210C. Akan tetapi perbanyakan dengan biji umumnya hanya digunakan untuk tujuan pemuliaan tanaman. Jika menggunakan stek, maka stek yang digunakan harus benarbenar bebas hama dan penyakit terutama virus. Pada suhu -10C (310F ) stek berakar bisa disimpan selama empat bulan, sedang stek tanpa akar bisa mencapai enam bulan (Dole dan Wilkins 1999).
Tanaman anyelir membutuhkan suhu malam yang berkisar antara 8-110C, sedangkan suhu siang sekitar 18-220C. Tanaman ini tumbuh baik pada cahaya matahari penuh, dengan intensitas penyinaran sekitar 44.000 luks. Cahaya merupakan faktor lingkungan yang paling berpengaruh terhadap pertumbuhan dan perkembangan anyelir. Di negara subtropis, minimal dibutuhkan cahaya 21.500 luks selama musim dingin (Besemer 1980).
Anyelir membutuhkan tanah yang gembur dengan drainase yang baik, sedangkan pH yang cocok adalah sekitar 6.5 (Pertwee 1996). Budidaya anyelir membutuhkan fosfat, nitrogen, kalium dan kalsium yang cukup tersedia dalam larutan tanah. Menurut Bhatt (1989) nitrogen merupakan faktor pembatas paling utama pada nutrisi tanaman anyelir, diperlukan baik pada fase vegetatif maupun generatifnya. Fosfat merupakan unsur makro yang dapat mempengaruhi kenormalan pertumbuhan anyelir. Kekurangan fosfat mengakibatkan daun-daun menjadi sempit dan ujung-ujungnya mengering, kemudian pada akhirnya keseluruhan daun menjadi kuning. Selain fosfat, kalium juga
memberikan pengaruh pada ketegaran tanaman anyelir. Kekurangan kalium mengakibatkan bintik-bintik putih pada daun-daun di bawah bunga, bentuk bunga yang tidak normal, warna bunga pucat dan kelopak bunga menguning. Walaupun secara spesifik tergantung lokasi, tapi secara umum dapat dinyatakan bahwa tingkat kebutuhan nutrisi optimum tanaman anyelir adalah sekitar 40 ppm nitrat, 5-10 ppm phosphat, 25-40 ppm kalium, 150-200 ppm kalsium dan 30-25-40 ppm magnesium. Pada anyelir, direkomedasikan untuk memberikan pupuk 20 ppm N dan K.
Genetika Tanaman Anyelir
Tipe liar anyelir yang berasal dari daratan Mediterania termasuk dalam spesies Dianthus barbatus, yang memiliki set kromosom diploid (2n=2x=30). Tanaman anyelir yang komersial yang ada sekarang merupakan hasil silangan sejak lebih dari 200 tahun yang lalu. Dalam The International Dianthus Register edisi kedua, Esley (1995) menyatakan terdapat 27.000 nama kultivar Dianthus yang telah terdaftar, dari berbagai macam spesies. Seluruh kultivar tersebut mempunyai jumlah kromosom yang berbeda-beda, umumnya 2n=30 atau 2n=45.
Tindakan hibridisasi telah banyak menghasilkan variasi kromosom pada anyelir. Makin sering tanaman mengalami persilangan, makin tinggi kemungkinan terjadinya perubahan jumlah kromosomnya, sehingga akhirnya menyebabkan perubaha n fenotipe pada anaknya (Darjanto dan Satifah 1990). Perubahan jumlah kromosom ini dapat terjadi misalnya pada hibridisasi interspesifik. Pada persilangan antara D. chinensis dan D. barbatus, yang masing- masing mempunyai kromosom 2n = 2x = 30, menghasilkan tanaman anyelir baru yang mempunyai kromosom 2n = 2x = 52. Dalam hal ini berarti telah terjadi perubahan jumlah kromosom, karena kromosom anak tidak sama dengan kromosom induk (Nakano dan Mii 1993).
Anyelir yang sekarang banyak dikenal dalam industri tanaman bunga potong ini termasuk dalam spesies Dianthus caryophyllus Linn., merupakan spesies anyelir yang sanga t bervariasi tingkat ploidinya. Dalam setiap set kromosom anyelir (Dianthus caryophyllus Linn.) terdapat 15 buah kromosom (x= 15). Dianthus caryophyllus memiliki tingkat ploidi yang cukup tinggi, bisa mencapai hexaploid. Dalam keadaan diploid, kromosom anyelir berjumlah 30 (2n= 2x= 30) dan dalam keadaan hexaploid
mencapai jumlah 90 kromosom (2n= 6x= 90) (Darlington dan Wylie 1955). Akan tetapi D. caryophyllus yang dikenal sebagai ‘anyelir greenhouse’, umumnya mempunyai kromosom diploid walau ada sebagian kecil tetraploid (Broertjes dan van Harten 1988).
Pemuliaan Mutasi
Secara umum, mutasi dapat didefinisikan sebagai perubahan materi genetik, dan merupakan sumber pokok dari semua keragaman genetik. Mutasi berperanan penting dalam proses evolusi dan akibat mutasi pula dapat tersedia keragaman materi genetik sebagai ‘bahan baku’ pekerjaan dalam program pemuliaan tanaman. Pada tanaman yang steril atau tanaman apomiktik obligat, mutasi merupakan satu-satunya sumber pencipta keragaman. Penggunaan mutasi, baik mutasi spontan yang terjadi alami maupun buatan yang diinduksi oleh mutagen, inilah yang disebut ‘pemuliaan mutasi’ (Ibrahim 1999).
Definisi mutasi menurut Poespodarsono (1988) adalah suatu perubahan baik terhadap gen tunggal, terhadap sejumlah gen atau terhadap susunan kromosom. Mutasi dapat terjadi pada setiap bagian tanaman dan fase pertumbuhan tanaman, namun lebih banyak terjadi pada bagian yang sedang aktif mengadakan pembelahan sel seperti tunas dan biji. Secara molekuler, dapat dikatakan bahwa mutasi terjadi karena adanya perubahan urutan (‘sequence’) nukleotida DNA kromosom, yang mengakibatkan terjadinya perubahan pada protein yang dihasilkan.
Untuk meningkatkan frekuensi kejadian mutasi alami, dilakukan mutasi buatan atau mutasi buatan (induced mutation) dengan menggunakan mutagen. Mutagen adalah wahana yang digunakan untuk menciptakan mutasi buatan. Menurut Simmonds (1979) secara umum mutagen bisa dibedakan menjadi mutagen fisik dan mutagen kimia. Mutagen yang termasuk dalam mutagen fisik adalah radiasi pengion seperti radiasi sinar alpha, sinar neutron, sinar X dan sinar gamma. Poespodarsono (1988) mengelompokkan mutagen dalam tiga golongan, yaitu (1) mutagen kimia, seperti EMS (ethylene methane sulfonate), NMU (nitrosomethyl urea), NTG (nitrosoguanidine), dan sebagainya, (2) mutagen fisik iradiasi, seperti sinar X, sinar α, sina r β, sinar γ, dan sebagainya, serta (3) mutagen fisik non-radiasi, seperti sinar UV. Mutagen fisik non-radiasi ini berdaya tembus rendah, sehingga umumnya digunakan untuk mutasi mikroorganisme. Mutagen kimia bekerja dengan cara mengubah kemampuan berpasangan rantai DNA sehingga
dapat merubah urutan genetik pada kromosom; sedangkan mutagen fisik iradiasi menyebabkan mutasi karena sel yang teradiasi dibebani tenaga kinetik yang tinggi sehingga dapat mempengaruhi atau mengubah reaksi kimia; akibatnya, susuna n kromosom pun berubah.
Broertjes dan van Harten (1988) menyatakan bahwa sinar gamma lebih sering digunakan karena mempunyai daya tembus yang lebih tinggi sehingga peluang terjadinya mutasi akan lebih besar pula. Sinar gamma ditemukan pada tahun 1900 ole h P. Villard setelah ditemukannya sina Alpha dan Beta oleh Rutherford dan Soddy (van Harten 1998). Sinar gamma merupakan radiasi elektromagnetik dengan panjang gelombang yang lebih pendek dari sinar X, yang berarti dapat menghasilkan radiasi elektromagnetik dengan tingkat energi yang lebih tinggi. Tingkat radiasi energi sinar gamma yang dihasilkan dari reaktor nuklir mencapai lebih dari 10 MeV. Daya tembusnya ke dalam jaringan sangat dalam, bisa mencapai beberapa sentimeter dan bersifat merusak jaringan yang dilewatinya (Sparrow 1979, van Harten 1998). Radiasi sinar gamma biasanya diperoleh dari disintegrasi radioisotop- radioisotop 137Cs atau 60Co. Menurut van Harten (1998) 60
Co memiliki dua puncak spektrum energi radiasi, yaitu pada 1.33 dan 1.17 MeV, dengan waktu paruh 5.27 tahun. Karena berbahaya, maka sumber harus diamankan dalam lapisan logam yang tebalnya 2-5 cm, tergantung pada jenis isotop yang digunakan.
Radiosensitivitas
Radiosensitivitas adalah tingkat sensitivitas tanaman terhadap radiasi (van Harten 1998; Datta 2001). Banyak hal yang dapat mempengaruhi radiosensitivitas. Dalam IAEA (1977) disebutkan terdapat dua faktor utama yang mempengaruhi radiosensitivitas yaitu (1) faktor lingkungan, seperti oksigen, kandungan air, penyimpanan pasca iradiasi, dan suhu, serta (2) faktor biologi, yaitu volume inti dan volume kromosom saat intefase, serta faktor genetik. Keragaman yang timbul akibat mutasi fisik iradiasi, sangat tergantung pada tingkat radiosensitivitas. Studi mengenai radiosensitivitas biasanya mengarah pada pemahaman terhadap mekanisme aksi dari ionisasi radiasi. Studi semacam ini sangat bermanfaat dalam penyediaan informasi mengenai proteksi radiasi, terapi iradiasi, dan juga untuk menginduksi keragaman genetik. Dalam hal yang terakhir ini, sangat diinginkan induksi mutasi yang menyebabkan paling sedikit aberasi
kromosom, kerusakan fisik dan sterilitas, dan pada saat yang sama dapat dikontrol untuk memproduksi mutasi yang diinginkan (Datta 2001).
Secara visual tingkat sensitivitas ini dapat diamati dari respon yang diberikan tanaman, baik dari morfologi tanaman, sterilitas, maupun dosis letal 50 (LD50). LD50 adalah dosis yang menyebabkan kematian 50% dari populasi yang diradiasi. Dari banyak penelitian mutasi induksi, telah diketahui bahwa umumnya mutasi yang diinginkan terletak pada kisaran LD50 atau lebih tepatnya pada dosis sedikit dibawah LD50. Pada kasus tertentu, misalnya pada perlakuan terhadap kalus, kisaran ini menjadi LD30, yaitu dosis yang menyebabkan kematian 30% pada populasi kalus (Jain, S.M. November 2001 komunikasi pribadi); atau menjadi LD25 pada perlakuan chronic irradiation.
Dosis optimum untuk menghasilkan mutan yang diinginkan ini selain dipengaruhi oleh teknik iradiasi dan jenis tanaman, juga dipengaruhi oleh jenis sinar radiasi serta bentuk bahan tanaman yang diradiasi. Pada krisan yang diradiasi dalam bentuk stek pucuk, Banerji dan Datta (1992) menemukan dosis optimum sinar gamma untuk menghasilkan mutan yang diinginkan terbanyak (30% dari populasi tana man) adalah 25 gray; Sedangkan melalui planlet krisan, dosis iradiasi sinar gamma yang optimum menghasilkan mutan yang diinginkan berada pada kisaran 19.5-22 gray (Waluyo, 2001). Pada perlakuan dengan sinar X, dosis optimum planlet krisan adalah 80 gray (Broertjes, Roest dan Bokelmann 1976).
Pada tanaman hias berumbi, jika sinar gamma akan diradiasikan pada umbinya, maka tingkat dosis yang diberikan harus lebih rendah lagi, karena tingginya efek letal yang ditimbulkan. Melalui risetnya pada umbi narcissus, Misra (1990) menemukan bahwa perlakuan sinar gamma pada dosis 10 dan 15 gray menyebabkan pembungaan lebih awal, sedangkan lebih dari dosis itu sinar gamma mengakibatkan terhambatnya pertumbuhan daun, bahkan menyebabkan kematian umbi. Demikian juga perlakuan 10 gray sinar gamma terhadap kultivar gladiol, semua parameter pertumbuhan tanaman baik vegetatif maupun generatif memperlihatkan karakter yang inferior dibandingkan kultivar asalnya.
Teknik Iradiasi
Teknik iradiasi memang berpengaruh terhadap radiosensitivas tanaman. Umumnya iradiasi diberikan satu kali dengan dosis yang diinginkan secara cepat. Teknik
ini dinamakan teknik acute irradiation atau radisi tunggal, yaitu teknik pemberian dosis secara sekaligus dalam satu kali penembakan iradiasi. Namun untuk mengurangi kerusakan akibat iradiasi tunggal yang diberikan sekaligus, maka dicobakan pula teknik chronic irradiation. Chronic irradiation yaitu teknik iradiasi dengan cara memberikan dosis yang sangat rendah secara terus menerus dalam waktu beberapa bulan (Nagatomi S. April 2001, komunikasi pribadi).
Selain itu, ada pula pemberian iradiasi dalam beberapa kali penyinaran, dengan dosis yang terbagi sehingga pada akhirnya total dosis yang diberikan sama dengan iradiasi tunggalnya. Hal ini cukup efektif, seperti yang dibuktikan oleh Weather dan Sader (1990) bahwa teknik fractionated irradiation (iradiasi terbagi) pada eksplan pucuk gerbera membuat persentase tumbuh tunas yang lebih tinggi dibandingkan teknik acute irradiation (iradiasi tunggal). Fractionated irradiation atau iradiasi terbagi adalah teknik pemberian dosis yang diberikan dua kali, masing- masing setengah dosis atau split dose.
Teknik pemberian iradiasi lainnya yaitu dengan iradiasi berulang baik secara intermittent irradiation (jarak antar iradiasi tidak terlalu lama) atau recurrent irradiation (iradiasi ulangan diberikan dalam waktu lama, bisa dalam hitungan tahun). Intermittent irradiation merupakan teknik iradiasi berulang yang ditujukan untuk meningkatkan efek iradiasi pada suatu jaringan, dibandingkan iradiasi tunggalnya. Pada iradiasi berulang ini, radiasi diberikan sekali atau beberapa kali lagi pada beberapa waktu kemudian dengan dosis yang lebih rendah (Basiran dan Ariffin 2002)
Recurrent irradiation adalah perlakuan iradiasi yang diberikan kembali pada mutan yang telah terbentuk, dalam hitungan tahun (minimal satu tahun setelah perlakuan mutasi pertama). Pada recurrent irradiation, tidak semua tanaman mutan dapat kembali menghasilkan mutan yang baru. Dalam penelitiannya, Datta (1996) meradiasi kultivar krisan ‘D-5’ dengan sinar gamma dan menghasilkan 3 kultivar mutan yang diberi nama: ‘Alankar’, ‘Shabnam’ dan ‘Agnishika’. Ketika diberikan iradiasi berulang pada tahun berikutnya dengan 1.5, 2.0 dan 2.5 Krad sinar gamma, ternyata ketiga mutan ini memperlihatkan radiosensitivitas yang berbeda. Dari kultivar ‘Alankar’dan ‘Shabnam’ dihasilkan mutan- mutan dengan warna baru, sedangkan pada kultivar ‘Agnishika’ sama sekali tidak ada perubahan. Kultivar ini sangat stabil. Hal ini menunjukkan bahwa antar kultivar pun (intraspesies) terdapat radiosensitivitas yang berbeda.
Uji Stabilitas
Stabilitas merupakan suatu hasil yang harus dicapai di akhir suatu program pemuliaan tanaman dalam rangka melepaskan varietas baru yang unggul. Tanpa stabilitas secara genetik, suatu varietas yang baru tidak dapat dilepas ke masyarakat.
Pada tanaman yang membiak secara generatif, uji stabilitas ini menjadi penting untuk mengetahui karakter yang diinginkan merupakan sifat yang dikendalikan secara genetik sehingga dapat diwariskan kepada keturunannya, ataukah hanya bersifat epigenetik saja, misalnya disebabkan oleh faktor lingkungan, transposon dan sebagainya. Pada tanaman yang diperbanyak secara vegetatif uji stabilitas umumnya jarang dilakukan karena secara teoritis perbanyakan vegetatif tidak akan menyebabkan keragaman akibat segregasi. Namun, walaupun diperbanyak secara vegetatif, jika asal keragamannya diperoleh dari perlakuan mutasi, maka perlu diadakan uji stabilitas terhadap “keturunan” vegetatifnya. Hal ini dilakukan untuk mengantisipasi adanya fenomena alam yang dikenal dengan istilah haplontic selection atau diplontic selection (Ibrahim 1999).
Pada situasi diplontic selection, jika sel-sel mutan kalah bersaing dengan sel-sel normal di sekelilingnya, maka pada perkembangan selanjutnya jaringan tanaman akan kembali tumbuh normal. Begitu juga sebaliknya, jika sel-sel mutan yang justru dapat ‘mengalahkan’ sel-sel normal, maka pada pertumbuhan selanjutnya tanaman akan menjadi mutan, sampai pada generasi berikutnya (Ibrahim 1999; IAEA 1977).
Ahloowalia (1995) menyatakan bahwa mutan krisan dan streptocarpus memperoleh kestabilannya pada generasi M1V4 melalui metode subkultur berulang, sedangkan pada kentang, setelah tiga kali perbanyakan mikro di laboratorium (M1V3), propagula yang diaklimatisasi mencapai stabilitasnya setelah kembali melalui tiga kali perbanyakan vegetatif di lapang (M1V6). Banerji dan Datta (1992) memperoleh satu cabang pada tanaman krisan yang menjadi mutan (kimera) dari hasil penelitiannya. Mutasi cabang ini dapat “dimurnikan” menjadi mutan solid seluruh tanaman dan stabil setelah beberapa kali diperbanyak secara vegetatif. Jadi pengujian stabilitas memang perlu dilakukan untuk meyakinkan produsen tanaman hias bahwa varietas mutan tersebut telah berubah secara genetis dan stabil, sehingga dapat dijadikan sebagai tanaman induk pada nurserynya tanpa kekhawatiran akan berubah kembali.
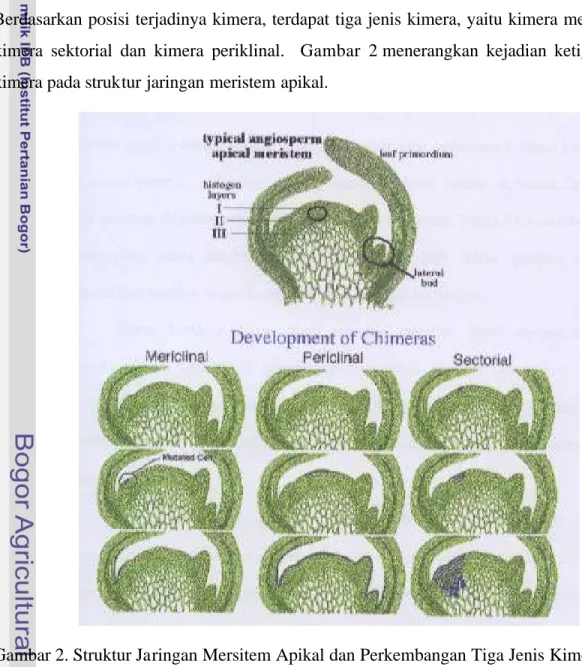
Kimera
Salah satu kekurangan metode mutasi menurut Brock (1979) adalah munculnya kimera, sifat-sifat yang justru merugikan atau tidak sesuai dengan harapan. Broertjes dan van Harten (1988) juga menyatakan bahwa salah satu pembatas dalam pemuliaan mutasi untuk tanaman yang diperbanyak secara vegetatif adalah timbulnya kimera. Hal ini terjadi karena umumnya mutasi terjadi pada satu sel, sedangkan jaringan multiseluler terdiri atas sel epidermis (L-I), sub-epidermis (L-II) dan korpus (L-III).
Kimera adalah jaringan tanaman yang mengandung sel yag termutasi dan sel-sel normal, sehingga memiliki konstitusi genetik yang berbeda (van Harten 2002). Berdasarkan posisi terjadinya kimera, terdapat tiga jenis kimera, yaitu kimera meriklinal, kimera sektorial dan kimera periklinal. Gambar 2 menerangkan kejadian ketiga jenis kimera pada struktur jaringan meristem apikal.
Pada kimera periklinal, sel mutan berkembang secara paralel (horisontal) sehingga menjadi suatu lapisan sel yang memiliki karakter yang berbeda. Sebagai contoh pada Gambar 2 tampak sel mutan berkembang menjadi satu lapisan epidermis yang memiliki karakter berbeda (misalnya pada pucuk meristem yang diploid, terdapat lapisan epidermis tetraploid). Pada kimera sektorial, sel mutan berkembang secara vertikal ke dalam jaringan sehingga membentuk suatu sektor dengan karakter yang berbeda dari karakter organ lainnya. Pada kimera meriklinal, sel mutan hanya berkembang horisontal pada sektor suatu organ saja (Steeves dan Sussex 1989).
Uji Kromosom
Umumnya, karakterisasi dan identifikasi keragaman yang timbul pada tanaman akibat mutasi dilakukan secara fenotipik, yaitu melalui penampakan morfologi tanaman. Namun, identifikasi yang terinci dan akurat kadang-kadang cukup sulit dilakukan jika hanya mengandalkan pada penampakan fenotip saja.
Perlakuan mutasi induksi dapat menyebabkan terjadinya mutasi gen atau mutasi kromosom. Crowder (1993) menyebutnya sebagai mutasi mikro (perubahan terjadi pada susunan molekulgen (DNA) atau nukleotida) dan mutasi makro (perubahan terjadi pada struktur dan susunan kromosom). Jadi mutasi gen hanya terjadi pada tingkat gen, bahkan bisa terjadi hanya pada sepasang basa saja yang disebut point mutation atau mutasi titik.
Mutasi kromosom terjadi jika perubahan terdapat di tingkat kromosom baik terhadap jumlah maupun struktur kromosom. Perubahan struktur kromosom bisa terjadi akibat delesi, inversi, duplikasi, atau translokasi. Pada delesi dan inversi, patahan kromosom terjadi hanya pada satu pasang kromosom, sedangkan pada duplikasi dan translokasi, lebih dari satu pasang kromosom yang terlibat dalam peristiwa aberasi kromosom (Schulz dan Schaeffer 1980)
Delesi adalah mutasi akibat hilangnya suatu segmen dari kromosom. Jika delesi terjadi pada ujung kromosom maka disebut delesi terminal, dan jika terjadi pada bagian tengah kromosom disebut delesi interkalar atau delesi interstisial (Suryo 1995). Jika delesi terjadi pada kedua kromosom yang homolog maka terjadi delesi homozigot yang biasanya letal. Jika hanya salah satu kromosom homolog yang mengalami delesi, maka disebut hemizigot. Jika delesi terjadi pada alel gen dominan yang heterozigot maka
fenotipe alel resesifnya akan tampak sehingga terjadi efek pseudodominan. Kejadian pseudominan karena delesi heterozigot dan lengkungan delesi dapat digunakan untuk menentukan lokasi fisik gen pada kromosom (Sujiprihati dan Syukur 2004).
Duplikasi adalah perubahan akibat penggandaan atau penambahan ruas kromosom. Duplikasi mungkin terjadi akibat síntesis DNA yang berlebihan saat replikasi. Pada eukariot, suatu penyimpangan dari rekombinasi homolog dapat dianggap sebagai sumber terjadinya duplikasi. Pada jaringan yang sedang aktif membelah, ujung kromatid kembar yang mengalami patahan dapat berfusi dan bereplikasi, kemudian memasuki fase mitosis. Akibat berfusinya ujung patahan kromosom, maka terciptalah jembatan pada anafase, kemudian jembatan tersebut patah akibat penarikan benang gelendong ke dua kutub yang berbeda, dan ujung patahan yang lengket akan kembali berfusi lagi. Kejadian ini dikenal sebagai breakage-fusion-bridge-cycle atau siklus jembatah-patah-berfusi (Schulz dan Schaeffer 1980).
Inversi adalah pemutaran struktur kromosom yang terjadi melalui pemutaran arah suatu ruas kromosom. Inversi muncul akibat pindah silang yang berlangsung antara dua situs homolog yang terdapat dalam satu kromosom. Terdapat dua tipe inversi, yaitu inversi parasentrik dan inversi perisentrik. Inversi perisentrik terjadi bila sentromer terdapat dalam segmen inversi, sedangkan inversi parasentrik terjadi jika sentromer terdapat di luar ruas inversi (Sujiprihati dan Syukur 2004).
Translokasi adala h mutasi yang terjadi akibat perpindahan segmen dari satu kromosom ke kromosom lain yang bukan pasangan homolognya. Antara dua kromosom yang non-homolog, masih mungkin terdapat ruas-ruas yang homolog walau dengan panjang terbatas. Hal ini terjadi, misalnya akibat adanya ruas berulang. Translokasi dapat bersifat resiprok, atau hanya searah saja. (Suryo 1995, Sujiprihati dan Syukur 2004).
Perubahan dalam jumlah kromosom dapat mengakibatkan perubahan tingkat ploidi akibat penambahan atau pengurangan set kromosom (‘euploidi’) atau menyebabkan ketidakgenapan jumlah kromosom akibat adanya penambahan atau kehilangan satu atau beberapa kromosom pada genomnya (‘aneuploidi’). Tipe-tipe aneuploid dikelompokkan berdasarkan banyaknya kromosom yang hilang dan atau bertambah dalam satu individu. Nulisomik (2n-2) terjadi jika kehilangan 2 kromosom homolog, monosomik (2n-1) terjadi jika kehilangan 1 kromosom, trisomik (2n+1) jika
bertambah 1 kromosom, tetrasomik (2n+2) jika bertambah 2 kromosom homolog, dan seterusnya (Poespodarsono 1988).
Dalam analisis sitologi terhadap lima kultivar krisan mutan yang diradiasi sinar gamma, aberasi kromosom teramati pada penelitian Datta dan Datta (1998). Selain itu, peningkatan sterilitas polen ditemukan sangat nyata pada semua mutan yang terbentuk. Pada penelitian ini Datta dan Datta menggunakan teknik SEM (Scanning Electron Micrograph) untuk menunjukkan adanya perbedaan yang nyata dari pola bentuk permukaan exine polen pada 4 kultivar mutan.
Analisis Isozim
Keragaman genetik tidak cukup hanya diamati secara sitologis melalui pengamatan kromosom selama pembelahan sel. Hal ini terjadi karena perubahan segmen ataupun adanya sisipan segmen pada suatu kromosom tidak dapat teramati dengan penggunaan mikroskop. Selain itu, seringkali keragaman yang timbul pada tanaman berbeda satu sama lainnya, hanya disebabkan oleh sejumlah kecil gen saja.
Untuk mengukur keragaman spesies tanaman, kini telah banyak berhasil dilakukan melalui teknik isozyme. Isozim adalah suatu enzim yang terdiri dari beberapa molekul aktif yang mempunyai struktur kimia berbeda dan dikode oleh gen yang berbeda, akan tetapi mengkatalisis reaksi yang sama (Taiz dan Zeiger 1991).
Aktivitas isozim yang dapat diuji pada tanaman sangat beragam tergantung spesies tanaman karena masing- masing tanaman memiliki isozim utama. Enzim yang banyak dijumpai pada tanaman diantaranya adalah peroxidase (PER) dan esterase (EST). PER merupakan enzim dalam sel tanaman yang terlibat dalam sintesis lignin, selain dijumpai juga di vakuola. Dalam pemilihan enzim yang akan digunakan, selain dengan alasan karena enzim tersebut banyak dijumpai pada tanaman, Bouman dan de Klerk (1997) juga mengingatkan agar mempertimbangkan adanya pengaruh fisiologi dan fase perkembangan tanaman terhadap keberadaan enzim. Untuk itu disarankan untuk menggunakan enzim yang bersifat stabil terhadap perubahan fisiologi maupun fase perkembangan tanaman, seperti enzim MDH (malate dehydrogenase), ADH (alkohol dehydrogenase), ACP (Acid phosphatase), PGA (phosphoglucoisomerase) dan PGM (phosphoglucomutase).
Heritabilitas
Heritabilitas (h2) adalah hubungan antara ragam genotipe dengan ragam fenotipenya. Hubungan ini menggambarkan seberapa jauh fenotipe yang tampak merupakan refleksi dari genotipe. Jadi konsep heritabilitas mengacu pada peranan faktor genetik dan juga lingkungan terhadap pewarisan suatu karakter. Sesuai dengan komponen ragam genetiknya, heritabilitas dibedakan menjadi heritabilitas dalam arti luas (broad sense heritability) dan heritabilitas dalam arti sempit (narrow sense heritability). Menurut Fehr (1987) heritabilitas dalam arti luas merupakan perbandingan antara ragam genetik total dan ragam fenotip (h2(BS) = σ2G /σ2P), sedangkan heritabilitas dalam arti sempit merupakan perbandingan antara ragam aditif dan ragam fenotip (h2(NS) = σ2A /σ2P). Pada tanaman, banyak metode yang digunakan untuk menduga nilai heritabilitas, antara lain dengan perhitungan ragam turunan, dengan regresi parent-offspring, atau dengan perhitungan komponen ragam dari analisis ragam. Metode yang digunakan untuk menduga nilai heritabilitas ini tergantung dari populasi yang dimiliki oleh pemulia dan tujuan yang ingin dicapai (Sutjahjo, Sujiprihati dan Syukur 2005). Nilai duga heritabilitas berkisar antara 0-1. Bila heritabilitas bernilai 1 (100%) maka munculnya keragaman fenotipik disebabkan oleh faktor genetik, sedangkan bila heritabilitas 0 maka keragaman fenotipik disebabkan oleh faktor lingkungan (Welsh 1981).
Pemuliaan Tanaman Hias dengan Mutasi Induksi
Mutasi induksi sangat berperanan penting dalam perakitan varietas unggul pada berbagai jenis tanaman hias. Hal ini disebabkan tidak semua tanaman hias mampu dengan mudah menghasilkan biji, sehingga sulit dilakukan hibridisasi. Selain itu, pemuliaan mutasi sangat bermanfaat untuk meningkatkan keragaman pada jenis tanaman dengan variasi keragaman sempit seperti manggis, Alpinia purpurata (lengkuas merah).
Penelitian mutasi induksi somatik di National Botanical Research Institute Lucknow, India terhadap beberapa komoditas tanaman hias dari tahun 1974 sampai 1998 menghasilkan 75 mutan yang telah dilepas sebagai kultivar baru dan unggul. Varietas mutan tersebut terdiri atas empat varietas bougenvillea, 43 varietas mutan krisan, satu varietas kembang sepatu, tiga varietas mutan lantana, enam varietas mutan portulaka, 16 varietas mutan mawar dan dua varietas mutan sedap malam (Gupta 1979; Datta 2001).
Penelitian Busey (1980) pada stolon tanaman St. Augustinegrass (Stenotaphrum secundatum (Walt.) Kuntze) yang diradiasi dengan 4.5 krad (= 45 gray) sinar gamma menghasilkan tanaman mutan sebanyak 7 % dari tetua FA-243. Selanjutnya Datta dan Banerji (1993) menghasilkan variasi warna pada krisan mutan, dari warna asli ungu menjadi belang putih-krem dengan dosis 20 gray sinar gamma, serta menjadi putih dan berbentuk pompon dengan dosis 25 gray. Galur mutan ini dirilis di India tahun 1995.
Misra (1998) juga melakukan mutasi induksi pada gladiol dengan sinar gamma, dan diketahui bahwa sampai pada dosis 30 gray sinar gamma menghasilkan perubahan warna secara parsial dari ungu ke putih, pada beberapa tanaman membentuk umbi kembar, dan meningkatkan jumlah bunga per tanaman. Pada kalanchoe, Boertjes dan Leffring (1972) telah berhasil membentuk mutan non-kimera yang solid dengan meradiasi daun. Daun ini kemudian digunakan sebagai eksplan yang ditumbuhkan in vitro, dan planlet yang tumbuh dari eksplan tersebut ternyata menjadi mutan yang solid.
Desai dan Abraham (1979) telah menghasilkan 13 mutan pada sedap malam, melalui penembakan 142-335 rad sinar fast neutron. Dari 10 000 umbi sedap malam yang diradiasi, ketiga belas mutan yang dihasilkan itu seluruhnya mengalami perubahan pada daun dalam uk uran, bentuk dan warna daun yang menjadi variegata. Tidak satupun mutan menunjukkan perubahan fenotip pada organ bunga. Hal ini terjadi mengingat sedap malam termasuk jenis tanaman yang sulit termutasi, sehingga dibutuhkan ukuran populasi yang banyak untuk diradiasi. Akan tetapi pada jenis tanaman yang termasuk pada chimer group (seperti krisan dan anyelir), tanaman ini akan sangat mudah termutasi oleh perlakuan mutagen yang diberikan. Dengan meradiasi hanya dua planlet krisan saja, Ahloowalia (1995) memperoleh 20 mutan dari 105 planlet ya ng diperoleh pada MV3. Dari 20 mutan ini, diperoleh 15 mutan yang solid, seragam dan stabil setelah melalui tiga kali perbanyakan secara vegetatif.
Pemuliaan Tanaman Anyelir
Anyelir merupakan tanaman hias bunga yang telah dikembangkan sedemikian rupa sehingga menghasilkan banyak jenis dan rupa baru, yang sangat berbeda dari jenis aslinya. Disebutkan oleh Besemer (1980) bahwa pemuliaan tanaman anyelir telah dimulai sejak abad ke-16. Jenis anyelir yang menjadi “tipe Amerika” dikembangkan di
Perancis pada 1840 dan diintroduksi ke Amerika pada 1852. Kultivar “William Sim” yang dikembangkan oleh Willian Sim dari Berwick Utara, Maine, USA, pada tahun 1839 merupakan jenis anyelir yang memberikan kontribusi terbesar terhadap industri anyelir saat ini. Dari kultivar “William Sim” berwarna merah ini dimutasikan berbagai warna petal baru seperti putih, pink, orange dan berbagai bentuk variegata. Sekitar 25% dari kultivar-kultivar anyelir yang dipasarkan di Belanda adalah berasal dari perlakuan mutasi induksi. Dalam waktu enam tahun setelah kultivar “William Sim” diintroduksikan ke Belanda, lebih dari 50 kultivar mutan berhasil dikomersialisasikan di negara tersebut.
Ansori (1993) dari hasil penelitiannya dengan iradiasi sinar gamma, memperoleh dua macam keturunan anyelir yang berbeda dari induknya, yaitu dari tetua yang berwarna merah muda polos menjadi berwarna kuning muda bergaris-garis pendek merah muda, atau menjadi berwarna merah muda berbintik putih. Selain itu, perlakuan iradiasi sinar gamma 1500 rad dan 2000 rad juga meningkatkan pertambahan tinggi jumlah tunas pada kultur in vitro anyelir, dibandingkan tanaman yang tidak diradiasi. Mutasi induksi juga dilaporkan bisa menghasilkan kuntum bunga anyelir yang lebih besar diameternya (Broertjes dan van Harten 1988).
Melalui penelitiannya, Johnson (1980) melaporkan bahwa dosis 68 gray iradiasi sinar gamma yang diberikan pada stek pucuk sembilan kultivar anyelir menimbulkan kimera periklinal pada lima kultivar, sedangkan keempat kultivar lainnya menunjukkan perubahan warna non-chimera. Kultivar non-kimera hanya menghasilkan bunga normal (sesuai aslinya) dan bunga mutan solid saja.
Di Balai Penelitian Tanaman Hias Segunung telah dilakukan serangkaian kegiatan pemuliaan tanaman anyelir dan telah dirilis empat kultivar anyelir dengan nama ‘Top Beauty’, ‘Snazzy’, ‘Unique’, dan ‘Puspita Arum’.
Pemanfaatan Kultivar Hasil Mutasi Induksi Secara Ekonomi
Divisi Pemuliaan Tanaman dan Genetika pada biro kerjasama antara FAO dan IAEA (“International Atomic Energy Agency”) telah mengumpulkan seluruh informasi mengenai kultivar-kultivar mutan yang telah dilepas sebagai varietas hasil induksi mutasi dengan teknik iradiasi. Sampai tahun 1985 saja, telah tercatat ada 794 varietas mutan yang dirilis, dan 270 (34%) diantaranya adalah tanaman hias. Di Jepang, kultivar yang
paling banyak dihasilkan dari mutasi iradiasi adalah untuk jenis tanaman hias yang diperbanyak secara vegetatif. Dari 138 kultivar mutan yang dirilis, 106 diantaranya adalah spesies chrysanthemum, 21 spesies begonia dan 11 sisanya berbagai macam tanaman hias dari dua genus (Kawai 1986). Pada tahun 2000, tercatat 2252 varietas mutan dari jenis tanaman bernilai ekonomi tinggi yang terdaftar dalam database FAO/IAEA (Maluszynski 2000). Dari 2252 entry tersebut, 552 diantaranya adalah mutan dari jenis tanaman hias, dan dari sekian banyak kultivar mutan yang telah dihasilkan tersebut, 66 % diantaranya dibentuk melalui mutagen iradiasi sinar gamma.
Dari database FAO/IAEA ini juga tercatat peranan varietas mutan secara ekonomi di sejumlah negara. Varietas-varietas mutan yang telah dirilis di Jepang ternyata dapat menyumbang sebesar US$ 30 juta pendapatan per tahun dari pear cv.’Gold Nijisseiki’ dan dari 18 kultivar padi mutan, total dihasilkan senilai US$ 937 juta per tahun; Kemudian di India, penambahan pendapatan yang dicapai sejak dirilisnya empat kultivar blackgram mutan adalah sebesar US$ 163 juta; Bahkan di Pakistan, nilai total per tahun yang dihasilkan dari kapas mutan cv.’NIAB-78’ sebanyak US$ 3 milyar.
Di Indonesia, pembentukan kultivar- kultivar dari mutasi induksi telah lama dirintis melalui penelitian-penelitian kerja sama dengan PATIR BATAN (Pusat Aplikasi Teknologi Isotop dan Radiasi, Badan Tenaga Atom Nasional) dan beberapa hasilnya telah dirilis, dimulai dengan varietas padi ‘Atomita’ pada tahun 1972 (BATAN 1996). BATAN juga akan me rilis 6 varietas padi yang tahan wereng coklat (biotype 2 dan 3) serta tahan terhadap bercak daun, 1 varietas kacang merah tahan terhadap kekeringan dan bercak Cercospora, serta 3 varietas kedelai tahan terhadap lahan masam dan keracunan aluminium. Penelitian pada cabe untuk mencari varietas tahan antraknosa, pada kapas untuk memperoleh ketahanan terhadap pengorok buah dan pada nilam dimaksudkan untuk meningkatkan kandungan minyak nilam. Penelitian pada krisan dilakukan dengan tujuan untuk memperoleh varietas yang mempunyai fotoperiodisme yang pendek (P3TIR BATAN 2000).