7
KALSIUM ALGINAT SEBAGAI PENDUKUNG AMOBILISASI
L-ASPARAGINASE DARI BAWANG PUTIH
(Allium sativum)
Nindy Kusumaningtias
*, Nies Suci Mulyani dan Purbowatiningrum Ria
Sarjono
Laboratorium Biokimia Jurusan Kimia Fakultas Sains dan Matematika Universitas Diponegoro, Semarang, Indonesia
*Keperluan korespondensi, telp: 081226283898, email: nindykusuma94@gmail.com
Received: July 22 , 2016 Accepted: August 15, 2016 Online Published: August 31, 2016
ABSTRAK
Enzim Asparaginase adalah enzim yang mampu menghidrolisis asam amino L-Asparagin menjadi L-Aspartat dan amonia. Dalam Industri makanan, L-asparagin merupakan salah satu asam amino yang mampu bereaksi dengan suatu gugus karbonil dalam bahan makanan yang dipanaskan. Reaksi tersebut berjalan melalui jalur reaksi Maillard membentuk senyawa akrilamida yang bersifat karsinogenik. Tujuan dari penelitian ini adalah untuk mendapatkan enzim Asparaginase serta memperoleh karakter suhu dan pH optimum L-Asparaginase dari bawang putih (Allium sativum) dalam bentuk enzim bebas maupun enzim amobil dengan pendukung kalsium alginat. Tahap pertama penelitian dimulai dari isolasi L-Asparaginase dari bawang putih dan pemurnian melalui pengendapan dengan amonium sulfat dan dialisis. Tahap kedua melakukan uji aktivitas spesifik dan karakterisasi L-Asparaginase dengan cara menghitung jumlah produk amonia yang terbentuk menggunakan pereaksi Nessler dan mengukur kadar protein total dengan metode Lowry. Tahap selanjutnya yaitu amobilisasi L-Asparaginase dalam matriks alginat dengan metode penjebakan. Tahap terakhir dari penelitian ini yaitu karakterisasi L-Asparaginase amobil. Hasil penelitian ini menunjukkan aktivitas spesifik tertinggi L-Asparaginase dari bawang putih ada pada fraksi 5 (80-100%) yaitu 1423,0248 U/mg protein. Kondisi optimum L-Asparaginase bebas yaitu pada suhu 37°C, pH 8,6. Enzim LAsparaginase dapat diamobil dalam matriks kalsium alginat dengan aktivitas spesifiik sebesar 1367,6741 U/mg protein yang diukur pada kondisi optimumnya yaitu pada suhu 42°C, pH 8,6.
Kata Kunci: Allium sativum, L-Asparaginase, Amobilisasi, Kalsium Alginat
ABSTRACT
Enzyme L-asparaginase hydrolizes L-asparagine into L-aspartate and ammonia. In the food industry L-asparagine in one of amino acid that is reactable with a carbonyl group in heated foodstuffs. The reaction comes through Maillard reactions to form carcinogenic compound, acrylamide. This study aims to obtain the enzyme L-Asparaginase from garlic (Allium sativum) as free enzymes and immobilized enzymes using calcium alginate supporters, and as well as its characterizations of temperature and pH optimum. This research was conducted into four steps. First step: isolation of L-Asparaginase from garlic and purification by precipitation with ammonium sulfate and dialysis. Second step: determination of specific activity of the purified L-Asparaginase based on ammonia product detected by Nessler reagent, protein concentration were measured using Lowry methods. The third step: immobilization of L-Asparaginase into the alginate matrix with trapping methods. The last step of this research is characterization of L-Asparaginase immobilized. The results showed that the highest specific activity of L-Asparaginase of garlic were found in fraction 5 (80-100%), 1423.0248 U/mg protein. Optimum condition of L-Asparaginase as free form is at a temperature of 37 °C and pH 8.6. That enzymes can be ammobilized into calcium alginate matrix and hahe spesifiik activities of 1367.6741 U/mg protein at a temperature of 42 ° C and pH 8.6.
PENDAHULUAN
Enzim L-Asparaginase (L-Asparagin amidohidrolase, E.C.3.5.1.1) merupakan enzim yang mampu mengkatalisis reaksi hidrolisis Asparagin menjadi asam L-Aspartat dan amonia [5]. Enzim
L-Asparaginase juga terbukti dapat
menurunkan kadar akrilamida di dalam makanan. Enzim L-Asparaginase dapat mencegah pembentukan akrilamida dengan mengkonversi asam amino L-Asparagin sebagai prekusornya menjadi bentuk asam amino lain yaitu asam L-Aspartat yang umum terdapat dalam makanan [1].
Akrilamida bersifat karsinogenik pada manusia. Akrilamida dapat muncul pada
makanan apabila dipanaskan sebagai
konsekuensi terjadinya reaksi antara L-Asparagin dan sumber karbonil melalui reaksi Maillard [1]. Beberapa penelitian
membuktikan bahwa pre-treatment
menggunakan enzim L-Asparaginase
terhadap kentang dan dough efektif
mereduksi akrilamida tanpa merusak
penampilan dan rasa dari hasil akhir produk
makanan [3]. Efektivitas enzim
L-Asparaginase dalam mereduksi akrilamida juga telah teruji dan dijadikan beberapa paten yang berbeda dalam pengolahan makanan seperti camilan, keripik, dough, dll [4].
Selama ini, bawang putih (Allium sativum) dimanfaatkan sebagai bumbu penyedap makanan dan diekstrak kemudian
dikapsulkan sebagai suplemen untuk
memelihara kesehatan tubuh. Di sisi lain, bawang putih juga mengandung enzim L-Asparaginase [7]. Untuk itu, padapenelitian ini digunakan bawang putih sebagai sumber
enzim L-Asparaginase. Penelitian yang dilakukan Rizki dkk (2009) menunjukkan bahwa bawang putih mengandung enzim L-Asparaginase dengan aktivitas spesifik sebesar 506,158 U/mg protein pada suhu optimum 37°C, dan pH optimum 8,6. Aktivitas spesifik ini dinilai cukup tinggi untuk kemudian diteliti dan dilakukan amobilisasi agar dapat dilakukan pemakaian secara berulang.
Amobilisasi dilakukan dengan matriks alginat karena sifatnya yang tidak beracun, mekanisme kestabilan dan porositasnya
tinggi, memerlukan prosedur yang
sederhana untuk ammobilisasi, dan
harganya murah untuk diaplikasikan dalam industri makanan atau farmasi [2].
Dari uraian diatas, penelitian ini bertujuan untuk memperoleh enzim L-Asparaginase baik bebas maupun amobil dan memberikan informasi karakter enzim L-Asparaginase bebas dan amobil dari bawang putih pada matriks kalsium alginat.
METODE PENELITIAN
Bahan dan AlatBahan: Bawang putih, bufer
tris-hidroksimetil aminometan p.a., amonium sulfat p.a., L-asparagin p.a., Trichloro acetate (TCA) p.a., Bovine serum albumine
(BSA) p.a., Follin ciocalteau p.a., natrium alginat, kalsium klorida p.a., barium klorida p.a., akuades, natrium karbonat p.a., kalium natrium tartrat p.a., tembaga sulfat p.a., reagen Nessler (kalium iodida dan raksa (II) iodida).
Alat: Sentrifugasi (Centrific-228),
spektrofotometer UV-Vis (Shimadzu),
neraca analitik (kern 870), magnetic stirer
(Quart), kulkas, membran selofan, kertas saring, gunting, tali, botol semprot,
aluminium foil, plastic wrap, dan alat-alat gelas untuk analisa.
Cara Kerja 1. Isolasi Enzim
Sampel penelitian berupa 250 g umbi bawang putih Allium sativum yang ditumbuk kemudian ditambahkan dengan 125 mL 0,2 M bufer tris-hidroksimetil aminometan pH 8,6 dan dihomogenkan. Homogenat yang diperoleh selanjutnya di didiamkan 1-2 jam pada suhu 5oC kemudian disaring dan filtratnya disentrifugasi. Supernatan yang diperoleh merupakan ekstrak kasar enzim (EK).
2. Pemurnian Enzim
2.1 Fraksinasi Amonium Sulfat
Pengendapan dengan garam
amonium sulfat dilakukan untuk memurnikan enzim (enzim kasar) dengan prinsip pengendapan. Amonium sulfat ditimbang sesuai fraksi yang dikehendaki 0-20% (dari tabel fraksinasi) dimasukkan dalam gelas beaker berisi ekstrak kasar sambil diaduk dengan magnetic stirer dalam keadaan
dingin. Campuran didiamkan semalam
dalam keadaan dingin kemudian
disentrifugasi dengan kecepatan 5000 rpm selama 15 menit sehingga diperoleh endapan dan filtrat untuk fraksi 0-20% (F1).
Endapan dipisahkan dan disuspensi dengan 0,2 M bufer Tris-hidroksimetil aminometan pH 8,6. Endapan tersebut merupakan fraksi 0-20%. Filtrat diperlakukan sama dengan diatas sehingga diperoleh fraksi-fraksi protein dengan tingkat kejenuhan 20-40%, 40-60%, 60-80%, 80-100%.
2.2 Dialisis Enzim
Dialisis dilakukan dengan membran selofan.Selofan yang telah berisi enzim direndam dalam bufer tris-hidroksimetil aminometan 0,002 M pH 8,6 dalam keadaan dingin. Bufer diaduk dengan magnetic stirrer
dan dilakukan pengujian kandungan
amonium sulfatnya setiap 2 jam dengan penambahan BaCl2. Dialisis dihentikan jika
hasil pengujian tidak lagi menghasilkan endapan putih.
2.3 Penentuan Aktivitas Enzim
Larutan substrat 1 mL L-asparagin ditambahkan dengan 0,05 mL enzim bebas dan 2,5 bufer tris-hidroksimetil aminometan 0,2 M pH 8,6 diinkubasi pada suhu 37oC selama 30 menit kemudian ditambahkan larutan TCA 1,5 M sebanyak 1 mL dan disentrifugasi pada kecepatan 5000 rpm
selama 15 menit untuk memisahkan
endapan. Filtrat diambil sebanyak 0,5 mL lalu ditambah 4 mL akuades dan 1 mL pereaksi Nessler. Campuran ini kemudian
diukur absorbansinya pada panjang
gelombang optimum (402 nm) dengan spektrofotometer UV-Vis. Aktivitas enzim ditentukan secara regresi linier terhadap kurva standar amonium sulfat.
2.4 Penentuan Kadar Protein dengan Metode Lowry
Sebanyak 9,8 mL larutan Na2CO3
ditambah 0,1 mL larutan kalium natrium tartrat dan 0,1 mL larutan CuSO4 kemudian
dikocok perlahan. Campuran ini kemudian ditambahkan 0,1 mL larutan ekstrak kasar atau enzim (F1, F2, F3, F4 dan F5) dan diinkubasi selama 10 menit pada suhu kamar. Campuran ini ditambahkan 1 mL
folin-ciocalteau kemudian diinkubasi kembali selama 30 menit pada suhu kamar. Larutan
tersebut selanjutnya diukur absorbansinya
menggunakan spektrofotometer UV-Vis
pada panjang gelombang optimum BSA (726 nm). Kadar protein ditentukan secara regresi linier terhadap kurva standar BSA.
3. Karakterisasi Enzim 3.2 Penentuan Suhu Optimum
Larutan substrat L-Asparagin 1 mL, ditambah 0,05 mL enzim dan 2,5 mL bufer tris-hidroksimetil aminometan 0,2 M pH 8,6 dan diinkubasi selama 30 menit dengan variasi suhu (27, 32, 37, 42, 47)°C. Tahap selanjutnya ditambahkan larutan TCA 1,5 M sebanyak 1 mL. Campuran ini diambil sebanyak 0,5 mL lalu ditambahkan 4 mL akuades dan 1 mL pereaksi Nessler. Larutan ini kemudian diukur absorbansinya pada panjang gelombang optimum (402 nm) dengan spektrometer UV-Vis.
3.3 Penentuan pH Optimum
Larutan substrat L-Asparagin 1 mL, ditambah 0,05 mL enzim dan 2,5 mL bufer tris-hidroksimetil aminometan 0,2 M dengan variasi pH (8,2; 8,4; 8,6; 8,8; 9,0) dan diinkubasi pada suhu 37°C selama 30 menit. Campuran ini ditambahkan larutan TCA 1,5 M sebanyak 1 mL. Larutan tersebut diambil sebanyak 0,5 mL lalu ditambahkan 4 mL akuades dan 1 mL pereaksi Nessler.
Campuran ini kemudian diukur
absorbansinya pada panjang gelombang optimum (402 nm) dengan spektrometer UV-Vis.
3.4 Amobilisasi Enzim
Pembuatan larutan Natrium Alginat 3%. Natrium alginat dilarutkan dalam bufer tris-hidroksimetil aminometan 0,2 M pH 8,6 dalam keadaan panas dan diaduk hingga homogen. Suhu diturunkan menjadi 37°C,
natrium alginat ditambahkan 0,1 mL enzim sambil diaduk hingga homogen. Penetesan dilakukan menggunakan pipet tetes ke dalam larutan CaCl2 0,2 M dingin kemudian
diinkubasi selama 2 jam. Manik-manik enzim yang telah terbentuk disaring menggunakan kertas saring untuk dipisahkan dari larutan kalsium klorida lalu dicuci menggunakan akuades sebanyak 3 kali. Larutan kalsium klorida ini selanjutnya digunakan untuk mengukur kadar protein teramobil.
4. Karakterisasi Enzim Amobil 4.1 Penentuan Suhu Optimum
Enzim amobil ditambah larutan
substrat L-Asparagin sebanyak 1 mL dan 2,5 mL bufer tris-hidroksimetil aminometan 0,2 M pH 8,6 dan diinkubasi selama 30 menit dengan variasi suhu (27, 32, 37, 42, 47)°C. Campuran ini ditambahkan larutan TCA 1,5 M sebanyak 1 mL. Larutan tersebut diambil sebanyak 0,5 mL lalu ditambahkan 4 mL akuades dan 1 mL pereaksi Nessler.
Campuran ini kemudian diukur
absorbansinya pada panjang gelombang optimum (402 nm) dengan spektrometer UV-Vis.
4.2 Penentuan pH optimum
Enzim amobil ditambah larutan substrat L-Asparagin sebanyak 1 mL, ditambah 0,05 mL enzim dan 2,5 mL bufer tris-hidroksimetil aminometan 0,2 M dengan variasi pH (8,2; 8,4; 8,6; 8,8; 9,0) dan diinkubasi selama 30 menit pada suuhu 37°C. Campuran ini ditambahkan larutan TCA 1,5 M sebanyak 1 mL. Selanjutnya filtrat diambil sebanyak 0,5 mL lalu ditambahkan 4 mL akuades dan 1 mL pereaksi Nessler. Campuran ini kemudian
gelombang optimum (402 nm) dengan spektrometer UV-Vis.
4.3 Penentuan Kadar Protein Enzim Amobil
Filtrat hasil rendaman (CaCl2) dan
larutan hasil pencucian (akuades) enzim amobil diukur kadar proteinnya dengan metode Lowry. Sebanyak 9,8 mL larutan Na2CO3 ditambah 0,1 mL larutan kalium
natrium tartrat dan 0,1 mL larutan CuSO4
dikocok perlahan. Campuran ini kemudian ditambahkan 1 mL filtrat dan diinkubasi selama 10 menit pada suhu kamar.
Sebanyak 1 mL folin-ciocalteau
ditambahkan pada campuran tersebut
secara cepat dan diinkubasi pada suhu kamar selama 30 menit. Larutan tersebut
diukur absorbansinya pada panjang
gelombang optimum BSA (726 nm)
kemudian ditentukan kadar protein yang terserap dilakukan dengan menghitung selisih antara kadar protein enzim bebas dengan kadar protein filtrat.
HASIL DAN PEMBAHASAN
1. Isolasi dan Purifikasi L-Asparaginase dari Bawang Putih.
Isolasi L-Asparaginase dilakukan secara mekanik yaitu dengan mengekstrak bawang putih melalui pemecahan jaringan bawang putih.
Ekstrak kasar enzim merupakan campuran protein enzim dan protein non enzim yang diperoleh dari proses ekstraksi bawang putih. Untuk memperoleh enzim L-Asparaginase dengan tingkat kemurnian yang tinggi maka perlu dilakukan pemurnian terhadap ekstrak kasar. Pemurnian yang dilakukan adalah dengan pengendapan
protein menggunakan garam amonium sulfat, sentrifugasi dan dialisis.
Ammonium sulfat lebih sering
digunakan karena memiliki beberapa
kelebihan dibandingkan garam-garam yang lain, yaitu mempunyai kelarutan yang tinggi, tidak mempengaruhi aktivitas enzim, mempunyai daya pengendapan yang efektif,
mempunyai efek penstabil terhadap
kebanyakan enzim, dapat digunakan pada berbagai pH dan harganya murah [8].
Hasil pemurnian yang diperoleh berupa fraksi endapan protein dengan berbagai tingkat kemurnian. Penambahan garam pada konsentrasi tinggi akan menurunkan kelarutan protein. Hal ini dikarenakan adanya peningkatan muatan listrik di sekitar protein yang akan menarik molekul-molekul air dari protein. Interaksi hidrofobik sesama molekul protein pada suasana ionik tinggi akan menyebabkan pengendapan protein, yang disebut salting out. Protein yang hidrofobisitasnya tinggi akan mengendap lebih dahulu, sedangkan protein yang memiliki sedikit residu non polar (lebih hidrofilik) akan tetap larut meskipun pada konsentrasi garam yang paling tinggi [8].
Pada tahap pemurnian selanjutnya, dialisis dilakukan sebagai metode untuk memisahkan partikel-partikel kecil dari
partikel-partikel yang lebih besar
menggunakan membran semipermeabel
berdasarkan prinsip difusi, yaitu
perpindahan molekul dari larutan
berkonsentrasi tinggi ke larutan
berkonsentrasi rendah.Enzim yang
merupakan molekul berukuran besar akan tetap tertahan di dalam membran karena tidak mampu melewati pori-pori membran
selofan. Garam amonium sufat sebagai molekul kecil akan bermigrasi keluar membran sehingga enzim menjadi lebih murni.
2. Uji Aktivitas Spesifik Enzim L-Asparaginase.
Penentuan aktivitas spesifik ini bertujuan untuk mengetahui kemurnian tiap fraksi enzim. Enzim L-Asparaginase dalam
menghidrolisis substrat L-Asparagin
menghasilkan produk asam L-Aspartat dan amonia. Aktivitas enzim L-Asparaginase dapat diketahui dari total amonia yang dihasilkan dari reaksi enzimatis melalui metode Nessler.
Aktivitas spesifik enzim
L-Asparaginase dari bawang putih dapat dilihat pada Gambar 1. Satu unit aktivitas enzim L-Asparaginase didefinisikan sebagai aktivitas enzim yang menghasilkan 1μmol produk L-Aspartat maupun amonia per satuan menit pada kondisi optimum. Aktivitas spesifik enzim L-Asparaginase ditentukan berdasarkan perhitungan unit aktivitas enzim L-Asparaginase (Unit/mL) per kadar protein enzim L-Asparaginase (mg/mL protein).
Gambar 1 menunjukkan pada setiap fraksi enzim memiliki aktivitas spesifik yang berbeda. Pada fraksi 5 memiliki nilai aktivitas spesifik tertinggi yaitu sebesar 1423,0248 U/mg protein. Hasil tersebut menunjukkan bahwa dalam fraksi 5 terdapat
enzim L-Asparaginase lebih banyak
dibandingkan dengan fraksi lainnya.
Pada fraksi 5 menunjukkan aktivitas spesifik yang lebih besar dibandingkan dengan fraksi protein sebelumnya. Hal ini menunjukkan bahwa pada fraksi 5 banyak asam amino
penyusun protein enzim L-asparaginase
yang bersifat hidrofil, sehingga
membutuhkan garam amonium sulfat lebih banyak untuk mengendapkannya.
Gambar 1. Grafik hubungan antara fraksi pemurnian enzim dan aktivitas spesifik enzim L-Asparaginase
3. Penentuan Karakter Optimum Enzim Bebas
Karakterisasi L-Asparaginase ini
bertujuan untuk mengetahui kondisi
optimum dari L-Asparginase hasil isolasi.
Fraksi enzim yang dikarakterisasi
merupakan fraksi enzim yang memiliki aktivitas spesifik tertinggi yaitu fraksi 5.
4. Suhu Optimum L-Asparaginase Bebas
Ditinjau dari struktur protein, suhu berpengaruh terhadap kerenggangan dan kerapatan ikatan pada struktur protein enzim. Hasil penentuan suhu optimum L-Asparaginase bebas dapat dilihat pada Gambar 2.
Berdasarkan Gambar 2 dapat dilihat bahwa suhu optimum dari L-Asparaginase hasil isolasi adalah 37°C yang ditunjukkan dengan meningkatnya aktivitas enzim. Pada suhu optimum, konformasi dari struktur protein enzim berada tepat untuk mengikat substrat dalam membentuk produk sehingga menghasilkan aktivitas tertinggi.
Gambar 2. Grafik hubungan antara suhu dan aktivitas spesifik enzim L-asparaginase.
Enzim merupakan protein yang tersusun dari ribuan asam-asam amino dimana protein dapat mengalami denaturasi pada suhu tinggi. Kenaikan aktivitas enzim di bawah suhu optimum disebabkan karena kenaikan energi kinetika molekul-molekul enzim yang bereaksi. Akan tetapi apabila suhu tetap dinaikkan terus, energi kinetika molekul-molekul enzim menjadi besar
sehingga memecahkan ikatan-ikatan
sekunder yang mempertahankan enzim dalam bentuk aslinya, akibatnya struktur sekunder dan tersier berubah sehingga aktivitas enzim menurun.
5. pH Optimum L-Asparaginase Bebas
Struktur protein enzim salah satunya dipengaruhi oleh pH [6]. Hasil penentuan pH optimum ditunjukkan pada Gambar 3. Berdasarkan Gambar 3 dapat diketahui bahwa pH optimum enzim L-Asparaginase dari bawang putih adalah 8,6. Pada pH tersebut, enzim berada pada konformasi struktur enzim 3 dimensi yang tepat untuk mengikat substrat. Pada kondisi di luar pH optimum, konformasi enzim mulai berubah menyebabkan posisi substrat berada tidak tepat pada sisi aktif enzim. Hal ini
menyebabkan proses katalisis tidak berjalan optimal sehingga aktivitas enzim menurun atau kurang optimal.
Gambar 3. Grafik hubungan antara pH lingkungan enzim dan aktivitas spesifik enzim L-Asparaginase
Dengan demikian perubahan pH berpengaruh terhadap efektivitas sisi aktif enzim dalam membentuk kompleks enzim substrat.
6. Amobilisasi Enzim L-Asparaginase dengan Pendukung Kalsium Alginat
Amobilisasi enzim merupakan suatu proses dimana pergerakan molekul enzim ditahan sedemikian rupa sehingga terbentuk sistem enzim yang aktif dan tidak larut dalam air. Hasil amobilisasi L-Asparaginase pada matriks alginat yaitu berupa manik-manik enzim amobil.
Aktivitas spesifik L-Asparaginase amobil mengalami penurunan aktivitas spesifik sebesar 4% jika dibandingkan dengan aktivitas spesifik enzim bebas (aktivitas spesifik enzim amobil 1367,6741 U/mg, aktivitas spesifik enzim bebas 1423,0248 U/mg). Penurunan aktivitas enzim amobil
disebabkan adanya matriks yang
dengan enzim. Amobilisasi enzim dengan metode penjebakan akan menyebabkan penghambatan kerja enzim [9].
7. Penentuan Karakter Optimum
L-Asparaginase Amobil.
a. Penentuan Suhu Optimum L-Asparaginase Amobil
Penentuan suhu optimum bertujuan untuk mengetahui kondisi optimum enzim setelah dilakukan amobil. Hasil penentuan suhu optimum L-Asparaginase amobil dapat dilihat pada Gambar 4.
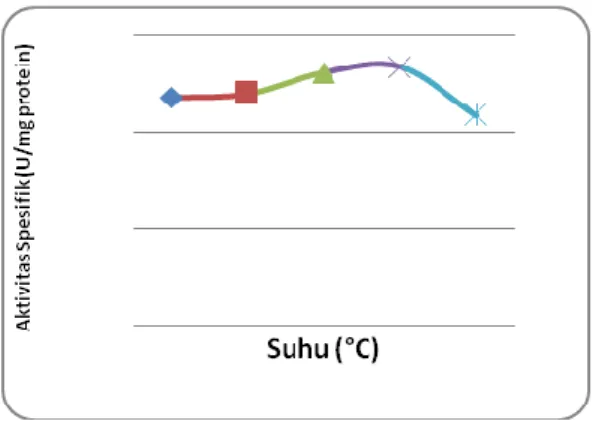
Gambar 4. Grafik hubungan antara suhu dan aktivitas spesifik enzim L-Asparaginase amobil.
Berdasarkan grafik di atas, dapat dilihat bahwa suhu optimum dari L-Asparaginase amobil adalah 42°C. Suhu optimum pada enzim amobil lebih tinggi dari enzim bebas dikarenakan matriks kalsium alginat mampu melindungi enzim L-Asparaginase amobil
terhadap panas sehingga enzim
L-Asparaginase mampu bertahan pada suhu yang lebih tinggi dibandingkan dengan enzim L-Asparaginase bebas. Hal tersebut menunjukkan bahwa matriks kalsium alginat mampu melindungi enzim L-Asparaginase amobil terhadap peningkatan suhu sehingga
enzim L-Asparaginase amobil mampu
bertahan pada suhu yang lebih tinggi dibandingkan dengan enzim L-Asparaginase bebas.
b.
PenentuanpH Optimum L-Asparaginase
Amobil.
Penentuan pH optimum perlu
dilakukan untuk mengetahui kondisi
optimum enzim dalam bereaksi dengan substrat. Hasil karakterisasi pH optimum dapat dilihat pada Gambar 5.
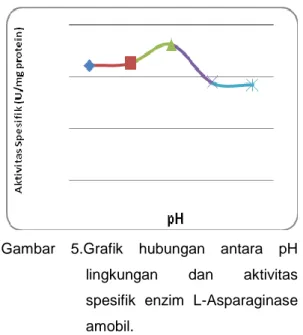
Gambar 5.Grafik hubungan antara pH
lingkungan dan aktivitas
spesifik enzim L-Asparaginase amobil.
Berdasarkan grafik di atas dapat diketahui bahwa pH optimum L-Asparaginase amobil dari bawang putih adalah pada pH 8,6. Kondisi optimum dari enzim bebas dan amobil adalah sama. Hal ini menunjukkan bahwa penggunaan matriks alginat dalam amobilisasi L-Asparaginase dari bawang putih tidak menyebabkan perubahan muatan sisi aktif enzim maupun struktur enzim terutama pada sisi aktif enzim.
KESIMPULAN
Berdasarkan penelitian yang telah dilakukan dapat disimpulkan beberapa hal sebagai berikut:
1. L-Asparaginase dapat diisolasi dari bawang putih dengan aktivitas spesifik tertinggi pada fraksi 5 (80-100%) yaitu 1423,0248 U/mg protein.
2. Kondisi optimum L-Asparaginase bebas diperoleh pada suhu 37°C dan pH 8,6. 3. L-Asparaginase dapat diamobil pada
matriks kalsium alginat 3% dengan penurunan aktivitas sebesar 4% dari aktivitas L-Asparaginase bebas.
4. Kondisi optimum L-Asparaginase amobil diperoleh pada suhu 42°C dan pH 8,6.
UCAPAN TERIMA KASIH
Penelitian ini sukses dan berjalan dengan lancar berkat dukungan dari dosen pembimbing, dosen lab. biokimia, dosen jurusan kimia, laboran jurusan kimia, serta teman-teman jurusan kimia angkatan 2011.
DAFTAR RUJUKAN
[1] Article of Journal: Anese, M., Quarta, B., dan Frias, J.M., 2011, Modelling Effect of Asparginase in Reducing Acrylamide Formation in Biscuits Food Chemistry, Ireland.
[2] Article of Journal: Bucke, C., 1987, Industrial Use of Immobilized Enzyme and Cells, In: Immobilized Microbial Enzyme and Cells, Bangkok.
[3] Article of Journal: Ciesarová, Z., Kukurová, K., dan Benešová, C., 2010,
Enzymatic Elimination of Acrylamide in
Potato-Based Thermally Treated
Foods, Slovak Republic.
[4] Article of Journal: Corrigan, P.J., 2008, Methods for Reducing Asparagine in a Dough Food Component Using Water Activity, Patent No US20080166450-A1.
[5] Article of Journal: Lincoln, L., dan More, S.S., 2014, Isolation and Production of
Clinical and Food Grade
L-Asparaginase Enzyme from
Fungi,India.
[6] Chapter of Book: Lehninger, A.L., 1982, Principles of Biochemistry: 1st Edition,
Worth Pub, New York.
[7] Thesis: Rizki, R.A., 2009, Isolasi dan Karakterisasi Enzim L-Asparaginase dari Bawang Putih (Allium sativum), Jurusan Kimia, Fakultas Sains dan Matematika, Universitas Diponegoro, Semarang.
[8] Whole Book: Scopes, R.K., 1987, Protein Purification, Priciple and Practice, 2nd ed, Springer Verlag, New York.
[9] Whole Book: Smith, J.E., 1990, Biotechnology, Diterjemahkan oleh Hartono, A., Penerbit Buku Kedokteran Indonesia, Jakarta.