ANALISIS SIDIKJARI DAN AUTOGRAFI ANTIOKSIDAN
MENIRAN HIJAU (
Phyllanthus niruri) MENGGUNAKAN
KROMATOGRAFI LAPIS TIPIS
AKROM EFFENDI
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
BOGOR 2016
PERNYATAAN MENGENAI SKRIPSI DAN SUMBER
INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa skripsi berjudul Analisis Sidikjari dan Autografi Antioksidan Meniran Hijau (Phyllanthus niruri) Menggunakan Kromatografi Lapis Tipis adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Agustus 2016 Akrom Effendi NIM G84110049
*Pelimpahan hak cipta atas karya tulis dari penelitian kerjasama dengan pihak luar IPB harus didasarkan pada perjanjian kerja sama yang terkait.
ii
ABSTRAK
AKROM EFFENDI. Analisis Sidikjari dan Autografi Antioksidan Meniran Hijau (Phyllanthus niruri) Menggunakan Kromatografi Lapis Tipis. Dibimbing oleh DIMAS ANDRIANTO dan MOHAMAD RAFI.
Meniran merupakan salah satu tumbuhan obat, namun kandungan komponen kimia dalam meniran dapat berbeda antar individu tanaman. Tujuan dari penelitian ini yaitu melakukan analisis sidik jari meniran hijau dan deteksi senyawa yang memiliki aktivitas antioksidan menggunakan KLT autografi-DPPH. Campuran kloroform-diklorometana (9:1) (v/v) memperlihatkan 9 spot dan keterpisahan terbaik. Stabilitas analat didalam larutan dan pada pelat menunjukkan bahwa tidak ada perbedaan jumlah, posisi, warna, dan intensitas pita pada kromatogram. Stabilitas analat selama kromatografi memperlihatkan analat tersebar menjadi spot-spot tidak pada satu garis lurus dan cenderung terlihat membentuk parabola. Kestabilan derivatisasi menunjukkan dengan tidak adanya perubahan kromatogram selam jeda waktu tunggu. Sepesifitas didasarkan dengan keberadaan senyawa penciri dan menunjukkan bahwa metode spesifik untuk meniran hijau. Hasil pengujian presisi tidak memenuhi kriteria keberterimaan namun uji presisi intermediet memenuhi kriteria keberterimaan. Uji robustness memenuhi kriteria keberterimaan. Metode KLT dapat digunakan untuk analisis sidikjari meniran hijau dan terdapat beberapa senyawa yang memliki aktivitas antioksidan yang ditunjukkan dengan bercak berwarna kuning pada pelat KLT. Kata kunci: derivatisasi, fase gerak, kendali mutu, validasi metode
ABSTRACT
AKROM EFFENDI. Fingerprint Analysis and Antioxidant Auotography of Green Meniran (Phyllanthus niruri) using Thin Layer Chromatography. Supervised by DIMAS ANDRIANTO and MOHAMAD RAFI.
Meniran is a kind of medicinal plant, but concentration of chemical components contained in meniran may differ among plants. This research aimed to analyze fingerprint of green meniran and identification of compounds throught antioxidan activity using TLC autography-DPPH. Mixture of chloroform-dichloromethane (9:1) (v/v) showed 9 spots and the best in separation. Analat stability in solution and on plates showed that were no difference in the bands on the chromatogram. Analat stability during chromatography showed analat spread into spots not in a straight line and tend to bend into parabolic. Stability of derivatization showed that chromatogram not change during waiting times. Specifity based on presence of the identifier compounds showed that this method specific for green meniran. Precision test was not meet the acceptance criteria, but intermediate precision test meets the acceptance criteria. Robustness test mets the acceptance criteria. TLC method could be used for fingerprint analysis of green meniran and some of chemical components has antoxidant activity shown by yellow spot on TLC plates.
ANALISIS SIDIKJARI DAN AUTOGRAFI ANTIOKSIDAN
MENIRAN HIJAU (
Phyllanthus niruri) MENGGUNAKAN
KROMATOGRAFI LAPIS TIPIS
AKROM EFFENDI
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains
pada
Departemen Biokimia
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
BOGOR 2016
Judul Skripsi : Analisis Sidikjari dan Autografi Antioksidan Meniran Hijau (Phyllanthus niruri) Menggunakan Kromatografi Lapis Tipis Nama : Akrom Effendi
NIM : G84110049
Disetujui oleh
Dr Dimas Andrianto, SSi MSi Pembimbing I
Dr Mohamad Rafi, SSi MSi Pembimbing II
Diketahui oleh
Dr Ir I Made Artika, MAppSc Ketua Depertemen
vi
PRAKATA
Puji dan syukur penulis panjatkan kepada Alah SWT, berkat rahmat dan karunia-Nya penulis dapat menyelesaikan karya ilmiah dengan judul “Analisis Sidikjari dan Autografi Antioksidan Meniran Hijau (Phyllanthus niruri) Menggunakan Kromatografi Lapis Tipis.
Terimakasih penulis ucapkan kepada Dr Dimas Andrianto, SSi MSi dan Dr Mohamad Rafi, SSi MSi selaku pembimbing yang telah memberi arahan selama penyusunan karya ilmiah ini. Disamping itu penghargaan penulis sampaikan kepada Drs Edy Djauhari Purwakusumah MSi (Alm) atas bimbingan dan motivasi kepada penulis. Terima kasih penulis juga sampaikan kepada Antonio Kautsar SSi, Nunuk Kurniati Nengsih, SFarm, Salina Febriany MSi, Endi Suhendi, dan Laela Wulan Sari SSi, yang senantiasa memberikan bimbingan, ilmu, dorongan, inspirasi selama pelaksanaan penelitian.
Akhir kata penulis berharap tulisan ini dapat bermanfaat bagi penulis maupun semua pihak demi kemajuan ilmu pengetahuan.
Bogor, Agustus 2016
DAFTAR ISI
DAFTAR TABEL viii
DAFTAR GAMBAR viii
DAFTAR LAMPIRAN viii
PENDAHULUAN 1
BAHAN DAN METODE 2
Alat dan Bahan 2
Metode Penelitian 3
Validasi Metode 4
HASIL 5
Penentuan Kadar Air 5
Pengoptimuman Fase Gerak 6
Validasi Metode 7
Stabilitas Analat 7
Spesifitas 9
Presisi 10
Robustness 11
Identifikasi Aktivitas Antioksidan secara Kualitatif Menggunakan KLT
Autografi DPPH 13
PEMBAHASAN 14
Penentuan Kadar Air 14
Pengoptimuman Fase Gerak 14
Validasi Metode 15
Stabilitas analat 15
Spesifitas 16
Presisi 17
Robustness 18
Identifikasi Aktivitas Antioksidan secara Kualitatif Menggunakan KLT
Autografi DPPH 18
SIMPULAN DAN SARAN 19
Simpulan 19
Saran 19
DAFTAR PUSTAKA 20
DAFTAR TABEL
1 Asal dan kode sampel 2
2 Nilai rerata kadar air seluruh sampel meniran dan petai cina 5 3 Nilai Rf tiga zona pita analat pada uji presisi 11 4 Nilai Rf tiga zona pita analit pada uji presisi intermediet 11
DAFTAR GAMBAR
1 Hasil elusi pelarut tunggal 6
2 Hasil elusi pelarut campuran kloroform-dikloromerana 6
3 Stabilitas analat pada pelat dan dalam larutan 7
4 Stabilitas analat selama kromatografi 8
5 Stabilitas visualisai kromatogram 8
6 Spesifitas meniran hijau 9
7 Spesifitas dengan pemalsu pada bagian daun 9
8 Spesifitas dengan pemalsu pada bagian herba meniran 10
9 Presisi meniran hijau 11
10 Presisi intermediet meniran hijau 11
11 Robustness tipe bejana pengembangan 12
12 Robustness jarak pengembangan meniran hijau 12
13 Antioksidan meniran hijau 13
14 Antioksidan meniran berbagai jenis dibandingkan dengan petai cina 13
DAFTAR LAMPIRAN
1 Skema alir penelitian 23
2 Nilai kadar air seluruh sampel yang digunakan 24
PENDAHULUAN
Meniran merupakan salah satu tumbuhan obat di Indonesia yang memiliki banyak khasiat antara lain sebagai antioksidan, antibakteri, antihepatotoksik, antiradang, antivirus, diuretik, ekspetoran, dan imunostimulan (Oktavidiati 2012). Meniran yang biasa digunakan oleh masyarakat Indonesia untuk obat adalah meniran hijau (Phyllanthus niruri). Khasiat yang ditimbulkan oleh meniran dalam mengobati penyakit tidak terlepas dari adanya komponen bioaktif yang terkandung didalamya. Meniran mengandung bermacam-macam senyawa kimia yang termasuk kedalam golongan flavonoid, terpenoid, alkoloid, lipid, benzenoid, tanin, vitamin, lignan, dan steroid (Gunawan 2008). Kualitas meniran berdasarkan penelitian sejauh ini ditentukan berdasarkan senyawa penanda dari golongan lignan, yaitu filantin dan hipofilantin. Keberadaan senyawa ini dipergunakan sebagai senyawa identitas dalam menganalisis ekstrak kental herba meniran (BPOM 2004).
Kandungan komponen kimia dalam meniran dapat berbeda antar individu tanaman dengan individu tanaman lainnya. Hal ini dapat disebabkan oleh beberapa faktor, yaitu lingkungan tempat tumbuh tanaman, perlakuan pasca panen, suhu, dan lain-lain (Liang et al. 2004). Berdasarkan hal tersebut, diperlukan suatu metode analitik untuk evaluasi kualitas bahan baku maupun produk obat herbal berbasis meniran melalui komponen kimianya. Fluktuasi komponen kimia pada meniran dapat berpengaruh terhadap khasiat yang ditimbulkan serta keamanan produknya. Oleh karena itu perlu dilakukan evaluasi komponen kimianya untuk kendali mutu meniran agar kualitas, khasiat, dan keamanannya terjamin.
Kendali mutu merupakan hal yang penting untuk menjaga identitas, konsistensi, dan keaslian suatu tumbuhan obat seperti meniran (Herdiana 2010). Salah satu cara yang dapat digunakan untuk hal tersebut yaitu dengan melakukan evaluasi bahan baku tumbuhan obat melalui keberadaan senyawa kimianya melalui pola sidikjari kimia menggunakan kromatografi lapis tipis (KLT). Pola sidikjari KLT dari suatu tumbuhan dapat memberikan informasi mengenai komponen kimia pada tumbuhan obat melalui pola kromatogramnya tanpa memerhatikan jenis kandungan komponennya (Wiandanie 2010). Selain itu evaluasi untuk kendali mutu meniran juga dilakukan dengan mengkonfirmasi perbandingan kromatogram meniran hijau (Phyllanthus niruri) dengan tumbuhan yang memiliki kekerabatan dekat seperti meniran merah (Phyllanthus urinaria) dan Phyllanthus debilis serta peta cina (Leucaena leucocepala) yang sering digunakan untuk memalsukan meniran.
Meniran yang diketahui mengandung berbagai macam golongan senyawa kimia menunjukkan adanya aktivitas antioksidan. Deteksi komponen aktif dari tanaman obat dengan aktivitas tertentu dilakukan menggunakan KLT autografi. KLT autgrafi merupakan teknik pengamatan langsung pada spot yang terbentuk setelah dilakukan penyemprotan dengan reagen untuk mendeteksi senyawa kimia dengan aktivitas tertentu pada kromatogram hasil kromatografi lapis tipis (Rinita 2008). Melalui teknik KLT autografi-DPPH dapat diketahui senyawa yang memiliki aktivitas antioksidan secara kualitatif didasarkan pada pengukuran area pita kuning terang pada latar pelat KLT berwarna ungu (Dewnjee et al 2014).
2
Dalam penelitian telah dikembangkan metode sidikjari KLT yang dilakukan meliputi pencarian fase gerak terbaik dan validasi metode. Parameter yang digunakan dalam validasi metode, yaitu kestabilan, spesifitas, presisi dan robustness (ketegaran). Tujuan dari penelitian ini yaitu melakukan analisis sidik jari meniran hijau dan deteksi senyawa yang memiliki aktivitas antioksidan menggunakan KLT autografi-DPPH yang nantinya dapat bermanfaat untuk evaluasi kendali mutu agar kualitas dan keamanan obat berbasis meniran terjamin.
BAHAN DAN METODE
Alat dan BahanAlat-alat yang digunakan pada penelitian ini antara lain KLT aplikator semiotomatis Camag Linomat 3, Camag Reprostar 3, bejana pengembang twin through chamber (CAMAG, Muttenz, Swiss), bejana pengembang flat buttom chamber (CAMAG, Muttenz, Swiss), alat penyemprot, neraca analitik, sonikator Branson 1510 (Branson, Danbury, USA), bulb, kertas saring, oven, dan blender. Selain itu, juga digunakan alat-alat kaca yang umum digunakan di laboratorium kimia.
Tabel 1 Asal dan kode sampel
No. Asal Sampel Kode
Sampel* Bagian sampel Meniran hijau (Phyllanthus niruri)
1. Dramaga (Bogor, Jawa Barat) Pn1 Daun
Pn2 Akar
Pn3 Batang
Pn4 Herba
2. Weleri (Kendal, Jawa Tengah) Pn5 Daun
Pn6 Herba
3. Ponorogo (Jawa Timur) Pn7 Daun
Pn8 Herba
4. Gunung Kidul (Yogyakarta) Pn9 Daun
Pn10 Herba
Meniran merah (Phyllanthus urinarai)
5. Cibereum (Cianjur, Jawa Barat) Pu1 Daun
Pu2 Herba
6. Cimacan (Cianjur, Jawa Barat) Pu3 Daun
Pu4 Herba
Phyllanthus debilis
7. Karang Tengah (Cianjur, Jawa Barat) Pd1 Daun
Pd2 Herba
Petai cina (Leucaena leucocepala)
8. Cipayung (Bogor, Jawa Barat) Ll1 Daun
9. Cepago (Boyolali Jawa Timur) Ll2 Daun
10. Ciutara (Sukabumi, Jawa Barat) Ll3 Daun
* Pn : Phyllanthus niruri, Pu : Phyllanthus urinarai, Pd : Phyllanthus debilis, Ll : Leucaena leucocepala
Bahan-bahan yang digunakan terdiri atas 4 sampel meniran hijau (Phyllanthus niruri), 2 sampel meniran merah (Phyllanthus urinarai), 1 sampel Phyllanthus debilis, dan 3 sampel petai cina (Leucaena leucocepala) yang diperoleh dari Provinsi Jawa Barat, Jawa Tengah, Jawa Timur, dan Yogyakarta (Tabel 1). Selain itu, juga digunakan bahan-bahan pendukung analisis, diantaranya pelat KLT silika gel F254 20 cm × 20 cm (Merck, Darmstadt, Jerman), anisaldehida (Sigma Aldrich, St Louis, Amerika Serikat), Vanilin, standar filantin dan hipofilantin (Sigma Aldrich, St Louis, Amerika Serikat), pelarut untuk fase gerak dengan tingkat analitis yang diperoleh dari Merck dan Sigma Aldrich (St Louis, Amerika Serikat) yaitu n-heksana, etanol, metanol, diklorometana, etil asetat, asetonitril, dietil eter, dan kloroform. Bahan-bahan lain yang digunakan adalah peranti lunak WinCATS 1.2.3 (CAMAG, Muttenz, Swiss).
Metode Penelitian Penentuan Kadar Air (Modifikasi AOAC 2006)
Sampel masing- masing ditimbang sebanyak 1 g, kemudian dimasukkan ke dalam cawan yang sebelumnya dipanaskan pada oven suhu 105 °C selama 30 menit dan telah diketahui bobotnya. Cawan berisi sampel kemudian dipanaskan dengan oven bersuhu 105 °C selama 5 jam lalu didinginkan di dalam desikator dan ditimbang, proses pengovenan dan penimbangan dilakukan kembali hingga diperoleh bobot konstan. Kadar air dihitung berdasarkan persamaan sebagai berikut :
% Kadar air=Bobot sampel awal (g)-Bobot sampel akhir (g)
Bobot sampel awal (g) ×100% Ekstraksi Meniran (Herdiana 2010)
Simplisia sebanyak 1 g dilarutkan dengan metanol pro analys (PA) 10 mL, kemudian dimasukkan ke dalam ultrasonik dengan frekuensi 42 kHz selama 30 menit pada suhu ruang. Setelah proses ekstraksi dihentikan, ekstrak disaring menggunakan kertas saring ke dalam labu takar 10 mL dan ditera kembali dengan metanol.
Instrumentasi dan Kondisi KLT (Herdiana 2010)
Sampel diaplikasikan dalam bentuk pita dengan lebar 7 mm dan jarak antar spot pita 5 mm dengan Camag Linomart V pada silika gel F254. Sampel diaplikasikan konstan dengan laju 70 nL/detik, aplikasi volume sampel sebanyak 15 µL. Sebelum digunakan untuk aplikasi sampel, plat terlebih dahulu dijenuhkan dalam metanol dan dikeringkan didalam oven suhu 150°C selama ± 30 detik. Pengoptimuman Fasegerak Terbaik (Modifikasi Herdiana 2010)
Pengoptimuman fase gerak terbaik diawali dengan menggunakan pelarut tunggal, yaitu n-heksana, etanol, metanol, diklorometana, etil asetat, asetonitril, dietil eter, dan kloroform dijenuhkan di dalam botol jar selama 30 menit. Pelat KLT masing-masing berukuran 1.5 cm × 10 cm yang telah ditotolkan ekstrak dimasukkan ke dalam botol jar. Setelah pengembangan dilakukan, pelat diangkat dan dikeringkan. Deteksi komponen dilakukan untuk melihat jumlah pita yang
4
muncul pada pelat. Fase gerak yang dipilih adalah fase gerak yang memperlihatkan pemisahan dengan jumlah pita terbanyak. Selanjutnya dua pelarut dipilih dari pelarut tunggal yang memberikan hasil pemisahan dengan jumlah pita terbanyak dan keterpisahan yang baik.
Validasi Metode Sidikjari KLT (Reich et al 2008)
Stabilitas Analat selama Kromatografi. Ekstrak yang diaplikasikan pada pelat untuk validasi metode adalah ekstrak sampel Pn1. Ekstrak diaplikasikan sebagai spot pada sudut kanan bawah pelat berukuran 10 cm × 10 cm (10 mm dari masing-masing tepi). Pelat dikembangkan dan dikeringkan. Pelat kemudian diputar 90° dan dikembangkan untuk kedua kalinya dengan fase gerak yang baru. Pelat kemudian didokumentasikan.
Stabilitas Analat pada Pelat dan dalam Larutan. Ekstrak sampel Pn1 diaplikasikan pada pelat dengan 4 cara, yaitu sampel pada pelat selama 3 jam sebelum kromatografi, sampel segar diaplikasikan segera sebelum kromatografi (dua kali), sampel yang telah disiapkan pada 3 jam sebelumnya (dalam larutan), diaplikasikan kembali pada pelat sebelum kromatografi. Pelat dikembangkan dan didokumentasikan.
Stabilitas Hasil Derivatisasi. Ekstrak sampel Pn1 diaplikasikan pada pelat, dikembangkan, dan didokumentasikan. Pelat diamati selama 60 menit. Gambar diambil setelah 2, 5, 10, 20, 30, dan 60 menit setelah selesai dilakukan pewarnaan dengan reagen anisaldehid.
Spesifitas. Sampel meniran hijau asal Bogor yang terdiri atas sampel daun, akar, batang dan herba diaplikasikan pada pelat bersama dengan senyawa standar filantin dan hipofilantin. Pelat kemudian dikembangkan dan didokumentasikan. Profil kromatogram yang diperoleh kemudian diamati dan dibandingkan. Hal yang sama dilakukan pula pada sampel meniran hijau asal Kendal, Ponorogo, Gunung Kidul, serta meniran varietas yang berbeda asal Cianjur selain itu daun petai asal Bogor, Boyolali, dan Sukabumi.
Presisi. Sampel Pn1 diekstraksi dengan cara yang sama sebanyak 3 kali. Masing-masing ekstrak diaplikasikan 3 kali pada 3 pelat berbeda. Pelat dikembangkan dan setiap kali pengembangan digunakan bejana pengembang yang sama dengan fase gerak yang baru. Setelah pengembangan selanjutnya kromatogram didokumentasikan dan dibandingkan
Presisi intermediet. Sampel Pn1 diekstraksi dengan cara yang sama sebanyak 3 kali pada 3 hari berbeda. Masing-masing ekstrak diaplikasikan 3 kali pada 3 pelat berbeda dengan pengaplikasian satu pelat per hari. Pelat dikembangkan dan setiap kali pengembangan digunakan bejana pengembang yang sama dengan fase gerak yang baru. Setelah pengembangan selanjutnya kromatogram didokumentasikan dan dibandingkan.
Robustness Tipe Bejana. Ekstrak sampel Pn1 serta standar filantin dan
dikembangkan menggunakan twin through chamber dan flat bottom chamber. Setelah didokumentasi hasil kromatogram dibandingkan.
Robustness Jarak Pengembangan. Ekstrak sampel Pn1 serta standar
filantin dan hipofilantin diaplikasikan pada 2 pelat berbeda. Jarak pengembangan dibedakan menjadi 75 mm dan 85 mm. Setelah didokumentasi, hasil kromatogram dibandingkan.
KLT Autografi-DPPH (Rininta 2008)
Sampel meniran hijau asal Bogor, Kendal, Ponorogo, Gunung Kidul beberapa meniran varietas yang berbeda asal Ciancur, selain itu daun petai cina asal Bogor, Boyolali, Sukabumi, serta senyawa standar filantin dan hipofilantin diaplikasikan pada pelat KLT. Larutan DPPH 0.04% dalam metanol dimasukan ke dalam wadah semprot yang dilapisi alumunium foil. Pelat yang telah mencapai garis akhir dikeluarkan dari bejana kromatografi dan dikeringkan selama 15 menit. Setelah kering, pelat KLT disemprot dengan larutan DPPH 0.04% keseluruh pelat. Spot pita berwarna kekuningan akan meuncul dengan dasar pelat berwarna ungu setelah didiamkan 5 menit yang menandakan bahwa senyawa pada spot tersebut memiliki aktivitas antioksidan.
HASIL
Penentuan Kadar AirAnalisis kadar air dilakukan terhadap sepuluh sampel yang terdiri atas empat sampel meniran hijau (Phyllanthus niruri), dua sampel meniran merah (Phyllanthus urinaria), satu sampel Phyllanthus debilis, dan tiga sampel petai cina (Leucaena leucocepala) yang berasal dari berbagai daerah yang berbeda. Tiap sampel dipisah menjadi bagian daun dan herba kecuali sampel meniran hijau asal Bogor, Jawa Barat yang dipisah menjadi bagian daun (Pn1), akar (Pn2), batang (Pn3), dan herba (Pn4). Sedangkan sampel petai cina hanya diambil bagian daunnya. Rerata kadar air tertinggi didapati pada sampel Pn4 seberas 11.73%, sedangkan rerata kadar air terkecil pada sampel Pn7 sebesar 8.82 % (Tabel 2).
Tabe 2 Nilai rerata kadar air seluruh sampel meniran dan petai cina Kode sampel Nilai rerata kadar air (%) ± SD Kode sampel Nilai rerata kadar air (%) ± SD Kode sampel Nilai rerata kadar air (%) ± SD Pn1 11.14 ± 0.70 Pn7 8.82 ± 0.12 Pu3 9.81 ± 0.19 Pn2 10.47 ± 0.41 Pn8 9.24 ± 0.06 Pu4 9.87 ± 0.18 Pn3 11.50 ± 0.67 Pn9 9.31 ± 0.47 Pd1 10.11 ± 0.11 Pn4 11.73 ± 0.38 Pn10 9.87 ± 0.36 Pd2 10.01 ± 0.26 Pn5 9.40 ± 0.11 Pu1 9.61 ± 0.10 Ll1 9.51 ± 0.08 Pn6 9.23 ± 0.07 Pu2 10.33 ± 0.31 Ll2 9.27 ± 0.05 Ll3 9.25 ± 0.07
6
Pengoptimuman Fase Gerak
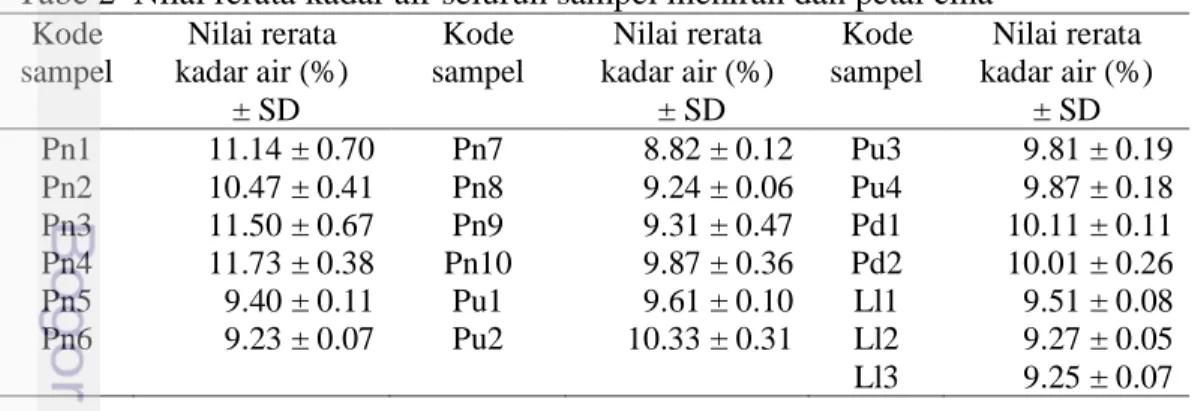
Pengoptimuman fase gerak terbaik terhadap meniran hijau diawali dengan menggunakan delapan pelarut tunggal dengan tingkat kepolaran tertentu dipilih dari pelarut polar, semi polar, dan non-polar (Lampiran 3). Sampel yang digunakan untuk pengoptimuman adalah sampel Pn1. Kromatogram dari kedelapan pelarut tunggal dibandingkan dan dipilih dua pelarut terbaik yang menunjukkan jumlah spot terbanyak dengan keterpisahan terbaik. Pengembangan delapan pelarut tunggal (Gambar 1) diperoleh hasil kloroform dan diklorometana memperlihatkan pemisahan terbaik dan jumlah spot terbanyak bila dibandingkan dengan pelarut lain, yaitu sebanyak 4 buah spot dan 6 buah spot.
Gambar 1 Hasil elusi pelarut tunggal. Fase gerak (1) n-heksana, (2) etanol, (3) metanol, (4) diklorometana, (5) etil asetat, (6) asetonitril (7) dietil eter, (8) kloroform. Dokumentasi menggunakan UV 366 nm.
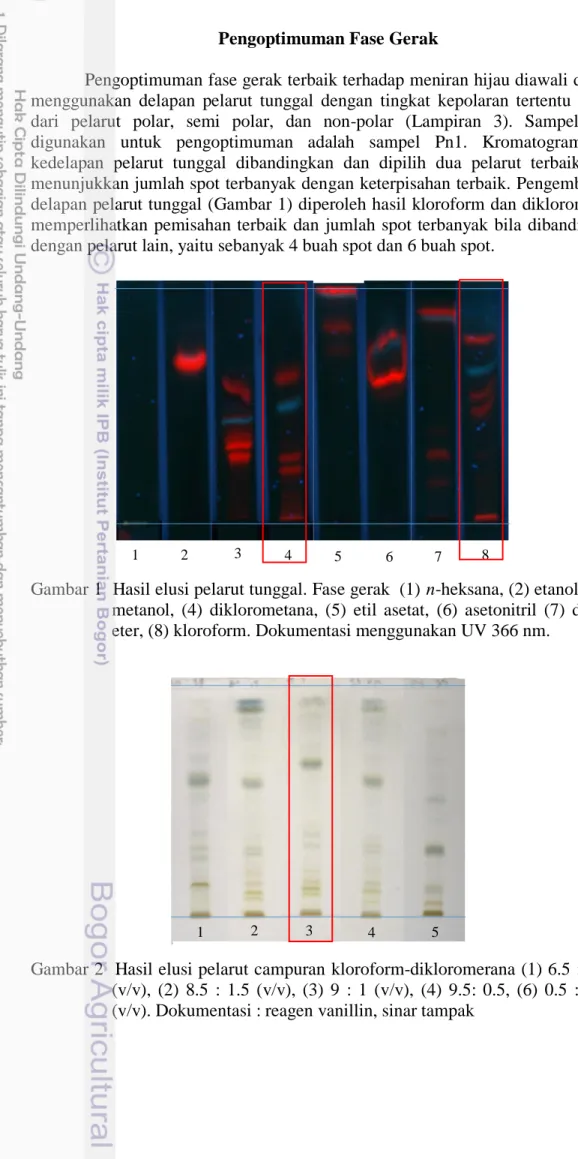
Gambar 2 Hasil elusi pelarut campuran kloroform-dikloromerana (1) 6.5 : 3.5 (v/v), (2) 8.5 : 1.5 (v/v), (3) 9 : 1 (v/v), (4) 9.5: 0.5, (6) 0.5 : 9.5 (v/v). Dokumentasi : reagen vanillin, sinar tampak
1 2 3 4 5
Selanjutnya kedua pelarut tunggal terbaik dicampurkan dengan beberapa perbandingan. Hasil pengembangan menggunakan pelarut campuran kloroform-diklorometana dengan perbandingan 6.5:3.5 (v/v), 8.5:1.5 (v/v), 9:1 (v/v), 9.5:0.5, (v/v) dan 0.5:9.5 (v/v) (Gambar 2). Sama halnya dengan pemilihan pelarut tunggal, pelarut campuran tebaik dilihat dari jumlah dan keterpisahan spot terbaik. Campuran kloroform-diklorometana (9:1) (v/v) memperlihatkan 9 spot dan keterpisahan terbaik (Gambar 2).
Validasi Metode Stabilitas Analat
Larutan sampel Pn1 disiapkan dua kali dan diaplikasikan empat kali pada permukaan pelat. Larutan sampel Pn1 pertama yang disiapkan diaplikasikan dengan segera pada pelat (Gambar 3a). Larutan dan pelat di simpan pada kondisi yang dijaga selama tiga jam. Setelah tiga jam, larutan sampel Pn1 kedua disiapkan dan segera diaplikasikan pada pelat berdampingan dengan spot sampel Pn1 sebelumnya (Gambar 3b). Pola ini digunakan untuk menyelidiki stabilitas meniran pada pelat. Selanjutnya, pada pelat yang sama kedua larutan sampel Pn1 (larutan Pn1 yang disimpan dan larutan Pn1 baru) diaplikasikan (berturut-turut Gambar 3d dan 3c). Pola ini bertujuan mengevaluasi stabilitas analat di dalam lautan. Kromatogram menunjukkan bahwa tidak ada perbedaan jumlah, posisi, warna, dan intensitas pita (Gambar 3). Hal ini menandakan bahwa analat stabil selama tiga jam baik pada pelat maupun di dalam larutan.
Gambar 3 Stabilitas analat pada pelat dan dalam larutan (a) sampel yang diaplikasikan 3 jam sebelum kromatografi, (b) sampel yang diaplikasikan sesaat sebelum kromatografi, (c) sampel yang dideteksi 3 jam sebelum kromatografi (3 jam dalam larutan), (d) sampel yang diaplikasikan sesaat sebelum kromatografi (identik dengan b). Dokumentasi menggunakan reagen anisaldehida pada sinar tampak. Fase gerak kloroform-diklorometana (9:1) (v/v).
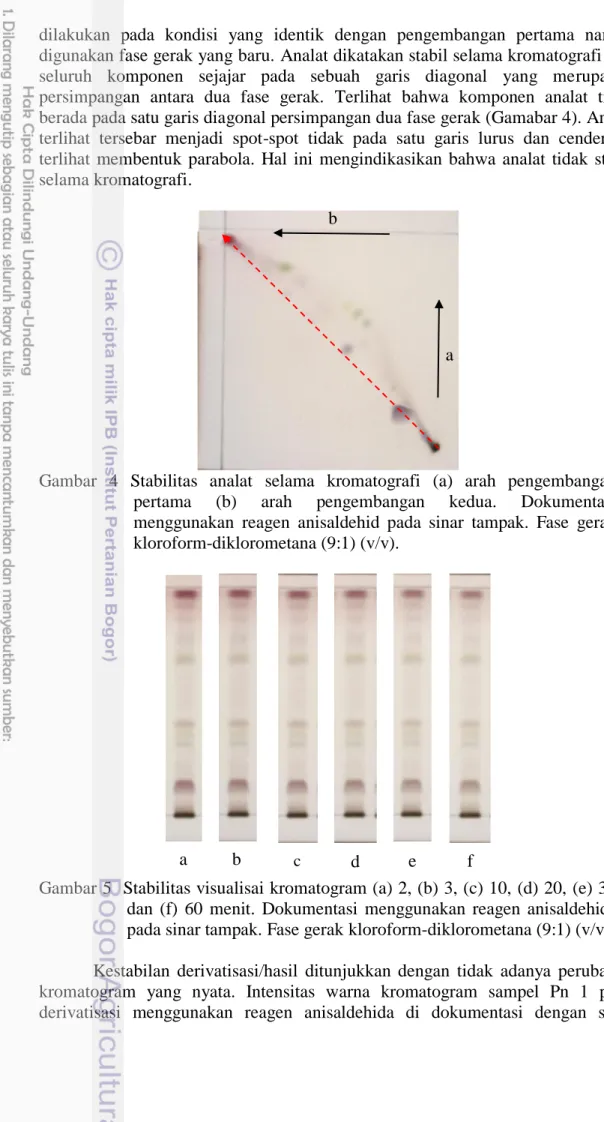
Stabilitas analat selama kromatografi diperiksa dengan menggunakan KLT 2-dimensi yaitu analat (sampel Pn1) diaplikasikan sebagai sebuah titik di bagian pojok bawah dari plat KLT. Setelah dilakukan pengembangan pertama, pelat secara menyeluruh dikeringkan. Setelah pelat diputar 90°, pengembangan kedua
8
dilakukan pada kondisi yang identik dengan pengembangan pertama namun digunakan fase gerak yang baru. Analat dikatakan stabil selama kromatografi bila seluruh komponen sejajar pada sebuah garis diagonal yang merupakan persimpangan antara dua fase gerak. Terlihat bahwa komponen analat tidak berada pada satu garis diagonal persimpangan dua fase gerak (Gamabar 4). Analat terlihat tersebar menjadi spot-spot tidak pada satu garis lurus dan cenderung terlihat membentuk parabola. Hal ini mengindikasikan bahwa analat tidak stabil selama kromatografi.
Gambar 4 Stabilitas analat selama kromatografi (a) arah pengembangan pertama (b) arah pengembangan kedua. Dokumentasi menggunakan reagen anisaldehid pada sinar tampak. Fase gerak kloroform-diklorometana (9:1) (v/v).
Gambar 5 Stabilitas visualisai kromatogram (a) 2, (b) 3, (c) 10, (d) 20, (e) 30 dan (f) 60 menit. Dokumentasi menggunakan reagen anisaldehida pada sinar tampak. Fase gerak kloroform-diklorometana (9:1) (v/v). Kestabilan derivatisasi/hasil ditunjukkan dengan tidak adanya perubahan kromatogram yang nyata. Intensitas warna kromatogram sampel Pn 1 pada derivatisasi menggunakan reagen anisaldehida di dokumentasi dengan sinar
a b c d e f
a b
tampak dalamm rentang waktu 2, 3, 5, 10, 20, 30 dan 60 menit tidak terlihat pita kromatogram yang muncul ataupun hilang (Gambar 5). Hal ini menunjukkan kromatogram tetap stabil selama 60 menit jeda waktu tunggu.
Spesifitas
Spesifitas meniran hijau dangan senyawa standar digunakan bagian meniran berupa daun, akar, batang, dan herba (Gambar 6). Sidikjari meniran di seluruh bagiannya tidak menunjukan adanya filantin dan hipofilantin dilihat dengan tidak terdapatnya bercak filantin (Gambar 6-3a) dan hipofilantin (Gambar 6-3b) dilihat dari pola dan warna yang terbentuk.
Gambar 6 Spesifitas meniran hijau (1) batang, (2) daun, (3) senyawa standar (a) filantin (b) hipofilantin,(4) herba, dan (5) akar dengan. Dokumentasi menggunakan reagen anisaldehida pada sinar tampak. Fase gerak kloroform-diklorometana (9:1) (v/v).
Gambar 7 Spesifitas dengan pemalsu pada bagian daun (1) Pn9 (2) Pd1, (3) Ll1, (4) Ll2, (5) Ll3, (6) standar (a) filantin (b) hipofilantin (7) Pn1, (8) Pn7, (9) Pn5, (10) Pu1, (11) Pu2. Dokumentasi menggunakan reagen anisaldehida pada sinar tampak. Fase gerak kloroform-diklorometana (9:1) (v/v). 1 2 3 4 5 6 7 8 9 10 11 a b 1 2 3 4 5 a b
10
Jika dilihat pada Gambar 7, Pn9 (Gambar 7-1), Pn7 (Gambar 7-8), dan Pn5 (Gambar 7-9) menunjukkan pola dan warna standar filantin dan hipofilantin. Hal ini menunjukkan bahwa metode spesifik untuk meniran hijau. Perbandingan kromatogram daun meniran hijau dengan tumbuhan yang memiliki kekerabatan dekat seperti meniran merah dan meniran debilis serta tumbuhan petai cina yang sering digunakan untuk memalsukan meniran (Gambar 7). Pola kromatogram memperlihatkan kesamaan antar tumbuhan dalam satu spesies, walaupun pita dalam satu spesies memperlihatkan perbedaan intensitas warna kromatogramnya. Uji yang sama juga dilakukan dengan menggunakan bagian herbal setiap sampel kecuali sampel petai cina (Gambar 8).
Gambar 8 Spesifitas dengan pemalsu pada bagian herba meniran (1) Pn10, (2) Pd2 , (3) Ll1, (4) Ll2, (5) Ll3, Pu4 (6) standar (a) filantin (b) hipofilantin, (7) Pn4, (8) Pn8, (9) Pn6, (10) Pu2, (11). Dokumentasi menggunakan reagen anisaldehida pada sinar tampak. Fase gerak kloroform-diklorometana (9:1) (v/v).
Presisi
Parameter presisi pada penelitian ini dilakukan uji presisi dan presisi intermediet. Kriteria keberterimaan uji presisi yaitu profil sidikjari tiap pelat identik terkait dengan jumlah, letak, warna dan intensitas warna. Perbedaan nilai Rf dari tiga zona pita analat pada pelat yang berbeda tidak lebih dari 0.02. Begitu pula dengan uji presisi intermediet, kriteria keberterimaanya tidak berbeda dengan uji presisi kecuali pada nilai Rf dari tiga zona pita analat pada tiga pelat tidak lebih dari 0.05.
Hasil pengujian presisi dan presisi intermediet tidak menunjukkan perbedaan yang berarti pada tiap pelat (Gambar 9 dan Gambar 10). Ketiga pelat pada uji presisi menampilkan pola kromatogaram yang identik berdasarkan jumlah, intensitas, dan warna pita. Nilai Rf tiga zona pita analat pada uji presisi (Tabel 3) memiliki perbedaan nilai ∆Rf sebesar 0.01, 0.04, dan 0.04, sehingga parameter uji presisi tidak dapat diterima. Pelat pada uji presisi intermediet menampilkan pola kromatogaram yang identik berdasarkan jumlah, intensitas, dan warna pita. Nilai Rf tiga zona pita analat pada uji presisi intermediet (Tabel 4)
1 2 3 4 5 6 7 8 9 10 11 a
memiliki perbedaan nilai ∆Rf sebesar 0.01, 0.03, dan 0.03, sehingga parameter uji presisi intermediet dapat diterima.
Gambar 9 Presisi meniran hijau pada (a) pelat 1, (b) pelat 2, (c) pelat 3. Dokumentasi menggunakan reagen anisaldehida pada sinar tampak. Fase gerak kloroform-diklorometana (9:1) (v/v).
Table 3 Nilai Rf tiga zona pita analat pada uji presisi
Rf Pelat 1 Pelat 2 Pelat 3 nilai ∆Rf
Unknown compound 1st 0.13 0.12 0.11 0.02
Unknown compound 2nd 0.27 0.23 0.23 0.04
Unknown compound 3rd 0.38 0.34 0.34 0.04
Gambar 10 Presisi intermediet meniran hijau pada (a) pelat hari ke-1, (b) pelat hari ke- 2, (c) pelat hari ke- 3. Dokumentasi menggunakan reagen anisaldehida pada sinar tampak. Fase gerak kloroform-diklorometana (9:1) (v/v).
Tabel 4 Nilai Rf tiga zona pita analit pada uji presisi intermediet
Rf Pelat hari 1 Pelat hari 2 Pelat hari 3 nilai ∆Rf
Unknown compound 1st 0.12 0.11 0.11 0.01
Unknown compound 2nd 0.23 0.26 0.23 0.03
Unknown compound 3rd 0.34 0.37 0.35 0.03
Robustness
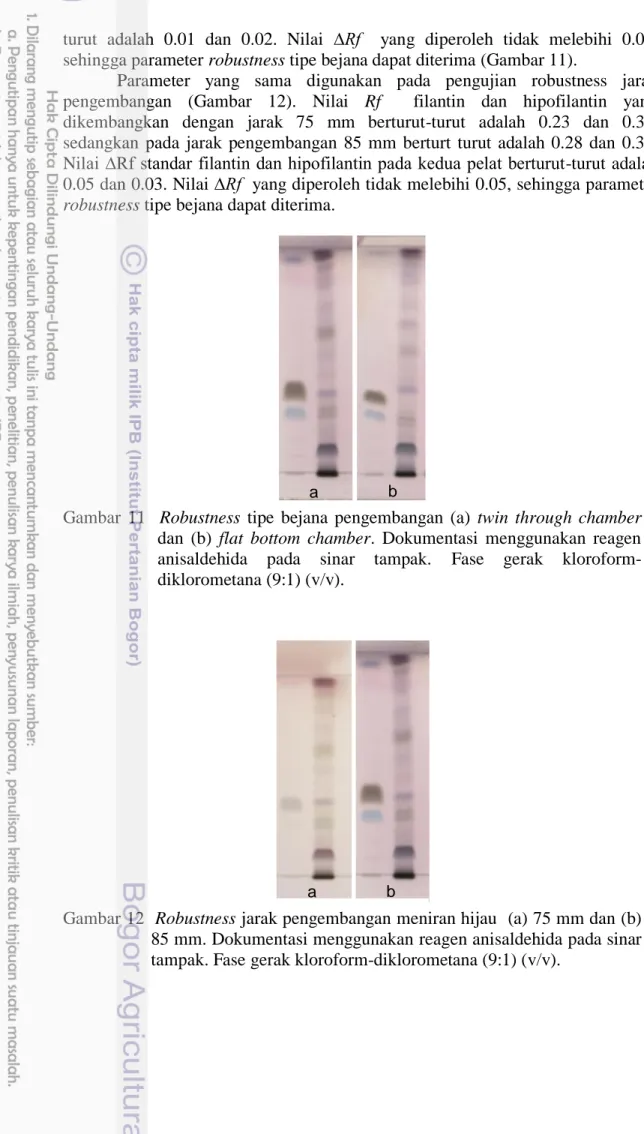
Pola kromatogram pada pelat yang dikembangkan menggunakan twin trough chamber dan flat bottom chamber tidak menunjukkan adanya perbedaan jumlah, intensitas, posisi, dan warna pita. Nilai Rf filantin dan hipofilantin yang dielusi dengan twin trough chamber berturut-turut adalah 0.28 dan 0.37, sedangkan pada pengembangan menggunakan flat bottom chamber adalah 0.27 dan 0.35. Nilai ∆Rf standar filantin dan hipofilantin pada kedua pelat
berturut-b
a c
12
turut adalah 0.01 dan 0.02. Nilai ∆Rf yang diperoleh tidak melebihi 0.05, sehingga parameter robustness tipe bejana dapat diterima (Gambar 11).
Parameter yang sama digunakan pada pengujian robustness jarak pengembangan (Gambar 12). Nilai Rf filantin dan hipofilantin yang dikembangkan dengan jarak 75 mm berturut-turut adalah 0.23 dan 0.34, sedangkan pada jarak pengembangan 85 mm berturt turut adalah 0.28 dan 0.37. Nilai ∆Rf standar filantin dan hipofilantin pada kedua pelat berturut-turut adalah 0.05 dan 0.03. Nilai ∆Rf yang diperoleh tidak melebihi 0.05, sehingga parameter robustness tipe bejana dapat diterima.
Gambar 11 Robustness tipe bejana pengembangan (a) twin through chamber dan (b) flat bottom chamber. Dokumentasi menggunakan reagen anisaldehida pada sinar tampak. Fase gerak kloroform-diklorometana (9:1) (v/v).
Gambar 12 Robustness jarak pengembangan meniran hijau (a) 75 mm dan (b) 85 mm. Dokumentasi menggunakan reagen anisaldehida pada sinar tampak. Fase gerak kloroform-diklorometana (9:1) (v/v).
a b
Identifikasi Aktivitas Antioksidan secara Kualitatif Menggunakan KLT Autografi DPPH
Hasil uji aktivitas atioksidan meniran hijau (Gambar 13) terlihat bercak positif berwarna kuning pada seluruh bagian meniran baik daun, akar, dan batang yang menunjukkan seluruh bagian organ meniran hijau memiliki beberapa senyawa dengan aktivitas antioksidan. Selain pada meniran hijau asal Bogor, uji untuk melihat potensi antioksidan dilakukan pada seluruh sampel yang diperoleh (Gambar 14).
I II
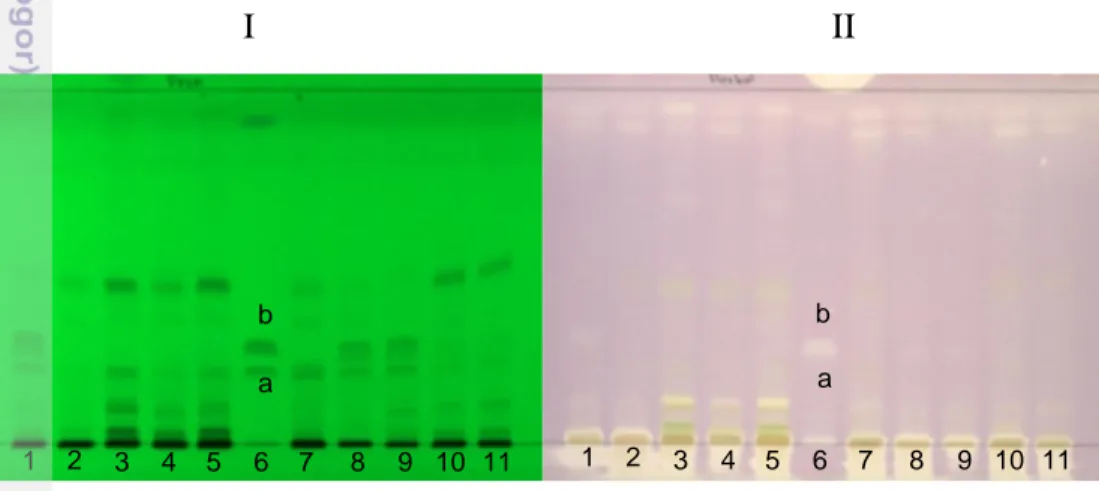
Gambar 13 Uji antioksidan meniran hijau (I) sebelum derivatisasi (II) setelah derivatisasi, (1) batang, (2) daun, (3) senyawa standar (a) filantin (b) hipofilantin, (4) herba, dan (5) akar dengan. Dokumentasi (I) pada UV 254 nm dan (II) menggunakan reagen DPPH pada sinar tampak. Fase gerak kloroform-diklorometana (9:1) (v/v).
I II
Gambar 14 Antioksidan meniran berbagai jenis dibandingkan dengan petai cina (I) sebelum derivatisasi (II) setelah derivatisasi, daun (1) Pn9 (2) Pd1, (3) Ll1, (4) Ll2, (5) Ll3, (6) standar (a) filantin (b) hipofilantin., (7) Pn1, (8) Pn7, (9) Pn5, (10) Pu1, (11) Pu2, Dokumentasi (I) pada UV 254 nm dan (II) menggunakan reagen DPPH. Pada sinar tampak. Fase gerak kloroform-diklorometana (9:1) (v/v). 1 2 3 4 5 6 7 8 9 10 11 a b a b 1 2 3 4 5 6 7 8 9 10 11 1 2 3 4 5 a b 1 2 3 4 5 a b
14
Secara umum, seluruh sampel meniran hijau dari berbagai daerah menunjukkan bercak positif berwarna kuning pada pelat KLT termasuk didalamnya sampel meniran merah, Phyllanthus debilis dan petai cina. Standar hipofilantin yang digunakan menunjukkan hasil positif memiliki aktivitas antioksidan. Hal ini menunjukkan bahwa hipofilantin merupakan salah satu senyawa dalam meniran yang berperan sebagai antioksidan.
PEMBAHASAN
Penentuan Kadar AirProses pengeringan merupakan salah satu faktor yang menentukan kualitas dan kuantitas kandungan senyawa aktif suatu tumbuhan. Penelitian Rivai et al (2011) menyimpulkan bahwa perbedaan metode pengeringan herba meniran dapat menyebabkan penurunan yang nyata terhadap perolehan zat ekstraktif, kadar senyawa fenolat, dan aktivitas antioksidan dibandingkan dengan meniran yang segar. Selain mempengaruhi hasil jumlah zat ekstraktif, pengeringan juga berfungsi untuk membuat sampel lebih awet saat disimpan dalam jangka waktu yang panjang. Apabila kadar air terlalu tinggi yaitu diatas 10% dapat mengakibatkan kerusakan sampel akibat adanya mikroba dan memicu reaksi enzimatis yang dapat mempengaruhi kandungan bahan aktif sampel.
Seluruh sampel pada penelitian ini dikeringkan dengan memanfaatkan sinar matahari secara tidak langsung. Metode pengerigan ini dipilih karena memiliki keuntungan yaitu ekonomis, murah, dan praktis karena pengeringan dapat dilakukan dengan jumlah sampel yang banyak (Rivai et al 2016). Beberapa sampel meniran memiliki kadar air lebih dari 10% seperti sampel Pn1, Pn2, Pn3, dan Pn4. Tingginya kadar air dapat disebabkan lamanya penyimpanan dan kondisi tempat penyimpanan yang dipengaruhi oleh kelembapan udara ruangan (Rivai et al 2011). Faktor tersebut sangat dimungkinkan karena sampel Pn1, Pn2, Pn3, dan Pn4 diperoleh beberapa bulan lebih awal bila dibandingkan dengan sampel yang lain.
Pengukuran kadar air ditujukan agar dapat dijadikan sebagai faktor koreksi terhadap rendemen ekstrak meniran. Sampel dengan kadar air yang tinggi akan menghasilkan rendemen ekstrak yang rendah bila dibandingkan dengan ekstrak dengan kadar air rendah pada bobot sampel yang sama (Rivai et al 2011). Setelah mengetahui nilai kadar air, diharapkan dapat diperoleh rendemen dengan jumlah yang sama pada semua sampel saat dilakukan ekstraksi. Hal ini dimaksudkan agar sampel yang diaplikasikan pada pelat KLT memiliki konsentrasi rendemen yang sama. Dengan demikian intensitas ketebalan kromatogram dapat saling dibandiingkan untuk mengetahui konsentrasi suatu senyawa dalam sampel yang diaplikasikan.
Pengoptimuman Fase Gerak
Secara umum prinsip kerja KLT berdasarkan fase diam dan fase gerak. Fase diam pada KLT berupa padatan silika gel yang disangga pada pelat alumunium. Pemilihan silika gel sebagai fase gerak karena silika gel mempunyai
kekuatan pemisahan yang sangat baik dan tersedia cukup banyak secara komersial. Fase diam akan dialiri fase gerak yang merupakan media angkut komponen-komponen senyawa dalam sampel. Fase gerak dapat terdiri atas pelarut tunggal atau gabungan beberapa pelarut dengan perbandingan tertentu yang ditempatkan dalam bejana pengembang (Reich dan Anne 2007).
Keberhasilan proses pemisahan dalam KLT salah satunya bergantung pada fase gerak yang digunakan. Hal ini dikarenakan setiap pelarut untuk fase gerak memiliki tingkat kepolaran berbeda, tentunya akan memberikan hasil pemisahan yang berbeda (Reich dan Anne 2007). Pelarut yang terlalu polar cenderung menghasilkan bercak yang terlalu tertarik mendekati garis akhir dan berekor. Sebaliknya pelarut yang bersifat nonpolar cenderung membuat bercak tertahan di sekitar titik penotolan. Sedangkan pelarut semipolar sepertihalnya pelarut terplih kloroform dan diklorometana, selain banyak memunculkan bercak juga memisahkan dengan baik sehingga dapat di katakan senyawa- senyawa yang berada dalam tumbuhan meniran bersifat semipolar (Wiandanie 2010).
Validasi Metode Sidikjari KLT Meniran Hijau
Validasi metode merupakan bukti formal bahwa suatu metode sesui untuk digunakan (Reich dan Anne 2007). Pada penelitian ini validasi metode bertujuan agar metode yang dikembangkan dapat digunakan dalam mengevaluasi kualitas dan stabilitas meniran. Parameter yang digunakan dalam validasi metode yaitu kestabilan, spesifitas, presisi dan ketegaran. Parameter kestabilan terdiri atas stabilitas analat selama kromatografi, stabilitas analat dalam pelat dan dalam larutan, dan stabilitas hasil derivatisasi. Parameter spesifitas terdiri atas spesifitas meniran dengan senyawa standar dan sepesifitas meniran dengan pemalsunya. Parameter presisi terdiri atas presisi dan presisi intermediet. Parameter terakhir yaitu ketegaran yang terdiri atas ketegaran tipe bejana dan ketegaran jarak pengembangan (Meter dan Spriano 2010).
Stabilitas analat
Stabilitas analat harus diperiksa sebelum kromatografi baik didalam larutan dan pada pelat, karena analat harus stabil selama proses analisis (Koll et al 2003). Kestabilan penting pada KLT mengingat metode ini merupakan sistem terbuka. Keberadaan sampel yang berada pada permukaan pelat yang sangat adsorban dapat dipengaruhi oleh udara, cahaya, asap, debu, suhu dan faktor- faktor lain yang dapat merubah sampel. Sampel dikatakan stabil didalam larutan dan pada pelat selama rentang waktu tertentu jika tidak ada perbedaan pada tiap trek kromatogram (Reich dan Anne 2007). Hasil penelitian menunjukkan bahwa tidak ada perbedaan jumlah, posisi, warna, dan intensitas pita pada kromatogram. Hal ini menandakan bahwa analat stabil selama tiga jam baik pada pelat maupun di dalam larutan.
Analisi kualitatif pada tumbuhan seperti meniran terkait stabilitasnya sangat penting dikarenakan identitas dari komponen yang terpisah secara umum tidak diketahui dan banyaknya substansi yang harus di liahat didalam sampel juga tidak diketahui. Namun uji ini akan memperlihatan kesamaan atau perbedaaan dari sampel selama rentang waktu tertentu. Terdapatnya penambahan, hilangnya
16
spot atau perubahan intensitas warna akan mengindikasikan terdapatnya masalah pada sampel (Reich dan Anne 2007).
Stabilitas analat selama kromatografi diperiksa dengan menggunakan KLT 2-dimensi. Analat dikatakan stabil jika seluruh komponen terletak pada garis diagonal yang merupakan persimpangan antara dua fase gerak. Hasil penelitian memperlihatkan analat tidak stabil karena spot-spot tidak berada pada satu garis lurus dan cenderung membentuk parabola. Dimungkinkan, penyimpangan spot dari garis diagonal mengindikasikan terjadinya kerusakan pada analat. Selain itu, penyimpangan pada beberapa kasus ketika analat sedikit melenceng dari garis diagonal dapat terjadi jika tahap pengeringangan tidak sempurna sehingga kepolaran dari pelarut yang digunakan akan berpengaruh. Jika stabilitas analat tidak seperti yang diharapkan, metode harus dioptimalkan ulang atau diubah, semisal dilakukan pengembangan di dalam tempat gelap, menggunakan antioksidan atau menggunakan sistem pelarut yang berbeda (Koell et al. 2003).
Stabilitas visualisasi kromatogram perlu untuk diperiksa karena terdapatnya jeda waktu tunggu penyelesaian tahap kromatografi dan deteksi/dokumentasi. Selain itu dalam penelitian ini tahap derifatisasi juga termasuk bagian dari metode, sehingga akan menambah jeda waktu tunggu. Dengan adanya jeda waktu tunggu, kromatogram dalam pelat dapat berubah (Reich dan Anne 2007). Hasil uji dalam rentang waktu 2, 3, 5, 10, 20, 30, dan 60 menit tidak telihat pita koromatogram yang muncul ataupun hilang. Hal ini menunjukan kromatogram tetap stabil selama 60 menit jeda waktu tunggu.
Spesifitas
Uji spesifitas untuk obat herbal diperlihatkan dengan membandingkan sidikjari sampel dengan sidikjari bahan obat herbal yang asli atau dengan bagian bahan yang memiliki aktivitas tertentu yang berhubungan dengan sampel uji atau substansi penanda (senyawa standar) dan material herbal yang diketahui (Koll et al. 2003). Uji spesifitas dilakukan dengan cara seluruh sampel diaplikasikan dalam satu pelat KLT secara beruntun. Uji ini spesifik terhadap meniran hijau jika sidikjari dapat dibedakan. Dalam hal ini, bukan hanya hubungan antar spot, namun intensitas juga mungkin menunjukkan informasi yang penting. Spot sampel yang relevan menunjukkan kesamaan dalam jumlah, warna, intensitas dan posisi relatif spot yang diperoleh (Shivatare et al 2013).
Hasil uji spesifitas (Gambar 6) sidikjari meniran tidak menunjukan adanya filantin dan hipofilantin dilihat dari pola warna yang terbentuk. Pada kasus ini dimungkinkan konsentrasi filantin dan hipofilantin rendah pada sampel Pn1, sehingga tidak cukup untuk terekspresi menjadi sebuah bercak pada plat KLT. Rendahnya kandungan filantin dan hipofilantin salah satunya dapat disebabkan pengaruh naungan tempat tumbuh meniran (Oktavidiati el al. 2011). Lingkungan tempat tumbuh tanaman, perlakuan pasca panen, suhu, dan lain- lain juga dapat mempengaruhi kandungan kedua senyawa tersebut (Liang et al. 2004). Terlebih karena sampel meniran diambil dari berbagai daerah yang berbeda dengan kondisi tanah, suhu, tingkat naungan, dan waktu pemanenan yang berbeda pula. Perbedaan pola kromatogram terlihat pula pada bagian-bagian organ daun dan batang terhadap pola bagian akar meniran hijau yang menandakan adanya perbedaan produksi senyawa metabolit pada bagian tersebut.
Perbedaan kromatogram meniran hijau dengan tumbuhan yang memiliki kekerabatan dekat dan tumbuhan yang sering dugunakan untuk memalsukan meniran (Gambar 7 dan Gambar 8) memperlihatkan kesamaan pola kromatogram antar tumbuhan yang berkrabat dekat, walaupun pita yang di hasilkan memiliki perbedaan intesitas warna. Namun perbedaan kecil tidak mempengaruhi perbedaan secara definitif beberapa perbedaan alami sampel tumbuhan (Widmer et al. 2007).
Bila perbedaan didasarkan dengan keberadaan senyawa penciri filantin dan hipofilantin, maka dapat dibedakan meniran hijau dengan daun petai cina yang sering digunakan sebagai pemalsu yang ditunjukkan dengan tidak adanya pita berwarna biru (filatin) dan coklat (hipofilantin) dengan nilai Rf yang sama. Akan tetapi filantin dan hipofilantin juga terlihat terekspresi pada sampel Pu1, Pu3, dan Pd3. Hal ini dapat terjadi karena konsentrasi filantin dan hipofilantin pada kedua jenis meniran tersebut sangat rendah sehingga tidak terekspresikan pada pelat KLT. Hasil serupa dilaporkan dalam penelitian. Tripathi et al. (2006) yang menggunakan analisis HPLC dan HPTLC terhadap P. amarus, P. fraternus, P. urinaria, P. maderaspatensis, P. virgatus, dan P. debilis yang menunjukkan bahwa filantin dan hipofilantin P. urinaria dan P. debilis tidak terdeteksi. Penelitian Oktavidiani (2012) juga memperlihatkan bahwa kandungan total filantin dan hipofilantin pada meniran merah sangat kecil bahkan tidak dapat terdeteksi.
Filantin dan hipofilantin merupakan senyawa utama dari golongan lignan. Sejauh ini, kualitas meniran ditentukan berdasarkan kandungan senyawa penanda tunggal dari golongan lignan (BPOM 2004). Tanin mengendapkan protein pada gelatin. Lignan merupakan senyawa golongan polifenol alam yang secara biosintesis termasuk ke dalam senyawa turunan asam amino protein aromatik yaitu fenilalanin dan fenilpropanoid. Golongan senyawa ini merupakan struktur dasar pembentuk lignan dan juga berkaitan dengan pengatur tumbuh dan pertahanan diri tanaman terhadap penyakit. Filantin dan hipofilantin telah terbukti sebagai antihepatotoksik terhadap karbon tetraklorida (Alegantina et al. 2015). Presisi
Menurut Sudberg et al (2010) presisi atau keseksamaan adalah tingkat kesesuaian di antara hasil analisis individual jika prosedur dilakukan berulang kali terhadap sampel ganda atau beberapa sampel yang homogen. Presisi pada metode analisi dapat dibagi menjadi tiga kategori, yaitu presisi, presisi intermediet, dan reproducibility (keterproduksiulang). Presisi, atau uji presisi dalam satu hari, ditentukan ketika analisis dilakukan dalam laboratorium yang sama dengan kondisi yang sama (alat, plat KLT, reagen) dan dilakukan dalam satu hari kerja. Presisi intermediet didapatkan ketika analis dilakukan dalam sebuah laboratorium dengan analisis, peralatan, reagen, dan pelat yang berbeda salama beberapa hari atau minggu. Reproducibility merepresentasikan presisi yang diperoleh dari beberapa laboratorium dengan tujuan untuk memverifikasi kemampuan metode dapat memberikan hasil yang sama pada laboratorium yang berbeda (Shivatare et al. 2013).
Kriteria keberterimaan presisi intermediet (∆Rf ≤ 0.05) lebih besar dibandingkan presisi (∆Rf ≤ 0.02) hal ini karena tidak mungkin menjaga semua kodisi lingkungan labolaturium untuk tetap konstan di tiap harinya. Sebagai
18
contoh faktor lingkungan yang dapat berubah tiap harinya adalah suhu dan kelembaban (Reich dan Anne 2007). Wldmer et al. (2007) menyebutkan kelembaban relatif yang sangat rendah semisal 3% menjadikan kromatogram memiliki penampakan yang rendah dan nilai Rf yang tinggi. Kelembapan relatif yang tinggi menjadikan banyak zona yang terdifusi menjadi satu dan memiliki resolusi (keterpisahan) yang rendah. Selain itu, keberadaan sedikit air dalam sistem dapat mempengaruhi kelembaban relative. Koll et al (2003) menyebutkan secara khas, nilai Rf menurun dengan meningkatnya suhu dan menurunnya kelembaban. Kelembaban relatif dan suhu merupakan faktor yang saling tergantung satu sama lain.
Hasil uji presisi dan presisi intermediet menunjukkan sedikit perbedaan nilai Rf (Tabel 3 dan Tabel 4). Perbedaan nilai Rf pada pengujian parameter presisi dan presisi intermediet dapat disebabkan perubahan kelembaban reatif pada sistem KLT. Selanin itu pengaruh peningkatan suhu dan terdapatnya sedikit air pada sistem juga dapat mempengaruhi perbedaan tersebut (Koll et al 2003).
Robustness
Robustness (ketegaran) merupakan metode untuk tidak terpengaruh dan bertahan pada pengaruh kecil, namun dilakukan dengan sengaja untuk membuat variasi dalam faktor metode yang memberikan indikasi realibilitas metode normal pada pengujian (Shivatare et al. 2013). Penjelasan lain mengenai robustness yaitu kemampuan metode untuk toleran terhadap fariasi suatu parameter tanpa terjadi perubahan yang signifikan terhadap hasil. Robustness tipe bejana dilakukan dengan memisahkan komponen meniran hijau pada twin through chamber dan flat bottom chamber, sedangkan robustness jarak pengembangan dilakukan pada jarak 75 mm dan 85 mm. Parameter dapat diterima jika perbedaan nilai Rf tidak melebihi 0.05 (Reich et al 2008).
Pola kromatogram pada pelat yang dikembangkan menggunakan twin trough chamber dan flat bottom chamber tidak menunjukkan adanya perbedaan jumlah, intensitas, posisi, dan warna pita. Parameter yang sama digunakan pada pengujian robustness jarak pengembangan. Nilai ∆Rf yang diperoleh tidak melebihi 0.05, sehingga parameter robustness tipe bejana dan jarak pengembangan dapat diterima.
Identifikasi Aktivitas Antioksidan secara Kualitatif Menggunakan KLT Autografi DPPH
Antioksidan didefinisikan sebagai senyawa yang mampu menunda, memperlambat, atau menghambat reaksi oksidasi. Metode DPPH mengukur kemampuan suatu senyawa antioksidan dalam menangkap radikal bebas. Kemampuan penangkapan radikal bebas berhubungan dengan kemampuan komponen senyawa dalam menyumbangkan elektron atau hidrogen (Dwenjee et al 2014). Setiap molekul yang dapat menyumbangkan elektron atau hidrogen akan bereaksi dan memudarkan DPPH. Intensitas warna DPPH akan berubah dari ungu menjadi kuning oleh elektron yang berasal dari senyawa antioksidan. Konsentrasi DPPH pada akhir reaksi bergantung pada konsentrasi awal dan struktur komponen senyawa penangkap radikal (Naik et al 2003).
Uji kualitatif terhadap eksrak metanol meniran hijau dilakukan untuk mengetahui senyawa kandungan ekstrak yang memiliki aktivitas antioksidan. Uji menggunakan DPPH 0.04% dalam metanol sebagai pereaksi untuk mendeteksi senyawa bioktif yang memiliki kemampuan menangkap radikal bebas. Senyawa bioaktif tersebut memberikan warna kuning dengan latar belakang warna ungu pada pelat KTL menggunakan sinar tampak (Rinita 2008).
Hasil uji aktivitas atioksidan meniran hijau (Gambar 13) memperlihatkan bercak positif berwarna kuning pada seluruh bagian meniran baik daun, akar, dan batang yang menunjukkan terdapat beberapa senyawa di seluruh bagian organ meniran hijau memiliki potensi sebagai antioksidan termasuk didalamnya sampel meniran merah dan Phyllanthus debilis (Gambar 14). Hasil skrining dalam penelitian yang dilakukan oleh Alegantina et al (2015) menunjukkan herba meniran (P.niruri Linn) mengandung senyawa tanin, steroid, alkaloid dan flavonoid. Golongan tanin merupakan senyawa fenolik yang cenderung larut dalam air dan pelarut polar, tanin bereaksi dengan gelatin membentuk kopomiler mantap yang tidak larut dalam air. Senyawa flavonoid merupakan senyawa yang dapat berperan sebagai antibakteri, antioksidan dan antivirus. Flavonoid dan lignan masuk ke dalam golongan polifenol. Berdasarkan hasil skrining dalam penelitian Alegantina el al (2015) diketahui herba meniran mengandung flavonoid, sehingga dapat diambil kesimpulan bahwa meniran mengandung senyawa polifenol, dengan senyawa lignan termasuk didalamnya yang berperan sebagai antioksidan.
SIMPULAN DAN SARAN
SimpulanMetode KLT dapat digunakan untuk analisis sidikjari meniran hijau. Kloroform-diklorometana (9:1) (v/v) menjadi campuran fase gerak terbaik pada optimasi fase gerak dengan derivatisasi menggunakan reagen anisaldehida pada sinar tampak. Secara umum validasi metode dapat diterima sesuai dengan krteria, kecuali parameter kestabilan analat selama kromatografi dan presisi yang tidak memenuhi kriteria keberterimaan. Meniran hijau, meniran merah, dan Phyllanthus debilis memiliki beberapa senyawa dengan aktifitas antikosidan yang ditunjukkan dengan bercak berwarna kuning pada pelat KLT yang diderivatisasi menggunakan reagen DPPH pada sinar tampak.
Saran
Faktor kelembapan/kejenuhan sistem pada saat pengembangan perlu diatur agar tetap konsisten karena sangat berpengaruh terhadap proses pemisahan senyawa pada pelat KLT, sehingga perlu dicoba dengan menggunakan camber dengan kelembaban konstan. Parameter validasi yang lain perlu untuk dicoba untuk mengabsahkan metode yang dikembangkan. Selain itu, metode pengeringan dan penyimpanan simplisia perlu diperhatikan untuk menjaga kualitas kandungan senyawa bioaktif didalam meniran.
20
DAFTAR PUSTAKA
[AOAC] Association of Official Analytical Chemist. 2006. Official Methods of Analysis of the Association of Official Analytical Chemist. Washington DC (US): Association of Official Analytical Chemist.
[RI BPOM] Republik Indonesia, Badan Pengawas Obat dan Makanan. 2004. Monografi ekstrak tumbuhan obat Indonesia. Jakarta (ID). 1:67-70.
Alegantina S, Harni AS, Triwahyuni. 2015. Pengujian mutu dan penetapan kadar filantin pada ekstrak etanol herba meniran (Phyllanthus nirruri Linn). Bul Pemelit Kesehatan. 43(1):11-16.
Dewanjee S, Moumita G, Niloy B, Ritu K, Tarun KD. 2014. Bioautography and its scope in the field of natural product chemistry. Jurnal of Pharmaceutical Analysis. 1-11.
Gunawan I, Bawa I, Sutrisnayanti N. 2008. Isolasi dan identifikasi senyawa terpenoid yang aktif antibakteri pada herba meniran (Phyllanthus niruri Linn). Jurnal Kimia. 12: 31-39.
Herdiana M. 2010. Analisis sidikjari kayu secang (Caesalpinia sappan L.) dengan kromatografi lapis tipis [skripsi]. Bogor (ID): Institut Pertanian Bogor. Koll K, Kike R, Anna B, Markus V. 2003. Valodation of standardized
high-performance thin-layer chromatographic methods of quality control and stability testing of herbals. JAOC Int. 82(5):909-915.
Liang YZ, Xie P, Chan K. 2004. Quality control of herbal medicines. Journal of Chromatography. 812: 53–70.
Meter B, Spriano D. 2010. Modern HPTLC a perfect tool for quality control of herbals and their preparation. JAOC Int. 93(5):1399-1409.
Naik GH, Priyadarsini KI, Satav JG, Banavalikar MM, Sohoni DP, Biyani MK,Mohan H. 2003. Competitive antioxidant activity of individual herbal components used in ayurvedic medicine. Phytochemistry. 63(1):97-104.
Oktavidianti E. MA Chozin, N Wijayanti, M Ghulamahdi, LK Darusman. 2011. Pertumbuhan tanaman dan kandungan total filantin dan hipofilantin aksesi meniran (Phyllanthus sp.L) pada berbagai tingkat naungan. Jurnal Littri. 17(1):25-31.
Oktavidiati E. 2012. Kajian beberapa aspek agronomi tanaman obat meniran hijau Phyllanthus Niruri L.) dan meniran merah (Phyllanthus urinaria L.) [disertasi]. Bogor (ID): Institut Pertanian Bogor.
Reich E, Anne S. 2007. High Performance Thin Layer Chromatography for The Analysis of Medicinal Plants. New York (US): Thieme Medical Publishers, Inc
Reich E, Anne S, Alison D. 2008. Validation of high performance thin-layer chromatographic methods for identification of botanical in a cGMP environment. JAOC Int. 91(1):13-20.
Rininta N. 2008. KLT autografi-CUPRAC sebagai teknik cepat pendeteksi senyawa antioksidan [skripsi]. Bogor (ID): Institut Pertanian Bogor. Rivai H, Hazil N, Hamzar R, Amir B. 2011. Pengaruh cara pengeringan terhadap
mutu herba meniran (Phyllanthus niruri L.). Majalah Farmasi Indonesia. 22(1): 73-76.
Shivantare RS, Dheeroj HN, Sanjay UN. 2013. ‘HPTLC’ and important tool in standardization of herbal medical product: a revieu. Jurnal of Scientific and Innovative Research. 2(6):1086-1096.
Sudberg S, Elen MS, Jennifer T, Sandra S, Kirtal P, Jose P, Bryan F. 2010. Fingerpront analysis and application of HPTLC for determination of identity and qulity of botanical form industry prespective. JAOC Int. 95(5):1367-1375.
Tripathi AK, Verma RK, Gupta AK, Gupta MM, Khanuja S. 2006. Quantiative determination of phyllanthin and hypophyllanthin in phyllanthus species by high performance thin layer chromatography. Phytochem Anal. 17:394-397.
Wiandanie RLA. 2010. Pengoptimuman ekstraksi dan fase gerak kromatografi lapis tipis untuk pemisahan komponen seledri [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Wldmer V, Eike R, Allon D. 2007. Validation HPTLC method for identification of Hoodia gordonii.
22
Lampiran 1 Skema alir penelitian Preparasi Sampel Pengeringan Penentuan kadar air Validasi metode sidikjari KLT KLT-Autografi DPPH Ekstraksi Pengoptimuman fase gerak
24
Lampiran 2 Nilai kadar air seluruh sampel yang digunakan
Kode Sampel* Ulangan Bobot cawan kosong (g) Bobot awal sampel (g) Bobot cawan dan sampel setelah di oven (g) Bobot sampel setelah di oven (g) kadar air (%) rerata kadar air (%) Pn1 1 5.0394 1.0005 5.9239 0.8845 11.59 11.14 2 4.4950 1.0009 5.3808 0.8858 11.50 3 4.3855 1.0005 5.2826 0.8971 10.33
Rerata kadar air ± SD 11.14 ± 0.70
Pn2
1 4.4863 1.0079 5.3923 0.906 10.11 10.47
2 4.6616 1.0084 5.5652 0.9036 10.39 3 4.5229 1.0071 5.4201 0.8972 10.91
Rerata kadar air ± SD 10.47 ± 0.41
Pn3
1 4.8970 1.0055 5.7905 0.8935 11.14 11.50
2 4.4621 1.0052 5.3557 0.8936 11.10 3 4.4852 1.0053 5.3671 0.8819 12.27
Rerata kadar air ± SD 11.50 ± 0.67
Pn4
1 4.5746 1.0010 5.4541 0.8795 12.14 11.73
2 4.7319 1.0008 5.6160 0.8841 11.66 3 4.5482 1.0007 5.4350 0.8868 11.38
Rerata kadar air ± SD 11.73 ± 0.38 Pn5
1 4.4831 1.0097 5.3971 0.9140 9.48 9.40
2 4.3989 1.0031 5.3071 0.9082 9.46 3 4.7154 1.0066 5.6286 0.9132 9.28
Rerata kadar air ± SD 9.40 ± 0.11 Pn6
1 5.0041 1.0058 5.9176 0.9135 9.18 9.26
2 5.0457 1.0085 5.9603 0.9146 9.31 3 4.5258 1.0024 5.4351 0.9093 9.29
Rerata kadar air ± SD 9.26 ± 0.07 Pn7
1 5.0931 1.0067 6.0097 0.9166 8.95 8.82
2 4.9147 1.0034 5.8300 0.9153 8.78 3 4.6704 1.0006 5.5837 0.9133 8.72
Rerata kadar air ± SD 8.82 ± 0.12 Pn8
1 4.4736 1.0094 5.3890 0.9154 9.31 9.24
2 4.4799 1.0005 5.3884 0.9085 9.19 3 4.5071 1.0058 5.4201 0.9130 9.23
Rerata kadar air ± SD 9.24 ± 0.06 Pn9
1 4.5728 1.0082 5.4900 0.9172 9.02 9.31
2 4.5994 1.0030 5.5116 0.9122 9.05 3 4.5071 1.0035 5.4117 0.9046 9.85
Lanjutan lampiran 2 No Sampel* Ulangan Bobot cawan kosong (g) Bobot awal sampel (g) Bobot cawan dan sampel setelah di oven (g) Bobot sampel setelah di oven (g) kadar air (%) rerata kadar air (%) Pn10 1 4.5484 1.0002 5.4460 0.8976 10.26 9.87 2 4.7218 1.0098 5.6352 0.9134 9.55 3 4.4822 1.0025 5.3863 0.9041 9.81
Rerata kadar air ± SD 9.87 ± 0.36 Pu1
1 4.4020 1.0009 5.3055 0.9035 9.73 9.61
2 5.0912 1.0042 5.9991 0.9079 9.59 3 4.6933 1.0048 5.6024 0.9091 9.52
Rerata kadar air ± SD 9.61 ± 0.10 Pu2
1 4.4732 1.0023 5.3743 0.9011 10.10 10.33 2 5.0113 1.0015 5.9105 0.8992 10.21
3 4.9279 1.0037 5.8243 0.8964 10.69
Rerata kadar air ± SD 10.33 ± 0.31 Pu3
1 5.0658 1.0009 5.9666 0.9008 10.00 9.81
2 4.4903 1.0026 5.3946 0.9043 9.80 3 4.5120 1.0058 5.4211 0.9091 9.61
Rerata kadar air ± SD 9.81 ± 0.19 Pu4
1 4.9158 1.0079 5.8224 0.9066 10.05 9.87
2 4.4900 1.0051 5.3959 0.9059 9.87 3 4.4738 1.0054 5.3818 0.9080 9.69
Rerata kadar air ± SD 9.87 ± 0.18 Pd1
1 5.0988 1.0013 6.0000 0.9012 9.99 10.13
2 5.0352 1.0017 5.9349 0.8997 10.18 3 4.4269 1.006 5.3303 0.9034 10.20
Rerata kadar air ± SD 10.13 ± 0.11 Pd2
1 4.5672 1.0033 5.4682 0.9010 10.20 10.01 2 4.5012 1.0048 5.4042 0.9030 10.13
3 4.5846 1.0062 5.493 0.9084 9.72
Rerata kadar air ± SD 10.01 ± 0.26 Ll1
1 4.4904 1.0046 5.3986 0.9082 9.59 9.50
2 4.5215 1.004 5.4301 0.9086 9.50 3 4.7214 1.0015 5.6285 0.9071 9.42
Rerata kadar air ± SD 9.51 ± 0.08 Ll2
1 5.0148 1.0067 5.9286 0.9138 9.23 9.27
2 4.5121 1.0052 5.4235 0.9114 9.33 3 4.6641 1.0014 5.5729 0.9088 9.25
Rerata kadar air ± SD 9.27 ± 0.05 Ll3
1 25.6585 1.0045 26.5696 0.9111 9.30 9.25 2 27.9008 1.0013 28.8091 0.9083 9.29
3 24.4675 1.003 25.3785 0.911 9.17
26
Contoh perhitungan kadar air
% kadar air =bobot sampel awal (g) − bobot sampel akhir (g)
bobot sampel awal (g) × 100%
= 1.0067 g- 0.9166 g1.0067 g × 100% = 8.95%
Lampiran 3 Penggolongan pelarut oleh Snyder’s
Golongan Pelarut Kekuatan pelarut
I n-heksana* 0 n-butil eter 2.1 Diisopropil eter 2.4 Metil-t-butil eter 2.7 Dietil eter* 2.8 II n-butanol 3.9 2-propanol 3.9 n-propanol 4.0 Etanol* 4.3 Metanol* 5.1 III Tetrahidrofuran 4.0 Piridin 5.3 Metoksietanol 5.5 Dimetilformamida 6.4 IV Asam asetat 6.0 Formamida 9.6 V Diklorometana* 3.1 1,1-dikloroetana 3.5 VI Etil asetat* 4.4
Metil etil keton 4.7
Dioksana 4.8 Aseton 5.1 Asetonitril* 5.8 VII Toluena 2.4 Benzena 2.7 Nitrobenzena 4.4 VIII Kloroform* 4.3 Dodekafloroheptanol 8.8 Air 10.2
RIWAYAT HIDUP
Penulis dilahirkan di Banjarnegara tanggal 15 Juni 1992 dari ayah Mutohar dan ibu Russinah. Penulis merupakan putra ketiga dari tiga bersaudara. Tahun 2011 penulis lulus dari SMA Negeri 1 Bawang, Banjarnegara dan pada tahun yang sama lulus seleksi masuk IPB melalui jalur Seleksi Masuk Perguran Tinggi Negeri dengan Program Studi Biokimia, Departemen Biokimia, Fakultas Matematika dan Ilmu Pengetahuan Alam. Pada tahun 2014, penulis melaksanakan praktik lapangan di Laboratorium Pusat Studi Biofarmaka dengan judul “Analisis Sidikjari Berbasis Kromatografi Lapis Tipis untuk Simplisia Meniran (Phyllantus niruri).”
Selama mengikuti perkuliahan, penulis menjadi asisten praktikum mata kuliah Kimia B (program SI TPB-IPB tahun ajaran 2012/2013 dan 2014/2015), Kimia Dasar II (program SI TPB-IPB tahun ajaran 2013/2014), Biokimia (program D3 IPB tahun ajran 2015/2016). Tahun 2011 menjadi anggota Pasukan Pengibar Bendera Resimen Mahasiswa IPB (PASKIBRA MENWA IPB) angkatan 48 dan pada tahun 2013 menjadi Komandan Tim PASKIBRA MENWA IPB angkatan 49. Aktif sebagai anggota Resimen Mahasiswa Batalyon VII/Suryakancana dari tahun 2011, pada periode 2014/2015 menjabat sebagai Komandan Kompi-A/IPB dan berlanjut pada periode 2015/2016 menjabat sebagai Komandan Batalyon VII/Suryakancana. Selain itu penulis juga akitif sebagai pengurus Community of Reserch and Edukation of Biochemistry (CREB’s) di periode 2012/2013 sebgai Staf HRD dan menjadi ketua pelaksana Masa Perkenalan Departemen (MPD) Biokimia di periode yang sama. Penulis ikut berpartisipasi dalam kegiatan IPB Goes to Field (IGTF) dengan daerah tugas Kab Pekalongan pada tahun 2013. Tahun 2016 penulis mengikuti kegiatan Ekspedisi NKRI Koridor Papua Barat tergabung dalam tim peneliti flora fauna.