KAJI BANDING DUA TEKNIK PENGEMASAN
MENGGUNAKAN TIGA MACAM PENGENCER UNTUK
PEMBEKUAN SEMEN SAPI
FRIESIAN HOLSTEIN
(FH)
(A Comparison of Two Packaging Techniques Using Three Extenders for
The Cryopreservation of Friesian Holstein (FH) Semen)
R.I. ARIFIANTINI, T.L. YUSUF danO. INDAH
Departemen Klinik, Reproduksi dan Patologi, Fakultas Kedokteran Hewan, Institut Pertanian Bogor Kampus Darmaga 16680, Bogor
ABSTRACT
The percentage of the progressive motile and life sperm of frozen thawed semen was used as criterion to compare methods of semen cryopreservation. Fifteen ejaculates from three friesian holsteins (FH) were frozen in three extenders, TEY (Tris egg yolk), home made tryladil (HMT) and AndroMed contain soya lecithin (KK), in each of two packaging techniques (0,3 mL minitub and 0,25 mL IMV straw). The samples were equilibrate (5oC) for four hour and frozen in liquid nitrogen vapor for 10 minutes. The percentages of post thaw progressive motile and life sperm were greater (P<0,05) for KK (56,28; 74,22) than for HMT (47,60; 65,93) and TEY (48,74; 69,63). They were no significant different in the percentages of progressive motile and life sperm freezing in 0,3 mL (52,16; 69,4) or 0,25 mL (49,59; 70,44). The percentages life sperm in KK minitub (72,76±10,83) and KK IMV (75,67±8,1) were greater than any other combination. The percentages of progressive motile sperm in KK Minitub (57,9) were greater than KK IMV or any other combination.
Key Words: Frozen Semen , Bull, Tris, Andromed, Triladyl ABSTRAK
Persentase sperma motil (%SM) dan sperma hidup (%SH) pasca thawing digunakan sebagai kriteria penilaian keberhasilan pembekuan semen sapi FH menggunakan tiga macam pengencer dan dua kemasan yang berbeda. Lima belas ejakulat dari tiga ekor sapi FH dibekukan menggunakan tiga macam pengencer, tris kuning telur (TEY), home made tryladil (HMT) dan androMed, pengencer yang mengandung kacang kedelai (KK), masing-masing dikemas dalam minitub 0,3 mL dan straw IMV 0,25 mL. Sampel di ekuilibrasi selama empat jam kemudian dibekukan dalam uap nitrogen cair selama 10 menit. Hasil pasca thawing menunjukkan % SM dan % SH pada pengencer KK (56,28; 74,22) lebih tinggi (P<0,05) dibandingkan HMT (47,60; 65,93) dan TEY (48,74; 69,63). Tidak ada perbedaan kualitas pada teknik pengemasan dengan SM dan SH masing-masing adalah 52,16; 69,4% (minitub) dan 49,59; 70,44% (IMV). Persentase SH pada KK minitub (72,76 ± 10,83) dan KK IMV (75,67 ± 8,1) menunjukkan hasil yang sama lebih baik dibandingkan kombinasi lainnya. Persentase SM pada KK minitub (57,9) lebih tinggi dibandingkan dengan KK IMV atau kombinasi lainnya. Kata Kunci: Semen Beku, Sapi, Tris, Andromed, Triladyl
PENDAHULUAN
Untuk menghasilkan semen beku yang berkualitas dibutuhkan bahan pengencer semen yang mampu mempertahankan kualitas spermatozoa selama proses pendinginan, pembekuan maupun pada saat thawing (ABOAGLA dan TERADA, 2004a). Pengencer semen beku harus mengandung sumber nutrisi,
buffer, bahan anti cold shock, anti biotik dan krioprotektan yang dapat melindungi spermatozoa pada saat pendinginan, pembekuan dan thawing. Sumber nutrisi yang paling banyak digunakan adalah kabohidrat terutama fruktosa yang paling mudah dimetabolisir oleh spermatozoa (TOELIHERE, 1993). Buffer berfungsi sebagai pengatur tekanan osmotik dan juga berfungsi menetralisir asam laktat
yang dihasilkan dari sisa metabolisme spermatozoa. Buffer yang umum digunakan adalah tris (hydroxymethyl) aminomethan yang mempunyai kemampuan sebagai penyangga yang baik dengan toksisitas yang rendah dalam konsentrasi yang tinggi (STEINBACH dan FOOTE, 1967). Bahan anti cold shock yang dapat melindungi spermatozoa pada saat perubahan suhu dari suhu ruang (28oC) pada saat pengolahan ke suhu ekuilibrasi (5oC). Anti
cold shock yang umum ditambahkan adalah kuning telur atau kacang kedelai (ABOAGLA dan TERADA, 2004b). Khasiat utama kuning telur atau kacang kedelai adalah kandungan lesitin (phosphatidil cholin) yang dapat bersifat membran couting untuk tetap mempertahankan konfigurasi normal phospholipid bilayer yang merupakan susunan utama membran sel spermatozoa.
Krioprotektan perlu ditambahkan dalam pengolahan semen beku untuk meminimalisasi kerusakan akibat pembekuan, seperti pembentukan kristal es intra dan ektra seluler. Krioprotektan yang umum digunakan pada pembekuan semen mamalia adalah gliserol (PARK dan GRAHAM, 1992). Selain itu karbohidrat bermolekul besar seperti raffinosa, trehalosa dan sukrosa juga dapat digunakan sebagai krioprotektan ekstra seluler.
Saat ini telah berkembang dan digunakan secara meluas bahan pengencer resep yang mengandung buffer seperti tris (hydroxymethyl aminomethan) yang telah secara universal digunakan untuk semen beku sapi. Tris juga telah digunakan secara meluas pada preservasi maupun kriopreservasi semen berbagai ternak diantaranya pada semen sapi (DAVIS et al., 1963; ANZAR dan GRAHAM, 1995); semen kambing (TAMBING, 2001; SUWARSO, 1999); semen domba (HAHN, 1972; SALAMON dan VISSER, 1972; MAXWELL dan SALAMON, 1993); semen anjing (YILDIZet al., 2000) dan semen ayam (SEXTON, 1978; ABDILLAH, 1999). Selain pengencer semen dapat dibuat berdasarkan resep, terdapat berbagai pengencer kemasan yang telah beredar dan dapat diperoleh dipasaran seperti Biochiphos dan Bioexel (IMV Perancis) juga triladyl, biladil dan pengencer AndroMed (Minitub Jerman) yang menggunakan lesitin dari kacang kedelai (KK).
Semen beku mulai berkembang setelah ditemukannya gliserol oleh Polge pada tahun 1949 (ROYEREet al., 1996) dengan kemasan
yang digunakan pertama kali berbentuk pellet. Kemasan semen lain yang berkembang selanjutnya adalah ampul, mini (0,25 mL) dan medium (0,5 mL) straw, minitub (0,25 dan 0,3 mL), macrotub (5 mL) serta kemasan plitplat (5mL) yang digunakan pada semen beku babi. Kemasan yang sekarang populer dan digunakan secara universal adalah kemasan straw 0,25 dan 0,5 mL (IMV, Prancis) dan minitub 0,25; 0,3 dan 0,5 mL (Minitub, Jerman). Di Indonesia saat ini terdapat dua balai inseminasi buatan (BIB) nasional dan beberapa balai inseminasi buatan daerah (BIBD), yang menggunakan dua kemasan straw yaitu ministaw minitub.
TUJUAN PENELITIAN
1. Membandingkan bahan pengencer tris kuning telur (resep dari FKH-IPB), triladyl (home made) dan pengencer KK terhadap kualitas semen beku sapi FH
2. Membandingkan kemasan minitub 0,3 mL dan ministraw 0,25 mL terhadap kualitas semen beku sapi FH
3. Membandingkan kombinasi antara pengencer dan kemasan semen beku terbaik pada sapi FH
MATERI DAN METODE Waktu dan tempat penelitian
Penelitian dilakukan di laboratorium Unit Rehabilitasi Reproduksi (URR) Bagian Reproduksi dan kebidanan, Departemen Klinik, Reproduksi dan Patologi, Fakultas Kedokteran Hewan, Institut Pertanian Bogor. Penelitian ini dimulai dari bulan Pebruari sampai Agustus 2004.
Materi penelitian Hewan percobaan
Hewan yang dipergunakan untuk sebagai sumber semen adalah tiga ekor sapi FH (Friesian holstein) jantan dewasa kelamin.ditempatkan dalam kandang individu. Pakan yang diberikan berupa hijauan rumput segar dan konsentrat serta air minum diberikan ad libitum.
Metode penelitian
Persiapan Bahan Pengencer
Pembuatan bahan pengencer tris-kuning telur (TEY)
Bahan pengencer TEY dilakukan dengan pembuatan larutan utama terdiri dari Tris (hydroxymethyl) aminomethan 3,87 g, asam sitrat 2,17 g, fruktosa 1,56 g dan aquadest ad 100 mL Pengencer TEY terdiri atas Larutan utama (stock solution) 73,6%, kuning telur (KT) 20% dan gliserol (G) 6,4%. Antibiotik penisilin 1000 IU dan streptomisin 1000 µg ditambahkan pada setiap mL pengencer untuk mencegah pertumbuhan bakteri.
Pembuatan pengencer (home made) tryladyl Home made Triladyl ( HMT) mempunyai bahan yang sama dengan TEY, hanya jumlahnya berbeda. Larutan utama terdiri dari Tris (hydroxymethyl) aminomethan 2,42 g, asam sitrat 1,48 g, fruktosa 1 g dan aquadest ad 73,6 mL. Larutan pengencer terdiri dari 73,6 mL larutan utama, 6,4 mL G dan 20 mL KT. Antibiotik penisilin 1000 IU dan streptomisin 1000 µg ditambahkan pada setiap mL pengencer untuk mencegah pertumbuhan bakteri.
Pembuatan pengencer kacang kedelai (KK) Pengencer paten yang mengandung lesitin dari kacang kedelai dilarutkan satu bagian dengan empat bagian aquadest, dihomogenkan dan dihangatkan pada temperatur ruang.
Penampungan dan evaluasi semen
Penampungan semen dilakukan dua kali dalam satu minggu pada pagi hari sebanyak dua ejakulat menggunakan vagina buatan. Suhu bagian dalam vagina buatan sekitar 41−44oC, yang merupakan suhu optimal untuk penampungan semen. Pemancing (teaser) menggunakan sapi betina. Semen yang diperoleh dievaluasi secara makroskopis dan mikroskopis. Evaluasi secara makroskopis meliputi pemeriksan volume (mL), warna (krem, putih kekuningan), pH (pH special
indicator paper; Merck, skala 6,5–10) dan konsistensi (encer, sedang hingga kental).
Penilaian mikroskopis meliputi: Gerakan massa diperiksa dengan meneteskan satu tetes semen segar ke gelas obyek yang bersih dan hangat lalu diamati di bawah mikroskop dengan perbesaran 100 kali. Kriteria penilaian berdasarkan kecepatan gerak massa yaitu: +++, gerakan massa yang paling baik yang ditandai dengan gelombang besar, gelap bergerak cepat dan berpindah-pindah tempat); ++, gerakan massa yang baik ditandai dengan gelombang besar, tipis, jarang dan bergerak lambat; + (lumayan), gelombang kecil, tipis dan lambat dan − (jelek) tidak ada gelombang, hanya gerakan individual aktif progresif.
Persentase sperma motil (% SM) dievaluasi secara subjektif kuantitatif dilakukan dengan meneteskan sedikit semen di atas gelas objek yang bersih dan hangat, kemudian ditambahkan 4–5 tetes NaCl fisiologis, dihomogenkan dan diambil satu tetes pada objek gelas yang lain ditutup dengan gelas penutup. Jumlah spermatozoa diusahakan setiap lapang pandang hanya 10–20 sel dan dihitung dari 10 lapang pandang yang berbeda. Penilaian dilakukan mulai dari 0% tidak ada SM yang bergerak progresif sampai 100% bergerak progresif seluruhnya dengan kisaran penilaian 5% (SORENSON, 1979). Pemeriksaan persentase sperma hidup (% SH) dan sperma abnormal (% SAN) menggunakan preparat differensial (BARTH dan OKO, 1989) dengan pewarnaan eosin nigrosin (Nigrosin 20,0 g, sodium sitrat 1,5 g, eosin yellow 3,3 g dan aquadest 300 mL).
Konsentrasi spermatozoa dihitung menggunakan hemocytometer pada kamar hitung Neubauer, yang diamati di bawah mikroskop dengan perbesaran 400 kali pada lima kotak yang mewakili empat bagian sisi dan satu di tengah (PHARISH, 2003).
Pengenceran dan pengemasan semen
Semen yang telah dievaluasi dan berkualitas dengan gerakan massa ++ atau +++, SM >70%, konsentrasi >800 juta mL-1 dan SAN <20% (GARNER dan HAFEZ, 2000).
Dibagi tiga bagian dan masing-masing dilarutkan dengan pengencer TEY, HMT dan KK dengan formulasi sebagai berikut:
Volume total (mL) =
V Semen x % SM x Konsentrasi spermatozoa dosis inseminasi
Volume bahan pengencer =
Volume total – volume semen yang diencerkan Dosis inseminasi 25 juta per 0,25 ml (straw IMV) dan 25 juta per 0,3 ml (Minitub)
Pengenceran dilakukan satu tahap pada temperatur ruang. Semen dilarutkan bahan pengencer secara perlahan-lahan tetes demi tetes. Semen yang telah dilarutkan untuk masing-masing pengencer dikemas dalam straw 0,25 mL dan minitub 0,3 mL.
Ekuilibrasi
Ekuilibrasi adalah waktu yang dibutuhkan oleh spermatozoa untuk menyesuaikan diri sebelun dilakukan pembekuan. Selama empat jam straw dan minitub ditempatkan pada temperatur 5oC. Setelah empat jam dari masing-masing perlakuan diambil satu straw untuk dilihat %SM pasca ekuilibrasi.
Pembekuan
Setelah ekuilibrasi dilanjutkan dengan proses pembekuan. Pembekuan dilakukan pada uap nitrogen (N2) cair, menggunakan boks styrofoam yang berukuran panjang x lebar x tinggi masing-masing 60 x 40x 30 cm. Straw ditempatkan pada rak pembekuan dengan jarak 3 cm dari permukaan N2 cair, selama 10 menit. Setelah beku, straw dan minitub disimpan dalam kontainer N2 cair (-196oC).
Thawing
Untuk mengetahui keberhasilan pembekuan semen, semen beku dicairkan kembali (thawing) dengan air hangat bersuhu 37oC selama 30 detik. Semen yang telah cair diteteskan pada gelas objek yang telah dihangatkan dan ditutup dengan gelas penutup.
Analisa data
Peubah yang diamati adalah % SM dan % HM pada tahap semen segar, pasca ekuilibrasi dan pasca thawing, serta % SAN pada tahap
semen segar dan pasca thawing. Data yang diperoleh dari hasil PTM dianalisis dengan sidik ragam Rancangan Acak Lengkap (RAL), faktorial 3 X 2 sebanyak lima ulangan. Jika ada perbedaan antar perlakuan dilanjutkan dengan uji Duncan (α = 0,05).
HASIL DAN PEMBAHASAN Karakteristik semen segar
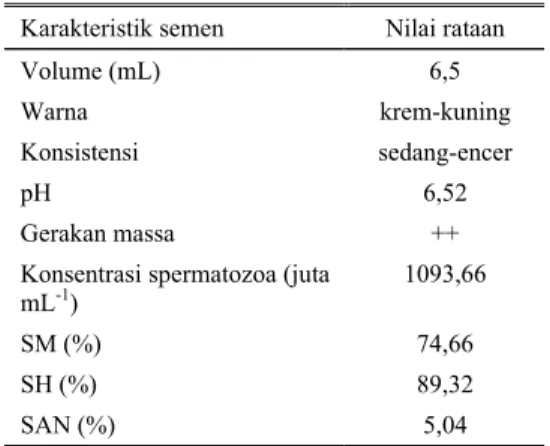
Hasil evaluasi semen segar meliputi pemeriksaan secara makroskopis dan mikroskopis menunjukkan bahwa semen yang diperoleh berada pada kisaran normal dan layak untuk diencerkan. Hasil rataan penampungan yang diperoleh pada penelitian ini terdapat pada Tabel 1.
Tabel 1. Karakteristik semen segar sapi FH Karakteristik semen Nilai rataan
Volume (mL) 6,5
Warna krem-kuning Konsistensi sedang-encer pH 6,52
Gerakan massa ++
Konsentrasi spermatozoa (juta
mL-1) 1093,66
SM (%) 74,66
SH (%) 89,32
SAN (%) 5,04
Hasil pemeriksaan makroskopis menunjukkan volume semen rataan dari 15 penampungan adalah 6.5 mL (Tabel 1). Hasil ini masih berada pada kisaran normal 5–8 mL (GARNER dan HAFEZ, 2000) dan 6–7 mL (SALISBURY dan VANDEMARK, 1985). Berwarna krem, dengan konsistensi sedang-encer hasil ini termasuk normal dan sesuai dengan laporan ROUGE (2004). Nilai derajat keasaman (pH) yang diperoleh rataan adalah 6,52, hasil ini masih normal dan hampir sama dengan yang dilaporkan GARNER dan HAFEZ (2000) yaitu 6,4 sampai dengan 7,8, tetapi sedikit lebih asam dibandingkan dengan pH sapi 6,9−7,5, laporan BEARDEN dan FUQUAY (2000). Menurut HOLM dan WISHART (1998) penurunan pH internal spermatozoa akan
mempengaruhi pengaturan fungsi spermatozoa mamalia dan non mamalia seperti reaksi akrosom dan motilitas.
Hasil pemeriksaaan mikroskopik menunjukkan gerakan massa ++, hal ini ditunjukkan dengan awan hitam yang tidak begitu gelap namun masih cepat berpindah gerakan massa menunjukkan gerakan berkelompok tanpa adanya tekanan dari luar. Sperma motil hasil penelitian ini adalah 74,66%, hasil ini lebih tinggi dibandingkan dengan laporan RAUGE (2003) yaitu 70% tetapi masih dalam kisaran normal yaitu 40–75% (GARNER dan HAFEZ, 2000). Selanjutnya menurut CAMPBELL et al. (2003) % SM yang baik berkisar antara 70–80%. Persentase SM banyak digunakan sebagai dasar untuk menentukan kualitas dan kemampuan spermatozoa untuk membuahi sel telur (MAXWELL dan WATSON, 1996). Meskipun tidak mempunyai korelasi terhadap fertilitas tetapi %SM spermatozoa yang bergerak maju (motil progresif) namun merupakan parameter kualitas spermatozoa yang paling sering digunakan mulai dari awal perkembangan IB hingga sekarang (RODRIGUEZ dan LARRSON, 2002).
Rataan % SH yang diperoleh pada penelitian ini adalah 89,32%. Penentuan % SH ini dapat dilakukan dengan pewarnaan vital, seperti pewarnaan eosin (TOELIHERE, 1985) eosin negrosin dan anilin blue (BARTH dan OKO, 1989) atau neural red (NAGY, 2001).
Prinsip dasar dari perwarnaan ini adalah karena adanya perbedaan aktifitas zat warna antara spermatozoa yang mati dan hidup.
Sperma yang telah mati permiabilitas membran menjadi tinggi akibatnya akan mudah terjadi penyerapan warna, akibat membran plasma yang sudah kehilangan fungsinya (Gambar 1).
Rataan konsentrasi spermatozoa yang diperoleh adalah 1093,66 juta spermatozoa ml-1 (Tabel 2). Hasil ini masih dalam kisaran konsentrasi spermatozoa sapi yang normal yaitu 800–1200 (CAMPBELL et al., 2003); 800-2000 (RAUGE, 2003) dan 1000–2000 x 106ml-1 (HAFEZ, 1987).
Pada penelitian ini jumlah % Spermatozoa yang abnormal (%SAN) adalah 5,40% (Tabel 2). Hasil ini masih tergolong normal dan memenuhi syarat untuk proses pengenceran. Sapi dengan % SAN lebih dari 20% menunjukkan adanya infertilitas atau ketidak suburan dari pejantan tersebut (HAFEZ, 2000). Kualitas semen pada berbagai tahapan pengolahan
Tahapan yang harus dilakukan setelah semen segar yang berkualitas diperoleh pada pengolahan semen beku adalah pengenceran semen, pengemasan dan ekuilibrasi serta pembekuan. Keberhasilan pengolahan semen beku dilaboratorium adalah menghasilkan kualitas semen beku pasca thawing yang tinggi, agar dapat diinseminasikan dan menghasilkan angka kebuntingan. Untuk memudahkan evaluasi keberhasilan serta mengetahui penurunan kualitas setiap tahapan maka pada penelitian ini dilakukan evaluasi % SM pada pasca pengenceran, pasca ekuilibrasi serta pasca thawing.
(a) (b)
a. Spermatozoa hidup b. Spermatozoa mati
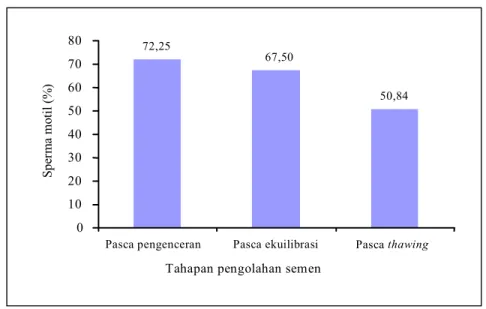
Gambar 2. Penurunan persentase spermatozoa motil pada berbagai tahapan pengolahan semen beku sapi
Dengan tidak memperhatikan jenis pengencer serta kemasan semen beku yang digunakan, penurunan % SM pada penelitian ini dari pasca pengenceran (72,25 ± 3,7%) ke pasca thawing (67,5 ± 4,6%) sebesar 4,75%. Dari pasca ekuilibrasi (67,5 ± 4,6%) ke pasca thawing (50,84 ± 9,14) sebesar 16,66% dengan total penurunan % SM dari pasca pengenceran ke pasca thawing sebesar 21,41% (Gambar 2).
Penurunan SM sebesar 20,41% ini termasuk kecil, karena pada ternak lain antara 10–40% (PARISH’S, 2003); 20–50% (PARTODIHARJO, 1985), bahkan bisa mencapai 50% (SORENSON, 1979). Penurunan % SM pada pembekuan semen domba adalah 27,42% (HERDIS, 2005), pada kambing 27,16% (SUWARSO, 1999) sampai 33,05% (TAMBING, 2004).
Pengaruh bahan pengencer terhadap kualitas semen beku
Bahan pengencer yang digunakan untuk pengolahan semen akan mempengaruhi kualitas semen beku yang dihasilkan. Bahan pengencer yang baik harus mampu mempertahankan spermatozoa selama proses pendinginan, pembekuan maupun pada saat thawing (ABOAGLA dan TERADA, 2004a).
Pengencer semen beku harus mengandung sumber nutrisi, buffer, bahan anti cold shock, anti biotik dan krioprotektan yang dapat melindungi spermatozoa pada saat pendinginan, pembekuan dan thawing.
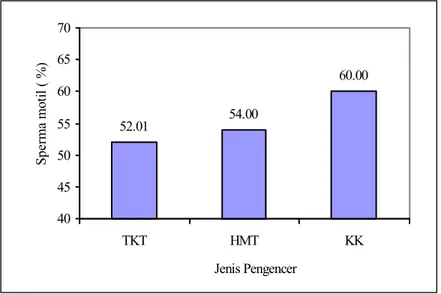
Pengaruh bahan pengencer, tanpa memperhatikan tahapan proses pengolahan serta kemasan yang digunakan, pengencer KK menunjukkan SM (60%) lebih tinggi (P<0,05) dibandingkan dengan pengencer TEY (54%) dan HMT (52,01%) (Gambar 3). Demikian juga dengan kualitas pasca thawing ternyata pengencer KK menunjukkan %SM (56,28%) dan %SH (74,22%) lebih tinggi (P<0,05) dibandingkan dengan pengencer TEY (47,60 & 65,93%) dan HMT (48,74 & 69,63%) (Gambar 4).
Pada kambing PE % SM pasca thawing menggunakan pengencer tris antara 50,39– 51,56% (SUWARSO, 1999) dan pada kambing Saanen 48,67–51,58% (TAMBING, 2004). Pada semen beku domba Garut pasca thawing tertinggi 53,33% (RIZAL, 2005) dan 54,17% (HERDIS, 2005), sedangkan pada domba St Croix dapat mencapai 60% (FERADIS, 1999). Pengencer yang mengandung KK pada penelitian ini menunjukan % SM tertinggi. Hasil yang sama juga dilaporkan oleh ARIFIANTINIet al. (2004) dengan keberhasilan 72,25 67,50 50,84 0 10 20 30 40 50 60 70 80
Pasca pengenceran Pasca ekuilibrasi Pasca thawing
Tahapan pengolahan semen
Sp er m a m otil ( % )
% SM pasca thawing sebesar 50,20 ± 7,07%, hal ini diduga pengencer KK mengandung soya lesitin, tanpa kandungan dari high density lipoprotein (HDL) seperti yang terkandung
pada kuning telur, yang dapat menghambat respirasi dan motilitas spermatozoa (Moussa et al., 2002).
Gambar 3. Rataan pengaruh bahan pengencer terhadap persentase sperma motil tanpa melihat tahapan pengolahan semen
Gambar 4. Pengaruh bahan pengencer terhadap kualitas semen beku pasca thawing
52.01 54.00 60.00 40 45 50 55 60 65 70 TKT HMT KK Jenis Pengencer Sp er ma mo til ( %) 47,60 65,93 48,74 69,63 56,28 74,22 0.00 10.00 20.00 30.00 40.00 50.00 60.00 70.00 80.00 Pe rs en TKT HMT KK Jenis Pengencer SM SH
Perbedaan ini bisa saja disebabkan oleh bahan pengencer KK yang mengandung lecithin kacang kedelai diperkirakan lebih mampu melindungi sperma dari pengaruh buruk pembekuan dari pada kuning telur. Selain mengandung lecithin kacang kedelai, pengencer KK diduga mengandung komponen dan komposisi bahan yang lebih sesuai untuk semen beku sapi.
Pengaruh kemasan terhadap kualitas semen beku
Kemasan yang digunakan untuk semen beku akan mempengaruhi proses penyebaran temperatur pada saat pembekuan. Ketebalan plastik, diameter serta panjang straw yang digunakan akan memberikan pengaruh terhadap kualitas semen beku yang dihasilkan.
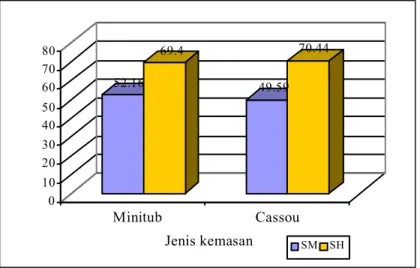
Pada penelitian ini tidak menunjukkan perbedaan kualitas (% SH dan %SM), dari straw yang digunakan. Straw Minitub menunjukkan SH (69,4%) dan SM (52,16%) hampir sama dengan straw IMV SH (70,44%) dan SM (49,59%) (Gambar 5). Kedua kemasan tersebut meskipun mempunyai perbedaan dalam ukuran panjang dan diameter, tetapi perbedaan tersebut tidak mempengaruhi proses
pembekuan dan pada saat thawing. Keuntungan dari sistem pengemasan ini menurut O’CONNER (1998) adalah (1) Memungkinkan pelepasan semen lebih banyak pada saat inseminasi; (2) Sistem kemasan straw dapat dikontrol secara seragam pada saat proses pembekuan sehingga akan meningkatkan sperm cell recovery (pemulihan sel sperma); (3) Dosis yang digunakan tepat.
Pengaruh interaksi bahan pengencer dengan kemasan terhadap kualitas semen beku
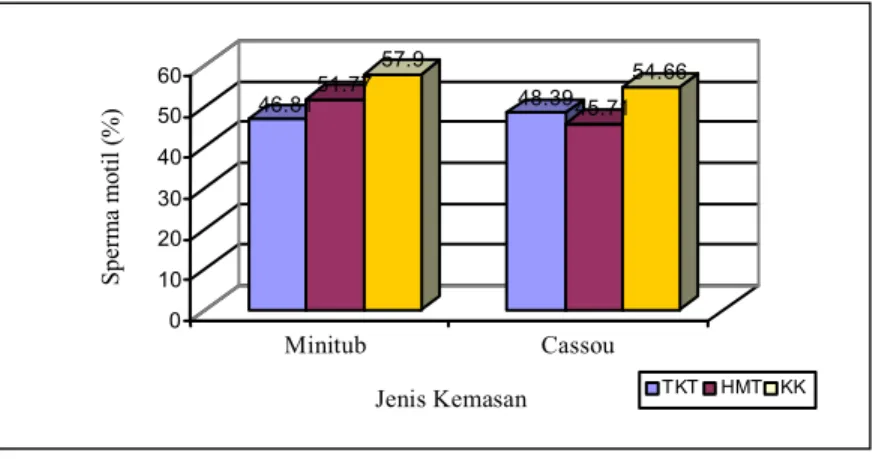
Interaksi antara bahan pengencer dan kemasan yang digunakan dalam penelitian ini ternyata pengencer KK yang dikemas pada straw minitub (72,76 ± 10,83) dan IMV (75,67 ± 8,1) menunjukkan %SH yang terbaik dan lebih tinggi dibandingkan pengencer lain yang dikemas pada straw minitub maupun IMV. Sedangkan % SM pada pengencer KK yang dikemas pada straw minitub (57,9) lebih tinggi dibandingkan pengencer KK yang dikemas dalam straw IMV (54,66) ataupun pada pengencer lain pada kedua kemasan (Tabel 2; Gambar 6 dan 7)
SM = sperma motil SH = sperma hidup
Gambar 5. Pengaruh kemasan terhadap kualitas semen beku pasca thawing 52.16 69.4 49.59 70.44 0 10 20 30 40 50 60 70 80 Minitub Cassou Jenis kemasan SM SH
Tabel 2. Pengaruh interaksi kemasan dengan pengencer terhadap kualitas semen beku sapi FH Kemasan Minitub Cassou Jenis pengencer %SH %SM %SH %SM TKT 64,05 ± 12,38c 46,81d 67,80 ± 10,17bc 48,39cd HMT 71,39 ± 7,93ab 51,77bc 67,86 ± 8,60bc 45,71d KK 72,76 ± 10,83a 57,90a 75,67 ± 8,10a 54,66ab
Huruf yang berbeda pada kolom yang sama menunjukkan beda nyata (P<0,05)
TKT = Tris kuning telur; HMT= home made triladyl; KK= pengencer kacang kedelai; %SH = persentase sperma hidup; %SM = persentase sperma motil
TKT= Tris kuning telur HMT= home made triladyl KK= pengencer kacang kedelai
Gambar 6. Pengaruh interaksi pengencer dan kemasan terhadap persentase sperma hidup pasca thawing
TKT= Tris kuning telur HMT= home made triladyl KK= pengencer kacang kedelai
Gambar 7. Pengaruh interaksi pengencer dan kemasan terhadap persentase sperma motil pasca thawing 46.8151.77 57.9 48.3945.71 54.66 0 10 20 30 40 50 60 Sper m a m ot il (% ) Minitub Cassou Jenis Kemasan TKT HMT KK 46.8151.77 57.9 48.39 45.71 54.66 0 10 20 30 40 50 60 Sp er m a mo til ( % ) Minitub Cassou Jenis Kemasan TKT HMT KK
Dari berbagai hasil penelitian ini terlihat bahwa bahan pengencer merupakan faktor yang berpengaruh dibandingkan kemasan semen. Hal ini terlihat dari Gambar 3 dan Gambar 4. Pengencer yang digunakan akan mempengaruhi kualitas semen beku tergantung pada komposisi bahan yang terdapat didalamnya. Pengencer TF dan HMT menunjukan kualitas yang hampir sama diduga karena komposisinya juga hampir sama yaitu baik buffer, nutrisi (fruktosa) dan kuning telur sebagai bahan anti cold shock serta gliserol yang digunakan. Sedangkan pengencer KK dengan komposisi yang tidak diketahui, kemungkinan mempunyai komposisi yang lebih sesuai dan mampu memberikan efek perlindungan yang lebih baik pada proses pembekuan ini.
Faktor kemasan meskipun ada perbedaan tetapi tidak secara nyata mempengaruhi kualitas semen mengingat jenis kemasan yang digunakan sama-sama terbuat dari plastik, jika menggunakan kemasan pellet atau ampul, kemungkinan hasilnya akan berbeda.
KESIMPULAN
Penurunan sperma motil dari pasca pengenceran ke pasca ekuilibrasi sebesar 4,75%; pasca ekuilibrasi ke pasca thawing sebesar 16,66%; total penurunan pasca pengenceran ke pasca thawing sebesar 21,41%.
Pengencer yang mengandung menunjukkan hasil yang paling baik dalam mempertahankan kualitas semen beku.
Tidak ada pengaruh kemasan semen yang digunakan terhadap kualitas semen beku.
Pengencer yang mengandung lesitin dengan kemasan minitub dan Cassou merupakan kombinasi yang paling baik dalam mempertahankan % SH.
Pengencer yang mengandung lesitin yang dikemas dalam Minitub menunjukkan % SM terbaik.
DAFTAR PUSTAKA
______________________. 2004b. Effects of supplementation of trehalosa extender containing egg yolk with sodium dodecyl sulfate on the freezability of goat spermatozoa. Theriogenology 62: 809–818.
ABDILLAH. 1999. Pengaruh beberapa pengencer semen, lama penyimpanan semen dan waktu inseminasi terhadap fertilitas spermatozoa ayam buras. Tesis. Program Pascasarjana Institut Pertanian Bogor.
ABOAGLA EM-E andT. TERADA. 2004a. Effects of egg yolk during the freezing step of cryopreservation on the viability of goat spermatozoa. Theriogenology 62: 1160–1172. ANZAR, M. and GRAHAM, E.F. 1995. Role of
sperm motility and acrosome integrity in the Filtration of Bovine Semen. Theriogenology 45: 513–520.
ARIFIANTINI, I., T.L. YUSUF dan N. GRAHA. 2005. Longivitas dan Recovery Rate Pasca Thawing Semen Beku Sapi Fresian Holstein menggunakan Bahan Pengencer yang berbeda. Buletin Peternakan28(3).
BARTH, A.D. and OKO, R.J. 1989. Abnormal Morfology of Bovine Spermatozoa. Iowa. Iowa State University Press. USA
DAVIS, I.S., R.W. BRATTON and R.H. FOOTE. 1963. Livability of bovine spermatozoa at 5, -25 and -85oC in tris-buffered and citrate-buffered yolk-glycerol. J. Dairy Sci. 46: 333.
FERADIS. 1995. Penggunaan Antioksidan dalam Pengencer Semen Beku dan Metode Sinkronisasi Estrus Pada Program Inseminasi Buatan Domba St. Croix. Disertasi. Program Pasca Sarjana Institut Pertanian Bogor. HAFEZ, B. and E.S.E. HAFEZ. 2000. Reproductive
Cycles dalam Reproduction in Farm Animals. 7thEd. HAFEZ, E.S.E. (Ed.). Philadelphia: Lippincot Williams & Wilkins
HAHN, G. 1972. Contribution to The freezing-preservation of goat-buck and ram semen. World Rev. Anim. Prod. 8: 80.
HERDIS. 2005. Optimalisasi Inseminasi Buatan Melalui Aplikasi Tekhnologi Laserpunktur Pada Domba Garut (Ovis aries). Disertasi. Program Pascasarjana, Institut Pertanian Bogor.
MAXWELL, W.M.C. and S. SALAMON. 1993. Liquid storage of ram semen: a review. Reprod. Fertil. Dev. 5: 29–46.
MOUSSA, M., V. MARTINEZ, A. TRIMECHE, D. TANTURIER and M. ANTON. 2002. Low Density Lipoprotein extracted from hen egg yolk by an easy method: cryoprotective effect on frozen-thawed bull semen. Theriogenology 57: 1591–1762.
PARRISH, J. 2003. Techniques in Domestic Animal Reproduction-Evaluation and Freezing of Semen http://www.wisc.edu/ansci_repro/ (25 Juli 2003).
RIZAL, M. 2005. Fertilitas Spermatozoa Ejakulat dan Epididimis Domba Garut Hasil Kriopreservasi Menggunakan Modifikasi Pengencer Tris dengan Berbagai Krioprotektan dan Antioksidan. (Disertasi). Program Pascasarjana, Institut Pertanian Bogor.
ROYERE, D., C. BARTHELEMY, S. HAMANAH and J. LANSAC. 1996. Cryopreservation of spermatozoa: a 1966 review. Human Reproduction Update 2(6): 553–559.
SALAMON, S. and D. VISSER. 1972. Fertility of Ram Spermatozoa Frozen in a Tris Based Diluent. Aust. J. Biol. Sci. 26: 513–516.
SALISBURY, G.W. and N.L. VAN DENMARK. 1985. Fisiologi Reproduksi dan Inseminasi Buatan pada Sapi. Terjemahan DJANUAR, R.. Gadjah Mada University Press, Yogyakarta.
SEXTON, T.J. 1978. A new poultry semen extender; Effect of storage condition on fertilizing capacity of chicken semen stored at 5oC. J. Poult. Sci. 57: 258–289.
SORENSON JR, A.M. 1979. Laboratory Manual for Animal Reproduction. 4ed American Press. Boston. USA
STEEL, R.G.D. and J.H. TORRIE. 1993. Prinsip dan Prosedur Statistika, Suatu Pendekatan Biometrik. Terjemahan SUMANTRI, B. Gramedia Pustaka Utama, Jakarta.
STEINBACH, J. and R.H. FOOTE. 1967. Osmotic pressure and pH effects on survival of frozen or liquid spermatozoa. J. Dairy Sci. 50: 205. SUWARSO. 1999. Peranan Rafinosa Dalam
Pengencer Tris-Sitrat Kuning Telur Terhadap Semen Beku Kambing Peranakan Etawah. Tesis. Program Pascasarjana Institut Pertanian Bogor.
TAMBING, S.N. 2004. Optimalisasi Pengembangan Pengencer Semen Beku Kambing Saanen Disertasi. Program Pascasarjana, Institut Pertanian Bogor.
TOELIHERE, M.R. 1993. Inseminasi Buatan pada Ternak. Penerbit Angkasa, Bandung.
YILDIZ, C., A. KAYA, M. AKSOY and T. TEKELI. 2000. Influence of sugar supplementation of the extender on motility, viability and acrosomal integrity of dog spermatozoa during freezing. Theriogenology 54: 579–585. DISKUSI
Pertanyaan:
1. Apakah dalam perlakuan pengenceran berpengaruh pada motilitas? Berapa lama daya tahan masing-masing pengencer mendukung daya hidup sperma?
2. Bagaimana analisis ekonomi dari ketiga pengencer tersebut?
Jawaban:
1. Waktu penyimpanan setelah beku tidak akan berpengaruh selama manajemen N2 cair dalam container diperhatikan. Lama daya tahan tak berpengaruh selama tetap terendam dalam N2 cair.
2. Biaya bahan pengencer untuk triladyl adalah Rp. 40 per dosis sementara untuk adromed adalah Rp. 100 per dosis.