104
EFFECT OF TEMPERATURE, PH ON TOTAL CONCENTRATION AND COLOR
STABILITY OF ANTHOCYANINS COMPOUND EXTRACT ROSELLE CALYX
(
HIBISCUS SABDARIFFA
L.)
.
Hermawan, R.1*, Hayati, E.K.2, Budi, U.S.3, Barizi, A4. Chemistry Department, Science and Technology Faculty The State Islamic University of Maulana Malik Ibrahim Malang, 2011ABSTRACT
Recently, Roselle (Hibiscus sabdariffa L.) has been known as communities used for tea, rather than based on this background, research was conducted with the aim: (1) To determine the rate of anthocyanin degradation due to the influence of heating and color stability extract roselle calyx (Hibiscus sabdariffa L.), (2) To determine the stability of anthocyanin due to the influence of pH on total anthocyanin extract compounds and color roselle calyx (Hibiscus sabdariffa L.) during the storage process. This research was conducted by extracting the sample with citric acid 2% solvent. Concentrated extract was used to test the stability of the heating temperature, test the stability of pH during the storage process for ± 30 days and color change. The results of this study indicate that extracts of roselle calyx (Hibiscus sabdariffa L.) experienced a decrease in concentration at 80 °C. Concentration of anthocyanin degradation rate followed the equation r = 0.014T – 1.169 with the lowest concentration value of 32.916 mg / L. The intensity of color produced due to the influence of heating at 80 °C with varying time is 29.6 to 30.7 for the parameters of brightness (L *), 23.9 to 20.7 redness (a *), and 13.5 - parameter 15 for yellow (b *) increased. The intensity of color produced due to the influence of pH variation during the storage process is 27.5 to 26.2 for L * values decreased on average instead of L * at different pH average value increased from 27.5 to 39.7 . The result of reading the value of a * decreased with increasing storage time and reduced levels of acidity, namely from 22.7 to 18.3 and from 22.7 to 9.7. While reading the value of b * along with increasing storage duration has decreased and has decreased with the reduction in the level of acidity, namely from 11.8 to 10.9 and from 11.8 to 13.8.
Keywords: Roselle (Hibiscus sabdariffa L.), anthocyanins, degradation, temperature, pH, color
1. PENDAHULUAN
Penentuan bahan makanan pada umumnya sangat bergantung pada beberapa faktor antara lain cita rasa, warna, tekstur, dan nilai gizi dan mikrobiologis. Tetapi faktor yang paling mudah diamati secara visual dan kadang-kadang sangat menentukan adalah warna (Winarno, 2004). Hampir semua bahan makanan olahan saat ini menggunakan pewarna, yang tanpa kita sadari pewarna tersebut banyak berasal dari bahan-bahan kimia dan menimbulkan dampak negatif terhadap tubuh.
Pada dasarnya, banyak tanaman ataupun tumbuhan yang dapat dimanfaatkan sebagai pewarna alami, salah satunya adalah bunga rosella. Senyawa antosianin merupakan sumber pewarna alami yang terdapat pada kelopak bunga rosella dan hampir pada semua tumbuhan yang memberikan pigmen berwarna kuat dan apabila dilarukan dalam air akan menimbulkan warna merah, jingga, ungu, dan biru (Nollet, 1996).
Antosianin merupakan salah satu senyawa yang terkandung pada kelopak bunga rosella dan perlu dikaji lebih mendalam baik fungsi dan kegunaannya bagi tubuh ataupun zat-zat makanan. Kestabilan warna senyawa antosianin dipengaruhi oleh pH atau tingkat keasaman, dan akan lebih stabil apabila dalan suasana asam atau pH yang rendah (Belitz and Grosch, 1999).
Kestabilan antosianin juga dipengaruhi oleh suhu. Laju kerusakan (degradasi) antosianin cenderung meningkat selama proses penyimpanan yang diiringi dengan kenaikan suhu. Degradasi termal menyebabkan hilangnya warna pada antosianin yang akhirnya terjadi pencoklatan. Laju termal degradasi mengikuti kinetika orde pertama. Kenaikan suhu bersamaan dengan pH menyebabkan degradasi antosianin pada buah cherri (Rein, 2005).
Berdasarkan latar belakang tersebut, peneliti bermaksud untuk melakukan penelitian tentang analisis konsentrasi dan kestabilan warna antosianin yang terdapat pada ekstrak bunga rosella. Penelitian ini terfokus pada pengaruh temperatur dan pH terhadap total konsentrasi dan kestabilan warna senyawa antosianin ekstrak kelopak bunga rosella (Hibiscus sabdariffa L).
1 Student of chemistry department
2Staff teaching of chemistry department 3Researcher from Balittas
4 Staff teaching of Religi in Science and Technology Faculty
105
2. METODOLOGI PENELITIAN
a. Pelaksanaan Penelitian
Penelitian ini dilaksanakan pada bulan Agustus sampai November tahun 2010 di Laboratorium Jurusan Kimia UIN Maulana Malik Ibrahim, BALITTAS, dan THP Brawijaya.
b. Bahan dan Alat Penelitian
Bahan sampel yang digunakan dalam penelitian ini adalah kelopak bunga Rosella (Hibiscus sabdariffa L) dari perkebunan BALITTAS, Karang Ploso yang sudah dikeringkan.
Bahan-bahan kimia yang digunakan adalah aquadest, asam sitrat, HCl, KCl, Na-Sitrat, Na-Asetat anhidrat, Na2HPO4.2H2O dan Asam Sitrat.
Alat-alat yang digunakan dalam penelitian ini adalah, seperangkat alat gelas, pisau atau alat pemotong, blender, timbangan analitik, kertas saring, sentrifuge, shaker, oven, waterbath, Spektrofotometer UV-Vis Varian Cary 50, dan Color reader Minolta CR 10, pH meter.
c. CARA KERJA
1. Preparasi Sampel
Sampel kelopak bunga rosella yang akan dianalisis sebelumnya dilakukan sortasi atau pemilihan. Kelopak bunga rosella yang masih baik selanjutnya dicuci pada air yang mengalir hingga diperkirakan kotoran (tanah, debu dan sebagainya) sudah hilang. Selanjutnya ditiriskan dan dikeringkan pada suhu 50oC selama 36 jam.
2. Ekstraksi Sampel Kelopak Bunga Rosella Menggunakan Metode Maserasi (Saona dan
Wrolstad, 2001)
Sampel kering diblender selama 5 menit dan ditimbang sebanyak 50 g. Dilakukan maserasi dalam beaker gelas 500 mL dengan pelarut asam sitrat 2%. Pengocokan dilakukan pada kecepatan 200 rpm dan dibiarkan selama 10 jam pada ruang gelap dan suhu ruangan memucat. Sebelum dan setelah penambahan sampel, pelarut diukur keasamannya dengan pH meter.
Sampel selanjutnya disaring dengan corong Buchner. Ekstrak yang diperoleh disentrifuges dengan kecepatan 2000 rpm selama 10 menit. Residu yang tersisa dimaserasi kembali dengan perlakuan yang sama sampai benar-benar pucat dan warnanya memudar. Ekstrak maserasi pertama yang telah disentrifugasi dapat dicampurkan dengan ekstrak maserasi kedua yang telah disentrifuge.
3. Pengukuran Total Antosianin Ekstrak Bunga Rosela dengan Spektrofotometri UV-Visible
(Guisti dan Wrolstad, 2001 dan Hosseinian, 2008)
Pengukuran total konsentrasi antosianin ekstrak kelopak bunga rosella diambil dari sampel larutan hasil ekstraksi 50 g rosella dalam 500 mL pelarut dilakukan dengan menggunakan Spektrofotometri UV-Vis pada rentang panjang gelombang 500-700 nm.
Disiapkan 2 sampel larutan, larutan pertama adalah larutan untuk pH 1,0 menggunakan buffer KCl dan larutan kedua untuk pH 4.5 menggunakan buffer Na-Asetat. Diambil masing-masing 1 mL ekstrak kelopak bunga rosella dan diencerkan menggunakan larutan buffer masing-masing sampai volume 10 mL (Faktor pengenceran = 10). Sampel hasil pengenceran masing-masing dilakukan pengukuran absorbansi pada panjang gelombang 500-700 nm dan 700 nm. Untuk menentukan nilai absorbansinya menggunakan persamaan berikut:
A = (Aλ vis max – A 700) pH 1,0 – (Aλ vis max – A 700) pH 4,5
dan untuk menentukan total konsentrasinya dapat menggunakan persamaan berikut:
4. Uji Stabilitas Terhadap Suhu Pemanasan (Nugrahan, 2007)
Mula-mula diambil 5 mL ekstrak hasil maserasi dan diencerkan dengan aquades dalam labu ukur 250 mL hingga tanda batas. Hasil pengenceran diambil 10 mL dan dimasukkan dalam tiga tabung reaksi, masing –masing dengan volume yang sama yaitu 10 mL dan ditutup dengan alumunium foil. Proses pemanasan dilakukan dengan menggunakan waterbath pada suhu bervariasi yaitu 30, 40, 50, 60, 70 dan 80oC dengan waktu pemanasan selama 30 menit dan dilakukan pengulangan sebanyak tiga kali.
106 Selanjutnya dilakukan pengukuran absorbansi pada panjang gelombang maksimal dan 700 nm dengan cara berikut, diambil masing-masing 1 mL sampel yang telah dipanaskan dan diencerkan menggunakan larutan buffer yaitu, pH 1 dan pH 4,5 sampai volume 10 mL (Faktor pengenceran = 50). Beriktnya dilakukan penentuan kecerahan warna dengan color reader. Data absorbansi yang diperoleh selanjutnya dikonversi mengikuti rumus berikut,
Hasil total konsentrasi terendah pada salah satu suhu tersebut (30-80oC), selanjutnya diulangi dengan variasi lama pemanasan kelipatan 5 menit selama 30 menit mulai dari 0 menit. Selanjutnya diukur absorbansi dan dikonversi menjadi konsentrasi. Untuk mengetahui laju degradasi antosianin, maka dilakukan perhitungan dengan dicoba pada 3 tingkatan orde, yaitu orde 0, 1, dan 2.
5. Uji Stabilitas Terhadap Perlakuan Buffer pH (Nugrahan, 2007)
Proses pelaksanaan uji stabilitas terhadap buffer pH sebagai berikut, mula-mula disiapkan ekstrak hasil maserasi. Disiapkan larutan buffer dengan pH yang bervariasi, yaitu pH 1 sampai 7. Masing-masing diambil sebanyak 10 mL, dimasukkan dalam tabung reaksi dan ditutup dengan alumunium foil.
Ekstrak antosianin sebanyak 1 mL dimasukkan ke dalam tujuh tabung reaksi yang telah berisi larutan buffer, ditutup dengan alumunium foil dan dikocok-kocok hingga benar-benar homogen. Ketujuh tabung reaksi tersebut disimpan pada suhu ruang ± 27oC kedap cahaya.
Penentuan total antosianin dilakukan dengan cara pengukuran absorbansi, diambil masing-masing ± 5 mL ektrak kelopak rosella. Sampel hasil pengenceran masing-masing dilakukan pengukuran absorbansi pada panjang gelombang maksimal dan 700 nm serta dilakukan penentuan kecerahan warna dengan color reader. Kedua perlakuan tersebut dilakukan setiap 3 hari, yaitu mulai hari ke-0 sampai hari ke-30.
6. Analisis Hasil
Analisa meliputi total konsentrasi antosianin, pH, suhu dan intensitas cahaya. Data yang diperoleh dari hasil penelitian dianalisis secara deskriptif menggunakan analisa statistik rancangan acak lengkap satu arah (one way ANOVA) menggunakan aplikasi MINITAB 14 dan Microsoft Exel 2007.
3. HASIL DAN PEBAHASAN
3.1 Preparasi Sampel
Kelopak bunga rosella yang masih segar disortasi dan dipisahkan dari bijinya. selanjutnya dicuci dengan sedikit air untuk menghilangkan kotoran dan ditiriskan. Sampel yang diinginkan dalam penelitian ini adalah kelopak rosella yang kering. Selanjutnya dilakukan proses pengeringan yaitu dioven selama kurang lebih 36 jam pada suhu 50 oC untuk menghilangkan sebagian kadar air yang terkandung dan diharapkan tidak merusak kandungan senyawanya pada suhu tersebut.
Pengeringan dimaksudkan untuk mengurangi kadar air, menghentikan reaksi enzimatis, mencegah tumbuhnya jamur sehingga dapat disimpan lebih lama dan tidak mudah rusak serta komposisi kimianya tidak mengalami perubahan. Kemudian dihaluskanmenggunakan blender.
3.2 Ekstraksi Maserasi
Ekstraksi yang digunakan yaitu ekstraksi maserasi, karena sampel yang digunakan tidak tahan panas dan pengerjaannya cukup sederhana. Metode maserasi bertujuan untuk mengambil zat atau senyawa aktif yang terdapat pada suatu bahan menggunakan pelarut tertentu. Menurut Rukmana (1997), dalam mengekstrak zat warna diperlukan metode yang sesuai dengan sifat bahan (sumber pigmen), agar dihasilkan rendemen dan stabilitas pigmen yang tinggi. Metode ini (maserasi) digunakan dengan mempertimbangkan sifat senyawa (antosianin) yang relatif rentan terhadap panas sehingga dikhawatirkan akan merusak bahkan menghilangkan senyawa yang akan dianaliasa.
Perbandingan jumlah sampel dan pelarut pada proses maserasi sampel ini adalah 1 : 5, yaitu 50 g sampel dalam 250 mL pelarut asam sitrat 2 %.
Penggunaan asam sitrat sebagai pelarut karena kondisi pelarut yang semakin asam dapat menyebabkan banyaknya dinding sel vakuola yang pecah sehingga pigmen antosianin yang terekstrak semakin banyak.
Sebelum proses perendaman, hal yang perlu dilakukan adalah mengukur pH untuk mengetahui kondisi pH pelarut sebelum dan pada saat diinteraksikan dengan sampel rosella. Adapun nilai pH yang diperoleh dari hasil pengukuran dapat dilihat pada Tabel 1 berikut.
107 Tabel 1 Kondisi pH pelarut yang digunakan sebelum dan saat ekstraksi
Ulangan Volume (mL) Warna Ekstrak pH Sebelum Sesudah 1 250 Merah hati pekat 2,24 2,51 2 250 Merah 2,24 2,48
Setelah pengocokan, sampel disaring dengan penyaring vakum, ekstrak yang dihasilkan ditampung (ekstrak 1), sedangkan residu hasil penyaringan dimaserasi/direndam kembali dengan pelarut asam sitrat 2%. Ekstrak dari hasil maserasi pertama disentrifuge untuk mengendapkan partikel-partikel koloid dan pengotor dengan kecepatan sentrifuge 2000 rpm selama 10 menit. Hal serupa juga dilakukan pada ekstrak hasil maserasi yang kedua, kemudian ekstrak 1 dan 2 digabung.
3.3 Uji Stabilitas Terhadap Pemanasan
Suhu memiliki peranan dan pengaruh yang sangat penting terhadap kestabilan antosianin. Menurut Hendry dan Houghton (1996), suhu penyimpanan maupun suhu proses pengolahan mempengaruhi degradasi antosianin. Jadi, pada suhu pengolahan yang tinggi dan selama penyimpanan akan menyebabkan degradasi antosianin.
Penetapan konsentrasi senyawa antosianin dilakukan dengan metode perbedaan pH (pH Differential) yaitu pH 1,0 dan pH 4,5.
Penetapan konsentrasi antosianin dengan metode ini dikarenakan pada pH 1,0 antosianin membentuk senyawa oxonium (kation flavilium) yang berwarna dan pada pH 4,5 berbentuk karbinol/hemiketal tak berwarna (Giusti M.M dan Wrolstad R.E, 2001). Kondisi inilah yang akan dijadikan acuan untuk menentukan absorbansi dengan menggunakan spektofotometer Uv-Vis dari masing-masing ekstrak yang dihasilkan. Perubahan warna pada antosianin dalam tingkatan pH tertentu disebabkan sifat antosianin yang memiliki tingkat kestabilan yang berbeda. Misalnya, pada pH 1,0 antosianin lebih stabil dan warna lebih merah dibandingkan pH 4,5 yang kurang stabil dan hampir tidak berwarna.
Adapun struktur dan perubahan warna pada antosianin karena perbedaan tingkatan pH dapat dilihat pada Gambar 1 dibawah ini.
Gambar 1 Struktur antosianin pada kondisi pH yang berbeda (Wrolstad dan Giusti, 2001)
Berdasarkan Gambar di atas, menjelaskan bahwa dalam media air asam, antosianin berada dalam empat jenis kesetimbangan, yaitu base kuinonoidal, kation flavilium atau bentuk oxonium, karbinol atau pseudobase, dan kalkon. Menurut Francis et al, (1985) bentuk pigmen antosianin pada kondisi asam adalah
O O HO O O OH gly gly R1 R2 O HO O R1 OH R2 gly gly O OH O HO R1 OH R2 gly O O HO O R1 OH R2 gly gly O gly OH -H+
basa kuinoidal : biru pH = 7
kation flavilium (bentuk oksonium) :orange ke umgu pH = 1
-H+ -H2O
karbinol pseudobasa (bentuk hemiketal) : tidak berwarna pH = 4.5
kalkon : tidak berwarna pH = 4.5
108 kation flavilium, sementara inti kation flavilium dari pigmen antosianin kekurangan elektron sehingga sangat reaktif.
Dari hasil penetapan senyawa antosianin dengan metode perbedaan pH (pH Differential) spektroskopi Uv-Vis, maka diperoleh data sebagaimana tertera pada Tabel 2 berikut,
Tabel 2 Konsentrasi senyawa antosianin setiap suhu pemanasan selama 30 menit
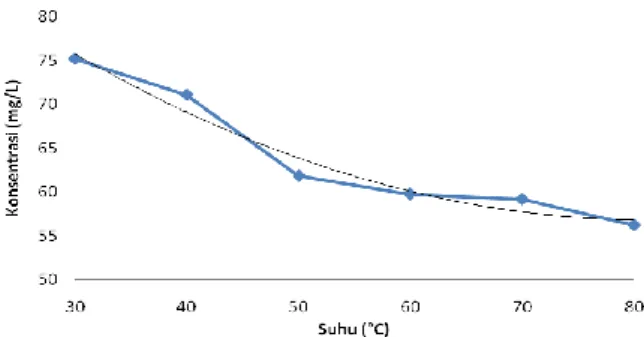
No Suhu (°C) Konsentrasi (mg/L) Rata-rata 1 30 75,164 2 40 71,079 3 50 61,866 4 60 59,749 5 70 59,183 6 80 56,231
Suhu berpengaruh terhadap kestabilan warna ekstrak rosella. Semakin meningkatnya suhu pemanasan dapat menyebabkan hilangnya glikosil pada antosianin dengan hidrolisis ikatan glikosidik. Aglikon yang dihasilkan kurang stabil dan menyebabkan hilangnya warna pada antosianin.
Berdasarkan Tabel 2 tampak bahwa terjadi penurunan nilai konsentrasi. Laju degradasi penurunan konsentrasi tersebut mengikuti persamaan r = d[antosianin]/dt = 0,014T – 1,169. Dimana r adalah konsentrasi dan T adalah suhu. Grafik degradasi konsentarsi sebagaimana pada Gambar 2.
Gambar 2 Grafik degradasi konsentarsi antosianin pada berbagai suhu
Berdasarkan nilai konsentrasi rata-rata pada tabel 4.2, suhu 80 °C memiliki konsentarsi yang terendah 56,231 mg/L. Oleh karena itu, nilai konsentrasi terendah pada suhu 80 °C dijadikan acuan uji selanjutnya. Uji selanjutnya tahap kedua dilakukan untuk mengetahui laju degradasi senyawa antosianin akibat pemanasan persatuan menit. Pemanasan dilakukan suhu tetap yaitu 80 °C dengan waktu pemanasan yang bervariasi yaitu, 0, 5, 10, 15, 20, 25, dan 30 menit. Proses percobaan ini dilakukan dengan memipet 10 mL larutan stok ekstrak rosella, dimasukkan ke dalam masing-masing tabung reaksi, selanjutnya dipanaskan pada suhu 80 °C dengan waktu pemanasan yang bervariasi. Setiap perlakuan dilakukan ulangan sebanyak tiga kali. Hasil pemanasan tersebut selanjutnya ditentukan nilai konsentrasinya dengan menggunakan spektrofotometer Uv-Vis dan diperoleh data pada Tabel 3 sebagai berikut,
Tabel 3 Konsentrasi senyawa antosianin setiap waktu dengan suhu pemanasan 80 °C
No Waktu (menit) Konsentrasi (mg/L) Rata-rata 1 0 39,088 2 5 37,597 3 10 35,391 4 15 34,019 5 20 33,512 6 25 33,453 7 30 32,916
109 Berdasarkan tabel di atas tampak bahwa terjadi penurunan nilai konsentrasi setiap 5 menit. Laju degradasi penurunan konsentrasi tersebut mengikuti persamaan r = d[antosianin]/dt = 0,016t – 0,458. Dimana r adalah konsentrasi dan t adalah waktu. Grafik degradasi konsentarsi sebagaimana pada Gambar 4.3.
Gambar 3 Grafik degradasi konsentarsi antosianin setiap waktu pada suhupemanasan 80 °C.
Kebergantungan laju degradasi penurunan konsentrasi tehadap konsentrasi spesies dalam reaksi juga dapat ditentukan melalui orde reaksinya dengan menggunakan metode grafik yang dicoba pada 3 tingkatan orde mulai dari 0, 1, dan 2. Penentuan orde reaksi dilakukan dengan membandingkan nilai R2 nya. Nilai R2 yang tertinggi merupakan orde yang sesuai dengan data konsentrasinya.
Berdasarkan hasil penelitian laju degradasi penurunan total antosianin pada kelopak bunga rosella mengikuti orde reaksi ke-1 dengan menggunakan persamaan berikut,
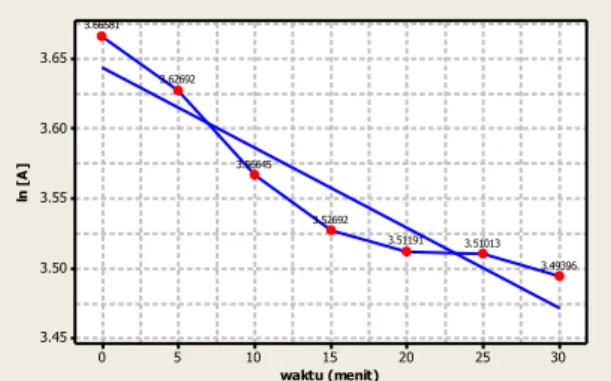
Tabel 4 Data konsentrasi pada orde ke-1
t ln[A] 0 3,666 5 3,627 10 3,566 15 3,527 20 3,512 25 3,510 30 3,494
Berdasarkan uji terhadap orde ke-1, maka diperoleh nilai koefisien determinan (R2) sebesar 0,89 dengan grafik kelinieran data sebagai berikut,
waktu (menit) ln [ A ] 30 25 20 15 10 5 0 3.65 3.60 3.55 3.50 3.45 3.49396 3.51013 3.51191 3.52692 3.56645 3.62692 3.66581
Gambar 4 Grafik uji kelinieran data konsentrasi dengan orde ke-1
Setelah melakukan uji terhadap orde 0, 1, dan 2, maka diperoleh nilai koefisien determinan dari masing-masing tingkatan orde sebagai berikut,
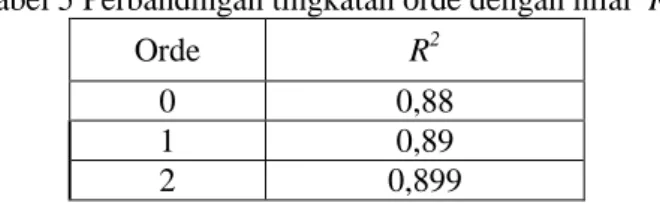
110 Tabel 5 Perbandingan tingkatan orde dengan nilai R2
Orde R2
0 0,88
1 0,89
2 0,899
Berdasarkan tabel di atas, diketahui bahwa orde ke-2 memiliki nilai koefisien determinan lebih besar dimana orde ke-2 > orde ke-1 > orde ke-0, yaitu 0,899; 0,89; dan 0,88. Perbedaan nilai R2 yang tidak terlalu signifikan antara orde 1 dan 2, dapat diasumsikan bahwa laju reasi mengikuti orde 1.
3.4 Uji Stabilitas Terhadap Buffer pH
Salah satu faktor yang sangat berpengaruh terhadap kestabilan antosianin adalah pH dari pelarut antosianin. Untuk mengetahui stabilitas antosianin terhadap pH, maka pada penelitian ini dilakukan perlakuan dengan variasi pH yaitu 1, 2, 3, 4, 5, 6, dan 7. Mula-mula dipipet 1 mL ekstrak rosella (larutan stok) dimasukkan dalam 7 tabung reaksi dan ditambah 10 mL larutan buffer masing-masing. Ditutup dan dikocok-kocok hingga benar-benar homogen, selanjutnya disimpan pada suhu ruang ± selama 30 hari dan diukur absorbansi pada panjang gelombang maksimal dan 700 nm. Proses pengukuran dilakukan setiap 3 hari sekali selama ± 30 hari, yaitu mulai dari hari ke- 0, 3, 6, 9, 12, 15, 18, dan 21. Setiap perlakuan pada penelitian ini dilakukan dengan ulangan sebanyak tiga kali.
Ekstrak rosella yang telah ditambahkan masing-masing buffer ternyata memberikan intensitas warna ekstrak yang berbeda, seperti pada Tabel 4.2 berikut,
Tabel 6 Warna Ekstrak Rosella setelah ditambahkan buffer pada hari ke- 0
No. Buffer
pH Warna Ekstrak
1 Kontrol Merah pekat keunguan
2 1 Merah bening keunguan
3 2 Merah muda terang
4 3 Merah muda terang
5 4 Merah bening kekuningan
6 5 Merah kecoklatan
7 6 Kuning kecoklatan
8 7 Coklat
Penetapan senyawa antosianin pada uji stabilitas buffer ini dilakukan dengan mengukur absorbansinya pada panjang gelombang maksimal dan panjang gelombang 700 nm. Pengukuran pada daerah panjang gelombang dilakukan karena aglikon pada antosianin (kation flavilium) mengandung ikatan rangkap terkonjugasi sehingga dapat diserap pada daerah panjang gelombang 500 nm.
Transisi elektron yang paling memungkin terjadi pada molekul senyawa antosianin adalah π → π* dan n → π. Jenis transisi π → π* terjadi pada molekul yang memiliki gugus fungsional yang tidak jenuh sehingga ikatan rangkap pada dalam gugus tersebut memberikan orbital π yang diperlukan dengan panjang gelombang antara 200 – 700 nm. Dalam orbital molekul, elektron-elektron π mengalami delokalisasi yang disebabkan oleh adanya ikatan terkonjugasi atau ikatan rangkap berselang-seling dengan satu ikatan tunggal. Adanya efek delokalisasi dari ikatan terkonjugasi tersebut dapat menyebabkan penurunan tingkat energi π*, sebagai konsekuensinya penjang gelombang akan mengalami pergeseran batokromik (pergeseran ke panjang kelombang yang lebih besar).
Jenis transisi n → π pada molekul senyawa antosianin terjadi akibat adanya auksokrom yang terikat pada molekul. Auksokrom merupakan gugus fungsional yang mempunyai elektron bebas, seperti –OH; −O; dan –OCH3. Terikatnya gugus auksokrom pada gugus kromofor akan mengakibatkan pergeseran pita
111
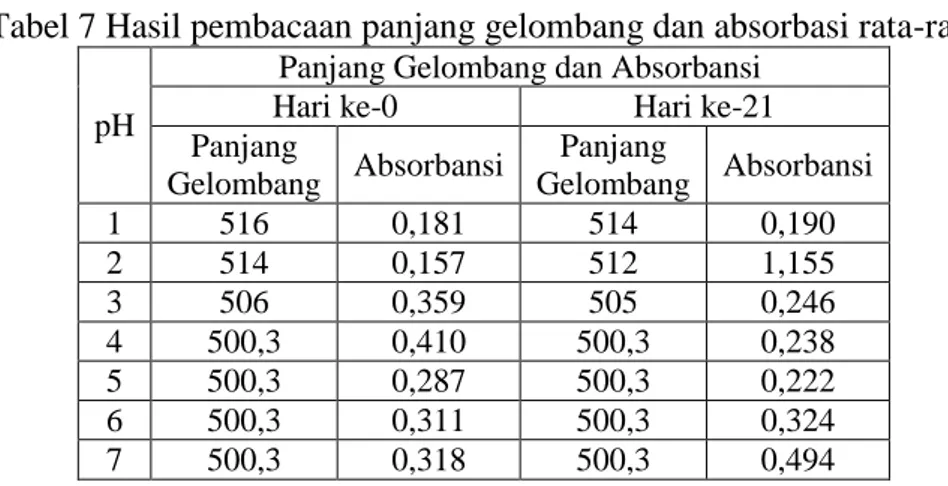
Tabel 7 Hasil pembacaan panjang gelombang dan absorbasi rata-rata
pH
Panjang Gelombang dan Absorbansi
Hari ke-0 Hari ke-21
Panjang Gelombang Absorbansi Panjang Gelombang Absorbansi 1 516 0,181 514 0,190 2 514 0,157 512 1,155 3 506 0,359 505 0,246 4 500,3 0,410 500,3 0,238 5 500,3 0,287 500,3 0,222 6 500,3 0,311 500,3 0,324 7 500,3 0,318 500,3 0,494
Sebagaimana hasil penelitian pada tabel di atas, diketahui bahwa seiring lamanya waktu penyimpanan, hasil pembacaan pada absorbansi untuk semua sampel (sampel dengan pH 1 sampai 7) mengalami pergeseran hipokromik hal ini disebabkan oleh banyaknya non-asilasi antosianin yang dibuktikan dengan struktur yang tidak berwarna sebagaimana pada Gambar 4.1.
Secara umum, dibawah pH 2 antosianin berada pada bentuk sebagai kation flavilium merah. Pada pH > 2, terjadi pengurangan proton dengan cepat berwarna merah atau quinonoidal biru. Selanjutnya, katio flavilium menjadi terhidrasi menghasilkan karbinol tidak berwarna atau pseudobasa yang berkeseimbangan untuk menjadi bentuk kalkon yang tidak berwarna (Mazza dan Minati, 1993).
Berdasarkan penelitian yang telah dilakukan, perubahan yang terjadi setelah penambahan larutan buffer 1 sampai 7 pada larutan sampel menunjukkan warna yang berbeda-beda sebagaimana pada Tabel 4.2. Perubahan warna dari merah pekat bergeser ke merah bening kecoklatan hingga warna coklat, hal ini disebabkan oleh tingkat keasaman pelarut yang menurun.
Perubahan panjang gelombang dan nilai absorbansi sangat berpengaruh juga terhadap nilai konsentrasi antosianin yang terkandung pada sampel. Pengaruhan perlakuan buffer pH 1-7 terhadap konsentrasi senyawa antosianin pada sampel juga diperkuat oleh analisis statistik dengan metode One-Way ANOVA (analysis of variance) menggunakan aplikasi MINITAB 14. Menurut hasil percobaan yang telah dilakukan menunjukkan pengaruh yang singnifikan selama selama ± 30 hari penyimpanan, hal ini dibuktikan dengan nilai R2 pada P < 0,05 sebagai berikut,
Tabel 8 Signifikansi pengaruh perlakuan buffer terhadap konsentrasi antosianin setiap pH
pH R2 Signifikansi ( ) P hitung 1 93,46 % 96,67 % 0,000 2 74,19 % 86,13 % 0,001 3 98,50 % 99,25 % 0,000 4 97,70 % 98,84 % 0,000 5 56,81 % 98,52 % 0,032 6 94,41 % 75,37 % 0,000 7 98,80 % 99,06 % 0,000
Menurut analisa statistik apabila nilai P ≤ α, maka data tersebut memiliki pengaruh dan perbedaan yang nyata. Derajat kepercayaan ( α ) yang digunakan adalah 5 %. Hal ini juga dibuktikan dengan tingginya nilai koefisien determinannya (R2) ≥ 50%.
3.5 Penentuan Intensitas Warna dengan Metode CIELAB
Penentuan intensitas warna pada tahap ini menggunakan color reader CR 10. Skala warna CIELAB merupakan sebuah perkiraan skala keseragaman warna. Sumbu L* mulai dari atas ke bawah, parameter L*
112 menunjukkan tingkat kecerahan dengan skala 0 (gelap atau hitam) sampai 100 (cerah atau terang). Sumbu a* dan b* tidak memiliki nilai batas yang spesifik. Bila nila a* positif berarti merah dan bila negatif adalah hijau, sedangkan untuk b* bila positif berarti kuning dan bila negatif adalah biru.
Penentuan intensitas warna dalam penelitian ini dilakukan terhadap dua faktor yang berbeda, yaitu suhu dan pH. Untuk mengetahui perbedaan intensitas warna secara tepat, maka dilakukan proses penentuan intensitas warna menggunakan alat color reader.
3.6 Perubahan Intensitas Warna Akibat Pengaruh Suhu Pemanasan
Warna dan kestabilan antosianin dipengaruhi oleh beberapa faktor, salah satunya adalah suhu. Suhu penyimpanan maupun suhu proses pengolahan mempengaruhi degradasi antosianin yang berakibat pula pada perubahan warna.
Tabel 9 Hasil pembacaan warna pada tiap suhu pemanasan selama 30 menit
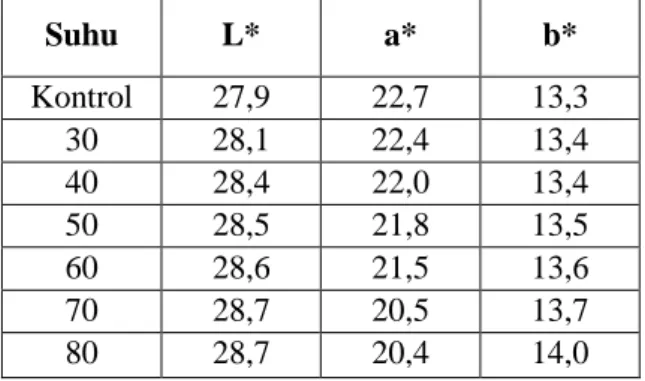
Suhu L* a* b* Kontrol 27,9 22,7 13,3 30 28,1 22,4 13,4 40 28,4 22,0 13,4 50 28,5 21,8 13,5 60 28,6 21,5 13,6 70 28,7 20,5 13,7 80 28,7 20,4 14,0
Berdasarkan Tabel 9 di atas, perubahan nilai L* untuk parameter terang-gelap mengalani peningkatan seiring dengan naik suhu pemanasan, hal ini menunjukkan semakin tinggi suhu pemanasan, maka tingkat intensitas terang (bening) sampel meninggkat pula. Selajutnya perubahan nilai a* untuk parameter merah-hijau seiring dengan naiknya suhu pemanasan mengalami penurunan yang berbanding terbalik dengan nilai L*. Perubahan juga terjadi juga nilai b* untuk parameter kuning-biru yang mengalami peningkatan seiring dengan naiknya suhu pemanasan.
Konsentrasi terendah terdapat pada suhu pemanasan 80 oC sebesar
56,231
mg/L (data Tabel 4.2) dengan asumsi bahwa pada suhu tersebut terjadi penurunan konsentasi, maka dilakukan pemanasan kembali, yaitu pada suhu tetap 80 oCdengan waktu yang bervariasi mulai dari 0, 5, 10, 15, 20, 25, dan 30 menit. Setiap perlakuan dilakukan ulangan sebanyak tiga kali.Dari hasil pemanasan diperoleh data hasil pembacaan intensitas warna pada sampel rosella dengan pemanasan 80 °C dengan waktu yang bervarisi sebagai berikut,
Tabel 10 Hasil pembacaan warna tiap waktu dengan suhu pemanasan 80 °C
Waktu (menit) L* a* b* Kontrol 29,6 23,9 13,5 5 29,6 23,3 13,6 10 30,1 23,1 13,6 15 30,1 22,2 13,8 20 30,2 21,7 14,2 25 30,4 21,1 14,3 30 30,7 20,7 15,0
Perubahan nilai parameter L*, a*, dan b* pada Tabel 10 di atas, hampir sama seperti Tabel 9. Dimana nilai L* dan b* mengalani peningkatan seiring dengan naik suhu pemanasan, Sedangkan nilai a* untuk parameter merah-hijau mengalami penurunan seiring dengan naiknya suhu pemanasan. Nilai L* dan b* berbanding terbalik dengan nilai a*.
113
3.7 Perubahan Intensitas Warna Akibat Pengaruh Buffer
Berdasarkan hasil analisa secara fisik pada Tabel 6 terdapat perbedaan intensitas warna ekstrak rosella yang telah ditambahkan maisng-masing buffer. Warna akan terus berubah selama proses penyimpanan selama ± 30 hari., sebagaimana yang terdapat pada tabel di bawah ini.
Tabel 11 Hasil pembacaan L* selama proses penyimpanan
pH Nilai L* pada hari ke-
0 3 6 9 12 15 18 21 Kontrol 27,5 27,7 27,6 27,0 27,1 25,9 25,7 26,2 1 38,0 36,7 38,4 37,5 36,4 35,4 35,0 35,2 2 38,6 37,5 38,5 38,1 37,0 37,6 37,1 37,4 3 39,1 38,4 38,6 38,8 37,6 38,0 37,8 37,9 4 39,3 38,7 38,9 39,1 38,1 38,3 37,9 37,9 5 39,3 40,1 39,6 39,4 39,0 38,4 37,8 38,1 6 39,6 40,3 40,8 39,5 39,1 39,3 39,0 38,6 7 39,7 40,5 41,7 39,8 39,2 39,4 39,2 39,7
Data nilai L* pada Tabel 11 di atas rata-rata mengalami penurunan, hal ini berarti selama proses penyimpanan mampu menurunkan tingkat kejernihan (terang/bening) sampel. Sebaliknya nilai L* pada pH yang berbeda rata-rata mengalami peningkatan. Selanjutnya data hasil pembacaan nilai a*. seiring dengan bertambahnya lama penyimpanan dan berkurangnya tingkat keasaman dari masing-masing sampel (sampel dengan buffer pH 1-7) mengalami penurunan. Hal ini disebabkan oleh perubahan warna sampel dengan buffer 1-7 dari merah menjadi kuning kecoklatan akibat perubahan struktur.
Tabel 12 Hasil pembacaan
a*
selama proses penyimpanan
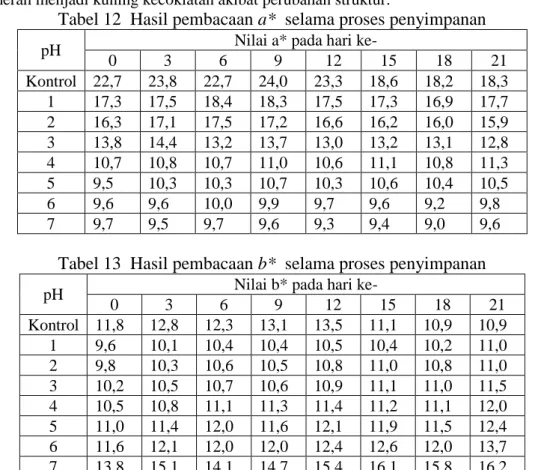
pH Nilai a* pada hari ke-
0 3 6 9 12 15 18 21 Kontrol 22,7 23,8 22,7 24,0 23,3 18,6 18,2 18,3 1 17,3 17,5 18,4 18,3 17,5 17,3 16,9 17,7 2 16,3 17,1 17,5 17,2 16,6 16,2 16,0 15,9 3 13,8 14,4 13,2 13,7 13,0 13,2 13,1 12,8 4 10,7 10,8 10,7 11,0 10,6 11,1 10,8 11,3 5 9,5 10,3 10,3 10,7 10,3 10,6 10,4 10,5 6 9,6 9,6 10,0 9,9 9,7 9,6 9,2 9,8 7 9,7 9,5 9,7 9,6 9,3 9,4 9,0 9,6
Tabel 13 Hasil pembacaan
b*
selama proses penyimpanan
pH Nilai b* pada hari ke-
0 3 6 9 12 15 18 21 Kontrol 11,8 12,8 12,3 13,1 13,5 11,1 10,9 10,9 1 9,6 10,1 10,4 10,4 10,5 10,4 10,2 11,0 2 9,8 10,3 10,6 10,5 10,8 11,0 10,8 11,0 3 10,2 10,5 10,7 10,6 10,9 11,1 11,0 11,5 4 10,5 10,8 11,1 11,3 11,4 11,2 11,1 12,0 5 11,0 11,4 12,0 11,6 12,1 11,9 11,5 12,4 6 11,6 12,1 12,0 12,0 12,4 12,6 12,0 13,7 7 13,8 15,1 14,1 14,7 15,4 16,1 15,8 16,2
Berdasarkan data hasil pembacaan nilai b* di atas, seiring dengan bertambahnya lama penyimpanan mengalami penurunan. Sedangkan dengan semakin berkurangnya tingkat keasaman dari masing-masing sampel (sampel dengan buffer pH 1-7) mengalami penurunan. Nilai b* denagn semakin berkurangnya tingkat keasaman sampel berbanding terbalik dengan nilai a*. Hal ini disebabkan oleh perubahan warna sampel dengan buffer 1-7 dari merah menjadi kuning kecoklatan akibat perubahan struktur.
114 Perbedaan intensitas warna dari ekstrak hasil penelitian ini tergantung dari jenis antosianin yang terkandung dalam kelopak bunga rosella dan dan faktor-faktor yang mempengaruhi kestabilannya.
Jika dilihat dari sudut pandang agama, pigmen senyawa antosianin pada kelopak bunga rosella dapat digunakan sebagai pewarna alami makanan, hal itu dilihat dari aspek kehalalan dan kebaikan dari pigmen tersebut. Selama ini pewarna makanan yang digunakan adalah pewarna sintetik yang mengandung bahan kimia berbahaya dan dapat menyebabkan penyakit bagi tubuh, padahal sejak 15 abad yang lalu Allah sudah menjelaskan dan memerintahkan kepada kita untuk selalu memakan makanan yang tidak hanya halal tapi juga harus baik, sebagaimana firmanNya.
Artinya: Hai sekalian manusia, makanlah yang halal lagi baik dari apa yang terdapat di bumi, dan janganlah kamu mengikuti langkah-langkah syaitan; karena Sesungguhnya syaitan itu adalah musuh yang nyata bagimu (QS. Al-Baqarah:168).
Berdasarkan ayat di atas, dapat diketahui bahwa betapa Allah sangat mencintai sesuatu yang baik, dan selalu memerintahkan kepada hambaNya untuk selalu melakukan hal-hal yang baik pula. Misalnya, kita diperintahkan untuk mengkonsumsi makanan dan minuman yang baik (bergizi, mengandung protein, karbohidrat, vitamin, lemak, dll). Makanan yang baik itu tentunya tidak menimbulkan efek bahaya bagi kesehatan, tetapi memperlancar proses metabolisme tubuh dan membantu perkembangan rohani dan jasmani ke arah yang lebih baik. Salah satu contoh tanaman yang dapat dimanfaatkan pada makanan dan berdampak positif bagi tubuh adalah kelopak bunga rosella.
4. KESIMPULAN DAN SARAN
4.1 Kesimpulan
1. Laju degradasi senyawa antosianin ekstrak kelopak bunga rosella (Hibiscus sabdariffa L) akibat pemanasan dengan variasi suhu terhadap total mengikuti persamaan r = d[antosianin]/dt = 0,014T – 1,169 dengan konsentrasi terendah terdapat pada pemanasan dengan suhu 80 °C, yaitu 56,231 mg/L dan memiliki pengaruh yang sangat signifikan dengan R2 56,81 - 98,80 %. Intensitas warna yang dihasilkan akibat pengaruh pemanasan pada suhu 80 °C dengan waktu yang bervariasi adalah (L*) 29,6 - 30,7; (a*) 23,9 – 20,7; (b*) 13,5 – 15.
2. Kestabilan senyawa antosianin akibat pengaruh pH terhadap total dan warna ekstrak kelopak bunga rosella (Hibiscus sabdariffa L) selama proses penyimpanan mengalami penurunan seiring dengan bertambahnya lama penimpanan dan berkurangnya tingkat keasaman sampel. Intensitas warna yang dihasilkan akibat pengaruh variasi pH selama proses penyimpanan adalah 27,5 – 26,2 untuk nilai L* rata-rata mengalami penurunan sebaliknya nilai L* pada pH yang berbeda rata-rata mengalami peningkatan dengan nilai 27,5 – 39,7. a* mengalami penurunan seiring dengan bertambahnya lama penyimpanan dan berkurangnya tingkat keasaman dari masing-masing sampel (sampel dengan buffer pH 1-7), yaitu 22,7 – 18,3 dan 22,7 – 9,7. b* seiring dengan bertambahnya lama penyimpanan mengalami penurunan dan mengalami penurunan dengan semakin berkurangnya tingkat keasaman dari masing-masing sampel (sampel dengan buffer pH 1-7), yaitu 11,8 – 10,9 dan 11,8 – 13,8.
4.2 Saran
Berdasarkan penelitian yang telah dilakukan, pemanasan ekstrak kelopak bunga rosella baik dilakukan pada suhu < 60 °C dan pada pH < 3.
Diperlukan penelitian lanjutan mengenai suhu yang cocok untuk penyimpanan, pengaruh cahaya terhadap kestabilan senyawa antosianin, dan aplikasi pemanfaatan senyawa antosianin yang terdapat pada rosella bahan pewarna pada makanan dan minuman.
5. DAFTAR PUSTAKA
Adam, J.B dan Ongley, M.H. 1972.Food Preservation. USA: Research Association Technology. Anonymous. 2008. CIE L*a*b* Color Scale. Insight on Color: Application Note. Volume 8. No. 7.
115 Arthey, D. dan Ashurst, P.R. 2001. Fruit Prossecing, Nutrition Product, and Quality Management. 2nd
Edition, An Aspen Publication Maryland.
Belitz, H.D. dan Grosch, W. 1999. Food Chemistry, 2nd Edition. Germany: Springer.
Casals dan Zevallos. 2004. Stability of Anthocyanin-based Aqueous Extracts of Adean Purpel Corn and Red-flesh Sweet Potato Compare to Syntetic an Natural Colorants. Food Chemistry. Volume 86. Hal 69-77. Elsevier.
Charley, H. 1970. Food Science. New York : John Willey and Sons Inc.
Cisse, M.,Vaillant, F., Acosta, O., Mayer, C.D., Dornier, M. 2009. Thermal Degradation Kinetik of Anthocyanins from Blood Orange, Blackberry, and Roselle Using the Arrhenius, Eyring, and Ball Model. Journal of Agricultural and Food Chemistry. Volume 57. Hal 6285-6291. American Chemical Society.
Dowhan, A dan Paul, C. 2000. Colouring Our Food in The Last dan Next Millenium. International Journal of Food Science and Technology. Volume 35. hal 5-22. London: Blackwell Science Ltd.
Duangmal, et.al,. 2004. Roselle Anthocyanin As a Natural Food Colorant and Improvement of its Colour Stability. International Color Association Proceeding, 155-158, Thailand: Chulalongkorn University. Elbe, V dan Schwartz. 1996. Food Chemistry. New York: Marcel Dekker Inc.
Eskin, N.A.M. 1979. Plant, Pigment, Flavour, and Texture.New York: Academic Press.
Falcao, L.D., Falcao, A.P., Gris, E.F. 2008. Spectrophotometric Study of the Stability of Anthocyanins from Cabarnet Sauvignon Grape Skins in a Model System. Brazilian Journal of Food Technology. Volume 11. Hal 63-69.
Fennema, O.R.. 1996. Food Chemistry 3th Edition. New York: Marcel Dekker Inc.
Francis. 1989. Food Colorants: Anthocyanin. Critical Reviews in Food Science and Nutrition,28: 273-314 Giusti, M.M., dan Wrolstad R.E., 2001, Characterization and Measurement of Anthocyanins by UV-Visible
Spectroscopy, Journal of Current Protocols in Food Analytical
Hendry, G.A.F dan Houghton, J.D. 1996. Natural Food Colorant, 2nd Edition. London: Blackie Academic and Professional
Heath, dan Reinessius, G. 1987. Flavor Chemistry and Technology. New York: Van Norstand Reindhold Co. Hosseinan, F.S., Li, W., Beta, T. 2008. Measurement of Anthocyanin and Other Phytochemical in Purpel
Wheat. Food Chemistry, 109: 916-924.
Khalil, K.E., Selim, K.A., Abdel-Bary, M.S., dan Abdel-Azeim, N.A. 2008. Extraction, Encapsulation and Utilization of Red Pigment from Rosella (Hibiscus sabdariffa L.) as Natural Food Colorants. Alex Journal Food, Science and Technology. Special Volume Conferense, pp 7-20.
Ketmaro, P., Muangsiri, W., Werawatganone, P. 2010. UV Spectroscopy Characterization and Stabilities of Natural Colorants from Rosella Calyx, Lac Resin and Gardenia Fruit. Journal Health Res. Volume 24 (1). Hal 7-13.
Maga, J.A dan Tu, A.T. 1994. Food Additive Toxycology. New York: Mancel Dekker Inc.
Markakis, P. 1982. editor oleh Fennema. 1996. Dalam Food Chemistry. New York: Marcel Dekker Inc. Markham. 1988. Cara Mengidentifikasi Flavonoid. Bandung: Penerbit ITB.
Maryani dan Kristiana. 2005. Khasiat dan Manfaat Rosela. Jakarta : Agro Media Pustaka.
Mazza dan Miniati. 1993. Anthocyanins in Fruits, Vegetables, and Grains. Boca Raton: CRC Press
Nollet. 1996. Dalam Efektivitas Jenis Pelarut dan Bentuk Pigmen Antosianin Bunga Kana (canna coccinea mill.) Serta Aplikasinya pada Produk Pangan (Skripsi), Niendyah, H., 2004. Universitas Brawijaya Malang, http://digilib.ti.itb.ac.id/go.php?id=jiptumm-gdl-s1-2004-niendyahag1533. Diakses tanggal 27 Juni 2008.
Rein, M. 2005. Copigmentation Reactions and Color Stability of Berry Anthocyanin. Academic Dissertation. Helsinki: University of Heslinki
Wrolstad, R.E dan Giusti, M.M. 2001. Characterization and Measurement of Anthocyanin by UV-Visible Spectroscopy: Current Protocols in Food Analytical Chemistry. New York: John Wiley and