Makalah Kimia Organik Bahan Alam
SENYAWA TERPENOID
Oleh :
Farah Permata (093234012) KA’09
Fitria Aprelia (093234021) KA’09
Tika Ayu Risky (093234034) KA’09
JURUSAN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN
ALAM
UNIVERSITAS NEGERI SURABAYA
2013
BAB I PENDAHULUAN
A. Latar Belakang
Pola hidup manusia yang tidak seimbang menyebabkan tingginya pertumbuhan kanker di dunia. Kanker merupakan penyakit akibat pertumbuhan yang tidak normal dari sel-sel jaringan tubuh yang berubah menjadi sel kanker. Sel-sel ini akan menyebar ke seluruh bagian tubuh sehingga dapat menyebabkan kematian. Kanker dapat menimpa semua orang dan semua golongan umur. Oleh karena itu, penyakit kanker merupakan penyakit yang menjadi salah satu ancaman utama terhadap kesehatan manusia. Hampir 1 juta individu di Amerika Serikat ditemukan menderita kanker setiap tahun, sekitar setengah diantaranya meninggal karena penyakit ini. Metode terapi yang lazim dilakukan selama ini untuk mengatasi kanker adalah radiasi dan kemoterapi. Metode ini membutuhkan biaya yang mahal dalam proses pengobatannya. Namun, hasil yang didapatkan belum memuaskan karena masih menimbulkan efek samping yang membahayakan. Oleh karena itu, pendekatan yang dilakukan untuk mengatasi hal tersebut adalah penggunaaan bahan alam sebagai alternatif agen antikanker. Salah satu hal yang menjadi pengamatan para ilmuwan adalah obat-obatan tradisional. Hal ini dilakukan mengingat potensi obat tradisional tersebut yang telah lama dipercaya oleh masyarakat mammpu menyembuhkan penyakit tertentu.
Salah satu bentuk pengobatan tradisional adalah metode pengobatan dengan menggunakan bahan-bahan herbal. Pengobatan herbal merupakan suatu pengobatan menggunakan berbagai macam ekstrak dari tumbuhan (tanaman obat), yang dikombinasikan dengan bahan alami lainnya yang diolah secara modern sehingga dapat membantu membersihkan saluran darah dari penyumbatan dan menstimulasi sistem kekebalan tubuh untuk bersama-sama membunuh sel kanker (Anonim, 2010). Senyawa-senyawa aktif dari tanaman obat akan bekerja serentak dalam menghambat pertumbuhan sel kanker sehingga lama kelamaan sel kanker akan melemah dan kemudian mati.
Indonesia merupakan salah satu negara yang kaya akan berbagai macam sumber daya alam hayati. Salah satu tumbuhan yang banyak hidup di Indonesia adalah jenis tumbuhan paku-pakuan. Tumbuhan paku merupakan salah satu divisi tumbuhan yang menjadi kekayaan alam hayati Indonesia. Pemanfaatan tumbuhan paku sebagai bahan obat tidak terlepas dari kemampuan tumbuhan paku memproduksi senyawa metabolit sekunder. Berdasarkan hasil uji bioaktivitas, beberapa metabolit sekunder dari tumbuhan paku menunjukkan aktivitas biologis yang menarik antara lain sebagai antikanker (Suyatno, 2008).
Berdasarkan hasil penelitian fitokimia yang telah dilakukan pada beberapa spesies tumbuhan paku dapat dinyatakan bahwa tumbuhan paku mengandung berbagai senyawa bioaktif golongan terpenoid, steroid, fenilpropanoid, poliketida, flavonoid, alkaloid, stilben, santon, turunan asam benzoat, lipid, dan senyawaan belerang (Franich, et al., 1998; Ageta & Arai, 1990; Robinson, 1991; Bohm, 1994; Wollenweber, et al., 1998; Adam, 1999 dalam Suyatno, 2011).
Berdasarkan uraian di atas, maka pada makalah ini akan di bahas mengenai salah satu senyawa metabolit sekunder yaitu Triterpen yang berhasil di isolasi dari tumbuhan paku dan diidentifikasi serta di uji bioaktivitasnya. Adapun jurnal yang dipakai sebagai materi yaitu Jurnal dengan judul “Senyawa Triterpen Tumbuhan Paku Kamuding dan Potensinya sebagai
Antikanker” oleh Ray Difa dan Suyatno (2012), Jurusan Kimia, FMIPA,
Universitas Negeri Surabaya. Materi yang dibahas dalam makalah ini meliputi struktur senyawa Tritrpen dan nama struktur yang berhasil diisolasi, cara mengisolasi, data spectrum yang digunakan untuk mengidentifikasi senyawa yang telah ditemukan, sifat dan uji Bioaktivitasnya.
B. Rumusan Masalah
Berdasarkan latar belakang di atas, maka dapat diperoleh rumusan masalah sebagai berikut”
1. Apa nama senyawa dan struktur senyawa Triterpen yang berhasil diisolasi?
2. Apa nama tumbuhan yang dijadikan sebagai objek pengambilan sampel? 3. Bagaimana cara mengisolasi senyawa triterpen?
4. Bagaimana data spectrum yang digunakan untuk mengidentifikasi senyawa triterpen yang telah diisolasi?
5. Bagaimana sifat dan uji bioaktivitas dari senyawa triterpen yang telah berhasil diisolasi?
C. Tujuan
Berdasarkan rumusan masalah di atas, maka tujuan dari penyusunan makalah ini adalah:
1. Mengetahui nama senyawa dan struktur senyawa yang telah disolasi. 2. Mengetahui asal tumbuhan yang djadikan sebagai objek pengambilan sampel.
3. Mengetahu cara mengisolasi senyawa Triterpen.
4. Mengetahui data spekturm yang digunakan untuk mengidentifikasi senyawa triterpen yang telah berhasil diisolasi.
5. Mengetahui sifat dan uji bioaktivitas dari senyawa triterpen yang telah berhasil diisolasi.
BAB II
KAJIAN PUSTAKA
A. Tinjauan umum Kanker
Kanker adalah penyakit yang ditandai dengan pembelahan sel yang tidak terkendali. Masalah utana dalam kanker adalah metastasis, yaitu kemampuan sel dalam berimigrasi ke jaringan yang lebih jauh dan tumbuh di jaringan tersebut (Murray et al., 2003). Pertumbuhanyang tidak terkendali tersebut disebabkan oleh kerusakan DNA akibat mutasi di gen vital yang mengontrol pembelahan sel. Beberapa mutasi mungkin dibutuhkan untuk mengubah sel normal menjadi sel kanker. Mutasi-mutasi tersebut sering diakibatkan agen kimia maupun fisik yang disebut senyawa karsinogen (Murray et al., 2003).
Kanker dapat menyebabkan banyak gejala yang berbeda, bergantung pada lokasinya dan karakter dari keganasan dan ada tidaknya metastasis. Penyakit kanker ditandai dengan pertumbuhan abnormal selpada jaringan tumbuh secara terus-menerus dan tidak terkendali. Penyebaran sel kanker dapat dilakuakn melalui darah dan kelenjar getah bening.
Pengobatan kanker dapat dibagi menjadi tiga, yaitu terapi radiasi, operasi dan terapi adjuvant (pendamping). Terapi adjuvan dapat dibagi menjadi terapi hormonal, kemoterapi, dan imunoterapi (Hahn & Payne 2003). Pengobatan kemoterapi ditujukan untuk menghancurkan sel kanker sehingga ukuran kanker mengecil dan kemunculannya setelah pengobatan dapat dicegah. Doxorubicin merupakan salah satu obat kemoterapi yang umum digunakan untuk menangani berbagai jenis kanker. Imunoterapi merupakan upaya penggunaan senyawa tertentu untuk memicu kerusakan sel kanker oleh sistem pertahanan tubuh. Herceptin merupakan obat yang banyak dugunakan dengan target spesifik, yaitu memblokade protein Her2/neu (Lewis, 2003). Protein Her2/neu merupakan reseptor yan berfungsi mendorong pembelahan sel (ER+).
B. Tinjauan Senyawa Terpenoid
Terpenoid merupakan komponen-komponen tumbuhan yang mempunyai bau dan dapat diisolasi dari minyak atsiri. Minyak atsiri yang berasal dari bunga pada awalnya dikenal dari penentuan struktur secara sederhana, yaitu dengan perbandingan atom hidrogen dan atom karbon dari suatu senyawa terpenoid yaitu 8:5 dan dengan perbandingan tersebut dapat dikatakan bahwa senyawa tersebut adalah golongan terpenoid (Lenny, 2006). Minyak atsiri bukanlah senyawa murni akan tetapi merupakan campuran senyawa organik yang kadangkala terdiri dari lebih 25 senyawa atau komponen yang berlainan. Sebagian besar komponen minyak atsiri adalah senyawa yang hanya mengandung karbon dan hidrogen atau karbon, hidrogen dan oksigen yang tidak bersifat aromatik yang secara umum disebut terpenoid. Minyak atsiri adalah bahan yang mudah menguap sehingga mudah dipisahkan dari bahan-bahan lain yang terdapat dalam tumbuhan.
Semua senyawa terpenoid berasal dari molekul isoprena CH2=C(CH3
)-CH=CH2 dan kerangka karbonya (carbon skeleton) disusun dengan menyambung
dua atau lebih satuan isoprena tersebut (C5) seperti pada Gambar 1. Berdasarkan
alasan tersebut, maka senyawa terpenoid seringkali dinyatakan dengan istilah “isoprenoid”. Namun, senyawa isoprena sendiri tidak terdapat di alam, senyawa yang sebenarnya terlibat adalah isopentenil pirofosfat, CH2=C(CH3)-CH2-CH2
-OPP. Hal ini menyebabkan ada sebagian senyawa terpenoid yang tidak tersusun dari molekul isoprena tersebut (Tukiran, 2010).
Klasifikasi terpenoid ditentukan dari unit isopren atau unit C-5 atau penyusun senyawa tersebut. Secara umum, biosintesa dari terpenoid terjadi dengan 3 reaksi dasar yaitu:
1) Pembentukan isoprena aktif berasal dari asam asetat melalui asam mevalonat. 2) Penggabungan kepala dan ekor dua unit isopren akan membentuk mono-,
seskui-, di-, sester-, dan poli-terpenoid.
3) Penggabungan ekor dan ekor dari unit C-15 atau C-20 menghasilkan triterpenoid dan steroid.
Mekanisme dari tahap-tahap biosintesis terpenoid adalah asam asetat yang telah diaktifkan oleh koenzim A melakukan kondensasi jenis Claisen menghasilkan asam asetoasetat. Senyawa yang dihasilkan ini dengan asetil koenzim A melakukan kondensasi jenis aldol mnghasilkan rantai karbon bercabang sebagaimana ditemukan pada asam mevalonat CH2OHCH2C(OHCH3)CH2COOH. Reaksi-reaksi berikutnya adalah fosforilasi,
eliminasi asam fosfat, dan dekarboksilasi menghasilkan iso-pentil pirofosfat (IPP) yang selanjutnya berisomerisasi menjadi dimetil alil pirofosfat (DMAPP) oleh enzim isomerase. IPP sebagai unit isopren aktif bergabung melalui ikatan kepala ke ekor dengan DMAPP dan penggabungan ini merupakan langkah pertama dari polimeraisasi isoprena untuk menghasilkan terpenoid.
Penggabungan ini terjadi karena serangan elektron dari ikatan rangkap IPP terhadap atom karbon dari DMAPP yang kekurangan elektron diikuti oleh penyingkiran ion pirofosfat yang menghasilkan geranil pirofosfat (GPP) yaitu senyawa antara bagi semua senyawa monoterpenoid.
Penggabungan selanjutnya antara satu unit IPP dan GPP dengan mekanisme yang sama menghasilkan farnesil pirofosfat (FPP) yang merupakan senyawa antara bagi semua senyawa senyawa seskuiterpenoid. Senyawa diterpenoid diturunkan dari geranil-geranil piofosfat (GGPP) yang berasal dari kondensasi antara satu unit IPP dan GPP dengan mekanisme yang sama. Reaksi-reaksi selanjutnya dari senyawa antara GPP, FPP, dan GGPP untuk menghasilkan
senyawa-senyawa terpenoid satu persatu hanya melibatkan beberapa jenis reaksi sekunder. Reaksi-reaksi sekunder tersebut antara lain hidrolisis, siklisasi, oksidasi, reduksi, dan reaksi-reaksi spontan yang dapat berlangsung dengan mudah dalam suasana netral dan pada suhu kamar, seperti isomerisasi, dehidrasi, dekarboksilasi, dan sebagainya (Achmad, 1986). Mekanisme biosintesis senyawa terpenoid dapat dilihat dalam Gambar 2.
Secara kimia, terpenoid umumnya larut dalam lemak dan hanya terdapat di dalam sitoplasma sel tumbuhan. Biasanya terpenoid diekstraksi dari jaringan tumbuhan dengan memakai eter minyak bumi, eter, atau kloroform, dan dapat dipisahkan secara kromatografi pada silika gel atau alumina memakai pelarut di atas tetapi sering kali terdapat kesukaran sewaktu mendeteksi dalam skala mikro karena hampir semua senyawa terpenoid tidak berwarna dan tidak ada pereaksi kromogenik yang peka (Harborne, 1987).
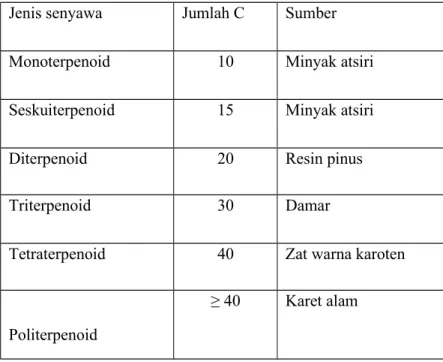
Berdasarkan mekanisme reaksi biosintesis senyawa terpenoid, maka senyawa terpenoid dapat dikelompokkan menjadi seperti pada Tabel 1
Tabel 1. Jenis-jenis senyawa golongan terpenoid
Jenis senyawa Jumlah C Sumber
Monoterpenoid 10 Minyak atsiri
Seskuiterpenoid 15 Minyak atsiri
Diterpenoid 20 Resin pinus
Triterpenoid 30 Damar
Tetraterpenoid 40 Zat warna karoten
Politerpenoid
(Lenny, 2006) H3C C O SCoA H3C C O SCoA H3C C O H2 C C O SCoA Asetil koenzim A Asetoasetil koenzim A
H3C C O SCoA H3C C OH H2 C H2C C C O O SCoA SCoA H OH C O H2 C C OH H3C H2C H2 C OH H3C C OPP H2 C CH2CH2OPP C OH O OPP CO2 H 3C C H2 C CH2 H2 C OPP Isopentenil pifosfat (IPP)
H3C C CH3 C H H2 C OPP Dimetilalil pirofosfat (DMAPP)
Fosforilasi
Isomerisasi
Asam mevalonat
Gambar 2. Reaksi biosintesis senyawa terpenoid (Achmad, 1986)
a. Monoterpenoid
Monoterpenoid merupakan senyawa “essence” dan memiliki bau yang spesifik yang dibangun oleh 2 unit isopren atau dengan jumlah atom karbon 10. Lebih dari 1000 jenis senyawa monoterpenoid telah diisolasi dari tumbuhan tinggi, binatang laut, serangga dan binatang jenis vertebrata dan struktur senyawanya telah diketahui.
Struktur dari senyawa monoterpenoid yang telah dikenal merupakan perbedaan dari 38 jenis kerangka yang berbeda, sedangkan prinsip dasar
OPP H OPP DMAPP IPP OPP Monoterpen Geranil pirofosfat OPP H OPP Farnesil pirofosfat OPP H Seskuiterpen Triterpen 2 x OPP Geranil-geranil pirofosfat Diterpen Tetraterpen 2 x + + +
penyusunannya tetap sebagai penggabungan kepala dan ekor dari 2 unit isopren. Struktur monoterpenoid dapat berupa rantai terbuka dan tertutup atau siklik. Senyawa monoterpenoid banyak dimanfaatkan sebagai antiseptik, ekspektoran, spasmolotik, dan sedatif. Disamping itu, senyawa monoterpenoid yang sudah banyak dikenal sebagai bahan pemberi aroma makanan dan aroma parfum (Lenny, 2006).
Dari segi biogenetik, perubahan geraniol nerol dan linalol dari yang satu menjadi yang lain berlangsung sebagai akibat reaksi isomerisasi. Ketiga alkohol ini, yang berasal dari hidrolisa geranil pirofosfat (GPP) dapat menjadi reaksi-reaksi sekunder, misalnya dehidrasi menghasilkan mirsen, oksidasi menghasilkan sitral dan oksidasi-reduksi menghasilkan sitronelal.
Perubahan GPP in vivo menjadi senyawa-senyawa monoterpen siklik dari segi biogenetik disebabkan oleh reaksi siklisasi yang diikuti oleh reaksi-reaksi sekunder.
Penetapan struktur monoterpenoida mengikuti suatu sistematika tertentu yang dimulai dengan penetapan jenis kerangka karbon. Jenis kerangka karbon suatu monoterpen monosiklik antara lain dapat ditetapkan oleh reaksi dehidrogenasi menjadi suatu senyawa aromatik (aromatisasi). Penetapan struktur selanjutnya ialah menentukan letak atau posisi gugus fungsi dari senyawa yang bersangkutan di dalam kerangka karbon tersebut (Lenny, 2006).
Cara lain untuk menentukan struktur molekul monoterpenoida adalah dengan mengubah senyawa yang bersangkutan dengan reaksi-reaksi tertentu menjadi senyawa lain yang mempunyai kerangka karbon yang sama. Pembuktian struktur suatu senyawa didukung oleh sintesa senyawa yang bersangkutan dari suatu senyawa yang diketahui strukturnya (Anonim, 2006).
b. Seskuiterpenoid
Seskuiterpen merupakan senyawa terpenoid yang dibangun oleh 3 unit isopren yang terdiri dari kerangka asiklik dan bisiklik dengan kerangka naftalen. Senyawa seskuiterpen ini mempunyai bioaktivitas yang cukup besar, diantaranya adalah sebagai antifeedant, hormon, antimikroba, antibiotik, toksin serta regulator pertumbuhan tanaman dan pemanis.
Senyawa-senyawa seskuiterpen diturunkan dari cis- isofarnesil pirofosfat dan trans- farnesil pirofosfat melalui reaksi siklisasi dan reaksi sekunder lainnya. Kedua isomer farnesil pirofosfat ini dihasilkan in vivo melalui mekanisme yang sama seperti isomerisasi antara geranil dan nerol.
c. Diterpenoid
Senyawa diterpenoid merupakan senyawa yang mempunyai 20 atom karbon dan dibangun oleh 4 unit isopren. Senyawa ini mempunyai bioaktivitas yang cukup luas yaitu sebagai hormon pertumbuhan tanaman, podolakton inhibitor pertumbuhan tanaman, antifeedant serangga, inhibitor tumor, senyawa pemanis, antifouling, dan antikarsinogen. Senyawa diterpenoid dapat berbentuk asiklik, bisiklik, trisiklik, dan tetrasiklik. Tatanama yang lebih banyak digunakan adalah nama trivial (Lenny, 2006).
d. Triterpenoid
Lebih dari 4000 jenis triterpenoid telah diisolasi dengan lebih dari 40 jenis kerangka dasar yang sudah dikenal dan pada prinsipnya merupakan proses siklisasi dari skualen. Triterpenoid terdiri dari kerangka dengan 3 siklik 6 yang bergabung dengan siklik 5 atau berupa 4 siklik 6 yang mempunyai gugus fungsi pada siklik tertentu. Sementara itu penamaan lebih disederhanakan dengan memberikan penomoran pada tiap atom karbon, sehingga memudahkan dalam penentuan substituen pada masing-masing atom karbon. Struktur terpenoida yang bermacam ragam itu timbul sebagai akibat dari reaksi-reaksi sekunder berikutnya seperti hidrolisa, isomerisasi, oksidasi, reduksi dan siklisasi atas geranil-, farnesil- dan geranil-geranil pirofosfat (Lenny, 2006).
Menurut Ageta (1986) dalam Burhan dan Zetra (1997), senyawa triterpenoid tumbuhan paku secara biogenetik dapat digolongkan ke dalam empat kelompok. Kelompok pertama adalah triterpenoid yang beranggotakan senyawa turunan hopana, isohopana, gammaseran, neohopana, fernana, adianana, filisana, dan 21-epifernana. Kelompok triterpen pentasiklik ini merupakan turunan skualen. Triterpenoid pentasiklik pada umumnya dibagi menjadi hopanoid dan nonhopanoid. Senyawa-senyawa yang termasuk
golongan hopanoid adalah hopana dan moretana, sementara itu beberapa nonhopanoid seperti gammaserana dan senyawa familinya yang disebut sebagai oleanana. Hopana mengandung 27-35 atom karbon dan berbentuk seri homolog dengan konfigurasi 17α(H), 21β(H). Senyawa-senyawa yang termasuk dalam kelompok ini mewakili triterpenoid yang terdapat pada tumbuhan paku-pakuan dan sebagian besar terdistribusi pada kelas Filicopsida. Senyawa hop-22(29)-ena (diploptena) (1) dan hopan-22-ol (diplopterol) (2) adalah dua senyawa turunan hopana tak jenuh yang banyak ditemukan.
kedua adalah yang terdiri dari senyawa-senyawa oleanan, ursan,
friedelan, dammaran, shionan, dan sejenisnya. Jenis oleanan ini pada tumbuhan paku-pakuan banyak ditemukan pada marga polypodium (Ageta & Arai, 1983; Ageta & Arai, 1984 dalam Burhan dan Zetra, 1997). Contoh struktur senyawa triterpen kelompok kedua yang berkerangka dasar ursan adalah α-amirin atau β-amirin (3) dan yang berkerangka dasar friedelan adalah friedelan (4) (Ageta & Arai, 1990).
HO
H
O
Kelompok ketiga adalah senyawa-senyawa triterpen yang terdiri dari polipodana, onoseran, seratan, malabarikan, dan kolisan. Contoh senyawa triterpen yang ditemukan pada tumbuhan paku famili polypodiaceae antara lain hop-17(21)-ene (5), serrat-14-ene (6) (Ageta & Arai, 1990).
Kelompok terakhir adalah yang mewakili perantara biogenetik fitosterol yang diturunkan dari 2,3-oksidoskualena. Kelompok ini banyak ditemukan pada akar polypodium formosanum (Ageta & Arai, 1984 dalam Burhan dan Zetra, 1997). Contoh struktur senyawa triterpen kelompok keempat yang mewakili perantara biogenetik fitosterol yang diturunkan dari 2,3-oksidoskualen adalah sikloartenol (7).
BAB III PEMBAHASAN A. Asal Tumbuhan hop-17(21)-ene serrat-14-ene HO sikloartenol
Pada jurnal disebutkan bahwa tumbuhan yang digunakan sebagai objek sampel adalah tumbuhan paku Adiantum philippensis L. Berikut kedudukan tumbuhan paku Adiantum philippensis L. dalam taksonomi dapat dinyatakan sebagai berikut: Divisi : Pterydophyta Kelas : Pterydopsida Bangsa : Polypodiales Suku : Adiantaceae Marga : Adiantum
Spesies : Adiantum philippensis L. (Mubashir & Shah, 2011)
Tumbuhan paku Adiantum philippensis L. sering disebut sebagai suplir kamuding. Tumbuhan ini sering dicirikan dengan batangnya yang pendek. Secara menyeluruh, terlihat pertumbuhannya yang tegak atau agak tegak. Sisiknya berwarna coklat gelap, berbentuk sempit, yang panjangnya sampai 3 mm. Tangkai entalnya beralur serta warnanya agak hitam. Masing-masing tangkai entalnya berukuran 8-18 cm. Anak-anak daunnya berjumlah sampai 12 pasang, yang letaknya agak berseling pada ental yang panjangnya mencapai 30 cm. Bentuk helaian anak daun seperti kipas. Teksturnya tipis tapi kuat. Kumpulan sporanya terdapat di sepanjang tepi daun (Joane,1989).
Rumpun Adiantum philippensis L. sering mati pada musim kemarau. Tunas-tunas baru tumbuh kembali pada musim penghujan. Adiantum
philippensis L. termasuk paku tanah, sehingga tumbuhnya sangat dipengaruhi
oleh keadaan tempat tumbuhnya. Tumbuhan ini tumbuh mulai daerah dataran rendah sampai pada ketinggian 1.000 m. Jenis ini menyukai tanah berbatu-batu, tanah liat, dan tanah berpasir. Selain itu, jenis ini diperbanyak melalui spora, pecahan-pecahan rumpunnya mudah sekali ditumbuhkan. Adiantum
B. Teknik Isolasi
Pada jurnal dijelaskan cara mengisolasi yaitu sampel yang berupa serbuk kering bagian aerial tumbuhan paku Adiantum philippensis seberat 800 gram diekstraksi dengan cara maserasi menggunakan pelarut n-heksana. Maserasi dilakukan pada suhu kamar selama 24 jam sebanyak 4 kali. Selanjutnya hasil maserasi n-heksana disaring menghasilkan ekstrak n-heksana dan residu. Ekstrak
n-heksana yang diperoleh diuapkan dengan rotary vacuum evaporator
menghasilkan ekstrak padat berwarna hijau gelap seberat 40 g.
Sebanyak 5 g ekstrak yang diperoleh, dipisahkan komponen-komponennya menggunakan metode kromatografi cair vakum (KCV) menggunakan fasa diam silika gel Merck 60 GF-254 dengan eluen berturut-turut heksana, campuran n-heksana-etilasetat, dan etilasetat menghasilkan 111 fraksi (@ 15 mL). Hasil pemisahan dimonitor dengan KLT dengan eluen n-heksana-etilasetat = 4 : 1. Gabungan fraksi 40-44 yang berupa padatan kuning direkristalisasi dengan menggunakan metanol menghasilkan isolat A sebanyak 335 mg. Selanjutnya isolat diuji kemurnian dengan pengukuran titik leleh dan kromatografi lapis tipis (KLT) tiga sistem eluen. Identifikasi struktur molekul dilakukan dengan metode spektroskopi (UV, IR, dan MS).
C. Hasil Identifikasi Senyawa Triterpenoid 1. Hasil Uji Kualitatif Senyawa Triterpenoid
Hasil isolasi dari ekstrak n-heksana bagian aerial tumbuhan paku kamuding (Adiantum philippensis L.) menghasilkan isolat yang berbentuk serbuk tidak berwarna dengan titik leleh 186-188 0C. Hasil positif pada uji dengan pereaksi
Liebermann-Burchard (merah jingga) menunjukkan bahwa senyawa hasil isolasi termasuk golongan terpenoid.
HO
HOAc /H2SO4
Ac2O (SO3)
Cholestahexaene sulf onic acid
λmax 410 nm ( calc 418 nm) senyawa steroid
+ SO2
HOO2S
carbonium ion of 3,5 - diene
Pentaenylic cation
λmax 620 nm ( calc 626 nm)
Gambar 3. Reaksi senyawa non fenolik dengen Liebermann-Burchad
2. Hasil Uji Spektroskopi Senyawa Triterpenoid
Pada jurnal disebutkan dala mengidentifikasi struktur molekul menggunakan spektroskopi UV, IR dan MS. Hasil pengukuran spektra ultraviolet (UV) senyawa hasil isolasi dalam pelarut n-heksana menunjukkan puncak serapan maksimum pada panjang gelombang 272 nm ( log ε = 5,30) dan 201 nm (log ε = 5,43) nm. Munculnya dua puncak pada λmak 272 nm dan
201 mengindikasikan bahwa terdapat ikatan C=C tidak terkonjugasi akibat adanya transisi elektron π→π*.
Hasil pengukuran spektra IR dasri hasil isolasi yang dipreparasi dengan teknik pellet KBr memberikan pita-pita serapan pada daerah: (2934:2855 cm-1)
puncak vibrasi ulur C-H alkil, (1641:1525 cm-1) regang C=C, dan (1457:1378
cm-1) vibrasi tekuk C-H alkil. Berdasarkan data spektrum IR senyawa isolat
merupakan senyawa non fenolik karena hanya menunjukkan puncak vibrasi ulur C-H alkil (2934 ; 2855 cm-1), regang C=C (1641 ; 1525 cm-1), dan vibrasi
tekuk C-H alkil (1457 ; 1378 cm-1).
Sedangkan spektrum massa isolat A memberikan puncak-puncak pada m/z (int.rel %): 410(30,30), 395(3,30), 367(6,06), 325(1,51), 274(0,30), 257(3,03), 243(3,03), 229(6,06), 217(15,15), 204(30,30), 191(100), 175(15,15), 161(36,36), 147(21,21), 134(27,27), 123(36,36), 109(42,42),
95(60,60), 81(62,12), 69(54,54), 55(54,54), serta 41(33,33) seperti yang disajikan pada Gambar dibawah ini:
Gambar 4. Spektrum MS Isolat A
D. Hasil Penentuan Struktur Molekul Isolat A
Pada jurnal, senyawa terpenoid yang telah berhasil diisolasi adalah senyawa neohop-13(18)-ena. Pola fragmentasi yang ditunjukkan dalam spektrum massa mendukung bahwa isolat merupakan senyawa neohop-13(18)-ena. Puncak ion fragmen pada m/z 191yang sangat tinggi intensitas relatifnya (100%) mendukung identifikasi senyawa golongan triterpenoid golongan neohop-13(18)-ena. Puncak m/z 191 muncul karena terlepasnya gugus C14H23+, selain itu ion-ion pada m/z 41,
55, dan 69 merupakan ciri khas dari terpenoid dengan rumus molekul CnH2n-1
dengan n= 3, 4, dan 5. Berdasarkan data spektroskopi di atas serta perbandingan dengan data literatur maka dapat disimpulkan bahwa isolat A merupakan senyawa neohop-13(18)-ena. Berikut struktur senyawanya:
Neohop-13(18)-ena
E. Sifat dan Uji Bioaktivitas BSLT
Sebanyak 5 mg isolat dilarutkan dalam 1 mL kloroform. Larutan yang terbentuk disebut larutan induk dengan konsentrasi 5000 µg/mL. Larutan induk kemudian dipipet sebanyak 10, 25, 50, 75, dan 100 µL dan dimasukkan ke dalam masing-masing vial yang berbeda. Selanjutnya masing-masing vial dibiarkan sampai pelarutnya menguap. Ke dalam masing-masing vial dimasukkan 10 ekor larva Artemia salina, kemudian ditambah air laut sampai volumenya mencapai 5 mL dan dibiarkan selama 24 jam. Setelah 24 jam dihitung jumlah larva Artemia salina yang mati. Hasil yang diperoleh dianalisis probit dengan menggunakan program SPSS 16 for windows untuk menentukan besarnya LC50 senyawa hasil isolasi (Mc Laughlin, et al., 1991).
Berdasarkan hasil uji pendahuluan aktivitas antikanker dengan menggunakan metode brine shrimp lethality test (BSLT), menunjukkan bahwa isolat A positif memiliki potensi sebagai antikanker. Hasil dari analisis probit menggunakan SPSS 16 diperoleh harga LC50 sebesar 67,378 µg/mL.
Adanya aktivitas antikanker pada tumbuhan paku Adiantum philippensis L. karena kandungan terpenoidnya terutama golongan triterpenoid membuat tumbuhan ini berpotensi untuk menjadi obat antikanker. Senyawa terpenoid dikenal sebagai salah satu golongan senyawa kimia dalam tanaman yang memiliki aktivitas antikanker dan antioksidan (Lisdawati, 2002).
Dari hasil pengujian dengan uji BSLT maka senyawa hasil isolasi dapat digolongkan sebagai zat yang toksik karena harga LC50 senyawa
neohop-13(18)-ena terletak antara 5-75µg/mL. Dengan demikian senyawa tersebut mempunyai peluang untuk digolongkan sebagai senyawa yang bersifat antikanker. Menurut Anderson (1991), bahwa senyawa murni dianggap memiliki aktivitas biologi apabila nilai LC50 < 200µg/mL. Namun demikian
untuk lebih memastikan berapa besar aktivitas antikanker dari senyawa isolat perlu dilakukan uji langsung pada sel kanker.
BAB IV SIMPULAN
Kesimpulan
Berdasarkan hasil pembahasan terhadap jurnal penelitian yang berjudul “Senyawa Triterpen Tumbuhan Paku Kamuding dan Potensinya sebagai
Antikanker” oleh Ray Difa dan Suyatno (2012), Jurusan Kimia, FMIPA,
Universitas Negeri Surabaya, maka dapat disimpulkan bahwa:
1. Senyawa triterpenoid yang terkandung pada isolat dari daun tumbuhan paku
Adiantum philippensis L. diduga merupakan senyawa neohop-13(18)-ena
dengan rumus molekul C30H50 dan memiliki struktur sebagai berikut:
2. Senyawa neohop-13(18)-ena positif mempunyai aktivitas sebagai antikanker pada uji pendahuluan menggunakan larva udang laut Artemia salina L. Hal ini dibuktikan dengan nilai LC50 sebesar 67,378 µg/mL.
DAFTAR PUSTAKA
Achmad, S.A. 1986. Kimia Organik Bahan Alam. Jakarta: Universitas Terbuka Ageta, H & Arai, Y., 1990. Chemotaxonomy of Fern 3. Triterpen from
Polypodium polipodiodes. J. Nat. Prod. 53(2) 325-332.
Anonim. 2006. Sekilas tentang senyawa Metabolit Sekunder Non-Fenolik. http://www.chem_is_try.com. Diakses tanggal 10 September 2011.
Anonim. 2010. Fito- kimia Komponen Ajaib Cegah PJK, DM dan Kanker. Amelia (Puslitbang Bogor). Kimia@net.mht. Diakses pada tanggal 02 Januari 2011.
Burhan R.Y.P dan Zetra, Y., 1997. Pencarian Bahan-Bahan Kimia Berguna Dari
Tumbuhan Keluarga Paku-Pakuan sebagai Sumber Prekursor Senyawa Penanda Biologik. Laporan Penelitian. Surabaya : Lemlit ITS. 14-32.
Darmawan, A., Sundowo, A., Fajriah, S., dan Artanti, N. 2006. Uji Aktivitas Antioksidan dan Toksisitas Ekstrak Metanol Beberapa Jenis Benalu.
Jurnal Kimia Indonesia. 1 (1) 1-4.
Difa, Ray dan Suyatno. 2012. Senyawa Triterpen Tumbuhan Paku Kamuding
(Adiantum philippensis L.) dan Potensinya Sebagai Antikanker. Dalam
Seminar Nasional Kimia (SNAKI) 2012
Harborne, J. B. 1996. Metode Fitokimia, Penuntun Cara Modern Menganalisis
Tumbuhan. Penerjemah: Kosasih Padmawinata dan Iwang Sudiro.
Joane, Gilbert. 1989. Cryptograms: Fern and Fern Allies. Jakarta: Pustaka Utama. Lenny, Sofia. 2006. Senyawa Terpenoida dan Steroida. Karya Ilmiah. Medan:
Departemen Kimia FMIPA Universitas Sumatera Utara.
Mubashir, Sofi and Shah, Wajahat A. 2011. Phytocemical and Pharmalogical
Review Profile of Adiantum VenustumI. International Journal of
PharmTech Research. Vol 3(2): 827-830.
Suyatno. 2008. Senyawa Metabolit Sekunder dari Tumbuhan Paku Chingia
sakayensis (Zeiller) Holt dan Aktivitas Sitotoksiknya terhadap Sel Murine
Leukimia P-388 secara in vitro. Disertasi. Program Pascasarjana Universitas Airlangga.
Suyatno. 2011. Keragaman Kimiawi dan Bioaktivitas Metabolit Sekunder dari Tumbuhan Paku (Pteridophyta). Seminar Nasional Kimia. Jurusan Kimia Universitas Negeri Surabaya.