MAKALAH KIMIA ORGANIK BAHAN ALAM
“
SENYAWA β-SITOSTEROL
”
Dosen pengampu : Harrizon, M.Si
OLEH
SINTA ANGGRAINI S
(F1C112003)
MEITRI WULANDARI (F1C112008)
PRODI KIMIA
FAKULTAS SAINS DAN TEKNOLOGI
UNIVERSITAS JAMBI
2015
Puji syukur penulis panjatkan kehadirat Allah SWT, yang mana telah memberikan penulis kekuatan serta kelancaran dalam menyelesaikan makalah untuk memenuhi tugas mata kuliah Kimia Organik Bahan Alam yang berjudul “Senyawa β-Sitosterol”.
Tersusunnya makalah ini tentunya tidak lepas dari peran serta berbagai pihak yang telah memberikan bantuan secara materil dan spiritual, baik secara langsung maupun tidak langsung. Oleh karena itu penulis mengucapkan terima kasih kepada :
1. Bapak Harrizon, M.Si, selaku Dosen pengampu mata kuliah Kimia Organik Bahan Alam.
2. Kedua Orang tua yang telah memberikan bantuan kepada penulis sehingga makalah ini dapat terselesaikan.
3. Teman-teman yang telah membantu dan memberikan dorongan semangat agar makalah ini dapat diselesaikan.
Semoga Tuhan Yang Maha Pengasih dan Penyayang membalas budi baik dari semua pihak yang bersangkutan.
Tak ada gading yang tak retak, untuk itu penulis pun menyadari bahwa makalah yang telah penulis susun masih memiliki banyak kekurangan, baik dari segi teknis maupun non-teknis. Oleh karena itu, penulis mengharapkan kepada semua pihak agar dapat memberikan saran dan kritik yang membangun demi penyempurnaan penulisan mendatang. Akhir kata, semoga makalah ini dapat berguna bagi penulis khususnya dan para pembaca pada umumnya.
Jambi, Juli 2015
DAFTAR GAMBAR
Hal
2.4.1.1 Spot - spot hasil KLT dengan eluen etil asetat 100 %
2.4.2.1 Struktur isomer β-sitosterol
2.4.3.1 Spektrum IR untuk senyawa β-sitosterol dari tanaman
Hygrophila spinosa T. Anders
2.4.3.2 Spektrum IR untuk senyawa β-sitosterol dari kulit batang tanaman kedoya (Dysoxylum gaudichaudianum)
2.4.4.1 Spektrum proton NMR untuk senyawa β-sitosterol dari
tanaman Odontonema strictum(Acanthaceae)
2.4.4.2 Spektrum proton NMR untuk senyawa β-sitosterol dari
kulit batang tanaman kedoya (Dysoxylum gaudichaudianum)
2.4.5.1 Spektrum karbon NMR untuk senyawa β-sitosterol dari
kulit batang tanaman kedoya (Dysoxylum gaudichaudianum)
2.4.5.2 Spektrum HMQC untuk senyawa β-sitosterol dari
kulit batang tanaman kedoya (Dysoxylum gaudichaudianum)
2.4.5.3 Spektrum karbon NMR untuk senyawa β-sitosterol dari
tanaman Odontonema strictum(Acanthaceae)
2.4.6.1 Pola fragmentasi pada spektroskopi massa untuk senyawa
β-sitosterol dari tanaman Hygrophila spinosa T. Anders
DAFTAR TABEL
Hal
2.4.1.1 Harga Rf spot setiap ekstrak buah buncis
2.4.2.1 Hasil KG-MS ekstrak etanol buah buncis
2.4.4.1 Pergeseran kimia dari proton NMR untuk senyawa
β-sitosterol isolat tanaman Hygrophila spinosa T. Anders
I. PENDAHULUAN
I.1 Latar Belakang
β-sitosterol adalah senyawa fitosterol dengan struktur kimia hampir sama dengan struktur kimia kolestrol. Fitosterol terdiri dari 28 hingga 30 atom dengan steroid sebagai rangka struktur dengan gugus hidroksil menempel pada C-3 dari cincin A, dan rantai alifatik pada atom C-17 dari cincin D. β-sitosterol merupakan senyawa fitosterol paling melimpah di alam dan telah digunakan dalam mengendalikan kadar kolesterol plasma (N. Mkhize et.al, 2013).
Berdasarkan penelitian Karan et al. (2012), β-sitosterol digunakan sebagai senyawa anti-oksidan dan anti-diabetes. Bouic et al. (1996) menyatakan bahwa β-sitosterol berperan aktif dalam pengobatan kanker prostat, meningkatkan fungsi sel-sel T dan sel-sel primer pada sistem kekebalan tubuh. Penelitian dari Valini dan Vanithakumari, (1991) menunjukkan aktivitas anti-fertilitas, anti-inflamatory dan anti-pyretik. Hasil penelitian dari Bhaskar et al. (2010) menunjukkan bahwa β-sitosterol terbukti menjadi kemopreventif untuk penderita kanker usus besar dan kanker payudara, menghambat proliferasi sel kanker melalui penurunan ekspresi β, catenin dan PCN A atau mengaktifkan sinyal Fas (Amit Sen, 2012).
Salah satu tanaman yang mengandung senyawa β-sitosterol adalah
Momordica charantia. Momordica charantia termasuk dalam keluarga
Cucurbitaceae, umumnya dikenal dengan nama labu pahit atau karela. Tanaman ini tumbuh subur di India dan didaerah tropis lainnya seperti Asia, Amazon, Afrika Timur, dan Karibia. Momordica charantia dibudidayakan sebagai sayuran dan tanaman obat-obatan. Menurut literatur Ayurveda dari India, Momordica charantia telah banyak digunakan sebagai obat anti-diabetes, anti-kankeraborsi, kontrasepsi, anti-malaria, pencahar, pengobatan eksim, asam urat, sakit kuning, batu ginjal, keputihan, pneumonia, psoriasis, rematik dan kudis.
anti-mikroba, anti-diabetis, anti-inflamasi, anti-oksidan, anti-kanker dan aktivitas farmakologis lainnya pada tanaman ini (Grover and Yadav, 2004).
Tanaman lain yang mengandung senyawa β-sitosterol yakni Hygrophila spinosa T. Anders. Hygrophila spinosa T. Anders (Acanthaceae) telah lama digunakan dalam sistem pengobatan Ayurveda dan sistem Unani. Tanaman ini menandung senyawa-senyawa bioaktif seperti alkaloid, fitosterol (β-sitosterol), glikosida, asam amino, protein, asam fenolat, enzim, vitamin, gula, mineral, flavonoid, terpenoid, dll. Tanaman ini banyak digunakan untuk mengobati berbagai macam penyakit (Arjun Patra, 2010)
Selain dua tanaman sumber senyawa β-sitosterol diatas, dalam makalah ini juga akan dibahas senyawa β-sitosterol yang terdapat pada tanaman lainnya yakni,
Phaseolus vulgaris L, Dysoxylum gaudichaudianum, dan Odontonema Strictum. Akan dibahas pula mengenai teknik isolasi untuk senyawa β-sitosterol, penentuan struktur senyawa yang dilakukan melalui analisis instrumental menggunakan kromatografi Lapis Tipis (KLT), Kromatografi Gas-Spektrometri Massa (KG-SM), Spektroskopi Inframerah, Resonansi Magnit Inti Proton (H-NMR), Resonansi Magnit Inti Karbon (C-NMR), dan Spektroskopi Massa (SM).
Aktivitas farmakologis yang akan dibahas meliputi bioaktivitas β-sitosterol sebagai senyawa mikroba, inflamasi, kanker, oksidan dan anti-diabetes.
I.2 Rumusan Masalah
Adapun rumusan masalah dalam penulisan makalah ini adalah :
1. “Apa saja tanaman yang menjadi sumber senyawa β-sitosterol?” 2. “Bagaimana cara isolasi untuk senyawa β-sitosterol?”
3. “Bagaimana struktur senyawa β-sitosterol?”
4. “Bagaimana cara penentuan struktur untuk senyawa β-sitosterol?”
I.3 Tujuan Penulisan
Tujuan penulisan makalah ini adalah:
1. Mengetahui tanaman - tanaman yang menjadi sumber senyawa β-sitosterol 2. Mengetahui cara isolasi untuk senyawa β-sitosterol
3. Mengetahui struktur senyawa β-sitosterol
4. Mengetahui cara penentuan struktur untuk senyawa β-sitosterol
5. Mengetahui aktivitas-aktivitas farmakologis yang dimiliki oleh senyawa β-sitosterol.
I.4 Manfaat Penulisan
II. PEMBAHASAN
2.4 Penetuan Struktur Senyawa β-sitosterol
Penentuan struktur organik isolat dilakukan melalui beberapa analisis instrumental yakni Kromatografi Gas-Spektrometri Massa (KG-SM), Spektroskopi Inframerah, Resonansi Magnit Inti Proton (H-NMR), Resonansi Magnit Inti Karbon (C-NMR) dan Spektroskopi Massa (SM).
2.4.1 Kromatografi Lapis Tipis
Penelitian dari Jannah, dkk, (2013) menunjukkan bahwa hasil pengamatan di bawah sinar UV dengan λ = 254 nm maupun iodin menunjukkan bahwa residu heksana memiliki spot sejajar terhadap spot senyawa standar stigmasterol (Gambar
2.4.1) dengan harga Rf yang sama dengan senyawa standar stigmasterol yaitu 0,90
(Tabel 2.4.1).
Gambar 2.4.1.1 Spot - spot hasil KLT dengan eluen etil asetat 100 %, (a) tampak
dibawah sinar UV pada λ = 254 nm (b) setelah dimasukkan dalam Iodin
Tabel 2.4.1.1 Harga Rf spot setiap ekstrak buah buncis
Analisis KLT terhadap fraksi ekstrak etanol telah dilakukan oleh peneliti terdahulu dengan pengembang kloroform : metanol (9:1), hasilnya nilai Rf100 dari fraksi
alkohol-6 (A-6) yaitu 85 mendekati nilai Rf100 zat pembanding standar β-sitosterol,
sehingga diduga fraksi tersebut mengandung senyawa β-sitosterol.
2.4.2 Kromatografi Gas-Spektrometri Massa (KG-SM)
Penelitian dari Jannah, dkk, (2013) menunjukkan bahwa hasil pengamatan KG-SM pada ekstrak air maupun hasil partisi buncis (residu n-heksan, residu DCM, ekstrak metanol, dan residu metanol) menunjukkan bahwa tidak ditemukannya senyawa fitosterol. Senyawa-senyawa mayor tersebut mayoritas merupakan senyawa senyawa metabolit primer seperti asam lemak, karbohidrat. Hal ini disebabkan karena metabolit primer merupakan produk essensial yangterdapat pada semua makhluk hidup yang digunakan untuk kelangsungan hidup dan berkembang biak (Ridhia, dkk., 2013), sehingga keberadaanya mutlak ada pada makhluk hidup.
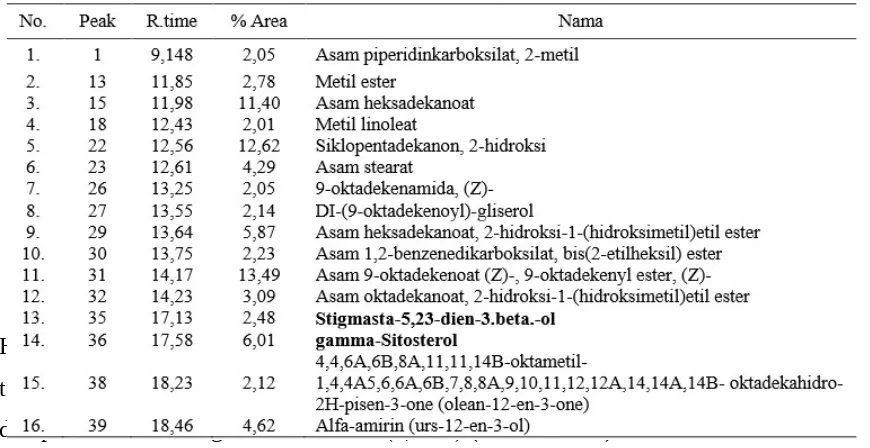
Tabel 2.4.2.1 Hasil KG-MS ekstrak etanol buah buncis
Hasil KG-SM ekstrak etanol buah buncis menunjukkan bahwa senyawa fitosterol terdeteksi pada puncak 35 untuk stigmasterol dengan persen areasebesar 2,48% dan puncak 36 untuk gamma-sitosterol (6,01%) (Tabel 2.4.2.1). Ini membuktikan bahwa di dalam buah buncis mengandung kedua senyawa fitosterol tersebut.
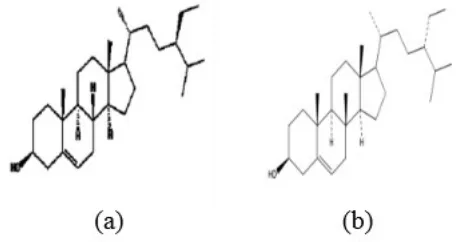
γ-sitosterol (Gambar 2.4.2.1) merupakan stereoisomer dari beta-sitosterol, isomernya terletak pada atom C24 pada β-sitosterol memiliki titik leleh 147-148ºC.
Penelitian terdahulu oleh Tripathi, et al. (2013) pada isolasi γ-sitosterol dalam daun Girardinia heterophylla, telah membuktikan bahwa γ-sitosterol menjadi epimer dari β-sitosterol. Satu-satunya perbedaan dari kedua epimer tersebut adalah adanya substituen C24-etil. C24-etil berada dalam rantai samping
γ-sitosterol.
Gambar 2.4.2.1 Struktur isomer β-sitosterol, (a) β-sitosterol dan (b) γ-sitosterol Berdasarkan hasil penelitian ini, senyawa fitosterol dalam ekstrak air buah buncis ditemukan hanya pada hasil uji fitokimia dan KLT, namun tidak ditemukan pada analisis KG-SM, sedangkan dalam ekstrak etanolbuah buncis keberadaan senyawa fitosterol terdapat pada semua uji, baik uji fitokimia, KLT, maupun KG-SM.
2.4.3 Spektroskopi Inframerah
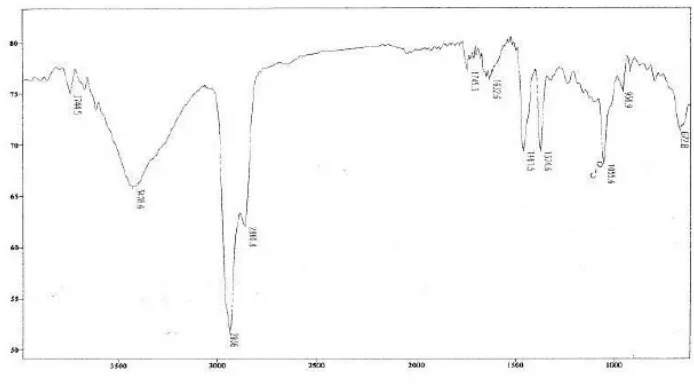
Hasil penelitian Arjun Patra, et.al (2010) menunjukkan data serapan spektroskopi inframerah untuk β-sitosterol sebagai berikut :
Vibrasi ulur OH muncul pada bilangan gelombang 3549,99 cm-1
, vibrasi ulur CH2
sp3 muncul pada bilangan gelombang 2935.73 cm-1 dan vibrasi ulur CH sp3
muncul pada bilangan gelombang 2867.38 cm-1. vibrasi ulur C=C muncul pada
bilangan gelombang 1637.63 cm-1. Interaksi getaran tekuk C-O muncul pada
bilangan gelombang 1063.34 cm-1 (gambar 2.4.3.1)
Gambar 2.4.3.1 Spektrum IR untuk senyawa β-sitosterol dari tanaman
Hygrophila spinosa T. Anders
Penelitian yang dilakukan oleh Tukiran, dkk menunjukkan serapan IR senyawa β-sitosterol dari kulit batang tanaman kedoya hampir sama dengan serapan IR yang dihasilkan oleh penelitian Arjun Patra, et.al (2010).
Gambar 2.4.3.2 Spektrum IR untuk senyawa β-sitosterol dari kulit batang
tanaman kedoya (Dysoxylum gaudichaudianum)
Spektrum IR senyawa hasil isolasi ini (gambar 2.4.3.2) memperlihatkan serapan pada daerah 3429, 2936 – 2861, 1462, 1375, dan 1056 cm-1 yang masing-masing
menunjukkan vibrasi ulur –OH, vibrasi ulur –CH3, –CH2 dan -CH, vibrasi ikatan
2.4.4 Resonansi Magnit Inti Proton (H-NMR)
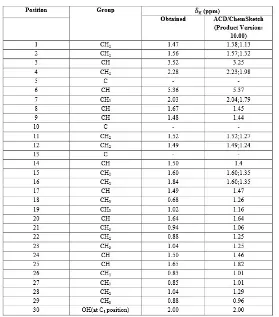
Data pergeseran kimia dari proton NMR untuk senyawa β-sitosterol, hasil penelitian Arjun Patra, et.al (2010) ditampilkan pada tabel 2.4.4.1.
Tabel 2.4.4.1Pergeseran kimia dari proton NMR untuk senyawa β-sitosterol isolat tanaman Hygrophila spinosa T. Anders
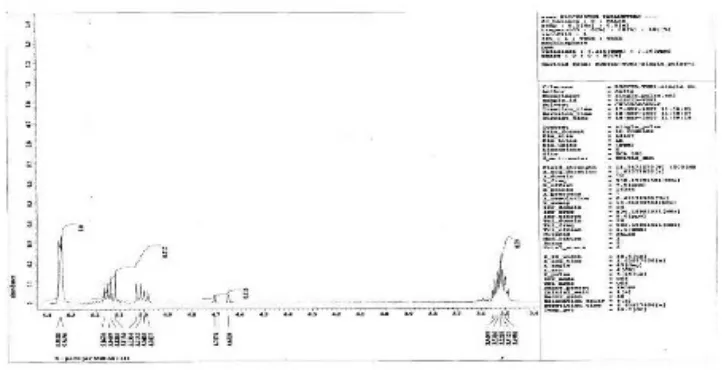
Penelitian yang dilakukan oleh Luhata Lokadi dan Munkombwe (2015) untuk isolasi senyawa β-sitosterol dari tanaman Odontonema strictum (Acanthaceae) menunjukkan adanya pergeseran kimia (proton NMR) pada δ 3.529 ppm dan muncul sinyal dari proton olefin pada δ5.067(m), 5.197 (m), 5.378 (m), dan 2.323(m). Angular proton metil muncul pada pergeseran kimia 0.69(s), 0.80(s) and 1.02(s).
Gambar 2.4.4.1 Spektrum proton NMR untuk senyawa β-sitosterol dari tanaman
Odontonema strictum(Acanthaceae)
Hasil spektrum proton NMR untuk senyawa β-sitosterol dari isolat kulit batang tumbuhan kedoya yang dilakukan oleh Tukiran, dkk hampir sama dengan spektrum dari penelitian Luhata Lokadi dan Munkombwe (2015). Spektrum proton NMR ditunjukkan oleh gambar 2.4.4.2.
Gambar 2.4.4.2 Spektrum proton NMR untuk senyawa β-sitosterol dari kulit
batang tanaman kedoya (Dysoxylum gaudichaudianum)
2.4.5 Resonansi Magnit Inti Karbon (C-NMR)
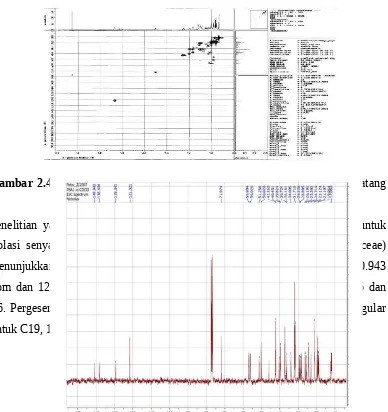
Gambar 2.4.5.1 Spektrum karbon NMR untuk senyawa β-sitosterol dari kulit batang tanaman kedoya (Dysoxylum gaudichaudianum)
Berdasarkan data spektrum 13C-NMR senyawa hasil isolasi yang didukung oleh spektrum H- NMR (2.4.4.2), HMQC (gambar 2.4.5.2) dan DEPT-135, diketahui bahwa kedua senyawa dan senyawab memiliki 29 karbon yang terdiri dari 6 gugus metil (-CH3), 11 gugus metilen (-CH2-), 3 atom karbon kuaterner, dan 1 atom C-OH dengan masing-masing mengandung 8 dan 6 gugus metin (CH)
Gambar 2.4.5.2 Spektrum HMQC untuk senyawa β-sitosterol dari kulit batang
tanaman kedoya (Dysoxylum gaudichaudianum)
Gambar 2.4.5.3 Spektrum karbon NMR untuk senyawa β-sitosterol dari tanaman
Odontonema strictum(Acanthaceae)
Spektrum karbon NMR menunjukkan adanya 29 sinyal yang muncul yakni 9 sinyal metil, 9 sinyal metilen, 11 sinyal metana, dan tiga sinyal karbon kuartener. Karbon alkena muncul pada pergeseran kimia 140,943, 138,404, dan 129,341ppm.
2.4.6 Spektroskopi Massa
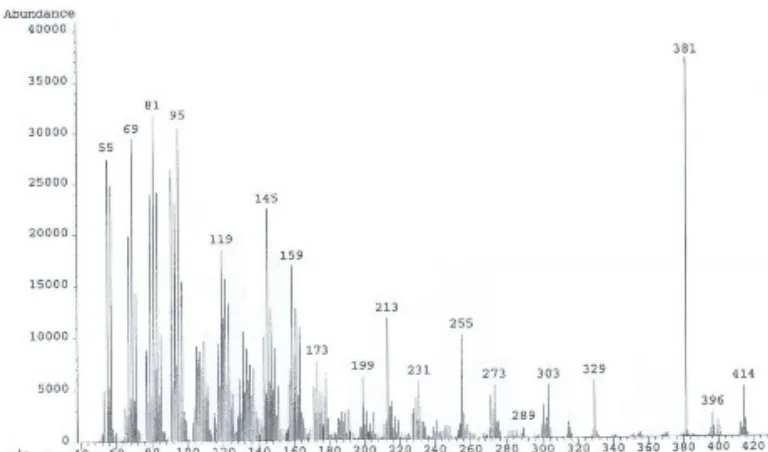
Spektroskopi massa menunjukkan bahwa senyawa β-sitosterol memiliki massa molekul relatif 414 gram/mol dengan rumus molekul (C29H50O) dengan
Gambar 2.4.6.1 Pola fragmentasi pada spektroskopi massa untuk senyawa β-sitosterol dari tanaman Hygrophila spinosa T. Anders
2.5 Aktivitas Farmakologis Senyawa β-Sitosterol 2.5.1 Aktivitas Anti-Mikroba
Aktivitas antimikroba dari senyawa β-sitosterol diuji menggunakan metode difusi cakram. Gentacimin digunakan sebagai kontrol positif. Berdasarkan hasil penelitian Amit Sen, et.al (2012). Aktivitas antimikroba ditentukan dengan cara mengukur ‘zona inhibisi’ disekitar media yang ditambahkan ekstrak tanaman yang mengandung β-sitosterol. Gentacimin menunjukkan adanya zona inhibisi terhadap
E.Coli (18 mm), S. aureus (18 mm), P. aeruginosa (16 mm), K. pneumoniae (17 mm), sementara β-sitosterol menghasilkan zona inhibisi sebesar 14 mm (E. coli), 13 mm (S. aureus), 11 mm (P. aeruginosa), dan 10 mm (K. pneumoniae). Senyawa β-sitosterol memiliki aktivitas antimikroba yang tinggi terhadap bakteri
E.Coli diikuti dengan S. aureus, P. Aeruginosa dan K. pneumoniae pada konsentrasi rendah. Hasil yang sama juga didapatkan dari penelitian sebelumnya, terhadap ekstrak kasar beberapa tanaman yang mengandung β-sitosterol.
2.5.2 Aktivitas Anti-Inflamasi
Penelitian Loizou et.al (2010) menentukan aktivitas β-sitosterol (dosis : 0,1-200 μM) dalam menghambat ekspresi adhesi vaskular dan adhesi intraseluler molekul ELISA pada faktor alfa tumor nekrosis (TNF alfa). Hasil menunjukkan bahwa β-sitosterol mampu menghambat ekspresi adhesi vaskular, maupun adhesi intraseluler molekul ELISA pada faktor alfa tumor nekrosis. Senyawa ini bertindak sebagai inhibitor pada proses fosfolirasi NFkB, yang mana β-sitosterol mampu mengurangi aktivitas transkripsi pada sel makrophag.
2.5.3 Aktivitas Anti-Kanker
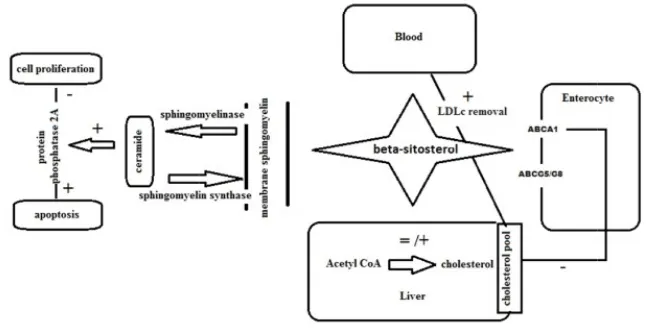
Pada jurnal yang dipublikasikan oleh Ovesna et.al (2004), peneliti melakukan eksperimen penghambatan sel kanker kolon dan sel kanker payudara menggunakan taraxasterol dan β-sitosterol. Mereka menyatakan bahwa senyawa ini dapat memberikan pengaruh yang berbeda pada perkembangan tumor, seperti efek penghambatan pembentukan tumor baru, induksi sel kanker dan menghambat invasi sel dan metastasis. Diagram yang menunjukkan aktivitas anti-kanker dari senyawa β-sitosterol ditunjukkan pada gambar 2.5.3.1.
Gambar 2.5.3.1 Diagram aktivitas anti-kanker dari senyawa β-sitosterol
2.5.4 Aktivitas Anti-Oksidan
β-sitosterol menstimulisasi enzim antioksidan dengan cara mengaktivasi jalur estrogen receptor/PI3-kinase (Soodabeh Saeidnia et.al, 2014).
2.5.5 Aktivitas Anti-Diabetes