LINGKUNGAN PERAIRAN YANG BERBEDA
AbstrakSpons merupakan hewan laut yang dapat menghasilkan senyawa bioaktif yang bermanfaat sebagai antibiotik, antijamur, anti virus, anti kanker, anti inflamasi, dan antioksidan. Tujuan dari penelitian ini adalah mengetahui laju pertumbuhan dan tingkat kelangsungan hidup spons Petrosia nigricans yang ditransplantasikan pada kondisi perairan yang berbeda. Metode transplantasi spons yang dipakai adalah fragmentasi (menanam potongan-potongan spons). Hasil penelitian ini ditemukan hubungan yang erat antara laju
pertumbuhan spons dengan bahan organik total (TOM). Spons yang
ditransplantasikan pada perairan yang tinggi mengandung bahan organik (Pulau Pari) menghasilkan laju pertumbuhan dan kelangsungan hidup yang lebih tinggi dibandingkan perairan yang lebih rendah bahan organik (Pulau Pramuka). Rata-rata laju pertumbuhan panjang spons P. nigricans berkisar antara 4.42±0.066-6.15±0.88 % per bulan. Rata-rata kelangsungan hidup spons berkisar 90.0-100.0%.
Abstract
Sponges is marine organism which able to produce bioactive metabolite as antibiotic, antifungal, antivirus, anticancer, antiinflammation, antioxidant. The aim of the research is to determine growth rate and survival rate of sponge P.
nigricans transplanted in different waters condition. Sponge transplantation use
fragmentation method (by plant fragment of sponge). In our study a strong correlation was found for growth rate with total organic matter. The transplanted sponges in high matter organic water (Pari Island) made better growth rate and gave higher live achievement than in lower matter organic water (Pramuka Island). The average length growth rate of P. nigricans sponge was between 4.42±0.066-6.15±0.88 % per month. The average of sponge survival rate was 90.0 -100.0%.
Pendahuluan Latar Belakang
Spons merupakan biota laut multi sel yang fungsi jaringan dan organnya sangat sederhana. Habitat spons umumnya adalah menempel pada pasir, batu-batuan dan karang-karang mati. Biota laut ini dikenal dengan filter feeder yaitu mencari makanan dengan mengisap dan menyaring air melalui sel cambuk dan memompakan air keluar melalui oskulum. Partikel-partikel makanan seperti bakteri, mikroalga dan detritus terbawa oleh aliran air (Amir dan Budiyanto 1996; Romimohtarto dan Juwana 1999).
Pada beberapa tahun terakhir ini peneliti kimia memperlihatkan perhatian pada spons, karena keberadaan senyawa bahan alam yang dikandungnya. Senyawa bahan alam ini banyak dimanfaatkan dalam bidang farmasi dan harganya sangat mahal dalam katalog hasil laboratorium (Pronzato et al. 1999). Keragaman metabolit sekunder yang dihasilkan spons telah banyak diteliti dan dimanfaatkan untuk menemukan senyawa-senyawa aktif yang berguna bagi dunia pengobatan. Senyawa-senyawa tersebut dapat berupa turunan asam amino dan nukleosida, makrolida, porphirin, terpenoid, gugus alifatik peraoksida dan sterol. Obat-obat yang dihasilkan spons antara lain discodermolide, topsentin, manzamine A, plakortolide, dan berbagai senyawa lainnya yang diketahui bersifat sebagai antikanker, antifungal, anti-inflamasi, anti HIV, penghambat aktivitas enzim dan sifat-sifat lainnya (Proksch et al. 2003; Hadas et
al. 2005; Zheng et al. 2005).
Salah satu langkah alternatif untuk penyediaan bahan baku senyawa bioaktif adalah pengembangan budidaya melalui transplantasi. Metode dilakukan dengan jalan melakukan fragmentasi pada induk spons menggunakan pisau. Setelah itu, fragmen-fragmen dengan ukuran tertentu diletakkan pada suatu substrat, kemudian diletakkan di dasar laut pada kedalaman tertentu untuk ditumbuhkan dan dipelihara. Teknik transplantasi saja belum cukup mengatasi ketersediaan bahan bioaktif spons. Lokasi transplantasi dimana terdapat perbedaan kualitas lingkungan perairan menjadi salah satu faktor yang berpengaruh terhadap pertumbuhan dan kandungan bioaktif spons.
Ada beberapa faktor yang mempengaruhi pertumbuhan dan penyebaran spons. Pada perairan yang kaya nutrien spons akan mengalami pertumbuhan yang lebih cepat. Parameter yang mempengaruhi penyebaran spons adalah kedalaman, intensitas cahaya, pasang surut dan kecepatan arus (Voogd 2005). Parameter lingkungan yang mempengaruhi budidaya spons adalah salinitas, cahaya, oksigen, makanan, dan substrat (Yi et al. 2005). Terdapat korelasi yang positif antara pertumbuhan spons budidaya dengan suhu, biomassa alga dan kandungan karbon dalam bentuk partikel tersuspensi ( Koopmans dan Wijffels 2008).
Bahan organik di perairan mempengaruhi pertumbuhan dan kelangsungan hidup spons. Peneltian budidaya tiga spons di Teluk Awarange, Kabupaten Barru di Sulawesi Selatan menunjukkan pertumbuhan spons tinggi pada nilai TOM 11.21- 16.00 mg/l. Tingginya kandungan TOM digunakan spons
sebagai sumber makanan dengan filter feeder (Rosmiati et al. 2002). Umumnya spons, lamella branchia dan ascidians tumbuh optimal pada kondisi bahan organik 15.0 – 20.0 mg/l air laut (Jorgensen 2008). Tingginya biomassa spons di Karibia menggambarkan tingginya konsentrasi bahan organik. Biomassa populasi spons di Belize Karibia lima kali lebih tinggi dibandingkan di Great Barrier Reef. Perbedaan ini disebabkan spons di Karibia mengkonsumsi sepuluh kali lebih bahan organik dibandingkan spons di Great Barrier Reef (Wilkinson dan Anthony 1990).
Penelitian tentang pertumbuhan dan kelangsungan hidup spons pada kondisi habitat perairan yang berbeda di luar negeri telah banyak dilakukan seperti spons jenis Latrunculia wellingtonensis dan Polymastia croceus yang ditransplantasikan pada dua lokasi dengan laju aliran yang terbuka di Selandia baru (Duckworth dan Battershill 2003); terdapat perbedaan laju pertumbuhan spons Petrosia ficiformis ditransplantasikan pada kedalaman 10m dan 20m (Ferrety et al. 2008). Sedangkan penelitian yang dilakukan di Indonesia masih terbatas jenis Auletta sp (Masak 2003), Aaptos aaptos (Haris 2005) dan
Callyspongia biru (Voogd 2007). Perbedaan penelitian ini dibandingkan
penelitian sebelum adalah spons ditransplantasi dengan kondisi kualitas air dan kedalaman yang berbeda serta pengaruhnya terhadap bioaktivitas antibakteri spons. Oleh karena itu, masih perlu dilakukan penelitian tentang laju pertumbuhan dan kelangsungan hidup spons tropis yang memiliki kandungan bioaktif. Penelitian ini diharapkan dapat dijadikan dasar untuk pengembangan budidaya spons dimasa mendatang, terutama untuk memproduksi bibit dan senyawa bioaktif secara komersial.
Tujuan Penelitian
Tujuan penelitian ini adalah menganalisa laju pertumbuhan dan tingkat kelangsungan hidup spons P. nigricans yang ditransplantasikan pada kondisi perairan yang berbeda.
Metode Penelitian Waktu dan Tempat Penelitian
Penelitian dilapangan bertujuan untuk memperoleh data laju pertumbuhan dan kelangsungan hidup transplantasi P. nigricans berlangsung
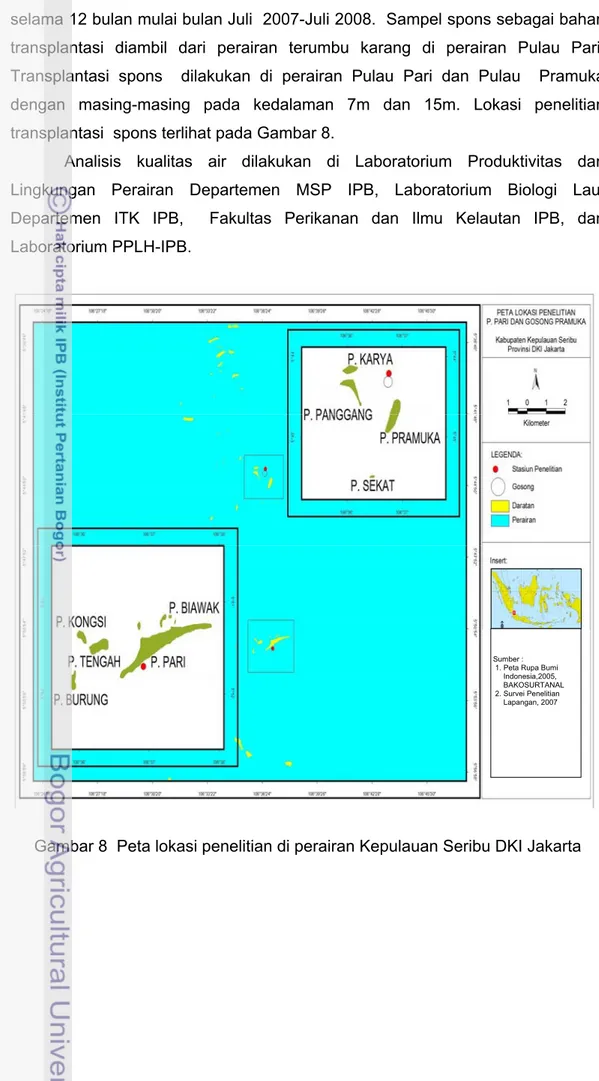
selama 12 bulan mulai bulan Juli 2007-Juli 2008. Sampel spons sebagai bahan transplantasi diambil dari perairan terumbu karang di perairan Pulau Pari. Transplantasi spons dilakukan di perairan Pulau Pari dan Pulau Pramuka dengan masing-masing pada kedalaman 7m dan 15m. Lokasi penelitian transplantasi spons terlihat pada Gambar 8.
Analisis kualitas air dilakukan di Laboratorium Produktivitas dan Lingkungan Perairan Departemen MSP IPB, Laboratorium Biologi Laut Departemen ITK IPB, Fakultas Perikanan dan Ilmu Kelautan IPB, dan Laboratorium PPLH-IPB.
Gambar 8 Peta lokasi penelitian di perairan Kepulauan Seribu DKI Jakarta
Sumber : 1. Peta Rupa Bumi Indonesia,2005, BAKOSURTANAL 2. Survei Penelitian Lapangan, 2007
Bahan dan Alat
Bahan dan Alat untuk Pengukuran Parameter Lingkungan
Bahan yang digunakan untuk pengukuran parameter lingkungan antara lain adalah: kalium permanganat, formalin, tiosulfat, sedangkan alat antara lain adalah: floating drouge, botol sampel, buret, pipet tetes, pipet volumetrik, gelas beker, turbidimeter, termometer, spektrofotometer, cool box, kenmerer water sampler, pH meter dan GPS.
Bahan dan Alat Penelitian untuk Transplantasi
Bahan yang digunakan untuk transplantasi antara lain adalah: spons laut dari Perairan Pulau Pari jenis P. nigricans, pelampung, kawat tembaga, rangka besi (1m x 1m) sedangkan alat antara lain adalah: peralatan selam SCUBA (Self Contained Underwater Breathing Apparatus), pisau cutter, caliper (jangka sorong), pisau, dan kamera nikonus V.
Penentuan Lokasi Penelitian
Lokasi penelitian dibagi atas dua stasiun yaitu yang masing-masing mewakili perairan Pulau Pari dan di Pulau Pramuka. Pulau Pari pada posisi 5 o51’56.3” LS – 106 o37’01.6” BT dan Pulau Pramuka 06o45’6” LS -106o32‘45” BT. Pulau Pari merupakan gugusan pulau yang terdiri dari 5 pulau yaitu Pulau Tikus, Pulau Burung, Pulau Kongsi, Pulau Tengah dan Pulau Pari. Gosong Pramuka sebagai tempat rak-rak transplantasi spons terletak disebelah utara Pulau Pramuka. Penentuan lokasi didasarkan atas perbedaan kondisi variabel fisika, dan kimia perairan yang nyata dari kedua pulau tersebut. Pulau Pari yang letaknya lebih dekat daratan (Jakarta) mewakili perairan yang banyak mendapat masukan zat hara (nutrien) dari Teluk Jakarta dan perairan Gosong Pramuka mewakili perairan lebih jauh dari daratan. Perairan Pulau Pari dan Pulau Pramuka berjarak ±11.26 mill dan ± 20.12 mill dari daratan terdekat.
Kualitas Lingkungan Perairan
Pengukuran kualitas air dilakukan sekali sebulan selama 12 bulan pada kedalaman 7m dan 15m tempat spons ditransplantasikan. Parameter- parameter yang diukur langsung di lapangan meliputi kecepatan arus, suhu air, pH,
salinitas, kecerahan, dan DO, sedangkan parameter yang diukur dilaboratorium meliputi nitrat, fosfat, TSS, dan TOM (Tabel 5).
Tabel 5 Parameter kualitas air, metode dan tempat pengukuran
Parameter Satuan Alat/Metode Tempat Pengukuran
Fisika
Suhu oC Termometer In-Situ
Kecerahan m Sechi disc In-Situ
Kecepatan arus m/dt Floating drouge In-Situ
Kimia
Salinitas ‰ Refraktometer In-Situ
pH - pH meter In-Situ
TSS mg/l Gravimetrik Laboratorium
TOM mg/l Titrimetrik Laboratorium
DO mg/l Alat titrasi In-Situ
Fosfat mg/l Spektrofotometer Laboratorium
Nitrat mg/l Spektrofotometer Laboratorium
Identifikasi Spons
Identifikasi spons laut yang dijadikan hewan uji didasarkan pada petunjuk (Voogd dan Soest 2002), dan Hooper (2000).
Metode Transplantasi
Metode transplantasi didasarkan modifikasi penelitian (Duckworth et al. 1999). Spons dipotong secara in situ dan disisakan sekitar 30 % dari volume awal, untuk memberikan kesempatan beregenerasi. Semua spons dikumpulkan dan dipotong dalam air laut. Fragmen dipotong berbentuk kubus dengan ukuran kira-kira (5 cm x 5 cm x 5 cm) dan berat sekitar 30 gram. Semua fragmen paling sedikit mempunyai satu sisi yang tidak terpotong, dengan seluruh pinacoderm dan oskula.
Induk spons berasal dari sumber lokasi yang sama yaitu berasal dari Pulau Pari. Setelah spons dipotong sesuai ukuran diatas dan ditransplantasikan pada lokasi perairan Pulau Pari dan Pulau Pramuka.
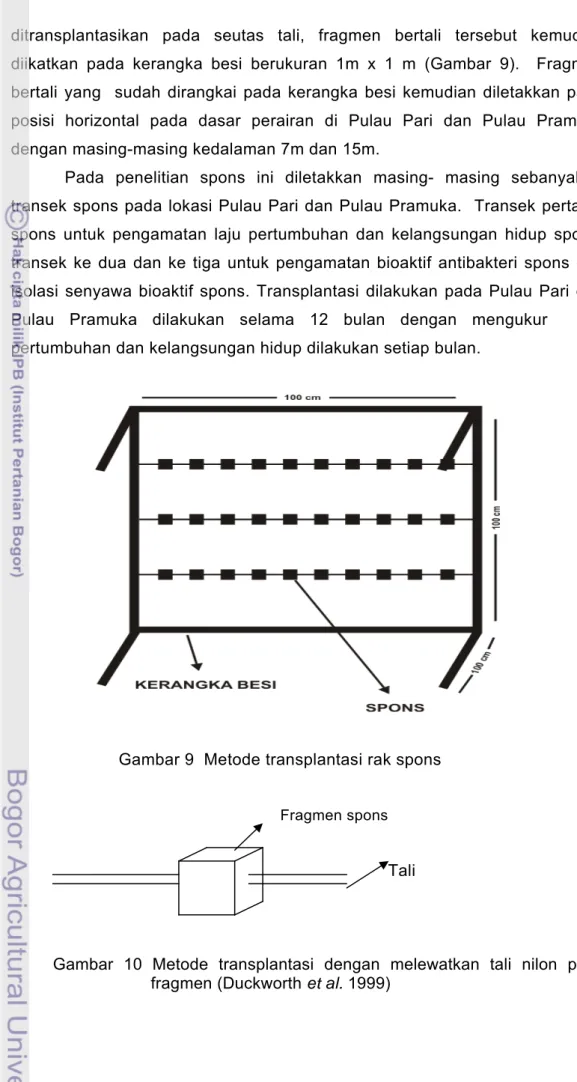
Metode transplantasi spons yang dipakai pada penelitian ini adalah metode transplantasi dengan cara spons dilewatkan pada seutas tali polyetilen (diameter 4 mm) ditengahnya. Jarak antara satu fragmen spons dengan fragmen spons lainnya pada seutas tali adalah sekitar 10 cm dan jarak antar tali satu dengan yang lainnya sekitar 33 cm. Setelah fragmen
ditransplantasikan pada seutas tali, fragmen bertali tersebut kemudian diikatkan pada kerangka besi berukuran 1m x 1 m (Gambar 9). Fragmen bertali yang sudah dirangkai pada kerangka besi kemudian diletakkan pada posisi horizontal pada dasar perairan di Pulau Pari dan Pulau Pramuka dengan masing-masing kedalaman 7m dan 15m.
Pada penelitian spons ini diletakkan masing- masing sebanyak 3 transek spons pada lokasi Pulau Pari dan Pulau Pramuka. Transek pertama spons untuk pengamatan laju pertumbuhan dan kelangsungan hidup spons, transek ke dua dan ke tiga untuk pengamatan bioaktif antibakteri spons dan isolasi senyawa bioaktif spons. Transplantasi dilakukan pada Pulau Pari dan Pulau Pramuka dilakukan selama 12 bulan dengan mengukur laju pertumbuhan dan kelangsungan hidup dilakukan setiap bulan.
Gambar 9 Metode transplantasi rak spons Fragmen spons
Tali
Gambar 10 Metode transplantasi dengan melewatkan tali nilon pada fragmen (Duckworth et al. 1999)
Laju Pertumbuhan
Pengukuran yang dilakukan adalah pengukuran panjang, lebar dan tebal spons secara langsung dalam air. Pengukuran ini menggunakan jangka sorong (caliper). Pengukuran dilakukan terhadap 30 buah spons dalam rak transplantasi per lokasi (Tabel 6).
Laju pertumbuhan yang diukur adalah laju pertumbuhan relatif. Rumus laju pertumbuhan spons dirujuk oleh Ferretti et al. (2009) dari Duckworth dan Battershill (2001). Rumus laju pertumbuhan dari Duckworth dan Battershill (2001) dimodifikasi dengan mengalikan 100% untuk menyatakan persentase laju pertumbuhan spons. Laju pertumbuhan (% per bulan) dihitung dari tiap sampel spons menggunakan rumus:
GR = (Vm-Vm-1) X 100%
(Vm-1)n
Dimana:
GR = Laju pertumbuhan (% per bulan)
Vm = Panjang/Lebar/Tebal spons yang diukur pada bulan m
Vm-1 = Panjang/Lebar/Tebal yang diukur pada bulan m-1
n = Jumlah bulan diantara dua pengamatan
Kelangsungan Hidup
Pengukuran tingkat kelangsungan hidup spons diakhir penelitian adalah dengan membandingkan jumlah fragmen spons yang hidup diakhir penelitian dan jumlah fragmen spons pada awal penelitian. Rumus yang digunakan adalah:
Dimana: S = Kelangsungan hidup spons (%)
Nt = Jumlah spons yang hidup pada akhir penelitian No = Jumlah spons pada awal penelitian
Tabel 6. Jumlah sampel dalam rak transplantasi untuk pengukuran pertumbuhan Lokasi Rak Spons ke n Jumlah (Buah) Pari 7m 1 2 3 4 5 6 7 8 9 10 …….30 30 Pari 15m 1 2 3 4 5 6 7 8 9 10 …….30 30 Pramuka 7m 1 2 3 4 5 6 7 8 9 10 …….30 30 Pramuka 15m 1 2 3 4 5 6 7 8 9 10 …….30 30 Jumlah Total 120
S = Nt x 100%
No
Analisis Data
Laju Pertumbuhan dan Kelangsungan Hidup
Analisis pengaruh kedalaman lokasi dan waktu (bulan) terhadap laju pertumbuhan dan kelangsungan hidup spons dilakukan dengan analisa Varian (Anova) dengan Rancangan Acak Kelompok (RAK) dengan model linier (Steel dan Torrie 1993) sebagai berikut:
Yij = µ + Ji + Dj + εij
Yij = Respon laju pertumbuhan/kelangsungan hidup pada waktu ke i, kedalaman lokasi ke j
µ = Rataan umum Ji = Pengaruh waktu ke i
Dj = Pengaruh kedalaman lokasi ke j
εij = Pengaruh acak pada waktu ke -i dan kedalaman lokasi ke-j
Uji lanjut yang digunakan adalah uji Beda Nyata Terkecil (BNT0.05) pada selang kepercayaan 95% dengan rumus sebagai berikut (Steel dan Torrie 1993):
BNT
α
=(tα
)* (Sd)Sd = √2S2/r
Diji = Xi-Xj
Dimana: Xi dan Xj adalah rataan perlakukan ke-i dan ke-j
Dij = perbedaan /selisih rata-rata antar perlakukan ke-i dan ke -j sd = galat baku beda rata-rata
r = banyaknya ulangan yang sama untuk kedua perlakukan S2 = kuadrat tengah galat
t
α
= t tabel pada taraf nyataα
/2 dengan n (derajat bebas)Penggunaan rancangan Rancangan Acak Kelompok dalam penelitian ini adalah pengelompokan berdasarkan waktu pengamatan (bulan). Perlakuan kedalaman berdasarkan lokasi perairan di Pramuka yang lebih jauh dari daratan (Teluk Jakarta) dan perairan Pulau Pari yang lebih dekat dengan daratan (Teluk Jakarta) sebagai daerah yang lebih banyak mendapat masukan nutrien.
Pengujian hipotesis dilakukan dengan uji F untuk melihat pengaruh waktu dan kedalaman lokasi terhadap laju pertumbuhan dan kelangsungan hidup spons. Analisis lebih lanjut dengan uji Beda Nyata Terkecil (BNT) untuk rancangan kelompok lengkap teracak dilakukan jika hasil uji F berbeda nyata. Jika D<BNT berarti selisih rata-rata antar perlakuan tidak berbeda nyata, dan bila D>BNT maka selisih rata-rata antar perlakuan berbeda nyata.
Kualitas Air
Perbedaan kualitas air pada kedua lokasi penelitian diuji dengan uji t berpasangan ditentukan dengan membandingkan parameter kualitas air Pulau Pramuka dan Pulau Pari. Rumus uji t berpasangan (Walpole 1995):
Dimana : t = uji berpasangan x1 = rata- rata populasi 1 x2 = rata-rata populasi 2 d0 = µ1- µ2
µ = nilai tengah populasi s2p = ragam populasi gabungan
Keterkaitan Laju Pertumbuhan Spons dan Kualitas Air
Untuk melihat keterkaitan antara laju pertumbuhan spons dengan kualitas air, digunakan analisis statistik multivariat yang berdasarkan Analisis Komponen Utama atau Principal Component Analysis; PCA (Legendre dan Legendre 1983; Ludwig dan Reynolds 1988).
Hasil dan Pembahasan Kualitas Lingkungan Perairan
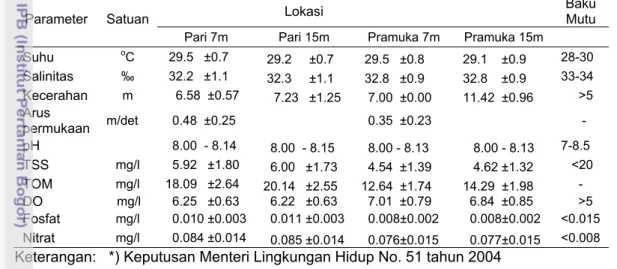
Parameter lingkungan perairan yang diamati meliputi suhu, kecerahan, kecepatan arus permukaan, salinitas, derajat keasaman (pH), padatan tersuspensi total (TSS), kelarutan oksigen (DO), fosfat dan nitrat. Pengukuran kualitas air dilakukan selama satu tahun mulai bulan Juli 2007 sampai Juli 2008. Secara umum hasil pengukuran kualitas perairan (suhu, kecerahan, kecepatan arus permukaan,TSS, DO, fosfat dan nitrat) memperlihatkan adanya variasi
t = (X1 –X2 )-d0 Sp√(1/n1) + (1/n2) S2p = (n1-1)S 2 1+(n2-1)S22 n1+n2-2
antara lokasi penelitian (Tabel 7). Hasil uji t berpasangan terhadap parameter fisika-kimia lingkungan (kecerahan, kecepatan arus, TSS, DO, nitrat, dan fosfat) antara lokasi penelitian menunjukkan perbedaan yang nyata (P<0.05) dan tidak berbeda nyata antara kedalaman perairan (P>0.05). Nilai suhu, salinitas dan pH tidak menunjukkan perbedaan nyata antara lokasi dan kedalaman perairan (P>0.05). Sedangkan nilai TOM menunjukkan perbedaan yang nyata (P<0.05) antara lokasi dan kedalaman perairan Pulau Pari dan Pramuka. Hasil pengukuran parameter kualitas air menunjukkan nilai yang masih berada di bawah ambang batas baku mutu, kecuali konsentrasi nitrat.
Tabel 7 Rata-rata hasil pengukuran parameter kualitas air selama penelitian di perairan Pulau Pari dan Pulau Pramuka.
Parameter Satuan Lokasi Baku Mutu
Pari 7m Pari 15m Pramuka 7m Pramuka 15m
Suhu oC 29.5 ±0.7 29.2 ±0.7 29.5 ±0.8 29.1 ±0.9 28-30 Salinitas ‰ 32.2 ±1.1 32.3 ±1.1 32.8 ±0.9 32.8 ±0.9 33-34 Kecerahan m 6.58 ±0.57 7.23 ±1.25 7.00 ±0.00 11.42 ±0.96 >5 Arus permukaan m/det 0.48 ±0.25 0.35 ±0.23 - pH 8.00 - 8.14 8.00 - 8.15 8.00 - 8.13 8.00 - 8.13 7-8.5 TSS mg/l 5.92 ±1.80 6.00 ±1.73 4.54 ±1.39 4.62 ±1.32 <20 TOM mg/l 18.09 ±2.64 20.14 ±2.55 12.64 ±1.74 14.29 ±1.98 - DO mg/l 6.25 ±0.63 6.22 ±0.63 7.01 ±0.79 6.84 ±0.85 >5 Fosfat mg/l 0.010 ±0.003 0.011 ±0.003 0.008±0.002 0.008±0.002 <0.015 Nitrat mg/l 0.084 ±0.014 0.085 ±0.014 0.076±0.015 0.077±0.015 <0.008
Keterangan: *) Keputusan Menteri Lingkungan Hidup No. 51 tahun 2004
Perairan Teluk Jakarta dan Kepulauan Seribu berada di bawah pengaruh angin musim (monsoon) yang menurut Wyrtki (1961) dapat dibagi menjadi:
a. Musim Barat berlangsung dari bulan Desember hingga Februari, merupakan musim hujan;
b. Musim peralihan ke Musim Timur atau Musim peralihan I dari bulan Maret hingga Mei;
c. Musim Timur berlangsung bulan Juni hingga Agustus merupakan musim kemarau;
d. Musim peralihan ke Musim Barat atau Musim Peralihan II berlangsung mulai bulan September hingga Nopember.
Suhu
Pengukuran suhu pada kedalaman 7m dan 15m di perairan Pulau Pramuka dan Pari menunjukkan nilai yang tidak bervariasi. Hasil penelitian
menyatakan rata-rata suhu antara kedalaman lokasi berkisar antara 29.1±0.9oC sampai 29.5±0.7oC. Rata-rata suhu yang tinggi terjadi pada musim timur dengan nilai rata-rata 30.1±0.3oC dan suhu yang rendah pada musim barat dengan nilai 28.5±0.5oC (Lampiran 1). Hasil uji t berpasangan menunjukkan bahwa nilai suhu antara lokasi dan kedalaman tidak menunjukkan perbedaan yang nyata (p>0.05)(Lampiran 2). Berdasarkan hasil pengamatan suhu terendah terjadi pada musim barat dan suhu tertinggi terjadi pada musim timur. Variasi bulanan dengan suhu terendah terjadi pada musim barat dikarenakan curah hujan yang tinggi, angin yang kencang dan awan yang tebal. Penelitian Rudi (2006) menyatakan nilai suhu terendah terjadi pada musim barat dan nilai suhu tertinggi pada musim timur dan Nontji (1984) suhu rendah pada musim barat.
Suhu perairan yang tidak bervariasi diantara kedalaman lokasi karena masih dalam lapisan perairan yang homogen. Ilahude (1999) menyatakan lapisan homogen suhu air umumnya sama mulai dari permukaan laut hingga kedalaman 100m. Keadaan yang homogen dicapai karena adanya pengaruh kegiatan angin, gelombang dan turbelensi yang mengaduk massa air di lapisan ini sehingga suhu hampir homogen. Di daerah tropis suhu lapisan homogen berkisar di sekitar 29 oC. Wyrtki (1961) menyatakan lapisan homogen dimulai dari permukaan hingga kedalaman 50-100m dengan nilai suhu berkisar 26-30 oC.
Salinitas
Hasil pengukuran terhadap salinitas di lokasi penelitian memperlihatkan kisaran nilai yang tidak terlalu besar yaitu antara 30.0-34.0‰ (Lampiran 3). Salinitas yang tinggi terjadi pada bulan September-Nopember (musim peralihan II) dengan nilai rata-rata 33.5±0.3‰ dan salinitas yang rendah pada bulan Desember-Februari (musim barat ) dengan nilai 31.2±0.8‰. Rata-rata nilai salinitas di perairan Pramuka lebih tinggi dari pada perairan Pulau Pari. Hasil uji t berpasangan menunjukkan nilai salinitas antara lokasi penelitian dan antara kedalaman perairan Pulau Pramuka dan Pulau Pari tidak menunjukan perbedaan yang nyata (p> 0.05)(Lampiran 4).
Berdasarkan hasil pengamatan salinitas nilai yang rendah terjadi pada musim barat (Januari-Februari) dan nilai salinitas yang tinggi terjadi pada peralihan II (September-Nopember). Hasil penelitian salinitas terlihat bahwa salinitas perairan Pulau Pari lebih rendah dari pada Pulau Pramuka. Hal ini karena lokasi spons di perairan Pulau Pari yang lebih dekat dengan daratan
sehingga lebih banyak mendapat masukan air tawar dari muara sungai di Teluk Jakarta dan Tangerang. Salinitas terendah terjadi pada bulan Januari karena pada waktu ini adalah musim penghujan. Penelitian Rudi (2006) dan Nontji (1984) salinitas lebih rendah terjadi pada musim barat (musim hujan). Spons hidup pada salinitas 28.00 – 34.00‰ (Voogd 2005). Salinitas maksimum di Teluk Jakarta hampir selalu dijumpai pada bulan Nopember, selain disebabkan karena pengaruh meterologi setempat, juga disebabkan karena pengaruh air yang bersalinitas tinggi dari Laut Flores yang dibawa oleh arus musim timur (Juni- Agustus) baru mencapai mencapai Teluk Jakarta bulan Nopember (Nontji, 1984). Wyrtki (1961) menyatakan setiap tahun Laut Jawa mengalami perubahan dua kali perubahan musim yang nyata. Pada musim timur arus utama di Laut Jawa bergerak ke barat membawa air dengan salinitas tinggi yang masuk dari Laut Flores.
Kecerahan
Kecerahan merupakan ukuran transparansi yang dipengaruhi oleh keadaan cuaca, waktu pengukuran, kekeruhan dan padatan tersuspensi. Hasil penelitian menyatakan kecerahan antara lokasi penelitian berkisar antara 5.50m sampai 13.50m. Rata-rata kecerahan yang tinggi terjadi pada peralihan II dengan nilai rata-rata 8.96±2.73m dan kecerahan yang rendah pada musim barat dengan nilai 7.17±1.85m. Rata-rata nilai kecerahan di perairan Pramuka lebih tinggi dari pada perairan Pulau Pari (Lampiran 5). Hasil uji t berpasangan menunjukkan nilai kecerahan antara lokasi penelitian menunjukkan perbedaan yang nyata (p<0.05)(Lampiran 6).
Berdasarkan hasil pengamatan kecerahan yang rendah terjadi pada musim barat (Desember-Februari) dan kecerahan yang tinggi terjadi pada musim peralihan I (Maret-Mei) dan Peralihan II (September-Nopember). Nontji (1984) mengemukakan bahwa perairan Teluk Jakarta bagian barat pada musim peralihan biasanya tenang dan kecerahan maksimum, sedangkan pada musim barat dengan angin dan ombak besar dengan kecerahan biasanya menurun.
Arus Permukaan
Hasil penelitian menyatakan rata-rata kecepatan arus permukaan yang tinggi terjadi pada bulan Desember- Februari (musim barat) dengan nilai rata-rata 0.80±0.11 m/det dan kecepatan arus yang rendah pada bulan Maret-Mei
(musim peralihan I) dengan nilai 0.21±0.07 m/det. Rata-rata nilai kecepatan arus permukaan di perairan Pramuka lebih rendah dengan nilai 0.36 ±0.23 m/det daripada perairan Pulau Pari dengan nilai 0.48 ±0.25 m/det (Lampiran 7). Hasil uji t berpasangan menunjukkan nilai kecepatan arus permukaan antara lokasi penelitian menunjukkan perbedaan yang nyata (p<0.05 (Lampiran 8).
Berdasarkan hasil pengamatan rata-rata kecepatan arus permukaan yang rendah terjadi pada musim peralihan I (Maret-Mei) dan peralihan II (September- Nopember) dan kecepatan arus yang tinggi terjadi pada musim barat (Desember-Januari). Hasil penelitian rata-rata kecepatan arus permukaan terlihat bahwa kecepatan arus Pramuka lebih rendah dari pada Pulau Pari. Hal ini karena lokasi spons di Pramuka terletak pada perairan Gosong yang lebih terlindung dari perairan Pulau Pari yang lebih terbuka. Pardjaman (1977) arus laut pada Teluk Jakarta pada musim barat berkecepatan rata-rata 0.75 m/det dengan arah barat ke tenggara sedangkan pada musim timur terjadi sebaliknya dengan arus yang lebih lemah. Penelitian Rudi (2006) di perairan Pulau Lancang, Payung dan Pari kecepatan arus berkisar antara 0.18-0.82 m/det, musim barat arus bergerak dari barat laut menuju ke bagian tenggara. Sebaliknya selama musim timur arus laut secara umum dari timur menuju bagian barat dan barat laut. Pada musim peralihan I dan Peralihan II kecepatan arus cenderung menurun dan arahnya relatif berubah.
Derajat Keasaman (pH)
Hasil pengamatan pH perairan di Pulau Pramuka dan Pari berkisar antara 8.00 sampai 8.15. Nilai pH antara di perairan Pramuka dan perairan Pulau Pari tidak jauh beda (Lampiran 9). Hasil uji t berpasangan menunjukkan nilai pH antara lokasi dan kedalaman penelitian menunjukkan nilai pH yang tidak berbeda yang nyata (p> 0.05)(Lampiran 10).
Berdasarkan hasil pengamatan nilai pH antara musim dan kedalaman 7 m dan 15 m adalah tidak berbeda nyata (homogen). Pada umumnya pH air laut tidak banyak bervariasi, karena adanya sistem karbon dioksida dalam air laut mempunyai kapasitas penyangga (buffering capacity) yang kuat. Ini berarti bahwa pH air laut tidak mudah mengalami perubahan. Menurut Millero dan Sohn (1992) air laut mempunyai kemampuan sebagai penyangga (buffer) dalam mempertahankan pH air laut untuk selalu basa dan sehingga nilainya relatif stabil dan sistem ini dikenal dengan sistem karbonat air laut.
Nilai pH yang terendah yang teramati terjadi pada bulan Januari bertepatan dengan musim barat dan musim hujan. Penelitian lain di Kepulauan Seribu dilaporkan bahwa nilai pH berkisar 7.60-8.16 dengan nilai tertinggi pada musim peralihan ke timur dan terendah pada musim barat (Rudi 2006). Nontji (1984) nilai di Teluk Jakarta dan sekitarnya berkisar antara 7.53-8.51 dengan nilai pH terendah pada bulan Januari. Helfinalis (2004) penelitian di perairan Teluk Jakarta dan Kepulauan Seribu, nilai pH berkisar antara 7.56-8.50 dengan rata-rata nilai pH antara permukaan laut dan dasar tidak ada perbedaan.
Padatan Tersuspensi Total (TSS)
Padatan tersuspensi total (Total Suspended Solid/TSS) adalah bahan-bahan tersuspensi (diameter>1µm) yang tertahan pada saringan millipore dengan diameter pori 0.45 µm. TSS terdiri atas lumpur dan pasir halus serta jasad-jasad renik, yang terutama disebabkan oleh kikisan tanah atau erosi tanah yang terbawa badan air (Effendi 2003). Hasil pengamatan TSS perairan berkisar antara 2.0 mg/l sampai 9.0 mg/l. Rata-rata TSS adalah diperairan Pramuka 7m (4.54±1.39 ), Pramuka 15m (4.62±1.32), Pari 7m (5.92±1.80) dan Pari 15m (6.00±1.73) Lampiran 11. Nilai TSS yang relatif tinggi bulan Desember sampai Februari (musim barat) sebesar 6.92±0.99 dan TSS yang relatif rendah terjadi pada bulan September sampai Nopember (peralihan II) 4.00±0.95 dan Maret sampai Mei (peralihan I) 3.50±0.52. Hasil uji t menunjukkan perbedaan yang nyata pada (p<0.05) antara lokasi perairan Pramuka dan Pari sedangkan antara kedalaman perairan Pulau Pramuka 7m dengan Pramuka 15m dan perairan Pulau Pari 7m dengan Pari 15m tidak menunjukan perbedaan yang nyata (p>0.05) (Lampiran 12).
Nilai TSS yang tinggi teramati terjadi pada bulan Januari bertepatan dengan musim barat dan musim hujan, dimana angin dan arus lebih kencang sehingga perairan mudah teraduk dan masukkan padatan tersuspensi dari Teluk Jakarta lebih besar. Nilai TSS perairan Pulau Pari lebih tinggi dibandingkan dengan Pulau Pramuka disebabkan jarak Pulau Pari lebih dekat ke Teluk Jakarta yang banyak mendapat masukan padatan tersuspensi dari daratan dibandingkan dengan perairan Pramuka. Penelitian Rudi (2006) nilai TSS perairan di Kepulauan Seribu berkisar antara 3.00-10.00 mg/l. Canter dan Hill (1981) memperlihatkan hubungan antara indeks kualitas air dengan kandungan muatan
padatan tersuspensi. Kandungan 3.00-10.00 mg/l merupakan kategori yang baik untuk kualitas lingkungan perairan.
Bahan Organik Total (TOM)
Hasil pengamatan TOM perairan berkisar antara 10.70 mg/l sampai 24.45 mg/l. Rata-rata TOM diperairan Pramuka 7m (12.64±1.74 mg/l), Pramuka 15m (14.29±1.98 mg/l), Pari 7m (18.09±2.64 mg/l) dan Pari 15m (20.14±2.55 mg/l). Nilai TOM yang relatif tinggi bulan Desember sampai Februari (musim barat) dan TOM yang relatif rendah terjadi pada bulan September-Nopember (peralihan II) 14.41±2.83 mg/l dan Maret-Mei (peralihan I)14.51±2.95 mg/l (Lampiran 13). Hasil uji t menunjukkan perbedaan yang nyata pada (p<0.05) antara lokasi dan kedalaman di perairan Pulau Pramuka dan Pari (Lampiran 14).
Nilai rata-rata TOM tertinggi yang teramati terjadi pada bulan Januari bertepatan dengan musim hujan, masukkan bahan organik dari muara sungai ke Teluk Jakarta lebih besar. Nilai TOM perairan Pulau Pari lebih tinggi dibandingkan dengan Pulau Pramuka disebabkan jarak Pulau Pari lebih dekat ke Teluk Jakarta yang banyak mendapat masukan bahan organik dari daratan dibandingkan dengan perairan Pramuka. Penelitian Rudi (2006) nilai TOM di perairan Lancang, Pari dan Payung berkisar antara 10.11-20.42 mg/l.
Kelarutan Oksigen (DO)
Hasil pengukuran terhadap DO di lokasi penelitian memperlihatkan kisaran nilai DO yaitu antara 5.52-7.96 mg/l. Rata-rata DO tertinggi terjadi pada musim barat dengan nilai rata-rata 7.54±0.35 mg/l dan DO terendah pada musim peralihan II dengan nilai 5.87±0.21 mg/l. Rata-rata nilai DO di perairan Pramuka lebih tinggi dari pada perairan Pulau Pari (Lampiran 15). Hasil uji t berpasangan menunjukkan nilai DO antara lokasi penelitian menunjukkan perbedaan yang nyata (p<0.05), kecuali nilai DO antar kedalaman Pramuka 7m dan Pramuka 15m serta serta Pari 7m dan Pari 15m pada (p> 0.05) Lampiran 16.
Berdasarkan hasil pengamatan nilai DO yang tinggi terjadi pada musim barat (Desember-Februari) dan nilai DO yang rendah terjadi pada peralihan 1 dan musim peralihan 2. Nilai DO antar kedalaman 7m dan 15m tidak berbeda nyata. Hasil penelitian terlihat bahwa DO perairan Pulau Pari lebih rendah dari pada Pulau Pramuka. Hal ini karena lokasi spons di perairan Pulau Pari yang
lebih dekat dengan daratan sehingga lebih banyak mendapat masukan bahan organik yang dapat menurunkan DO perairan. DO yang tinggi terjadi pada bulan Januari karena pada waktu ini adalah musim barat dimana terjadi gelombang dan arus yang besar sehingga kelarutan oksigen di perairan bertambah.
Kelarutan oksigen diperairan dipengaruhi oleh suhu dan dekomposisi bahan organik. Perairan yang kaya bahan organik memerlukan oksigen yang banyak untuk proses dekomposisi bahan organik tersebut. Oksigen yang tidak cukup tersedia akan berpengaruh terhadap kehidupan biota laut. Salmin (2005) menyatakan oksigen memegang peranan penting sebagai indikator kualitas perairan, karena oksigen terlarut berperan dalam proses oksidasi dan reduksi bahan organik dan anorganik. Dalam kondisi anaerobik, peranan oksigen adalah untuk mengoksidasi bahan organik dan anorganik dengan hasil akhir adalah nutrien yang dapat menyuburkan perairan.
Fosfat
Hasil pengukuran terhadap fosfat di lokasi penelitian berkisar antara 0.005-0.018 mg/l. Rata-rata fosfat yang tinggi terjadi pada musim barat dengan nilai rata-rata 0.013±0.003 mg/l dan nilai fosfat yang rendah pada musim timur dengan nilai 0.005±0.001 mg/l. Rata-rata nilai fosfat di perairan Pari lebih tinggi dari pada perairan Pulau Pramuka. (Lampiran 17). Hasil uji t berpasangan menunjukkan nilai fosfat antara lokasi penelitian menunjukkan perbedaan yang nyata (p<0.05), kecuali nilai fosfat antara kedalaman Pramuka 7m dan Pramuka 15m serta Pari 7m dan Pari 15m pada (p>0.05) Lampiran 18.
Berdasarkan hasil pengamatan nilai fosfat yang tinggi terjadi pada musim barat (DesemberFebruari) dan nilai fofat yang rendah terjadi pada timur (Juni -Agustus). Nilai fosfat antar kedalaman 7m dan 15m tidak berbeda nyata. Hasil penelitian terlihat bahwa fosfat perairan Pulau Pari lebih tinggi dari pada Pulau Pramuka. Hal ini karena Pulau Pari lebih banyak mendapat masukan fofat berasal dari muara sungai yang mengalir ke Teluk Jakarta. Berdasarkan penelitian Rudi (2006) bahwa rata-rata fosfat berkisar antara 0.003-0.013 mg/l dan tertinggi pada musim barat. Riley dan Chester (1971) menyatakan kandungan fosfat di perairan alami sekitar 0.07 mg/l.
Nitrat
Hasil pengukuran terhadap nitrat di lokasi penelitian berkisar antara 0.059-0.109 mg/l. Rata-rata nitrat yang tinggi terjadi pada musim barat dengan nilai rata-rata 0.102±0.003 mg/l dan nitrat yang rendah pada musim timur dengan nilai 0.062±0.003. Rata-rata nilai nitrat di perairan Pari lebih tinggi dari pada perairan Pulau Pramuka. (Lampiran 19). Hasil uji t berpasangan menunjukkan nilai nitrat antara lokasi penelitian menunjukkan perbedaan yang nyata (p<0.05), kecuali nilai fosfat antara kedalaman Pramuka 7m dan Pramuka 15m serta Pari 7m dan Pari 15m pada (p> 0.05) (Lampiran 20).
Berdasarkan hasil pengamatan nilai nitrat yang tinggi terjadi pada musim barat (Desember-Februari) dan nilai nitrat yang rendah terjadi pada timur (Juni-Agustus). Nilai nitrat antara kedalaman 7m dan 15m tidak berbeda nyata. Hasil penelitian terlihat bahwa nitrat perairan Pulau Pari lebih tinggi dari pada Pulau Pramuka. Hal ini karena Pulau Pari lebih banyak mendapat masukan nitrat berasal dari muara sungai yang mengalir ke Teluk Jakarta. Berdasarkan penelitian Rudi (2006) bahwa rata-rata nitrat berkisar antara 0.043-0.104 mg/l dan tertinggi pada musim barat. Riley dan Chester (1971) menyatakan kandungan nitrat di perairan alami 0.001-0.5 mg/l.
Regenerasi Fragmen Spons P. nigricans
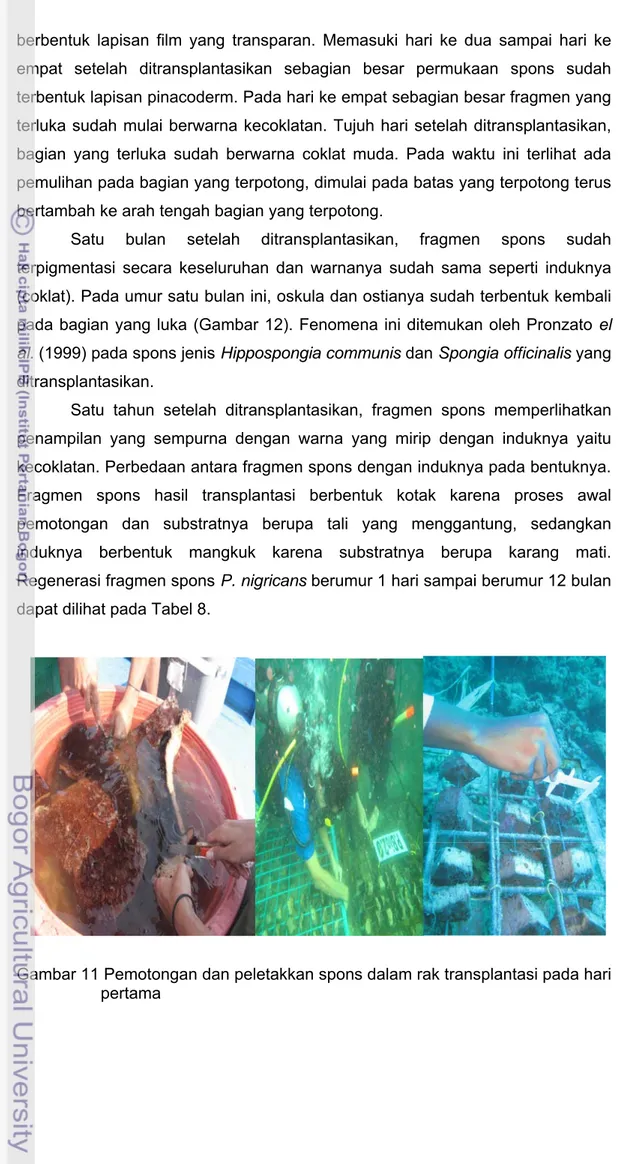
Perkembangan transplantasi spons dimulai dari pengambilan dari induk, pengangkatan, pemotongan dan pengikatan fragmen. Spons dipotong dalam wadah yang berisi air dan terjadi perubahan warna spons menjadi lebih pucat. Spons mengsekresikan cairan sehingga terjadi perubahan air pada wadah berwarna merah kecoklatan (Gambar 11). Pada awal peletakan fragmen pada rak di dalam air, kondisi spons masih dalam keadaan stres. Lapisan sel yang transparan terbentuk setelah satu hari ditransplantasikan ditemukan oleh Pronzato et al. (1999) pada spons jenis Hippospongia communis dan Spongia
officinalis dan Scheffers (1995) menyatakan setelah satu hari ditransplantasikan
spons banyak mengeluarkan lendir pada permukaan yang luka. Lendir yang dikeluarkan oleh fragmen spons merupakan suatu strategi pertahanannya terhadap organisme fouling, mikroorganisme dan predasi.
Proses pemulihan terjadi setelah satu hari ditransplantasikan, permukaan spons yang terluka atau terpotong sudah tertutupi oleh lapisan sel yang
berbentuk lapisan film yang transparan. Memasuki hari ke dua sampai hari ke empat setelah ditransplantasikan sebagian besar permukaan spons sudah terbentuk lapisan pinacoderm. Pada hari ke empat sebagian besar fragmen yang terluka sudah mulai berwarna kecoklatan. Tujuh hari setelah ditransplantasikan, bagian yang terluka sudah berwarna coklat muda. Pada waktu ini terlihat ada pemulihan pada bagian yang terpotong, dimulai pada batas yang terpotong terus bertambah ke arah tengah bagian yang terpotong.
Satu bulan setelah ditransplantasikan, fragmen spons sudah terpigmentasi secara keseluruhan dan warnanya sudah sama seperti induknya (coklat). Pada umur satu bulan ini, oskula dan ostianya sudah terbentuk kembali pada bagian yang luka (Gambar 12). Fenomena ini ditemukan oleh Pronzato el
al. (1999) pada spons jenis Hippospongia communis dan Spongia officinalis yang
ditransplantasikan.
Satu tahun setelah ditransplantasikan, fragmen spons memperlihatkan penampilan yang sempurna dengan warna yang mirip dengan induknya yaitu kecoklatan. Perbedaan antara fragmen spons dengan induknya pada bentuknya. Fragmen spons hasil transplantasi berbentuk kotak karena proses awal pemotongan dan substratnya berupa tali yang menggantung, sedangkan induknya berbentuk mangkuk karena substratnya berupa karang mati. Regenerasi fragmen spons P. nigricans berumur 1 hari sampai berumur 12 bulan dapat dilihat pada Tabel 8.
Gambar 11 Pemotongan dan peletakkan spons dalam rak transplantasi pada hari pertama
Tabel 8 Regenerasi fragmen spons P. nigricans
Usia Regenerasi Fragmen Spons
Hari ke 1 Terbentuk lapisan film yang transparan pada spons yang luka. Hari ke 2-4 Sebagian besar permukaan yang terluka terbentuk lapisan
pinacoderm, pada hari ke 4 sebagian besar spons mulai
berwarna kecoklatan.
Hari ke 7 Bagian terluka coklat muda dan terdapat pemulihan pada
bagian yang terpotong, fragmen sudah menempel erat pada tali
Bulan 1 Spons sudah terpigmentasi secara keseluruhan dan warna
mirip dengan induknya (coklat), oskula dan ostia sudah terbentuk pada bagian yang luka. Terjadi kematian spons ditandai spons berwarna putih dan mudah hancur.
Bulan ke 2 Spons terus tumbuh dan pada kedalaman 7m mulai
ditumbuhi alga, masih terdapat kematian spons Bulan ke 3 Masih terdapat kematian spons.
Bulan ke 4- 12 Spons tumbuh mulai lebih cepat dengan laju pertumbuhan
panjang 4.42±0.66-6.15±0.88% per bulan, kematian spons tidak ada lagi
Kecepatan regenerasi jaringan spons yang terluka sampai terpigmentasi secara sempurna dan terbentuknya saluran air memerlukan waktu satu bulan dan sama dengan spons Aaptos aaptos. Hoppe (1988) melaporkan sampai terpigmentasi secara sempurna dan terbentuknya sistem saluran air spons
Neofibularia nolitangere membutuhkan waktu 5-20 hari, spons Chondrosia candelabrum memerlukan waktu 2-4 minggu (Caralt 2003) dan A. aaptos
memerlukan waktu 4 minggu (Haris 2005). Perbedaan kecepatan regenerasi jaringan spons tergantung perbedaan bentuk pertumbuhan, kekerasan jaringan, dan ukuran rata-rata bagian spons yang terluka waktu pemotongan. Spons P.
nigricans mempunyai jaringan yang keras, sedangkan spons N. nolitangere
memiliki jaringan yang relatif tidak keras. Faktor lain yang menyebabkan perbedaan ini adalah perbedaan ukuran rata rata bagian yang terluka. Duckworth (2003) menyatakan kecepatan regenerasi dan pertumbuhan spons setelah terluka tergantung pada besarnya luka. Laju regenerasi dan pertumbuhan spons umumnya menurun dengan meningkatnya luka.
1 hari 1 bulan 2 bulan 4 bulan
6 bulan 8 bulan
10 bulan 12 bulan
Gambar 12 Perkembangan fragmen spons dari hari pertama sampai 1 tahun di Perairan Pulau Pari
Laju Pertumbuhan Spons P. nigricans
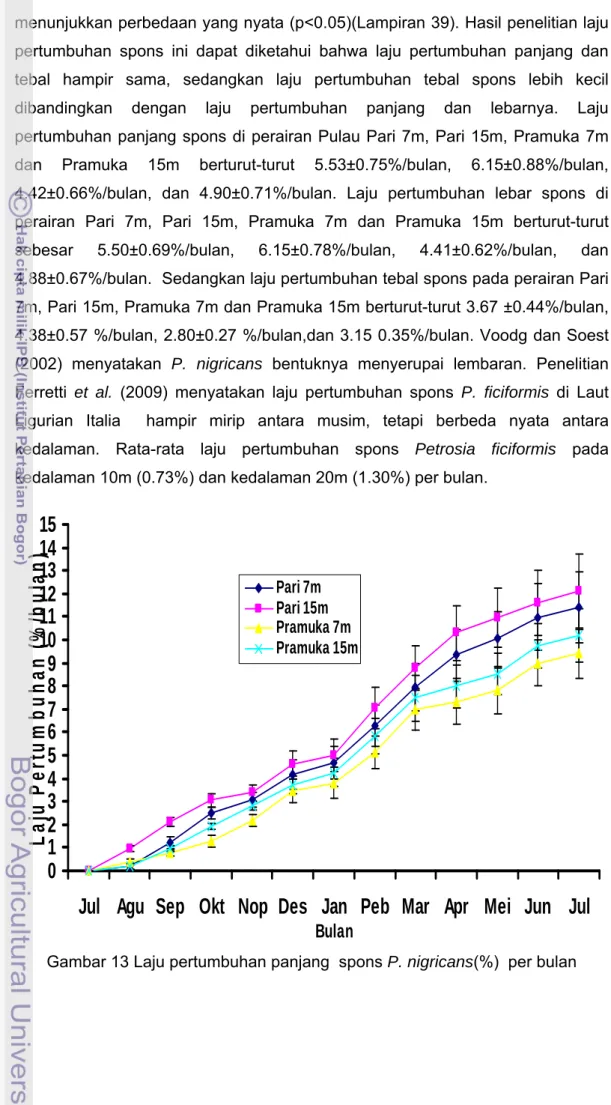
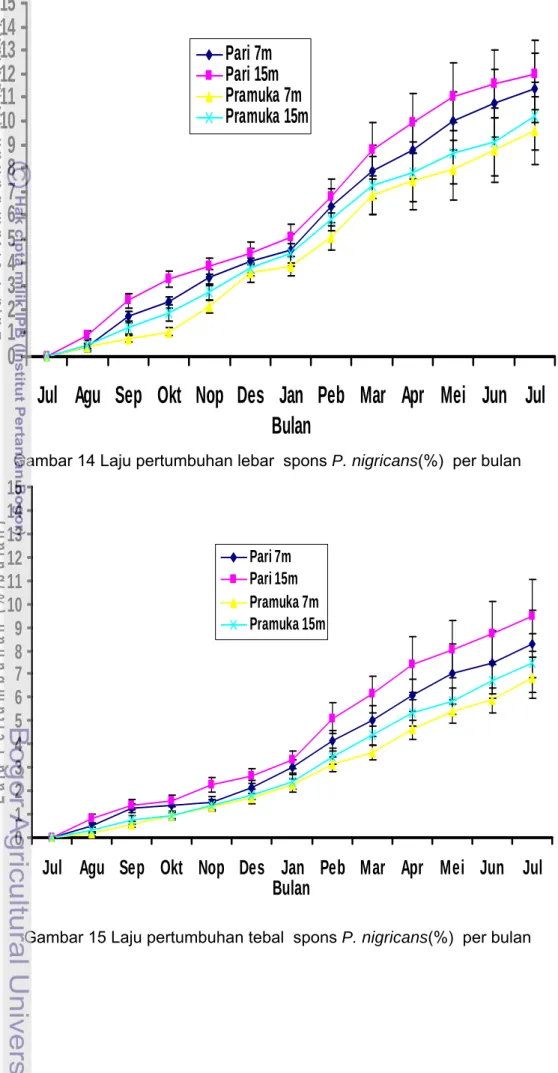
Hasil pengamatan laju pertumbuhan spons P. nigricans selama 12 bulan selengkapnya disajikan pada Gambar 13, 14 dan 15 dan Lampiran 27,31 dan 35. Pada Gambar 13, 14, 15 terlihat rata-rata laju pertumbuhan panjang, lebar dan tebal spons P. nigricans tidak sama antara kedalaman lokasi dan waktu pengamatan. Laju pertumbuhan spons di perairan Pulau Pari lebih tinggi dibandingkan perairan Pulau Pramuka. Hasil analisis sidik ragam (Anova) menunjukkan laju pertumbuhan panjang, lebar dan tebal spons P. nigricans antara kedalaman lokasi dan waktu pengamatan berbeda nyata (P<0.05)(Lampiran 28, 32 dan 36). Dari uji rataan laju pertumbuhan panjang, lebar, dan tebal antara kedalaman lokasi dengan uji BNT (P< 0.05 ) diperoleh laju pertumbuhan yang berbeda nyata antara semua kedalaman (Lampiran 29, 32 dan 36). Uji BNT terhadap laju pertumbuhan panjang, lebar dan tebal menunjukkan perbedaan yang nyata (P<0.05) dengan semua bulan pengukuran spons (Lampiran 30, 34 dan 38).
Laju pertumbuhan bulan pertama (Agustus) fragmen spons di kedua lokasi penelitian menunjukkan nilai yang rendah. Laju pertumbuhan rata-rata pada bulan ke dua (September) sampai akhir penelitian menunjukkan laju pertumbuhan yang meningkat antar bulan yang satu dengan lainnya. Peningkatan laju pertumbuhan ditandai dengan semakin sempurnanya sistem saluran air dan semakin sempurna pigmentasi warna spons. Sempurnanya sistem saluran air ditandai dengan semakin banyaknya jumlah ostia dan oskula. Sempurnanya pigmentasi dan meningkatnya jumlah mikroba simbion ditandai dengan kembalinya warna asli spons P. nigricans yaitu warna kecoklatan. Amir dan Budiyanto (1996) menyatakan spons memiliki warna yang berbeda walaupun dalam satu jenis, spons yang hidup di lingkungan yang gelap akan berbeda warnanya dengan spons sejenis yang hidup pada lingkungan yang cerah. Warna spons sebagian dipengaruhi oleh fotosintesa mikrosimbionnya yaitu cyanobakteri dan eukariot alga seperti dinoflagella atau zooxanthella. Menurut Osinga et al. (1999) pertumbuhan spons yang ditransplantasikan dimulai setelah fase statis (pertumbuhan tidak bertambah) selama 5-20 hari pertama.
Hasil uji t berpasangan menyatakan laju pertumbuhan panjang dan lebar tidak menunjukkan perbedaan yang nyata (p>0.05). Sedangkan hasil uji t berpasangan antara panjang dan tebal, serta laju pertumbuhan lebar dan tebal
menunjukkan perbedaan yang nyata (p<0.05)(Lampiran 39). Hasil penelitian laju pertumbuhan spons ini dapat diketahui bahwa laju pertumbuhan panjang dan tebal hampir sama, sedangkan laju pertumbuhan tebal spons lebih kecil dibandingkan dengan laju pertumbuhan panjang dan lebarnya. Laju pertumbuhan panjang spons di perairan Pulau Pari 7m, Pari 15m, Pramuka 7m dan Pramuka 15m berturut-turut 5.53±0.75%/bulan, 6.15±0.88%/bulan, 4.42±0.66%/bulan, dan 4.90±0.71%/bulan. Laju pertumbuhan lebar spons di perairan Pari 7m, Pari 15m, Pramuka 7m dan Pramuka 15m berturut-turut sebesar 5.50±0.69%/bulan, 6.15±0.78%/bulan, 4.41±0.62%/bulan, dan 4.88±0.67%/bulan. Sedangkan laju pertumbuhan tebal spons pada perairan Pari 7m, Pari 15m, Pramuka 7m dan Pramuka 15m berturut-turut 3.67 ±0.44%/bulan, 4.38±0.57 %/bulan, 2.80±0.27 %/bulan,dan 3.15 0.35%/bulan. Voodg dan Soest (2002) menyatakan P. nigricans bentuknya menyerupai lembaran. Penelitian Ferretti et al. (2009) menyatakan laju pertumbuhan spons P. ficiformis di Laut Ligurian Italia hampir mirip antara musim, tetapi berbeda nyata antara kedalaman. Rata-rata laju pertumbuhan spons Petrosia ficiformis pada kedalaman 10m (0.73%) dan kedalaman 20m (1.30%) per bulan.
0
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
Jul Agu Sep Okt Nop Des Jan Peb Mar Apr Mei Jun Jul
Bulan
La
ju P
e
rt
um
b
uha
n
(%
/bul
a
n
)
Pari 7m Pari 15m Pramuka 7m Pramuka 15m0
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
Jul Agu Sep Okt Nop Des Jan Peb Mar Apr Mei Jun Jul
Bulan
La
ju
P
e
rt
um
bu
ha
n
(%/
b
u
la
n
)
Pari 7m
Pari 15m
Pramuka 7m
Pramuka 15m
Gambar 14 Laju pertumbuhan lebar spons P. nigricans(%) per bulan
0
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
Jul Agu Sep Okt Nop Des Jan Peb Mar Apr Mei Jun Jul
Bulan
La
ju
P
e
rt
um
b
uha
n
(
%
/bul
a
n
)
Pari 7m Pari 15m Pramuka 7m Pramuka 15mGambar 16 Analisis komponen utama kualitas air. A. Korelasi antara variabel pada sumbu 1 dan sumbu 2. B. Distribusi stasiun penelitian pada sumbu 1 dan sumbu 2.
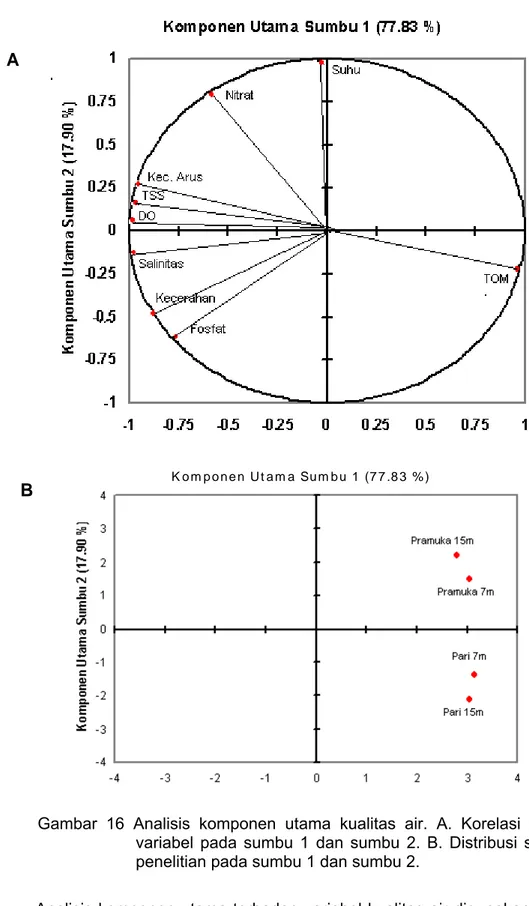
Analisis komponen utama terhadap variabel kualitas air digunakan untuk melihat distribusinya berdasarkan lokasi penelitian. Hasil analisa terhadap matrik korelasi data kualitas air memperlihatkan ragam pada komponen utama sangat tinggi. Sumbangan dua komponen utama terhadap ragam total mencapai
A
95.73%, dimana komponen utama pertama dan kedua secara berturut-turut mempunyai akar ciri 10.014 dan 2.327 dapat menjelaskan 77.83% dan 19.90% keragaman dari gugus data. Berdasarkan hasil Analisis Komponen Utama (Gambar 16) bahwa bahan organik total (TOM) mempunyai keterkaitan yang erat dengan laju pertumbuhan spons perairan Pulau Pari.
Penelitian Rosmiati et al. (2002) tentang budidaya tiga spons di Teluk Awarange, Kabupaten Barru di Sulawesi Selatan dengan perbedaan ukuran transplantasi, laju pertumbuhan spons tinggi dengan nilai TOM 11.21- 16.00 mg/l. Tingginya kandungan TOM digunakan spons sebagai sumber makanan dengan filter feeder. Jorgensen (2008) menyatakan bahwa umumnya spons, lamella branchia dan ascidians tumbuh optimal pada kondisi bahan organik 15.00 – 20 mg/l air laut. Brusca dan Brusca (1990) menyatakan spons dapat mengkomsumsi bahan organik dalam jumlah yang signifikan dengan cara pinositosis dari dalam air pada sistem saluran airnya. Ketersediaan makanan yang banyak dalam bentuk bahan organik akan memicu pertumbuhan spons yang tinggi. Koopmans dan Wijffels (2008) rata-rata laju pertumbuhan spons
Haliclona oculata di Belanda dipengaruhi oleh lingkungan perairan. Dalam
penelitian ini rata-rata pertumbuhan spons berkorelasi positif dengan perairan partikel organik karbon yang tersuspensi di perairan.
Berdasarkan Gambar 12, 13 dan 14 laju pertumbuhan spons P. nigricans lebih tinggi di perairan Pulau Pari dibandingkan Pulau Pramuka. Spons memiliki beberapa tipe sel dengan fungsi yang berbeda-beda, yang terbagi atas tiga bagian yaitu lapisan choanosome (dalam), lapisan ectosome (bagian tepi) terdiri sel pinacocytes, sel spherulous, collencytes dan serat kolagen (Osinga et al. 1999); Caralt et al. 2003) dan lapisan bagian dalam mengandung sel-sel bergerak bebas (archaoecytes) dan bahan rangka (Osinga et al. 1999). Elastisitas sel pada spons memudahkan untuk memperbaharui dan menyesuaikan bentuknya dengan kondisi lingkungan (Caralt et al. 2003). Kelangsungan hidup spons dan laju pertumbuhan spons dari spesies yang sama dapat memberikan hasil yang berbeda jika dilakukan pada kondisi lingkungan yang berbeda (Voogd 2005). Penelitian Gerrodette dan Flechsig (1979) menyatakan ketersediaan nutrisi merupakan faktor yang menentukan populasi dan biomassa spons di ekosistem terumbu karang. Total biomassa spons 5 kali lebih tinggi pada spons di ekosistem terumbu yang dekat pantai pada kedalaman yang sama dari pada biomassa spons yang jauh pantai. Besarnya
nutrien di ekosistem terumbu karang dekat pantai sangat mempengaruhi besarnya biomassa spons.
Laju pertumbuhan spons lebih tinggi pada kedalaman 15m baik pada perairan Pulau Pari dan Pramuka dibandingkan pada kedalaman 7m diakibatkan oleh pengaruh radiasi matahari, faktor kesediaan makanan, dan kompetisi merebutkan ruang. Sebagai hewan filter feeder yang menetap spons kehidupannya sangat tergantung kepada makanan terutama bahan organik. Wilkinson dan Trott (1985) menyatakan spons di Great Barrier Reef umumnya pada kedalaman kurang dari 10m sinar UV menjadi faktor pembatas distribusi spons yang mengakibatkan spons stress. Penelitian Lesser (2005) tentang makanan dan pertumbuhan spons Callyspongia vaginalis, Angelas conifera dan
Aplysina fistularis dari Florida dan Bahama terdapat perbedaan yang nyata dan
lebih besar hasil transplantasi spons terhadap biomassa, pertumbuhan dan makanan dengan bertambahnya kedalaman. Penelitian dilakukan di kedalaman 7m,15m, 23m dan 30m. Spons bertambah ukuran dan laju pertumbuhannya dengan bertambahnya kedalaman, hal ini dikarenakan adanya bertambahnya ketersediaan makanan dan berbeda nyata proses-proses di dasar perairan yang pada akhirnya akan mempengaruhi laju pertumbuhan spons. Pada penelitian tersebut ditunjukkan bahwa ukuran dan pertumbuhan spons bertambah dengan bertambahnya kedalaman karena kontribusi langsung dari ketersediaan bahan makanan yang semakin besar dengan bertambahnya kedalaman. Makanan yang banyak dimakan adalah partikel organik karbon. Karibian spons seperti
Callyspongia vaginalis, Angelas conifera dan Aplysina fistularis mendapatkan
makanan melalui proses heterotropik, tidak seperti tipe spons fotoautotropik di Great Barrier Reef. Penelitian Trussel et al. (2006) menyatakan laju pertumbuhan spons Callyspongia vaginalis di pantai Florida pada perbedaan kedalaman menyatakan pertumbuhan spons lebih besar pada perairan yang dalam dari pada spons yang ditransplantasikan pada perairan yang dangkal. Hal ini dikarenakan bertambahnya ketersedian makanan pada perairan yang lebih dalam merupakan faktor penting untuk pertumbuhan spons sebagai hewan filter feeder.
Untuk mendapat sinar matahari pada perairan dangkal terdapat persaingan antara karang dan alga dalam hal melakukan fotosintesa, dengan bertambahnya kedalaman terjadi penurunan cahaya matahari dan kompetisi ruang spons dan alga menurun. Pada perairan yang lebih dalam spons
mendapatkan energi yang lebih besar dari bertambahnya konsentrasi picoplankton (Lesser 2005). Spons berkompetisi untuk mendapat ruang dan cahaya dengan alga dan karang pada perairan dangkal, sehingga spons beradaptasi dengan perairan yang lebih dalam (Amir dan Budiyanto 1996). Pertumbuhan spons lebih baik pada kedalaman 12m dari pada 3m di perairan Barranglompo (Suharyanto 2008). Penelitian spons di Daviest Reef (Great Barrier Reef) bahwa total biomassa spons mencapai maksimum pada kedalaman 20m (Wilkinson dan Trott 1985), sedangkan di perairan Sulawesi Selatan (Kepulauan Spermonde) kelimpahan spons optimum pada kedalaman 10-15m (Voogd 2005). Pada semua lokasi penelitian yang diteliti di Great Barrier Reef populasi spons menurun pada perairan yang dangkal (<10m) dibandingkan pada perairan yang lebih dalam. Cahaya dalam bentuk radiasi UV adalah faktor pembatas perairan dangkal kurang dari 10m (Wilkinson dan Trott 1985). Penelitian spons Hibah Pasca IPB (Soedharma et al. 2007) bahwa distribusi spons melimpah pada kedalaman 7-15m di perairan Pulau Lancang, Pari dan Pramuka.
Spons P. nigrican termasuk spons yang menyukai habitat perairan yang lebih dalam, termasuk spons berukuran besar dan mempunyai penyebaran yang luas. Voogd (2007) menyatakan habitat spons P. nigricans pada kedalaman 3-45 meter dan spons yang berukuran besar tumbuh di lereng pasir terumbu karang. P. nigricans mempunyai penyebaran yang luas di wilayah Indo-Australia (Voogd dan Soest 2002). Spons berbentuk mangkok seperti P. nigricans jarang ditemukan pada lokasi yang dangkal. P. nigricans dapat tumbuh mencapai diameter 1-2 meter pada lingkungan yang dalam (Voogd 2007). P. nigricans merupakan salah satu spons yang dominan terdapat di Kepulauan Seribu (Voogd dan Cleary 2008; Estradivari et al. 2007).
Spons P. nigricans menyukai perairan yang lebih dalam dan laju pertumbuhan perairan yang dalam (15m) lebih tinggi dari pada perairan yang dangkal (7m). Pada perairan kedalaman 15m kandungan bahan organik lebih tinggi, sehingga aktifitas filter feeder spons berjalan optimal dengan sedikit persaingan dengan biota laut lainnya. Verdenal dan Vacelet (1985) menyatakan spons mempunyai laju pertumbuhan yang lebih cepat pada perairan yang kaya nutrien. Thacker (2005) pada kondisi yang gelap (perairan dalam), bakteri fotosimbion sering tidak ditemukan karena kurangnya sinar matahari sehingga spons untuk mendapatkan makanan melalui mekanisme filter feeder.
Berdasarkan kategori Wilkinson dan Trott (1985) spons Petrosia sp untuk mendapatkan makanan termasuk spons campuran heterotropik dan fototropik spons. Penelitian di Great Barrier Reef berdasarkan rasio produktifitas primer bersih dan respirasi, spons dikategorikan fototropik, campuran fototropik dan heterotropik, dan heterotropik. Spons fototropik mendapatkan makanan dari simbion cyanobakteri. Sedangkan spons heterotropik mendapatkan makanan dari filter feeder: detritus, bahan organik terlarut, plankton dan lain-lain.
Laju pertumbuhan spons lebih tinggi kedalaman 15m dibandingkan 7m di Pulau Pari dan Pramuka. Parameter lingkungan yang mempengaruhi budidaya spons adalah salinitas, cahaya, oksigen, makanan, dan substrat (Yi et al. 2005). Wilkinson dan Anthony (1990) menyatakan biomassa spons di perairan Belize Karibia menunjukkan kenaikkan dengan bertambahnya kedalaman. Biomassa umumnya spons rendah pada perairan dangkal kurang dari 10m dan bertambah naik mencapai maksimum pada kedalaman 15-20m. Wikinson dan Cheshire (1989) menyatakan kenaikkan biomassa spons dengan bertambahnya kedalaman juga terjadi di perairan karang di Great Barrier Reef dimana biomassa populasi spons maksimal terjadi pada kedalaman 15-20m. Wilkinson dan Anthony (1990) bahwa tingginya biomassa heterotropik spons pada kedalaman 15-20m berhubungan langsung dengan ketersediaan bahan organik di perairan terumbu karang. Tingginya biomassa spons menunjukkan indikator adanya bahan organik yang tinggi pada perairan. Penelitian Lesser (2005) beberapa lokasi perairan di Karibia, ukuran spons, pertumbuhan dan ketersediaan makanan bertambah besar dengan bertambahnya kedalaman. Spons mengkonsumsi 65-93% partikel bahan organik dari makanannya dari semua stasiun penelitian. Yahel et al. (2003) partikel organik karbon dan organik karbon terlarut merupakan sumber karbon yang sangat penting bagi spons.
Perbedaan lain laju pertumbuhan spons lebih tinggi kedalaman 15m dibandingkan 7m di Pulau Pari dan Pramuka adalah kondisi hidrooseanografi dimana perairan dangkal lebih dinamis dan perairan dalam lebih stabil. Amir dan Budiyanto (1996) menyatakan spons pada perairan yang lebih dalam spons cenderung memiliki tubuh yang lebih simetris dan lebih besar sebagai akibat dari kondisi lingkungan yang lebih stabil jika dibandingkan dengan jenis yang sama yang hidup pada perairan yang dangkal. Suharyanto (2008) menyatakan bahwa pertumbuhan spons lebih baik pada kedalaman 12m dibandingkan 3m di perairan Barranglompo diakibatkan pengaruh makanan, sinar matahari, dan
kecepatan arus, dimana arus pada kedalaman 12m lebih tenang daripada kedalaman 3m. Palumbi (1986) menyatakan kondisi hidrodinamik diantaranya dipengaruhi arus yang semakin membesar pada spons di perairan dangkal.
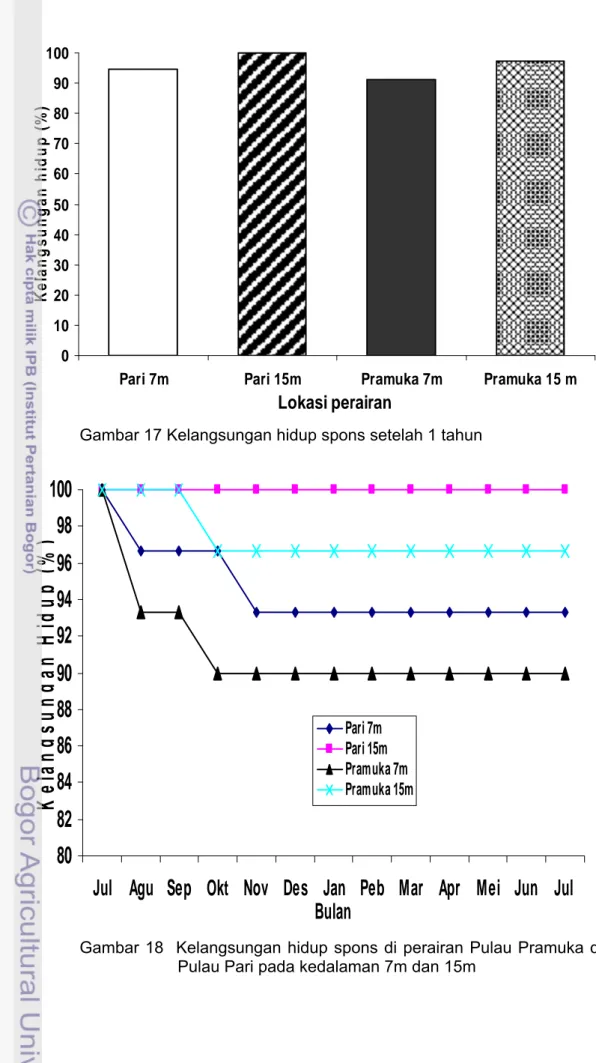
Kelangsungan Hidup Spons
Kelangsungan hidup spons P. nigricans pada dua lokasi dan kedua kedalaman setelah 1 tahun transplantasi berkisar 90.0-100.0%, rata-rata kelangsungan hidup spons perairan Pulau Pari lebih tinggi dari pada perairan Pulau Pramuka dengan nilai pada lokasi Pari 7m (94.61±2.09%), Pari 15m (100±0.00%), Pramuka 7m (91.28±2.78%) dan Pramuka 15m (97.44±1.40%). Rata-rata kelangsungan hidup spons kedalaman 15m lebih tinggi dari pada kedalaman 7m (Lampiran 41 dan Gambar 17). Hasil analisis ragam terhadap kedalaman lokasi dan waktu pengamatan menunjukkan hasil yang berbeda nyata (p<0.05)(Lampiran 42). Berdasarkan uji rataan kelangsungan hidup antara kedalaman lokasi dengan uji BNT (P<0.05 ) diperoleh kelangsungan hidup yang berbeda nyata antar semua kedalaman lokasi (Lampiran 43). Uji BNT terhadap bulan pengamatan menunjukkan perbedaan yang nyata pada bulan Juli (bulan 0), Agustus (bulan ke satu) dan September (bulan ke tiga) dengan semua bulan pengukuran spons (Lampiran 44).
Hasil penelitian kelangsungan hidup spons P. nigricans pada perairan Pulau Pari dan Pramuka setelah 1 tahun berkisar antara 90.0-100.0% lebih tinggi dari pada beberapa hasil penelitian transplantasi spons. Kelangsungan hidup spons Aaptos aaptos berkisar antara 35.87-60.83% (Haris 2005); spons
Callyspongia biru berkisar 82.00-100.00% (Voogd 2005), spons jenis Latrunculia brevis (2.5-100.00%) dan Polymastia croceus (78.00-100.00%)(Duckworth et al.1999). Spons P. nigricans termasuk spons bertekstur keras sehingga tahan
terhadap predasi ikan. Spons ini juga melekat kuat pada tali substrat dan tidak terlepas oleh hempasan gelombang dan arus sampai akhir penelitian. Kelangsungan hidup spons termasuk tinggi dan spons P. nigricans di alam tergolong spons berukuran besar mempunyai potensi besar untuk dibudidayakan sebagai bahan bioaktif.
0 10 20 30 40 50 60 70 80 90 100
Pari 7m Pari 15m Pramuka 7m Pramuka 15 m
Lokasi perairan
K e la ngs unga n hi dup (% )Gambar 17 Kelangsungan hidup spons setelah 1 tahun
80
82
84
86
88
90
92
94
96
98
100
Jul Agu Sep Okt Nov Des Jan Peb Mar Apr Mei Jun Jul
Bulan
Ke
la
n
g
su
n
g
an
H
id
u
p
(%
)
Pari 7m Pari 15m Pramuka 7m Pramuka 15mGambar 18 Kelangsungan hidup spons di perairan Pulau Pramuka dan Pulau Pari pada kedalaman 7m dan 15m
Gambar 19 Penempelan dan kompetisi ruang spons dengan makroalga pada kedalaman 7m di perairan Pulau Pari
Gambar 20 Kematian spons di perairan Pramuka pada bulan ke tiga Kelangsungan hidup spons pada 1 minggu pertama baik kedua lokasi di perairan Pulau Pari dan Pulau Pramuka dan kedalaman 7m dan 15m mencapai 100%. Kondisi ini menunjukkan bahwa bahwa spons P. nigricans memiliki kemampuan adaptasi yang tinggi terhadap proses pemotongan, pengangkutan dan perlakuan transplantasi. Pada bulan ke satu (Agustus), dua (September), tiga (Oktober) fragmen spons terjadi kematian. Memasuki bulan ke empat (Nopember) sampai akhir penelitian, fragmen spons sudah tidak ada lagi mengalami kematian spons (Gambar 18). Kematian pada bulan pertama sampai tiga disebabkan karena bulan-bulan tersebut spons yang ditransplantasikan melakukan proses adaptasi terhadap lingkungannya (Gambar 20). Memasuki bulan ke empat dan seterusnya, spons yang ditransplantasikan sudah beradaptasi secara sempurna dan kemampuan pertahanan kimianya (chemical defense) yang sudah terbentuk dengan baik untuk merespon gangguan lingkungan. Pertahanan kimia (chemical defense) yang diproduksi spons memiliki peranan secara ekologi di alam (Wright et al. 1997; Lozano et al. 1998) untuk
pertahanan terhadap faktor-faktor tekanan lingkungan seperti antipredasi dan aktivitas antifouling (Pawlik et al. 2002) mencegah infeksi yang disebabkan oleh mikroorganisme patogenik (Lozano et al.1998) dan berkompetisi ruang (Proksch 1994).
Kelangsungan hidup spons yang ditransplantasikan pada kedalaman 15m lebih tinggi daripada spons pada kedalaman 7m hal ini diantaranya disebabkan oleh perbedaan intensitas cahaya dan penempelan alga (Gambar 19). Wilkinson dan Trott (1985) menyatakan spons pada kedalaman kurang dari 10m sinar UV menjadi faktor pembatas distribusi spons yang mengakibatkan spons stress. Duckworth et al. (1997) menyatakan bahwa radiasi UV mempengaruhi kelangsungan hidup spons. Penelitian spons Psammocinia hawere lebih baik pada kedalaman 17m dibandingkan dengan kedalaman 5m, hal ini diakibatkan tingginya cahaya pada kedalaman tersebut. Cahaya yang tinggi pada kedalaman perairan dangkal (5m) akan meningkatkan derajat penempelan alga. Penempelan alga dapat menyebabkan kematian dan mengurangi penyembuhan luka.
Simpulan
Hasil simpulan penelitian tentang laju pertumbuhan dan kelangsungan hidup spons P. nigricans sebagaimana diuraikan diatas adalah:
1. Kualitas air sangat berpengaruh terhadap laju pertumbuhan dan tingkat kelangsungan hidup spons P. nigricans.
2. Paramater kualitas air yang paling berpengaruh terhadap laju pertumbuhan spons adalah Total Bahan Organik (TOM).
Daftar Pustaka
Amir I, Budiyanto A. 1996. Mengenal Spons Laut (Demospongiae) Secara Umum. Oseana 21: 15 – 31.
Brusca RC, Brusca GJ. 1990. Invertebrates. Massachusetts: Inc. Publishers. Sunderland. hlm 181 – 207.
Caralt S de, Agell G, Uriz MJ. 2003. Long Term Culture of Sponge Explant: Conditions Enhancing Survival and Growth, and Assessment of Bioactivity. Biomolekuler Engineering 20: 339-347.
Canter LW, Hill LG. 1979. Handbook of Variables for environmental Impact
Duckworth AR, Battershill CN, Bergquist PR. 1997. Influence of Explant Procedures and Environmental Factors on Culture Success of Three Sponges. Aquaculture 165: 251-267.
Duckworth AR, Battershill CN, Schiel DR, Bergquist PR. 1999. Farming Sponges for the Production of Bioactive Metabolites. Memoir of the Queensland
Museum 44: 155 – 159.
Duckworth AR, Battershill CN. 2001. Population Dynamics and Chemical Ecology of New Zealand Demospongiae Latrunculia sp and Polymastia croceus. J
Mar Freshw Res 35: 935 – 949.
Duckworth AR. 2003. Effect of Wound Size on the Growth and Regeneration of Two Temperate Subtidal Sponge. J Exp Mar Biol Ecol 287: 139-153
Duckworth AR, Battershill CN. 2003. Developing Farming Structures for the Production of Biologically Active Sponge Metabolites. Aquaculture 217: 139-156.
Duckworth AR, Battershill CN, Schiel DR. 2004. Effects of Depth and Water Flow on Growth, Survival and Bioctivity of Two temperate Sponges Cultured in Different Seasons. Aquaculture 242: 237- 250.
Effendi H. 2003. Telaah Kualitas Air. Yogyakarta: Kanisius. hlm 50-112.
Estradivari, Syahrir M, Susilo N, Yusri S, Timotius S. 2007. Terumbu Karang
Jakarta. Jakarta: Yayasan Terumbu Karang Indonesia. hlm 25- 36.
Ferretti C, Vacca S, Ciucis C D, Marengo B, Duckworth A, Manconi R, Pronzato R, Domenicotti C. 2009. Growth Dynamics and Bioactivity Variation of the Mediterranean Demosponges Agelas oroides (Agelasidae) and Petrosia
ficiformis (Petrosiidae). Marine Ecologi 10:1-10.
Gerrodette T, Flechsig AO. 1979. Sedimen Induced Reduction in the Pumping Rate of the Tropical Sponge Verongia lacunosa. Mar Biol 55: 103-110. Hadas E, Sphigel M, Ilan M. 2005. Sea Ranching of the Marine Sponge
Negombata magnifica (Demospongiae, Latruncullidae) as a First Step for
Latrunculin B Mass Production. Aquaculture 244: 159-169.
Haris A. 2005. Pertumbuhan, Sintasan, Perkembangan Gamet, dan Bioaktivitas Ekstrak dan Fraksi Spons Aaptos aaptos yang Ditransplantasikan pada Perairan yang Berbeda [disertasi]. Bogor: Sekolah Pascasarjana, Institut Pertanian Bogor
Hefinalis. 2004. Penelitian Dinamika Sumberdaya Laut Perairan Teluk Jakarta
dan Kepuluan Seribu. Jakarta: Puslit Oseanografi LIPI. hlm 8-30.
Hooper JNA. 2000. Sponguide: Guide to Sponge Collection and Identification. South Brisbane: Queensland Museum. hlm 50-62.
Hoppe WF. 1988. Growth, Regeneration and Predation in Three of Coral Reef Sponges. Mar Ecol Prog Ser 50: 117-125.
Ilahude AG. 1999. Pengantar ke Oseanografi Fisika. Jakarta: Pusat Penelitian dan Pengembangan Oseanologi LIPI. hlm 105-133.
Ismet MS. 2007. Penapisan Senyawa Bioaktif Spons Aaptos aaptos dan Petrosia sp dari Lokasi yang Berbeda [tesis]. Bogor: Sekolah Pascasarjana, Institut Pertanian Bogor
Jorgensen CB. 2008. Quantitative Aspects of Filter Feeding in Invertebrates. Biologycal Reviews. London. hlm 391-453.
Kawaroe M. 2009. Fragmentasi Buatan dan Reproduksi Seksual Spons Aaptos
aaptos dalam upaya Perbanyakan Stok Koloni di Alam. [disertasi]. Bogor:
Sekolah Pascasarjana, Institut Pertanian Bogor
Koopmans M, Wijffels RH. 2008. Seasonal Growth Rate of the Sponge Haliclona
aculata (Demospongiae: Haplosclerida). Mar Biotechnol 10: 502-510.
Legendre L, Legendre P. 1983. Numerical Ecology. London: Elsevier Scientific Publishing Company.hlm 1-419.
Lesser MP. 2005. Benthic Pelagic Coupling on Coral Reefs: Feeding and Growth of Caribbean Sponges. J Exp Mar Biol Ecol 328: 277 -288.
Lozano MB, Farias FG, Acosta BG, Gasca AG, Zavala JRB. 1998. Variation of Antimicrobial Activity of Sponge Aplysina fistularis (Pallas, 1766) and Its Relation to Associated Fauna. J Exp Mar Biol Ecol 223:1-18.
Ludwig JA, Reynolds JF. 1988. Statistical Ecology, Primer on Methods and
Computing. Singapore: John Wiley and Sons. Hlm 1-338.
Masak PRP. 2003. Studi Budidaya Sponge (Auletta sp) Secara Transplantasi pada Substrat Berbeda . Maritek 3:1-9.
Millero FJ, Sohn ML. 1992. Chemical Oceanography. London: CRC Press.hlm 45-75.
Nontji A. 1984. Biomassa dan Produktivitas Fitoplankton di Perairan Teluk Jakarta serta Kaitannya dengan Faktor-Faktor Lingkungan [disertasi]. Bogor: Fakultas Pascasarjana, Institut Pertanian Bogor.
Osinga, R. Redeker D, Beukelaer PB de. 1999. Wijffels measurement of Sponge
Growth by Projected Body Area and Underwater Weight. Di dalam:
Hooper JNA, editor. Proceedings of the 5 th international Sponges
Symposium; Brisbane 30 June 1999. Queensland: Memoir of the
Qeensland Museum 44: hlm 419-426.
Pardjaman D. 1977. Akresi dan Abrasi Pantai Teluk Jakarta Disebabkan oleh
Kondisi Fisik dan Sosial. Hutomo M, Romimohtarto K dan Burhanuddin,
editor. Teluk Jakarta: Sumberdaya, Sifat-Sifat Oseanologis serta Permasalahannya. Jakarta: LON-LIPI. hlm 83-106.
Pawlik JR, McFall G, Zea S. 2002. Does the Odor from Sponges of the Genus
Proksch P. 1999. Pharmacologically Active Natural Products from Marine
Invertebrates and Associated Microorganisms. Di dalam: Soemodihardjo
S, Rachmat R, Saono S, editor. Prosidings Seminar Bioteknologi
Kelautan Indonesia I; Jakarta 14 – 15 Oktober 1998. Jakarta: LIPI. hlm
33-44.
Proksch P, Estrada ERA, Ebel R. 2003. Drugs from the Sea : Opportunities and Obstacles. Marine Drugs 1: 5-17.
Proksch P. 2004. Defensive Roles for Secondary Metabolites from Marine Invertebrates and Associated Microorganism. Di dalam: Soemodihardjo S, Rachmat R, Saono S, editor. Prosidings Seminar Bioteknologi Kelautan
Indonesia I; Jakarta 14 – 15 Oktober 1998. Jakarta: LIPI. hlm 33-40.
Pronzato R, Bavestrello G, Cerrano C, Magnino G, Manconi R, Pantelis J, Sara A, Sidri M. 1999. Sponge Farming in the Mediterranian Sea: New Perspectives. Memoir of the Queensland Museum 44: 485 – 491.
Riley JP, Chester R. 1971. Introduction to Marine Chemistry. London: Academic Press. hlm 56-90.
Romihmohtarto K, Juwana S. 1999. Biologi Laut. Ilmu Pengetahuan tentang
Biota Laut. Jakarta: Pusat Penelitian dan Pengembangan Oseanologi
LIPI. hlm 115 – 128.
Rosmiati, Masak PRP, Suryati E, Tjaronge M. 2008. Sponge (Callyspongia sp,
Callyspongia basilana, and Haliclona sp) Culture with Different Initial
Explant Sizes. Indonesian Aquaculture Journal 3: 125-132.
Rudi E. 2006. Rekruitmen Karang (Skleraktinia) di Ekosistem Terumbu Karang Kepulauan Seribu DKI Jakarta [disertasi]. Bogor: Sekolah Pascasarjana, Institut Pertanian Bogor.
Salmin. 2005. Oksigen Terlarut (DO) dan Kebutuhan Oksigen Biologi (BOD) Sebagai Salah Satu Indikator untuk Menentukan Kualitas Air. Oseana 30: 21-26.
Scheffers S. 1995. Ecological Aspects of the Tropical Reef Sponge
Desmapsamma anchorata on the Reefs of Curacao. Amsterdam:
Departemen of Biology University of Amsterdam. hlm 1-54.
Soedharma D, Zamani NP, Aktani U. 2007. Teknik Reproduksi Spons Laut
Kelas Demospongiae untuk Sediaan Senyawa Bioaktif (Penelitian Hibah Pascasarjana). Bogor : Institut Pertanian Bogor. hlm 55-101.
Subhan B. 2009. Tingkat Kelangsungan Hidup dan Pertumbuhan Spons Jenis
Petrosia nigricans dan Aaptos aaptos yang Ditransplantasikan di Perairan
Pulau Pari, Kepulauan Seribu, Jakarta [tesis]. Bogor: Sekolah Pascasarjana, Institut Pertanian Bogor
Suharyanto. 2008. Distribusi dan Persentase Tutupan Sponge (Porifera) pada Kondisi Terumbu karang dan Kedalaman yang Berbeda di perairan Pulau Barranglompo, Sulawesi Selatan. Biodiversitas 9: 2009- 212.